江苏恒瑞医药股份有限公司关于公司及子公司开展药物临床试
2021抗肿瘤药物临床应用管理制度

关于印发XXX医院《抗肿瘤药物临床应用管理制度》的通知各科室、各部门:为加强我院抗肿瘤药物临床应用管理,提高抗肿瘤药物临床应用水平,保障抗肿瘤药物使用的医疗质量和医疗安全,经院相关部门研究,特制定我院《抗肿瘤药物临床应用管理制度》,自印发之日起实施,请认真贯彻执行。
附件:抗肿瘤药物临床应用管理制度2021年2月26日XXXX医院抗肿瘤药物临床应用管理制度为加强我院抗肿瘤药物临床应用管理,提高抗肿瘤药物临床应用水平,保障抗肿瘤药物使用的医疗质量和医疗安全,依据《抗肿瘤药物临床应用管理办法(试行)》、《新型抗肿瘤药物临床应用指导原则(2020 年版)》等相关规定,制定本制度。
一、抗肿瘤药物的定义抗肿瘤药物是指通过细胞杀伤、免疫调控、内分泌调节等途径,在细胞、分子水平进行作用,达到抑制肿瘤生长或消除肿瘤的药物,一般包括化学治疗药物、分子靶向治疗药物、免疫治疗药物、内分泌治疗药物等。
二、抗肿瘤药物的分级抗肿瘤药物临床应用实行分级管理。
根据安全性、可及性、经济性等因素,将抗肿瘤药物分为限制使用级和普通使用级。
抗肿瘤药物的分级具体划分标准如下:(一)限制使用级是指具有下列特点之一的抗肿瘤药物:1.药物毒副作用大,纳入毒性药品管理,适应证严格,禁忌证多,须由具有丰富临床经验的医务人员使用,使用不当可能对人体造成严重损害的抗肿瘤药物;2.上市时间短、用药经验少的新型抗肿瘤药物;3.价格昂贵、经济负担沉重的抗肿瘤药物。
(二)普通使用级是指除限制使用级抗肿瘤药物外的其他抗肿瘤药物。
抗肿瘤药物分级管理供应目录详见附录。
三、抗肿瘤药物的管理组织及职责(一)我院药事管理与药物治疗学委员会下设抗肿瘤药物管理工作组。
抗肿瘤药物管理工作组由医务、药学、临床科室、医学影像、病理、护理、检验、信息管理、质控等部门负责人或具有相关专业高级技术职务任职资格的人员组成,共同管理抗肿瘤药物临床应用。
(二)抗肿瘤药物管理工作组的工作职责包括1.贯彻执行抗肿瘤药物管理相关的法律、法规、规章,制订本机构抗肿瘤药物管理制度并组织实施;2.审议本院抗肿瘤药物分级管理目录,制订抗肿瘤药物临床应用相关技术性文件,并组织实施;3.对本院抗肿瘤药物临床应用情况进行监测,定期分析、评估、上报监测数据并发布相关信息,提出干预和改进措施;4.对医务人员进行抗肿瘤药物管理相关法律、法规、规章制度和技术规范培训,组织对患者合理使用抗肿瘤药物的宣传教育;5.涉及抗肿瘤药物管理的其他工作。
恒瑞医药:关于药品临床试验进展的公告

证券代码:600276 证券简称:恒瑞医药公告编号:临2019-068 江苏恒瑞医药股份有限公司关于药品临床试验进展的公告本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性承担个别及连带责任。
一、概况近日,江苏恒瑞医药股份有限公司(以下简称“公司”)研发的马来酸吡咯替尼片联合卡培他滨治疗晚期乳腺癌的随机、开放、平行对照、多中心III期临床研究(以下简称“PHOEBE研究”),经独立数据监察委员会(IDMC)审核确认,本研究主要终点-IRC评估的无进展生存期(PFS)达到方案预设的期中分析优效判定标准,且安全性可接受。
PHOEBE研究结果表明,对于既往接受过曲妥珠单抗和紫杉类药物的转移性乳腺癌患者,接受吡咯替尼联合卡培他滨对比拉帕替尼联合卡培他滨,可显著延长患者的无进展生存期。
二、药品基本情况药品名称:马来酸吡咯替尼片(SHR-1258)剂型:片剂规格:按C32H31ClN6O3计(1)80 mg;(2)160 mg。
注册分类:化学药品第1类三、药品研究情况PHOEBE研究是一项随机、开放、平行对照、多中心III期临床研究,主要研究终点为独立影像评估委员会(IRC)评估的无进展生存期(PFS),由中国医学科学院肿瘤医院徐兵河教授担任主要研究者。
本研究于2017年7月开始入组患者,截至2019年3月,共有267例患者随机入组并接受研究药物,其中134例患者接受了吡咯替尼治疗,133例患者接受了拉帕替尼(一种选择性、可逆性EGFR/HER2小分子酪氨酸激酶抑制剂)治疗,所有入组患者均联用卡培他滨。
近日,本研究开展了方案预设的期中分析,独立数据监查委员会(IDMC)在审阅了期中分析的有效性和安全性数据后,确定本研究主要终点-IRC评估的无进展生存期(PFS)已达到方案预设的期中分析优效判定标准,且安全性可接受。
研究表明,对于既往使用过曲妥珠单抗和紫杉类药物的转移性乳腺癌患者,接受吡咯替尼联合卡培他滨治疗对比拉帕替尼联合卡培他滨,可显著延长患者的无进展生存期。
注射用异环磷酰胺检验标准操作规程

1.性状本品应为白色结晶性多孔质块或粉末.。
2.鉴别2.1所用仪器:万分之一电子天平;高效液相色谱仪;并均已校验;层析缸;薄层板2.2所用试剂及试液:乙醇:AR 异丙醇:AR 甲苯:AR碘蒸气:将碘放入层析缸内,使之挥发成碘蒸气。
异环磷酰胺对照品2.3操作方法:2.3.1取供试品约50mg , 加乙醇2.5ml , 振摇使异环磷酰胺溶解, 滤过, 取滤液作为供试品溶液; 另取异环磷酰胺对照品约200mg , 加乙醇制成每1ml中含20mg的溶液, 吸取上述两种溶液各10ul, 分别点于同一硅胶G薄层板上, 以异丙醇-甲苯(1:1)为展开剂, 展开后, 晾干, 置碘蒸气中显色, 供试品所显主斑点的颜色与位置与对照品主斑点的颜色与位置应一致。
2.3.2在含量测定项下记录的图谱中,供试品峰的保留时间应与对照品峰的保留时间一致。
3.检查3.1酸碱度3.1.1所用试剂及试液磷酸盐标准缓冲液:精密称取在115℃±5℃干燥2~3小时的无水磷酸氢二钠3.55g与磷酸二氢钾3.40g,加水使溶解并稀释至1000ml。
苯二甲酸盐标准缓冲液:精密称取在115℃±5℃干燥2~3小时的邻苯二甲酸氢钾10.21g,加水使溶解并稀释至1000ml。
3.1.2所用仪器:酸度计,酸度计每年检定一次,使精密度和准确度符合要求。
3.1.3原理电位法测定pH值是用饱和甘汞电极为参比电极,玻璃电极作指示电极(或复合电极),在供试液中组成原电池,测量电池电动势,以测溶液的pH值,借以控制该品的酸碱性。
3.1.4操作方法酸度计校正:先用苯二甲酸盐标准缓冲液和磷酸盐标准缓冲液(25℃pH值为6.86)校正酸度计,在与测定供试液相同的温度下,用磷酸盐标准缓冲液(25℃pH值为6.86)充满测定池,将温度钮调到与溶液温度一致,斜率调节至100%,再调节定位控制钮,使测得的pH值与此温度时磷酸盐标准缓冲液标准值一致,用苯二甲酸盐标准缓冲液充满测定池,在测定供试液相同的温度下测定pH值,苯二甲酸盐标准缓冲液测得pH值与此温度时标准值之差应≤±0.07pH单位.若偏差大于0.07pH,应检查电极,如果电极不合格,应更换之.调节斜率或定位钮使测得值与标准值一致,用二种标准缓冲液重新校正,直到不再调节控制钮而二种标定用缓冲液与标准值之差不超过0.02pH单位.注意事项:每次更换标准缓冲液或供试液前,应用纯化水充分洗涤电极,然后将水吸尽,也可用所换的标准缓冲液或供试液洗涤。
恒瑞医药:关于获得临床试验通知书的公告

证券代码:600276 证券简称:恒瑞医药公告编号:临2020-055 江苏恒瑞医药股份有限公司关于获得临床试验通知书的公告本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性承担个别及连带责任。
江苏恒瑞医药股份有限公司(以下简称“公司”)及子公司上海恒瑞医药有限公司、苏州盛迪亚生物医药有限公司近日收到国家药品监督管理局(以下简称“国家药监局”)核准签发的《临床试验通知书》,并将于近期开展临床试验。
现将相关情况公告如下:一、药品基本情况(一)SHR-1316注射液1、药品名称:SHR-1316注射液剂型:注射剂申请事项:临床试验申请人:江苏恒瑞医药股份有限公司;苏州盛迪亚生物医药有限公司;上海恒瑞医药有限公司受理号:CXSL2000040审批结论:根据《中华人民共和国药品管理法》及有关规定,经审查,2020年3月2日受理的SHR-1316注射液符合药品注册的有关要求,同意按照提交的方案开展SHR-1316注射液联合氟唑帕利胶囊及替莫唑胺胶囊治疗复发性小细胞肺癌的临床试验。
2、药品的其他情况SHR-1316作为PD-L1单抗药物,可以解除PD-L1介导的免疫抑制效应,增强杀伤性T细胞的功能,发挥调动机体免疫系统清除体内肿瘤细胞的作用。
SHR-1316为公司自主研发产品。
经查询,SHR-1316目前国外有同类产品Atezolizumab(商品名Tecentriq®)、Avelumab(商品名Bavencio®)和Durvalumab(商品名Imfinzi®)于美国获批上市销售。
2019年12月,Durvalumab(商品名Imfinzi®)在国内获批上市。
国内有CS1001等多个同类产品处于临床试验阶段。
经查询,2019年Atezolizumab、Durvalumab和Avelumab 全球总销售额约为35.08亿美元。
国家药监局批准富马酸泰吉利定注射液上市

国家药监局批准富马酸泰吉利定注射液上市
佚名
【期刊名称】《中国处方药》
【年(卷),期】2024(22)4
【摘要】近日,国家药品监督管理局批准江苏恒瑞医药股份有限公司申报的1类创新药富马酸泰吉利定注射液上市,适用于腹部手术后中重度疼痛。
此次获批是基于恒瑞医药进行的SHR8554-301研究所取得的积极结果。
SHR8554-301是一项Ⅲ期临床研究,旨在评估富马酸泰吉利定注射液在腹部手术后镇痛中的有效性和安全性。
研究主要疗效指标包括在开始输注负荷剂量试验药物后24 h内静息状态下疼痛强度差异的时间加权和(SPID24)。
【总页数】1页(PI0001-I0001)
【正文语种】中文
【中图分类】F42
【相关文献】
1.国家药监局批准佩索利单抗注射液上市
2.国家药监局附条件批准伊基奥仑赛注射液上市
3.国家药监局批准托莱西单抗注射液上市
4.国家药监局批准仑卡奈单抗注射液上市
5.国家药监局附条件批准纳鲁索拜单抗注射液上市
因版权原因,仅展示原文概要,查看原文内容请购买。
恒瑞医药关于许可韩国HLB Life Science公司马来酸吡咯替尼的公告

证券代码:600276证券简称:恒瑞医药公告编号:2020-102江苏恒瑞医药股份有限公司关于许可韩国HLB Life Science公司在韩国开发和销售马来酸吡咯替尼片的公告本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性承担个别及连带责任。
江苏恒瑞医药股份有限公司(以下简称“恒瑞”或“公司”)与韩国HLB Life Science Co., Ltd.公司(以下简称“HLB-LS公司”)达成协议,将具有自主知识产权的抗肿瘤药品马来酸吡咯替尼片(以下简称“吡咯替尼”)项目有偿许可给韩国HLB-LS公司。
一、许可产品基本信息吡咯替尼为恒瑞自主研发且具有知识产权的口服表皮生长因子受体(EGFR)/人表皮生长因子受体2(HER2)/人表皮生长因子受体4(HER4)酪氨酸激酶抑制剂。
2017年7月公司向江苏省食品药品监督管理局提交药品注册申请并获受理。
2018年8月吡咯替尼在中国有条件批准上市,适应症为“联合卡培他滨,适用于治疗表皮生长因子受体2(HER2)阳性、既往未接受或接受过曲妥珠单抗的晚期或转移性乳腺癌患者”。
使用本品前患者应接受过蒽环类或紫杉类化疗。
2020年7月,吡咯替尼修订说明书的补充申请获批,吡咯替尼联合卡培他滨,适用于治疗表皮生长因子受体2(HER2)阳性、接受过曲妥珠单抗的复发或转移性乳腺癌患者的适应症转为完全批准。
截至目前,该产品已投入研发费用约为84,363万元人民币。
二、同类药品市场情况经查询,国外已上市的同类产品有Tykerb®(lapatinib)、Gilotrif®(afatinib)Nerlynx®(neratinib)、Vizimpro®(dacomitinib)和Tukysa®(tucatinib)。
Tykerb®由GlaxoSmithKline公司开发,最早于2007年3月获美国食品药品监督管理局批准,规格为250mg/片,国内已进口上市。
恒瑞医药将于近期开展美洛昔康混悬注射液的Ⅰ期临床试验

恒瑞医药将于近期开展美洛昔康混悬注射液的Ⅰ期临床试验佚名
【期刊名称】《临床合理用药杂志》
【年(卷),期】2018(11)32
【摘要】近日,恒瑞医药发布公告称,收到国家药监局核准签发的《临床试验通知书》,并将于近期开展美洛昔康混悬注射液Ⅰ期临床试验。
据悉,美洛昔康混悬注射液是一种静脉注射用非甾体类抗炎药,拟用于术后中重度疼痛的治疗。
【总页数】1页(P177-177)
【正文语种】中文
【中图分类】R979.1
【相关文献】
1.恒瑞医药:创新药研发进入收获期
2.“恒瑞”之路;江苏恒瑞医药股份有限公司技术创新调查
3.氟苯尼考混悬注射液与普通注射液在猪体内的药代动力学比较
4.恒挂瑞帆惠苍生—访全国人大代表、江苏恒瑞医药股份有限公司董事长孙飘扬
5.硫酸头孢喹肟混悬制剂的药敏及临床试验
因版权原因,仅展示原文概要,查看原文内容请购买。
生物制药企业的创新药物研发与临床试验考核试卷

B.项目经理
C.质量管理人员
D.市场人员
11.以下哪个阶段是生物制药企业药物研发成本最高的阶段?()
A.靶点发现
B.先导化合物筛选
C.临床试验
D.上市后监测
12.生物制药企业在进行临床试验时,以下哪个国家或地区的监管机构最为严格?()
A.美国
B.欧洲
C.日本
D.中国
13.以下哪个疾病领域的生物药物研发最为活跃?()
A.靶点选择
B.先导化合物优化
C.临床前研究
D.临床试验
5.生物制药企业在进行临床试验时,以下哪个环节最为重要?()
A.受试者招募
B.数据收集
C.数据分析
D.安全性监测
6.以下哪个药物类型在生物制药企业中占据主导地位?()
A.化学药品
B.生物制品
C.中药
D.天然药物
7.在创新药物研发过程中,以下哪个环节是药物上市前必须完成的?()
生物制药企业的创新药物研发与临床试验考核试卷
考生姓名:__________答题日期:______年__月__日得分:_________判卷人:_________
一、单项选择题(本题共20小题,每小题1分,共20分,在每小题给出的四个选项中,只有一项是符合题目要求的)
1.创新药物研发的初期阶段,以下哪项工作最为关键?()
A.知情同意
B.伦理审查
C.数据隐私保护
D.保险赔偿
10.以下哪些因素可能导致药物研发项目的延期?()
A.研发资金不足
B.临床试验结果不理想
C.法规政策变化
D.研发团队人员流失
11.生物制药企业在新药研发过程中,以下哪些环节需要关注药物的知识产权问题?()
注射用甲苯磺酸瑞马唑仑(CXHS1800002)申请上市技术审评报告

国家药品监督管理局药品审评中心2020年3月一、基本信息 (4)1.申请人信息 (4)2.原料药及制剂基本情况 (4)3.审评程序及审评与审核人员信息 (5)4.审评经过 (5)二、核查与检验等情况 (6)1.研制现场核查情况 (6)2.样品检验情况 (6)3.申请人获得申报剂型的GMP证书情况 (7)4.临床试验核查 (6)三、综合审评意见 (7)1.适应症/功能主治 (7)2.药理毒理评价 (8)3.原料和/或制剂评价 (8)4.支持上市申请的关键性临床数据及评价 (9)(1)临床药理学评价 (9)(2)有效性评价 (10)(3)安全性评价数据 (11)(4)临床试验数据分析与评价 (12)(5)风险分析与控制 (13)(6)获益与风险评估 (13)四、三合一审评情况 (13)1.生产现场检查情况 (13)2.抽样检验情况 (14)3.技术审评的总体评价 (14)五、技术审评意见 (14)1.技术结论 (14)2.上市后要求 (15)3.上市后风险控制 (15)批准日期:2019年12月26日批准文号:国药准字H20190034注射用甲苯磺酸瑞马唑仑(CXHS1800002)申请上市技术审评报告一、基本信息1.申请人信息2.原料药及制剂基本情况3.审评程序及审评与审核人员信息略。
4.审评经过受理日期:2018年3月7日承办日期:2018年3月21日召开会议情况:补充资料时间:2018年12月13日;2019年8月8日临床试验核查:2019年5月21-27日生产现场检查:2019年9月5-10日二、核查与检验等情况1.研制现场核查情况与生产现场检查合并进行。
2.样品检验情况中检院于2019年4月15日按照企业申报标准完成对原料和制剂各3批样品(原料药批号保密内容保密内容保密内容保密内容,制剂批号保密内容保密内容保密内容保密内容)的标准复核及检验,结论为申报标准基本可行,检验结果符合标准;根据CDE的发补通知,企业于2019年8月对标准进行了修订,中检院于2019年11月21日完成了对原料和制剂各3批样品(原料药批号保密内容保密内容保密内容保密内容保密内容,制剂批号保密内容保密内容保密内容保密内容)的单项复核及检验,结果符合规定。
甲氨蝶呤联合米非司酮用于宫外孕的保守治疗

甲氨蝶呤联合米非司酮用于宫外孕的保守治疗发表时间:2019-01-18T10:55:02.937Z 来源:《健康世界》2018年25期作者:王萍[导读] 目的:研究分析甲氨蝶呤联合米非司酮在宫外孕保守治疗中的应用效果。
山东省东平县中医院 271500摘要:目的:研究分析甲氨蝶呤联合米非司酮在宫外孕保守治疗中的应用效果。
方法:纳入此次研究58例宫外孕患者的收治时间均为2017年5月至2018年5月,患者入组后以随机分组的形式将其分为单一组与联合组,每组各29例,单一组使用甲氨蝶呤进行治疗,联合组使用甲氨蝶呤联合米非司酮进行治疗,对比两组患者的治疗效果。
结果:联合组患者治疗总有效率93.1%比单一组患者治疗总有效率68.9%高,数据差异具有统计学意义(P<0.05);联合组患者不良反应反应发生率10.3%比单一组患者不良反应发生率34.4%低,数据差异具有统计学意义(P<0.05)。
结论:甲氨蝶呤联合米非司酮在宫外孕保守治疗中的效果较为理想,且具有较高的安全性,值得推广使用。
关键词:甲氨蝶呤;米非司酮;宫外孕;治疗效果Methotrexate combined with mifepristone for conservative treatment of ectopic pregnancy 【Abstract】Objective:To study the effect of methotrexate combined with mifepristone in conservative treatment of ectopic pregnancy. Methods:58 patients with ectopic pregnancy were enrolled in the study from May 2017 to May 2018. Patients were randomized into a single group and a combined group,with 29 patients in each group. A single group was treated with methotrexate,and the combination group was treated with methotrexate and mifepristone to compare the therapeutic effects of the two groups. Results:The total effective rate of treatment in the combined group was 93.1% higher than that in the single group. The total effective rate was 68.9%,and the difference was statistically significant(P<0.05). The incidence of adverse reaction in the combined group was 10.3%,which was worse than that in the single group. The reaction rate was low at 34.4%,and the data difference was statistically significant(P<0.05). Conclusion:Methotrexate combined with mifepristone is effective in the conservative treatment of ectopic pregnancy,and it has high safety and is worthy of popularization. 【Key words】Methotrexate;Mifepristone;Ectopic pregnancy;Therapeutic effect宫外孕是常见的一种病症,发生因素有附件炎等,临床症状有腹部疼痛、阴道出血等,临床诊断宫外孕的手段有超声、HCG测定等[1]。
2021 年度恒瑞医药联合基金项目申报指南

2021 年度恒瑞医药联合基金项目申报指南摘要:1.恒瑞医药联合基金项目申报指南简介2.申报项目的类别和要求3.申报流程和时间安排4.申报材料的准备和提交5.申报成功的关键因素正文:恒瑞医药联合基金项目申报指南是为了鼓励和促进医药领域的科研创新,推动医药行业的发展而设立的。
该项目旨在支持具有创新性、实用性和可行性的医药研究项目,以提高我国医药行业的整体水平。
申报项目的类别和要求包括以下方面:(1)创新药物研究:针对重大疾病和未满足的临床需求,开展创新药物的研究和开发;(2)医疗器械研究:研究开发新型医疗器械,提高疾病诊断和治疗水平;(3)生物技术研究:开展生物技术在医药领域的应用研究,促进生物医药产业发展;(4)药物临床研究:开展药物临床试验,评估药物的安全性和有效性;(5)其他医药相关研究:包括药物质量控制、药物经济学、药物政策研究等。
申报流程和时间安排如下:(1)申报单位需在规定时间内提交项目申报书,包括项目背景、研究目标、研究内容、研究方法、预期成果等;(2)项目申报书经过专家评审,确定入围项目名单;(3)入围项目单位需在规定时间内提交项目实施方案,经专家审核通过后,正式立项;(4)项目执行期间,申报单位需按要求提交项目进展报告和年度总结报告;(5)项目完成后,申报单位需提交项目验收报告和成果报告。
申报材料的准备和提交需要注意以下几点:(1)项目申报书需严格按照规定格式填写,内容完整、准确;(2)项目实施方案需详细、具体,明确研究目标、研究内容、研究方法等;(3)提交的材料需加盖申报单位公章,扫描后以电子邮件形式发送至指定邮箱;(4)提交的材料应确保无涉密内容,否则后果自负。
申报成功的关键因素包括:(1)项目选题具有创新性、实用性和可行性;(2)申报单位具备一定的科研实力和项目实施条件;(3)项目申报书和实施方案撰写质量高,能充分展示项目的优势和特点;(4)申报单位在项目执行过程中,能严格按照要求完成各项任务。
医药生物行业周报:板块持续回调,逢低布局景气度高的细分赛道
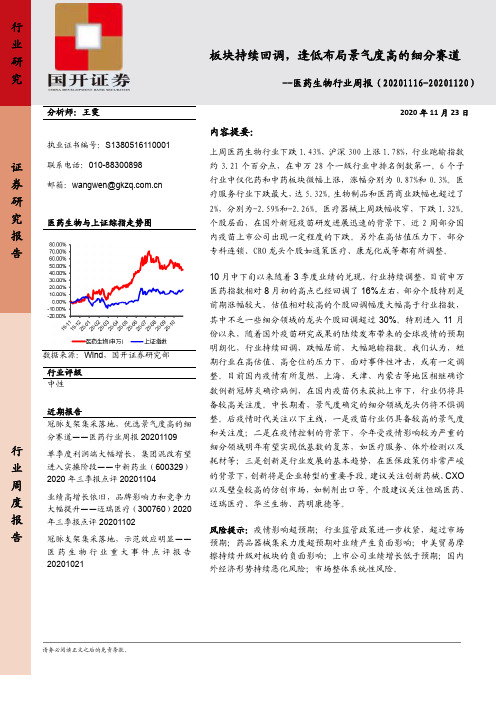
行业研究证券研究报告行业周度报告板块持续回调,逢低布局景气度高的细分赛道--医药生物行业周报(20201116-20201120)分析师:王雯执业证书编号:S1380516110001联系电话:************邮箱:****************.cn医药生物与上证综指走势图数据来源:Wind,国开证券研究部行业评级中性近期报告冠脉支架集采落地,优选景气度高的细分赛道——医药行业周报20201109单季度利润端大幅增长,集团混改有望进入实操阶段——中新药业(600329)2020年三季报点评20201104业绩高增长依旧,品牌影响力和竞争力大幅提升——迈瑞医疗(300760)2020年三季报点评20201102冠脉支架集采落地,示范效应明显——医药生物行业重大事件点评报告202010212020年11月23日内容提要:上周医药生物行业下跌1.43%,沪深300上涨1.78%,行业跑输指数约3.21个百分点,在申万28个一级行业中排名倒数第一。
6个子行业中仅化药和中药板块微幅上涨,涨幅分别为0.87%和0.3%。
医疗服务行业下跌最大,达5.32%。
生物制品和医药商业跌幅也超过了2%,分别为-2.59%和-2.26%。
医疗器械上周跌幅收窄,下跌1.32%。
个股层面,在国外新冠疫苗研发进展迅速的背景下,近2周部分国内疫苗上市公司出现一定程度的下跌。
另外在高估值压力下,部分专科连锁、CRO龙头个股如通策医疗、康龙化成等都有所调整。
10月中下旬以来随着3季度业绩的兑现,行业持续调整,目前申万医药指数相对8月初的高点已经回调了16%左右,部分个股特别是前期涨幅较大,估值相对较高的个股回调幅度大幅高于行业指数,其中不乏一些细分领域的龙头个股回调超过30%。
特别进入11月份以来,随着国外疫苗研究成果的陆续发布带来的全球疫情的预期明朗化,行业持续回调,跌幅居前,大幅跑输指数。
我们认为,短期行业在高估值、高仓位的压力下,面对事件性冲击,或有一定调整。
江苏 2023年药物临床试验知识竞赛真题模拟汇编(共242题)

江苏 2023年药物临床试验知识竞赛真题模拟汇编(共242题)1、()是临床试验中用于试验或参比的任何药品或安慰剂。
(单选题)A. 试验用药品B. 药品C. 标准操作规程D. 药品不良反应试题答案:A2、()指为有效地实施和完成某一临床试验中每项工作所拟定的标准而详细的书面规程。
(单选题)A. 药品B. 标准操作规程C. 试验用药品D. 药品不良反应试题答案:B3、什么是伦理委员会的审查范围?()(多选题)A. 对结束项目进行审查B. 在研究开始前对研究项目进行审查C. 同时还应对已通过审查、真在进行的研究项目进行跟踪审查D. 以上都是试题答案:B,C4、在试验方案中有关试验药品一般不考虑:()。
(单选题)A. 给药途径B. 给药剂量C. 用药价格D. 给药次数试题答案:C5、受试者在任何阶段有权退出试验,但退出后无权要求下列哪一项?()(单选题)A. 不受到歧视B. 不受到报复C. 不改变医疗待遇D. 继续使用试验药品试题答案:D6、下面说法错误的为()(多选题)A. 每一位受试者在试验中的有关资料均应记录于预先按试验要求而设计的病例报告表中。
B. 每一受试者在试验中的有关资料只记录在病历中。
C. 研究者在临床试验开始后,按临床试验的具体情况决定记录数据的方式。
D. 研究者只需将每一受试者在试验中的有临床意义的资料记录在病例报告表中。
试题答案:B,C,D7、下面说法正确的是()(多选题)A. 临床试验的设计与结果的表达及分析过程中,必须采用公认的统计分析方法,并应贯彻于临床试验的始终。
B. 临床试验设计与结果表达及分析的各步骤中,均需有熟悉生物统计学的人员参加。
C. 试验方案中观察样本的大小必须以统计学原则为依据。
D. 试验方案中观察样本的大小必须以检出有明显的差异为原则试题答案:A,B,C8、主要研究(PI)在临床实验时应签署哪些文件?()(多选题)A. 研究方案修正案B. 知情同意书C. 多方协议D. 病例报告表E. 总结报告试题答案:A,B,C,D,E9、试验病例数()。
600276恒瑞医药关于获得药物临床试验批准通知书的公告

证券代码:600276 证券简称:恒瑞医药公告编号:临2020-109 江苏恒瑞医药股份有限公司关于获得药物临床试验批准通知书的公告本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性承担个别及连带责任。
江苏恒瑞医药股份有限公司(以下简称“公司”)及子公司苏州盛迪亚生物医药有限公司近日收到国家药品监督管理局核准签发的《药物临床试验批准通知书》,并将于近期开展临床试验。
现将相关情况公告如下:一、药品基本情况1、药品的基本情况2、药品的其他情况甲磺酸阿帕替尼是公司创新研发的小分子靶向药物,2014年获批上市。
经查询,甲磺酸阿帕替尼目前国内外有索拉非尼、舒尼替尼、培唑帕尼等多种同类产品获批上市。
索拉非尼由拜耳公司开发,最早于2005年在美国获批上市;舒尼替尼由辉瑞公司开发,最早于2006年在美国获批上市。
培唑帕尼由诺华研发,2009年在美国获批上市。
目前三款多靶点抑制剂均已在国内获批上市。
经查询,2019年索拉非尼、舒尼替尼和培唑帕尼全球销售额约为21.59亿美元。
注射用卡瑞利珠单抗是人源化抗PD-1单克隆抗体,可与人PD-1受体结合并阻断PD-1/PD-L1通路,恢复机体的抗肿瘤免疫力,从而形成癌症免疫治疗基础。
经查询,目前国外有3款PD-1单克隆抗体获批上市,分别为帕博利珠单抗(默沙东,商品名可瑞达),纳武利尤单抗(百时美施贵宝,商品名欧狄沃)和cemiplimab(再生元制药,商品名Libtayo)。
帕博利珠单抗和纳武利尤单抗均已在国内获批上市。
除恒瑞医药外,国内另有3款PD-1单克隆抗体获批上市,分别为特瑞普利单抗(上海君实,商品名拓益,2018年获批),信迪利单抗(信达生物,商品名达伯舒,2018年获批)和替雷利珠单抗(百济神州,商品名百泽安,2019年获批)。
经查询,2019年抗PD-1抗体全球销售额约为188.09亿美元。
截至目前,甲磺酸阿帕替尼累计已投入研发费用约为35,625万元人民币,注射用卡瑞利珠单抗累计已投入研发费用约为127,984万元人民币。
药物临床试验合作协议模板

甲方:(药物研发企业或机构名称)乙方:(临床试验机构名称)鉴于甲方拥有一项或多项已获得相关批准的药物或医疗器械产品,并希望进行临床试验以验证其安全性和有效性;乙方具备开展临床试验的资质和条件,愿意为甲方提供临床试验服务。
为明确双方的权利和义务,经友好协商,特订立本协议如下:一、合作内容1. 试验项目:本协议项下的临床试验项目为甲方产品【药物/医疗器械名称】的临床试验。
2. 试验目的:通过临床试验,评估【药物/医疗器械名称】在人体内的安全性、有效性及药代动力学特征。
3. 试验方案:双方将共同制定详细的临床试验方案,包括试验设计、试验方法、样本量、入选/排除标准、疗效指标、安全性指标等。
4. 试验地点:试验将在乙方指定的临床试验机构进行。
二、双方权利与义务甲方权利与义务:1. 提供临床试验所需的药物/医疗器械、相关资料及试验设备。
2. 负责临床试验费用的预算和支付。
3. 按时向乙方提供临床试验所需的文件和资料。
4. 对乙方在临床试验过程中所获取的数据和信息保密。
乙方权利与义务:1. 按照临床试验方案和相关规定,负责组织实施临床试验。
2. 确保试验数据的真实、准确、完整。
3. 对试验过程中发现的问题及时向甲方报告。
4. 按时提交临床试验报告。
三、保密条款1. 双方对本协议内容以及试验过程中所获取的数据和信息负有保密义务。
2. 未经对方同意,不得向任何第三方泄露。
四、知识产权1. 甲方拥有本协议项下药物/医疗器械的知识产权。
2. 乙方在试验过程中所获取的数据和信息,除用于试验目的外,未经甲方同意,不得用于其他用途。
五、违约责任1. 若甲方未按时支付试验费用,乙方有权暂停试验。
2. 若乙方未按试验方案执行试验,甲方有权要求乙方承担相应的违约责任。
六、争议解决1. 双方在履行本协议过程中发生的争议,应友好协商解决。
2. 协商不成的,任何一方均可向甲方所在地人民法院提起诉讼。
七、协议生效与终止1. 本协议自双方签字盖章之日起生效。
恒瑞SHR6390片药物竞争格局
哌柏西利胶囊
重庆药友制药有限责任公司
哌柏西利胶囊
重庆药友制药有限责任公司
Lerociclib片
G 1 The rape ut i cs ,I nc. 、Quot ient S c i e n c e s
Lerociclib片
G 1 The rape ut i cs ,I nc. 、Quot ient S c i e n c e s
生产企业 江苏恒瑞医药股份有限公司 江苏恒瑞医药股份有限公司 江苏恒瑞医药股份有限公司 江苏恒瑞医药股份有限公司 江苏恒瑞医药股份有限公司 江苏恒瑞医药股份有限公司 江苏恒瑞医药股份有限公司 江苏恒瑞医药股份有限公司 江苏恒瑞医药股份有限公司
点击查看更多数据
承办日期 2021-05-11 2021-05-11 2021-04-27 2021-04-27 2021-04-27 2020-09-05 2020-09-05 2020-09-05 2020-06-11
临床前 (2020-0410)
药物发现
临床前
( 2 0 2 0 - 04- —— 10)
——
医药行业周报:关注创业板注册制带动的医药投资机会

报告摘要:●本周观点本周创业板第一批注册制18家公司上市,医药板块的“创新”性质将使其长期成为创业板的重要组成部分,我们认为在创业板投资热情高涨,医药估值性价比提升的时点,可以关注创业板带动的板块投资机会;站在后疫情时代和中报期的时点,我们继续关注变化最直接、最快速的医疗器械板块:短期有业绩支撑,疫情后又有基本面变化预期,长期逻辑兑现节奏较快,政策压力整体较小,确定性相对较强;本周中报披露结束,下半年开始,医药板块的主题行情慢慢结束,仍将回归到公司的基本面投资,我们持续关注高景气度、高成长性的优质“赛道”。
●一周市场回顾对2020年初到目前的医药板块进行分析,医药板块收益率58.5%,同期沪深300收益率18.3%,医药板块跑赢沪深300 收益率40.3%。
本周沪深300指数上涨2.66%,医药板块上涨4.04%,医药板块跑赢沪深300 收益率1.38%。
其中,本周医药所有子板块均上涨,医药服务涨幅最大,为9.51%,其次为中药4.55%,生物制品板块涨幅最小,为1.55%,医药商业为2.90%。
目前医药板块估值52倍PE(TTM,整体法,剔除负值),高于2010年以来的历史平均水平(37倍PE),相对扣除银行后全部A股的溢价率为86%。
●行业动态跟踪(1)湖北省将在三年内投资1783亿实施1216个公卫项目;(2)江苏豪森药业集团有限公司生产的甲磺酸阿美替尼片(55mg*20片/盒)挂网限价由19600元/盒调整至9800元/盒,冲刺医保。
●投资建议建议关注1)医疗器械板块:包括传统医疗器械进口替代逻辑的迈瑞医疗、乐普医疗,新冠检测服务催化的IVD公司万孚生物、金域医学,以及高成长属性的自主创新器械心脉医疗、三友医疗;2)创新药产业链:关注大市值恒瑞医药、药明康德;3)消费升级“赛道”:疫苗板块智飞生物、康泰生物(短期回调不改长期产品放量、消费升级逻辑,叠加全球新冠疫苗研发火热),生长激素龙头长春高新;4)医药流通和药店板块,前期涨幅较小,具有高估值性价比和安全边际,且药店板块同时受益于消费升级、互联网+医疗等,建议关注国药股份、大参林、益丰药房等。
恒瑞医药近年申报的品种

还没上市,只能玩完。 生物制品 贝伐珠单抗(生物报临床):原研的单抗,用于 治疗多种实体瘤,超适应症用于年龄相关性黄斑 变性,年销售额亿美元。江苏泰康、江苏先声
、苏州思坦维、齐鲁制药、百奥泰等有单抗在研, 华海药业与合作开发贝伐珠单抗生物仿制药。 首仿品种 替格瑞洛(化药报生产):替格瑞洛是研发的受 体拮抗剂,分别在年
品库很大而且质量很高,大多数都是首仿品种或 者独家剂型,生物制品开始起步。 瑞格列汀:重磅口服降糖药西格列汀的类似物 (专利),有单用片剂和联用二甲双胍的复方, 已
全面开展期临床。维格列汀、西格列汀的专利到 期时间分别是年、年,瑞格列汀如果能在年上市, 前景是非常不错的。当然后面的一堆格列汀估计 死定了,国外的几个原研全到期,你
、年获得、批准,用于急性冠脉综合征、段抬高 型心肌梗死患者预防血栓事件,自估年销售峰值 亿美元。该药由恒瑞子公司成都盛迪申报(第 家),与石药集团进度相当。 格隆溴
铵(化药报临床):格隆溴铵是开发的胆碱受体 拮抗剂,没有中枢抗胆碱活性,可抑制抑制胃液 分泌。目前国内只上市了格隆溴铵片剂,而格隆 溴铵注射剂可以用于麻醉前给药,抑制
注射液、枸橼酸钠林格注射液、达托霉素、碘化 油注射液、瑞格列奈、紫七片
黄曲霉毒素
ห้องสมุดไป่ตู้
/zh/cas-1402-68-2.html
腺体分泌,恒瑞的注射剂虽不是第家申报但有可 能拿到首仿。 其他品种 卡巴他赛、替吉奥、中长链脂肪乳氨基酸葡萄糖 注射液、丙泊酚中长链脂肪乳注射液、罗氟司特、 塞来
昔布、对乙酰氨基酚、马尼地平、氯吡格雷、兰 地洛尔、曲美他嗪(缓释)、奥美沙坦酯、氨氯 地平奥美沙坦酯、缬沙坦氨氯地平、西那卡塞、 多烯磷脂酰胆碱、高热值混合糖电解质
恒瑞目前的上市产品主要是抗癌药、麻醉药、造 影剂、电解质输液,还有少量抗生素、降压药, 其中抗癌药是承压部分,麻醉药市场占有率已经 领先,其他业务还有上升空间。近年新
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
证券代码:600276 证券简称:恒瑞医药公告编号:临2018-017 江苏恒瑞医药股份有限公司
关于公司及子公司开展药物临床试验的公告
本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性承担个别及连带责任。
江苏恒瑞医药股份有限公司(以下简称“恒瑞医药”或“公司”)及子公司上海恒瑞医药有限公司将于近期开展SHR6390片的II期临床试验。
现将相关情况公告如下:
一、药品基本情况
1、药品名称:SHR6390片
剂型:片剂
注册分类:化学药品第1.1类
申报阶段:临床
申请人:江苏恒瑞医药股份有限公司、上海恒瑞医药有限公司
审批结论:根据《中华人民共和国药品管理法》,经审查,本品符合药品注册的有关规定,同意本品进行临床试验。
2、药品的其他相关情况
2014年4月1日,恒瑞医药及上海恒瑞医药有限公司向江苏省食品药品监督管理局递交临床试验申请获受理。
SHR6390是一种CDK4/6选择性抑制剂,拟用于恶性肿瘤的治疗。
全球首个上市的CDK4/6抑制剂为辉瑞公司研发的palbociclib,商品名Ibrance,于2015年2月通过加快审评途径获美国食品药品监督管理局批准上市,目前已在欧盟、日本等多个国家和地区上市。
其他已上市的CDK4/6抑制剂有诺华研发的Ribociclib(商品名Kisqali)和礼来研发的
Abemaciclib(商品名Verzenio)。
目前中国境内(不包括港澳台地区)尚无具有自主知识产权的、与本品同靶点的药物上市。
经查询IMS数据库,该产品的同类产品2017年全球销售额约为34.88亿美元。
截至目前,公司在该研发项目上已投入研发费用约为3,300万元人民币。
根据我国药品注册相关的法律法规要求,药物在获得临床试验批件并开展临床试验后,尚需经国家食品药品监督管理总局审评、审批通过后方可生产上市。
二、风险提示
由于医药产品具有高科技、高风险、周期长的特点,药品的前期研发以及产品从研制、临床试验报批到投产的周期长、环节多,容易受到一些不确定性因素的影响,敬请广大投资者谨慎决策,注意防范投资风险。
公司将积极推进上述研发项目,并按有关规定及时对项目后续进展情况履行信息披露义务。
特此公告。
江苏恒瑞医药股份有限公司董事会
2018年3月21日。
