细胞基因组DNA的提取.ppt
DNA的复制PPT课件
•Molecular Biology Course
(CsCl gradient centrifuge)
N15
DNA
N14
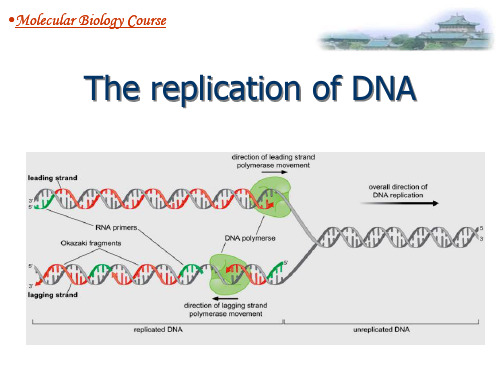
Semi-ConservationReplication
–第三阶段为DNA复制的终止阶段。DNA复制的整个 过程中需要30多种酶及蛋白质分子参加,我们将 在DNA复制的各个阶段着重介绍它们的作用。
•Molecular Biology Course
•Molecular Biology
Course (二)、复制的起始阶段
1、复制的起点 2、复制的方向 3、复制的速度 4、DNA复制起始引发体的形成及所参与的酶和 蛋白质
1、DNA半保留复制的机理 2、DNA的半不连续复制
•Molecular Biology
Course
1、DNA半保留复制的机理
Semi-Conservation Replication
DNA作为遗传物质的基本特点就是在细胞分裂前进行准 确的自我复制,使DNA的量成倍增加,这是细胞分裂的 物质基础。
当用缺乏糖苷酶的大肠杆菌变异株(ung-进行 实验时,尿嘧啶不再被切除。)
此时,新合成的DNA有一半放射性标记出现于岗 崎片断中,另一股直接进入大的片断。由此可 见,当DNA复制时,一条链是连续的,另一条链 是不连续的,因此称为半不连续复制(semidiscontinuous replication) 。
二、复制的起始阶段
•Molecular Biology Course
复制叉( replication fork ):DNA分子中正在进行 复制的分叉部位。它由两条亲代链及在其上新合成的子 链构成。
6动物组织细胞基因组DNA的提取和定量

10.加200ul TE重新溶解沉淀物,然后置于4℃ 或–20℃保存备用。
11.吸取适量样品于GeneQuant上检测浓度和纯度。
【注意事项】
标本必须新鲜,提取前细胞应保持完整。
所用EP管、吸嘴等器物及ddH2O、试剂 等应高压灭菌,操作尽量在4℃以下进行。 混匀试剂、吸取上清等操作时应避免动 作剧烈。 弃异丙醇时动作应轻,切忌甩干,以免 DNA丢失。
动物细胞基因组DNA的 提取及定量
真核细胞基因组DNA的分离纯化
核酸包括DNA、RNA两种分子,在细胞中
都以与蛋白质结合的状态存在。
真核生物的染色体DNA为双链线性分子.
大多数生物体内RNA分子为单链线性分子
分离纯化核酸总的原则:
应保证核酸一级结构的完整性 排除蛋白质、脂类、糖类等其他分子的污染 无其他核酸分子的体积异丙醇,倒转混匀后,可以看见丝 状物,用100ul 吸头挑出,凉干,用200ul TE 重新溶解。
4.加等量的酚·氯仿·异戊醇振荡混匀,
离心12000 rpm,5min。
5.取上层溶液至另一管,加入等体积的氯仿·异戊
醇,振荡混匀,离心12000 rpm,5min。
6. 取上层溶液至另一管,加入1/2体积的7.5mol/L
3. 对于很稀的核酸溶液,可用荧光光度法进行测 定。核酸经凝胶电泳后,在EB(溴化乙锭)中 浸染,核酸分子与溴化乙锭结合后, 能吸收300360nm波长的紫外光,同时诱发出波长为590nm 的红橙色荧光,从而可通过照像机摄影,凝胶成 像系统记录实验结果。此方法灵敏度高,10ng或 更少的DNA即可检出。
一、实验目的
掌握DNA定量的原理 掌握紫外分光光度仪的正确使用。
二、实验原理
植物生物工程实验二植物DNA的提取讲课文档

第三十三页,共41页。
6. 重复第3、第4步。
7. 每支离心管中加入等体积异丙醇(400-500μl)。上下颠倒 几次,4℃静置20分钟(或-20℃,15分钟)。(异丙醇用于 沉淀DNA)
8. 14,000rpm离心20分钟。小心倒出上清夜,避免DNA颗粒丢 失。倒置离心管,空气干燥(1-2分钟)。
第十六页,共41页。
测定结果分析
A:测DNA: 纯的DNA样品OD260/OD280应为1.8,OD260m/OD230应大
于2.0。 1) OD260/OD280大于1.9时,表明有RNA污染。 2) 小于1.6时,表明样品中存在蛋白质或酚污染; 3) OD260/OD230小于2.0时,表明溶液中有残存的盐和小分子杂质,如
第十九页,共41页。
根据OD260定量:
測定260nm吸光值,OD=1.0代表值如下:
a. ds DNA (double stranded DNA) = 50 mg/ml
b. ss DNA (single stranded DNA) = 40 mg/ml c. oligonucleotide = 33 mg/ml
1. 称取100mg新鲜叶片,置于预冷1.5ml离心管中,加入液氮, 研为细粉。加入350μl新鲜2×CTAB缓冲液,再仔细研磨。 (CTAB用于抽提DNA)
2. 用350μl新鲜2×CTAB缓冲液,冲洗研磨棒,加入2μlβ- 巯基乙醇,混匀。65℃水浴45分钟,每15分钟摇动一次。 冷却至室温,静置2分钟。
抽提液
贮存液l 168ul 4032ul
异丙醇;70%乙醇;90%乙醇;10mg/ml EB
不可忽视的细节—血液基因组提取PPT课件

DNA提取原则2:DNA产物纯度
• 严格要求产物纯度
▪ 存档、产物长期保存 ▪ Southern杂交 ▪ 荧光定量PCR ▪ SNP Microarray ▪ CGH (比较基因组杂交)
• 没有严格要求
▪ 常规PCR
内容
DNA提取的原则 基因组提取方法 样本保存和前处理 基因组提取流程 DNA保存及检测方法 试剂选择原则
红细胞裂解充分的现象: 得到的沉淀应为白色沉淀或淡粉色沉淀。有时血液需要进 行两次裂解,注意第二次加入裂解液后需要将沉淀votex 彻底混匀。
核细胞裂解
如果有裂红的步骤,请尽量将上清去除再加入裂解液。 加入裂解液(如:TIANGEN试剂盒中的GB或FG)和蛋白酶K需要彻底混匀。 将沉淀打散混匀后再进行水浴。 水浴时看到溶液变清,没有粘稠物或沉淀时即可进行下步操作,通常水 浴时间10-30min. 若采用有机(酚/氯仿)抽提时应充分混匀,动作要轻柔。离心分离两相 时,应保证一定的转速和时间,且吸取上清时注意不要吸取到中间层及 有机相。
不可忽视的细节
—血液基因组提取
天根生化科技(北京)有限公司
内容
DNA提取的原则 基因组提取方法 样本保存和前处理 基因组提取流程 DNA保存及检测方法 试剂选择原则
DNA提取原则1:DNA片段长度
DNA Length
严格要求片段长度:▪ 构建 ▪ PFGE(脉冲场凝胶电泳)没有严格要求:
▪ PCR ▪ Southern Blots ▪ RFLP
样本保存和前处理-微量血液/干血点/羊水/胸水
保存 微量血液:抗凝血液-20或-70℃保存; 干血点:干燥后室温或4℃保存; 羊水: -20或-70℃保存。 样本前处理 1. 微量血液处理同抗凝血液,不同之处是无需进行红细胞裂解步骤。 2. 干血点加入缓冲液直接进行提取。 3. 羊水/胸水提取时先离心得到沉淀,再进行裂解提取核酸。
实验三-细胞外周血DNA提取

步骤
6. 弃乙醇,敞开Eppendorf管盖,烘干(37℃恒温 箱)后,加1xTE溶液30ul,溶解DNA。(制成的 DNA液置于-20℃冰箱保存备用)
7.用DNA/RNA Calculator检测DNA的含量和纯 度。纯DNA的此比值约为1.8~2.0。纯RNA的比值 约为大于2.0。
步骤
8、限制性内切酶酶切:
实验三、外周血细胞基因组 DNA的提取 (NaI法)
基因组DNA提取原理
Loparev等报道利用NaI提取DNA的方法,从全血制 备白细胞DNA,可用双蒸水溶涨红细胞及白细胞膜, 释放出血红蛋白及细胞核。加NaI破核膜并使DNA 从核蛋白中解离,用氯仿/异戊醇抽提使蛋白质沉淀 完全(异戊醇去泡沫),DNA存在于上层水相中, 以异丙醇沉淀 DNA,离心弃去异丙醇,并重复操作 一次,即可获得白细胞DNA。
9、聚合酶链式反应:
步骤
a、25 ul标准PCR反应体系各成分终浓度如下:
b、标准PCR反应循环参数:
95℃:5 min预变性;94℃ 30s
63℃ 30s、 72℃ 60s, 共30个循环; 72℃ 7min。 c、置于4℃或-20℃保存。
模板DNA50~10ຫໍສະໝຸດ ngTaq DNA聚合酶
0.5~1 uL
PCR反应反复进行三步骤的循环过程: 热变性——退火——引物延伸 1)热变性:基因组DNA在95 ℃下加热5分,双螺旋结构被热变
性解链为两股单链。 2)退火:将反应混合物降温至55~65℃,引物与上述单链DNA
上互补的序列杂交在一起,即退火,形成模板——引物复合。 3)引物延伸:将反应混合物调节至72℃,在DNA聚合酶作用下,
上游引物 (10 uM)
1 uL
真核细胞基因组DNA的提取与鉴定

真核细胞基因组DNA的提取与鉴定一、目的要求掌握真核细胞基因组DNA的提取方法,掌握紫外分光光度法测定DNA含量的方法和DNA电泳方法。
重点实践植物 DNA 的抽提,掌握 CTAB 法快速抽提白三叶草 DNA 。
二、基本原理植物DNA的抽提常采用两种方法:(1)SDS 法:离子去污剂,过程长,纯度高;(2)CTAB 法:该方法简便、快速,DNA产量高(纯度稍次,适用于一般分子生物学操作) 。
CTAB是一种非离子去污剂,植物材料在CTAB的处理下,结合65℃水浴使细胞裂解、蛋白质变性、DNA被释放出来。
CTAB与核酸形成复合物,此复合物在高盐(>0.7mM )浓度下可溶,并稳定存在,但在低盐浓度(0.1-0.5mM NaCl )下CTAB-核酸复合物就因溶解度降低而沉淀,而大部分的蛋白质及多糖等仍溶解于溶液中。
经离心弃上清后,CTAB-核酸复合物再用70-75%酒精浸泡可洗脱掉CTAB。
再经过氯仿/ 异戊醇(24:1) 抽提去除蛋白质、多糖、色素等来纯化DNA,最后经异丙醇或乙醇等DNA沉淀剂将DNA 沉淀分离出来。
现生物试剂公司多依据此原理,经过改造,以吸附膜吸附DNA,除去杂质,从而减少了使用有害药品氯仿抽提的步骤。
琼脂糖凝胶电泳是分离、鉴定和纯化DNA片段的标准方法之一。
琼脂糖是从海藻中提取出来的一种线状高聚物,将其熔化在所需缓冲液中使成清澈、透明的溶液,然后倒入胶模令其固化。
不同浓度的琼脂糖形成的固体基质具有不同的密度(或孔隙度),因此适宜分离不同大小的DNA片段。
在电场中,DNA分子主要因其分子大小不同而被分离。
三、实验步骤(具体见试剂盒操作说明)植物基因组DNA的提取(参考步骤)1.采集适量幼嫩叶片,用液N2 研成粉末,0.4 g 装入1.5ml 离心管中(-20 ℃预冷)。
2.预热 1.5 ×CTAB 到95 ℃,加1ml 到装有叶片粉末的离心管中,混匀(防止冻融)。
细胞基因组dna提取

细胞基因组dna提取一、细胞基因组DNA提取的概念细胞基因组DNA提取是指从生物体内的细胞中提取出其基因组DNA,以便进行分子生物学实验。
DNA提取是许多分子生物学技术和实验的前提,如PCR、限制性酶切、电泳等。
二、细胞基因组DNA提取的原理1. 细胞破碎:将细胞破碎以释放DNA。
可以使用机械方法(如超声波)、化学方法(如溶液中加入洗涤剂)或酶解方法(如加入蛋白酶)等方式进行破碎。
2. DNA分离:将破碎后的混合物离心,使得DNA沉淀到底部。
然后通过去除上层液体和洗涤沉淀来纯化DNA。
3. DNA溶解:将沉淀的DNA溶解在适当的缓冲液中,以便进行后续实验操作。
三、细胞基因组DNA提取的步骤1. 收集样品:收集需要提取DNA的样品,如血液、组织或菌落等。
2. 细胞破碎:使用适当的方法对样品中的细胞进行破碎,释放出DNA。
3. 清洁DNA:通过离心等方法将DNA沉淀到底部,去除上层液体和洗涤沉淀来清洁DNA。
4. 溶解DNA:将沉淀的DNA溶解在适当的缓冲液中,以便进行后续实验操作。
四、细胞基因组DNA提取的影响因素1. 样品来源:不同的样品来源对细胞基因组DNA提取有不同的影响。
如血液、组织或菌落等。
2. 细胞数量:细胞数量越多,提取到的DNA量越多。
3. 细胞类型:不同类型的细胞具有不同的细胞壁和膜结构,需要采用不同的破碎方法。
4. 存储条件:样品在收集后需要妥善存储,避免样品受到污染或降解。
五、细胞基因组DNA提取常用方法1. CTAB法:CTAB法是一种化学法,使用CTAB(十六烷基三甲基溴化铵)来裂解细胞壁和膜,并与核酸结合形成复合物。
该方法适用于高含量多酚类物质的样品。
2. 盐溶法:盐溶法是一种简单易行的方法,使用盐和洗涤剂来裂解细胞壁和膜,并与核酸结合形成复合物。
该方法适用于低含量多酚类物质的样品。
3. 商业化试剂盒:商业化试剂盒是一种快速方便的DNA提取方法,通过购买商业化试剂盒来进行DNA提取。
动物组织细胞基因组DNA提取

动物组织细胞基因组DNA提取一、实验原理真核生物的一切有核细胞(包括培养细胞)都能用来制备基因组DNA。
真核生物的DNA 是以染色体的形式存在于细胞核内,因此,制备DNA的原则是既要将DNA与蛋白质、月旨类和糖类等分离,又要保持DNA分子的完整。
提取DNA的一般过程是将分散好的组织细胞在含SDS(十二烷基硫酸钠)和蛋白酶K的溶液中消化分解蛋白质,再用酚和氯仿/异戊醇抽提分离蛋白质,得到的DNA溶液经乙醇沉淀使DNA从溶液中析出。
蛋白酶K的重要特性是能在SDS和EDTA(乙二胺四乙酸二钠)存在下保持很高的活性。
在匀浆后提取DNA的反应体系中,SDS可破坏细胞膜、核膜,并使组织蛋白与DNA分离,EDTA则抑制细胞中Dnase的活性;而蛋白酶K可将蛋白质降解成小肽或氨基酸,使DNA 分子完整地分离出来。
二、仪器及试剂1. 仪器:恒温水浴锅、台式离心机、紫外分光光度计(GeneQuant)、移液器、玻璃匀浆器、离心管(灭菌)、吸头(灭菌)2. 试剂:(1)细胞裂解缓冲液:Tris(pH8.0)100mmol/LEDTA(pH8.0)500mmol/LNaCL20mmol/LSDS10%胰RNA酶20ug/ml(2)蛋白酶K:称取20mg蛋白酶k溶于1ml灭菌的双蒸水中,C20°C备用。
(3)TE缓冲液(pH8.0):高压灭菌,室温贮存。
(4)酚?氯仿?异戊醇(25:24:1)、(5)异丙醇、冷无水乙醇、70%乙醇、灭菌水。
三、操作步骤1.取新鲜或冰冻动物组织块0.1g(0.5cm3),尽量剪碎。
置于玻璃匀浆器中,加入1ml的细胞裂解缓冲液匀浆至不见组织块,转入1.5ml离心管中,加入蛋白酶K(500ug/ml)20pl,混匀。
在65C恒温水浴锅中水浴30min,也可转入37C水浴12〜24h,间歇振荡离心管数次。
于台式离心机以12000rpm离心5min,取上清液入另一离心管中。
2•加2倍体积异丙醇,倒转混匀后,可以看见丝状物,用100ul吸头挑出,凉干,用200ulTE 重新溶解。
实验7基因组DNA的提取(综合性设计实验)

展望
未来,基因组DNA提取技术将更加广泛应 用于生命科学、医学、农业等领域的研究和 实践中,为人类认识生命本质、解决重大疾 病和促进农业发展等方面发挥重要作用。同 时,随着技术的进步和应用领域的拓展,基
因组DNA提取技术也将面临更多的挑战和 机遇。THANK YOU提取效率低详细描述
在某些情况下,由于实验条件 或操作不当,可能导致DNA的 提取效率较低。这可能表现为 提取时间较长,获得的DNA量 较少,甚至出现DNA降解的情 况。这可能是因为某些试剂使 用不当或实验操作失误所导致 。
DNA纯度与质量的评估
总结词:纯度高 总结词:纯度低
详细描述:通过电泳和紫外光谱分析等方法,可以 评估所提取DNA的纯度和质量。纯度高的DNA表现 为电泳时条带单一、无杂质,紫外光谱分析中 A260/A280比值接近1.8,说明DNA无蛋白质和 RNA污染。
酚-氯仿法
利用酚和氯仿的混合液反复抽提细胞破 碎后的上清液,使蛋白质变性并去除, 留下基因组DNA。
VS
试剂盒法
利用特定的试剂盒,通过细胞裂解、洗涤 、纯化等步骤,高效地提取基因组DNA 。
实验中使用的试剂与设备
试剂
细胞培养基、蛋白酶K、酚-氯仿混合液、乙醇、洗涤缓冲液等。
设备
离心机、PCR仪、电泳仪、移液器等。
03
实验步骤
样品准备与处理
01
样品来源
选择合适的生物样品,如人类、 动物或植物组织,确保样品新鲜 且无污染。
样品处理
02
03
清洗与去杂质
将样品进行匀浆或研磨,以充分 破碎细胞结构,释放出基因组 DNA。
去除样品中的蛋白质、脂肪和糖 类等杂质,以避免干扰后续的 DNA提取。
【2024版】[课件]实验七-植物DNA的提取与纯度鉴定PPT
![【2024版】[课件]实验七-植物DNA的提取与纯度鉴定PPT](https://img.taocdn.com/s3/m/ec44a4e28662caaedd3383c4bb4cf7ec4bfeb660.png)
提醒 不同种类或同一种类的不同组织因其细
胞结构及所含的成分不同,分离方法也有差 异。在提取某种特殊组织的DNA时必须参照 文献和经验建立相应的提取方法,以获得可 用的DNA大分子,尤其是组织中的多糖和酚 类物质对随后的酶切、PCR反应等有较强的 抑制作用,因此用富含这类物质的材料提取 基因组DNA时,应考虑除去多糖和酚类物质。
CTAB法实验原理
• 离子型表面活性剂如十六烷基三甲基溴化铵 (hexadyltrimethyl ammomum bromide,简称为 CTAB)、十二烷基硫酸钠(sodium dodecyl sulfate, 简称SDS)等可以有效裂解植物细胞壁,且与DNA 形成可溶于高盐溶液的复合物,当降低盐浓度时 DNA又可沉淀析出,从而与蛋白质及多糖等分离。
实验步骤(2)
• 3、 最后一次加液氮磨样后,立即加入预热的CTAB抽提 液,每克叶片加入8 mL CTAB抽提液,再加入160 L 2- 巯基乙醇(2-Me)(终浓度2%(v/v))。继续研磨待 CTAB抽提液溶化后,将研磨液转入50 mL离心管;
• 4、 65℃水浴锅温浴0.5-1小时,每10-20分钟摇动一次离心 管;同时65℃预热CTAB/NaCl; 注意:离心管盖子应轻轻搭在管口,千万不能盖紧, 以防加热使盖子冲出,最好离心管壁和盖子同时做好标记。
实验试剂及其配置
4 CTAB/NaCl (10% CTAB, 0.7 M NaCl) (要求配50mL)
•
CTAB
•
NaCl
20 g 8.2 g
• 加入160 mL ddH2O,加热至65℃溶解,补dd H2O定容至200 mL,高压灭菌。
• 注意:此溶液很粘稠,使用时需加热至65℃。
DNA提取教学课件ppt

提取病变组织的DNA可以进行疾病诊断和治疗 ,如癌症、遗传性疾病等的诊断和治疗方案的 制定。
分子生物学研究
DNA提取是分子生物学研究的基础,通过提取 DNA可以开展基因克隆、基因测序、分子标记 等研究工作。
dna提取的基本原理
细胞裂解
通过物理、化学或酶学方法将 细胞裂解,使细胞膜和细胞壁
提取DNA可以用于基因克隆、基因测序、分子标记等研究工
作,有助于深入探究生物学的奥秘。
亲子鉴定、犯罪鉴定
03
通过提取DNA可以进行亲子鉴定和犯罪鉴定,为司法鉴定提
供重要依据。
dna提取的发展历程
19世纪末期
DNA的发现和初步研究阶段,人们开始认识到DNA在遗传和细胞分裂中的重要性。
20世纪50年代至80年代
DNA提取是PCR技术的前提和基础,PCR技术需要以提取得到的DNA为模板 ,通过特定的引物进行扩增。
DNA提取与基因测序技术的关系
DNA提取是基因测序技术的重要步骤,只有经过有效的DNA提取,才能保证 测序结果的准确性。
dna提取技术的未来发展趋势
自动化和高通量
随着生物技术的发展,未来DNA提取技术将朝着自动化和高通量的方向发展,提 高提取效率和质量的同时,降低实验操作成本。
破裂,释放出其中的DNA。
沉淀与纯化
通过加入沉淀剂和纯化剂将DNA 从裂解液中沉淀出来,去除其中 的蛋白质、脂肪、糖类等杂质。
干燥和保存
将纯化后的DNA干燥并保存,以 便后续的分析和应用。
dna提取的应用
疾病诊断和治疗
01
通过提取病变组织的DNA,可以用于疾病诊断和治疗方案的
制定。
分子生物学研究
02
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
? 离心分离两相时,应保证一定的转速和时间
? 针对不同材料的特点,在提取过程中辅以相 应的去杂质的方法
四、注意事项 ——核酸沉淀、溶解
? 当沉淀时间有限时,用预冷的乙醇或异丙醇沉淀, 沉淀会更充分
? 沉淀时加入1/10体积的NaAc(pH5.2,3M),有利 于充分沉淀
? 材料应适量,过多会影响裂解,导致DNA量 少,纯度低
? 针对不同材料,选择适当的裂解预处理方式:
? 植物材料--液氮研磨 ? 动物组织--匀浆或液氮研磨 ? 组培细胞--蛋白酶K ? 细菌--溶菌酶破壁 ? 酵母--破壁酶或玻璃珠
? 高温温浴时,定时轻柔振荡
四、注意事项 ——核酸分离、纯化
? 采用吸附材料吸附的方式分离DNA时,应提 供相应的缓冲体系
原 因
1. DNA中含有蛋白、 多糖、多酚类杂质
2. DNA在溶解前,有
酒精残留,酒精抑 对
制后续酶解反应
策
3. DNA中残留有金属 离子
1. 重新纯化DNA,去 除蛋白、多糖、多酚 等杂质
2. 重新沉淀DNA,让 酒精充分挥发
3. 增加70%乙醇洗涤 的次数(2-3次)
五、DNA提取常见问题
?问题二: DNA 降解
以上处理时均要同时加入核酸酶抑制剂
? 核酸提取的一般过程 2)破碎抽提核酸除去杂质
1.首先使脱氧核糖核蛋白、核糖体、病毒的核蛋白与 其它成分分离 2.使核酸与蛋白质分离 3.除去脂类 4.多糖的除去
? 核酸提取的一般过程
3)核酸的纯化 根据所需核酸的性质和特点除去其它核酸污
染,并除去提取过程中的系列试剂 (盐、有机溶剂 等)杂质,最后得到均一的核酸样品。
? 除上述DNA,RNA外,还有非细胞形式存在的病毒和 噬菌体,其或只含DNA,或只含有RNA。
一、实验原理
2、核酸制备的一般原则
? 分离纯化核酸总的原则: ①应保证核酸一级结构的完整性; ②排除其它分子的污染。
? 核酸纯化应达到的要求: ①核酸样品中不应存在对酶有抑制作用的有机溶剂和过高 浓度的金属离子; ②其它生物大分子的污染应降低到最低程度; ③排除其它核酸分子的污染。
对于RNA,因分子较小,不易被机械张力拉断, 但抑制RNase活力较难,故在RNA提取中设法抑制 RNase更重要。
? 核酸酶的抑制和抑制剂
DNase抑制
①加入少量金属离子螯合剂,如0.01 mol/L EDTA 或柠檬酸钠,DNase基本可以全部失活。 ②去垢剂、蛋白变性剂及DNase抑制剂也可使 DNase失活。
如:苯酚、氯仿、盐酸胍、DEPC
? 核酸制备中常用的酶
DNase RNase 蛋白酶 K 溶菌酶
? 核酸提取的一般过程 1)破碎细胞(防止核酸酶的作用)
微生物:溶菌酶、SDS裂解。 高等植物:捣碎器破碎、液氮研磨。
酶法:蛋白酶,如胰蛋白酶, 冰冻法:反复冻融或液氮冻后组织捣碎。 动物:液氮处理后用匀浆器破碎。 细胞器DNA:首先纯化细胞器。
细胞基因组DNA的提取
银巍 中山医学院生化教研室
实验一 细胞基因组 DNA的提取
一、实验原理
1、核酸的分类
? DNA 主要存在于细胞核的染色体中。核外也有少量DNA, 如线粒体DNA(mtDNA),叶绿体DNA (cpDNA),质粒DNA。
? RNA 存在于细胞质中,如mRNA, rRNA, tRNA等。
如:SDS、脱氧胆酸钠、4-氨基水杨酸钠、萘-1.5-二磺酸钠、 三异丙基萘磺酸钠
? 核酸制备中常用的蛋白质变性剂
蛋白质变性剂的作用: 1.使蛋白质变性、沉淀,从核酸提取液中分离除去,以防造
成蛋白污染。 2.使蛋白质变性,故可使核糖体解聚释放出核酸。 3.某些蛋白质变性剂也有抑制RNase活性和破裂细胞的作用。
? 沉淀后应用70%的乙醇洗涤,以除去盐离子等 ? 晾干DNA,让乙醇充分挥发(不要过分干燥) ? 若长期储存建议使用TE缓冲液溶解
? TE中的EDTA能螯和Mg2+或Mn2+离子,抑制DNase ? pH值为8.0,可防止DNA发生酸解
五、DNA提取常见问题
?问题一:DNA样品不纯,抑制后续酶解和 Pse抑制 ①操作要带手套。 ②所有器皿要严格消毒, ③试剂处理 ④低温操作
⑤在分离过程中要加入一定的 RNase抑制剂。
? 核酸制备中常用的去垢剂
核酸本身带负电荷,结合带正电荷的蛋白质。用 于核酸提取的去垢剂,一般都是阴离子去垢剂, 去垢剂的作用: 1.溶解膜蛋白及脂肪,使细胞膜破裂; 2.溶解核糖体上面的蛋白质,使其解聚,将核酸 释放出来; 3.对 RNase 、DNase 有一定的抑制作用。
4)核酸样品的保存 核酸保存的主要条件是 温度和介质
温度: 4℃(5℃)最佳和最简单 -70℃是长期保存的良好温度,为一次性保存 -20℃保存
保存介质 : TE缓冲溶液 (最常用 ) 10mmol/L Tris-Cl pH8.0 1mmol/L EDTA pH8.0
实验目的
材料与试剂
实验操作与注意事项
纯化
IV.沉淀或吸附核酸,并去除杂质
V.核酸溶解在适量缓冲液或水中
一、实验原理
4、核酸制备的一般方法和原理
? 核酸酶的抑制和抑制剂 降低温度,改变pH及盐的浓度,都利于对核酸酶
活性的抑制,但均不如利用核酸酶抑制剂更有利,当 然,几个条件并用更好。
对于DNA,抑制DNase活力很容易,但防止机械 张力拉断则更重要。
一、实验原理
3、核酸制备的一般原则
? 核酸制备时应注意的事项: ①尽量简化操作步骤,缩短提取过程。 ②减少化学因素对核酸的降解。 ③减少物理因素对核酸的降解:机械剪切力和高温 ④防止核酸的生物降解。
? 核酸制备的步骤:
I.材料准备
破碎细胞
II.破碎细胞或包膜-内容物释放
提取
III.核酸分离、纯化
,1000rpm,5min离心
四、注意事项 ——材料准备
? 最好使用新鲜材料,低温保 存的样品材料不要反复冻融
? 提取血液基因组DNA时,要 选择有核细胞(白细胞)
? 组培细胞培养时间不能过长, 否则会造成DNA降解
? 含病毒的液体材料DNA含量 较少,提取前先富集
四、注意事项 ——细胞裂解
