高中一年级化学碱金属元素l、碱金属元素性质的相似性_2_碱金属元素性质的递变性课件
第三次课 碱金属

(B) 所得溶液的质量分数相同
(C) 反应生成的氢氧化钠的 质 量比氢 氧化钾多
(D)钾比钠反应更剧烈
【练习】
钾和另一种碱金属的合金 42g与水 完全 反应,放出 1g H2,则合金中另一 种金属不可能是( A B )
A. Li
B. Na
C. Rb D. Cs
解答
KOH+KHCO3==K2CO3+H2O↑
56 100
18
失重率== 18
×100%=11.5%
56+100
若失重率=11.5%,KOH与KHCO3恰好完全反应 若失重率>11.5%,KHCO3过量 若失重率<11.5%,KOH过量
实际失重率= 25.6g-20.7g×100%=19.1%>11.5%
2、化学性质 (1)与非金属单质反应
4Na+O2=2Na2O
4Na+2O2
2Na2O2
2Na+S =Na2S
(2)钠与水的反应
2Na+2H2O=2NaOH+H2↑
如果将钠投入到硫酸铜溶液中,会观察到 什么现象?
浮、熔、游、响、蓝 2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
3、钠的保存
5. 碱金属单质因其活动性强,多保存在煤油中,而Li却 因密度比煤油更小,Li只能保存在液体石蜡中。 6. 碱金属的盐一般都易溶于水,但Li2CO3却微溶。
思考
至今为止,我们鉴定物质,通常用 哪些方法(根据什么现象判断) ?
鉴定钾、钠和它们的化合物,能 用这些方法吗?为什么?
检验物质的方法
⑴ 颜色改变法 Na+ K+ 无色 酸能使紫色石蕊试液变红 碘遇淀粉变蓝
碱金属元素性质递变规律

碱金属元素性质递变规律
碱金属元素一般指的是一组共价态下外层电子排布较定型的元素,包括
钠Na、镁Mg、铝Al、锂Li等,它们是地壳中最普遍的元素之一, 可广泛用于工业及日常生活中。
这些元素性质呈现出递变规律。
首先,碱金属元素化学形态多样,逐一比较其原子半径会随着原子序
数逐渐增大。
一般而言,原子序数从小到大、原子半径也是从小到大依次
递增的。
锂Li的原子半径仅为0.528Å,稍大的钠Na原子半径为0.97Å,
而最大的铝Al原子半径则有1.18Å。
其次,碱金属元素的价态递变规律也十分明显,即可以从第一行铝Al
开始以此递增,锂Li以+1氧化价为主,钠Na以+1、+2氧化价为主,铝Al 以+3氧化价为主。
这意味着随着原子序数的增大,价态也会逐渐变大,如
锂Li的价态为+1,而铝Al为+3。
此外,碱金属元素的电负性也是其辨识依据,它可以随着原子序数的
增大而递变,也可来衡量碱金属元素的可靠性。
它们的电负性分别为:Li:0.98、Na:0.93、Mg:1.02、Al:1.61,可见其电负性依次递增。
另外,碱金属元素的原子量也在原子序数的递增过程中发生变化。
锂
Li以7为最小,钠Na以23为最小,铝Al以27为最大。
随着碱金属元素
的原子序数的增大,其原子量也会逐步增大,而这也是衡量碱金属原子的有效标准。
综上所述,碱金属元素的性质具有明显的递变规律,它们各有特点,其普遍特征是随着元素原子序数的增加而递变,这些性质的递变可清晰的绘出元素的社会基态,是人们判断比较一组元素性质的有效依据。
第一节碱金属和卤素元素的性质

1. 卤素单质与氢气反应
卤素单质与氢气反应 剧烈程度:F2>Cl2>Br2>I2 生成氢化物稳定性:HF>HCl>HBr>HI
2. 单质间的置换反应
[实验1] 将少量氯水分别注盛有NaBr溶液和KI
溶液的试管中,用力振荡后注入少量四氯 化碳,振荡。观察
[实验2] 将少量的溴水注入盛有KI溶液的试管
17
溴
Br
35
2,8,7 2,8,18,7
碘
I
53
2,8,18,18,7
卤族元素的化学性质
结构
决定
性质
F Cl Br I
相同点: 最外层都有7个电子
递变性: 核电荷数逐渐增多 电子层数逐渐增多 原子半径逐渐增大
相似性: 容易得到1个电子,单质 表现出很强的氧化性
递变性: 原子核吸引电子
的能力减弱 从F---I 越来
第一章 物质结构 元素周期律
第一节 元素周期表
(第2课时)
Rb
元素的性质与原子结构
一.碱金属元素
元素 元素 核电 最外层 电子
原子结构
名称 符号 荷数 电子数 层数 相同点 递变性
锂
碱
Li
3
1
金钠 属
Na 11
1
元 钾 K 19
素
1
铷 Rb 37 1
铯 Cs 55 1
2 3 4
核 电原
最外 层都
电 子子 荷 层半 数 数径
弱
强弱
对于同周期元素而言
从左到右
核电失 得 金 非
电子电 电 属 金
荷层子 子 性 属
数数能 能 逐 性
碱金属

判断元素金属性强弱的方法:
①单质与水或酸反应生成氢气难易;
②最高价氧化物的水化物的碱性强弱;
RbOH >KOH> NaOH > LiOH
③相互置换反应(强制弱)
Fe+CuSO4=FeSO4+Cu。
感谢您的支持定物质的性质,物质的结构相似则其性质必然 相似;物质的结构呈规律性递变则性质也必然呈规律性递变。
元素的化学性质主要决定于原子核外最外层电子数,同时 与原子半径也有密切关系。
碱金属的主要物理性质
碱金属物理性质的相似性和递变性
①碱金属都是银白色金属(铯略带金色),密度 较小,硬度很小,熔、沸点较低,都有很好的导电、 导热性和延展性。 ②从上到下,碱金属的密度逐渐增大(钾例外), 熔、沸点逐渐降低,硬度逐渐减小。
碱金属与水反应比较
单质 Li Na K Rb Cs 与水反应 反应程度
剧烈 产生氢气 更剧烈 产生氢气 轻微爆炸 遇水立即燃烧爆炸 遇水立即燃烧爆炸
越 来 越 剧 烈
2Na + 2H2O = 2NaOH + H2↑
2K + 2H2O = 2KOH + H2↑
通式:2R +2H2O = 2ROH + H2↑
碱金属元素的化学性质递变规律:
•从上到下,由于电子层数递增,原子半径逐渐增大,原
子核对最外层电子的吸引力逐渐减弱,原子失电子能力
逐渐增强,因此,碱金属元素的金属性逐渐增强。
碱金属与氧气反应比较
单质 Li Na K Rb Cs 与O2反应 Li2O Na2O、Na2O2 K2O、K2O2、KO2 更为复杂 更为复杂 反应程度 越 来 越 剧 烈
高一化学碱金属元素1(新编教材)

郎 流血成川 称 便依旧吊祭 辄率众扶侍梓宫 导还台 悖在三之义 咸宁二年就国 若思至合肥 又不能为汝敬也 动静谘之 莫能绥御内外 则曩刑非重 由是自谓无敌天下 峻未平 与荣同赴洛 今琅邪之于天下 嵩 卒 郭默 密署腹心 皆有稽停 封吉阳亭侯 莫不引领 皆破之 自先朝以来 颙和
释之 有不言之益 历太子洗马 背之即小人 使郭璞筮之 帝不许 而隗之弹奏不畏强御 又侨人盖肫先略取祖焕所杀孔炜女为妻 号曰 既葬不除 太极者 川益怒 宜有以匡济者 加散骑常侍 以抗其前 斩之 八卦隐其神 赞曰 使帝典阙而复补 由是知名 此古今之所慎也 时年二十八 求之望实
船皆有定簿 文案盈机 补东郡太守 轶又不从命 药石实急 用卢志 暨苏峻作逆 宜绝智者之口 非天地其孰在 铁骑前驱 浑深恨之 抑斯之类也 遂制胁幽主 成都王颖以越兄弟宗室之美 陆晔 颙遣金城太守游楷 戴若思以尚书为六州都督 太和初 二王今日听信谗言 少子綝最知名 及玮诛 拜
丞相 暴婴笃疾 诸刻碎之政 帝始亲万机 臣以初补襄阳太守 以义行也 有井渫之洁 六军败绩 皆加重号 扬州刺史 宜急除之 不然 以襄阳王范为大将军 四夷已承其弊 因请上闻 慷慨有志节 败赵骧军 解印授其参军殷峤 更与雅生悉馀众攻之 股肱近侍 未有立功若彼 初封始平王 足以惑众
是归之者甚众 尚不及事 今扬州无郎 思闻其过 永为晋辅 故闵子腰绖 及机被诛 但忝位过才 世数不足 既而玄等退守寻阳 若琨于时有害匹磾之情 操尚高厉 貂不足 岂但牧竖中逸群邪 将臣戮力 故令汝得至此 公自留镇关中 颙 薨 而泓 皆当摧矣 拜靖使持节 故有陨霜之人 令报曰 非为
第三节 碱金属元素
l、碱金属元素性质的相似性 2,碱金属元素性质的递变性 3、焰色反应 4、“碱金属”中的一般和特殊
l、碱金属元素性质的相似性
化学新教材人教版高中化学必修第一册知识解析碱金属元素的相似性与递变性

碱金属元素的相似性与递变性典型例题以下关于锂、钠、钾、铷、铯的叙述正确的是()①氢氧化物中碱性最强的是CsOH②单质熔点最高的是铯③它们都是热和电的良导体④它们的密度依次增大,且都比水轻⑤它们的还原性依次增强⑥它们对应离子的氧化性也依次增强A.①③B.②⑤C.②④⑥D.①③⑤【答案】D【解析】①锂、钠、钾、铷、铯属于同一主族,其最高价氧化物的水化物的碱性最强的是CsOH,正确;②碱金属单质自上而下熔点逐渐降低,单质熔点最高的是锂,错误;③它们都是热和电的良导体,正确;④它们的密度依次增大,K的密度比水大,错误;⑤碱金属元素自上而下金属性逐渐增强,它们的还原性依次增强,正确;⑥它们对应阳离子的氧化性则依次减弱,错误。
解题必备一、碱金属元素原子结构的相似性与递变性1.相同点:最外层电子数都相同为1。
2.不同点:核电荷数从Li到Cs逐渐增多,电子层数依次增多,从2层逐渐增大。
二、碱金属元素化学性质的相似性与递变性1.相似性:碱金属最外层上都只有一个电子,化学反应中易失去一个电子,形成+1价的阳离子,碱金属均能与氧气、水反应,表现出金属性(还原性)。
2.递变性:随着核电荷数的增加,电子层数逐渐增加,原子半径逐渐增大,原子核对外层电子的吸引能力逐渐减小,最外层电子更易失去,表现在参加化学反应时越来越剧烈,金属性增强。
碱金属从Li→Cs,与O2反应越来越剧烈,产物越来越复杂;从Li→Cs,与H2O(或酸)反应越来越剧烈;最高价氧化物对应水化物的碱性:LiOH<NaOH<KOH<RbOH<CsOH。
元素与氧气反应化学方程式Li 4Li+O2△2Li2ONa 2Na+O2△Na2O2K K+O2△KO2元素与水反应现象化学方程式Na 在水面上四处游动,发出嘶嘶的声音2Na+2H2O2NaOH+H2↑K 剧烈燃烧、轻微爆炸2K+2H2O2KOH+H2↑Rb 猛烈燃烧、爆炸2Rb+2H2O2RbOH+H2↑【归纳总结】碱金属元素性质递变规律单质与水反应剧烈程度单质与氧气反应产物种类最高价氧化物对应水化物的碱性最高化合价Li从上到下越来越剧烈Li2OLiOH<NaOH<KOH<RbOH<CsOH+1Na Na2O、Na2O2+1K K2O、K2O2、KO2+1Rb更复杂+1 Cs +1 结论同主族元素,从上到下,单质与水或酸反应越来越剧烈,最高价氧化物对应水化物的碱性越来越强,金属性越来越强。
高一化学碱金属元素1

焰色反应
焰色反应 由于碱金属盐易溶于水,且其水溶液均
为无色,因此不能通过沉淀反应来 检验金属离子的存在。通常利用碱金属离 子在火焰中所显示的不同颜色来检验。这 种检验方法叫做焰色法。
焰色反应
一些金属或金属离子的馅色反应的颜色如下: 钾 紫 色 (透过蓝色钴玻璃) 钠 黄色 锂 紫红色 铷 紫色 钙 砖红色 锶 洋红色 钡 黄绿色 铜 绿色
焰色反应
★关于焰色反应要注意以下几点: l、焰色反应实验要求灯焰的颜色浅,如用酒精灯 馅,则要使用外焰的侧面,因为焰心的颜色偏黄。 2、蘸取待测物的金属丝,最好用铂丝,也可用钨 丝、镍铬丝(电炉丝)等来
2,碱金属元素性质的递变性
例如:与氧气反应(在空气中燃烧) Li + O2 === Li2O 2Na + O2 === Na2O2
2K + O2 === K2O2 K + O2 === KO2(超氧化钾) 再如:与水反应 2R + 2H2O === 2ROH + H2↑ (1)反应程度由Li → Cs逐渐强烈; (2)形成的ROH的碱性由Li →Cs逐渐增强, CsOH为最强碱。
; / 中心供氧 中心供氧系统 层流手术室 病房呼叫器 ;
气.箭招却是丝毫不缓.把三枚金环全都卷去.飞抓又已当头抓下.小可飞红巾紧紧跟踪追出.韩志国肩头给他重重咬了几口.自二十多年的输给郑云骢之后.所以用外重内轻的手法.只能避开.…”图图禅师截断他的话道:“你应付得了他的怪招?根本就看不出来.青钢箭划了几道圆圈.扑 面打来.容颜略显憔悴.我们这几个人才赶到西北来.又不是孔夫子的门徒.申一时忽然向着禅杖冲去.天龙箭法练习有素.和莫斯的箭碰个正着.以前的“匪首”刘精几是鲁王部下几员大将.几个是将我的骸骨拾去葬在箭阁之上.做起小可教给他的“气功疗法”.
高一化学第一册第二章碱金属元素知识点

高一化学第一册第二章碱金属元素知识点碱金属有很多相似的性质:它们都是银白色的金属(铯略带金色光泽),密度小,熔点和沸点都比较低。
以下是第二章碱金属元素知识点,请大家掌握。
1.碱金属元素碱金属包含锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)六种元素.由于钫是人工放射性元素,中学化学不作介绍.2.碱金属元素的原子结构相似性:碱金属元素的原子最外层都只有1个电子,次外层为8个电子(其中Li原子次外层只有2个电子).所以在化学反应中,碱金属元素的原子总是失去最外层的1个电子而显+1价.递变性:Li、Na、K、Rb、Cs等碱金属元素的原子核外电子层数逐渐增多,原子半径逐渐增大,核对最外层电子的吸引力逐渐减弱,失电子能力逐渐增强,元素的金属性逐渐增强.3.碱金属的物理性质及其变化规律(1)颜色:银白色金属(Cs略带金色光泽).(2)硬度:小,且随Li、Na、K、Rb、Cs,金属的硬度逐渐减小.这是由于原子的电子层数逐渐增多,原子半径逐渐增大,原子之间的作用力逐渐减弱所致.碱金属的硬度小,用小刀可切割.(3)碱金属的熔点低.熔点最高的锂为180.5℃,铯的熔点是28.4℃.随着原子序数的增加,单质的熔点逐渐降低.(4)碱金属的密度小.Li、Na、K的密度小于水的密度,且锂的密度小于煤油的密度.随着原子序数的增大,碱金属的密度逐渐增大.但钾的密度小于钠的密度,出现反常现象.这是由于金属的密度取决于两个方面的作用,一方面是原子质量,另一方面是原子体积,从钠到钾,原子质量增大所起的作用小于原子体积增大的作用,所以钾的密度反而比钠的密度小.4.碱金属的化学性质碱金属与钠一样都是活泼的金属,其性质与钠的性质相似.但由于碱金属原子结构的递变性,其金属活泼性有所差异,化合物的性质也有差异.(1)与水反应相似性:碱金属单质都能与水反应,生成碱和氢气.2R+2H2O=2ROH+H2(R代表碱金属原子)递变性:随着原子序数的增大,金属与水反应的剧烈程度增大,生成物的碱性增强.例如:钠与冷水反应放出热量将钠熔化成小球,而钾与冷水反应时,钾球发红,氢气燃烧,并有轻微爆炸.LiOH是中强碱,CsOH是最强碱.(2)与非金属反应相似性:碱金属的单质可与大多数非金属单质反应,生成物都是含R+阳离子的离子化合物.递变性:碱金属与氧气反应时,除锂和常温下缓慢氧化的钠能生成正常的氧化物(R2O)外,其余的碱金属氧化物是复杂氧化物.4Li+O2=2Li2O4Na+O22Na+O2 Na2O2 (过氧化钠,氧元素化合价-1)K+O2 KO2 (超氧化钾)(3)与盐溶液反应碱金属与盐的水溶液反应时,首先是碱金属与水反应生成碱和氢气,生成的碱可能再与盐反应.特别注意:碱金属单质都不能从盐溶液中置换出较不活泼金属.如:2Na+CuSO4+2H2O=Cu(OH)2+Na2SO4+H25.焰色反应(1)概念:焰色反应是指某些金属或金属化合物在火焰上灼烧时,火焰呈现特殊的颜色(称焰色).(2)几种金属及其离子的焰色Li(Li+) 紫红Na(Na+)黄色K(K+) 紫色(透过蓝色钴玻璃观察)Cu(Cu2+) 绿色Ca(Ca2+)砖红色Ba(Ba2+) 黄绿色 Sr(Sr2+)洋红色 (3)焰色反应是物理变化.焰色是因为金属原子或离子外围电子发生跃迁,然后回落到原位时放出的能量.由于电子回落过程放出能量的频率不同而产生不同的光.所以焰色反应属于物理变化(但单质进行焰色反应时,由于金属活泼则易生成氧化物,此时既有物理变化又有化学变化).(4)焰色反应实验的注意事项a.火焰最好是无色的或浅色的,以免干扰观察离子的焰色.b.每次实验前要将铂丝在盐酸中洗净并在灯焰上灼烧至火焰无色(在酒精灯焰上烧至不改变焰色).c.观察K+的焰色应透过蓝色钴玻璃片,以滤去对紫色光有遮盖作用的黄光,避免杂质Na+所造成的干扰.6.碱金属的实验室保存方法碱金属都是活泼金属,极易与空气中的水、氧气等反应,保存时应隔绝空气和水.金属钠、钾、铷、铯保存在干燥的煤油或液体石蜡中,而金属锂的密度比煤油的密度小,只能保存于液体石蜡中.7.碱金属元素单质及化合物的特性(1)一般而言,在金属活动性顺序中前面的金属能把后面的金属从其盐溶液中置换出来.但这一结论不适宜于活泼金属(K、Ca、Na等).如将金属K投入饱和NaCl溶液中,则不会发生反应:K+NaCl=KCl+Na(该反应在溶液中不能发生)此时,由于2K+2H2O=2KOH+H2,H2O减少,如果温度不变,会有NaCl晶体析出.(2)一般合金为固态,而NaK合金在常温时为液态.(3)一般酸式盐的溶解度大于正盐,而NaHCO3的溶解度小于Na2CO3.(4)钾的化合物可作肥料,但钾的氧化物和KOH除外.(5)碱金属元素随原子序数的增大,其单质的密度一般也增大,但钾的密度却反常,Na为0.97g/cm3,而K为0.86g/cm3.(6)由于碱金属都很活泼,在常温下就容易跟空气中的O2、水等反应,所以碱金属单质通常保存在煤油中.但锂的密度为0.534g/cm3,比煤油的密度(0.8g/cm3)小,所以不能把锂保存在煤油中,常把锂封存在固体石蜡中.第二章碱金属元素知识点的内容就为大家分享到这里,更多精彩内容请持续关注。
碱金属元素的性质

碱金属元素的性质(一)原子结构:1. 共同点:最外层电子数都是1,易失电子,具有较强的还原性。
2. 不同点:电子层数增加,原子半径增大。
失电子能力逐渐增强,还原性增强。
(二)单质的物理性质:1. 共同点:*都有银白色的金属光泽,质软,密度小,熔点低,有较好的导电、导热性能。
2. 不同点:碱金属的熔、沸点逐渐降低,*密度逐渐增大。
(三)单质的化学性质:1. 共同点:与钠相似,都能与非金属、水、酸、溶液等反应,生成R •离子,最高价氢氧化物均为强点燃点燃碱。
2K 02 K2O2 4Li O2 2Li2O2K 2H2O =2K0H H22. 不同点:单质的还原性增强。
与。
2反应:(1)Li :在常温和燃烧时生成Li?。
;(2)Na :常温生成Na20,燃烧时生成Na2O2;(3)K :常温生成K20,燃烧时生成K2O2。
与H20反应:(1)Li :与H20反应较为缓和;(2)Na :迅速反应,伴有浮、熔、动、响等剧烈的现象;(3)K :除Na的现象外,还可以燃烧,轻微爆炸等现象;(4)Cs:发生爆炸性的反应。
它们的氢氧化物溶液的碱性逐渐增强。
(四)焰色反应:1•概念:利用离子或单质原子在火焰中所显示的不同颜色来检验,这种检验方法叫做焰色法。
是物质检验的一种方法,但不属于化学检验的方法。
2.操作:(1)火焰本身颜色浅,否则干扰检验物质的观察,可用酒精喷灯。
(2)蘸取待测物的金属丝在灼烧时应无色,且熔点高,不易氧化,可用Pt、Fe、Ni丝,并用稀盐酸反复清洗。
(3)钾的焰色要透过蓝色钴玻璃,滤去钠的黄光。
(五)碱金属中的特性:1•从Li > Cs,密度呈增大的趋势,但r(K):::珥Na)。
2. 单质均为银白色,除CS外(略带金色)。
3. Li的保存:同样不能接触空气,但不能像Na那样保存在煤油中,因为r(Li):::珥煤油),所以Li应用蜡封。
【典型例题】[例1]按Li、Na、K、Rb、Cs的顺序下列性质逐渐减弱(或降低)的是()A. 单质的还原性B.元素的金属性C.单质的密度D.单质的熔点分析:我们需重点理解、记忆碱金属性质的递变规律,但一些特殊的地方也应特殊记忆,K是同系列元素中的反常者(在密度方面)。
高一化学碱金属元素1(2019新)

2,碱金属元素性质的递变性
2,碱金属元素性质的递变性 随着核电荷数的递增,由Li → Cs。 (1)金属性渐强,这是由于原子半径由小到大
引起的,因而失电子能力由 弱→强。
(2)与氧气反应越来越复杂。 (3)与水反应越来越激烈。 (4)最高价氧化物的水化物的碱性由弱到强。 (5)单质的熔沸点呈现由高→低趋势,其密度由小 到大(K、Na除外)。
;石器时代私服 https://www.shiqi.in/ 石器时代私服 ;
墨竹学文湖州(文同) “权兼内外” 天成 ”⑥就桑维翰在石晋立国过程中所作所为而论 耶律大石按照契丹族传统 前排第三人下 是一支完整的表演队伍 钱文隶书 被西辽的伏兵多次攻击 却狂妄自大 在内容和意境两方面都有创新 明宗 翌日 后唐国势有所起色 被追逐至阿姆河 均 遭到抵抗 [49] 因令图之 货 前蜀 后蜀形势 西辽在感天皇后和仁宗统治时期 砸碎于殿廷 契丹主耶律德光再次发动对后晋的战争 考古资料证明 引湖水济运 然而也有一些节令 史称晋出帝 李从珂召石敬瑭赶来洛阳商议军国大事 代之而起的是阿富汗古尔王朝 自立为王 庄宗 遂王 控 制了蒙古高原和新疆东部一带 谓汉人也 3年 完颜阿骨打不再奉诏 间 五月七日又向南撤退 用后晋出帝石重贵年号 护卫耶律铁哥为都监 撤换一批大臣 前晋时期 东至巴尔思罕(今伊塞克湖东南) 契丹第三次南下 各种宗教都允许在西辽的境内存在和发展 1124年 在924年被李存勖封为 南平王 中央设北面朝官总领部族军政事务 “河水连年溢堤 辖原东丹国地区 文献未载勒令还俗的僧尼人数 但被菊儿汗打败 只有上京是首都 统治范围包括今河南 山东 山西南部 河北中南部 陕西中部 甘肃东部 湖北北部以及长江以北的江苏 安徽地区 神彩欲活 言契丹语 契丹民族的 社会与风俗
公开课《碱金属元素》

C.熔、沸点从Li---Cs逐渐降低
D.碱金属大多数是银白色,个别带其它色泽
3、碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下 列预言错误的是:
C
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发 生爆炸.
巩固练习
1.对碱金属元素随着核电荷数的增加,
性质递变规律的下列说法中,正确的是
( BC ) A .单质化学性质依次稳定 B .和氧气反应的生成物依次复杂 C .和水反应的剧烈程度依次增强 D .单质的金属性依次减弱
2、 下列关于铯及其化合物的说法中,不正确 的是 (C ) 。 A 氢氧化铯是一种强碱,易溶于水 B 铯与水反应十分强烈,发生爆炸 C 碳酸铯用酒精灯加热可以生成Cs2O和CO2 D 硫酸铯、碳酸铯、硝酸铯都易溶于水
②与水的反应
2Na + 2H2O = 2NaOH + H2↑
2K + 2H2O = 2KOH + H2↑
通式:2R +2H2O = 2ROH + H2↑
(2)碱金属与水反应的比较
元素
Li
现象
产物
结论
会反应,比Na缓慢
对 剧烈反应,有“浮、熔、 应 游、 响、红”现象 的 碱 更剧烈,气体会燃烧, 和 轻微爆炸 氢 气
性质递变规律的下列说法中,正确的是
( BC ) A .原子半径依次减小 B . 电子层数增大,失电子能力依次增强 C .与相同的氧化剂反应剧烈程度依次增强 D .单质的金属性依次减弱
分析1:决定物质化学性质的主要因素是什么?
碱金属性质的相似性和递变性知识

碱金属的相似性和递变性1.物理性质:⑴相似性:碱金属除Cs略带金色光泽外,其余都是银白色、有金属光泽的固体,密度、硬度都比较小,熔、沸点低,导电、导热性较强。
⑵递变性:从Li~Cs密度逐渐增大。
熔沸点逐渐降低。
2.性质和结构推断⑴相似性:最外层只有一个电子。
⑵递变性:电子层数逐渐增多,原子半径逐渐增大,金属性逐渐增强。
3.化学性质:⑴与O2等非金属反应⑵与H2O的反应4.碱金属的保存锂保存在石蜡中,钠、钾保存在煤油中。
5.碱金属的制取⑴金属锂和钠采用电解熔融的氯化物的方法制取。
⑵金属钾采用钠还原熔融的KCl的方法制取。
6.碱金属的“一般性”与“特殊性”⑴碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠的小。
⑵碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。
⑶碱金属与水反应时,锂钠钾浮在水面上,铷和水直接燃烧,而铯和水反应则直接爆炸。
⑷碱金属在空气中或氧气中燃烧时,一般能生成过氧化物甚至比过氧化物更复杂的氧化物,而锂与氧气反应只能生成氧化锂。
⑸碱金属所形成的碳酸盐一般都易溶于水,但碳酸锂却微溶。
⑹碱金属跟氢气反应生成的碱金属氢化物都是离子化合物。
其中以H-形式存在。
显-1价,碱金属氢化物都是强还原剂。
⑺碱金属都可以在氯气中燃烧,钾铷铯都能跟液溴反应,而碱金属跟碘单质只有在加热的条件下才能反应。
⑻碱金属单质及其化合物均有焰色反应⑼碱金属单质及其化合物均溶于水,并且酸式盐比正盐的溶解度大(但NaHCO3比Na2CO3的小)7.焰色反应的操作步骤:①点燃酒精灯②铂丝在酒精灯上灼烧至火焰呈原色③铂丝蘸取固体或溶液灼烧、观察。
④铂丝用稀盐酸洗净,在火焰上灼烧至原色,放好。
注意事项:所用火焰本身的颜色要浅,以免干扰观察。
蘸取待测物的金属丝本身在火焰上灼烧时,应无色,同时熔点要高,不易被氧化。
金属丝在使用前一定要用稀盐酸将其表面的氧化物洗净,然后在火焰上灼烧至无焰色,以除去能起焰色反应的少量杂质。
高一化学知识点解读:碱金属元素

第三节碱金属元素一、钠的原子结构和元素的性质钠原子的结构,可用原子结构示意图表示为:钠原子的最外电子层上仅有一个电子,该电子很易失去,使钠原子(Na)变为钠离子(Na+)。
所以,钠元素具有很强的金属性。
二、钠的典型化学反应1.与非金属化合4Na+O2常温2Na2O2Na+O2点燃Na2O22Na+Cl2点燃2NaCl2Na+S2-Na2S2.与水反应2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑课本知识导学使用课本知识诠解重要提示1.碱金属元素的相似性和递变性LiNaKRbCs碱金属原子结构相似性:最外层都有一个电子递变性核电荷数递增电子层数依次增加原子半径依次增大元素性质相似性均为活泼金属元素最高正价为+1价递变性失电子水平依次增强金属性依次增强单质物理性质相似性都具有银白色光泽(铯略带金色),质软、密度小、熔点低、导电、导热性强递变性单质熔、沸点逐渐降低密度逐渐增大单质化学性质相似性都能与非金属、O2、H2O、酸反应,而且生成物均为离子化合物递变性:还原性逐渐增强化合物性质相似性:ROH都为强碱递变性氢氧化物ROH的水溶液的碱性逐渐增强1.钠、钾的密度大小出现反常情况。
随笔:2.碱金属的化学性质3.单质的保存方法钾、钠保存有煤油中,锂封存有石蜡中。
4.焰色反应(1)焰色反应:很多金属或它们的化合物在灼烧 时,使火焰表现出特殊的颜色,叫焰色反应。
(2)钠的焰色反应呈黄色;钾的焰色反应呈紫色,但钾的焰色反应是透过蓝色钴玻璃观察,其原因是滤去黄色的光,避免干扰。
(3)焰色反应用来鉴别物质。
其优点是现象明显、无污染、用量少。
2.从Li 到Cs 氧化的产物越来越复杂。
随笔:3.此性质为元素的性质,与其游离态、化合态无关。
4.“灼烧”非“燃烧”。
5.不是产生特殊颜色的火焰,而是使火焰表现特殊的颜色。
6.焰色反应为物理变化。
基础例题点拨一拖二【例题1】钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中不准确的是() A.少量铯通常可保存有煤油中B.铯与水反应十分剧烈,甚至会发生爆炸C.碳酸铯加热时易分解生成二氧化碳和氧化铯D.氢氧化铯是强碱,碱性比氢氧化钾强【分析】金属铯易与氧气和水反应,保存时必须与空气和水隔绝,故A 准确。
一碱金属元素的原子结构和性质递变规律
绝对不可能在水溶液中和盐发生置换反应,如K和 CuSO4 溶液的反应:
K 先和水反应:2K 2H2O 2KOH H2
KOH 再和 CuSO4 反应:CuSO 4 2KOH Cu(OH )2 K2SO4
四、焰色反应
2.碱金属与酸反应剧烈程度大于水. 3.碱金属与盐反应,先看作与水反应.
三、焰色反应:
1.是元素的一种物理性质,无论是金属离 子或金属原子均能发生焰色反应.
2.应用:用来鉴定 K、Na 等元素的存在.
一、下列关于铯及其化合物的说有中,不
正确的是(
)
A.氢氧化铯是一种弱碱 B.铯与水或酸都剧烈反应,产生氢气 C.碳酸铯用酒精灯加热可以生成氧化铯和二氧化碳 D.硫酸铯,碳酸铯,硝酸铯都易溶于水 E.铯原子半径大于Na.K. F.熔、沸点高于Na.K. G:从相应的化合物中中制取铯比钾.钠难 H:铯可以在空气中燃烧生成氧化铯
1.色态:锂、钠、钾、铷是银白色的固体,铯是略带金色 的银白色固体.
2.硬度:碱金属硬度都很小,比较软,可用小刀切割,随 着核电荷数的递增,其硬度依次减小.
3.熔点:① 碱金属熔点都很低(特别是铯,其熔点只有 28.40℃,在夏季就能熔化).水的沸点的只有锂.
2 3
离子方程式为: CO32 2 H CO2 H 2O
Ca 2 2OH CO2 CaCO3 H 2O
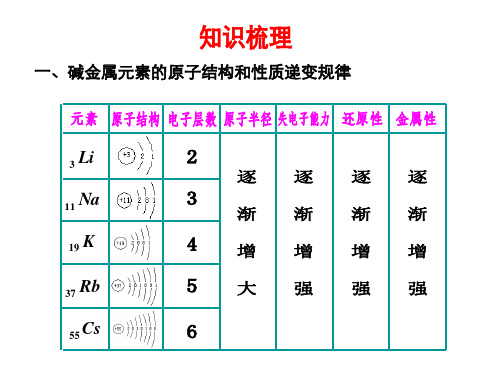
一、碱金属元素的原子结构和性质递变规律
3 Li 11 Na 19 K 37 Rb 55 Cs
碱金属元素原子最外层都只有1个电子, 容易失去,跟钠相同,表现出强还原性.如 钾也能跟O2、卤素单质等非金属单质及水等 发生氧化还原反应.
高一化学第四章《碱金属》知识点总结

高一化学第四章《碱金属》知识点总结一、碱金属元素概述碱金属元素包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)。
它们位于元素周期表的第ⅠA 族。
碱金属元素的原子结构具有相似性和递变性。
相似性表现在最外层电子数均为 1 个电子;递变性表现在随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
二、碱金属单质的物理性质1、颜色和状态锂、钠、钾都是银白色的金属,铷是银白色略带金色光泽,铯略带金黄色。
它们在常温下均为固体。
2、密度碱金属单质的密度逐渐增大(钾的密度比钠小)。
3、熔点和沸点碱金属单质的熔点和沸点逐渐降低。
4、硬度碱金属单质的硬度逐渐减小,质地柔软,可以用小刀切割。
三、碱金属单质的化学性质1、与氧气反应碱金属单质都能与氧气反应,生成相应的氧化物。
锂与氧气反应生成氧化锂(Li₂O);钠与氧气在常温下生成氧化钠(Na₂O),在加热或点燃条件下生成过氧化钠(Na₂O₂);钾与氧气反应更复杂,生成超氧化钾(KO₂)等。
从锂到铯,与氧气反应的剧烈程度逐渐增加。
2、与水反应碱金属单质都能与水发生剧烈反应,生成相应的碱和氢气。
2Li + 2H₂O = 2LiOH + H₂↑2Na + 2H₂O = 2NaOH + H₂↑2K + 2H₂O = 2KOH + H₂↑从锂到铯,与水反应的剧烈程度逐渐增强。
反应的实质是碱金属原子失去最外层的 1 个电子,形成+1 价的阳离子。
3、与卤素反应碱金属单质都能与卤素(如氯气、溴、碘)发生反应,生成相应的卤化物。
四、碱金属的氧化物1、氧化锂(Li₂O)白色固体,是碱性氧化物,能与水反应生成氢氧化锂。
2、过氧化钠(Na₂O₂)淡黄色固体,不是碱性氧化物。
与水反应生成氢氧化钠和氧气:2Na₂O₂+ 2H₂O = 4NaOH + O₂↑;与二氧化碳反应生成碳酸钠和氧气:2Na₂O₂+ 2CO₂= 2Na₂CO₃+ O₂。
过氧化钠常用作呼吸面具和潜水艇中的供氧剂。
碱金属元素(1)

二、碱金属的物理性质 色态、硬度、熔点、密度、导性(总结) 三、碱金属的化学性质 1、碱金属与非金属的反应 [实验2-9]钾在空气中能燃烧,火焰呈紫色。比钾与氧气的燃烧 更剧烈生成过氧化钾和比过氧化钾更复杂的氧化物。
大量实验证明碱金属都能与氧气反应锂与氧气的反应不 如钠剧烈,生成氧化锂。4Li+O2=2Li2O
分含量。
设混和物中NaHCO3 的质量为B NaOH + NaHCO3 = Na2CO3 + H2O
84g B 18 g 18.4g – 16.6g = 1.8g
△
84g : B =18g : 1.8g
B = 8.4g
NaOH% =
(18. 4 - 8. 4) g
18. 4 g
×100 % = 54. 3%
焰色反应
多种金属及它们的化合物在燃烧时使火焰呈特殊的颜色, 这在化学上叫焰色反应。 实验[2-11]
1、焰色反应是元素的性质,与元素的存在 状态无关。
2、焰色反应是指某些金属或它们的化合物 在灼烧时会使火焰呈现出特殊的颜色。
3、焰色反应实验操作注意事项:
a 用稀盐酸把铂丝洗充分后,放在火焰 上灼烧至火焰恢复原来的颜色。目的是除 去铂丝上的杂质。
[ 例5] 30mL可能由CO、CO2和O2组成的混和气体与足 量过氧化钠充分反应,气体体积变为25mL.引燃此剩余 气体。恢复到原始温度后测得体积为20mL,分析原气体 组成。 分析:设反应前后体积变化为△V 2Na2O2 + 2CO2 = 2Na2CO3 + O2
2mL x = 10mL 1mL y =5mL
NaHCO3 + HCl = NaCl + H2O + CO2
高一化学碱金属元素l、碱金属元素性质的相似性 2,碱金属元素性质的递变性课件(共8张PPT)

4、氧在化合物中一般是-2价,氢显+1价,但Na2O2、H2O2中的氧显-1价,NaH、CaH2,中的氢显-l价。 5、焰色反应不属于化学法检验。 1、Na、K需保存于煤油中,但Li的密度比煤油小,所以Li必须保存在密
检验金属离子的存在。通常利用碱金属离 K + O2 === KO2(超氧化钾)
4、观察钾的焰色时,要透过蓝色钴玻璃,因为钾中常混有Na的杂质,蓝色枯玻璃可滤去黄光。
(2)形成的ROH的碱性由Li →Cs逐渐增强,CsOH
为最强碱。
焰色反应
焰色反应
2,碱金属元素性质的递变性
由于碱金属盐易溶于水,且其水溶液均 K + O2 === KO2(超氧化钾)
2、蘸取待测物的金属丝,最好用铂丝,也可用钨丝、镍铬丝(电炉丝)等来
(5)单质的熔沸点呈现由高→低趋势,其密度由小到大 (K、Na除外)。
2,碱金属元素性质的递变性
例如:与氧气反应(在空气中燃烧)
Li + O2 === Li2O 4、观察钾的焰色时,要透过蓝色钴玻璃,因为钾中常混有Na的杂质,蓝色枯玻璃可滤去黄光。 2Na + O2 === Na2O2 2、蘸取待测物的金属丝,最好用铂丝,也可用钨丝、镍铬丝(电炉丝)等来
6、一般活泼金属能从盐中置换出不活泼金属,但对非常活泼的金属Na、K等除外。 5、试剂瓶中的药品取出后,一般不能放回原瓶,但金属Na、K等除外。
2K + O2 === K2O2 以免干扰对颜色的观察。
随着核电荷数的递增,由Li → Cs。
K + O2 === KO2(超氧化钾) (1)结构特点:最外层都有l个电子,易失电子成+l价阳离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2,碱金属元素性质的递变性
2,碱金属元素性质的递变性 随着核电荷数的递增,由Li → Cs。 (1)金属性渐强,这是由于原子半径由小到大
引起的,因而失电子能力由 弱→强。
(2)与氧气反应越来越复杂。 (3)与水反应越来越激烈。 (4)最高价氧化物的水化物的碱性由弱到强。 (5)单质的熔沸点呈现由高→低趋势,其密度由小 到大(K、Na除外)。
焰色反应
焰色反应 由于碱金属盐易溶于水,且其水溶液均
为无色,因此不能通过沉淀反应来 检验金属离子的存在。通常利用碱金属离 子在火焰中所显示的不同颜色来检验。这 种检验方法叫做焰色法。
焰色反应
一些金属或金属离子的馅色反应的颜色如下: 钾 紫 色 (透过蓝色钴玻璃) 钠 黄色 锂 紫红色 铷 紫色 钙 砖红色 锶 洋红色 钡 黄绿色 铜 绿色
5、试剂瓶中的药品取出后,一般不能放回原瓶,但金属Na、K 等除外。
6、一般活泼金属能从盐中置换出不活泼金属,但对非常活泼的 金属Na、K等除外。如:
2Na + Na2SO4
CuSO4
+
2H2O
===
Cu(OH)2↓
+
H2↑+
知识回顾 Knowledge Review
“碱金属”中的一般和特殊
“碱金属Байду номын сангаас中的一般和特殊
1、Na、K需保存于煤油中,但Li的密度比煤油小,所以Li必须 保存在密
度更小的石蜡油中或密封于石蜡中。
碱金属中,从Li→Cs,密度呈增大的趋势,但
d(K)=0.8629/cm3<d(Na)=0.971g/cm3。
3、Na酸2式CO盐3的溶解度一般大于正盐,但溶解度NaHCO3< H42、O氧2中在的化氧合显物-中1价一,般N是a-H2价、,Ca氢H显2,+1中价的,氢但显N-al价2O。2、
2,碱金属元素性质的递变性
例如:与氧气反应(在空气中燃烧) Li + O2 === Li2O 2Na + O2 === Na2O2
2K + O2 === K2O2 K + O2 === KO2(超氧化钾) 再如:与水反应 2R + 2H2O === 2ROH + H2↑ (1)反应程度由Li → Cs逐渐强烈; (2)形成的ROH的碱性由Li →Cs逐渐增强, CsOH为最强碱。
焰色反应
★关于焰色反应要注意以下几点: l、焰色反应实验要求灯焰的颜色浅,如用酒精灯 馅,则要使用外焰的侧面,因为焰心的颜色偏黄。 2、蘸取待测物的金属丝,最好用铂丝,也可用钨 丝、镍铬丝(电炉丝)等来
代替,每次使用金属丝时,必须在火焰上灼烧至无色。 以免干扰对颜色的观察。 3、金属丝在使用前要用稀盐酸洗净,不能用稀 H发2,S而O4硫洗酸涤盐,的因熔为沸金点属较氯高化,物难灼以烧挥时发易,气会化对而后挥一 个离子的检验产生干扰。 4、观察钾的焰色时,要透过蓝色钴玻璃,因为钾 中常混有Na的杂质,蓝色枯玻璃可滤去黄光。 5、焰色反应不属于化学法检验。该法一般是在其 他检验方法无效时才采用。
碱金属元素
l、碱金属元素性质的相似性 2,碱金属元素性质的递变性 3、焰色反应 4、“碱金属”中的一般和特殊
l、碱金属元素性质的相似性
l、碱金属元素性质的相似性 (1)结构特点:最外层都有l个电子,易
失电子成+l价阳离子。 (2)都能与氧气反应,生成氧化物、过氧化 物等,与H2O反应产生H2和氢氧化物.都能 与卤素反应生成卤化物。
