化验室EDTA滴定法测定水质钙镁离子操作规程
EDTA法测定钙镁含量

石灰石中CaCO3含量的测定方法提要:试样经盐酸、硝酸分解,以三乙醇胺掩蔽铁铝等干扰元素,在PH大于12.5的溶液中,以钙黄绿素为指示剂,用EDTA标准溶液滴定钙。
PH=10时,以铬黑T为指示剂,用EDTA标准溶液滴定钙镁总量,由差减法求得氧化镁含量。
主要仪器;(1)分析天平感量0.1mg(2) 250.00ml 容量瓶(3) 20.00ml 移液管(试样)(4) 10.00ml 移液管(氨缓)(5) 5.00ml 移液管(三乙醇胺)(6) 5.00ml 移液管(KOH)(7) 1.00 ml 移液管 (氨水)试剂;(1)20% KOH(2)1+2 三乙醇胺(3)1+1 NH3H2O(4)氯化铵-氨水缓冲溶液(PH=10)(5)铬黑T指示剂(6)CMP混合指示剂一、碳酸钙含量的测定;1.准确称取0.5g试样(精确至0.0001)于250m l杯中,用少量的水湿润样品,然后用玻璃棒混匀,盖上表面皿沿皿口滴加5ml(1+1)HCL,搅拌均匀小心加热煮沸半分钟使之溶解,冷却后转入250ml容量瓶中,用水稀释至刻度摇匀备用(此时pH1.42)。
2.准确吸取10ml试样于250ml三角瓶中加入100ml除盐水(pH 1.97),加入5ml(1+2)三乙醇胺(掩蔽Fe3+AL3+等应在酸性时加入)摇匀(此时pH9.36)及适量的CMP混合指示剂,在搅拌下加入5ml20%KOH溶液(此时pH ≥13)。
在黑色背景下用0.01mol/L EDTA标准溶液滴定至溶液的黄绿色荧光消失,并呈现红色时即为滴定终点。
计算;0.01×V×0.05608CaO% = ————————————×100G×10/250CaCO3% = CaO%×1.7857二、氧化镁含量的测定:准确吸取10ml试样于250ml三角瓶中加入100ml除盐水,加入5ml(1+2)三乙醇胺,搅拌加入1ml(1+1)NH3H2O调节溶液pH至10(此时pH=10.16左右),然后加入10ml(pH=10)NH3-NH4Cl缓冲溶液,加入1%铬黑T指示剂,以0.01mol/L EDTA标准溶液滴定,近终点时应缓慢滴定至纯蓝色,此消耗体积为滴定钙、镁总量所消耗的体积V总。
水中钙镁离子的测定

自来水总硬度及钙镁离子含量的测定一、实验目的1、练习移液管、滴定管的使用;2、学会EDTA 法测定水的总硬度的原理和方法;3、掌握铬黑T 指示剂及钙指示剂的应用及指示剂终点的原理;4、了解金属指示剂的特点5、掌握配位滴定过程,突跃范围及指示剂的选择原理。
二、实验原理滴定前:Mg 2+ + HIn 2-←→ [MgIn]- + H +纯蓝色酒红色化学计量点前:Ca 2+ + H 2Y 2-←→[CaY]2- + 2H +Mg 2+ + H 2Y 2-←→[MgY]2- + 2H +化学计量点时: [MgIn]- + H2Y 2-←→ [MgY]2- + HIn - + H+酒红色纯蓝色根据消耗的EDTA 标准溶液的体积V 1 计算水的总硬度。
三、实验用品:四、实验步骤1. 水的总硬度测定用移液管移取水样, 置于250ml 锥形瓶中, 加5ml pH=10的NH 3·H 20-NH 4Cl 缓冲溶液, 加铅黑T 指示剂约( 或溶液 5 滴), 用EDTA 标准溶液滴定至溶液由酒红色变为纯蓝色, 记下EDTA 用量V 1。
平行测定3 次。
计算水的总硬度。
101100010Vs CaOM EDTA V EDTA C d (备注:一升水中含有10mg 氧化钙为1度—德国度)3. 钙和镁含量的测定另取取水样, 置于锥形瓶,加10%氢氧化钠5ml,加钙指示剂少许( 约, 用EDTA 标准溶液滴定至溶液由红色变为纯蓝色, 记录EDTA 用量V 2。
平行测定 3 次。
计算水中钙和镁的质量浓度。
VsCaM V EDTA c Ca 2(g/L )Vs Mg M V V EDTA c Mg 21(g/L )。
水质 钙和镁总量的测定 EDTA 滴定法

式中 c1 EDTA 二钠溶液浓度 mmol/L V1 滴定中消耗 EDTA 二钠溶液的体积 mL V0 试样体积 mL
如试样经过稀释 采用稀释因子 F 修正计算 关于硬度的计算 见附录 A 1 mmol/L 的钙镁总量相当于 100.1mg/L 以 CaCO3 表示的硬 度 8 精密度 本方法的重复性为 0.04mmol/L 约相当于 2 滴 EDTA 二钠溶液 9 参考文献
锥形瓶中 用水润湿 逐滴加入 4mol/L 盐酸至碳酸钙全部溶解 避免滴入过量酸 加 200mL 水 煮沸数分钟赶除二氧化碳 冷至室温 加入数滴甲基红指示剂镕液(0.1g 溶于 100mL60
乙醇) 逐滴加入 3mol/L 氨水至变为橙色 在容量瓶中定容至 1000mL 此溶液 1.00mL 含 0.4008mg(0.01mmol)钙
美国
mg/L 100 17.8 14.3 10 1
3
GB7477-87
附录 A 水硬度的概念
(参考件)
硬度 不同国家有不同的定义概念 如总硬度 碳酸盐硬度 非碳酸盐硬度
A.1 定义
A.1.1 总硬度 钙和镁的总浓度
A.1.2 碳酸盐硬度 成的硬度
总硬度的一部分 相当于跟水中碳酸盐及重碳酸盐结合的钙和镁所形
A.1.3 非碳酸盐硬度 总硬度的另一部分 当水中钙和镁含量超出与它们结合的碳酸盐和
重碳酸盐含量时 多余的钙和镁就跟水中氯化物 硫酸盐 硝酸盐结成非碳酸盐硬度
A.2 硬度的表示方法
A.2.1 A.2.2 A.2.3 A.2.4
德国硬度 英国硬度 法国硬度 美国硬度
1 德国硬度相当于 CaO 含量为 10mg/L 或为 0.178mmol/L l 英国硬度相当于 CaCO3 含量为 1 格令/英加仑 或为 0.143mmol/L 1 法国硬度相当于 CaCO3 含量为 10mg/L 或为 0.1mmol/L l 美国硬度相当于 CaCO3 含量为 lmg/L 或为 0.01mmol/L
钙、镁的测定方法

钙和镁的测定——EDTA滴定法方法原理:EDTA能与许多金属离子Mn、Cu、Zn、Ni、Co、Ba、Sr、Ca、Mg、Fe、Al 等起配合反应,形成微理解的无色稳定性配合物。
但在土壤水溶液中除Ca2+和Mg2+外,能与EDTA配合的其它金属离子的数量极少,可不考虑。
因而可用EDTA在pH10时直接测定Ca2+和Mg2+的数量。
干扰离子加掩蔽剂消除,待测液中Mn、Fe、Al等金属含量多时,可加三乙醇胺掩蔽。
1:5的三乙醇胺溶液2ml能掩蔽5-10mg Fe、10mgAl、4mgMn。
当待测液中含有大量CO32-或HCO3-时应预先酸化,加热除去CO2,否定时,由于CaCO3逐渐离解而使滴定终点拖长。
当单独测定Ca时,如果待测液含Mg2+超过Ca2+的5倍,用EDTA滴Ca2+时应先稍加过量的EDTA,使Ca2+先和EDTA配合,防止碱化时形成的Mg(OH)2沉淀对Ca2+吸附。
最后再用CaCl2标准溶液回滴过量EDTA。
单独测定Ca时,使用的指示剂有紫尿酸铵,钙指示剂(NN)或酸性铬蓝K等。
测定Ca、Mg含量时使用的指示剂有铬黑T,酸性铬蓝K等。
主要仪器:磁搅拌器、10mL半微量滴定管试剂:(1)4mol·L-1的氢氧化钠溶液。
溶解氢氧化钠40g于水中,稀释至250mL,贮塑料瓶中,备用。
(2)铬黑T指示剂。
溶解铬黑T0.2g于50mL甲醇中,贮于棕色瓶中备用,此液每月配置1次,或者溶解铬黑T0.2g于50mL二乙醇胺中,贮于棕色瓶。
这样配置的溶液比较稳定,可用数月。
或者称铬黑T0.5g与干燥分析纯NaCl100g共同研细,贮于棕色瓶中,用毕即刻盖好,可长期使用。
(3)酸性铬蓝K+萘酚绿B混合指示剂(K-B指示剂)。
称取酸性铬蓝K 0.5g和萘酚绿B 1g 与干燥分析纯NaCl100g共同研磨成细粉,贮于棕色瓶中或塑料瓶中,用毕即刻盖好,可长期使用。
或者称取酸性铬蓝K 0.1g,萘酚绿B0.2g,溶于50mL水中备用,此液每月配制1次。
实验七EDTA的标定与水样中钙镁总量的测定(精)

实验七EDTA的标定与水样中钙镁总量的测定一、实验目的1.熟悉EDTA的配置与标定原理和方法。
2.了解EDTA的滴定方法和水样中钙镁的测定。
3.了解金属指示剂的使用。
4.了解络合滴定中缓冲溶液的作用。
二、实验原理乙二胺四乙酸二钠简称EDTA,由于EDTA与大多数金属离子形成稳定的1:1型螯合物,故常用作配合滴定的标准溶液。
标定EDTA溶液的基准物有,Zn,ZnO,CaCO3,Cu,Bi,MgSO4·7H2O,Ni,Pb等。
通常选用的标定条件应尽可能与测定条件一致,以免引起系统误差,如果用被测元素的纯金属或化合物作基准物质,就更为理想。
常见用纯金属锌作基准物标定EDTA,可以用铬黑T 作指示剂,用氨缓冲溶液,在pH=10进行标定。
也可用二甲酚橙作指示剂,用六亚甲基四胺调节酸度,在pH=5~6进行标定。
三、试剂1、环境准备:2人一个水槽;4人一桶(10L)蒸馏水;4人一台恒温水浴箱;16人一个烘箱;5人一台电子天平(配齐干燥器、称量瓶、称量手套或称量夹,称量勺),10人一台电子台秤。
2、器皿准备:每人准备: 烧杯 100mL 2个,250mL 2个;容量瓶100mL 1个,250mL 2个;锥形瓶 250mL 5个;试剂瓶 500mL磨口瓶2个,塑料瓶2个;洗瓶1个;50mL洗耳球1个;酸式滴定管(25mL~50mL)1支,碱式滴定管(25mL~50mL)1支;移液管(25mL~50mL)1支,刻度吸管(1ml、2mL、5mL、10mL)各1支;滴定台一套,托盘1个。
3、乙二胺四乙酸二钠(Na2H2Y·2H2O)摩尔质量为372.2。
4g/人。
4、MgSO4的干燥:移取试剂于数个称量瓶中,半开盖于250℃烘箱内干燥1 h ,取出放入干燥器内备用。
5、金属Zn(A·R)6、NH3·H2O-NH4Cl缓冲溶液(pH≈10):称取20gNH4Cl,加入100mL原装分析纯氨水,蒸馏水稀至1L。
实验十 钙镁离子浓度测定实验

实验十水中钙镁离子含量的测定一、目的:1、掌握EDTA法测定水中钙镁离子含量的原理和方法。
2、熟悉EBT和钙指示剂的应用。
二、原理:1、总硬度测定原理在PH=10的溶液中以EBT为指示剂,用EDTA滴定,EDTA首先与Ca2+离子配合,然后与Mg2+配合,方程式如下:H2Y2-+Ca2+←→CaY2-+2H+H2Y2-+Mg2+←→MgY2-+2H+到达终点时,由于lgK MgY>lgK MgIn稍微过量的EDTA就会从MgIn-中夺取Mg2+,反应式如下:MgIn-+H2Y2-←→MgY2-+HIn2-+H+(EDTA滴定Mg2+允许的最小PH值为:logαY(H)=8.63-8=0.63 PH9.5~10.0lgαY(H)=10.69-8=2.69 PH7.5~8.0)2、钙硬度测定原理:用NaOH调节水样PH=12.5,使Mg2+→Mg(OH)2↓,以钙指示剂确定终点,用EDTA滴定至由红→蓝。
Ca2++HIn2-=CaIn-+H+(红色)Ca2++H2Y2-=CaY2-+2H+终点时: CaIn-+H2Y2-=CaY2-+HIn2-+H+红蓝三、试剂:EDTA标溶液(稀释至约0.005mol·L-1)、氨性缓冲液(PH=10.0)、10%的NaOH(或2mol·L-NaOH)EBT、钙指示剂四、步骤:1、Ca2+、Mg2+总含量的测定。
100ml水样+5ml缓冲液,滴加EBT 2~3滴用EDTA滴定,到终点时溶液由酒红色变为蓝色,记下V EDTA平行三次(如果水样中Mg2+的含量很低,可事先在EDTA中加入少量Mg2+提高变色点的敏锐性)2、Ca2+含量的测定100mL水样+10%NaOH 8~10mL+钙指示剂(摇匀后再加)由酒红色滴定至蓝色,平行三次。
五、数据及结果计算:计算公式:总硬度(相当于CaO的含量)1L水中含CaO10mg相当于1度。
M CaO=0.056g·mmol-1总硬度=[(V1EDTA·C EDTA)M CaO/(V水样×10)]×1000×1000毫摩尔硬度换算 1000ml 换算成mg钙硬度=[(C EDTA V EDTA M CaO)/(V水样×10)]×1000×1000六、讨论:1、水样中含有Ca、Mg离子时测定Ca2+的含量为什么要加入NaOH溶液?能用EBT作指示剂吗、为什么?2、分析个人的操作误差。
钙镁离子滴定方法

二、水中钙、镁离子、总硬度的测定1、方法原理水的总硬度的测定在pH=10的NH3-NH4Cl缓冲溶液中,以铬黑T为指示剂,用EDTA标准溶液滴定溶液中的Ca2+、Mg2+。
铬黑T和EDTA都能和Ca2+、Mg2+形成配合物,其配合物稳定性顺序为:[CaY]2- > [MgY]2- > [MgIn]- > [CaIn]-加入铬黑T后,部分Mg2+与铬黑T形成配合物使溶液呈酒红色。
用EDTA 滴定时,EDTA先与Ca2+和游离Mg2+反应形成无色的配合物,化学计量点时,EDTA夺取指示剂配合物中的Mg2+,是指示剂游离出来,溶液有酒红色变成纯蓝色即为终点。
滴定前: Mg2+ + HIn2-←→ [MgIn]- + H+纯蓝色酒红色化学计量点前 : Ca2+ + H2Y2-←→[CaY]2- + 2H+Mg2+ + H2Y2-←→[MgY]2- + 2H+化学计量点时 : [MgIn]- + H2Y2-←→ [MgY]2- + HIn- + H+酒红色纯蓝色根据消耗的EDTA 标准溶液的体积 V1计算水的总硬度。
钙镁含量的测定取与测定总硬度时相同体积的水样, 加入NaOH调节PH=12,Mg2+ 即形成Mg(OH)2沉淀。
然后加人钙指示剂, Ca2+与钙指示剂形成红色配合物。
用EDTA 滴定时,EDTA 先与游离Ca2+形成配合物, 再夺取已与指示剂配位的Ca2+,使指示剂游离出来, 溶液由红色变为纯蓝色。
由消耗EDTA标准溶液的体积V2计算钙的含量。
再由测总硬度时消耗的EDTA体积V1和V2的差值计算出镁的含量。
2、干扰及消除水中若含有Fe3+、A13+, 可加三乙醇胺掩蔽;若有Cu2+、Pb2+、Zn2+等 , 可用Na2S或KCN掩蔽。
3、水样取液量以水样的总溶固含量(mg/L)为参考,适当移取水样稀释后进行滴定,同时为了提高工作效率每个样品消耗EDTA应在10ml左右。
4、试剂a)钙离子指示剂:称取0.2g钙红与100gNaCL,充分混合,研磨后通过40-50目筛,盛放在棕色瓶中,塞紧。
水中总硬度的测定--EDTA滴定法

实验三水中总硬度的测定――EDTA滴定法1、原理将溶液的pH值调整到10,用EDTA溶液络合滴定钙、镁离子。
铬黑T作指示剂与钙、镁离子生成紫红色络合物。
滴定中,游离的钙和镁离子首先与EDTA反应,跟指示剂络合的钙镁离子随后与EDTA反应,到达终点时溶液的颜色由紫色变为天蓝色。
2、仪器1.50mL滴定管2.250mL锥形瓶1.钙标准溶液:10mmol/L。
将CaC03在150℃干燥2h,取出放在干燥器中冷至室温,称取于500mL锥形瓶中,用水润湿。
逐滴加入4mol/LHCl溶液至CaC03全部溶解,避免滴入过量酸。
加200mL水,煮沸数分钟赶除C02,冷至室温,加入数滴甲基红指示剂溶于100mL60%乙醇),逐滴加入3mol/L 氨水至变为橙色,转移至1000mL容量瓶中,定容至1000mL。
此溶液含 L)M1=W/m2. EDTA二钠标准溶液:10mmol/L。
将EDTA二钠二水合物(C10H14N2O8Na2·2H20)在80℃干燥2h后置于干燥器中冷至室温,称取二钠,溶于去离子水中,转移至1000mL容量瓶中,定容至1000mL,其准确浓度标定如下:用移液管吸取二钠标准溶液于250mL锥形瓶中,加入25mL去离子水,稀释至50mL。
再加入5mL缓冲溶液及3滴铬黑T指示剂(或50—100mg铬黑T干粉),此溶液因应呈紫红色,pH值应为。
为防止产生沉淀应立刻在不断搅拌下,自滴定管加入EDTA一2Na标准溶液,开始滴定时速度宜稍快,滴定至溶液由紫红色变为蓝色,计算其准确浓度:M2=MLV1/V23.缓冲溶液(pH=lO)(1)、称取16.9g氯化氨(NH4Cl),溶于143mL浓氢氧化氨中。
(2)、称取0.780g硫酸镁(MgS04·7H20)及二钠二水合物,溶于50mL去离子水中,加入2mLNH4Cl一NH40H溶液和5滴铬黑T指示剂(此时溶液应成紫红色,若为蓝色,应加极少量MgS04使成紫红色)。
镁总量的测定-EDTA滴定法(精)

钙、镁总量的测定-EDTA滴定法本方法等效采用ISO 6059-1984 《水质钙与镁总量的测定EDTA滴定法》。
l 范围本方法规定用 EDTA 滴定法测定地下水和地面水中钙和镁的总量。
本方法不适用于含盐量高的水,诸如海水。
本方法测定的最低浓度为0.05mmol/L。
2 原理在 pHl0的条件下,用 EDTA 溶液络合滴定钙和镁离子,铬黑 T 作指示剂,与钙和镁生成紫红或紫色溶液。
滴定中,游离的钙和镁离子首先与 EDTA 反应,跟指示剂络合的钙和镁离子随后与EDTA反应,到达终点时溶液的颜色由紫变为天蓝色。
3 试剂分析中只使用公认的分析纯试剂和蒸馏水,或纯度与之相当的水。
3.1 缓冲溶液(pH=10)。
3.1.l 称取1.25g EDTA 二钠镁(C10H12N2O8Na2Mg)和16.9g氯化铵(NH4Cl)溶于143mL 浓的氨水(NH3·H2O)中,用水稀释至250ml。
因各地试剂质量有出入,配好的溶液应按 3.1.2 方法进行检查和调整3.1.2 如无 EDTA 二钠镁,可先将 l6.9g 氯化铵溶于 143mL 氨水。
另取 0.78g 硫酸镁(MgSO4·7H2O)和1.179gEDTA 二钠二水合物(C10H12N2O8Na2·2H2O)溶于50mL水,加入2mL配好的氯化铵、氨水溶液和0.2g左右铬黑 T指示剂干粉(3.4)。
此时溶液应显紫红色,如出现天蓝色,应再加入极少量硫酸镁使变为紫红色,逐滴加入 EDTA 二钠溶液(3.2)直至溶液由紫红转变为天蓝色为止(切勿过量) 将两溶液合并,加蒸馏水定容至 250mL。
如果合并后,溶液又转为紫色,在计算结果时应减去试剂空白。
3.2 EDTA 二钠标准溶液:≈10mmol/L。
3.2.1 制备将一份 EDTA 二钠二水合物在 80℃干燥2h,放人干燥器中冷至室温,称取 3.725g溶于水,在容量瓶中定容至1000mL,盛放在聚乙烯瓶中,定期校对其浓度。
镁总量的测定-EDTA滴定法(精)

钙、镁总量的测定-EDTA滴定法本方法等效采用ISO 6059-1984 《水质钙与镁总量的测定EDTA滴定法》。
l 范围本方法规定用 EDTA 滴定法测定地下水和地面水中钙和镁的总量。
本方法不适用于含盐量高的水,诸如海水。
本方法测定的最低浓度为0.05mmol/L。
2 原理在 pHl0的条件下,用 EDTA 溶液络合滴定钙和镁离子,铬黑 T 作指示剂,与钙和镁生成紫红或紫色溶液。
滴定中,游离的钙和镁离子首先与 EDTA 反应,跟指示剂络合的钙和镁离子随后与EDTA反应,到达终点时溶液的颜色由紫变为天蓝色。
3 试剂分析中只使用公认的分析纯试剂和蒸馏水,或纯度与之相当的水。
3.1 缓冲溶液(pH=10)。
3.1.l 称取1.25g EDTA 二钠镁(C10H12N2O8Na2Mg)和16.9g氯化铵(NH4Cl)溶于143mL 浓的氨水(NH3·H2O)中,用水稀释至250ml。
因各地试剂质量有出入,配好的溶液应按 3.1.2 方法进行检查和调整3.1.2 如无 EDTA 二钠镁,可先将 l6.9g 氯化铵溶于 143mL 氨水。
另取 0.78g 硫酸镁(MgSO4·7H2O)和1.179gEDTA 二钠二水合物(C10H12N2O8Na2·2H2O)溶于50mL水,加入2mL配好的氯化铵、氨水溶液和0.2g左右铬黑 T指示剂干粉(3.4)。
此时溶液应显紫红色,如出现天蓝色,应再加入极少量硫酸镁使变为紫红色,逐滴加入 EDTA 二钠溶液(3.2)直至溶液由紫红转变为天蓝色为止(切勿过量) 将两溶液合并,加蒸馏水定容至 250mL。
如果合并后,溶液又转为紫色,在计算结果时应减去试剂空白。
3.2 EDTA 二钠标准溶液:≈10m mol/L。
3.2.1 制备将一份 EDTA 二钠二水合物在80℃干燥2h,放人干燥器中冷至室温,称取3.725g溶于水,在容量瓶中定容至1000mL,盛放在聚乙烯瓶中,定期校对其浓度。
水中钙的测定--EDTA法
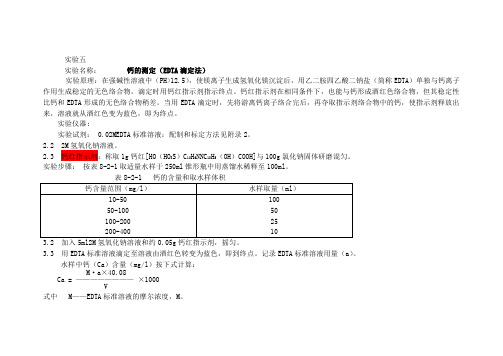
实验五实验名称:钙的测定(EDTA滴定法)实验原理:在强碱性溶液中(PH>12.5),使镁离子生成氢氧化镁沉淀后,用乙二胺四乙酸二钠盐(简称EDTA)单独与钙离子作用生成稳定的无色络合物。
滴定时用钙红指示剂指示终点。
钙红指示剂在相同条件下,也能与钙形成酒红色络合物,但其稳定性比钙和EDTA形成的无色络合物稍差。
当用EDTA滴定时,先将游离钙离子络合完后,再夺取指示剂络合物中的钙,使指示剂释放出来,溶液就从酒红色变为蓝色,即为终点。
实验仪器;实验试剂: 0.02MEDTA标准溶液:配制和标定方法见附录2。
2.2 2M氢氧化钠溶液。
2.3 钙红指示剂:称取1g钙红[HO(HO3S)C10H6NNC10H5(OH)COOH]与100g氯化钠固体研磨混匀。
实验步骤:按表8-2-1取适量水样于250ml锥形瓶中用蒸馏水稀释至100ml。
3.2 加入5ml2M氢氧化钠溶液和约0.05g钙红指示剂,摇匀。
3.3 用EDTA标准溶液滴定至溶液由酒红色转变为蓝色,即到终点。
记录EDTA标准溶液用量(a)。
水样中钙(Ca)含量(mg/l)按下式计算:M·a×40.08Ca = ————————×1000V式中 M——EDTA标准溶液的摩尔浓度,M。
a——滴定时消耗EDTA标准溶液的体积,ml;V——水样的体积,ml。
40.08——钙的原子量。
[注释]1)在加入氢氧化钠溶液后应立即迅速滴定,以免因放置过久引起水样浑浊,造成终点不清楚。
2)当水样的镁离子含量大于30mg/l时,应将水样稀释后测定。
3)若水样中重碳酸钙含量较多时,应先将水样酸化煮沸,然后用氢氧化钠溶液中和后进行测定。
4)钙红又称钙指示剂。
若无钙红时,也可用紫尿酸铵或钙试剂(依来铬蓝黑R)代替,这些指示剂的配制和使用方法见表8-2-2。
计算过程:实验小结:实验六实验名称:镁的测定(重量法)实验原理:在氨性溶液中,水中的镁和磷酸盐生成磷酸铵镁沉淀,然后经过滤、灼烧、冷却、称量,计算出水中镁的含量。
水中钙镁离子含量测定

实验十四水硬度的测定一实验目的1、了解硬度的常用表示方法;2、学会用配位滴定法测定水中钙镁含量,钙含量的原理和方法3、掌握铬黑T,钙指示剂的使用条件和终点变化。
二、实验原理1、总硬度、钙硬度、镁硬度的概念及表示方法;水的硬度主要是指水中含可溶性的钙盐和镁盐。
总硬度通常以每L水中含的碳酸钙的mg数,即mg/L.钙硬度即每1L水中含的钙离子的mg数,mg/L.镁硬度即每1L水中含的镁离子的mg数,mg/L2 总硬度的测定条件与原理测定条件:以NH3-NH4Cl 缓冲溶液控制溶液pH=10,以铬黑T为指示剂,用EDTA滴定水样。
原理:滴定前水样中的钙离子和镁离子与加入的铬黑T指示剂络合,溶液呈现酒红色,随着EDTA的滴入,配合物中的金属离子逐渐被EDTA夺出,释放出指示剂,使溶液颜色逐渐变蓝,至纯蓝色为终点,由滴定所用的EDTA的体积即可换算出水样的总硬度。
3 钙硬度的测定条件与原理;测定条件:用NaOH溶液调节待测水样的pH为13,并加入钙指示剂,然后用EDTA 滴定。
原理:调节溶液呈强碱性以掩蔽镁离子,使镁离子生成氢氧化物沉淀,然后加入指示剂用EDTA滴定其中的钙离子,至酒红色变为纯蓝色即为终点,由滴定所用的EDTA的体积即可算出水样中钙离子的含量,从而求出钙硬度。
4、相关的计算公式总硬度=(CV1)EDTAMCaCO3/0.1 钙硬度=(CV2)EDTAMCa/0.1 镁硬度=C(V1-V2)MMg/0.1三实验步骤四实验数据记录与处理总硬度的测定钙硬度的测定镁硬度=C(V1-V2)MMg/0.1五、思考题1、水硬度的测定包括哪些内容?如何测定?〈1〉水硬度的测定包括总硬度与钙硬度的测定,镁硬度则根据实验结果计算得到;〈2〉可在一份溶液中进行,也可平行取两份溶液进行;①.在一份溶液中进行;先在pH=12 时滴定Ca2+,再将溶液调至pH=10 (先调至pH=3,再调至pH=10,以防止Mg(OH)2或MgCO3等形式存在而溶解不完全),滴定Mg2+。
水中钙、镁含量的测定—配位滴定法【范本模板】

水中钙、镁含量的测定—配位滴定法〖实验目的〗(1)了解水的硬度的表示方法。
(2)掌握EDTA法测定水中钙、镁含量的原理和方法.(3)正确判断铭黑T和钙指示剂的滴定终点。
〖实验用品〗仪器:酸式滴定管、容量瓶、移液管、锥形瓶、烧杯、细口试剂瓶、量筒。
药品: EDTA、CaCO3、MgCl2·H2O、固体pH=10氨性缓冲溶液、HCl水溶液、NaOH溶液络黑T指示剂:将1g铬黑T指示剂与100g干燥的纯NaC1混合,研细备用。
钙指示剂:将1g钙指示剂与100g干燥的纯NaC1混合,研细备用。
试样:自来水、矿泉水〖实验原理〗水的总硬度通常是指水中钙、镁的总量.各国对水的硬度表示方法有所不同。
我国采用Ca2+、Mg2+总量折合成CaO来计算水的硬度,硬度单位以度(°)表示,一个硬度单位代表1L 水中含10mgCaO。
一般饮水的总硬度不得超过25°,各种工业用水对硬度有不同的要求,如酿酒以硬水为宜,锅炉用水则必须是软水。
因此,测定水的总硬度有很重要的实际意义。
用EDTA法测定水的总硬度,即在PH=10的氨性缓冲溶液中,以络黑T(EBT)作为指示剂,用EDTA标准溶液直接滴定水中的Ca2+、Mg2+,直到溶液由酒红色变为纯兰色,即为终点。
反应式如下:滴定前:EBT+M(Ca2+,Mg2+)=M-GEBT(兰色) (酒红色)滴定开始到等量点前:M+EDTA=M-EDTA等量点:M—EBT+EDTA=M—EDTA+EBT(酒红色) (兰色)滴定时,Fe3+、Al3+等干扰离子可用三乙醇胺予以掩蔽,Ca2+、pb2+、Zn2+等重金属离子可用KCN、Na2S或巯基乙酸予以掩蔽。
铬黑T与Ca2+络合较弱,所呈颜色不深,终点变化不明显。
当水样中的Mg2+的含量较低时(一般要求相对Ca2+来说须有5% Mg2+存在),用铬黑T指示剂往往得不到敏锐的终点。
这时,可在加铬黑T前于被滴定液中加入适量Mg2+—EDTA溶液(也可在标定前于EDTA溶液中加入适量Mg2+),使终点变色敏锐。
水中钙镁的测定实验报告

一、实验目的1. 掌握配位滴定的基本原理和方法。
2. 熟悉铬黑T和钙指示剂的使用条件及终点变化。
3. 通过实验测定水中钙镁的含量。
二、实验原理水中钙镁含量是评价水质的重要指标之一。
本实验采用EDTA滴定法测定水中钙镁含量。
EDTA是一种常用的配位剂,其与钙镁离子形成的配合物具有稳定的1:1比例。
在滴定过程中,EDTA与钙镁离子发生配位反应,直至所有的钙镁离子都与EDTA配位,此时加入的EDTA量即为钙镁离子的总量。
实验步骤如下:1. 将待测水样分取两份,一份用于测定钙含量,另一份用于测定钙镁总量。
2. 向钙含量测定溶液中加入钙指示剂,用EDTA滴定至溶液颜色由酒红色变为纯蓝色,记录EDTA的用量。
3. 向钙镁总量测定溶液中加入铬黑T指示剂,用EDTA滴定至溶液颜色由酒红色变为纯蓝色,记录EDTA的用量。
4. 根据EDTA的用量和浓度,计算水中钙镁的含量。
三、实验用品1. 待测水样2. 6mol/L氢氧化钠溶液3. NHH2O-NH4Cl缓冲溶液4. 铬黑T试剂5. 钙指示剂6. 滴定管7. 25mL移液管8. 锥形瓶6个9. 蒸馏水四、实验步骤1. 取6个锥形瓶,洗净,用蒸馏水润洗。
2. 向每个锥形瓶中加入100mL蒸馏水。
3. 取其中三个锥形瓶,分别加入2mL 6mol/L氢氧化钠溶液和5滴钙指示剂,溶液变成酒红色。
4. 用EDTA滴定至溶液颜色由酒红色变为纯蓝色,记录EDTA的用量,记为V1。
5. 剩余三个锥形瓶,分别加入5mL NHH2O-NH4Cl缓冲溶液和3滴铬黑T试剂,溶液变成酒红色。
6. 用EDTA滴定至溶液颜色由酒红色变为纯蓝色,记录EDTA的用量,记为V2。
五、数据处理1. 根据V1和V2计算钙镁总量:Ca2+ + Mg2+总量 = V2 - V12. 根据钙镁总量和EDTA的浓度计算水中钙镁的含量:钙含量 = (Ca2+ + Mg2+总量× EDTA浓度) / 水样体积镁含量 = 钙镁总量 - 钙含量六、实验结果与分析1. 本实验测定了某水样中钙镁的含量,结果如下:钙含量:100mg/L镁含量:200mg/L2. 与国家标准相比较,该水样钙镁含量均在安全范围内。
水中钙镁离子含量的测定

水中钙镁离子含量的测定
水中钙镁离子含量的测定可以通过以下步骤进行:
1. 采集水样:在需要测试的地方采集水样,将其放入干净的容器中。
2. 准备试剂:准备一定量的硝酸铵(NH4NO3)、乙二胺四乙酸(EDTA)和卡钠(Calcein Na)试剂。
3. 样品前处理:将采集到的水样用玻璃棒充分搅拌,以保证样品均匀。
根据所需样品量,取少量水样置于锥形瓶中。
4. 钙镁离子络合反应:分别取两个锥形瓶,其中一个加入所需量的硝酸铵溶液,另一个加入乙二胺四乙酸(EDTA)溶液。
然后将两个瓶中溶液混合均匀。
5. 添加指示剂:将卡钠试剂溶解于适量去离子水中,然后滴加到混合溶液中。
搅拌均匀,使溶液发生橙黄色变化。
6. 加标法测定:取一定量的钙标准溶液,加入到产生橙黄色的溶液中。
继续滴加卡钠试剂,直到溶液颜色变为红色。
记录所需滴加的钙标准溶液体积。
7. 测定样品:将步骤6中记录的钙标准溶液体积作为参考,再分别对未加标样品和标准样品进行滴定,直到溶液颜色变为红色。
记录所需滴加的钙标准溶液体积。
8. 计算钙镁离子含量:根据滴定过程中钙标准溶液的使用量,以及水样中的滴定用量,通过计算可以得到水样中钙镁离子的含量。
9. 结果分析:根据计算结果,可以得出水中钙镁离子含量的浓度。
测量水中钙镁离子总含量

实验目的:测量水中钙、镁离子的总含量1.了解配位滴定法基本原理和方法。
2.了解水的硬度的概念及其表示方法。
实验原理含有钙、镁离子的水叫硬水。
测定水的总硬度就是测定水中钙、镁离子的总含量,可用EDTA配位滴定法测定:滴定前: M + EBT M-EBT(红色)主反应: M + Y MY终点时: M-EBT + Y MY + EBT(红色) (蓝色)滴定至溶液由红色变为蓝色时,即为终点。
滴定时,Fe3+、Al3+等干扰离子可用三乙醇胺予以掩蔽;Cu2+、Pb2+、Zn2+等重属离子,可用KCN、Na2S或巯基乙酸予以掩蔽。
水的硬度有多种表示方法,本实验要求以每升水中所含Ca2+、Mg2+总量(折算成CaO的质量)表示,单位mg・L-1。
器材和药品1.器材天平(0.1g、0.1mg),容量瓶(100mL),移液管(20mL),酸式滴定管(50mL),锥形瓶(250mL)等。
2.药品 HC1(1∶1),乙二胺四乙酸二钠(Na2H2Y・2H2O,A.R.),碱式碳酸镁[Mg(OH)2・4MgCO3・6H2O,基准试剂],NH3-NH4Cl缓冲溶液(pH=10.0),三乙醇胺(1∶1),铬黑T指示剂(0.2%氨性乙醇溶液)等。
实验方法一、Mg2+标准溶液的配制(约0.02mol・L-1)准确称取碱式碳酸镁基准试剂0.2~0.25g,置于100mL烧杯中,用少量水润湿,盖上表面皿,慢慢滴加1∶1 HC1使其溶解(约需3~4mL)。
加少量水将它稀释,定量地转移至100mL容量瓶中,用水稀释至刻度,摇匀。
其浓度计算:二、EDTA标准溶液的配制与标定1.EDTA标准溶液的配制(约0.02mol・L-1)称取2.0g乙二胺四乙酸二钠(Na2H2Y・2H2O)溶于250mL蒸馏水中,转入聚乙烯塑料瓶中保存。
2.EDTA标准溶液浓度的标定用20mL移液管移取Mg2+标准溶液于250mL锥形瓶中,加入10mL氨性缓冲溶液和3~4滴EBT指示剂,用0.02mol・L-1EDTA标准溶液滴定,至溶液由紫红色变为蓝色即为终点。
钙、镁总量的测定-EDTA滴定法

钙、镁总量的测定-EDTA滴定法
操作步骤
(1)试样的制备
①一般样品不需预处理。
如样品中存在大量微小颗粒物,需在采样后尽快经0.45μm孔径滤膜过滤。
样品经过滤,可能有少量钙和镁被滤除。
②试样中钙和镁总量超出3.6mmol/L时,应稀释至低于此浓度,记录稀释因子F。
③如试样经过酸化保存,可用计算量的氢氧化钠溶液中和。
计算结果时,应把样品或试样由于加酸或碱的稀释考虑在内。
(2)测定
①用移液管吸取50.0ml试样于250ml锥形瓶中,加4ml缓冲溶液和3滴铬黑T指示剂溶液或约50~100mg指示剂干粉,此时溶液应呈紫红或紫色,其pH值应为10.0±0.1。
②为防止产生沉淀,应立即在不断振摇下,自滴定管加入EDTA二钠溶液,开始滴定时速度宜稍快,接近终点时应稍慢,并充分振摇,最好每滴间隔2~3s,溶液的颜色由紫红或紫色逐渐转变蓝色,在最后一点紫的色调消失,刚出现天蓝色时即为终点,整个滴定过程应在5min 内完成。
③在临滴定前加入250mg氰化钠或数毫升三乙醇胺掩蔽。
氰化物使锌、铜、钴的干扰减至最小。
加氰化物前必须保证溶液呈碱性。
④试样如含正磷酸盐和碳酸盐,在滴定的pH条件下,可能使钙生成沉淀,一些有机物可能干扰测定。
如上述干扰未能消除,或存在铝、钡、铅、锰等离子干扰时,需改用火焰原子吸收法或等离子发射光谱法测定。
实验42水中钙、镁含量的测定配位滴定法

42.3操作流程
3、水的总硬度的测定
量取水样50ml
记录耗用体 积V1,平行 测定3次
放入250ml锥形瓶
加5ml 氨性缓 冲溶液
变为纯 蓝色
少许铬黑 T指示剂
EDTA标准 溶液滴定
摇匀
2021年7月2日星期五
通用化学实验技术
物质的分离与提纯技术
42.3操作流程
4、水中钙硬度的测定
量取水样50ml
通用化学实验技术
物质的分离与提纯技术
实验42.水.1实验目的
(1) 掌握EDTA滴定法测定水中钙、镁含量的原 理和方法;
(2) 掌握EBT和钙指示剂终点颜色的判断; (3) 了解测定水中钙、镁含量的意义; (4) 了解测定水中钙、镁含量的其他方法 。
2021年7月2日星期五
只需用量筒量取便可满足要求。
2021年7月2日星期五
通用化学实验技术
物质的分离与提纯技术
在没有Fe2+,Al3+,Cu2+,Pb2+,Zn2+离 子存在,且Mg2+的含量达到Ca2+含量的5%时, 可以省去所述步骤。
2021年7月2日星期五
面工程, 2005, 24(5) (4) 小林.水的硬度与人体健康[J].健康,2001/11 (5) 曹名.硬水软水的区别[J].广西质量监督导报,2003/06
(6)
/kns50/classical/singledbindex.aspx?ID
=1
(7) /kns50/
2、0.02mol. L-1EDTA标准溶液的标定
称取0.4g烘干 的CaCO3
放入250ml烧杯
去离子水润湿
取25ml标准溶液
4 EDTA标准溶液的配制标定及水中钙镁离子含量的测定

EDTA标准溶液配制标定及水中钙镁离子含量的测定一.实验目的1. 掌握配位滴定的原理,了解配位滴定的特点;2. 掌握标定EDTA的基本原理及方法;3. 了解缓冲溶液的应用;4. 了解水的硬度测定意义和常用硬度表示方法;5. 掌握EDTA法测定水的硬度的原理、方法和计算;6. 掌握络合滴定指示剂的应用,了解金属指示剂的特点;7. 熟练掌握吸管和容量瓶的基本操作。
二.实验原理乙二胺四乙酸二钠盐简称EDTA,由于EDTA与大多数金属离子形成稳定的1:1型螯合物,故常用作配位滴定的标准溶液。
标定EDTA溶液的基准物有Zn,ZnO,CaCO3,Cu,Bi,MgSO4·7H2O,Ni,Pb等。
通常选用的标定条件应尽可能与测定条件一致,以免引起系统误差,如果用被测元素的纯金属或化合物作基准物质,就更为理想。
常见用纯金属锌作基准物标定EDTA,可以用铬黑T作指示剂,用氨缓冲溶液,在pH = 10进行标定。
也可用钙指示剂、二甲酚橙作指示剂,用六亚甲基四胺调节酸度,在pH = 5~6进行标定。
本实验中采用CaCO3作为基准物,用HCl把CaCO3溶解制成钙标准溶液,用K-B指示剂(两种指示剂复配而成,可以使颜色变化更明显)指示滴定终点。
在氨性缓冲溶液(pH = 10)中用EDTA溶液滴定至溶液由紫红色变成蓝绿色为终点。
滴定前Ca2++ In = CaIn纯蓝色酒红色滴定开始至终点前Ca2++ Y = CaY终点时CaIn + Y = CaY + In酒红色纯蓝色水的硬度主要是指水中含有的钙盐和镁盐,其他金属离子如铁、铝、锰、锌等离子也形成硬度,但一般含量甚少,测定工业用水总硬度时可忽略不计。
测定水的硬度常采用配位滴定法,用乙二胺四乙酸二钠盐(EDTA)溶液滴定水中Ca、Mg总量,然后换算为相应的硬度单位。
若水样中存在Fe3+、Al3+等微量杂质时,可用三乙醇胺进行掩蔽,Cu2+、Pb2+、Zn2+等重金属离子可用Na2S或KCN掩蔽。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化验室EDTA滴定法测定水质钙镁离子操作规程
一、引用标准
GB/T15452-2009工业循环冷却水中钙、镁离子的测定EDTA滴定法二、方法提要
钙离子测定是在pH为12~13时,以钙—羧酸为指示剂,用EDTA标准滴定溶液测定水样中的钙离子含量。
滴定时EDTA与溶液中游离的钙离子仅应形成络合物,溶液颜色变化由紫红色变为亮蓝色时即为终点。
镁离子测定是在pH为10时,以铬黑T为指示剂,用EDTA标准滴定溶液测定钙、镁离子含量,溶液颜色由紫红色变为纯蓝色即为终点,由钙镁含量减去钙离子含量即为镁离子含量。
三、试剂和材料
1、硫酸溶液:1+1。
2、过硫酸钾溶液:40g/L,存储于棕色瓶中(有效期1个月)。
3、三乙醇胺溶液:1+2。
4、氢氧化钾溶液:200g/L。
5、氨-氯化铵缓冲溶液(甲):pH=10;54gNH4Cl与350mL浓氨水,加少量水溶解,待温度在室温时,定容至1L棕色容量瓶中,上下颠倒混合均匀。
6、乙二胺四乙酸二钠标准溶液:c(EDTA)约0.01moL/L。
7、钙—羟酸指示剂:0.2g钙–羧酸指示剂[2-羟基-1-(2-羟基-4-磺基-1-萘偶氮)-3-萘甲酸]与100g氯化钾混合研磨均匀,存储于磨口瓶中。
8、铬黑T指示剂液:溶解0.50g铬黑T﹝1-(1-羟基-2-萘偶氨-6-硝基-萘酚-4-磺酸钠)﹞于85mL三乙醇胺中,再加入15mL乙醇。
四、分析步骤
1、钙离子的测定
用移液管移取50mL过滤后的水样于250mL锥形瓶中,加入1mL硫酸溶液和5mL过硫酸钾溶液,加热煮沸至近干,取下冷却至室温向其中加入50mL 水、3mL三乙醇胺溶液、7mL氢氧化钾溶液和约0.2g钙—羧酸指示剂,用EDTA标准滴定液滴定,近终点时速度要缓慢,当溶液颜色由紫红色变为亮蓝色时即为终点。
2、镁离子的测定
用移液管移取50mL过滤后的水样于250mL锥形瓶中,加入1mL硫酸溶液和5mL过硫酸钾溶液,加热煮沸至近干,取下冷却至室温加50mL水、3mL 三乙醇胺溶液。
用氢氧化钾溶液调节pH近中性,再加5mL氨—氯化胺缓冲溶液和3滴铬黑T指示液,用EDTA标准滴定液滴定,近终点时速度要缓慢,当溶液颜色由紫红色变为纯蓝色时即为终点。
注:(1)原水(未经过任何人工净化处理的水)中的钙、镁离子含量测定时不用加硫酸及过硫酸钾加热。
(2)过硫酸钾用于氧化有机磷系药剂以消除测定的干扰。
(3)三乙醇胺用于消除铁、铝离子对测定的干扰,原水中钙、镁离子测定不加入。
五、结果计算
1、钙离子含量以质量浓度C1计,数值以mg/L表示,按式(1)计算:
C1=V1CM1/V×1000
式中:
V1──滴定钙离子时,消耗EDTA标准滴定溶液的体积的数值,单位为毫升(mL);
C──EDTA标准滴定溶液的浓度的准确数值,单位为摩尔每升(moL/L);
V──所取水样的体积数值,单位为毫升(mL);
M1──钙的摩尔质量的数值,单位克每摩尔(g/moL)(M1=40.08)。
2、镁离子含量以质量浓度C2计,数值以mg/L表示,按式(2)计算:
C2=(V2-V1)CM2/V×1000
式中:
V1──滴定钙离子时,消耗EDTA标准滴定溶液的体积的数值,mL;
V2──滴定钙、镁合量时,消耗EDTA标准滴定溶液的体积的数值,mL;
C──EDTA标准滴定溶液的浓度的准确数值,moL/L;
V──所取水样的体积数值,mL;
M2──镁的摩尔质量的数值,g/moL(M2=24.31)。
六、测定结果允许差
取平行测定结果的算术平均值为测定结果,平均测定结果的允许差不大于0.4mg/L。
