物质的量及有关计算
物质的量的计算公式

物质的量的计算公式: n=m/M=V
(g)/Vm=N/N
A=c*V
(aq)
式中 n 为物质的量,单位为mol ;
m 为物质质量,单位为g;
M 为摩尔质量,单位为 g?mol;V(g)为气体体积,单位为 L;Vm 为气体摩尔体积,单位为 L?mol;
N 为粒子个数, NA 为 xx 德罗常数
6.02 × 10mol-1;
c 为物质的量浓度,单位为mol?L-1
-1
-1
23
或者 mol?mL;V(aq)为溶液体积,单位为L 或 mL;- 1
物质的量浓度是溶液中溶质的物质的量浓度的简称,通常它是以单位体积里所含溶质 B(B表示各种溶质 )的物质的量来表示溶液组成的物理量,叫做溶质
B 的物质的量浓度。
物质的量浓度是一种重要的浓度表示法,符号 c(B)。
常用单位为 mol/L。
物质的量浓度的基本公式为:
c(B)=n( B)/V (B 表示各种溶质)
质量分数( w)溶质的质量与溶液的质量之比称为溶质的质量分数。
w=m(溶质) /m (溶液)(× 100%)m 密度的定义式:=V
1 / 2
33
33
密度的单位:
在国际单位制中,密度的单位是千克/米(kg/m)
其它常用单位还有克/厘米1g/cm=10kg/m
溶液稀释的有关公式:
C1(浓溶液) V1(浓溶液) =C2(稀溶液) V2(稀溶液)
2 / 2。
物质的量所有公式

物质的量所有公式
1物质的量
物质的量是指物质的定义特性之一,可以衡量物质的总量,以及量的大小。
物质的量用数学和物理学的术语来表示,这是物质的基本性质和特性。
使用“量”一词,这一概念有一些不同的含义:它可以是物质的总量,物质相对于某一参照物的量,物质总量比以及物质总量的变化。
2常见公式
1.物质的总量公式:物质总量=比例(物质单位)×数量(物质单位)
2.比例公式:物质的比例=物质总量÷物质数量
3.物质总量比公式:物质总量比=比较物质总量÷参照物质总量4.物质总量变化公式:物质总量变化=(末总量-初总量)÷初总量
3工程应用
物质的量在学术领域中有重要的工程应用,如在化学、气体动力学、水资源管理、能源管理、材料数据处理等领域。
物质总量的计算可以用来比较不同时间或不同环境的物质量。
它也可以用于推算物质的密度和浓度。
此外,可以使用物质总量公式来确定物质的比例关系,从而正确设计工程和实验,改善工程和实验的可重复性。
4结论
物质的量是物质的基本性质和特性,使用相关公式可以计算出物质总量、比例、总量比和总量变化,并且推算物质的密度和浓度,物质总量的计算可以用来比较不同时间和环境的状态,有重要的工程应用。
物质的量及有关计算

物质的量及有关计算【基础知识】一、物质的量符号:n1、国际单位制规定的七个基本物理量之一。
(长度、质量、时间、物质的量等)2、物质的量是含有一定数目粒子的。
即表示物质所含原子、分子、离子等微观粒子的多少。
3、物质的量的单位:符号:mol4、1摩尔任何物质都含有阿伏加德罗常数个结构微粒,因此,1mol任何粒子集体所含有的粒子数相等.二、阿伏加德罗常数符号:N A1、1mol任何粒子含有阿伏加德罗常数个粒子。
通常使用 mol—这个近似值。
例:1molCO2在任何情况下,都含有N A个CO2分子,约为6.02×1023个。
三、摩尔质量符号:M1、单位物质的量的物质所具有的质量,即每摩尔物质所具有的质量,数值上等于该物质的。
22四、气体摩尔体积符号:Vm1、表示:单位物质的量的气体所占有的体积.2、单位:常用的是:L/molmn——气体的物质的量(单位:mol)4、标准状况下,任何气体的气体摩尔体积都约为 L/mol.不在标准状况时,气体摩尔体积不一定为22.4 L/mol。
5、用到22.4 L/mol时一定要同时满足两个条件:①标准状况;②气体。
五、阿伏加德罗定律1.内容:在同温同压下,同体积的气体含有相同的分子数.即“三同"定“一同”。
2.注意:阿伏加德罗定律也适用于不反应的混合气体。
阿伏加德罗常数这类题的解法:① 状况条件:考查气体时经常给非标准状况如常温常压下,1。
01×105Pa 、25℃时等。
② 物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H 2O 、乙醇等.③ 物质结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及稀有气体He 、Ne 等为单原子组成的分子.六、物质的量浓度 符号:C B1、以单位体积溶液里所含溶质的物质的量来表示溶液组成的物理量.2、单位:常用mol/L3、C B =V nn B ——溶质的物质的量(单位:mol ),V-—溶液体积(单位常取:L ),C B —-n B 是V 与的比值(单位:mol/L )七.一定物质的量浓度溶液的配制步骤:计算、 、 (注意: )、转移、 、 、 、装瓶贴签.八、本节书所涉及到的公式包括:【难点突破】1.方法与技巧(1)充分利用物质的量与各量间的关系(2)充分利用物质的量浓度与质量分数、溶解度间的关系(3)充分利用守恒关系、十字交叉法、差量法等解题技巧2.解题注意点(1)对气体来说,在解题时要特别注意气体所处的外界条件,因温度、压强不同,等物质的量的气体所占的体积不同。
(完整)物质的量的公式和比例

物质的量的公式和比例1.万能公式和比例(适用于任何状态,任何条件)n=m/M n=N/NA n1:n2=N1:N22.只适用于气体的公式和比例:n=V/Vm(在标况下,Vm=22.4L/mol)同温同压同体积,气体的分子数相等(物质的量也相等)同温同压,气体的体积之比等于分子数之比(物质的量之比)同温同体积,气体的压强之比等于分子数之比(物质的量之比)同温同压,气体的密度之比等于摩尔质量之比(用来计算气体的摩尔质量)3.计算摩尔质量的方法:(1)公式法:M=m/n(2)摩尔质量在数值上等于1mol物质的总质量,M=N A`m o(m o为一个粒子的质量,该粒子可以是分子,原子等)(3)摩尔质量在数值上等于相对原子质量,M=m o/(C-12质量的1/12),(m o为一个原子的质量)(4)平均摩尔质量法:M平=m总/n总=(n1M1+n2M2)/(n1+n2)=[M1(n1/n总)]/[M2(n2/n总)]=[M1(V1/V总)]/[M2(V2/V总)]V1/V总是气体的体积分数=n1/n总,做题时注意思维的迁移(5)相对密度法:ρ1:ρ2=M1:M2(已知某气体对氢气的相对密度为16,则该气体的摩尔质量为16×2=32)(6)标况密度法:M=22。
4ρ(标况)(依据为:M=1mol气体的总质量)4。
有关浓度的公式和相互换算:(1)c=n/V有关溶液体积V的处理:若不知道溶液的密度,一般要近似处理.几种液体混合,溶液总体积=几种液体的体积之和气体溶于液体,溶液总体积=液体的体积固体溶于液体,溶液总体积=液体的体积若已知所得溶液的密度,溶液的总体积=溶液的质量/溶液的密度ρg/cm3=1000ρg/L (2)w=m质/m液溶液的质量=溶液的体积×溶液的密度(3)溶液浓缩和稀释—-溶质的量(质量或物质的量)不变c1V1=c2V2 m1W1=m2W2(4)已知溶液的物质的量浓度,求质量分数w= m质/m液= (n质M质)/(ρ液V液)= cM/ρ[ρg/cm3=1000ρg/L](5)已知质量分数,求物质的量浓度c= n质/V液= (m质/M质)/(m液/ρ液) = wρ液/M质 [ρg/cm3=1000ρg/L]。
物质的量11个公式

物质的量11个公式以物质的量11个公式为标题,本文将介绍有关物质量的基本概念、计算方法和物质量在实际应用中的重要性。
1. 物质的量(n) = 质量(m)/摩尔质量(M)物质的量是物质中所含化学实体的数量,通常用摩尔表示。
摩尔质量是指一个物质的相对分子质量或相对原子质量。
2. 摩尔质量(M) = 质量(m)/物质的量(n)摩尔质量是指物质中每个摩尔所含的质量。
对于元素而言,摩尔质量等于相对原子质量;对于化合物而言,摩尔质量等于分子量。
3. 质量分数(w) = 溶液中溶质的质量(m1)/溶液的总质量(m2)质量分数是指溶液中溶质的质量与溶液总质量之比,常用于描述溶液中的浓度。
4. 摩尔浓度(C) = 物质的量(n)/溶液的体积(V)摩尔浓度是指单位体积溶液中溶质的摩尔数,通常用mol/L表示。
5. 摩尔体积(Vm) = 摩尔质量(M)/密度(ρ)摩尔体积是指物质一摩尔的体积,通常用L/mol表示。
6. 摩尔热容(Cm) = 热容(c)/摩尔质量(M)摩尔热容是指单位摩尔物质在温度变化时所吸收或释放的热量。
7. 反应物的摩尔比 = 反应物的物质的量(n1)/反应物的物质的量(n2)反应物的摩尔比是指化学反应中反应物之间的摩尔比,用于计算反应物的化学计量。
8. 摩尔反应热(Q) = 反应物的物质的量(n) × 反应热(ΔH)摩尔反应热是指化学反应中单位摩尔反应物参与反应所放出或吸收的热量,通常用kJ/mol表示。
9. 等温吸附量(q) = 吸附质的质量(m1)/吸附剂的质量(m2)等温吸附量是指吸附剂单位质量所吸附的吸附质的质量,常用于描述吸附剂的吸附能力。
10. 摩尔吸附量(qm) = 吸附剂的质量(m)/吸附质的物质的量(n)摩尔吸附量是指单位质量吸附剂所吸附的吸附质的物质的量,通常用mol/g表示。
11. 摩尔传导率(Km) = 电导率(κ) × 摩尔电导率(λm)摩尔传导率是指单位浓度溶液的电导率与摩尔电导率之积,常用于描述电解质在溶液中的传导能力。
关于物质的量的计算

精心整理关于物质的量的计算1、物质的量的基本概念(1)物质的量:表示含一定数目粒子的集合体。
符号:n(2)摩尔:物质的量的单位。
符号:mol①它反映了化学反应的实质;②它把看不见的、不可量度的粒子数(微观量)和看得见的、可量度的质量或体积(宏观量)联系起来了;③它把气体的体积和分子数联系起来了;④可以建立以物质的量为中心的,联系其它各种物理量的一个完整的化学计算体系;⑤由于化学方程式中各物质的化学计量数之比既是粒子数比,又是物质的量之比,也是相同条件下气体的体积比。
这种比值较相应的质量比简单,因此,用物质的量的关系进行计算就比较简捷。
=摩尔质量大的质量就大。
=⑥ 1 mol分子(或原子)的质量是1个分子(或原子)质量的6.02×1023倍。
⑦不同元素的相对原子质量之比等于其摩尔质量之比;不同分子的相对分子质量之比等于其摩尔质量之比。
⑧化学反应方程式中,各物质的化学计量数之比既是粒子数之比,也是物质的量之比。
?化学反应定律?提示:高中化学计算主要是以物质的量为中心的计算,学习中要养成把其他物理量转化为物质的量这一思维模式4.有关物理量及符号、单位(1)配制溶液时,需要根据所选择容量瓶的容量和溶液的物质的量浓度,称取一定质量的固体溶质或量取一定体积的液体溶质。
(2)不能配制任意体积的一定物质的量浓度的溶液。
这是因为在配制的过程中是用容量瓶来定容的,而容量瓶的规格是有限的,常用的有50 mL、100 mL、150 mL、200 mL、250 mL、500 mL、1000 mL等。
所以只能配制溶液体积与容量瓶容积相匹配的一定物质的量浓度的溶液。
(3)在配制一定物质的量浓度的溶液时,不能直接将溶质放入容量瓶中进行溶解,而要在中溶解,待烧杯中溶液的温度恢复到室温时,才能将溶液转移到容量瓶中。
7、阿伏加德罗常数常考八大方面中含有的氯原子数目(1)考物质的状态:标准状况下,22.4 L CHCl3为3NA为液态错,标准状况下,CHCl3(2)考分子的组成:10 g氖(相对原子质量为2)气所含分子数为0.25NA错,氖为单原子分子(3)考粒子的质量:任何条件下,48 g O3气体含有6.02×1023个O3分子对,质量与条件无关(8)考反应原理:常温常压下,4.6 g NO2气体含有0.602×1023个NO2分子。
物质的量及有关计算

物质的量及有关计算物质的量是化学中的基本概念之一,它描述了物质中含有的粒子的数量。
物质的量可以用摩尔(mol)作为单位表示,它与质量和体积的关系密切相关。
在化学反应和物质转化中,了解物质的量十分重要,因为它可以帮助我们计算反应的产量、理解反应机理以及解决各种化学问题。
物质的量与质量的关系可以通过物质的摩尔质量来建立。
摩尔质量是指一个物质中含有的摩尔数与质量之间的比率,通常以克/摩尔(g/mol)表示。
例如,氧气(O₂)的摩尔质量是32g/mol,这意味着1摩尔的氧气质量为32克。
利用摩尔质量,可以进行物质的量和质量之间的转换。
具体而言,物质的质量可以通过以下公式计算:质量(g)= 物质的量(mol)× 摩尔质量(g/mol)同样地,物质的量也可以通过以下公式计算:物质的量(mol)= 质量(g)÷ 摩尔质量(g/mol)通过这些计算,可以轻松地将一个量值转换为另一个量值,从而使得我们可以更好地理解物质的性质和相互作用。
在化学反应的计算中,物质的量也起着关键的作用。
在平衡反应方程式中,反应物和生成物的系数表示了它们之间的物质的量的比例。
通过平衡反应方程式,可以确定化学反应中物质的量的变化,并从中推导出反应的产量。
例如,平衡反应方程式2H₂+O₂→2H₂O表明,2摩尔的氢气反应与1摩尔的氧气生成2摩尔的水。
如果我们知道初始物质的量,那么我们就可以计算出反应的产量。
物质的量还可以用于计算溶液中的浓度。
浓度是指溶质在溶剂中的物质的量与溶液体积之间的比率。
通常,浓度以摩尔/升(mol/L)表示。
浓度的计算可以通过以下公式进行:浓度(mol/L)= 物质的量(mol)÷ 溶液体积(L)利用这个公式,我们可以计算出溶液中溶质的浓度,并根据浓度的变化来了解溶液中物质的量的变化。
物质的量计算在其他领域也有广泛应用。
在分析化学中,我们可以利用光谱学或电化学方法来确定产生或消耗的物质的量。
物质的量及相关计算

★ ★注意:不能认为摩尔质量就是式量。
摩尔质量是有单位的,而式量是没有单位的。
描述一种物质的摩尔质量时后面必须要带上单位g/mol ,否则就是错误的。
物质的量n ,物质的摩尔质量M 与质量m 之间的关系:n=m/M相对原子质量:Fe-56 C-12 O-16 H-1 N-14 例3①求物质的质量(1)1mol 氧原子的质量为16×1g 。
解析:由n=m/M 知m=nM=1mol ×16g/mol=16g (2)3mol 二氧化碳分子的质量为44×3 g 。
(3)4mol 铁的质量为____________________g 。
(4)2mol 水的质量为____________________g 。
②.求物质的量(1)112g 铁含铁2mol 。
(2)48g 水含水_________mol 。
链接中考:1.“物质的量”是国际单位制中的一个基本物理量,有关说法正确的是( )A.18gH 2O 含有3mol 原子 B .1mol CO 2中约含6.02×1023个氧原子 C .0.5molO 2约含6.02×1023个氧 D .CO 的摩尔质量是28g 2.“物质的量”是国际单位制中的一个基本物理量,有关说法正确的是( ) A .28gN 2含lmol 氮 B .1molO 2约含6.02×1023个氧原子 C .lmolCO 2含有3mol 原子 D .H 2O 的摩尔质量是183.SiO 2是制造光导纤维的主要原料,下列关于SiO 2的说法正确的是 ( ) A .SiO 2的摩尔质量是60 B .1mol SiO 2中含有1molO 2C .1.5mol SiO 2中含有18.06×1023个氧原子D .1mol SiO 2的质量是60g/mol 4.下列说法正确的是 ( ) A.18gH 2O 中含有2mol 氢B.1molSO 3比1molSO 2多一个氧原子C.1mol 任何物质都含有约6.02×1023个原子D.1molO 3中约含有1.806×1024个氧原子5.二氧化硫是空气污染物之一,关于其描述正确的是 ( )A .二氧化硫的摩尔质量为64g/molB .1mol SO 2中约含有6.02×1023个原子C .2mol SO 2的质量为64 gD .3mol SO 2中含有3mol 氧原子(二)有关物质的量、摩尔质量及其相关计算(1)有关物质的量的计算,实质就是利用公式n=m/M 进行计算,学生只要熟记公式并会运用即可。
物质的量浓度及相关计算

物质的量浓度及相关计算1.溶液组成的两种表示方法 (1)物质的量浓度(c B )(2)溶质的质量分数(w )①概念:用溶质的质量与溶液质量的比值来表示溶液组成的物理量,一般用百分数表示。
②表达式:w =m (溶质)m (溶液)×100%。
2.物质的量浓度的有关计算 (1)物质的量浓度计算的两要素 ①溶质确定 与水发生反应生成新的物质: 如Na 、Na 2O 、Na 2O 2――→水NaOH ; SO 3――→水H 2SO 4;NO 2――→水HNO 3。
特殊物质:如NH 3溶于水后溶质为NH 3·H 2O ,但计算浓度时仍以NH 3作为溶质。
含结晶水的物质: CuSO 4·5H 2O ―→CuSO 4;Na 2CO 3·10H 2O ―→Na 2CO 3。
②溶液体积确定:不是溶剂体积,也不是溶剂体积与溶质体积之和,可以根据V =m (溶液)ρ(溶液)求算。
(2)计算类型①标准状况下,气体溶于水形成溶液的物质的量浓度的计算⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫溶质的物质的量n =V 气体22.4 L·mol -1溶液的体积V =m ρ=m 气体+m 水ρc =n V ②溶液中溶质的质量分数与物质的量浓度的换算推导过程(以1 L 溶液为标准):1 L(1 000 mL)溶液中溶质质量m (溶质)=1_000ρ×w g n (溶质)=1 000ρw M mol 溶质的物质的量浓度c =1 000ρw M mol·L -1。
(c 为溶质的物质的量浓度,单位mol·L -1,ρ为溶液的密度,单位g·cm -3,w 为溶质的质量分数,M 为溶质的摩尔质量,单位g·mol -1) ③溶解度与质量分数的关系某温度下饱和溶液质量分数(w )与溶解度(S )的换算公式:w =S100+S100%。
3.溶液稀释与混合的计算 (1)溶液稀释①溶质的质量在稀释前后保持不变,即m 1w 1=m 2w 2。
物质的量经典例题计算过程

物质的量经典例题计算过程物质的量是描述物质数量的物理量,用单位摩尔(mol)表示。
计算物质的量需要知道物质的质量和相应物质的摩尔质量。
一般来说,计算物质的量的公式为:物质的量(mol)= 质量(g)/ 摩尔质量(g/mol)以下是几个经典的例题,包括计算物质的量、质量和摩尔质量的过程和方法。
例题1:计算铁(Fe)的物质的量。
已知质量为10g,求物质的量。
解答:首先,我们需要知道铁的摩尔质量。
根据元素周期表,铁的摩尔质量约为55.845g/mol。
将已知的质量和铁的摩尔质量代入公式:物质的量(mol)= 质量(g)/ 摩尔质量(g/mol)物质的量= 10g / 55.845g/mol ≈ 0.1788 mol所以,铁的物质的量约为0.1788 mol。
例题2:计算硫酸铜(CuSO4)含有的铜(Cu)的质量。
已知硫酸铜的物质的量为0.1 mol,求铜的质量。
解答:首先,我们需要知道硫酸铜和铜的摩尔质量。
硫酸铜(CuSO4)的摩尔质量可通过元素周期表得知:63.546g/mol (Cu) + 32.07g/mol (S) + 4 * 16.00g/mol (O) ≈ 159.60g/mol 铜(Cu)的摩尔质量可直接从元素周期表得知:63.546g/mol将已知的物质的量和硫酸铜的摩尔质量代入公式:质量(g)= 物质的量(mol)* 摩尔质量(g/mol)质量= 0.1 mol * 159.60g/mol ≈ 15.96g所以,硫酸铜含有的铜的质量约为15.96g。
例题3:计算氯化钠(NaCl)溶液中的氯离子(Cl-)的物质的量。
已知氯化钠的物质的量为0.5 mol,求氯离子的物质的量。
解答:首先,我们需要知道氯化钠和氯离子的摩尔质量。
氯化钠(NaCl)的摩尔质量可通过元素周期表得知:22.99g/mol (Na) + 35.45g/mol (Cl) ≈ 58.44g/mol氯离子(Cl-)的摩尔质量可直接从元素周期表得知:35.45g/mol由于氯化钠中的氯离子与钠离子的物质的量相等,所以氯离子的物质的量也为0.5 mol。
物质的量及其计算
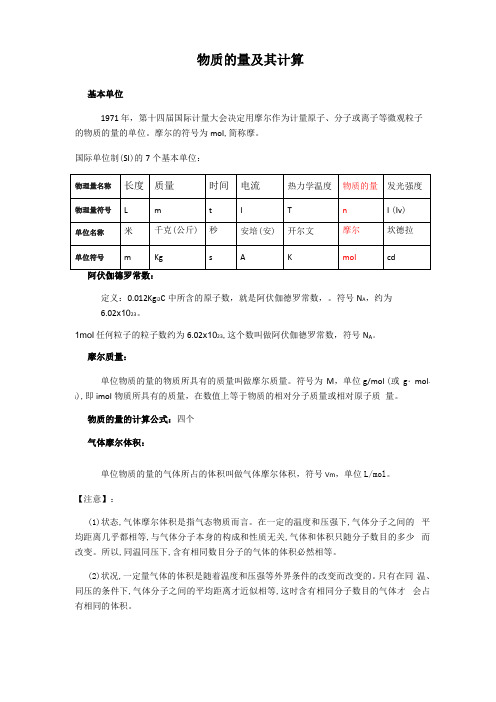
物质的量及其计算基本单位1971 年,第十四届国际计量大会决定用摩尔作为计量原子、分子或离子等微观粒子的物质的量的单位。
摩尔的符号为mol,简称摩。
国际单位制(SI)的7个基本单位:定义:0.012Kg i2C中所含的原子数,就是阿伏伽德罗常数,。
符号N A,约为6.02x1023。
1mol任何粒子的粒子数约为6.02x1023,这个数叫做阿伏伽德罗常数,符号N A。
摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量。
符号为M,单位g/mol (或g・mol-i),即imol物质所具有的质量,在数值上等于物质的相对分子质量或相对原子质量。
物质的量的计算公式:四个气体摩尔体积:单位物质的量的气体所占的体积叫做气体摩尔体积,符号Vm,单位L/mol。
【注意】:(1)状态,气体摩尔体积是指气态物质而言。
在一定的温度和压强下,气体分子之间的平均距离几乎都相等,与气体分子本身的构成和性质无关,气体和体积只随分子数目的多少而改变。
所以,同温同压下,含有相同数目分子的气体的体积必然相等。
(2)状况,一定量气体的体积是随着温度和压强等外界条件的改变而改变的。
只有在同温、同压的条件下,气体分子之间的平均距离才近似相等,这时含有相同分子数目的气体才会占有相同的体积。
阿伏伽德罗定律的推论:(通过PV=nRT来推导,这个是理想气体状态方程)物质的量、气体的体积和气体摩尔体积之间的关系:当气体处于0℃,1.01x105Pa时,即标准状况下,V m x 22.4 L/mol阿伏伽德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
推论1:同温、同压下,气体体积比等于其物质的量之比:推论2:同温、同压、同体积的两种气体,质量比等于相对分子质量比:推论3:同温、同压的两种气体,密度之比等于其相对分子质量之比:(通过PV=nRT来推导,这个是理想气体状态方程)物质的量浓度的换算(1)物质的量浓度的定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度;单位:mol/L(2)在一定物质的量浓度的溶液中,溶质B的物质的溶液的体积和溶质的物质的量浓量、度之间的关系为:溶质的物质的量士43 物质的量浓度=溶液的体积表达式:溶液中溶质的质量分数与溶质的物质的量浓度的换算:例:某市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3.计算该市售浓硫酸中H2SO4 的物质的量浓度。
物质的量及化学计算

第七节 物质的量及其化学计算(过量、差量、混合物计算)一、物质的量及其单位1.国际单位制的基本物理量及其单位 在国际单位制(SI 制),只有7个基本物理量,它们有我们学过的质量、时间、长度、电流强度,还有为学习过的热力学温度和物质的量等。
其他的物理量如:密度、速度等全是导出物理量。
2.物质的量及其单位物质的量(n )是国际单位制7个基本物理量之一,表示物质含有一定数目粒子的集体。
单位为摩尔(mol )。
摩尔是物质的量的单位。
1 mol 物质含有阿伏伽德罗常数(N A )个基本粒子。
3.1 mol 的标准和阿伏伽德罗常数(N A )1 mol 的标准:国际单位制规定,1 mol 物质含有阿伏伽德罗常数(N A )个基本粒子。
阿伏伽德罗常数(N A ):0.012 kg 12C 所含碳原子数目定义为阿伏伽德罗常数(N A )。
23260.012 6.021101.99310A kgN kg-==⨯⨯ 为了使阿伏伽德罗常数(N A )更好地服务于物质的量及其单位,阿伏伽德罗常数(N A )可定义其单位为“1mol -个”,简写为“1mol -”。
所以在高中2316.0210A N mol -≈⨯。
【练习】完成下列填空:①1 mol H 2O 约含 个H 2O 分子,约含 个H 原子,约含 个电子,约含 个质子。
②1 mol H 2SO 4约含 个H 2SO 4分子,约含 个H 原子,约含 个个O 原子,约含 个电子,约含 个质子。
③约含233.0110⨯个H 2SO 4分子其物质的量为 。
二、摩尔质量1.摩尔质量:单位物质的量的物质所占的质量称为摩尔质量,用M 表示,单位为1g mol - 。
A N n N = m n M =1.下列关于物质的量的说法正确的是A.物质的量就是物质的质量B.物质的量就是物质的数量C.物质的量可以改为物质量D.物质的量是一物理量,所表示的意义是含有一定数目粒子的集体2.下列关于阿伏加德罗常数的书法正确的是A.阿伏加德罗常数是一个纯数,没有单位B.阿伏加德罗常数就是6.02×1023C.阿伏加德罗常数是指1mol的任何粒子的粒子数D.阿伏加德罗常数的近似值为6.02×1023mol-13.下列关于摩尔的说法正确的是A.摩尔是一物理量,是6.02×1023个粒子B.摩尔是物质质量的单位C.摩尔是表示物质的量的单位D.1mol的标准是0.012kg 12C中所含的原子数目4.0.5mol氧气中含有A.1个氧原子B.约6.02×1023个氧原子C.1mol氧原子D.0.5个氧分子5.下列叙述正确的是A.1molKClO3中含有3mol氧元素B.1molKClO3中含有3mol氧原子C.1molKClO3中含有1.5molO2 D.1molKClO3中含有1molCl-6.3.01×1024个H2SO4分子中氢原子的物质的量为A.0.5mol B. 1mol C. 5mol D. 10mol7.0.5mol H2O与0.5mol NH3中含有相同的A.质子数 B. 中子数 C. 分子数 D. 氢原子数8.下列数值等于阿伏加德罗常数的数值的是A.1mol Fe2+ 还原成单质需要结合的电子数B.1mol He 含有的原子数C.1mol H+含有的电子数D.1mol H2含有的质子数9.在MgCl2、KCl、K2SO4三种盐的混合液,若K+、Cl- 各0.5mol,Mg2+为0.5mol,则SO42-的物质的量为A.0.1mol B. 0.5mol C. 0.15mol D.0.25mol10.在一定条件下Cl2与NH3反应生成NH4Cl 和N2,反应中转移1.2 mol电子时,被氧化的还原剂为A.0.4 mol B. 1.6 mol C. 0.6 mol D. 以上都不是11.多少摩尔CaCl2溶解在1mol H2O 中,才能使Cl-与H2O 分子的物质的量之比为1:10 A.0.1mol B. 10mol C. 0.5mol D. 0.05mol二、填空题12.2 mol CO(NH2)2 中含有mol碳原子,mol氮原子,氢原子,所含的氧原子数与mol H2O 所含氧原子数相等。
化学方程式的物质的量与计算

化学方程式的物质的量与计算化学方程式是描述化学反应的重要工具,它可以清晰地展示反应涉及的化学物质以及它们之间的相对比例。
了解化学方程式中物质的量与计算方法对于理解和推导化学反应过程中的相关信息非常重要。
本文将详细介绍化学方程式中物质的量的概念和计算方法。
一、物质的量的概念物质的量是用来表示化学反应中参与物质的数量的物理量,用化学符号n表示。
其国际单位是摩尔(mol)。
摩尔是指一个物质内含有的基本粒子(如原子、分子或离子)的数量,其数值等于物质的质量除以该物质的摩尔质量。
二、化学方程式中物质的量的关系化学方程式中不同物质的物质的量之间存在着一定的比例关系,这种比例关系可以通过方程式的配平来确定。
在方程式中,化学物质的系数即表示物质的量的比例关系。
例如以下简单的化学方程式:2H₂ + O₂ → 2H₂O方程式中的2表示了氢气和氧气的物质的量的比例为1:1,同时也说明了水的生成需要2个氢气分子和1个氧气分子。
三、计算物质的量的方法在化学反应中,根据反应物质的质量或体积可以计算出物质的量。
以下是常用的计算物质的量的方法:1. 根据质量计算物质的量利用给定物质的质量和相应物质的摩尔质量,可以计算出物质的量。
计算公式如下:物质的量(mol)= 质量(g)/ 摩尔质量(g/mol)例如,若有10克的氧气,其摩尔质量为32 g/mol,那么氧气的物质的量可以计算为:物质的量(mol)= 10 g / 32 g/mol = 0.3125 mol2. 根据体积计算物质的量对于气体,可以利用给定的体积和相应气体在特定条件下的摩尔体积来计算物质的量。
计算公式如下:物质的量(mol)= 体积(L)/ 摩尔体积(mol/L)例如,若有4升的氢气,在标准状况下(摩尔体积为22.4 L/mol),那么氢气的物质的量可以计算为:物质的量(mol)= 4 L / 22.4 mol/L = 0.179 mol四、利用物质的量计算其他相关量物质的量是化学反应中各种相关量的基础。
物质的量浓度及相关计算

「思维建模」 物质的量浓度有关计算的一般方法
(1)由定义出发,运用守恒(溶质守恒、溶剂守恒等)及公式:c=、溶质质量分数=×100%进行推理,注意密度的桥梁作用,不要死记公式。
(2)气体溶于水,溶质是该气体与水反应生成的物质,NH3溶于水后主要溶质是NH3·H2O,但以NH3计算。
(3)气体溶于水,溶液的体积不是溶剂的体积更不是气体体积与溶剂体积之和,应根据V=进行计算。
c===或w===。
类型三 溶液稀释和同种溶质的溶液混合的计算
(1)溶液稀释
①溶质的质量在稀释前后保持不变,即m1w1=m2w2。
②溶质的物质的量在稀释前后保持不变,即c1V1=c2V2。
③溶液质量守恒,m(稀)=m(浓)+m(水)(体积一般不守恒)。
(2)溶液混合:混合前后溶质的物质的量保持不变,即:c1V1+c2V2=c混V混。
c(BaCl2)=c(Ba2+)=c(Cl-)。
0.1 mol/L的醋酸溶液中:c(H+)<0.1 mol/L。
②根据溶液中离子的电荷守恒求未知离子浓度
如AlCl3和Na2SO4的混合溶液中满足:c(Al3+)×3+c(Na+)+c(H+)=c(Cl-)+c(SO)×2+c(OH-)。
3.(高考经典题)把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为()
5应用物质的量浓度进行计算时,要注意质量守恒和电荷守恒的应用。
考向1关于物质的量浓度、质量分数、溶解度的计算和换算
标准状况下VL氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρg·mL-1,溶质质量分数为w,物质的量浓度为cmol·L-1,则下列关系中不正确的是()
物质的量知识点公式

物质的量知识点公式物质的量(n)是描述物质数量多少的物理量,用单位摩尔(mol)表示。
物质的量与物质内含基本颗粒(例如原子、分子、离子等)数量之间有关联。
物质的量与物质内含的基本颗粒数量之间的关系可以通过以下公式来表示:n=N/Nₐ其中,n表示物质的量(单位为摩尔),N表示物质内含的基本颗粒数量(例如原子数、分子数、离子数等),Nₐ表示阿伏伽德罗常数,其近似值为6.0221×10²³/mol。
这个公式说明物质的量与物质内含基本颗粒数量成正比关系。
当物质内含的基本颗粒数量增加时,物质的量也相应增加;反之,当基本颗粒数量减少时,物质的量也减少。
需要注意的是,物质的量是一个宏观物理量,用于描述大量基本颗粒的总数量。
它与物质的微观结构(例如原子、分子等)以及物质的质量(m)之间有关联。
物质的质量(m)与物质的量(n)之间的关系可以通过以下公式来表示:m=M×n其中,m表示物质的质量(单位为克),M表示物质的摩尔质量(单位为克/摩尔),n表示物质的量(单位为摩尔)。
这个公式说明物质的质量与物质的量成正比关系。
当物质的量增加时,物质的质量也相应增加;反之,当物质的量减少时,物质的质量也减少。
通过物质的量与物质的质量之间的关系,可以在给定物质的量或物质的质量的情况下,计算出另一个物理量的值。
这在化学实验和计算中经常被应用到。
总结起来,物质的量与物质内含的基本颗粒数量以及物质的质量之间有着密切的关联。
物质的量可以通过物质内含基本颗粒数量除以阿伏伽德罗常数来计算,物质的质量可以通过物质的量乘以摩尔质量来计算。
这些公式为我们理解和计算物质的量提供了基础。
化学物质的量相关计算所有公式

化学物质的量相关计算所有公式物质的量相关计算公式1.物质的量=微粒数/阿伏伽德罗常数(n=N/NA)2.物质的量=物质的质量/物质的摩尔质量(n=m/M)3.物质的量=气体的体积/气体的摩尔体积(n=V/Vm)4.c=1000mL/Lρ(密度) w / M5:物质的量(mol)=物质的质量(g)/物质的摩尔质量(g/mol)6.c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液) 用浓溶液配制稀溶液时使用在稀释溶液时,溶液的体积发生了变化,但溶液中溶质的物质的量不变,即在溶液稀释前后,溶液的物质的量相等。
7.c混·V混=c1·V1+c2·V2+……+cn·Vn(有多少种溶液混合n就为几)8.同温同压时 V1/V2=n1/n2=N1/N2 正比同温同体积 P1/P2=N1/N2=n1/n2 正比同压同物质的量 V1/V2=T1/T2 正比同温同物质的量 V1/V2=P2/P1 反比同体积同物质的量 P1/P2=T1/T2 正比同温同压同体积 m1/m2=Mr1/Mr2=M1/M2 正比同温同压同质量 V1/V2=p1/p2=M2/M1 反比同温同体积同质量 p1/p2=Mr1/Mr2=M2/M1 反比同温同压密度1/密度2=Mr1/Mr2=M1/M2 正比9.n、V、Vm、N、NA、m、M、c的关系n=m/M=N/NA=V/Vm=cVPS:V----体积 p------压强T-----温度 n ------物质的量N ----分子数 Mr----相对分子质量M------摩尔质量 m-----质量c------物质的量浓度9.关于物质的量浓度与质量分数的转化(推导和演化)C=ρ·ω·1000/M其中,C:物质的量浓度(单位mol/L)ω:溶液的密度,(形式为质量分数,1)ρ:密度,(单位g/mL)M:物质的摩尔质量,(单位g/mol)c=n/Vn(溶质的物质的量)=ω_m(溶液质量)/Mm(溶液质量)=ρ· Vm(溶液溶质的质量)=ω(质量分数)·ρ(密度)·V故,n(溶质的物质的量)=ω·ρ·V / Mc= n/V=(ω·ρ· V /M) /V=ω·ρ· V /M V=ω·ρ/M若密度ρ单位为1000kg/m^3(国际单位)=1 g/cm^3.有关溶液稀释和浓缩的计算V1ρ1×ω1= V2ρ2×ω2 (溶质的质量守恒)C1V1=C2V2 (溶质的物质的量守恒)有关两种不同浓度溶液混合的计算C3V3 =C1V1+C2V2 (混合前后溶质的物质的量总和不变)高三化学差怎么办1、对基础不好的高三学生来讲,首先要明晰,不管是啥化学反应,全要从元素周期表的视角来思考。
物质的量及计算

物质的量及计算文件排版存档编号:[UYTR-OUPT28-KBNTL98-UYNN208]物质的量及有关计算【基础知识】一、物质的量符号:n1、国际单位制规定的七个基本物理量之一。
(长度、质量、时间、物质的量等)2、物质的量是含有一定数目粒子的。
即表示物质所含原子、分子、离子等微观粒子的多少。
3、物质的量的单位:符号:mol4、1摩尔任何物质都含有阿伏加德罗常数个结构微粒,因此,1mol任何粒子集体所含有的粒子数相等。
二、阿伏加德罗常数符号:NA1、1mol任何粒子含有阿伏加德罗常数个粒子。
通常使用mol-这个近似值。
例:1molCO2在任何情况下,都含有NA个CO2分子,约为×1023个。
三、摩尔质量符号:M1、单位物质的量的物质所具有的质量,即每摩尔物质所具有的质量,数值上等于该物质的。
2、单位:g/mol或kg/mol例:1molCO2的质量为44g,CO2的摩尔质量为44g/mol四、气体摩尔体积符号:Vm1、表示:单位物质的量的气体所占有的体积。
2、单位:常用的是:L/molV——气体摩尔体积(单位:L/mol),V——气体的体积(单位常取:L),mn——气体的物质的量(单位:mol)4、标准状况下,任何气体的气体摩尔体积都约为L/mol。
不在标准状况时,气体摩尔体积不一定为mol。
5、用到mol时一定要同时满足两个条件:①标准状况;②气体。
五、阿伏加德罗定律1.内容:在同温同压下,同体积的气体含有相同的分子数。
即“三同”定“一同”。
2.注意:阿伏加德罗定律也适用于不反应的混合气体。
阿伏加德罗常数这类题的解法:①状况条件:考查气体时经常给非标准状况如常温常压下,×105Pa、25℃时等。
②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,O、乙醇等。
如H2③物质结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及稀有气体He、Ne等为单原子组成的分子。
第3讲 物质的量及有关计算

(2010 年高考四川卷)标准状况下 V L 氨气溶 解在 1 L 水中(水的密度近似为 1 g/mL), 所得溶液 的密度为 ρ g/mL,质量分数为 w。物质的量浓度 为 c mol/L,则下列关系中不正确的是( ) . A.ρ=(17V+22400)/(22.4+22.4 V) B.w=17c/(1000 ρ) C.w=17V/(17V+22400) D.c=1000Vρ/(17V+22400)
5、物质的量浓度 单位体积的溶液所含溶质的物质 的量 单位:mol/L 符号:C 公式:C=n/V(aq)= 1000ρω/M 注:1)体积为溶液的体积而不 是溶剂的体积 2)换算时注意体积的单位mL与L 3)稀释时:n=C1V1=C2V2
例:将标准状况下的 aLHCl溶于 1000g水中,得到的溶液密度为 3 ,则该盐酸的物质的量 b g/cm 浓度是( D )
3.阿伏加德罗常数类试题易错点
1)考查气体体积与物质的量、 微粒数目等关系时,故意忽略标 准状况条件或给出常温常压条件。
2)物质状态问题。考查气体摩 尔体积时,常常用标准状况下非 气态的物质来迷惑考生,如H2O、 SO3、己烷、CCl4、HF等。
3)结合氧化还原反应考查电子转 移的数目问题,特别是歧化反应 的电子转移数目,如过氧化钠与 水反应、氯气与水的反应等。
【答案】 B
三、一定物质的量浓度溶液的 配制及误差分析 配制100mL 1.配制步骤 1mol/LNaCl 计算→称取或量取→溶解或稀释 →冷却→转移→洗涤→振荡→ 定容→摇匀→倒瓶贴签
2.配制过程中所需要的主要仪器 (1)量筒或托盘天平 (2)烧杯 (3)玻璃棒 (4)容量瓶 (5)胶头滴管
注:容量瓶的使用 (1)构造:细颈、平底玻璃瓶,瓶 口配有磨口玻璃塞或塑料塞 (精确至0.01mL)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质的量及有关计算 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-物质的量及有关计算【基础知识】一、物质的量符号:n1、国际单位制规定的七个基本物理量之一。
(长度、质量、时间、物质的量等)2、物质的量是含有一定数目粒子的。
即表示物质所含原子、分子、离子等微观粒子的多少。
3、物质的量的单位:符号:mol4、1摩尔任何物质都含有阿伏加德罗常数个结构微粒,因此,1mol任何粒子集体所含有的粒子数相等。
二、阿伏加德罗常数符号:N A1、1mol任何粒子含有阿伏加德罗常数个粒子。
通常使用 mol-这个近似值。
例:1molCO2在任何情况下,都含有N A个CO2分子,约为×1023个。
三、摩尔质量符号:M1、单位物质的量的物质所具有的质量,即每摩尔物质所具有的质量,数值上等于该物质的。
2、单位:g/mol或kg/mol例:1molCO2的质量为44g,CO2的摩尔质量为44g/mol四、气体摩尔体积符号:Vm1、表示:单位物质的量的气体所占有的体积。
2、单位:常用的是:L/molV——气体摩尔体积(单位:L/mol),V——气体的体积(单位常取:mL),n——气体的物质的量(单位:mol)4、标准状况下,任何气体的气体摩尔体积都约为 L/mol。
不在标准状况时,气体摩尔体积不一定为 L/mol。
5、用到 L/mol时一定要同时满足两个条件:①标准状况;②气体。
五、阿伏加德罗定律1.内容:在同温同压下,同体积的气体含有相同的分子数。
即“三同”定“一同”。
2.注意:阿伏加德罗定律也适用于不反应的混合气体。
阿伏加德罗常数这类题的解法:①状况条件:考查气体时经常给非标准状况如常温常压下,×105Pa、25℃时等。
② 物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H 2O 、乙醇等。
③ 物质结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及稀有气体He 、Ne 等为单原子组成的分子。
六、物质的量浓度 符号:C B1、以单位体积溶液里所含溶质的物质的量来表示溶液组成的物理量。
2、单位:常用mol/L七.一定物质的量浓度溶液的配制步骤:计算、 、 (注意: )、转移、 、 、 、装瓶贴签。
八、本节书所涉及到的公式包括:【难点突破】 1.方法与技巧(1)充分利用物质的量与各量间的关系(2)充分利用物质的量浓度与质量分数、溶解度间的关系 (3)充分利用守恒关系、十字交叉法、差量法等解题技巧 2.解题注意点 (1)对气体来说,在解题时要特别注意气体所处的外界条件,因温度、压强不同,等物质的量的气体所占的体积不同。
对于NO 2方面的试题,还要考虑后续反应,即NO 2与N 2O 4的平衡转换。
(2)对混合物中各物质的物质的量的分析,既要考虑反应,还要考虑反应进行的程度及过量问题。
物质的量= 物质的质物质的摩尔质物质的微粒数 阿伏加德罗常气体的体积 气体摩尔体积 物质的量浓度╳体= = = 物质的量浓1000╳密度╳溶质质量溶质的摩尔质量饱和溶液溶质质量分溶解度 100+溶解= = ,由于不深入的观察思考,浮光掠影地看题、审题,在此类试题的解题中也经常出现。
不少考生解题过程中,在未形成正确的解题思路之前,便依靠熟题效应,对题设条件以点概面、以偏概全而形成错误。
如不注意反应物的状态、不注意外界条件、将物质A看成B、忽视过量问题、忽视平衡问题、忽视对题中隐含条件的分析等。
以此造成分析不完整、答案残缺不全,对于与问题相关的多个因素顾此失彼。
3.命题趋向(1)有关物质的量与阿伏加德罗常数间的关系是高考中的必考点,今后将继续出现。
(2)有关物质的量浓度与质量分数、溶解度间的关系,将会再次出现在高考题中。
(3)在今后高考众多的应用性试题中,如能抓住反应间物质的量的关系,通过物质的量理清反应过程,将会使题目变得简单明了,易于获得正确结果。
【典例解析】【例1】、下列几种说法中正确的是A.摩尔是和化学上常用的一个物理量B.某物质含有×1023个粒子,含有这个数目粒子的物质一定是1 mol。
C.1摩尔氢气分子可以表示为1 mol H2。
D.硫酸的摩尔质量为98 g。
【例2】、下列各组物质中,所含分子数相同的是A、10gH2和10gO2B、 N2和 CO2C、14g CO和14g N2D、个H2和 N2【例3】(1)已知FeS+2H+=Fe2++H2S↑,将m g铁粉和n g硫粉均匀混合,在密闭容器中加热至红热,冷却后,加入多少毫升 b mol/L的盐酸就不再产生气体若把已放出的气体收集起来,在标准状况下的体积一共是多少升(2)把铁粉和 g 硫粉均匀混合,铺在石棉网上用酒精灯加热引燃,完全反应后,将残渣全部放入过量的稀H2SO4中充分反应,结果所产生的气体体积在标况下明显少于 L,其原因是。
【例4】在2LFe2(SO4)3和CuSO4的混合溶液中,加入30g纯铁粉,最后得到L的FeSO4溶液以及26g固体沉淀物。
求原混合溶液中Fe2(SO4)3和CuSO4的物质的量浓度。
【例5】镁和铝的混合物10g,与足量的稀硫酸充分反应,生成氢气,混合物中镁和铝的质量比为多少【例6】有NaCl和KCl的混合物25g,溶于水形成溶液,加入1000g %的AgNO3溶液,充分反应后滤出沉淀,再向混合溶液加入100g Cu片,过一段时间取出(反应完全),洗涤干燥称其质量为,求原混合物中NaCl和KCl的物质的量各为多少【例7】有一块Al、Fe合金,将其溶于足量的盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加时,将沉淀滤出并充分灼烧,得到的残留物恰好与原来的合金质量相等,则此合金中Al的质量分数为( )A. %B. 30%C. %D. %【例8】配制100mL1mol/L的氢氧化钠溶液,下列操作错误的是A. 在托盘天平上放两片大小相同的纸,然后将氢氧化钠放在纸上称取B. 把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液转入容量瓶中C. 用蒸馏水洗涤烧杯、玻棒2~3次,洗涤液也移入容量瓶D. 沿着玻棒往容量瓶中加蒸馏水,直至溶液凹面的最低点与刻度相切【巩固练习】1.×1024个H2O中, H2O的“物质的量”是_________,氢原子的数目是________,氧元素的质量是_________。
2.下列说法正确的是()A.摩尔是国际单位制七个基本物理量之一 B.Cl2的摩尔质量是71 g/molC.标准状况下,的物质的量为1mol D.1molH2的质量是1g3.下列叙述正确的是( )A.1 mol H2O的质量为18g/mol B.CH4的摩尔质量为16gC.×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为4.下列各组物质中,所含分子数相同的是A、10gH2和10gO2B、 N2(标准状况)和11gCO2C、9gH2O和 D、224mLH2(标准状况)和5.下列有关的说法中正确的是A.28g N2含有的原子数为2NAB.4gCa变成Ca2+失去0.1N A个电子C.1mol的CH4和O2质量相等 D.2g H2中含有1mol氢6. 下列各组物质中,所含离子数为NA的是A. 27g Al3+ mol NaCl C. 2 mol SO42- Cl- 7.下列说法正确的是(设阿伏加德罗常数的数值为×1023)A.在标准状况下,苯所含分子数目为×1023B.1mol/L K2SO4溶液所含K+数目为2××1023C.在常温常压下,16g O2和O3的混合气体所含原子数目为×1023D. Mg与足量盐酸完全反应时,失去电子数目为××10238.下列说法正确的是:()A.在标准状况下1mol水和1mol氢气的体积都约是升。
B. 2克氢气和44克CO2的体积相等。
C. 1 mol 氮气和1 mol氧气体积相同D.在标准状况下1 mol氧气和氮气混合气(任意比)的体积约为9.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是A.950mL, B.500mL,117g C.1000mL,117g D.任意规格,10.下列溶液中的氯离子浓度与100mL molL―1氯化铝溶液中的氯离子浓度相等的是A.50mL molL―1的KCl溶液 B.50mL molL―1的FeCl2溶液C.100mL 1 molL―1的MgCl2溶液D.450mL molL―1的NaCl溶液11. 有5瓶溶液分别是:①10ml ·L-1NaOH水溶液,②20ml ·L-1H2SO4水溶液,③30ml ·L-1HCl水溶液。
以下各瓶溶液所含阳离子数的大小顺序是()A.①>②>③B.②>①>③C.②>③>①D.③>②>①12. 硫跟热的氢氧化钾溶液发生反应: 3S + 6KOH == 2K2S + K2SO3+ 3H2O该反应中还原剂和氧化剂相比,正确的是:()A.质量比为1∶2 B.物质的量之比为1∶3C.质量比为2∶3 D.物质的量之比为1∶213. 将钠和铝分别放入等体积、等浓度的足量盐酸中,同温同压下产生的气体体积比是2:3 ,反应中关于钠和铝说法正确的是:A. 物质的量之比为:2:1B.质量之比为:23:27C. 摩尔质量之比为:23:27D.体积之比为:2:114.两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温同压下,两容器的气体一定具有相同的 A.质量 B. 质子总数 C.密度 D. 原子总数15.物质的量浓度相同的NaCl MgCl2 AlCl3三种溶液,当溶液的体积比为3:2:1时,三种溶液中Cl-的物质的量浓度之比为()A. 1:1:1B. 1:2:3C. 3:2:1D. 3:4:316.下列说法中不正确的是( )A.1 mol氧气中约含有×1023个氧原子,B.1 mol臭氧和 mol氧气含有相同的氧原子数C.1 mol H2 在标准状况下占有体积 LD.等物质的量的干冰和一氧化碳中所含碳原子数之比为1∶1,氧原子数之比为1∶217.将40mL · L-1的CuSO4溶液与30mL 3 mo1·L-1的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中c(Cu2+)或c (OH—)都已变得很小,可忽略,则生成沉淀的组成可表示为 A.Cu(OH)2 B.CuSO4·Cu(OH)2·2Cu(OH)2 D.CuSO4·3Cu(OH)218.在100mL mol·L-1的 AgNO3溶液中加入100mL溶有 BaCl2的溶液,再加入100 mL溶有 mol CuSO4·5H2O的溶液充分反应。
