环境分析化学习题(第三章)汇编
分析化学各章节习题(含答案)

第一章误差与数据处理1-1 下列说法中,哪些是正确的?(1)做平行测定的目的是减小系统误差对测定结果的影响。
(2)随机误差影响精密度,对准确度无影响。
(3)测定结果精密度高,准确度不一定高。
(4)只要多做几次平行测定,就可避免随机误差对测定结果的影响。
1-2 下列情况,将造成哪类误差?如何改进?(1)天平两臂不等长(2)测定天然水硬度时,所用蒸馏水中含Ca2+。
1-3填空(1)若只作两次平行测定,则精密度应用表示。
(2)对照试验的目的是,空白试验的目的是。
(3)F检验的目的是。
(4)为检验测定结果与标准值间是否存在显著性差异,应用检验。
(5)对一样品做六次平行测定,已知d1~d5分别为0、+0.0003、-0.0002、-0.0001、+0.0002,则d6为。
1-4用氧化还原滴定法测定纯品FeSO4·7H2O中铁的质量分数,4次平行测定结果分别为20.10%,20.03%,20.04%,20.05%。
计算测定结果的平均值、绝对误差、相对误差、平均偏差、相对平均偏差、标准偏差及变异系数。
1-5有一铜矿样品,w(Cu) 经过两次平行测定,分别为24.87%和24.93%,而实际w(Cu)为25.05%,计算分析结果的相对误差和相对相差。
1-6某试样5次测定结果为:12.42%,12.34%,12.38%,12.33%,12.47%。
用Q值检验法和4d检验法分别判断数据12.47%是否应舍弃?(P = 0.95)1-7某分析人员测定试样中Cl的质量分数,结果如下:21.64%,21.62%,21.66%,21.58%。
已知标准值为21.42%,问置信度为0.95时,分析结果中是否存在系统误差?1-8 在不同温度下测定某试样的结果如下:10℃::96.5%,95.8%,97.1%,96.0%37℃:94.2%,93.0%,95.0%,93.0%,94.5%试比较两组数据是否有显著性差异?(P = 0.95)温度对测定是否有影响?1-9某试样中待测组分的质量分数经4次测定,结果为30.49%,30.52%,30.60%,30.12%。
大学《环境化学》习题3(5~8章)

环境化学习题3(5~8章)一、名词解释1、致畸作用:2、植物提取:3、可持续的化学:4、电动力学修复:5、共代谢:6、环境内分泌干扰物:7、原子经济性:8、原子利用率:二、填空1、写出两种无氧氧化过程的有机受氢体和。
2、CH3OCONHC6H5的水解反应产物为,,。
3、写出DDT的结构式,并写出其还原脱氯产物的结构。
4、写出米氏方程。
5.毒作用的生物化学机制包括、、和等四种。
6.人类在生产建设、日常生活和其他活动中产生的污染环境的固态、半固态和液态废弃物质。
按其来源可分为、、、、和等六类7、固体废物的三大特性①。
②。
③。
8、丙酮酸在有氧条件下,通过________辅酶,转化为________,然后与________反应生成________,进入________循环过程。
9、化学物质的联合作用包括________ 、________ 、________ 、________。
10、硝化细菌为型细菌,严格要求氧;反硝化的重要条件是氧。
11、汞发生生物甲基化的主要甲基供体为。
12、催化生物转化的双成分酶由酶蛋白和构成。
13、污染物化学致癌的两个阶段为和,在第一个阶段形成。
14、固体废弃物的处理原则主要是“三化”,即,,,并在相当长的时间内以为主:我国技术政策的发展趋势是:,资源化是以无害化为前提的,无害化和减量化则应以为条件。
15、绿色化学的理想在于。
绿色化学的最大特点在于 ,因而。
三、选择题1、表面活性剂进入水体,主要靠()来消除。
A、微生物降解B、光解C、吸附D、非生物降解2、可通过光解进行迁移转化的污染物(ABCD )。
A、卤代脂肪烃B、酚类化合物C、有机磷农药D、PCDD和PCDF3、水体中无机污染物能通过有机化过程进行迁移转化的是( )。
A、无机汞B、无机铬C、无机砷D、无机镍4、下列有关酶的叙述中正确的是()A、双成分酶含有酶蛋白、辅基。
辅基同酶蛋白的结合松弛。
B、脲酶是单成分酶。
C、辅酶具有酶的催化活性。
环境分析化学资料

环境分析化学资料环境化学试题库第一章绪论一,选择题1,五十年代日本出现的痛痛病是由______污染水体后引起的. ACdBHgCPbDAs2,五十年代日本出现的水俣病是由______污染水体后引起的. ACdBHgCPbDAs3,黄河含沙量达______kg/m3,为世界之最.A13B73C27D374,联合国已将每年的______定为"世界水日",提醒人们注意水资源的开发,管理和保护.A4.22B3.28C3.22D6.225,属于环境化学效应的是A热岛效应B温室效应C土壤的盐碱化D噪声二,填空题1,世界环境日为________.2,造成环境污染的因素有物理,化学和生物的三方面,其中化学物质引起的约占________.3,人为污染源可分为____________,____________,____________和__________.4,污染物的性质和环境化学行为取决于它们的和在环境中的.5,环境中污染物的迁移主要有,和三种方式.6,Cu,Zn共存时,往往能产生____________作用.7,一般情况下Se对Hg2+能产生作用.三,问答题1,当前人类生存面临的主要环境问题有哪些2,环境中主要的化学污染物有哪些3,举例简述污染物在环境各圈的迁移转化过程.第二章大气环境化学一,选择题1,由污染源排放到大气中的污染物在迁移过程中受到的影响. A风B湍流C天气形式D地理地势2,酸雨是指pH______的雨,雪或其它形式的降水.A<6.0B<7.0C<5.6D10B15D10,则表示待查元素i________. 19,降水中主要阴离子有______,______,______,______.20,写出下列物质的光离解反应方程式(1)NO2+hν+(2)HNO2+hν+或H NO2+hν+(3)HNO3+hν+(4)H2CO+hν+或H2CO+hν+(5)CH3X+hν+21,乙烯在大气中与O3的的反应机理如下:O3+CH2==CH2H2CO+H2COO22,制冷剂氯氟烃破坏臭氧层的反应机制是:CFmCln+hνCFmCln-1++O3O2++OO2+Cl三,问答题1,简述大气污染物的来源及汇机制.2,试述大气污染效应.3,试述酸雨的主要成分,形成机理及危害,写出有关化学反应式.并阐述重庆地区酸雨频率高,而北京酸雨频率低的原因.4,试述光化学烟雾的特征,形成条件,请以CH3CH=CHCH3为例,参考下面的光化学烟雾形成示意图,写出光化学烟雾形成的有关反应式.5,为什么排放到大气中的CFCs能破坏臭氧层,写出有关化学反应式.6,简要叙述用富集因子法判断气溶胶粒子污染来源的基本原理,方法(步骤). 7,试述大气中CO2等气体浓度上升,引起温室效应的原因.8,试比较伦敦烟雾和洛杉矶光化学烟雾的区别.9,说明臭氧层破坏的原因和机理.10,影响污染物在大气中运动的主要因素有哪些第三章水环境化学一,选择题1,海水中Hg2+主要以_______的形式存在.AHg(OH)2,HgCl2BHgCl2,HgCl3-CHgCl42-DHgCl3-,HgCl42-2,某一氧化还原体系的标准电极电位为0.80,其pEo为______.A13.50B13.35C13.05D12.803,一般情况下,当水体DO______时,鱼类会死亡.A>8.0mg/LB0D>4.0mg/L4,若水体的pE值高,有利于下列_______组在水体中迁移.AFe,MnBCr,FeCCr,MnDCr,V5,当前最简单,也较流行的是将金属划分为溶解态和颗粒态,溶解态是能通过______um孔径滤膜的部分.A0.54B0.22C0.45D0.506,河水中阴,阳离子的含量顺序为______.ANa+>Mg2+>Ca2+HCO3->SO42->Cl-BCa2+>Na+>Mg2+HCO3->SO42->Cl-CNa+>Ca2+>Mg2+Cl->HCO3->SO42-DNa+>Mg2+>Ca2+Cl->SO42->HCO3-7,某一氧化还原体系的标准电极电位为0.771,其pEo为______.A13.50B13.35C13.05D12.808,某一水体的BOD20为100ppm,其BOD5约为__________.A40B50C35D709,水体中溶解氧对石油降解影响很大,估计1升油类氧化需消耗______m3海水中的溶解氧.A200B400C600D50010,下列各种形态的汞化物,毒性最大的是______.AHg(CH3)2BHgOCHgDHg2Cl211,影响水环境中颗粒物吸附作用的因素有.A溶解氧含量B颗粒物粒度C温度DpH二,填空题1,天然水中的总碱度=+2+[OH-]—.2,水环境中胶体颗粒物的吸附作用有,和3,环境中某一重金属的毒性与其_______,___________和_____________有关.4,腐殖质中不溶于NaOH的部分称为___________,可溶于NaOH的部分称为___________,既溶于碱又溶于酸的部分称为_________.5,一般认为,但浓度较高时,金属离子与腐殖质的反应以________为主,当金属离子浓度低时,则以__________为主.6,天然水的PE随水中溶解氧的减少而,因而表层水呈环境.7,有机污染物一般通过,,,光解和生物富集和降解等过程进行迁移转化.8,正常水体中其决定电位作用的物质是___________.9,20℃时,需氧有机物经过____天,才能完成第一阶段的生化氧化.10,当水体pH处于中性或碱性条件下,汞的甲基化产物是________.11,当水体pH处于偏酸性条件下,汞的甲基化产物主要是_________.12,_______,________和_________常衡量水体富营养化的指标.13,_________,_________,__________常用作水体自净的指标.14,水体的自净作用可分为________,__________和__________.15,亨利常数大于________atmmol-1m-3的有机物,在浅而流速较快的河流中有显著的解吸速率.16,Cu-Zn金属对能还原六六六,在反应中Zn起______作用,而Cu 则起_______作用.17,碳水化合物生化水解的最终产物为_________,在氧气充足时,能进一步分解为________.18,影响胶体微粒聚沉的因素有_________,___________,_________,水体pH及流动状况,带相反电荷颗粒间的相互作用.19,溶解态金属的形态可通过_____________,_______________两种途径进行研究. 20,适用于水体颗粒物对污染物吸附的等温式有_______________,________________两种方程.其中_______________可求饱和吸附量.21,有机物的辛醇-水分配系数常用___________表示.三,问答题1,什么是水体自净水体自净的方式有哪几种举例说明河水自净过程.2,水体污染物可分几类3,试述水体中有机污染物的迁移转化途径.4,重金属污染的特点是什么水体中重金属的迁移方式有几类并举例说明水体中金属迁移转化的影响因素.5,某冶炼厂含铅废水经处理后排入河水中,测得排污口附近河水中铅的含量为0.4~0.5mg/L,而在下游500米处河水中铅含量仅为3~4μg/L,请解释其原因. 6,根据Streeter—phelps定律,计算20℃和29℃时,水体中需氧有机物分解掉50%所需的时间(已知,k20℃=0.1);计算结果说明什么7,某水体中Fe2+为56mg/L,Fe3+为56μg/L,试求水体的pE值.若与该水体平衡的氧分压为10-10大气压,当水体pH为9和6时,能否将Fe(Ⅱ)氧化为Fe(Ⅲ)8,试述水体中汞甲基化的途径及影响因素,写出有关反应式.9,为什么水体pH较低时,鱼体内积累的甲基汞含量较高10,试解释用BOD5,CODCr评价水环境质量时会掩盖有毒有害有机物污染的风险.11,影响水体中胶体微粒聚沉的因素有哪些12,什么是决定电位水体中起决定电位作用的物质是什么13,有机物的化学降解包括哪几种14,有机物的生化降解包括哪几种反应影响生物降解的因素有哪些15,影响有机物光化学降解的因素有哪些四,计算题1,若一个天然水体的pH为7.0.碱度为1.4mmol/L,需加多少酸才能把水体的pH 降低到6.0.2,含镉废水通入H2S达到饱和并调整pH为8.0,计算水中剩余镉离子浓度.[Ksp(CdS=7.9X10-27)]3,一个有毒化合物排入pH=8.4,T=25C水体中,90%的有毒物质被悬浮物所吸着,已知其Ka=0,Kb=4.9X10-7L/(d·mol),Kh=1.6d-1,计算化合物的水解速率常数. 4,在厌氧消化池中和pH=7.0的水接触的气体含65%CH4和35%CO2,计算PE 和Eh.5,某废水中Cu2+含量为5.0mg/L,经EDTA处理后,未络合EDTA 为200mg/L,体系pH=11,计算后回答反应平衡时,Cu的存在形式.(已知Cu2++Y4-==CuY2-,K=6.3X1018,EDTA分子量为372.)第四章土壤环境化学一,选择题1,以下因素可以诱发重金属从沉积物中释放出来A盐度升高BpH降低C增加水中配合剂的含量D改变氧化还原条件2,土壤有机质的来源有.A树脂B腐殖酸C腐黑物D矿物质3,腐植质胶体是非晶态的无定形物质,有巨大的比表面,其范围为________.A350-900m2/gB650-800m2/gC100-200m2/gD15-30m2/g 4,在土壤中,下列离子的交换吸附能力最强.ACa2+BNa+CFe3+DH+二,填空题1,土壤具有发生激烈变化的能力,它可以保持土壤反应的相对稳定,称为土壤的缓冲性能.2,土壤是由气,液,固三相组成的,其中固相可分为________,________,两者占土壤总量的________.3,重金属在土壤--植物系统中的迁移过程与重金属的________,及土壤的类型,_________,_________有关.4,土壤对农药的吸附作用可分为_________,_________和_______.5,土壤处于淹水还原状态时,砷对植物的危害_________.6,土壤中有多种无机氨,其中NH4+和________是植物摄取的主要形式.7,土壤中的大部分是有机氮,约占总氮的_______%,有机氮能变成无机氮的过程叫做__________.8,土壤中砷以三价或五价状态存在,其存在形态可分为可溶性砷,吸附,代换态砷及难溶态砷,可溶态砷主要为________和_______,一般占总砷的5~10%.9,土壤中铬是以________,________,_________,_________四种形态存在.10,在旱地土壤中,镉的主要存在形式是___________.11,土壤淹水条件下,镉的迁移能力________.12,土壤中农药的残留量受到__________,________,吸附及生物,化学降解等诸多因素的影响.13,农药在土壤中的迁移主要通过和两个过程.14,土壤中存在着由土壤动物,_________和_________组成的生物群体.15,土壤及沉积物(底泥)对水中有机污染物的吸附作用(sorption)包括_________,__________.三,问答题1,试述土壤的组成.土壤具有哪些基本特性2,什么是土壤污染如何判别农药等污染物进入土壤后是怎样自净的3,什么是土壤环境容量4,进入土壤的农药是怎样迁移转化的5,举例说明影响土壤中农药残留量的因素.6,有机磷农药在环境中的主要转化途径.举例说明其原理.7,试述土壤中氮的迁移转化过程.部分参考答案:1.A镉2.B有机汞3.D黄河的输沙量和含沙量均居世界各大江河首位,年均输沙量16亿吨,年均含沙量37.7千克/立方米4.C每年的3月22日是世界水日(英语:WorldDayforWater,或WorldWaterDay)。
分析化学第三章答案

思考题与习题1.指出在下列情况下,各会引起哪种误差?如果是系统误差,应该采用什么方法减免?(1)砝码被腐蚀;(2)天平的两臂不等长;(3)容量瓶和移液管不配套;(4)试剂中含有微量的被测组分;(5) 天平的零点有微小变动;(6)读取滴定体积时最后一位数字估计不准;(7)滴定时不慎从锥形瓶中溅出一滴溶液;(8)标定HCl溶液用的NaOH标准溶液中吸收了CO2。
答:(1)系统误差中的仪器误差.减免的方法:校准仪器或更换仪器。
(2)系统误差中的仪器误差。
减免的方法:校准仪器或更换仪器。
(3)系统误差中的仪器误差。
减免的方法:校准仪器或更换仪器.(4)系统误差中的试剂误差.减免的方法:做空白实验。
(5)随机误差。
(6)系统误差中的操作误差。
减免的方法:多读几次取平均值。
(7)过失误差。
(8)系统误差中的试剂误差。
减免的方法:做空白实验。
2.如果分析天平的称量误差为±0。
2mg,拟分别称取试样0.1g和1g左右,称量的相对误差各为多少?这些结果说明了什么问题?解:因分析天平的称量误差为mg 2.0±。
故读数的绝对误差g a 0002.0±=E根据%100⨯TE =E ar 可得 %2.0%1001000.00002.01.0±=⨯±=E gg gr%02.0%1000000.10002.01±=⨯±=E gg gr这说明,两物体称量的绝对误差相等,但他们的相对误差并不相同。
也就是说,当被测定的量较大时,相对误差就比较小,测定的准确程度也就比较高. 3.滴定管的读数误差为±0。
02mL 。
如果滴定中用去标准溶液的体积分别为2mL 和20mL 左右,读数的相对误差各是多少?从相对误差的大小说明了什么问题?解:因滴定管的读数误差为mL 02.0±,故读数的绝对误差mL a 02.0±=E 根据%100⨯T E =E ar 可得 %1%100202.02±=⨯±=E mLmLmL r%1.0%1002002.020±=⨯±=E mLmLmL r 这说明,量取两溶液的绝对误差相等,但他们的相对误差并不相同。
环境化学总复习题(附答案但不完全)解析

《环境化学》总复习题第一章绪论一、填空1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占80%-90%。
2、污染物的性质和环境化学行为取决于它们的化学性质和在环境中的迁移。
3、环境中污染物的迁移主要有机械、物理化学和生物三种方式。
4、人为污染源可分为工业、农业、交通运输和生活。
二、选择题1、属于环境化学效应的是CA热岛效应 B温室效应 C土壤的盐碱化 D噪声2、五十年代日本出现的痛痛病是由A污染水体后引起的。
A CdB HgC PbD As3、五十年代日本出现的水俣病是由B污染水体后引起的。
A CdB HgC PbD As三、问答题1、环境中主要的化学污染物有哪些?2、举例简述污染物在环境各圈的迁移转化过程。
第二章大气环境化学一、填空1、写出下列物质的光离解反应方程式(1)NO2 + hνNO + O·(2)HNO2 + hνHO·+ NO 或HNO2 + hνH·+ NO2(3)HNO3 + hνHO·+ NO2(4)H2CO + hνH· + HCO·或H2CO + hνH2+ CO2、大气中的NO2可以转化为HNO3、N2O5和N2O3。
3、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。
4、乙烯在大气中与O3的的反应机理如下:O3 + CH2 == CH2H2CO+H2COOCH2(O3)CH25、大气颗粒物的去除与颗粒物的粒度和_化学性质_有关,去除方式有干沉降和湿沉降。
6、制冷剂氯氟烃破坏臭氧层的反应机制是:CFmCln + hv CFmCln-1 + Cl·Cl·+ O3O2 + ClO·ClO·+O O2 + Cl7、当今世界上最引人瞩目的几个环境问题_温室效应_、_臭氧层破坏_、_光化学烟雾_等是由大气污染所引起的。
8、许多大气污染事件都与逆温现象有关,逆温可分为_辐射逆温_、_平流逆温_、_融雪逆温和地形逆温_。
环境化学重点 课后习题解答 试题

第一章绪论1、环境化学研究的内容;主要研究有害化学物质在环境介质中的存在、化学特性、行为和效应及其控制的化学原理和方法。
2、环境污染;由于认为因素使环境的构成或状态发生变化,环境素质下降,从而扰乱和破坏了生态系统和人们的正常生活和生产条件。
3、环境污染物:是环境化学研究的对象,进入环境后使环境的正常组成和性质发生改变,直接或间接有害于人类与生物的物质。
4、优先污染物;指在众多污染物中筛选出的潜在危险大因而作为优先研究和控制对象的污染物。
5、环境效应;是指由环境变化而产生的环境效果6、环境效应化学:在多种环境条件的影响下,物质之间的化学反应所引起的环境效果。
第二章大气环境化学1、一次污染;是指污染物由污染源直接排入环境所引起的污染2、二次污染;是由一次污染物经化学反应形成的污染物如CO,SO2,NO3、辐射逆温;晴朗平静的夜晚,地面因辐射而失去热量,近地气层冷却强烈,较高气层冷却较慢,形成从地面开始向上气温递增。
4、地形逆温;由于山坡散热快,冷空气山坡下沉到谷地,谷底原来的较暖空气被冷空气抬挤上升,从而出现气温的倒置现象。
5、温室效应;大气能使太阳短波辐射到达地面,但地表向外放出的长波热辐射线却被大气吸收,这样就使地表与低层大气温度增高,因其作用类似于栽培农作物的温室,6、光量子产率;化学物质吸收光量子后,所产生的光物理过程或光化学过程相对效率。
7、气温垂直递减率气温随高度的变化通常以气温垂直递减率(Г)表示,即每垂直升高100m,气温的变化值:T-绝对温度,K;Z-高度。
8、光化学反应;物质一般在可见光或紫外线的照射下而产生的化学反应。
9、气溶胶;由固体或液体小质点分散并悬浮在气体介质中形成的胶体分散体系。
10、酸雨;被大气中存在的酸性气体污染,pH小于5.65的酸性降水。
11、湿沉降;下雨时,高空雨滴吸收包含酸性物质继而降下时再冲刷酸性物质降到地面。
12、干沉降:不下雨时,大气中酸性物质可被植被吸附或重力沉降到地面。
环境化学习题3答案

环境化学习题3答案环境化学习题3答案环境化学是一门研究环境中化学物质的分布、转化和影响的学科。
在环境保护和可持续发展的背景下,对环境化学的学习和理解变得越来越重要。
下面是环境化学习题3的答案,希望对大家的学习有所帮助。
问题1:什么是环境化学?答:环境化学是研究环境中化学物质的来源、分布、转化和影响的科学。
它主要关注环境中的有机和无机物质,如污染物、营养物质和天然物质等。
通过研究环境化学,可以了解化学物质在环境中的行为和效应,为环境保护和可持续发展提供科学依据。
问题2:什么是环境化学分析?答:环境化学分析是通过实验和测试方法,对环境中的化学物质进行定性和定量的分析和检测。
常用的环境化学分析方法包括质谱分析、光谱分析、电化学分析等。
通过环境化学分析,可以确定环境中的污染物种类和浓度,评估其对环境和人类健康的影响。
问题3:什么是环境化学反应?答:环境化学反应是指在环境中发生的化学反应。
环境中的化学反应可以是自然界中的生物和地球化学反应,也可以是人为活动引起的化学反应。
例如,大气中的光化学反应会导致臭氧层的破坏;水体中的化学反应可以造成水质污染;土壤中的化学反应会影响植物的生长等。
了解环境化学反应可以帮助我们预测和控制环境污染的发生和发展。
问题4:什么是环境化学平衡?答:环境化学平衡是指在环境中发生的化学反应达到稳定状态的情况。
在环境中,化学物质之间会发生各种反应,包括溶解、沉淀、氧化还原等。
当反应速率达到一定平衡时,反应物和生成物的浓度保持相对稳定。
环境化学平衡的研究可以帮助我们理解环境中化学物质的分布和转化规律。
问题5:环境化学在环境保护中的作用是什么?答:环境化学在环境保护中起着重要的作用。
通过研究环境中的化学物质,可以了解其来源、分布和转化规律,评估其对环境和人类健康的影响。
基于环境化学的研究结果,可以制定并实施相应的环境保护政策和措施,减少和控制污染物的排放,保护生态系统的健康和可持续发展。
总结:环境化学是一门研究环境中化学物质的分布、转化和影响的学科。
各章环境化学习题2013

各章环境化学习题2013环境化学习题第一章绪论一、填空1.造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占80%-90%。
2.污染物的性质和环境化学行为取决于它们的化学结构和在环境中的存在形态。
3.环境中污染物的迁移主要有机械迁移、物理-化学迁移和生物迁移三种方式。
4.人为污染源可分为工业、农业、交通运输、和生活。
二、选择题1.属于环境化学效应的是A热岛效应B温室效应C土壤的盐碱化D噪声2.五十年代日本出现的痛痛病是由______污染水体后引起的。
A CdB HgC PbD As3.五十年代日本出现的水俣病是由______污染水体后引起的。
A CdB HgC PbD As三、问答题1.环境化学与基础化学有什么不同?环境化学的特点是从微观的原子、分子水平上来研究宏观的环境现象与变化的化学机制及其防治途径,其核心是研究化学污染物在环境中的化学转化和效应。
与基础化学的方式方法不同,环境化学所研究的环境本身是一个多因素的开放性体系,变量多、条件较复杂,许多化学原理和方法则不易直接运用。
化学污染物在环境中的含量很低,一般只有毫克每千克、微克每千克甚至更低。
环境样品一般组成比较复杂,化学污染物在环境介质中还会发生存在形态的变化。
它们分布广泛,迁移转化速率较快,在不同的时空条件下有明显的动态变化。
2.环境污染物有哪些类别?主要的化学污染物有哪些?(P12)按环境要素可分为:大气污染物、水体污染物和工业污染物。
按污染物的形态可分为:气态污染物、液态污染物和固体污染物;按污染物的性质可分为:化学污染物、物理污染物和生物污染物。
主要化学污染物有:元素:如铅、镉、准金属等。
2.无机物:氧化物、一氧化碳、卤化氢、卤素化合物等有机化合物及烃类:烷烃、不饱和脂肪烃、芳香烃、PAH等;金属有机和准金属有机化合物:如,四乙基铅、二苯基铬、二甲基胂酸等;含氧有机化合物:如环氧乙烷、醚、醛、有机酸、酐、酚等;含氮有机化合物:胺、睛、硝基苯、三硝基甲苯、亚硝胺等;有机卤化物:四氯化碳、多氯联苯、氯代二噁瑛;有机硫化物:硫醇、二甲砜、硫酸二甲酯等;有机磷化合物:磷酸酯化合物、有机磷农药、有机磷军用毒气等。
环境化学总复习题(附答案但不完全)演示教学

《环境化学》总复习题第一章绪论一、填空1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占80%-90%。
2、污染物的性质和环境化学行为取决于它们的化学性质和在环境中的迁移。
3、环境中污染物的迁移主要有机械、物理化学和生物三种方式。
4、人为污染源可分为工业、农业、交通运输和生活。
二、选择题1、属于环境化学效应的是CA热岛效应 B温室效应 C土壤的盐碱化 D噪声2、五十年代日本出现的痛痛病是由A污染水体后引起的。
A CdB HgC PbD As3、五十年代日本出现的水俣病是由B污染水体后引起的。
A CdB HgC PbD As三、问答题1、环境中主要的化学污染物有哪些?2、举例简述污染物在环境各圈的迁移转化过程。
第二章大气环境化学一、填空1、写出下列物质的光离解反应方程式(1)NO2 + hνNO + O·(2)HNO2 + hνHO·+ NO 或HNO2 + hνH·+ NO2(3)HNO3 + hνHO·+ NO2(4)H2CO + hνH· + HCO·或H2CO + hνH2+ CO2、大气中的NO2可以转化为HNO3、N2O5和N2O3。
3、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。
4、乙烯在大气中与O3的的反应机理如下:O3 + CH2 == CH2H2CO+H2COOCH2(O3)CH25、大气颗粒物的去除与颗粒物的粒度和_化学性质_有关,去除方式有干沉降和湿沉降。
6、制冷剂氯氟烃破坏臭氧层的反应机制是:CFmCln + hv CFmCln-1 + Cl·Cl·+ O3O2 + ClO·ClO·+O O2 + Cl7、当今世界上最引人瞩目的几个环境问题_温室效应_、_臭氧层破坏_、_光化学烟雾_等是由大气污染所引起的。
8、许多大气污染事件都与逆温现象有关,逆温可分为_辐射逆温_、_平流逆温_、_融雪逆温和地形逆温_。
第三章-水环境化学习题解答

第三章水环境化学一、填空题1、天然水体中常见的八大离子包括:K+、Na+、Ca2+、Mg2+、HCO3-、NO3-、Cl-、SO42-。
2、天然水体中的碳酸平衡体系a0、a1、a2分别表示[H2CO3*]、[HCO3-]、[CO32-]的分配系数,其表达式分别为:(用pH\K1\K2表达):a 0=[H2CO3*]/{[ H2CO3*]+[ HCO3-]+[ CO32-]}=[H+]2/{[H+]2+K1[H+]+K1K2}a 1=[ HCO3-] /{[ H2CO3*]+[ HCO3-]+[ CO32-]}= K1[H+]/{[H+]2+K1[H+]+K1K2}a 2=[ CO32-] /{[ H2CO3*]+[ HCO3-]+[ CO32-]}= K1K2/{[H+]2+K1[H+]+K1K2}。
(注:此三个公式前半段教材119-120页有错误!)a 0+a1+a2=13、根据溶液质子平衡条件得到酸度低表达式:总酸度= [H+]+2[ H2CO3*]+[HCO3-]-[OH-];CO2酸度= [H+]+[H2CO3*]-[CO32-]-[OH-](注:教材121此公式错误),无机酸度= [H+]-[HCO3-]-2[CO32-] -[OH-] 。
4、根据溶液质子平衡条件得到酸度低表达式:总碱度= [OH-] +2[CO32-]+[HCO3-]-[H+];酚酞碱度= [OH-] +[CO32-]-[H+]-[ H2CO3*];苛性碱度= [OH-] -2[ H2CO3*]-[HCO3-]-[H+]。
5、“骨痛病事件”的污染物是镉;水俣病的污染物是汞(或甲基汞)。
6、水体的富营养化程度一般可用总磷(TP)、总氮(TN)、叶绿素a、透明度等指标来衡量。
7、水环境中氧气充足的条件下有机物发生的生物降解称为有氧(或好氧)降解,最终产物主要为二氧化碳和水,有机氮转化为硝酸根,有机硫转化为硫酸根。
水中的有机物在无氧条件经微生物分解,称为厌氧降解,降解产物除二氧化碳和水外,还有小分子的醇、酮、醛、酸等,无机态氮主要以氨氮存在、硫主要以硫化物存在,水体发臭发黑。
环境工程第三章习题

例题:某市有一条流量稳定的小河,流量为9.6m3 /s,断
面平均流速为0.15m/s,CODCr为15.7mg/L,河的左岸有一
流量稳定的排污口,流量为1.6 m3 /s,CODCr为65 mg/L,
假设河水与污水在排污口完全混合,已知耗氧系数
k1=0.5/d,求排污口下游6km处的CODCr浓度。
第三章水的物理化学处理方法习题
YANGTZE NORMAL UNIVERSITY
6、常见的沉砂池的形式有
平流
,
竖流
,
曝气
等。
7、以下
工艺不具有除磷功能。 。
A.传统活性污泥法;B.A/A/O法;C.氧化沟法; Nhomakorabea.化学沉淀
8、絮凝沉降的特点是
A.颗粒沉淀轨迹呈直线;
B.颗粒相互聚集增大,加快沉淀; C.颗粒挤成一团,以大块面积沉降; D.悬浮颗粒浓度很高
第三章水的物理化学处理方法习题
YANGTZE NORMAL UNIVERSITY
9、为了保证水中所有的病原细菌确实地受到氯的作用,水经过氯 消毒一定时间以后,应该有适量的剩余氯留在水中,以保证持续 的----------。 A.pH值; B.氯味;C.杀菌能力; D.氯含量。 10、许多工业用水对水的硬度、碱度和含盐量有一定的要求。降低 水中 含量的处理称为水的软化。 A.Ca2+ Mg2+ ; B.CO32- OH- ; C.HCO3- CO32-; D. HCO3- CO32- OH-。
泥量。
第三章水的物理化学处理方法习题
YANGTZE NORMAL UNIVERSITY 解:()沉淀区有效表面积: 1 8640 A= 211.8m 2 ; 24 1.7 8640 (A 318.6m 2 , 设计时表面负荷缩小1.5倍 24 1.13 1.5x=1.7 x=1.13m/h,沉淀时间放大1.75倍,65 1.75=113.8min=1.9h) 211.8 采用二池,每池平均面积= 105.9m 2 ; 2 318.6 (每池平均面积= 159.3m 2 ;) 2 (2)沉淀池有效深度: 8640 65 8640 1.9 24 2 60 1.90m = 24 2 h2 = (h 2 2.15m) 105.9 159.3 (3)采用每池宽度5.5m则池长 105.9 159.3 L= 19.3m(L= 29.0m) 5.5 5.5 (4)污泥的体积:(每池) 8640 (450 70%) 2 Q/2(C1 -C 2)T 2 V 90.7m3 (100-p) 10 1000 (100-97) 10 第三章水的物理化学处理方法习题
环境分析化学习题及答案

Part 1 Self-study exercises and answers1. Write down the definition and characteristics of environmental analytical chemistry chemistry. . Answers 环境分析化学是环境化学的一个重要组成部分,是开展环境科学研究不可缺少的基础。
可缺少的基础。
它是研究环境污染物的组成、结构、状态以及含量的分析化学的一个新分支。
从某种意义上讲,环境科学的发展依赖于环境分析化学的发展。
特点:涉及范围广;对象复杂;变异性;定量分析;普遍性、实用性强。
2. What is the principal factors underlying some very difficult problems to analytical chemists in environmental analytical? Answer the principal factors underlying these difficulties are listed below: a: The range of analyte types is very wide. They vary from simple inorganic species at one end of the scale to complex bio-molecules at the other. b: b: Sample Sample Sample matrices matrices matrices are are are frequently frequently frequently complex complex complex and and and unknown. unknown. unknown. They They They may may may be be solid, liquid or gaseous. c: Analytes may may have to be have to be m easured at very measured at very l ow concentrations, e.g. a few low concentrations, e.g. a few ppb(ppb(μμg. kg -1). d: d: Environmental programmes often Environmental programmes often g enerate generate generate very very very large large large number of samples number of samples and place a premium on automation. e: Some analyses can only be made at, or very close to, the sampling site. Readily Readily portable portable portable and and and robust robust robust analytical analytical analytical equipment equipment equipment or or or remote remote remote sensing sensing sensing devices devices devices are are thus required. 3. Write down the stages of overall analytical process in an environmental investigate. Answer a: definition of the aims ;b: selection and development of appropriate method ;c: sampling plan ,sample collection ,sample handing and pretreatment ; d: separations ;e: final measurements; f: method validation; g: assessment and interpretation of results; h:safety h:safety. . 4. How to select an analytical method ?Answer In order to select an appropriate method, a whole range of factors needs to be taken taken into into into account account account in in in this this this selection selection selection process, process, process, some some some of of of the the the important important important factors factors factors are are listed below: a: what is the analyte? b: detection limits. c: precision. d: accuracy. e: turn-round time. analyses needed ‘on-site’?f: are a nalyses needed ‘ong: number of sample and any consequent automation. h: cost. 。
环境监测第三章练习题-化学10

环境监测第三章练习题一、名词解释1、硫酸盐化速率2、二次污染物3、空气污染指数4、光化学氧化剂二、填空题1、大气层分为,对流层、平流层、中间层、热层、散逸层,其中,大气污染物的迁移和转化主要发生在。
2、产生急性危害必须满足两个条件:、。
3、直接从污染源排放到空气中的有害物质称为,经过发生作用,产生一些新的物质,这些物质和直接排放的污染物的物理化学性质均有很大不同,毒性也比较大,这些新产生的污染物称为。
如。
4、空气中的污染物按存在状态进行分类,可以分为、。
5、粒子状态污染物(或颗粒物)是分散在空气中的微小液体和固体颗粒,粒径多在0.01-200微米之间,是一个复杂的非均匀体系,通常分为、。
6、PM10是指、TSP是指。
7、空气污染物的常规监测项目有、、、、。
8、大气采样点应设在整个监测区域的、、三种不同污染物浓度的地方。
9、污染源比较集中的地区,若主导风向较明显,应位置多设采样点。
10、大气采样的布点方法有、、、。
11、对于区域性的常规监测一般采用。
12、如某地区有多个污染源,且分布较均匀,采样的过程中,应采用进行布设采样点。
13、布点法的监测结果可以绘制成污染物空间分布图,对指导城市环境规划和管理具有重要意义。
14、布点法适用于多个污染源构成污染群,且大污染源较集中的地区。
15、布点法适用于孤立的高架点源,且主导风向明显的地区。
扇形的角度一般为。
16、采用同心圆和扇形布点法时,要特别注意高架点源排放污染物的扩散特点,在的位置应多布设采样点。
19、采集空气样品的方法可归纳为和两类20、当空气中的被测组分浓度较高,或者监测方法灵敏度高,采样时可采用。
21、当空气中的被测组分浓度比较低,或者监测方法灵敏度不高,采样时可采用。
22、溶液吸收法的吸收原理主要有和两种。
23、气泡吸收管适用于采集物质;冲击式吸收管适用于采集物质。
多空筛板吸收管适用于采集物质。
24、富集采样法中的填充柱阻留法,根据填充剂阻留作用的原理,可将填充柱分为、、。
环境化学课后习题参考答案

第一章绪论2、根据环境化学的任务、内容和特点以及发展动向,你认为怎样才能学好环境化学这门课?环境化学是一门研究有害化学物质在环境介质中的存在、化学特征、行为和效应及其控制的化学原理和方法的科学。
环境化学以化学物质在环境中出现而引起环境问题为研究对象,以解决环境问题为目标的一门新型科学。
其内容主要涉及:有害物质在环境介质中存在的浓度水平和形态,潜在有害物质的来源,他们在个别环境介质中和不同介质间的环境化学行为;有害物质对环境和生态系统以及人体健康产生效用的机制和风险性;有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。
环境化学的特点是要从微观的原子、分子水平上来研究宏观的环境现象与变化的化学机制及其防治途径,其核心是研究化学污染物在环境中的化学转化和效应。
目前,国界上较为重视元素(尤其是碳、氮、硫和磷)的生物地球化学循环及其相互偶合的研究;重视化学品安全评价、臭氧层破坏、气候变暖等全球变化问题。
当前我国优先考虑的环境问题中与环境化学密切相关的是:以有机物污染为主的水质污染、以大气颗粒物和二氧化硫为主的城市空气污染;工业有毒有害废物和城市垃圾对水题和土壤的污染。
3、环境污染物有哪些类别?主要的化学污染物有哪些?按环境要素可分为:大气污染物、水体污染物和工业污染物。
按污染物的形态可分为:气态污染物、液态污染物和固体污染物;按污染物的性质可分为:化学污染物、物理污染物和生物污染物。
主要化学污染物有:1.元素:如铅、镉、准金属等。
2.无机物:氧化物、一氧化碳、卤化氢、卤素化合物等3.有机化合物及烃类:烷烃、不饱和脂肪烃、芳香烃、PAH等;4.金属有机和准金属有机化合物:如,四乙基铅、二苯基铬、二甲基胂酸等;5.含氧有机化合物:如环氧乙烷、醚、醛、有机酸、酐、酚等;6.含氮有机化合物:胺、睛、硝基苯、三硝基甲苯、亚硝胺等;7.有机卤化物:四氯化碳、多氯联苯、氯代二噁瑛;8.有机硫化物:硫醇、二甲砜、硫酸二甲酯等;9.有机磷化合物:磷酸酯化合物、有机磷农药、有机磷军用毒气等。
环境分析化学习题(第三章)
δ0 +δ1= 1
例1、计算pH=5.00时, HAC和AC- (P63)
(已知Ka1=1.70×10-5)
解:
[HAc] [H+] 1= = + c [H ] + Ka [Ac-] Ka 0= = + c [H ] + Ka
23:30:05
例2:在浓度为C的 NaNH4HPO4溶液的质子条件式
23:30:05
• 5、共轭酸碱对Ka和Kb的关系为( )。 A、Ka=Kb B、Ka×Kb=1 C、Ka×Kb=Kw D、Ka÷Kb=1 • 6、用0.10mol/LHCl溶液滴定0.10mol/LNaOH溶液,其pH 值突跃范围为9.7---4.3,如果用0.010mol/LHCl溶液滴定 0.010mol/L NaOH溶液,估计其突跃范围是( ) A,9.7----4.3 B,10.7-----3.3 C,8.7----3.3 D,8.7----5.3 • 7、滴定分析中,一般利用指示剂颜色的变化来判断等当 点的到达,在指示剂变色时停止滴定,这一点称( ) A等当点; B滴定分析; C滴定 ; D滴定终点
13、某碱样为NaOH和Na2CO3的混合液。用HCl标准溶液滴定。 先以酚酞为指示剂,耗去HCl溶液体积为V1,继以甲基橙为 指示剂,又耗去HCl溶液体积为V2。V1与V2的关系是: C A、V1=2V2; B、2V1=V2; C、V1>V2;D、V1<V2。
14.某NaOH标准溶液,在保存过程中吸收了少量的CO2,若用此 标准溶液来标定HCl溶液浓度,以酚酞为指试剂,问所测得的 HCl溶液浓度结果( A ) A偏高 B 偏 低. C不影响 D不确定 15、某水样碱度组成为含CO32-碱度为0.0010mol/L,HCO3-碱度 为0.0020mol/L,则总碱度以CaCO3计为( ) A。2.0 mmol/L; B。 1.5 mmol/L; C。 3.0 mmol/L; D。 2.5 mmol/L
环境分析化学3章

20.0 m L 5.0 m L 20.0
mL
)2
0.145 m g
E 20.0 m g 0.145 m g 100% 99.3% 20.0 m g
5. 分离系数 定义为: 两种溶质在有机相和水相中的分配比之比,
用 β 来表示。 如果在同一体系中有两种溶质 A 和 B,它们的分配
比分别为 DA 和 DB,分离系数即可用下式表达 :
4. 萃取百分率 定义为: 被萃取物质在有机相中的总量占被萃取物
质总量中的百分比,用 E 表示。
被 萃 取 物 质 萃 取 到 有 机 相 中 的 总 量
E
被 萃 取 物 质 的 总 量 1 0 0 %
E 与分配比的关系:
当用等体积萃取时 (V水 = V有 )
E=
D × 100%
1 D
E
C 有 V有
解 : 用 10mL萃 取 液 一 次 萃 取
W1
20.0 m g
20.0 m L 43 10.0 m L 20.0 m L
0.889 m g
E 20.0 m g 0.889 m g 100% 95.6% 20.0 m g
用5mL萃 取 液 连 续 萃 取 二
( 43
2. 分配定律 定义: 如果溶质在有机相和水相中具有同样的分子
量 (分子状态相同),则在一定温度下,溶质在两个互不
相溶的溶剂中的分配达到平衡时,两相溶质浓度之比为
一常数。这一常数称为分配系数,用 KD 表示。
[M]水 == [M]有 适用条件是:
KD
M有 M水
(a) 溶质的浓度较低,否则,必须考虑离子强度的影 响。
MnO4-+(C6H5)4As+Cl-→[(C6H5)4As+ MnO4-]
(完整版)第三章水环境化学答案

第三章 水环境化学1、 请推导出封闭和开放体系碳酸平衡中[H 2CO 3*]、[HCO 3-]和[CO 32-]的表达式,并讨论这两个体系之间的区别。
解:开放体系,考虑到CO 2在气液相之间的平衡,[H 2CO 3*] 不变 根据亨利定律: [CO 2(aq)] = K H Pco 2 lg[H 2CO 3*] ≈ lg[CO 2(aq)]= lg K H + lg Pco 2 = - 4.9lg[HCO 3-] = lg K 1 + lg [H 2CO 3*] + pH= -11.3 + pHlg[CO 32-] = lgK 1 + lgK 2 + lg[H 2CO 3*] + 2pH= -21.6 + 2pH*][][][*][]][[32133231CO H H KHCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H KK CO CO H CO H K K +--+⋅==⋅][][][233*32--++=CO HCO CO H C T 是常数。
的总和为各种碳酸化合态浓度假设,T C T C HCO ⎥⎦⎤⎢⎣⎡-=31αT C CO ⎥⎦⎤⎢⎣⎡-=232αT C CO H ⎥⎦⎤⎢⎣⎡*=320α122122)][][1(-+++=K H K K H α1211)][][1(-++++=H K K H α122110)][][1(-++++=H K K H K α*][][][*][]][[32133231CO H H K HCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H K K CO CO H CO H K K +--+⋅==⋅][][][][21233*32+--H K K CO HCO C CO H T 和含有的表示式,,为变量表示以:,][],[*],[21023332得到,,代入把αααT C CO HCO CO H --2、请导出总酸度、CO2酸度、无机酸度、总碱度、酚酞碱度和苛性碱度的表达式作为总碳酸量和分布系数(α)的函数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 一元酸:以醋酸(HAc)为例
HAc + H 2O = H 3O + + Ac-
K =[H+ ][Ac-]/[HAc] a
Ac- +
H 2O
=
HAc
+
OH-
K =[OH-][HAc]/[Ac-] b
共轭酸碱对的Ka和Kb有下列关系: Ka· Kb= Kw = 10-14 (25℃) 或 pKa+ pKb = pKw = 14
[H+]=1/2(CHX+
)
CHX浓度大于10-6mol/L
例4:计算5×10-7mol/L Hcl溶液的pH值 (P68)
01:43:26
3.一元弱酸碱水溶液中pH的计算
01:43:26
例5:计算1.0×10-4mol/L HCN溶液的pH值(P70)
已知HCN的Ka=4.9×10-10 比较 CKa 20Kw 比较C/Ka 500 选择H+计算公式计算
01:43:26
• 5、共轭酸碱对Ka和Kb的关系为( )。 A、Ka=Kb B、Ka×Kb=1 C、Ka×Kb=Kw D、Ka÷Kb=1 • 6、用0.10mol/LHCl溶液滴定0.10mol/LNaOH溶液,其pH 值突跃范围为9.7---4.3,如果用0.010mol/LHCl溶液滴定 0.010mol/L NaOH溶液,估计其突跃范围是( ) A,9.7----4.3 B,10.7-----3.3 C,8.7----3.3 D,8.7----5.3 • 7、滴定分析中,一般利用指示剂颜色的变化来判断等当 点的到达,在指示剂变色时停止滴定,这一点称( ) A等当点; B滴定分析; C滴定 ; D滴定终点
12.某碱性样品用0.1000mol/L的HCl溶液滴至酚酞终点,用去 20.00ml,加入甲基橙又用0.1000mol/LHCl溶液滴至终点,又用去 30.00ml,此样品为( C ) A .NaCO3 B. NaCO3 +NaOH C. NaCO3 +NaHCO3 D.NaHCO3 01:43:26
01:43:26
• 8、已知NH3的Kb=1.8×10-5;则NH4+的Ka是: () A、9.25; B、5.6×10-10; C、 1.00×10-14; D、4.24×10-3 • 9、用纯水把下列溶液稀释两倍时,其中pH值变化最小的 是( ) A 0.1mol/LHCl ;B 1mol/L NH3· H2O; C 1mol/LHAc; D 1mol/LHAc+ 1mol/LNaAc 10、某酸碱指示剂的Ka=1.0×10-5,其理论变色范围是 pH为 。 11、酸碱滴定中,当选用的指示剂一定时,若PH突跃范 围越大,则滴定的相对误差越 。
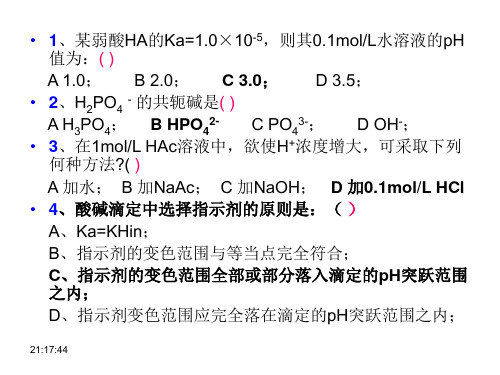
• 1、某弱酸HA的Ka=1.0×10-5,则其0.1mol/L水溶液的pH 值为:( ) A 1.0; B 2.0; C 3.0; D 3.5; • 2、H2PO4 - 的共轭碱是( ) A H3PO4; B HPO42C PO43-; D OH-; • 3、在1mol/L HAc溶液中,欲使H+浓度增大,可采取下列 何种方法?( ) A 加水; B 加NaAc; C 加NaOH; D 加0.1mol/L HCl • 4、酸碱滴定中选择指示剂的原则是:( ) A、Ka=KHin; B、指示剂的变色范围与等当点完全符合; C、指示剂的变色范围全部或部分落入滴定的pH突跃范围 之内; D、指示剂变色范围应完全落在滴定的pH突跃范围之内;
PBE:[H3O+ ] +[H2PO4- ] +2[H3PO4 ]= [OH- ] +[NH3 ] + [PO43-]
例3:在浓度为C的 H3PO4溶液的质子条件式
PBE:[H+ ] = [OH- ] +[H2PO4- ] +2[HPO4 ]+ 3[PO43-]
01:43:26
2. 强酸溶液:对于浓度为C 的一元强酸溶液pH 计算 精确式 最简式
13、某碱样为NaOH和Na2CO3的混合液。用HCl标准溶液滴定。 先以酚酞为指示剂,耗去HCl溶液体积为V1,继以甲基橙为 指示剂,又耗去HCl溶液体积为V2。V1与V2的关系是: C A、V1=2V2; B、2V1=V2; C、V1>V2;D、V1<V2。
14.某NaOH标准溶液,在保存过程中吸收了少量的CO2,若用此 标准溶液来标定HCl溶液浓度,以酚酞为指试剂,问所测得的 HCl溶液浓度结果( A ) A偏高 B 偏 低. C不影响 D不确定 15、某水样碱度组成为含CO32-碱度为0.0010mol/L,HCO3-碱度 为0.0020mol/L,则总碱度以CaCO3计为( ) A。2.0 mmol/L; B。 1.5 mmol/L; C。 3.0 mmol/L; D。 2.5 mmol/L
01:43:26
一元酸:以醋酸(HAc)为例 HAc 在水溶液中以HAc和Ac- 两种形式存 在,它们的平衡浓度分别为[HAc]和[Ac- ], 则总浓度(分析浓度): HA=H++A- c = [HAc] + [Ac- ] 设: HAc 的分布系数为δ1 ; Ac-的分布系数为δ0 ; 则: [HAc] [H+] 1= = + c [H ] + Ka [Ac-] Ka 0= = + c [H ] + Ka
01:43:26
δ0 +δ1= 1
例1、计算pH=5.00时, HAC和AC- (P63)
(已知Ka1=1.70×10-5)
解:
[HAc] [H+] 来自= = + c [H ] + Ka [Ac-] Ka 0= = + c [H ] + Ka
01:43:26
例2:在浓度为C的 NaNH4HPO4溶液的质子条件式
01:43:26
10、测定水样的碱度,用HCl标准溶液滴定。先以酚酞为指示剂, 耗去HCl溶液体积为P,继以甲基橙为指示剂,又耗去HCl溶液 体积为M,若P=M,则水样中的碱度组成为(A ) A. CO32-; B. HCO3C.CO32-和 HCO3- ; D. OH-和 CO3211.今有某溶液,酚酞在里面是无色的,甲基橙在里面是黄色的, 它可能含有哪些碱度 ( C ) A, OH- B,CO32- C,HCO3- D ,OH-+ CO32E、CO32-+ HCO3-
