偏摩尔体积测定
溶液偏摩尔体积的测定实验报告

溶液偏摩尔体积的测定实验报告
实验目的:
测定溶液的偏摩尔体积。
实验原理:
溶液的偏摩尔体积是指在一个特定温度下,溶质在溶液中单位摩尔体积的变化量。
偏摩尔体积可以通过对溶液稀释的实验来测定,根据实验数据可以绘制出摩尔体积随溶液浓度变化的曲线。
实验步骤:
1. 准备一定浓度的溶液A,并称取一定体积的溶液A。
2. 先称取一定体积的纯溶剂B,随后将溶液A定量加入纯溶剂B中,制备一系列不同浓度的溶液。
3. 分别测量不同浓度的溶液的摩尔体积,记录浓度和对应的摩尔体积数据。
4. 根据实验数据绘制摩尔体积随浓度变化的曲线。
实验数据:
溶液浓度 / mol/L 摩尔体积 / mL
0.1 50
0.2 48
0.3 45
0.4 42
0.5 40
实验结果:
根据实验数据绘制的摩尔体积随浓度变化的曲线如下:
实验讨论:
根据曲线可以看出,随着溶液浓度的增加,摩尔体积逐渐减小,这说明溶质在溶液中占据的体积随着浓度的增加而减小。
这可能是由于溶质分子在溶液中的相互作用力导致的。
结论:
本实验测定了溶液的偏摩尔体积,实验结果显示溶质在溶液中占据的体积随着溶液浓度的增加而减小。
物化实验偏摩尔体积测定
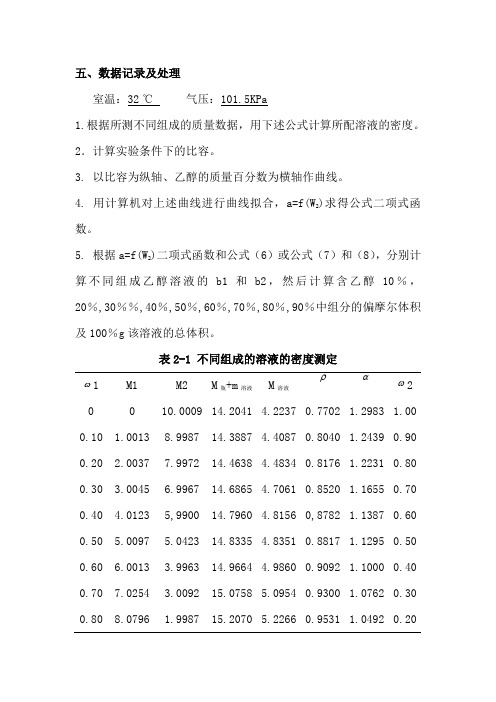
五、数据记录及处理室温:32℃气压:101.5KPa1.根据所测不同组成的质量数据,用下述公式计算所配溶液的密度。
2.计算实验条件下的比容。
3. 以比容为纵轴、乙醇的质量百分数为横轴作曲线。
4. 用计算机对上述曲线进行曲线拟合,a=f(W2)求得公式二项式函数。
5. 根据a=f(W2)二项式函数和公式(6)或公式(7)和(8),分别计算不同组成乙醇溶液的b1和b2,然后计算含乙醇10%,20%,30%%,40%,50%,60%,70%,80%,90%中组分的偏摩尔体积及100%g该溶液的总体积。
表2-1 不同组成的溶液的密度测定ω1 M1 M2 M瓶+m溶液M溶液ραω20 0 10.0009 14.2041 4.2237 0.7702 1.2983 1.00 0.10 1.0013 8.9987 14.3887 4.4087 0.8040 1.2439 0.90 0.20 2.0037 7.9972 14.4638 4.4834 0.8176 1.2231 0.80 0.30 3.0045 6.9967 14.6865 4.7061 0.8520 1.1655 0.70 0.40 4.0123 5,9900 14.7960 4.8156 0,8782 1.1387 0.60 0.50 5.0097 5.0423 14.8335 4.8351 0.8817 1.1295 0.50 0.60 6.0013 3.9963 14.9664 4.9860 0.9092 1.1000 0.40 0.70 7.0254 3.0092 15.0758 5.0954 0.9300 1.0762 0.30 0.80 8.0796 1.9987 15.2070 5.2266 0.9531 1.0492 0.200.90 9.0142 1.10129 15.3134 5.3330 0.9725 1.0283 0.10 1.00 10.0012 015.4641 5.4837 1.0000 1.0000图1 溶液的比容—质量百分数关系Y=1.0097+0.1713X+0.1098Xαω21β2βk 1.0000 0 1.0000 1.2056 0.1713 1.0283 0.10 1.0108 1.2500 0.1933 1.0492 0.20 1.0074 1.2656 0.2152 1.0762 0.30 1.0047 1.2893 0.2372 1.1000 0.40 0.9987 1.3096 0.2591 1.12950.500.99091.32820.28111.1387 0.60 0.9578 1.3215 0.30311.1655 0.70 0.9393 1.3557 0.32501.2231 0.80 0.9469 1.3663 0.34701.2439 0.90 0.9114 1.3540 0.36891.2983 1.00 0.9083 1.2983 0.3909六、注意事项1.实际需配制9份溶液,可用移液管加液,但乙醇含量根据称重算得。
偏摩尔体积的测定

偏摩尔体积的测定实验报告:偏摩尔体积测定⼀.实验⽬的1. 配置不同浓度的NaCl ⽔溶液,测定各容易的密度。
2. 计算溶液中各组分的偏摩尔体积。
3. 学习⽤⽐重管测定溶液的密度。
⼆.实验原理设体系有⼆组分A,B,体系的总体积V 是n A , n B 、温度、压⼒的函数,即V=f(n A ,n B ,T ,P )(C9.1)组分A 、B 的偏摩尔体积定义为B n P T A A n V V ,,)(= A n P T BB n V V ,,)(??= (C9.2)在恒定温度和压⼒下B n P T BA n P T A dn n Vdn n V dV A B ,,,,)()(+= (C9.3) dV=V A dn A + V B dn B(C9.4)体系总体积由式(C9.4)积分⽽得V = n A V A +n B V B(C9.5)在恒温恒压条件下对式(C9.5)微分dV=n A dV A +V A dn A ⼗n B dV B +V B dn B吉布斯-杜亥姆(Gibbs-Duhem )⽅程n A dV A +n B dV B =0(C9.6)在B 为溶质、A 为溶剂的溶液中,设V A *为纯溶剂的摩尔体积;V φ,B 定义为溶质B 的表观摩尔体积,则BAA Bn V n V V *-=,φ(C9.7)V= n A V A *+n B V φ,B(C9.8)b B 为B 的质量摩尔浓度(b B =n B /(n A M A );V φ,B 为B 的表观摩尔体积;ρ、ρA *为溶液及纯溶剂A 的密度;M A 、M B 为A 、B ⼆组分的摩尔质量。
可得ρρρρρ?B AB A BM b V +-=**, (C9.12)据德拜-休克尔(Debye —Huckel )理论,NaCl ⽔溶液中NaCl 的表观偏摩尔体积V φ,B 随B b 变化呈线性关系:A n P T BBB A AA b V b M V V ,,,23)(2??-=*φ(C9.14)A n P T BBB B B b V b V V ,,,,)(2??+=φφ(C9.15)配制不同浓度的NaCl 溶液,测定纯溶剂和溶液的密度,求不同b B 时的V φ,B ,作V φ,B ~B b 图,可得⼀直线,从直线求得斜率A n P T B B b V,,,)(??φ。
偏摩尔体积的测定

偏摩尔体积的测定
熔体体积(Molar volume)是指在标准状态下,由1 mol 分子或原子所组成的物质,占据某一单位体积的体积。
它是根据物质的分子量以及它的浓度来确定的。
它是表征物质
及其化学属性的一种重要的物理参数,也是化学测定中常用的参数。
因此,偏摩尔体积的
测定具有重要的理论意义以及实际应用价值。
偏摩尔体积的测定方法有很多,其中最常用的是蒸馏法。
该法是根据物质在室温下的
沸点来测定它的偏摩尔体积的,即将某种物质分解成两种以上的组分,然后以室温下的沸
点作为条件,将这些组分分开。
一般来说,当沸点越高的时候,它的偏摩尔体积会越小。
这个方法的优点是简便、容易掌握,但缺点是受沸点测定仪器的精度影响较大,不能测定
较低沸点的物质。
另外还有一种偏摩尔体积测定方法是电泳法。
该方法是利用特定物质在电场作用下移
动的原理进行测量,其偏摩尔体积取决于分子间电荷的数量和分子大小。
这种方法可以准
确测量低沸点物质的偏摩尔体积,其优点是精度高,但它的缺点是操作较复杂,耗费大量
的时间和人力。
除了以上常用的测定方法,还有一种比较少见的方法是热量法。
这种方法是利用物质
在加热后会发生膨胀的原理,来测量物质在标准温度下的偏摩尔体积,但它的精度受到实
验条件的影响,比较大。
偏摩尔体积的测定是一项重要的实验技术,有着广泛的实际应用,可用于测定分子量
比较大的有机物、无机物、同分异构体以及金属离子的偏摩尔体积,用于计算物质溶解度、共价键的构型,可有效的分析物质的结构与特性。
乙醇—水溶液偏摩尔体积的测定

乙醇—水溶液偏摩尔体积的测定一、实验原理溶液是由溶质和溶剂组成的。
在常温常压下,溶液中的溶剂不发生体积变化,而溶质所占的体积减小。
因此,溶液的体积总是小于溶剂和溶质的体积之和。
溶液的偏摩尔体积是指单位摩尔溶质所占的体积与对应的溶剂的体积之差,即:$$\Delta V_i = \frac{V_i^{solvent} - V_{i}^{solution}}{n_i}$$其中,$V_i^{solvent}$ 表示纯溶剂 i 的摩尔体积,$V_{i}^{solution}$ 表示浓度为 c 的 i 的溶液的摩尔体积,$n_i$ 表示摩尔浓度。
$\Delta V_i$ 的正负号表示溶质在溶剂中的体积效应。
若摩尔体积可用密度来计算,即:$$V_i = \frac{m_i}{\rho_i}$$其中,$m_i$ 是摩尔物质量,$\rho_i$ 表示物质的密度。
为了消除在密度方面的误差,可以通过比较相同浓度的溶液与纯溶剂的密度差来计算偏摩尔体积:$$\Delta \hat{V_i} = \hat{V_i} - V_i^{solvent} = \frac{\rho_{solution} -\rho_{solvent}}{\rho_{solvent}} \cdot V_i^{solvent} = \frac{\Delta\rho}{\rho_{solvent}} \cdot V_i^{solvent}$$其中,$\Delta \rho$ 表示溶液与溶剂的密度差,$\rho_{solvent}$ 表示溶剂的密度,$\hat{V_i}$ 表示偏摩尔体积。
二、实验步骤1. 实验原料:乙醇与双级蒸馏水。
比重杯、量筒、计时器。
密度计。
1. 用比重杯取一定质量的乙醇,称重并记录质量。
2. 将乙醇倒入量筒中,测量其体积并记录。
5. 将上述测量的数据代入公式中,计算乙醇水溶液的偏摩尔体积。
三、实验注意事项1. 比重杯的表面必须保持干燥,以避免附着水珠的干扰。
2021年实验二溶液偏摩尔体积的测定实验报告思考题绘图

试验二 溶液偏摩尔体积测定一、试验目偏摩尔量是溶液中一个关键参数, 有很多性质都与偏摩尔数量相关。
本试验是测定溶液偏摩尔体积。
1. 掌握用比重瓶测定溶液密度方法;2. 利用密度法测定指定组成乙醇—水溶液中各组分偏摩尔体积;3. 学会恒温槽使用。
4. 了解偏摩尔量物理意义。
二、 预习要求1.复习课堂讲授内容, 真正了解偏摩尔量物理意义。
2.了解摩尔体积—摩尔分数图与比容—质量百分数图之间关系。
三、 试验原理在多组分体系中, 某组分i 偏摩尔体积定义为,,,()j i m i T p n i j V V n ≠⎛⎫∂= ⎪∂⎝⎭ (1) 若是二组分体系, 则有21,1,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (2) 12,2,,m T p n V V n ⎛⎫∂= ⎪∂⎝⎭ (3) 体系总体积V=n1V1, m +n2V2。
m (4)将(4)式两边同除以溶液质量W1,2,1212m mV V W W V W M W M W=+(5) 令 1,2,12,,m m V V V W W Wααα=== (6) 式中α是溶液比容; α1, α2分别为组分1、 2偏质量体积。
将(6)式代入(5)式可得:α=W1%α1+W2%α2=(1-W2%)α1+W2%α2 (7)将(7)式对W2%微分:122122,%%W W αααααα∂∂=-+=+∂∂即 (8) 将(8)代回(7), 整理得121%%W W ααα∂=-∂ (9) 和 212%%W W ααα∂=+∂ (10)所以, 试验求出不一样浓度溶液比容α, 作α—W2%关系图, 得曲线CC′(见图15.1)。
如欲求M浓度溶液中各组分偏摩尔体积, 可在M点作切线, 此切线在两边截距AB和A′B′即为α1和α2, 再由关系式(6)就可求出V1,m 和V2,m 。
四、 仪器与药品1.仪器恒温设备1套; 分析天平(公用); 比重瓶(10mL)2个; 工业天平(公用); 磨口三角瓶(50mL)4个。
偏摩尔体积的测定

四.实验步骤:1.分别配置体积百分数为0%,20%,40%,60%,80%,100%的乙醇水溶液。
每份溶液的体积都控制在50ml左右。
2.将比重瓶洗净晾干,最好放在干燥橱干燥一会,然后放在电子天平上精确测量空的比重瓶质量。
3.用注射器向比重瓶内注入蒸馏水,然后再次放在电子天平上称重。
4.将3中的比重瓶的水倒去,然后用待测液清洗两到三次,在利用注射器向比重瓶依次注入待测的乙醇水溶液。
五.注意事项:1.注意比重瓶的毛细管部分非常脆弱,小心取放。
2.向比重瓶内注入溶液时不能有气泡。
3.称重时应用滤纸条包住比重瓶,不能直接用手取放比重瓶六.实验数据一号比重瓶:空瓶质量:12.0115g 注满水质量:21.8463g 容积:9.8637ml二号比重瓶:空瓶质量:9.3435g 注满水质量:19.6191g 容积:10.3058ml溶液配置(体积分数):0%:50ml蒸馏水20%:10ml乙醇+40ml蒸馏水40%:20ml乙醇+30ml蒸馏水60%:30ml乙醇+20ml蒸馏水80%:40ml乙醇+10ml蒸馏水100%:50ml乙醇乙醇体积分数一号比重瓶二号比重瓶20% 21.5751g 19.2222g40% 21.2691g 19.0240g60% 20.9561g 18.6709g80% 20.4520g 18.1468g100% 19.8255g 17.4827g乙醇质量分数比容(一号比重瓶)比容(二号比重瓶)16.516% 1.0314 1.043234.535% 1.0655 1.064654.274% 1.1028 1.104975.992% 1.1686 1.1707100% 1.2628 1.2662由图像得到,对于比容2,当乙醇质量分数为30%,比容为2.6203 对于比容1,当乙醇质量分数为30%,比容为2.6545 质量分数为30%的溶液中,乙醇的偏摩尔体积为58.302,水的偏摩尔体积为18.053100g时体积为108.2285㎝³七.实验思考:可能引起本实验的误差的有哪些?1.从电子天平角度分析:没有等读数稳定下来就读数;电子天平测量时需关闭玻璃门;直接用手将比重瓶放入天平室;2.从配置溶液过程分析:量取乙醇体积有误差;3.从实验仪器药品分析:本组实验所用的注射器针头粗细不一样,难以直接将溶液直接住满比重瓶;乙醇不纯;可能在毛细管处存在我们没有发现的气泡;实验总结:本实验关键在于配置溶液以及使用电子天平读数,难度虽不大,但都是些比较精细的操作过程,需要本组成员细心且耐心去对待这个实验。
溶液偏摩尔体积的测定数据处理

溶液偏摩尔体积的测定数据处理1. 引言嘿,朋友们,今天我们要聊一个听上去有点高深的课题——溶液偏摩尔体积的测定。
这听起来就像是科学家的秘密,实际上却与我们的日常生活息息相关。
比如,你有没有想过为什么不同的液体混合在一起会发生变化?就像你和朋友一起聚会,有的人一来就热闹非凡,有的人则默默无闻,气氛瞬间改变。
溶液的偏摩尔体积就是在帮我们理解这些变化的“调皮鬼”。
1.1 溶液偏摩尔体积是什么?说到偏摩尔体积,简单来说,它就是每种组分在溶液中所占的“个人空间”。
想象一下,你跟一群朋友在一块儿玩,你的空间就叫做“偏摩尔体积”。
而溶液中的每种成分都有自己的偏摩尔体积,这些数字反映了它们在一起时的“互动效果”。
这就像在一个派对上,有的人喜欢占据舞池,有的人则偏好待在角落,造成的整体氛围可就大相径庭了。
1.2 为啥要测定偏摩尔体积?那么,为什么我们要测定偏摩尔体积呢?哎,这就跟你去餐馆点菜一样,想知道什么菜好吃、价钱合理,测定偏摩尔体积可以帮助我们预测溶液的性质,知道在某种条件下,哪种物质的表现更“讨喜”。
这对于化学反应、药物设计等领域都非常重要,毕竟谁也不想做实验时惊讶得掉下巴。
2. 数据测定的步骤好啦,接下来我们就进入正题,看看怎么测定这个偏摩尔体积。
其实过程并不复杂,但需要一点耐心哦,像是做饭前的准备工作。
2.1 准备材料首先,你得准备一些必要的工具,比如量筒、电子天平、温度计等等。
可以说,没了这些工具,咱们就像做菜没了锅,难以成事!同时,你还需要选择要研究的溶液成分,确保它们的纯度高,这样测出来的数据才更靠谱。
想想看,拿着一杯泥沙俱下的水,谁能喝得下去?2.2 实际测量接下来,就是测量环节。
我们将溶液倒入量筒,仔细记录体积变化。
记得保持微笑,尽量避免任何气泡,因为那可是数据测量的“杀手”!而后,我们还需要计算每种成分的摩尔体积。
这一步就像算账一样,要认真仔细,别漏掉了任何一个数字。
毕竟,误差就像调料,太多太少都影响“味道”。
偏摩尔体积测定

C B
H
E 组份2重量百分数
式两边乘M1(组分1 的摩尔质量)
A 图1
G 2
D
G2 图
1
dV AB M 1 V1,m W1 d M1
ห้องสมุดไป่ตู้
组分1的偏 摩尔体积
同理可证明求得DF×M2为组分2的偏摩尔体积V2,m
t ,s 温度定为ts时该物质的密度 t ,m 温度定为tW时水的密度
偏摩尔体积 在T,P不变下,多组分均相体系中,组分为n1、n2、 n3…ni 摩尔时,体系的广度性质(如体积、熵、吉布 斯自由能等)对各组分摩尔数的偏微分,称为偏摩尔 量
体积的偏摩尔量为:
Vi,m
V = ni T , P ,n j i
一定T,P下,体系的体积V 和各偏摩尔 体积V1,m,V2,m….之间有如下关系:
V = nV i i,m
i=1
k
对二组分体系
V =nV 1 1,m +n2V2,m
偏摩尔体积有各种求法,最常用有回归分析法和图解法 图解法(截矩法) 设有W1克组分1和W2克组分2混合,溶液的密度为ρ, 溶液的体积为
实验目的
偏摩尔体积的测定
1. 配制不同浓度乙醇水溶液,测定各溶液中各组份 的偏摩尔体积。 2. 学会用比重管测定液体密度的方法。 3. 通过实验加深对偏摩尔体积的理解。 实验原理 密度是单位体积物质的质量,可由下式表示:
m t = V
单位:Kg· m-3 ;g· mL-1
某种物质对于水的相对密度定义为
两式相比得
dD dV 1 V 1 dG2 dW1 G2 W1 W2 G2
整理得:
dD dV G2 D dG2 dW1
实验二溶液偏摩尔体积的测定实验报告思考题绘图

实验二 溶液偏摩尔体积的测定一、 实验目的偏摩尔戢是溶液中一个重要参数,有许多性质都与偏摩尔数量有关。
本实验是测左溶液的 偏摩尔体积。
1. 掌握用比重瓶测泄溶液密度的方法;2. 运用密度法测立指左组成的乙醇一水溶液中各组分的偏摩尔体积:3. 学会恒温槽的使用。
4. 理解偏摩尔虽的物理意义。
二、 预习要求1•复习课堂讲授内容,真正理解偏摩尔量的物理意义。
2•理解摩尔体积一摩尔分数图与比容一质量百分数图之间的关系。
三、实验原理在多组分体系中,某组分i 的偏摩尔体积左义为(1)若是二组分体系,则有oVT.p.nydV体系总体积V= n i V\. m + 门 2 #2・ m将⑷式两边同除以溶液质量“v V v一 =a s = a 2,11 = a W ' W P IV 2式中a 是溶液的比容;au 4分别为组分1、2的偏质量体积。
将⑹式代入⑸式可得:a= ”i%ai+ W z 2%a2=(l- ^2%)ai+ ^2%a?0V(7)将(7)式对W?%微分:将(8)代回(7),整理得所以,实验求岀不同浓度溶液的比容*作(X — “2%关系图,得曲线CCX 见图15」)。
如欲求N4浓度溶液 中各组分的偏摩尔体积,可在M 点作切线,此切线在两边的截距A B 和A W 即为⑴和(12,再由关系式(6)就可求岀Am 和r 2.mo四. 仪器与药品1•仪器恒温设备1套:分析天平(公用):比重瓶(10mL)2个:工业天平(公用):磨口三角瓶(50mL)4 个。
2 •药品95%乙醇(分析纯),纯水。
五、实验步骤调节恒温槽温度为(25.0±0.irc o以95%乙醇(A)及纯水(B)为原液,任磨口锥形瓶瓶中用分析天平称重,配制含A 体积 百分数为0%, 20%, 40%, 60%, 80%, 100%的乙醇水溶液,每份溶液的总体积为20ml 。
配好后盖紧塞子,以防挥发。
摇匀后测左每份溶液的密度,其方法如下:用分析天平精确称量一个预先洗净烘干的比重瓶,然后盛满纯水(注意不得存留气泡), 用滤纸迅速擦去毛细管膨胀出来的水。
实验二--溶液偏摩尔体积的测定实验报告-思考题-绘图

实验⼆--溶液偏摩尔体积的测定实验报告-思考题-绘图实验⼆溶液偏摩尔体积的测定⼀、实验⽬的偏摩尔量是溶液中⼀个重要参数,有许多性质都与偏摩尔数量有关。
本实验是测定溶液的偏摩尔体积。
1. 掌握⽤⽐重瓶测定溶液密度的⽅法;2. 运⽤密度法测定指定组成的⼄醇—⽔溶液中各组分的偏摩尔体积;3. 学会恒温槽的使⽤。
4. 理解偏摩尔量的物理意义。
⼆、预习要求1.复习课堂讲授内容,真正理解偏摩尔量的物理意义。
2.理解摩尔体积—摩尔分数图与⽐容—质量百分数图之间的关系。
三、实验原理在多组分体系中,某组分i 的偏摩尔体积定义为,,,()j i m i T p n i j V V n ≠= ?(1) 若是⼆组分体系,则有21,1,,m T p n V V n = ?(2) 12,2,,m T p n V V n ??=(3) 体系总体积V=n1V1,m +n2V2。
m (4)将(4)式两边同除以溶液质量W1,2,1212m mV V W W V W M W M W=+g g (5) 令 1,2,12,,m m V V V W W Wααα=== (6) 式中α是溶液的⽐容;α1,α2分别为组分1、2的偏质量体积。
将(6)式代⼊(5)式可得:α=W1%α1+W2%α2=(1-W2%)α1+W2%α2 (7)将(7)式对W2%微分:122122,%%W W αααααα??=-+=+??即 (8)将(8)代回(7),整理得121%%W W ααα?=-?g (9)和 212%%W W ααα?=+?g (10)所以,实验求出不同浓度溶液的⽐容α,作α—W2%关系图,得曲线CC′(见图15.1)。
如欲求M浓度溶液中各组分的偏摩尔体积,可在M点作切线,此切线在两边的截距AB和A′B′即为α1和α2,再由关系式(6)就可求出V1,m 和V2,m 。
四、仪器与药品1.仪器恒温设备1套;分析天平(公⽤);⽐重瓶(10mL)2个;⼯业天平(公⽤);磨⼝三⾓瓶(50mL)4个。
偏摩尔体积测定

同理:
VB,m=M B. BP
……………(6)
测得不同浓度乙醇溶液的比容 V 比, 作 W 乙醇 与 V 比比容的曲线, 即可按上式求出各种浓度下的偏摩尔体积。
三 仪器与药品
恒温槽,100mL 磨口锥形瓶,10mL 比重瓶,10mL 量筒。 乙醇和蒸馏水若干。
四 实验步骤
1.比重瓶体积的测定 将比重瓶洗净烘干,精确称其重量,然后,装满蒸馏水,塞紧瓶塞。在 298.2K 下恒温,比重瓶内液体 由瓶塞的毛细管孔逸出,约 15min 后,取出并擦干比重瓶表面上的水滴,然后称重。 2 不同浓度溶液比容的测定 按(2)式计算,配制乙醇的重量百分数分别为 20%,40%,60%,80%,100%的溶液 50ml(四组用)。
W A =WA%=
WA W A WB
=
nA M A …………………………(2) n A M A nB M B
设溶液的比容为 V 比,则溶液的总体积 V 可写为 V (W A WB )V比 =(nAM A+nBMB)V 比……(3) 根据偏摩尔体积定义,用(2)与(3)式可得:
V V WB V A, m M AV比 (n A M A nB M B ) 比 n A T , p , nB W B T , P n A nB
六 注意事项
恒温槽的温度应比室温略高些, 槽内的水面不要没过比重瓶的磨口处, 比重瓶每次要用待测液润洗两次。
七 思考题
1 我们用的方法测密度由几位有效数字?实验的重复性如何?产生误差的原因有哪些? 2 比重瓶的构造如何改进可使实验的准确度提高? 3 为什么恒温槽的温度要高于室温? 4 偏摩尔量是强度性质还是容量性质?
偏摩尔体积的测定实验报告

偏摩尔体积的测定实验报告一、实验目的1. 了解偏摩尔体积的概念和计算方法;2. 计算溶液的偏摩尔体积,并分析影响因素;3. 熟悉溶液浓度的测定方法。
二、实验原理偏摩尔体积是指溶液中各成分分子的体积加起来的和减去溶液的实际体积得到的体积,它的单位是cm3/mol。
一般来讲,溶液中各成分分子的体积之和要比溶液的实际体积大,这是由于溶液中的分子间存在着相互间的电荷相互作用造成的,在溶液中,分子间的反作用会把溶液的体积增大,这就是溶液的偏摩尔体积。
三、实验原料盐酸、苯乙烯、重量等级分子筛(200目)、10%硫酸铵溶液、0.1mol/L NaCl溶液、滴定管、滴管、滴定瓶、烧杯、烧瓶。
四、实验步骤1. 在滴定瓶中加入硫酸铵溶液和苯乙烯,用滴定管滴定,直到滴定液恒定;2. 将滴定液放入烧杯中,加入重量等级分子筛等,放入烧瓶中,加热至60°C,振荡搅拌;3. 将溶液加入滴定瓶,用滴管滴定,直到滴定液恒定;4. 将滴定液放入烧杯中,加入0.1mol/L NaCl溶液,放入烧瓶中,加热至60°C,振荡搅拌;5. 重复步骤3-4,计算溶液的偏摩尔体积。
五、实验结果分析实验结果显示,溶液的偏摩尔体积为20.3 cm3/mol。
由此可见,溶液中各成分分子的体积加起来的和减去溶液的实际体积得到的体积为20.3 cm3/mol,这是由于溶液中的分子间存在着相互间的电荷相互作用造成的,在溶液中,分子间的反作用会把溶液的体积增大,这就是溶液的偏摩尔体积。
六、总结本实验的目的是计算溶液的偏摩尔体积,以及分析影响因素。
实验结果显示,溶液的偏摩尔体积为20.3 cm3/mol。
通过实验,我们更深入地了解了偏摩尔体积的概念和计算方法,对溶液浓度的测定有了更深入的理解。
偏摩尔体积的测定

实验十 偏摩尔体积的测定一、实验目的1.配制不同浓度的NaCl 溶液,通过测定溶液的密度,求算其偏摩尔体积。
二、实验原理在T,p 不变的A,B 两组分溶液中,如A 组分的物质的量为A n ,B 组分的物质的量为B n ,则溶液的任何广度性质(Y)可表示为,,,,BA AB A A B B A B T p n T p n Y Y dY dn dn Y dn Y dn n n ⎛⎫⎛⎫∂∂=+=+ ⎪ ⎪∂∂⎝⎭⎝⎭ (1)积分上式,得A AB B Y n Y n Y =+ (2) 定义表观摩尔体积V φ为*A AV B V n V n φ-=(3) 式中:V 为溶液体积,*A V 为T,p 不变下纯A 的摩尔体积。
方程(3)式可变为*B V A A V n n V φ=+ (4) (4)式对B n 偏微商,得,,,,AA VB V B B B T p n T p n V V n n n φφ⎛⎫⎛⎫∂∂==+ ⎪⎪∂∂⎝⎭⎝⎭ (5)以,,B A V V V 代替(2)式中的,,B A Y Y Y ,则B BA AV n V V n -=(6) 结合(4),(5),(6)三式,得*2,,1A V A A A B A B T p n V n V n n n φ⎡⎤⎛⎫∂⎢⎥=- ⎪∂⎢⎥⎝⎭⎣⎦ (7) 在已知A n ,B n 和摩尔质量,A B M M 及溶液密度ρ的情况下,由(7)式可计算A V ,因为A AB Bn M n M V ρ+=(8)将(8)式代入(3),得*1A A B B V A A B n M n M n V n φρ⎡⎤+=-⎢⎥⎣⎦(9) 采用质量摩尔浓度B m ,令式中B n =B m ,1000A An M =,则(9)式变为 *100011000/B B V B A A m M m M V φρ⎡⎤+=-⎢⎥⎣⎦(10) 在T,p 不变时,纯A 的密度**AA AM V ρ=则(10)式最后可表示为1000()B v A B A M m φρρρρρ**=-+ (11) 由(7)式求A V 时,其中VBn φ⎛⎫∂ ⎪∂⎝⎭要通过作V φ-B n 图求微商而得,但V φ-B n 并非线性关系.Debye-Huckel 证明,对于强电介质的稀水溶液, V φ随B m 有线性关系,故可作如下变换,,,,,,,,12A A A A B V V V V B B B B B B T p n T p n T p n T p n m n m m m m mφφφφ⎛⎫⎛⎫∂⎛⎫⎛⎫∂∂∂∂==⨯= ⎪⎪ ⎪ ⎪ ⎪⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭(12) 可作V φ-B m 图,该图为直线,其直线斜率为VBm φ∂∂. 因此,不仅可用(7)式求A V ,还可通过(5)式求B V .在计算过程中应注意:,1000/B B A A n m n M ==(A M 为A 的摩尔质量)。
偏摩尔体积的测定实验报告

偏摩尔体积的测定实验报告实验目的:通过实验,掌握偏摩尔体积的测定方法,加深对气体化学性质的理解。
实验仪器和药品:实验仪器,烧杯、烧瓶、导管、水槽、气压计、气体收集瓶。
实验药品,氢氧化钠溶液、稀盐酸、锌粉、氢气。
实验原理:偏摩尔体积是指气体在一定条件下的体积,通常以标准状态下的体积为基准。
在标准状态下,1摩尔气体的体积为22.4升。
偏摩尔体积的测定是通过实验测定气体在一定条件下的体积,然后根据实验数据计算出偏摩尔体积。
实验步骤:1. 将烧瓶中的氢氧化钠溶液和锌粉混合,产生氢气。
2. 将产生的氢气通过导管收集到气体收集瓶中。
3. 在水槽中,将气体收集瓶倒置于水中,使氢气充满整个气体收集瓶。
4. 用气压计测定氢气的压强和温度。
5. 根据实验数据计算出氢气的体积,并据此计算出偏摩尔体积。
实验数据:1. 实验温度,25℃。
2. 氢气压强,98 kPa。
3. 氢气体积,45 mL。
实验结果:根据实验数据计算出氢气的偏摩尔体积为0.082升/摩尔。
实验分析:通过本次实验,我们成功地测定了氢气的偏摩尔体积。
实验结果与理论值相近,表明实验操作准确,数据可靠。
偏摩尔体积是气体化学中重要的物理量,它与气体的化学性质密切相关。
掌握偏摩尔体积的测定方法,有助于加深对气体化学性质的理解,为进一步研究气体化学提供了基础。
结论:本次实验通过测定氢气的偏摩尔体积,掌握了偏摩尔体积的测定方法,并成功计算出氢气的偏摩尔体积。
实验结果可靠,为深入研究气体化学提供了基础。
实验注意事项:1. 实验操作要细心,确保实验数据的准确性。
2. 实验结束后,要及时清洗实验仪器,保持实验环境整洁。
3. 实验过程中要注意安全,避免发生意外事故。
参考文献:[1]《化学实验指导与技术》。
[2]《化学实验原理与技术》。
以上为偏摩尔体积的测定实验报告。
测定偏摩尔体积思考题

测定偏摩尔体积思考题
测定偏摩尔体积是化学实验中常见的一个实验项目,通常用于
研究气体的性质。
偏摩尔体积是指在一定条件下,单位摩尔物质的
气体所占据的体积。
在实验中,我们可以通过一定的操作和测量来
确定气体的偏摩尔体积。
下面我将从实验原理、操作步骤和数据处
理等多个角度来详细介绍测定偏摩尔体积的思考题。
首先,测定偏摩尔体积的实验原理是基于气体状态方程PV=nRT (P为气体压强,V为气体体积,n为摩尔数,R为气体常数,T为
绝对温度)以及理想气体的假设。
根据这些原理,我们可以通过测
量气体的压强、体积和温度,来计算出气体的摩尔数,从而确定偏
摩尔体积。
其次,测定偏摩尔体积的操作步骤一般包括准备气体样品、测
量气体的压强、体积和温度等环节。
首先需要准备好气体样品,并
将其通入一个已知体积的容器中,然后测量容器内气体的压强和温度,并记录下来。
接着可以通过测量容器的体积来得到气体的摩尔数,最终计算出偏摩尔体积。
最后,在数据处理方面,我们需要将实验中得到的压强、体积、
温度等数据进行整理和处理,然后利用气体状态方程PV=nRT进行计算,最终得到气体的偏摩尔体积。
在数据处理过程中,需要注意数
据的准确性和可靠性,以及计算过程中可能存在的误差和不确定性。
总的来说,测定偏摩尔体积是一个涉及多个方面知识和技能的
实验项目,需要我们在实验操作、数据处理和结果分析等方面都要
非常细致和严谨。
希望以上内容能够对你有所帮助。
实验二 偏摩尔体积的测定

实验二 偏摩尔体积的测定一、实验目的1.掌握通过测量密度求取二组分溶液偏摩尔体积的方法2.加深对偏摩尔体积概念的认识3.学习定温下溶液密度的测定方法 二、实验原理在定温定压下,由于A 、B 各组分的微小变化引起的二组分溶液的某一广度性质,如体积V 的变化可表示B ,,BA ,,A d )(d )(d AB n n Vn n V V n p T n p T ∂∂+∂∂= (6-1) 令 B ,,A A )(n p T n V V ∂∂= , A ,,BB )(n p T n VV ∂∂= (6-2) 则(6-1)式可表示为B B A A d d d n V n V V += (6-3)其中,VA、VB分别称为组分A 和组分B 的偏摩尔体积。
在T,p 恒定条件下,对式(6-3)两边积分,可得B B A A V n V n V += (6-4)其中VA、VB彼此不是相互独立的,VA的变化将引起VB的变化,反之亦然。
因而难于用(6-4)式直接求取VA、VB。
本实验用Q ~m 作图法求取二组分系统的偏摩尔体积VA、VB。
(6-4)式可写成:Q n V n V B A ,m A +=。
其中,A ,m V 为纯A 的摩尔体积,Q 定义为组分B 的表观摩尔体积。
BAm,A n V n V Q -=经推导可以得到如下四个关系式(推导过程附后)ρρρρρB A A )(1000M m Q +-=(6-5)mQ mQ Q ∂∂+=0 (6-6))21(51.552Am,A mQ m m V V ∂∂⋅-= (6-7) A ,,0B )(23n p T mQ m Q V ∂∂+= (6-8) 其中,ρ为溶液的密度,ρA为纯组分A 的密度;m 为溶液的质量摩尔浓度;MB为组分B 的摩尔质量。
在恒定的温度和压力下,通过称量组分A 和组分B 的质量,就可以计算出相应溶液的质量摩尔浓度m ,通过称量溶液的质量,就可以得到溶液的密度ρ,组分A 的密度ρA可以查表得到。
偏摩尔体积的测定实验报告

偏摩尔体积的测定实验报告偏摩尔体积的测定实验报告引言:偏摩尔体积是物质在溶液中的体积变化与溶液浓度之间的关系。
测定偏摩尔体积可以帮助我们了解溶质和溶剂之间的相互作用力,对于理解溶液的性质和溶解过程有着重要的意义。
本实验旨在通过测定溶液的密度和浓度,计算偏摩尔体积的数值,并讨论溶质和溶剂之间的相互作用力。
实验方法:1. 实验仪器和试剂准备:本实验所需的仪器包括电子天平、容量瓶、滴定管、移液管等。
试剂包括溶剂(如水)和溶质(如盐酸)。
2. 实验步骤:(1)准备不同浓度的溶液:根据实验要求,按照一定比例配制出不同浓度的溶液。
(2)测定溶液的密度:使用电子天平称取一定质量的溶液,然后使用容量瓶将溶液定容至一定体积,记录容量瓶上的刻度,计算溶液的密度。
(3)测定溶液的浓度:使用滴定管或移液管,取一定体积的溶液,加入适量的指示剂,滴定至终点,记录滴定的体积,计算溶液的浓度。
(4)计算偏摩尔体积:根据溶液的密度和浓度,利用公式计算偏摩尔体积的数值。
结果与讨论:通过实验测得不同浓度溶液的密度和浓度数据,利用计算公式得到偏摩尔体积的数值。
根据实验结果发现,偏摩尔体积随溶液浓度的增加而减小,即溶质的添加导致溶液体积的收缩。
这表明溶质与溶剂之间存在着相互作用力,溶质的添加改变了溶剂的结构,导致溶液体积的变化。
进一步分析发现,偏摩尔体积的数值随着溶质浓度的增加而逐渐趋于一个极限值。
这说明在高浓度下,溶质与溶剂的相互作用已经达到了饱和状态,继续增加溶质的浓度不会再引起溶液体积的明显变化。
这种趋势可以用溶质与溶剂之间的相互作用力饱和来解释,即溶质与溶剂之间的相互作用力已经达到了最大值。
此外,实验还发现溶液的温度对偏摩尔体积有一定的影响。
随着温度的升高,偏摩尔体积的数值增加,即溶液的体积随温度的升高而膨胀。
这可以解释为温度的升高增加了溶剂分子的热运动,使得溶剂分子之间的相互作用力减弱,导致溶液体积的增加。
结论:通过实验测定和计算,得到了不同浓度溶液的偏摩尔体积数值,并讨论了溶质和溶剂之间的相互作用力。
偏摩尔体积的测定

实验五 溶液偏摩尔体积的测定一、实验目的1.测定指定组成的乙醇—水溶液中各组分的偏摩尔体积。
2.掌握用比重瓶测定溶液密度的方法。
二、实验原理在多组分体系中,某组分i 的偏摩尔体积定义为⎪⎭⎫ ⎝⎛∂∂=i i n V V niP T ,, (1) 若是二组分体系,则有()ABn V V n P T A ∂∂=,, ()BAn V V n P T B∂∂=,,体系总体积=V A A V n +B B V n (2)将(2)式两边同除以溶液质量m V M m m V A A A ⨯=+m V M m BBB ⨯ (3) 令,α=m V,αA M V A A = αB BB M V = (4) 式中α是溶液的比容;αA ,αB 分别为组分A 、B 的偏质量体积。
将(4)式代入(3)式可得: α=WA %αA+WB %αB=(1-WB %)αA+WB %αB (5)将(5)式对WB%微分:αααB A B W +-=∂∂%, 即 αααAB B W +∂∂=% (6)将(6)代回(5),整理得 %%W W B B A ∂∂⨯+=ααα (7)和 %%W W B B A ∂∂=⨯-ααα (8)图16 比重瓶所以,实验求出不同浓度溶液的比容α,作α—WB%关系图,得曲线CC′(见图15)。
如欲求M浓度溶液中各组分的偏摩尔体积,可在M点作切线,此切线在两边的截距AB和A′B′即为αA和αB,再由关系式(4)就可求出VA和VB。
三、仪器药品恒温槽1台;电子天平1台;50ml磨口锥形瓶4只;10ml比重瓶1只;无水乙醇(AR);蒸馏水。
四、实验步骤1、调节恒温槽温度为(25.0±0.1)℃。
2、溶液配制以95%乙醇(A)及纯水(B)为原液,在磨口锥形瓶瓶中用分析天平称重,配制含A体积百分数为0%,20%,40%,60%,80%,100%的乙醇水溶液,每份溶液的总体积为20ml。
配好后盖紧塞子,以防挥发。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
偏摩尔体积测定
实验日期:20年月日
姓名:班号:学号:
一、实验目的及要求
1)配制不同浓度的NaCl水溶液,用密度瓶测定各溶液的密度。
2)计算溶液中各组分的偏摩尔体积。
二、原理
设体系有二组分A,B,体系的总体积V是n A, n B、温度、压力的函数,即
V=f(n A ,n B,T,P)(C9.1)
组分A、B的偏摩尔体积定义为
(C9.2)
在恒定温度和压力下
(C9.3)
dV=V A dn A + V B dn B (C9.4)
体系总体积由式C9.4积分而得
V = n A V A+n B V B(C9.5)
在恒温恒压条件下对式C9.5微分
dV=n A dV A+V A dn A十n B dV B+V B dn B
吉布斯-杜亥姆(Gibbs-Duhem)方程
n A dV A+n B dV B =0(C9.6)
在B为溶质、A为溶剂的溶液中,设V A*为纯溶剂的摩尔体积;V f,B定义为溶质B的表观摩尔体积,则
(C9.7)
V= n A V A*+n B V f,B(C9.8)
(C9.11)
b B为B的质量摩尔浓度(b B =n B/(n A M A);Vφ,B为B的表观摩尔体积;ρ、ρA*为溶液
及纯溶剂A的密度;M A、M B为A、B二组分的摩尔质量。
可得
(C9.12)
据德拜-休克尔(Debye—Huckel)理论,NaCl水溶液中NaCl的表观偏摩尔体积V f,B随
变化呈线性关系,
(C9.14)
(C9.15)
配制不同浓度的NaCl溶液,测定纯溶剂和溶液的密度,求不同b B时的V f,B,作V f,B~图,
可得一直线,从直线求得斜率。
由式C9.14、C9.15计算V A、V B。
三、实验步骤
1)调节恒温槽至设定温度,33℃。
2)配制不同组成的NaCl水溶液:用称量法配制质量百分比约为:1%、4%, 8%、12%和16%的NaCl水溶液.
3)了解用比重管测液体密度的方法。
洗净、干燥比重管。
在分析天平上称量空比重管(注意带盖)。
4)将密度瓶装满去离子水,放入恒温槽内恒温10min,擦干比重管外部,在分析天平上再称量。
重复本步骤一次。
5)将已进行步骤4操作的比重管用待装溶液涮洗3次,再装满NaCl水溶液,放入恒温槽内恒温10min。
擦干比重管外部,在分析天平上称量。
重复本步骤操作一次。
6)用上述步骤5的方法对其它浓度NaCl溶液进行操作。
四、数据记录与处理
表C9.1 实验数据
第一组数据NaCl的表现摩尔体积偏差过大,故舍去,用后四组数据得到图Vφ,B~图
五、思考题
1 偏摩尔体积可能小于零吗?
可以
2在实验操作中如何减小称量误差?
在使用称量瓶称量水的过程中要求管中没有气泡,避免气泡产生,可以在盛满水的烧杯中给称量瓶盖上盖子,减小实验误差。
