QP-42 飞行检查准备程序
飞检实施方案

飞检实施方案一、引言。
飞检是一种重要的安全管理手段,通过对飞行器进行定期检查,可以及时发现并排除飞行器存在的安全隐患,保障飞行安全。
为了有效实施飞检工作,制定科学合理的飞检实施方案至关重要。
二、飞检实施方案的制定原则。
1.安全第一。
飞检实施方案应以保障飞行安全为首要原则,确保每一架飞行器的安全飞行。
2.科学合理。
飞检实施方案应基于科学数据和经验总结,制定合理的飞检周期和内容,确保飞检工作的有效性。
3.全面细致。
飞检实施方案应覆盖飞行器的各个部位和系统,对每一个细节都要进行全面检查,杜绝疏漏。
4.规范标准。
飞检实施方案应符合国家和行业的相关标准和规范,确保飞检工作的合法合规。
三、飞检实施方案的内容。
1.飞检周期。
根据飞行器的使用情况和技术要求,制定飞检周期,一般分为日常飞检、定期飞检和特别飞检。
日常飞检由飞行员和机务人员完成,定期飞检由专业的维修人员完成,特别飞检针对特定情况进行。
2.飞检内容。
飞检内容包括飞行器的外部和内部结构、发动机、机载设备、油液系统、电气系统等各个方面的检查,确保每一个部件都处于良好状态。
3.飞检程序。
制定详细的飞检程序,包括检查前的准备工作、检查过程中的注意事项、异常情况的处理方法等,确保飞检工作有条不紊地进行。
4.飞检记录。
对每一次飞检都要做好详细的记录,包括检查的内容、发现的问题、处理的方法等,为飞行器的后续维护提供参考依据。
四、飞检实施方案的执行。
1.组织实施。
飞检实施需要由专业的机务人员和维修人员组成的团队来完成,确保每一次飞检都能够得到有效执行。
2.监督检查。
对飞检工作进行定期的监督检查,确保飞检实施方案得到有效执行,并及时发现和解决存在的问题。
3.持续改进。
根据实际情况和飞检工作的效果,及时对飞检实施方案进行调整和改进,不断提高飞检工作的质量和效率。
五、总结。
飞检实施方案是飞行安全管理的重要组成部分,制定科学合理的飞检实施方案对保障飞行安全至关重要。
只有严格执行飞检实施方案,才能确保飞行器的安全飞行,为航空运输的安全稳定做出贡献。
QP-42-飞行检查准备程序

6.5 国内关于不配合审查的要求与处理
6.5.1 有下列情形之一的,视为拒绝、逃避检查: - 拖延、限制、拒绝检查人员进入被检查场所或
者区域的,或者限制检查时间的; - 无正当理由不提供或者延迟提供与检查相关
的文件、记录、票据、凭证、电子数据等材料的; - 以声称工作人员不在、故意停止生产经营等方
式欺骗、误导、逃避检查的; - 拒绝或者限制拍摄、复印、抽样等取证工作的; - 其他不配合检查的情形。
理 部部
部 部部政
管部
部部
部
理
部
分发 份数
1
1
1
1
1
1 2 11 1
1
1
制/修订记录
日期
制/修订内容
制定
审核
批准
1.根据 2013/473/EU 指令、
与《药品医疗器械飞行检 ____ _____ ____
2016- 查办法》与 SGS 审核员的 ___ __ ___
1-19 要求,新制定;
王海 丘璇, 王海
2.结合公司的质量体系升级 龙 游长 龙
规划,版本为 C/0。
春
文件名称
飞行检查准备程序
类别
QP
页次
1/3
编号
QP-42 版本/次
C/0
- 例行飞行检查抽样(一般三年一次); - 公司产品在市场上出现重大投诉或可能的医疗事
故案例;
6.2 飞行检查的内部临时通知
6.2.1 根据质量体系的管理要求,公司的质量管理体 系应实时保持有效的运行。
6.3 飞行检查的实施与陪同
6.3.1 当审核人员安排好后,得到审核员的通知时, 安排全体管理人员参加首次会议。在会议中审 核人员会将此次审核的主要目的与要求予以讲 明,各部门需要听取后会后作出安排。并且在 会议时,签名确认。
医疗器械生产企业飞行检查工作程序征求意见稿

医疗器械生产企业飞行检查工作程序征求意见稿I. 引言医疗器械生产企业是保障人们的健康和生命安全的重要角色。
为了确保医疗器械的质量安全和合规性,飞行检查成为一种常见的监管手段。
本文旨在征求意见,就医疗器械生产企业飞行检查工作程序进行讨论和改进。
II. 检查前准备工作在进行飞行检查之前,需要进行一系列准备工作,包括但不限于:1. 调研和了解被检企业的基本情况,包括企业所属行业、生产的医疗器械类型和规模等;2. 制定检查计划,明确检查的目的、范围和重点;3. 统筹调度人员,包括检查组成员、行业专家等;4. 准备必要的工具和设备,如检测设备、纸质文件等;III. 飞行检查程序飞行检查程序是保障检查的公正性和高效性的关键。
以下是飞行检查程序的大致步骤:1. 通知企业:在确定检查时间前,向被检查企业发出书面通知,说明检查目的、范围和具体时间等信息;2. 签到:检查组成员按时到达企业,并在被检查企业处进行签到手续;3. 阐述目的与规则:检查组成员向企业负责人和相关员工阐述检查的目的、规则和时限等;4. 调查和采访:检查组成员根据检查计划,对企业的各个环节进行调查和采访,了解企业的生产流程、管理制度等;5. 检查设备:检查组成员对企业的检测设备进行检查和验证,确保其准确性和有效性;6. 获取样品:根据检查计划,获取医疗器械的样品,进行后续的检测和评估;7. 检查记录:检查组成员在整个检查过程中,逐步生成检查记录和相关资料,确保过程的可追溯性和准确性;8. 检查总结和反馈:在检查结束后,检查组成员与企业负责人进行总结和反馈,提出存在的问题和改进建议;9. 评估和报告:依据检查结果,进行医疗器械质量和合规性的评估,并生成飞行检查报告。
IV. 检查后续工作飞行检查结束后,还需要进行一系列后续工作,包括但不限于:1. 整理和归档文件:对检查过程中生成的各类文件进行整理和归档,确保其整洁有序,并便于后续查阅和审计等;2. 检查报告的生成和传达:根据检查记录和评估结果,生成检查报告,并及时传达给被检查企业和相关监管部门;3. 监督和整改:根据飞行检查报告,监督被检查企业按照规定要求进行整改,并定期跟进和督促;4. 经验总结与分享:定期总结飞行检查工作的经验和教训,分享给其他相似领域的监管机构或企业,促进行业的规范化和合规化。
民用运输机场仪表飞行程序验证实施指南

民用运输机场仪表飞行程序验证实施指南第一章总则1.目的和依据为进一步完善飞行程序质量保证体系,规范仪表飞行程序验证工作,根据《民用机场飞行程序和运行最低标准管理规定》,制定本咨询通告。
2.适用范围本通告适用于在中国境内民用运输机场(含军民合用运输机场的民用部分)开展的仪表飞行程序验证活动。
3.背景仪表飞行程序验证是通过对障碍物、地形和导航数据等在内的仪表飞行程序设计进行质量评估,确保仪表飞行程序的安全性、可飞性、数据的准确性与完整性的过程。
中国民航在《民用机场飞行程序和运行最低标准管理规定》(CCAR-97FS-R3)中首次对仪表飞行程序验证工作作出了明确规定。
国际民航组织在《飞行程序质量保证手册》(ICAO Doc.9906)中对飞行程序验证的流程、步骤、基本内容、具体技术细节和验证工作单有明确规定,并在附件11《空中交通服务》中对各缔约国提出定期(最长不得超过5年)检查本国仪表飞行程序的国家责任要求。
欧美等民航发达国家也都高度重视飞行程序验证工作,将其作为机场开航及日常运行的重要安全保障措施,并颁布了相应的规章文件指导该工作。
在参考国际民航组织标准及相关国家做法基础上,结合我国民航实际情况和飞行程序验证工作特点,制定本通告。
4.参考文件(1)《民用航空机场飞行程序和运行最低标准管理规定》(CCAR-97)(2)《航空器运行目视和仪表飞行程序设计规范》(AC-97-FS-005)(3)《飞行程序质量保证管理规定》(AC-97-FS-00X)(4)《飞行程序设计质量保证手册》(ICAO Doc.9906)(5)《标准飞行验证手册》(FAA Order 8200)(6)《Standards Applicable to Instrument Flight procedure Design》(澳大利亚Manual of Standards Part 173)(7)《Validation of Instrument Flight Procedures》(英国)5.职责5.1中国民用航空局对民用机场飞行程序验证工作实施统一管理,负责相关政策和技术标准的制定工作。
航空公司飞行品质监控管理程序+飞行品质监控标准修改程序
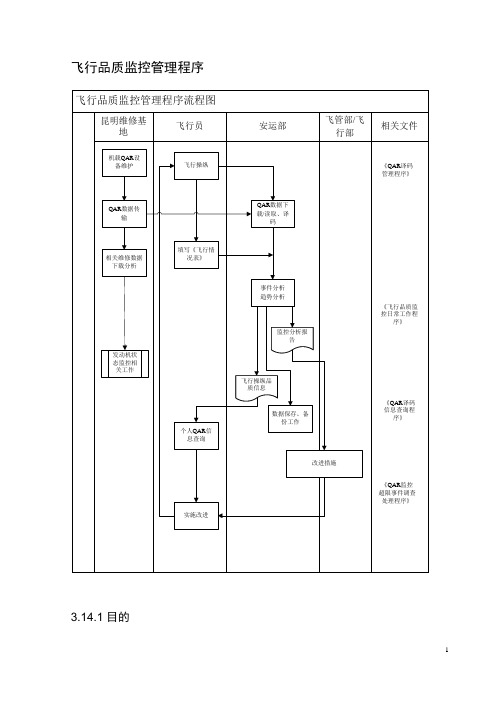
飞行品质监控管理程序3.14.1目的规范云南分公司(以下简称公司)的飞行品质监控管理工作,提高公司的安全管理水平,充分发挥飞行品质监控在飞行技术管理和安全运行监察中的作用。
3.14.2 适用范围适用于公司飞行品质监控管理工作。
3.14.3职责3.14.3.1安运部:负责QAR译码及飞行操纵品质监控的日常管理与协调工作。
3.14.3.2飞管部:负责对监控中发现的问题进行分析、研究,有针对性地提出改进意见,制定提升飞行操纵品质的培训计划予以落实和监督。
3.14.3.3飞行部:负责实施本单位的飞行操纵品质监控(超限事件调查及处理),针对译码中发现的倾向性问题及不安全事件进行深入调查研究,寻找解决问题的方法,提出处理意见和实施改进措施,并上报安运部和飞管部。
3.14.3.4昆明维修基地:1)负责飞行记录器和机载QAR设备的维护工作,确保飞行记录器和机载QAR 设备的正常运行。
2)负责QAR光盘/PCMCIA卡及飞行数据记录器的安装及拆卸及QAR数据的传输。
3)负责发动机状态监控的相关数据传输和信息反馈工作。
3.14.4工作程序3.14.4.1昆明维修基地完成飞机上的QAR光盘/PCMCIA卡装卸工作,将QAR 数据上传到指定服务器后,由安运部进行数据下载和飞行操纵品质的译码分析;由昆明维修基地进行发动机状态监控的相关数据传输和信息反馈工作。
3.14.4.2飞行机组在每次航班结束后,须填写《飞行情况表》,内容有日期、航班号、航段操纵者、超限原因项目等。
《飞行情况表》与飞行任务书一起使用,用于建立飞行员的飞行操纵品质档案。
如遇到超限事件,飞行员可填写《安全信息主动报告表》,及时报告安运部,可按《中国东方航空安全信息主动报告减免处罚试行办法》的规定实施处理。
3.14.4.3安运部对QAR数据进行译码并进行飞行操纵品质分析工作,对出现的严重超限事件应及时报告部领导,进行具体分析和调查;对监控航班和超限事件等进行事件分析、趋势分析和数据统计,编制QAR监控分析周期报告,并做好数据保存和备份工作。
飞行检查应急预案
飞行检查应急预案修订记录审批记录分发范围1.目的统一领导,快速反应、措施果断,协同应对、加强合作,规范应对GMP检查工作流程,提高工作效率。
2.适用范围本程序适用于公司GMP突击检查的管理。
3.定义3.1 指上级行政管理部门的临时突击性检查,如市场监督管理局、环境监督局等外部单位。
4. 应急流程一旦外部飞行检查(或其它政府部门人员来突击检查)→门卫每一时间通知行政人事负责人到公司门口确认情况→行政部负责人根据来访单位的性质快速通知总经理或质量负责人→各部门进行快速反应,积极配合其它相关部门把工作处理完毕。
5.职责5.1 GMP检查领导小组5.1.1 GMP检查领导小组组成组长:总经理或质量部负责人小组成员:质量工作负责人、生产工作负责人、行政人事工作负责人、采购工作负责人、仓库部门负责人、研发中心负责人。
5.1.2 公司质量部为GMP检查牵头部门,质量部与其他部门为具体执行部门。
5.1.3 组长:确认监察机构的准确信息,同时上报公司负责人,负责GMP检查的总协调。
5.1.4 副组长:主要负责和专家组协调并组织质量部门和生产部门人员GMP 检查迎审等,领导小组组长不在公司时,授权副组长代行组长职责。
5.1.5 各部门负责人:负责各部门检查准备、专家陪同及组织本部门迎审工作。
5.2 行政人事部5.2.1 负责公司GMP检查全过程的专家接待工作(接机、接站车辆及人员的安排等)及会场准备工作。
5.2.2 负责培训档案、体检档案及人员资质等材料的提供。
5.2.3 负责厂区环境、卫生、安全、虫害等工作及记录的提供。
5.2.4 其他管理范围内的资料提供。
5.3 质量部5.3.1 负责公司GMP认证申请材料的申报,GMP认证过程中首次会议、末次会议召集。
5.3.2 负责本部门迎检的各项工作,负责和专家沟通有关质量管理方面的问题。
5.3.2 负责其他部门迎检工作的指导及日常审查工作。
5.3.3 其他管理范围内的资料提供。
飞机安全设备检查sop流程

飞机安全设备检查sop流程英文版Aircraft Safety Equipment Inspection SOP ProcessIntroduction:The Safety of Flight is paramount, and regular inspection of aircraft safety equipment is crucial to ensure its reliability and effectiveness. This Standard Operating Procedure (SOP) outlines the steps involved in conducting a thorough inspection of aircraft safety equipment.1. Pre-Inspection Preparation:Gather all necessary tools and checklists.Familiarize yourself with the aircraft's safety equipment and its location.Ensure that the aircraft is parked in a safe and secure location.2. Visual Inspection:Inspect all safety equipment visually for any visible damage or defects.Check for any missing or tampered components.Verify the correct positioning and installation of all equipment.3. Functional Testing:Test the functionality of all safety equipment, such as life vests, oxygen masks, and fire extinguishers.Ensure that all equipment operates as designed and meets manufacturer specifications.4. Documentation:Record all inspection findings in the designated logbook or checklist.Note any issues or concerns and report them to the appropriate authorities.5. Post-Inspection Actions:Report any failed or malfunctioning equipment for immediate repair or replacement.Ensure that all tools and checklists are properly stored and ready for the next inspection.Conclusion:Regular inspection of aircraft safety equipment is crucial for flight safety. By following this SOP, inspectors can ensure that all equipment is in good working condition and ready to perform in case of an emergency. This SOP also helps to maintain a thorough and consistent inspection process, ensuring the highest level of safety for all flight operations.中文版飞机安全设备检查SOP流程介绍:飞行安全至关重要,定期对飞机安全设备进行检查是确保其可靠性和有效性的关键。
gmp飞行检查应急预案

GMP飞行检查应急预案1. 引言GMP(Good Manufacturing Practice)是一种严格的质量管理体系,旨在确保生产过程中的产品质量和安全性。
在航空业,GMP飞行检查应急预案是为了应对在飞行检查中可能遇到的紧急情况而制定的一套预先安排和应急措施。
本文档旨在提供一份详细的GMP飞行检查应急预案,帮助相关人员在紧急情况下采取适当的行动,保证飞行检查的安全和高效进行。
2. 应急预案流程2.1 事前准备在进行GMP飞行检查之前,需要进行充分的事前准备。
这些准备工作包括:•了解飞行检查的详细计划和目标•对相关飞行器、设备和工具进行仔细检查,确保其完好和可靠性•检查飞行检查的文件和资料,确保其完备和准确性•检查相关人员的适航和技能情况,确保其具备相应的资质和能力•与相关单位和部门进行沟通和协调,确保整个飞行检查过程的顺利进行2.2 应急响应在飞行检查过程中,可能会遇到各种紧急情况,包括但不限于以下情形:2.2.1 飞行器故障在遇到飞行器故障时,应采取以下措施:1.驾驶员应立即报告故障情况,并通过无线电通讯与地面人员保持联系。
2.根据飞行手册和相关流程,执行应急程序,如关闭故障系统、更换备用设备等。
3.如果故障无法解决,根据情况考虑是否紧急降落或中断飞行检查。
2.2.2 恶劣天气在遭遇恶劣天气条件时,应采取以下措施:1.驾驶员应立即报告天气情况,并根据相关规定和程序作出应急决策。
2.根据天气情况,考虑是否调整飞行计划、改变高度或航路。
3.如果遭遇极端天气条件,飞行员应立即寻找安全的地方进行紧急降落。
2.2.3 受限空域在进入受限空域或遭遇空中交通管制时,应采取以下措施:1.驾驶员应立即报告并遵守相关的空中交通管制规定,保持与空中交通管制部门的沟通。
2.根据情况考虑是否改变航路、高度或速度,以确保遵守空中交通管制要求。
3.如果无法遵守交通管制规定,应立即寻找安全的紧急着陆点,并与地面人员协调解决问题。
精选干货-2017年医疗器械飞行检查不合格项盘点(下)

42*
42*
43 44 45 46 47 48 49 50 51 52 53* 54* 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70
1)抽查组件20170418批“软管”《注塑、移印、挤(吹)塑工序流转卡》,使用PVC导管料(输 血(液)器具用软聚氯乙烯塑料)原料批号为170101,查看该批原材料进货检验报告、出入库 台账等记录,显示2017年仅购进一批PVC导管料,账面库存8700公斤,实际现场没有。现场仓库 存放PVC导管料批号为170418,无相应原料检验记录、无对应发放、使用记录。 2)抽查组件20170405批“调节轮”《注塑、移印、挤(吹)塑工序流转卡》,使用聚乙烯原料 批号为170102,情况同上,账面库存4500公斤,实际现场未发现。现场仓库存放聚乙烯批号为 170312,无相应原料检验记录、无对应发放、使用记录。 3)抽查组件20170405批“穿刺器”《注塑、移印、挤(吹)塑工序流转卡》,使用ABS的原料批 号为170116,情况同上,显示账面库存5500公斤,实际现场未发现。现场仓库存放ABS批号为 170326和170308,无相应原料检验记录、无对应发放、使用记录。 2. 查看一次性使用输液器带针(批号:20170510)批生产记录、灭菌记录、成品请验单等显示 该批批量为100箱,现场存放在解析库,但在环氧乙烷灭菌柜(设备编号A07-03)内,发现额外 16箱上述批号半成品,不能追溯来源。 成品检验紫外吸收光谱仅做单一波长吸光度值,未按标准要求进行连续扫描并评价。 成品放行单未包括生产中不合格、紧急放行等情形处置、产品标签/说明书内容、版本审核等内 留样观察室未装满的留样产品均无留样标识(如:压力延长管,一次性使用输注泵等)。 万级电子天平操作台无防震措施,影响天平正常使用。 1.检验用滴定管、刻度吸管、容量瓶等计量器具均未提供检定校准证书;女二更压差计无检定 2.查现场,微粒分析仪放置于普通环境。 查170524批检验记录,无硫代硫酸钠、高锰酸钾标准滴定溶液的配制记录。 查留样室,未配备温湿度计。 查《工艺用水管理制度》(文件编号:C.KT/7.5(C1)-01),要求纯化水电导率应小于2μs/cm,查 纯化水全性能检测报告,未见原始记录;查现场,碱性碘化汞钾(生产日期:2014年8月4日)试 剂瓶底部有絮状物,已变质。 洁净区内暂存库未划分区域;酒精存放库房未按《酒精管理制度》的要求进行每日的仓库温度 记录监控。 吸附剂为白色微小微粒(50目),网布亦为白色,冲水环境下无法有效观察网布上是否吸附颗 一次性使用输液器带针(生产批号20170321)批准放行签署时间2017年3月23日,批检验报告出 具时间为2017年4月6日。 企业的无菌、微生物限度、阳性对照间共用一套空调系统。阳性对照室检测使用超净工作台。 编号为Z-1的细菌培养箱中的温度计无编号未检定,并且直接放置在培养箱的内壁;电子天平未 按规定放置在防震工作台。 企业未明确其中间品的存储环境和存放时间。 一次性使用输液器带针(生产批号20170321)实际留样数量为36套,但留样台帐显示为35套。 未查见生产批号20150118、型号规格HJZ-03的一次性使用无菌活检针的留样观察样品。 生物准备室冰箱内放置的营养琼脂培养基(生产批号20140221-00,有效期至2017-02-20)已失 化学实验室台面放置的酚酞指示剂、铅标准液已于2016年10月13日失效,甲基红指示液已于 2016年12月7日失效。 企业提供的输液针微粒实验原始记录未保存微粒分析仪测定的原始数据。 未制定物理试验室使用的通风橱试验设备的使用方法。 洁净区一更外压力表(编号:ID-JCS-66和ID-JCS-42)校准有效期在2014年7月过期。洁净区的空 调系统初、中效过滤器压力表未校准。 纯化水检测规程(编号:ID-GL-SZGL-4)未规定每次检测均包含总送水口、总回水口及管路最远 端取样点。 AET/QP7.6(C)—01光学测量仪(经济型三次元)首次确认报告评估内容与仪器的实际功能不一 TC4供应商提供了原材料成分、晶相等第三方检验报告,但企业未对检验机构的第三方检验资质 进行确认,也未说明相关检验结论能否作为成品检验的相关分项结果。 未按成品检验规程要求进行成品表面缺陷的评价并制定内控标准。 成品放行程序中未包括生产中不合格、紧急放行、返工返修处置和产品标签说明书版本审核等 内容。 制水车间的压力表( 2个)未进行校准。 查工艺用水制水间的操作间,用于盛装检验水样的容器无明显标识,无法区分纯化水和注射用 水。
无人直升机使用前检查流程-ZIYANUAV
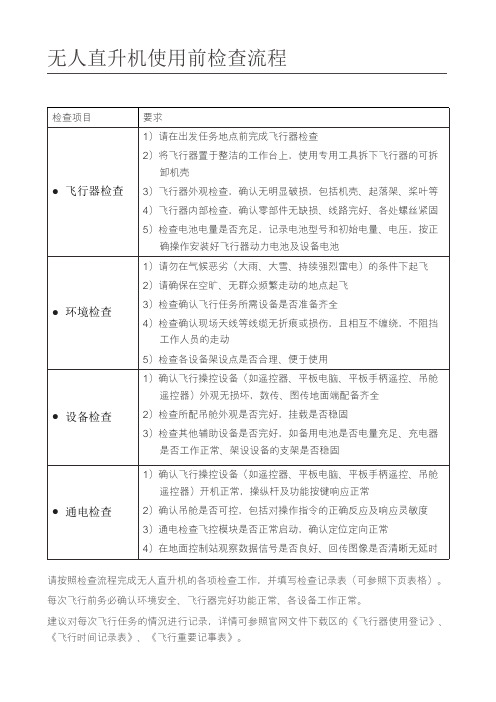
无人直升机使用前检查流程检查项目要求● 飞行器检查1)请在出发任务地点前完成飞行器检查2)将飞行器置于整洁的工作台上,使用专用工具拆下飞行器的可拆 卸机壳3)飞行器外观检查,确认无明显破损,包括机壳、起落架、桨叶等4)飞行器内部检查,确认零部件无缺损、线路完好、各处螺丝紧固5)检查电池电量是否充足,记录电池型号和初始电量、电压,按正 确操作安装好飞行器动力电池及设备电池● 环境检查1)请勿在气候恶劣(大雨、大雪、持续强烈雷电)的条件下起飞2)请确保在空旷、无群众频繁走动的地点起飞3)检查确认飞行任务所需设备是否准备齐全4)检查确认现场天线等线缆无折痕或损伤,且相互不缠绕,不阻挡 工作人员的走动5)检查各设备架设点是否合理、便于使用● 设备检查1)确认飞行操控设备(如遥控器、平板电脑、平板手柄遥控、吊舱 遥控器)外观无损坏,数传、图传地面端配备齐全2)检查所配吊舱外观是否完好,挂载是否稳固3)检查其他辅助设备是否完好,如备用电池是否电量充足、充电器 是否工作正常、架设设备的支架是否稳固● 通电检查1)确认飞行操控设备(如遥控器、平板电脑、平板手柄遥控、吊舱 遥控器)开机正常,操纵杆及功能按键响应正常2)确认吊舱是否可控,包括对操作指令的正确反应及响应灵敏度3)通电检查飞控模块是否正常启动,确认定位定向正常4)在地面控制站观察数据信号是否良好、回传图像是否清晰无延时请按照检查流程完成无人直升机的各项检查工作,并填写检查记录表(可参照下页表格)。
每次飞行前务必确认环境安全、飞行器完好功能正常、各设备工作正常。
建议对每次飞行任务的情况进行记录,详情可参照官网文件下载区的《飞行器使用登记》、《飞行时间记录表》、《飞行重要记事表》。
飞行地点任务性质飞行器型号搭载设备飞行方式□ 自动 □ 手动天气地面系统操作人员工作现场现场环境设备摆放整齐有序;放在不易被碰撞踩踏的位置 □ 起飞地点空旷安全 □天线架设架设在不易碰倒、不会跌落的位置 □ 线缆无折痕、损伤,不缠绕 □指挥控制站地面设备架设完全 □ 各接插件、针孔无锈损、无变形 □ 接头无松动 □主体设备确认无人直升机□ 地面控制系统□ 遥控器□ 数图传□ 天线、三脚架□无人直升机飞行平台检 查机体外观机壳、桨叶、起落架,以及曾修复的地方(重点检查),均无损伤 □连接机构旋翼系统拉杆、倾斜盘无损伤或变形 □ 螺丝螺母螺帽无损伤、松动 □执行机构舵机、连杆、轴承无磨损、变形 □ 各轴承活动、尾桨毂变距顺滑 □电机结构无损坏 □ 安装牢固 □ 最近维护时间: 年 月 日飞控接口牢固 □ 线缆整齐无缠绕 □ 减震座完好 □航电系统各模块架设齐全 □ 线路无损坏 □ 各通信接口接线正确 □机载天线机载各天线安装牢固 □ 无松动 □ 接头连接可靠 □动力系统连接动力电池的接头完好 □ 机内线路外皮无破损 □齿轮减速器齿轮与电机齿轮的安装间隙合适 □ 齿轮无磨损 □皮带皮带无裂痕 □ 皮带完好无磨损 □尾管尾管安装稳固 □ 尾管无松动 □电池动力电池型号: 电量: (mah) 电压: (V)舵机电池型号: 电量: (mah) 电压: (V)注:本页表格可自行打印/复印,建议与后续配套表格一同复印装订成册,按日期分类备案设备检查遥控器遥控器无损坏 □ 未配此设备 □手持吊舱遥控器遥控器无损坏 □ 未配此设备 □平板手柄遥控遥控器无损坏 □ 平板显示无异常 □ 未配此设备 □军用三防电脑电量: (%) 能正常运行地面站软件 □ 未配此设备 □军用三防平板电量: (%) 能正常运行地面站软件 □ 未配此设备 □地面站控制系统终端(工业平板)电量: (%) 能正常运行地面站软件 □ 未配此设备 □定向定位系统GPS系统 □ RTK系统 □吊舱设备无损伤,通电正常 □ 吊舱挂载稳固,不易跌落 □三脚架三脚架无损坏 □ 架设稳固 □备用电池机用锂电池: (mah) 共 组; 设备/遥控电池:充电器机用锂电池充电器 □ 设备电池充电器 □ 遥控电池充电器 □其他辅助设备通电检查遥控器按键按钮响应正确 □ 操纵杆活动正常 □ 通电验证设备可控 □飞控GPS定位正常 □ 卫星定向正常 □ 卫星颗数:地面站控制系统连接飞控成功,信号接收正常 □ 数据显示正常、不卡顿 □数传、图传信号接收正常 □ 实时图像显示正常,无波纹,不卡顿 □备注飞行数据设计单架次总航程: (km) 须小于续航时间内能达到的最大航程起飞点海拔: (m) 相对起飞点的飞行高度: (m)注意对于时间长的飞行任务,需确保各电量充足,备用物资准备充分飞行:监控:地勤:注:本页表格可自行打印/复印,建议与后续配套表格一同复印装订成册,按日期分类备案。
4-食品生产飞行检查工作流程

食品生产飞行检查工作流程1 范围本标准规定了对食品(不含特殊食品、食盐,下同)生产企业开展飞行检查的工作流程。
本标准适用于食品生产处开展食品生产企业飞行检查工作。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
《中华人民共和国食品安全法》《食品安全法实施条例》《食品生产经营日常监督检查管理办法》《山东食品药品监督管理局食品生产企业飞行检查工作规定(试行)》(鲁食药监发〔2014〕49号)省级年度食品生产环节监督检查计划3 术语和定义下列术语和定义适用于本文件。
3.1飞行检查实施监督检查的一种形式,是指市场监管部门根据监管工作需要,对省内食品生产企业开展的有重点、不定期、突击性的监督检查。
4 工作目的4.1 检查食品生产企业合规情况,排查食品安全风险,督促企业落实主体责任。
4.2 查阅市县监管部门日常监督检查情况,监督指导基层监管部门落实监管责任。
5 工作流程5.1 工作流程图食品生产企业飞行检查工作流程图见附录A。
5.2 制定飞行检查计划每年3月底前制定全年飞行检查计划。
下列情形作为飞行检查重点:——监督抽检和风险监测中发现食品生产者存在食品安全问题和风险的;——投诉举报、媒体舆情或其他线索有证据表明食品生产者存在食品安全问题和风险的;——食品生产者涉嫌存在严重违反食品安全法律法规及标准规范要求的;——食品生产者风险等级连续升高或存在不诚信记录的;——其他需要开展飞行检查的情形。
5.3 确定检查企业根据飞行检查计划,确定检查企业名单。
5.4 确定检查人员检查组应由2名及以上行政执法人员组成,必要时,可以安排相关领域专家参加。
5.5 形成飞行检查方案5.5.1 飞行检查方案应包括检查对象、检查时间、检查重点、人员分工等事项;5.5.2 飞行检查方案模板参见附录B;5.5.3 飞行检查方案电子版提前发检查人员熟悉检查内容。
飞检实施预案(最新)

中南玖宸二期(M10/05地块)飞检实施预案编制:_____________审核:_____________审批:_____________中南玖宸二期项目部年月日目录一、编制依据 (1)二、飞检目标 (1)三、前期策划及部署 (2)四、项目质量容易失分点重点控制 (2)五、材料质量检查(主要检查资料) (5)六、安全文明施工 (6)七、迎检策略 (6)一、编制依据1、中南集团飞检管理制度(2019版)2、以往飞检情况3、本项目实际情况二、飞检目标飞检综合成绩:86分以上进度管理合格率目标86%以上质量风险合格率目标86%以上材料质量合格率目标86%以上安全文明合格率目标86%以上工程质量成绩=实测实量成绩*0.7+质量风险成绩*0.3飞检综合成绩=进度管理成绩*0.25+工程质量成绩*0.4+材料质量成绩*0.15+安全文明*0.2三、前期策划及部署1)、成立项目飞检体系实施领导小组组长:沈新(项目经理)副组长:顾永新(项目总工)、李大勇(生产经理)组员:刘进、高海林、邓成飞、刘芳、杨安邦2)全面协调、督促各项目工程质量、材料质量及安全文明检查、整改。
3)组织项目领导班子及管理人员学习、研究集团飞检制度及实施细则。
项目技术质量部编制可行的技术方案,切实落实好公司三检制度、道道工序验收制度、技术复核、安全质量检查,切实落实过程建设全过程验收。
4)加强对工人的技术交底和技术培训,提升是工人技能水平和质量意识。
5)组织技术质量部、工程部全面展开自检工作,全数纠察各栋号质量、安全,对发现的问题及时整改落实,同时技术质量部做好复查工作,确保问题落实。
6)责任划分:组长全面管理进度、质量、安全、文明施工的落实,副组长负责对各片区、各栋号工作的具体部署及整改情况,各组员负责各片区、各栋号工作的执行和整改(实行栋号管理制度)。
四、项目质量容易失分点重点控制1、房间开间进深原因有以下几方面(1)墙体砌筑定位放线不准确;(2)墙体垂直度偏差较大,造成抹灰层变厚,从而造成开间进深与设计值偏差较大;提升措施:加强工序验收,从源头把控;加强过程管控,现场做到哪一道工序就要紧随其后进行实测实量,不合格的立即要求停工整改,未整改合格前不允许去新的工作面施工,避免等到大面积完成后才进行实测实量。
GMP飞行检查

GMP飞行检查第一篇:GMP飞行检查模拟GMP飞行检查模拟GMP飞行检查是指,国健做为第三方合规保证组织,受委托依照有关GMP法律法规,对委托企业的仓库、净化系统、纯水系统、生产车间、检验室、体系文件、记录等质量体系进行审查,找出企业生产经营中违规之处,出具GMP合规审计报告,揭示企业违规风险,通过后期整改,保证企业持续合规!服务内容一、全面审计1、按照《药品生产质量管理规范》2010版及附录要求/《医疗器械生产质量管理规范》/保健食品良好生产规范对企业进行质量体系审计;2、就企业日常质量管理工作中存在的疑问与企业人员进行沟通、讨论、答疑;3、出具全面系统的审计报告,列出风险点,评价风险级别,提出整改建议。
二、年度监护1、首次审计:按照《药品生产质量管理规范》2010版及附录要求/《医疗器械生产质量管理规范》/保健食品良好生产规范对企业进行质量体系的审计,出具全面系统的审计报告,列出风险点,评价风险级别,提出整改建议;2、定期监护:针对上次审计存在的问题进行复查,对近期企业的质量体系运行情况进行审查并提出整改建议;3、现场指导过程中就企业日常质量管理工作中存在的疑问与企业人员进行沟通、讨论、答疑;4、平时可通过CIO在线即时沟通、电话、邮箱、QQ等方式对企业进行咨询辅导。
服务流程第一阶段:前期准备(1)通过电话、网络等手段了解客户的基本信息,包括证照、产品、工艺、质量标准、关键人员情况。
(2)准备审计表(筛选符合客户情况条款,统计合理缺陷)(3)加强熟练法规内容(GMP及其附录等)(4)提前一天与客户预约,并告知客户准备事项:①在册人员全员参与,安排好相关配合工作②整理好体系文件、记录③告知客户审计流程第二阶段:审计开展(1)首次会议,双方认识并告知审计安排及注意事项。
(2)全面审计(仓库、净化系统、纯水系统、生产车间、检验室、体系文件、记录、现场问答等)(3)整理审计记录、汇总审计问题,出具审计报告(4)召开未次会议,宣读审计报告,现场答疑。
医疗器械飞检要注意哪些文件管理问题

医疗器械飞检要注意哪些文件管理问题2023-04-0418:44质量管理体系是企业运营的一个方法,不仅需要建立整套完善的管理文件,更要确保体系的有效、持续运行。
因此,文件管理作为体系有效运行的第一道关卡就有了重要意义,更是企业从事日常业务、质量管理的根据。
本文从实际运用角度对文件的编写、发放、评审与更新、执行使用、保存与流通等方面论述其注意事项,以期把文件用活,使之成为体系管理的源泉。
一、文件编写1编写格式是否规范:如页面、字体、编号、版本等;2、文件正文是否有错别字;3、起草、审核、批准人员是否出现错乱。
飞检实例:1未经批准发布质量手册(PA/QW0200-17),例如无编制、审核、批准人签字,颁布令执行总裁未签字。
2、《文件控制程序》(REK-QP-OVin)3.1文件审批权限规定"支持性文件由管理者代表批准现场查看《质量目标测量评估办法》(SOP-Z138/1V)等文件中批准人件该企业总经理康正国;《采购控制程序》(PEK-QP-09∕IΠ)在质量手册155中被描述为支持性文件。
二、文件发放1使用部门未及时得到现行有效的文件;2、未填写《文件发放登记表》;3、外来文件(如法规)未及时更新;4、破损与作废文件未及时回收、补发;5、下发的文件出现实质性错误,如清洗温度应是3(ΓC,但文件是50°飞检实例:1作业指导文件册(受控文件)中多个文件没有文件编号。
《原辅材料检验标准》(Y∕SMA01-Z08∙03-07)用的GB/T2828-2008为已废止标准。
2、《合格供方名录》版本升级后出现旧版本01/PD-1O-HO/O3)与新版本(儿/PD-10-H1/03)同时受控有效,旧版本未按文件和记录控制程序规定处理。
3、两恒温水槽2023年度校准结果分别为"在37。
C下测得下偏差为-0.23o C w和"在37。
C下测得下偏差为-0.19。
C〃,不满足文件规定≤土0.03。
空姐航前检查流程

空姐航前检查流程As flight attendants, the pre-flight inspection process is crucial in ensuring the safety and security of all passengers on board. 空姐的航前检查流程对于确保所有乘客的安全和安全非常重要。
It is a meticulous and thorough procedure that involves checking all necessary equipment, supplies, and emergency protocols before each flight. 这是一个细致和彻底的程序,涉及在每次飞行前检查所有必要的设备、物品和紧急协议。
From checking the cabin for any potential hazards to ensuring that all emergency exits are functional, every aspect of the aircraft must be thoroughly inspected. 从检查机舱是否存在潜在危险到确保所有紧急出口功能正常,飞机的每个方面都必须进行彻底检查。
This process requires attention to detail and a keen eye for potential safety issues that could arise during the flight. 这个过程需要注意细节和对可能在飞行过程中出现的安全问题有敏锐的洞察力。
One of the first steps in the pre-flight inspection process is to check the cabin for any potential hazards or safety concerns. 在航前检查流程中的第一步之一是检查机舱是否存在潜在危险或安全问题。
医械企业飞行检查程序

医疗器械生产企业飞行检查工作程序第一条为加强医疗器械生产监督管理,规范医疗器械监督检查工作,根据《医疗器械生产监督管理办法》和《医疗器械生产日常监督管理规定》,制定本程序。
第二条医疗器械生产企业飞行检查是指食品药品监管部门根据监管工作需要,对医疗器械生产企业实施的突击性有因检查。
第三条飞行检查是医疗器械生产企业监督检查的一种特殊方式。
对于下列情形的监督检查,食品药品监管部门可采取飞行检查的方式实施:(一)对涉嫌违法违规企业的监督检查;(二)对发生重大产品质量事故企业的监督检查;(三)对国家质量监督抽验产品不合格企业的监督检查;(四)对质量管理体系存在缺陷企业的跟踪检查;(五)对生产企业信用管理记录中不守信企业的监督检查;(六)其他情形的有因检查。
第四条医疗器械生产企业飞行检查过程中应对该企业前次质量管理体系检查中发现的缺陷或问题的整改情况进行检查确认。
第五条飞行检查由食品药品监管部门组织实施,包括检查准备,现场检查,和检查结果处理三个阶段。
第六条检查准备阶段,飞行检查组织部门主要做好以下工作:(一)选派检查组。
检查组一般由2至3名具有医疗器械生产质量管理规范检查员资格的人员组成,必要时可邀请有关专家参加;(二)根据实施飞行检查的缘由,并参考企业日常监管档案中的有关信息,按照有关法规和文件的要求,制定详细的有针对性的检查方案;(三)确定检查时间;(四)填写飞行检查任务书(格式见附件1);(五)对检查组进行纪律教育;(六)必要时,适时通知企业所属的下一级食品药品监管部门选派相关监管人员担任观察员协助检查。
第七条现场检查前,检查组成员应到指定地点集中,统一前往被检查的医疗器械生产企业。
第八条现场检查实行检查组长负责制。
检查组长要组织检查组做好下列工作:(一)向被检查企业出示飞行检查通知;(二)按照检查方案实施现场检查;(三)在检查过程中完成有关问题的调查、取证工作;(四)在现场检查记录表(附件2)中如实记录现场检查发现的缺陷和问题,并请生产企业负责人签字,加盖企业公章。
基于DA42-MPP飞机的轻型飞行校验系统

75中国航班机场与航班Airports and flights CHINA FLIGHTS 基于DA42-MPP 飞机的轻型飞行校验系统唐健仁 白银刚|中电科芜湖钻石飞机制造有限公司摘要:确保飞行安全是民航工作的永恒主题,也是实施飞行校验的根本目的。
本文介绍了一种可以集成在DA42-MPP 飞机上的,该飞行校验系统具有和大型飞行校验系统相同的校验能力,其机载设备小型化、模块化,可以非常方便地集成在DA42-MPP 飞机上。
关键词:飞行校验;飞行程序;程序校验;多用途飞机我国民航产业正在蓬勃发展,我国共有颁证运输机场235座,同期共有颁证通用机场239座,根据各省市发布的相关规划,各地将规划建设通用机场1100余座。
飞行校验任务繁重,国内现有飞行校验飞机多为大型公务机,数量有限,无法适应民航产业的高速发展。
DA42-MPP 飞机是一款多用途飞机,搭载AT-940构成飞行校验飞机可以填补我国小型飞行校验飞机的市场空白。
1 AT-940飞行校验系统1.1 AT-940概述AT-940飞行校验系统是一款先进的全自动飞行校验系统,可校验所有类型的常规导航设备,还提供飞行程序校验功能。
该系统的主要用户界面是安装在便携式电脑上的Windows 版WinFIS 飞行校验软件。
AT-940机载设备可以通过固定点或者货物皮带捆绑安装在飞机上,可以选择将其安装在专用的操作员控制台上。
AT-940设备可以在几分钟内完成安装,或者在安装后,几分钟内完成拆卸。
(见图1)1.2 AT-940校验能力AT-940飞行校验系统具有以下校验能力。
1.3 系统设备组成1.3.1 主计算机主计算机是一台坚固耐用的便携式计算机,它安装了WinFIS 飞行校验软件,是AT-940系统的主要用户界面。
主计算机通过串行数据连接与AT-940的SPU 通信,它使用WinFIS 软件接收、显示、记录和分析数据。
1.3.2 信号处理单元(SPU)信号处理单元(SPU)对所有飞行校验数据进行实时数据采集,它接收并处理来自传感器和其他输入到飞行校验系统的信号。
42应急准备与响应管制程序SEP-T-09

5.2.7.3风灾发生后的抢救:
a)由工厂人事部组织,各部门主管负责本部门人员的统计,保证工厂员工安全;
b)人事部组织各部门人员,进行现场人员和财产的抢救,受伤人员视伤势情况,由人事部决定送医院治疗。
5.2.8地震紧急应变处理
5.2.8.1地震前的预报:
5.2.5.4发电房消防措施:配备足够的消防器材,如“干粉灭火器”等。
5.2.5.5各部门主管及安全委员会人员应定期参加消防知识与政府举办的消防操作培训。
5.2.5.6定期检查消防器材。
5.2.5.7发电房用柴油专库保管,配备足够的消防器材,严格执行明火规定。
5.2.5.8雷击现场的保护:
a)发现雷击现场的目击者,要在保护现场无变化的情况下,迅速上报经理及人事部等负责人。
b)对有电源的现场,需要由电工切断电源,经验明无电后,方可采取措施。
5.2.5.9雷击后的处理:
a)发生人员伤亡时,由工厂通报劳动局、电业局、公安局、检察院、工会,请予协助调查事故原因。
b)查明事故原因后,工厂人事部教育全体员工,有关部门采取措施进行改进,以杜绝事故再度发生。
5.2.6供水中断/厂内自来水泄漏紧急应变处理
5.2.4.7若爆炸波及工厂设施,并影响工厂生产动作,经理要对此提出对策,对设备抢修,尽快恢复生产。
5.2.5电力供应系统中断紧急应变处理
5.2.5.1停电检修,有关部门要事先通报,各部门事先采取措施,以防意外发生。通报内容:a)时间; b)地点。
5.2.5.2意外停电,各部门(特别是供电、供水等关键性部门)要采取措施,检查设备机器,并做好开车准备。
g)检修清洗设备的废油交具有回收资格的废油回收商统一处理。
机上应急设备的检查流程

机上应急设备的检查流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!《机上应急设备的检查流程》一、准备工作1. 检查人员应具备相关的知识和技能,熟悉机上应急设备的种类、位置和使用方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7.相关附件及表单
无
8.记录保存
相关记录审核的记录与证据,作为质量体系记录予以保存。保存期限依《记录管理程序》要求执行。
6.4 飞行检查发现的纠正预防
6.4.1 审核的结果分为三种:第一种是非常严重的(如涉嫌弄虚作假、重大安全隐患),可能会被吊销 相关证件,勒令停产整顿、罚款或者企业法人负刑事责任;第二种是审核有轻微发现,允许予以 改正;第三种是是非常良好,没有任何问题。
文件名称
飞行检查准备程序
类别 编号
QP
页次
3/3
5.流程
无
6. 内容
6.1 飞行检查的时机
6.1.1 根据中国的《医疗器械监督管理条例》与《药品医疗器械飞行检查办法》的要求,在如下时机可 能会被执行飞行检查: - 投诉举报或者其他来源的线索表明可能存在质量安全风险的; - 检验发现存在质量安全风险的; - 药品不良反应或者医疗器械不良事件监测提示可能存在质量安全风险的; - 对申报资料真实性有疑问的; - 涉嫌严重违反质量管理规范要求的; - 企业有严重不守信记录的; - 例行飞行检查抽样(一般一年一次); - 其他需要开展飞行检查的情形。
文件编号:QP-42
发放编号:
东莞市 XXXXX 有限公司
飞行检查准备程序
生效日期:2016/1/19 版本/版次:C/0
文件名称:
文件封面修订页
QP-42
文件编号:
飞行检查准备程序
分发
总
市开法规与 工来自管PM 品 采 人事 生产
生产
部门
经
场
发
体系管 程 代
C
管 购 行政 一部 二部
理部部
理部 部 部 部 部 部
分发
份数 1 1 1 1
1
1 2 11 1
1
1
制/修订记录
日期
制/修订内容
制定
审核
批准
2016-1-19
1. 根据 2013/473/EU 指令、与《药品医疗器械飞行 检查办法》与 SGS 审核员的要求,新制定;
2. 结合公司的质量体系升级规划,版本为 C/0。
_______ 王海龙
_______ 丘璇, 游长春
6.3.4 文控专员负责在场为审核员提供文件查找、归档、复印等辅助配合工作。 6.3.5 根据《药品医疗器械飞行检查办法》与 2013/473/EU 指令的要求,审核时可能会涉及到设计开发、
生产过程、关键供应商管理、检验试验、设备仪器、纠正预防方面。其中对于关键工序的外包商 或供应商可能会到供应商的现场进行审核。审核时还会抽查相关产品进行检查。 6.3.6 关于欧盟飞行检查的特别要求: 抽查的机型,申请认证机型在 100 个以内,不少于三个;100 个以上,每一百个机型抽样三个机型 检查。 6.3.7 在审核的过程中,各部门必须认真配合,不得拖延、弄虚作假或拒绝配合。但是根据法规的要求, 如下信息可以不提供审核: -- 财务数据 -- 销售数据 -- 核心技术机密 -- 涉及到内部运营数据的内审过程与管评过程数据(但计划、日程签到、输出应提供审核) 6.3.8 审核完成后,根据审核员的安排进行末次会议。相关的审核发现,应予以记录。
QP-42 版本/次
C/0
6.4.2 对于第一种情况,公司绝不允许存在。 6.4.3 对于第二种情况,在审核员走后,管代应根据审核发现,召集相关部门负责人,研究审核发现的
改善措施,在七个工作日内完成整改,并依据法规或审核员的要求的方式予以回复或处理。 6.4.4 关于纠正预防措施填写的表单,若审核员有要求以审核员提供的格式。若无要求,以公司的《改
3.定义
飞行检查(Unannounced audits):指在没有预先通知的情况下,直接到公司进行质量体系检查,适用 于本公司可能存在两种情形:1)国内药监当局的飞行检查;2)公告机构的飞行检查。
4.职责
4.1 管理者代表:负责在飞行检查审核员来到时,组织、陪同全程的审核;负责组织各部门配合检查及 首次/末次会议;负责组织对飞行检查的发现项进行整改。
_______ 王海龙
文件名称
飞行检查准备程序
类别
QP
页次
1/3
编号
QP-42 版本/次
C/0
1.目的
为督促公司质量管理体系的实时运行有效,内部熟知飞行检查的政策,良好地配合好飞行检查工作, 特制定本程序。
2.范围
适用于本公司所有质量管理体系运行管理的范围,财务、敏感的销售数据、技术机密、运营数据除外;
者法规专员)。 6.2.4 飞行检查一般是两名审核员,审核时长为一个工作日。 6.2.5 得到通知是管理者代表应去门卫室迎接审核人员,然后安排好。
6.3 飞行检查的实施与陪同
6.3.1 当审核人员安排好后,得到审核员的通知时,安排全体管理人员参加首次会议。在会议中审核人 员会将此次审核的主要目的与要求予以讲明,各部门需要听取后会后作出安排。并且在会议时, 签名确认。
善行动通知单(CAR)》填写。 6.4.5 审核发现的实施追踪与效果确认由法规与体系管理部负责。
6.5 国内关于不配合审查的要求与处理
6.5.1 有下列情形之一的,视为拒绝、逃避检查: - 拖延、限制、拒绝检查人员进入被检查场所或者区域的,或者限制检查时间的; - 无正当理由不提供或者延迟提供与检查相关的文件、记录、票据、凭证、电子数据等材料的; - 以声称工作人员不在、故意停止生产经营等方式欺骗、误导、逃避检查的; - 拒绝或者限制拍摄、复印、抽样等取证工作的; - 其他不配合检查的情形。
6.3.2 首次会议结束后,管理者代表、开发部、品质部与文控专员应留下,审核员会将审核的日程与需 要的资料进行说明,各负责人记录下后,应在 15 分钟内准备齐全。特殊情况下,可以分批提供, 但不能超一小时。
6.3.3 检查的全过程,管理者代表(或其代理人)应全程予以陪同。相关的检查发现,如属实应予以记 录,不属实的应予以澄清。
6.1.2 根据 2013/473/EU 指令的要求,在如下时机可能会被执行飞行检查:
文件名称
飞行检查准备程序
类别 编号
QP
页次
2/3
QP-42 版本/次
C/0
- 例行飞行检查抽样(一般三年一次); - 公司产品在市场上出现重大投诉或可能的医疗事故案例;
6.2 飞行检查的内部临时通知
6.2.1 根据质量体系的管理要求,公司的质量管理体系应实时保持有效的运行。 6.2.2 门卫室在遇到陌生人事访问时,应询问其目的,查看其主证件,并且做好登记。 6.2.3 当得知是执行飞行检查工作时,应立即通知到公司的管理者代表(如果不在时,可通知总经理或
4.2 人事行政部:负责在有外来人员来访时,询问目的与登记;如果确定是飞行检查的人员时,应立即 通知管理者代表接待。
4.3 文控中心:负责陪同审核,在经得管理者代表同意下,为审核要求提供、查找或复印相关记录/文件 及证据。
4.4 各职能部门:负责参与首次与末次会议;否则配合审核员的要求,提供相关的证据与现场以供审核。
