高等有机化学课件第四章 有机化合物的芳香性
高等有机化学-4芳香性与亲电取代

Part 1 芳香性
• 1.芳香性的定义:
• 早期的定义是考虑动力学稳定性,取代反应比 加成反应更容易发生;后来的定义则依靠热力 学的稳定性,以共轭能的大小来量度;最近的 定义提倡用光谱及磁的标准,磁有向性在平面 л电子体系中能受感应,并可用质子磁共振光 谱中位移到较低的场来鉴定或借反磁性的灵敏 度上升的测定。
• 正离子这种越过一个碳原子的同芳香性叫单 同芳香体系,越过二个或三个饱和碳原子的 则分别叫双同或三同芳香体系。
• 含有两个或十个电子的同芳香性化合物为已 知的。
•
H H
H
OTs
• 三同环丙基正离子是首先由顺-双环[3,1, 0]己-3-对甲苯磺酸酯的溶剂化性质的分 析提出的假说。
(I)
H
H
(II)
HC HC
C
H
H C
CH C
H
H C
HC C
H
H C
CH C
H
芳环上离域的π电子的作用,易于发生 亲电取代反应,只有当芳环上引入了强吸电 子基团,才能发生亲核取代反应。
一. 亲电取代反应
(一) 加成-消除机理
HE
E
E+Nu-
σ-络合物 芳正离子
HNO3 H2SO4
NO2
2H2SO4 HNO3
NO2+
例如:
在硝酸与乙酸酐的体系中 甲苯的硝化速度是苯进行硝化反应的23倍. 取代产物的百分比为:
邻
对
间
63%
34%
3%
fo
(6) (2)
(23) × (1) ×
(0.63)
43.5
fm
(6) (2)
×
(23) (1)
【VIP专享】湖南大学_有机化学及实验第四、五、六章教学课件

2、苯的共振结构
H
H
H
图 4.1 苯的离域 л 分子轨道
共振论认为许多化合物可以用一个结构式表示其结构,例如乙烯 H
化合物却不能用单一的结构式精确表示其结构。它的真实结构是由多个共振结构式共振而
成的共振杂化体。例如,苯的真实结构可以认为主要是由下列共振结构式共振而成的共振
杂化体。共振结构式之间用双箭头“
CH2 OH
贡献较大
(5)如果在共振结构式中,具有结构上相似和能量上相同的两个或多个共振结构式,则不
仅这些相同的共振结构式都是主要的共振结构式,而且由此共振而形成的共振杂化体也特
别稳定。
(6)共振杂化体的能量比能量最低的共振结构还要低。这种能量之间的差叫共振能(离域 能)。
H
H
H
H
CC
H
H 。但有一些
+ + _
_
CH3CCH3 O
CH2 CH CH2
CH2CH CH2
O CH3 C O
(2)能量越低越稳定的共振结构在共振杂化体中占较大的分量,它们的贡献越大。
(3)没有正负电荷分离的共轭结构式贡献较大。例如:
CH3C OH
贡献较大
O
(4)原子均满足惰性气体电子构型的共轭结构式贡献较大,例如:
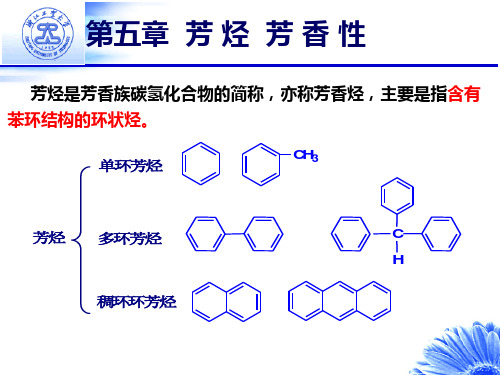
第四章 芳烃
一 基本要求 1、掌握芳烃的分类、命名和结构。 2、掌握芳烃的化学反应:氧化反应、加成反应和取代反应,重点学习芳香族化合物的亲电 取代反应理论。 3、掌握芳烃亲电取代反应中的定位效应。三类定位基的特点极其理论解释以及利用定位效 应于有机合成中。 4、了解芳烃的一些物理性质和光谱特征,特别是苯环的各向异性效应在解析 1HNMR 谱图 方面的应用。 5、了解芳香族亲电取代反应的机理和实例,学会运用付-克反应处理有机化学中的分析、 合成问题。
高等有机化学第四部分4-4金属有机化合物的制备.ppt
(三)其它价态金属
4EtCl + 4NaPb 4EtBr + Mg2 Sn
Et4 Pb + 4NaCl + 3Pb E4t Sn + 2MgB2r
2C6H6 + Cr*
Cr(C6H6)2
PEt3
C6F5Br +Ni* + 2 Et3P
C6F5 _ Ni Br
PEt3
4-4-2 从金属有机试剂的 交换反应制备
尽管这些取代基有的推电子,有的吸电 子,但都得到邻位的Li化试剂,这主要是诱导 效应和取代基时Li的配位作用所至。
Li
MeO
R
H
MeO Li
当然这反应也不限于芳基金属试剂,如:
+ ( i Pr )2NU1 HMPT
N
CH2LI W
(四)金属化合物对双键的加成
1、 RLi + C C
R C C Li ( 增加两个碳 )
M=Fe,Cr,V
这类金属交换反应在有机合成中非常有用,
因为可以直接从金属本身制备的金属有机化 合物太活泼,反应的选择性差,而选择性高 的金属有机试剂活性低,难以直接从金属制 备,所以只好用间接方法。
(二)另一种交换方式
R M + R' X
R' M + RX
其中用得最多的是Li交换反应。
BuLi +
2、M(CO)6 + RLi [ Me3O]BF4
(CO)5M
C
OLi R
(CO)5M
C
OMe R
( Fisher Carbene)
3、B2H6 + 6MeCH2CH CH2
2Bu3
芳香性PPT课件

第四章 有机化合物的芳香性
2
五. Y芳香性 六. 方克酸类 七. 二茂铁类物质 八. 有机化学中的应用
1.亲核取代反应 2.偶极距 3.酸碱性
第四章 有机化合物的芳香性
3
·
下列物质是否具有芳香性?
4
芳香性 (Aromaticity)
“芳香”最初是指从天然香树脂、香 精油中提取的物质,具有特殊的芳香 气味,而且具有特殊的性质,后来将 这种特殊的性质叫做芳香性,而具有 芳香性的化合物通称为芳香化合物。
H 吸热反应
Br 放热反应
反同芳结构
4.9 在有机化学中的应用
30
31
第四章 作业答案及课堂测试
32
第四章作业
根据 Hückel规则判断下列各化合物是否具有芳香性。
作业
=
33
第四章作业答案
1、具有芳香性。可写成由环庚三烯正离子和环戊二烯负离子及 其相应的共振结构式组成,符合Hückel 规则。 2、无芳香性。其中一个具sp3杂化的碳原子阻碍了首尾p轨是从侧 面交盖,不能形成共轭体系。 3、无芳香性。 4、无芳香性。 5、具有芳香性。6个π电子的平面闭合的环状共轭体系,符合 规则。 6、 12个π电子,无芳香性。 7、无芳香性。不是共轭体系。 8、具有芳香性。单环平面封闭共轭体系中有14个π电子,符合 规则。叁键中只有两个p电子参与共轭体系。 9、无芳香性。不是共轭体系。
胍是较强的碱,因为它的共轭酸是具有 芳香性结构的物质。
HN
NH2 C
H+
NH2
ቤተ መጻሕፍቲ ባይዱ
NH2
+C
H2N
NH2
+ NH2
C
H2N
NH2
有机化学-芳香族PPT课件
亲二烯体
一、芳烃苯环上的反应---聚合反应
A lC l3, C uC l2 n
聚苯
n
第五章 芳 烃 芳 香 性
芳烃的构造异构和命名 苯的结构 单环芳烃的化学性质 a. 芳烃苯环上的反应
b. 芳烃侧链的反应
苯环上亲电取代反应的定位规则 稠环芳烃 芳香性 多官能团化合物的命名
五.苯环上亲电取代反应的定位规则
慢
+ N O 2
H N O 2
NO2+H3O+HSO4 硝 酰 正 离 子
H
N O 2
快
N O 2 + H S O 4
+ H 2 S O 4
亲电取代反应
还 原
Ar NO 2
Ar NH2
偶 氮 染 料
N=N
磺 胺 药 H2N
SO 3H
磺胺嘧啶银
苏丹红Ⅱ号
亲电取代反应
c. 磺化:
浓 硫 酸25℃ H2SO4 SO3
这类定位基在与苯环直接相连的原子上一般具有单键或具 有孤对电子(或带负电荷),具有推电子效应。一般使苯环活 化,反应速度比苯快。
定位规律
b. 间位定位致钝基
N (C H 3)3,N O 2,C F 3,C C I3, 强 第 二 类 定 位 基 C N ,C O O H ,S O 3H ,C H O ,中
CH2
C H
CH2CHCH2CH3 C H CH3
2-甲 基 -3-苯 基 戊 烷
顺 --5 -甲 基 -1 -苯 基 -2 -庚 烯
一、芳烃的构造异构和命名
芳烃从形式上去掉一个氢原子后所剩下的原子团,称为芳基, 常用 Ph-(phenyl的缩写) 。
H2C
有机化学-芳香性概述

芳香性概述内容提要1. 芳香性1.1芳香性的定义与基本判据1.2芳香化合物的基本化学性质1.3芳香化合物的基本结构特征1.4芳香化合物的核磁共振性质和芳香性的检验手段1.4.1核磁共振原理1.4.2 电磁屏蔽效应1.4.3 全反式[18]轮烯的核磁共振1.4.4 芳香化合物的核磁共振性质1.4.5 芳香性的检验手段1.5芳香性的定性判据——休克尔规则1.5.1休克尔规则的表述1.5.2. 休克尔规则的应用举例1.5.3适用休克尔规则的常见非苯芳香化合物1.6周边修正1.6.1萘和薁1.6.2芘1.6.3双键修正在周边修正中的应用1.7芳香性定性判据的局限性2. 反芳香性2.1反芳香性的定义与基本判据2.2典型的反芳香化合物2.2.1 环丁二烯2.2.2 环戊二烯正离子3. 非芳香性4. 同芳香性4.1环辛四烯正离子4.2其它典型的同芳香性分子4.2.1环戊烯-4-正离子4.2.2降冰片烯-7-正离子4.2.3亚甲叉[10]轮烯5. Y芳香性6. 休克尔分子轨道理论6.1变分法概述6.2尝试波函数的构建方法6.3尝试波函数Ψ = c A A + c B B的构建举例6.4同核双原子分子的变分法构建结果6.5异核双原子分子的变分法构建结果6.6 αA和αB的差值对成键和反键轨道能E+和E-的影响6.7休克尔分子轨道法7. 富烯7.1线性π体系分子轨道能量的计算公式7.2使用休克尔分子轨道法简便求解分子轨道能和轨道系数的举例:1,3-丁二烯7.3富烯与1,3,5-己三烯7.3.1 富烯7.3.2 1,3,5-己三烯7.3.3 富烯与1,3,5-己三烯的比较7.3.4 休克尔分子轨道法的局限性8. 环丁二烯与姜泰勒畸变8.1单一环状π体系分子轨道能量的计算公式8.2多边形法则8.3休克尔分子轨道法对环丁二烯的处理8.4环丁二烯的真实情况与姜-泰勒畸变8.4.1 环丁二烯的真实情况8.4.2 姜-泰勒畸变正文1.芳香性(Aromaticity)1.1芳香性的定义与基本判据芳香化合物一词,最早源于苯的合成,天然产物安息香胶中,含有苯甲酸(俗称安息香酸),苯甲酸与碱共热可脱去羧基得到苯,其带有芬芳气味[1]最初,芳香化合物的范围仅限于苯与其同系物,后来随着人们对芳香性的认识不断加深,芳香性的概念也不断被扩展和重新定义公元1931年,德国物理学家和物理化学家艾瑞克·休克尔(Erich Hückel)提出,离域π电子数符合4n + 2规则的平面共轭多烯,具有芳香性,其中n是非负整数[2]。
沈阳药科大学高等有机化学课件(胡春版)——第四章 芳香性

ph
O
O
+
+
.
ph
BF4-
ph
Cl
SbF5, SO2
+ +
-75oC,
-2Cl
离子体系的芳香性
CH3 CH3 CH3 Cl Cl CH3
CH3
SbF5, SO2 -75oC, -2Cl-
CH3 ++
+ 2SbF5Cl
CH3
CH3
..
Na -H2
+
Na+
O
_
2
_
+
FeCl2
Fe
2+ +
_
CH3COCl FeCl3 Fe
化学家Willstatter历时八年(19031911年),以伪石榴碱为原料经12步 反应,合成了一克多环辛四烯。
[10]轮烯,环癸五烯,无芳香性。
因环内氢的作用,发生了扭曲非 平面。
H H
[14]轮烯,14个π电子 ,无芳香性。 因环内氢的作用,发生了扭曲非平面。
HH HH
[18]轮烯,18个π电子,符合4n+2规则。经 X-射线衍射,环中碳碳键长几乎相等。整 个分子基本是处于同一平面上,说明了轮 烯内氢原子的排斥力是很微弱的,具有一 定芳香性。
2+
CCH3
_
_
H H
+ Ph3C+Br夺取负氢离子
+
Br-
AgNO3
+
+ AgBr
环庚三烯正离子 1891年合成
7 6
H O 1 2 O
O +
有机化合物的芳香性.

环戊二烯负离子轨道表示式
环戊二烯负离子轨道结构
环庚三烯正离子
环庚三烯正离子盐如溴化物具有芳香性。环庚三烯正离子 是容易从氯化环庚三烯得到的,它的水溶性和IR光谱都表明了 它的稳定性和对称性。
Br
现在我们知道,在芳香性分子中的芳环上,每个碳原 子各以 sp2杂化轨道相互交盖连结,构成环状平面,处在同
一环平面上的每个碳原子还剩下一个未杂化的 p原子轨道,
这些p轨道轴相互平行,于是相互间发生交盖重叠,构成所 谓“芳香大 π 键”,所有的 π 电子成为环绕整个环平面上下
运动的电子流,完全失去了它的定域性。这种芳香大π键又
薁具有明显的 极性,其中五元环 是负电性的,七元 环是正电性的。
+
_
NMR研究证明蓝烃的芳香性。蓝烃分子的化学活性相当 于一个活泼的芳香化合物。亲电取代很容易地发生在 1(3)位置 上,亲核取代发生在 4(8)位置上。蓝烃似乎不发生加成反应。 这样的化学活性也表明此烃的芳香性。
多环芳烃电子数的计算方法
杯烯(Calicene)
富勒烯与C60
称为非定域键(离域键).由于芳香大π键中的π电子离域的结果, 导致体系能量降低,键长平均化,环稳定性增加。这就是所
谓的芳香性。但目前,芳香性这个概念早已扩大到了非苯型
体系。
2. 休克尔规则
1931年,德国化学家休克尔(E. Hü ckel)用简单的分子轨 道计算指出,只有当π电子为4n+2的体系,它们的成键轨道在 基态时全部充满电子(有的还充满非键轨道),具有与惰性气 体相类似的结构,使体系趋于稳定,具有芳香性,从而提出了 一个判断芳香性体系的规则,称为休克尔规则,也叫做休克尔 4n+2规则。 休克尔提出,单环多烯烃要有芳香性,必须满足三个条件。 成环原子共平面或接近于平面,平面扭转不大于0.1nm; 环状闭合共轭体系; 环上π电子为4n+2的体系(n= 0、1、2、3……);
有机化学10第四章ppt

②按照凯库勒结构,苯的邻二卤代物应有以 下两种结构,它们应有区别。
X X
X 但实际上苯的邻二卤代物只有一种, 也就是说此两种结构应相同。
X
现代物理方法测得苯的结构为:
H
H
H
所有原子共平面,正六
0.1397 nm
C C
C键长为:0.1397 n H键长为:0.110 nm
H H 0.11H0 nm
所有键角都为:1200
发烟 H2SO4
200~245℃
SO3H SO3H
常用的磺化剂:浓硫酸、发烟硫酸、 三氧化硫和 氯磺酸(ClSO3H)等。
• 磺化反应是一个可逆反应。
H2SO4
SO3H
稀 H2SO4
+ H2SO4
除水、加过量苯有利于正反应; 稀酸、加热有利于逆反应.
磺化反应的应用
-----可作位置保护基用于有机合成
H2/Pt
② 苯的一元取代产物为什么只有一种?
X
=
原因是苯的一元取代的这两种 X 可能的产物结构其实是完全相
同的结构。
① 凯库勒结构式实际上是环己三烯。
则其中的“C-C”单键和“C=C”双键键长 应不同,实测结果在苯中所有的“C-C”键 长 均 为 0. 140nm 、 “ C-H” 键 长 也 均 为 0.110nm,并很难进行加成或氧化反应,这 与环己三烯的性质的差别较大。
SO3H
CH3 Cl 稀 H2SO4
CH3 Cl
SO3H
可作位置保护基
4 、 傅瑞德尔-克拉夫茨反应
• 在无水三氯化铝催化下,芳烃环上的氢被烷基和 酰基取代的反应,分别叫烷基化反应和酰基化反
应,统称Friedel-Crafts reaction。
芳香性和反芳香性ppt课件

例如:五元环共轭体系,其分子轨道数及其 能量如下图表示:
A.当π电子数为4,则电子填充如下:
π电子数不是成键轨道数的2倍,因此无芳香 性.
B.当π电子数为5,则电子填充如下:
π电子数也不是成键轨道数的2倍,因此无 芳香性. C:当π电子数为6,则π电子数刚好是成键轨 道数的2倍,因此有芳香性
• 能级的确定方法:圆内接N边形法
CH3
NO2OAc Ac2O
CH(CH3)2
CH3 NO2 +
CH(CH3)2 82%
CH3
CH3
+ NO2 CH(CH3)2 NO2
8% 10%
取代基消除的难易程度取决于其容纳正电荷
的能力。+CH(CH3)2比较稳定,异丙基容易作为 正离子消除。
③:Gattermann-Koch反应
ArH
Al3Cl + CO A +rCHO C HlCl+
• NMR:存在反磁环流,使去屏蔽区内质子的δ值移 向低场(7 ~8),屏蔽区则移向高场.
• F.化学特性:易取代,难加成,难氧化
• 2.Hückel 4n+2规则
• A: Hückel 规则的内容:含有4n+2个π
• 电子的平面共轭单环化合物应具芳香性.
• B: Hückel 规则的理论解释:
• 用分子轨道理论计算证明:凡含有 4n+2个的平面共轭单环体系,即为π电子 数恰好是成键轨道数的二倍.
4
3
5
2
S1
Thiophene 噻吩
6
7
5N
8
N4
N9
H
3
P u rin e 嘌啉
二.芳香化合物的取代反应
高等有机化学芳香性

7-氯环庚烯
Cl
<
5-氯环戊二烯
生成反芳香性中间体, 不易进行SN1反应。
教学ppt
Cl
3-氯-1,4-戊二烯
6
2.偶极距
一些化合物由于能形成稳定的芳香性 结构而产生较大的偶极距。
教学ppt
7
3.酸碱性
若共轭碱是芳香性结构,则其共轭酸的酸性大。
R3N
芳环使 碱性减弱
酸性
>
>
教学ppt
8
环丁烯酮由于其共轭碱的反芳香性的结构, 不稳定,而呈现弱酸性
O
2H+
O
OH
O
O-
-O
O-
-O
O
-O
O-
-O 教学ppt O
O
O
3
三、二茂铁类物质
茂类物质与金属形成特殊的大π键,其电子云 平均化,具有芳香性。
教学ppt
4
四、有机化学中的应用
1.亲核取代反应
很难
Cl
H C l
H
迅速
反同芳香性 不稳定
H
同芳香性, 稳定
教学ppt
5
C l
3-氯环丙烯
Cl
形成芳香性中间体, 反应活性高。
教学ppt
9
苯环易进行亲电取代反应,而不是亲电加成反应。
Br
Br2
H
Fe
Br H
H Br Br
H 吸热反应
Br
放热反应
反同芳结构
教学ppt
10
教学ppt
11
Y芳香性 方克酸类 二茂铁类物质 有机化学中的应用
亲核取代反应 偶极距 酸碱性
教学ppt
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
丁二烯的分子轨道能量
类似处理可以得到其它单环共轭体系的轨道能量为:
芳香体系的特征—芳香性是与分子轨道的“特殊 稳定性”相联系的。分子轨道理论假设,在芳香体系 中,除了碳-碳和碳-氢之间有键以外,还存在着一种 更稳定的键 (大键)。
Hü ckel对芳香化合物的特征用简单分子轨道理论 作了满意的解释,提出以sp2杂化的原子形成的含有 4n+2个电子的单环平面体系,具有相应的电子稳定性。 通常把这个规律称为4n+2规律。
光谱研究的结果表明苯分子具有六重对称性,其 中六个碳原子位于平面正六边形的角顶,六个碳-碳 键彼此相当。X-射线分析、电子衍射和偶极矩测定, 也都证明了苯的平面六边形结构。
苯的实验结构数据
共价键理论对苯结构的解释: 苯分子的各个键角都是120,因而碳原子必须采 取sp2杂化轨道,构成六个C-C 键和六个C-H 键。而 每一个碳原子的另外一个p电子轨道,则在与环垂直的 方向形成8字形的轨道相继重叠,均匀对称地配布在整 个环上,形成一个环状共轭体系。这里,电子公共化, 电子密度平均化,环上没有单键复键的区别。因而, 经典的定域化的价键结构式(环己三烯式)不能代表苯 的结构。
NMR研究证明蓝烃的芳香性。蓝烃分子的化学活 性相当于一个活泼的芳香化合物。亲电取代很容易地 发生在1(3)位置上,亲核取代发生在4(8)位置上。蓝烃 似乎不发生加成反应。这样的化学活性也表明此烃的 芳香性。 理论计箅的结果和测定的数值是一致。以此键长 与苯的键长(1.395Å)相比就表明了蓝烃的芳香性。9, 10-键显然没有参加共轭体系,因此可以把蓝烃看作 [10]轮烯。蓝烃的共轭能是302千卡/摩尔。
(3)富烯衍生物 富烯不很稳定,但是它的寿命和偶极矩 可以被环丙基和胺基所提高。富烯、6,6—二环丙基富 烯和6,6—二(二甲胺基)富烯的偶极矩分别为1.1,1.7和 5.4D。
-
-
+ + +
+
杯烯(Calicene)是饶行兴趣的具有潜在的负电荷和 正电荷的芳香体系。
它们的芳香性表现在有的发生亲电取代反应,如 溴代和硝化,有的偶极矩高 (六苯基杯烯的偶极矩为 6.3 D),有的UV光谱受溶剂的影响很大 (偶极体系的特 点)。
这样形成的六氯锑盐是白色固体,与空气隔绝, 在室温可以保存几天,在-20C可以无期限的保存。暴 露在潮湿的空气里则引起分解。
IR和NMR谱证明了它的正离子结构,其它的盐也 一样。正如对具备这样对称性的分子所期望的,它的 IR光谱很简单,只有四个谱带,其中两个谱带是C-H 的伸展谱带,另外两个相当于以前报告的三氯环丙烯 正离子的骨架谱带。NMR研究的结果表明环丙烯正离 子的稳定能比烯丙基正离子的高约18千卡/摩尔。
三苯基环丙烯正离子
2)环丙烯酮 3,3-二氯环丙烯或氯代环丙烯正离子盐水 解形成环丙烯酮。
环丙烯酮的IR光谱表明,就是在水溶液中,它也 以酮式化合物存在,而不形成谐二醇。这种情况和环 丙酮显然不同。量子化学处理联系IR和NMR光谱,引 导人们认为环丙烯酮以下图所示的偶极形式存在。
这里,羰基极化为三员环体系符合Hü ckel 4n+2 规则提供了条件,因而环丙烯酮呈现芳香性。
(3)环丙烯叉衍生物 亚甲基环丙烯虽属未知。但是它 的一些衍生物是已知的,而且是比较稳定的。
在亚甲基上连接着吸电子基团,分子极化,则环 体系可能具有芳香性。例如,双(三氟甲基) 乙烯酮与 二苯基环丙烯酮作用形成的六氟异丙叉二苯基环丙烯 的偶极矩为7.42 D,因而体系以偶极化的形式存在。
4.3.2 环丁烯衍生物
Pople计算环丙烯正离子的共轭能在60千卡/摩尔 以上。
二氯、三氯和四氯代环丙烯也可与强Lewis酸作用 分别形成一氯、二氯和三氯代环丙烯正离子盐。
一氯、二氯和三氯代环丙烯正离子
在环丙烯正离子中,三苯基环丙烯正离子的键长 曾经测定过,令人吃惊的是这里测定的三苯基环丙烯 正离子中碳-碳键长几乎和苯的一样。
4.3.3 环戊二烯衍生物
(1)环戊二烯负离子 环戊二烯是一个酸性烯烃(pKa=16.0 ), 离解形成一个比较稳定的负离子。
环戊二烯与金属锂作用形成环戊二烯锂。环戊二 烯锂的NMR谱表明分子中锂离子位于环戊二烯负离子 的电子云之上,形成紧贴着的离子对。
(2)环戊二烯依律德 重氮环戊二烯是一个可以离析的、 热稳定的化合物,与重氮烷烃对比,这里具有芳香环 的稳定效应。
4.1.3 芳香性化合物的量子化学处理(自学)
即使用前述的简单分子轨道法处理较大的多原子分手时, 计算过程还是比较复杂的. Hü ckel曾经提出了一个简化的近 似计算方法,称为HMO法,主要用于电子体系,即平面共轭 分子体系.其基本假定是: (1) 电子与电子是互相独立的,即电子是在核和键所形 成的分子骨架之中运动。 (2)各碳原子的Coulomb积分相同,都是。 (3)键连碳原子间的交换积分都相同,都是 。而非键连碳原 子间的交换积分都是零,即忽略非键连原子的原子轨道间的相 互作用。 (4)各原子轨道间的重叠积分都取为零。
环丁烯离子盐 3,4-二溴-1,2,3,4—四苯基环丁烯与SbF5SO2作用在溶液中形成四苯基环丁烯双正离子。
NMR谱确证了它的结构。在四苯基环丁烯双正离 子中,正电荷分散在苯环上。3,4-二氯-1,2,3,4四甲基环丁烯在-78C与SbF5-SO2或SbF5-SO2ClF作用, 形成四甲基环丁烯双正离子。后者双正离子的结构也 是经过NMR谱证明的。
环多烯烃(CnHn)的分子轨道能级和基态电子构型
第二节 苯系芳香结构
4.2.1 苯
自从1865年Kekule提出苯分子的结构式以来,关 于苯的结构的研究,从来也没有中断过,众多科学家 提出过许多结构式。
Kekule式
余价学说结构式
中介结构
Pauling共振结构
苯的结构的正确认识是在化学反应的研究、物理 方法的应用、以及量子化学的发展的基础上,逐步加 深的。
第四节 中环芳香结构
4.4.1 环庚三烯正离子
环庚三烯正离子盐如溴化物具有芳香性。环庚三 烯正离子是容易从氯化环庚三烯得到的,它的水溶性 和IR光谱都表明了它的稳定性和对称性。
Br
4.4.2 蓝烃
蓝烃是一个天蓝色的、稳定的化合物。它是一个 非苯芳香化合物的典型的例子。它的电子体系是符合 4n+2规则的。下图中所示是平面的取代蓝烃的键长。
分子轨道理论对苯结构的解释: 分子轨道理论处理苯分子,从六个2p原子轨道波 函数(每个碳原子一个)组成六个分子轨道波函数:
这样得到的六个分子轨道示于下图中。
分子轨道理论表明苯环的电子体系围绕着环完全 离域化,电子云界面分布在原子核平面的上下。
4.2.2 多苯稠环体系 在多苯稠环体系中,如萘、菲、蒽、苾、蔻、八 苯并萘等的环碳原子都在同一平面里。石墨的C-C键 长为1.420.01 Å (X-射线衍射),其他很多多苯稠环体 系的键长也都经过精确的测定。
蓝烃的偶极矩约为1.0D,五员环是负的。计算值 为1.3D,和实验值吻合。这就提示人们认为蓝烃是有 环庚三烯正离子和环戊二烯负离子稠合在一起形成的 一个桥[10]轮烯离子结构。
4.4.3 环辛四烯二负离子
环辛四烯与金属钠作用形成环辛四烯-二负离子。
(7) 电子符合4n+2规则 休克尔(E.Hü ckel)发现: 如果一个单环状化合物只要它具有平面的离域体系, 它的电子数为4n+2(n=0,1,2,…整数),就具有芳 香性。其中,n相当于简并成对的成键轨道和非键轨道 的对数(或数组)。这就是休克尔规则,也叫做休克尔 4n+2规则。这个规则简明扼要地归纳了大量的化学事 实,而且具有科学的量子化学基础。凡符合休克尔规 则,具有芳香性,但又不含苯环的烃类化合物就叫做 非苯芳烃。非苯芳烃包括一些环多烯和芳烃离子。
下面以丁二烯为例说明HMO法的大意。 在丁二烯中, 电子的分子轨道是由四个碳原子的2p轨道组合而成的,即:
用处理氢分子的相似方法,写出单电子的Schrö dinger方程 H=E,将上式代入此方程,用变分法可以得到下列久期方程:
根据HMO法的基本假定,简化得到行列式:
求解行列式,得到丁二烯的分子轨道能量为:
有机化合物的芳香性就是有机分子组成原子相互 协同作用而使分子呈现稳定结构和状态的性质。
4.1.2 芳香性的特征 (1) C/H比例高 例如苯C6H6,蒽C10H8,一般脂肪族 化合物,除C2H2、C3H4、C4H2等外,绝大部分都没有 这样高的C/H比例。
(2) 键长趋向于平均化 例如,在苯环中,六个碳-碳 键键长彼此相等,环里没有单键、复键的区别。X-射 线衍射测定芳香体系中碳-碳键是等同的,键长介于单 键和复键之间,1.38 1.40Å。
多省(helicenes)
十星苯
在这些稠环体系中,碳原子以三个键和与之相 邻的三个原子结合,这样以sp2杂化轨道结合形成包 括2,3,4…个六边形苯环的平面的骨架,其余一个 2p电子则依其p轨道与邻位碳原子的p电子形成键。 这些化合物包含着在整个多环体系中离域化的体系。 苯环的这种并联几乎可以无限制的继续。石墨代表一 个极端的情况,在其中无数个sp2杂化碳原子相互结 合,形成一个离域体系的多六边形结构。
对联多苯和间联多苯
联多苯的HOMO能量
联苯和联多苯的共轭能和热稳定性都比苯环的高。 依据对联多苯和间联多苯结构因素以及计算的HOMO 能量,都表明了对联多苯的共轭能比间联多苯的高。
第三节 小环芳香结构
4.3.1 环丙烯衍生物 1) 环丙烯离子盐 环丙烯正离子的盐是通过3-氯代 环丙烯与Lewis酸如五氟化锑,三氯化铝或四氟硼银 作用制备的。
(5) 共轭能 氢化热和燃烧热的测定都表明芳香化 合物的稳定性和体系的共轭能(或称为离域能)是密 切关联着的。例如,苯的共轭能大约为36千卡/摩 尔。
(6)特征光谱 近代物理方法的发展,为判断化合 物的芳香性提供了有力的武器。芳香体系的振动光 谱和电子光谱与简单的共轭体系的有明显的差异。 如具有特征NMR谱:
