高三化学第五章物质结构元素周期律思维导图
物质结构 元素周期律的框架图
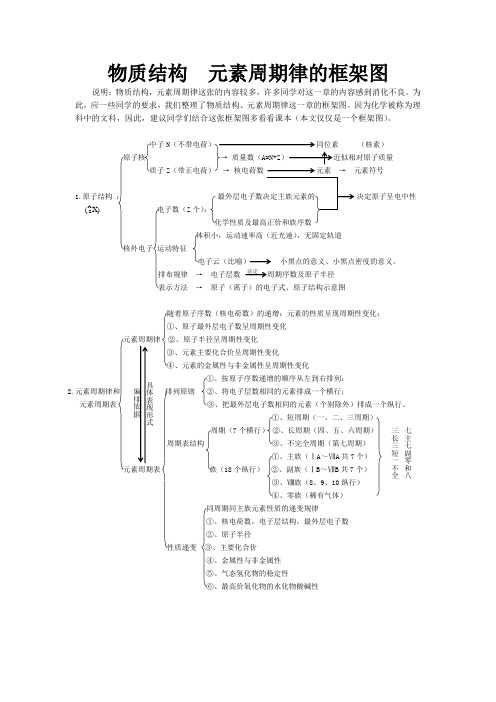
物质结构 元素周期律的框架图 说明:物质结构,元素周期律这张的内容较多,许多同学对这一章的内容感到消化不良。
为此,应一些同学的要求,我们整理了物质结构、元素周期律这一章的框架图。
因为化学被称为理科中的文科,因此,建议同学们结合这张框架图多看看课本(本文仅仅是一个框架图)。
中子N(核素) 原子核 质子Z → 元素符号1.原子结构 : 决定原子呈电中性 电子数(Z 个):化学性质及最高正价和族序数 体积小,运动速率高(近光速),无固定轨道核外电子 运动特征电子云(比喻) 小黑点的意义、小黑点密度的意义。
排布规律 → 电子层数 周期序数及原子半径表示方法 → 原子(离子)的电子式、原子结构示意图随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化:①、原子最外层电子数呈周期性变化元素周期律 ②、原子半径呈周期性变化③、元素主要化合价呈周期性变化④、元素的金属性与非金属性呈周期性变化 ①、按原子序数递增的顺序从左到右排列; 2.元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) ①、主族(ⅠA ~ⅦA 共7个) 元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体)同周期同主族元素性质的递变规律①、核电荷数,电子层结构,最外层电子数②、原子半径性质递变 ③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性决定编排依据 具体表现形式X)(A Z 七主七副零和八三长三短一不全电子层数:相同条件下,电子层越多,半径越大。
判断的依据核电荷数相同条件下,核电荷数越多,半径越小。
最外层电子数相同条件下,最外层电子数越多,半径越大。
高中化学全套思维导图(高清版)

高中化学全套思维导图(高清版)第一章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第三章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第四章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第五章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第六章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第七章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第八章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第九章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十一章:物质的量与物质的量浓度1. 物质的量物质的量的定义:摩尔物质的量的计算:摩尔质量、物质的量浓度2. 摩尔体积摩尔体积的定义:摩尔体积摩尔体积的计算:气体摩尔体积、液体摩尔体积、固体摩尔体积第十二章:化学反应速率与化学平衡1. 化学反应速率化学反应速率的定义:速率影响化学反应速率的因素:温度、浓度、催化剂、表面积2. 化学平衡化学平衡的定义:平衡状态化学平衡的建立:平衡常数、平衡反应物和物的浓度第十三章:氧化还原反应与电化学1. 氧化还原反应氧化还原反应的定义:氧化剂、还原剂氧化还原反应的类型:单一置换反应、复分解反应、合成反应、分解反应2. 电化学电化学的定义:电流、电极电化学反应:原电池、电解池第十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十九章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二十章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第二十一章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第二十二章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第二十三章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第二十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第二十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第二十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第二十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第二十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用。
高中化学全套思维导图(高清版)

2020-2-269:09:5【老师】俸・KH 高中化経套思“.版).pdf (18.11MB )髙中化学全套思谁导图(高清版),pdf}来目群文件打开打开文骸 转发三1【老师】俸自己没有思维导图的可以借鉴。
1 /43高中化学 第一章 从实验学化学第一节化学实验基础知识取用固体取用液体防火与灭火常见危险与安全措施了解实验安全常识及意外事故处理方法学法指导操作的先后顺序 操作的注意事项 操作的目的 适用范围化学与人类健康 不溶性固体与液体的分萬 实验安全化学与环境保护分离溶于溶液中的固体溶质适用范围1 .蒸发过程不断搅拌I 注意事项蒸发是否易潮解.物质的提纯是将混合物中的少 量杂质除去而得到纯净物质将物质的分 萬与提纯混淆吸取少量液体用滴管 (专用,垂直悬滴,不倒置)实验基本操作物质分离提 纯必须遵循注意防火、防爆炸、防倒吸不増、不减、易分离、易复原2.当大量固体析岀时,停止加热,余热蒸干知识 梳理 化学实解通过动手实验,熟练掌握常用化学 仪器的使用方法和操作注意事项 较多液体用倾倒法 (瓶塞倒放,标签向手心,抓住物质的特性寻找突破口物质检验和实验综合题块状固体用锻子 粉末状用药匙中及故取用药 品的仪器的意的热覗分离 仪器热源,温度可达400 - 500 r酒劈/龜精不超过2/3,不少于1/4,用外 / 5,不对火,不吹灯,先灭后添酒精喷灯温度可达I 000 X ) 水浴漏斗loop 以下 普通漏斗长颈漏斗分液 漏斗主要 用途萃取,分液, 反应加液体用器常仪冷凝管 洗气瓶于燥管注意事项用前先检査是否漏液, 分液时上层液体从上口倒岀,下层液体从下层放出,放液时应打开分液漏斗上玻璃塞或将塞 上的凹槽对准上口小孔。
使漏斗内外大气压相等反应器1 是否易被氧化 是否易燃、易爆 是否易与空W 中某些成分作用 是否易挥发、,1 尹华 是否具有毒性、 腐蚀度便于取用 防止变质 防独、防爆等 细口瓶、产口瓶、 通瓶 塑料瓶、赢r 笑是器等剂质试性则原仪器据依学剂保化试的存密封:水封、 油封、蜡封方式/开放式存放阴凉、避光处(干燥器中存放利用沸点不同,除去难挥发和不挥发的杂质适用范围1.蒸憎烧瓶加热要垫石棉网,温度、 计的水银球与支管口下缘位于同一水平线注意事项2.冷水是下口进,上口出3.要加碎瓷片,防暴沸在互不相溶的溶剂里溶解度差别较大的溶质适用范围1 .溶液总量不超过漏斗容积的3/4 2.把分液漏斗放在铁架台上静置、分层注意事项蒸饌分液3.打开塞子,先从下口放出下层 液体,再从上口倒出上层液体其他基本 操作计量仪器玻璃仪器的洗涤药品的取用药品的保存 装置气密性检验溶液的配勉气体的收集和体积的测量量筒试管、柑垠、隔网可加热或液浴烧杯、烧瓶、 蒸憎烧瓶、锥形瓶 乂_不能加热集气瓶、试剂瓶、滴瓶、 启普发生器主要用途粗略量取液体,精度0.1 mL刻度由下而上增大,无0刻度线, 读数平视。
高考化学:最全的高中化学思维导图,学霸都是这样复习的

高考化学:最全的高中化学思维导图,学霸都是这样复习的
临近高考,许多孩子不知道怎么处理最后的时间,觉得这点时间复不复习对自己最后的成绩影响不大。
老师要告诉家长的是,其实不然,最后的复习时间如果能好好利用,效果一定是之前的3到4倍。
因为这段时间,孩子的神经处于高度紧绷。
人在专注力集中的时候无论做什么事,效率都比以前做同样的事高很多。
化学,有点类似理科中的文科,有很多公式需要记忆,无归纳性的死记硬背,不但容易忘,还会在做题时运用得很慢。
高考做题的时间都是分秒必争的。
我们通过一定的方法(思维导图记忆法),整体记忆这些公式,考试时看到题就能想起,可以节省非常多的时间。
同学们还能利用剩余时间对之前做的题进行检查。
如此一来,分数自然领先旁人。
下面分享22张化学思维导图,同学好好记忆理解抓紧最后时间提升自己!
预祝同学们高考顺利,接下来我还会分享高考的知识归纳总结,另:
如果您的孩子存在记忆力差,学习成绩难以提升,学习方法不正确,严重偏科等这些问题,都可以通过下面的微信找我。
作为一名资深老师,我在朋友圈每天都会分享一些关于教育、学习方法、记忆训练的文章,帮您分析孩子学习过程中的问题。
高三化学第五章物质结构 元素周期律 思维导图

1 / 21 / 2考点一 原子构成 1.构成原子的微粒及作用 1.构成原子的微粒及作用原子 ⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧质子(Z 个)——决定 的种类中子[(A -Z )个]在质子数确定后决定 种类同位素核外电子(Z 个)——最外层电子数决定元素的 性质2.将下列核素符号(X)周围5个位置数字的含义填写在方框内3.微粒之间的关系(1)质子数(Z )=核电荷数=____________; (2)质量数(A )=________(Z )+________(N ); (3)阳离子的核外电子数=质子数-____________; (4)阴离子的核外电子数=质子数+______________。
考点二 元素、核素、同位素 1.元素、核素、同位素的关系2.同位素的性质同一元素的各种核素的________不同,________相同, 化学性质______________,物理性质____________。
考点三 核外电子排布 1.原子核外电子排布规律(1)核外电子一般总是尽先排布在__________的电子层里。
(2)每个电子层最多容纳的电子数为________个。
①最外层最多容纳电子数不超过____个(K 层为最外层时不超过____个)。
②次外层最多容纳的电子数不超过______个,倒数第三层电子数最多不超过______个。
识记1-20号元素的特殊电子层结构 (1)最外层有1个电子的元素:H 、Li 、Na 、K ; (2)最外层电子数等于次外层电子数的元素:Be 、Ar ; (3)最外层电子数是次外层电子数2倍的元素:C ; (4)最外层电子数是次外层电子数3倍的元素:O ; (5)最外层电子数是内层电子总数一半的元素:Li 、P ; (6)最外层电子数是次外层电子数4倍的元素:Ne ; (7)次外层电子数是最外层电子数2倍的元素:Li 、Si ; (8)电子层数与最外层电子数相等的元素:H 、Be 、Al ; (9)电子层数是最外层电子数2倍的元素:Li 、Ca ; (10)最外层电子数是电子层数2倍的元素:He 、C 、S 。
最新化学思维导图

化学思维图解一、化学实验二、溶液和胶体三、物质的分类四、化学反应类型五、元素及其化合物六、物质结构与元素周期律七、化学用语和化学计量夏树高考免费押题资料群304143402 八、化学计算九、化学反应速率和化学平衡夏树高考免费押题资料群304143402十、电解质溶液十一、有机化合物夏树高考免费押题资料群304143402贯口.练习孟苏七式拳,寸锦张关东拳、斜穿星秋拳、正丝缠风拳、怀德摔踩拳、潭芳滚漏拳、燕青跌架拳、李逵硬绷拳、三星炮锤拳、虎鹤双行拳,有达尊拳、迷祖拳、太乙拳、太岁拳、太祖长拳、五祖贺阳拳、太祖七十二式拳,有一宗拳、二元拳、三趟拳、四通锤拳、四把岳家拳、五占拳、五虎爬山拳、六合拳、六合八法拳、七圣拳、七星访友拳、八仙拳、八极拳、九进飞龙拳、十把内外拳、十二钩拳、十三太保拳、十三抓少林拳、一十八内闪翻拳、二十四擦马拳、三十六匕首拳、七十二横拳、小石拳、一百零八罗汉拳,飞虎拳、伏虎拳、青龙拳、蛟龙拳、螳螂拳、白鹤拳、大黑拳、大蟒拳,有鼠拳、牛拳、虎拳、兔拳、龙拳、蛇拳、马拳、羊拳、猴拳、鸡拳、狗拳、豹拳、狮拳、熊拳、凤拳、鹞拳、飞虎鞭拳、白猿通臂拳,有大洪拳、小洪拳、大成拳、密宗拳、内家拳、外家拳、殷家拳、杨家拳、霍家拳、赵家拳、蔡家拳、莫家拳、朝阳拳、宝剑拳、开山拳、*山拳、工力拳、乒乓拳(可能是不对的)、崩磨拳、子母拳、白眉拳、拖*拳、士门拳、地趟拳、太子剑拳,有空手、硬手、行手拳,形意、心意、如意拳,劈拳挂拳、截拳跳拳,有弹拳、快拳、绷拳、攒拳、长拳、短拳、横拳、断拳、南拳、泰拳、仰拳、插拳、花拳、套拳、撩拳、扎拳、劈挂手拳、自然拳、阴阳太极拳、五当太乙五行拳!:贯口基本功练习之报菜名分类:蒸羊羔、蒸熊掌、蒸鹿尾儿、烧花鸭、烧雏鸡儿、烧子鹅、卤煮咸鸭、酱鸡、腊肉、松花、小肚儿、晾肉、香肠、什锦苏盘、熏鸡、白肚儿、清蒸八宝猪、江米酿鸭子、罐儿野鸡、罐儿鹌鹑、卤什锦、卤子鹅、卤虾、烩虾、炝虾仁儿、山鸡、兔脯、菜蟒、银鱼、清蒸哈什蚂、烩鸭腰儿、烩鸭条儿、清拌鸭丝儿、黄心管儿、焖白鳝、焖黄鳝、豆鼓鲇鱼、锅烧鲇鱼、烀皮甲鱼、锅烧鲤鱼、抓炒鲤鱼、软炸里脊、软炸鸡、什锦套肠、麻酥油卷儿、熘鲜蘑、熘鱼脯儿、熘鱼片儿、熘鱼肚儿、醋熘肉片儿、熘白蘑、烩三鲜、炒银鱼、烩鳗鱼、清蒸火腿、炒白虾、炝青蛤、炒面鱼、炝芦笋、芙蓉燕菜、炒肝尖儿、南炒肝关儿、油爆肚仁儿、汤爆肚领儿、炒金丝、烩银丝、糖熘饹炸儿、糖熘荸荠、蜜丝山药、拔丝鲜桃、熘南贝、炒南贝、烩鸭丝、烩散丹、清蒸鸡、黄焖鸡、大炒鸡、熘碎鸡、香酥鸡,炒鸡丁儿、熘鸡块儿、三鲜丁儿、八宝丁儿、清蒸玉兰片、炒虾仁儿、炒腰花儿、炒蹄筋儿、锅烧海参、锅烧白菜、炸海耳、浇田鸡、桂花翅子、清蒸翅子、炸飞禽、炸葱、炸排骨、烩鸡肠肚儿、烩南荠、盐水肘花儿,拌瓤子、炖吊子、锅烧猪蹄儿、烧鸳鸯、烧百合、烧苹果、酿果藕、酿江米、炒螃蟹。
利用思维导图辅助“元素周期表与元素周期律”教学

1( . 2009·北京卷)W、X、Y、Z均为短周期元素,W的最外 层电子数与核外电子总数之比为7∶17,X与W同主族,Y 真题举例 的原子序数是X和W的原子序数之和的一半;含Z元素的 物质焰色反应为黄色,则下列判断正确的为( 摇摇)。
7-
A. 金属性:Y>Z
B. 氢化物的沸点:X>W
C. 离子的还原性:X>W D. 原子及离子半径: Z>Y>X
2.(2011·江苏卷)短周期元素X、Y、Z、W、Q在元素周期
表中的相对位置如下图所示。 下列说法正确的是( 摇摇)。
A.元素X与元素Z的最高正化合价之和的数值等于8
真题举例 B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
2-
3+
C.离子Y 和Z 的核外电子数和电子
层数都不相同
D.元素W的最高价氧化物对应的水
!
!"#$ """""""""""""""""""""""""""""""""""
%&'()*+,-./012-./0345
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.构成原子的微粒及作用 1.构成原子的微粒及作用 原子⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧ 质子(Z 个)——决定 的种类中子[(A -Z )个]在质子数确定后决定 种类同位素核外电子(Z 个)——最外层电子数决定元素的 性质2.将下列核素符号(X)周围5个位置数字的含义填写在方框内3.微粒之间的关系(1)质子数(Z )=核电荷数=____________; (2)质量数(A )=________(Z )+________(N ); (3)阳离子的核外电子数=质子数-____________; (4)阴离子的核外电子数=质子数+______________。
考点二 元素、核素、同位素 1.元素、核素、同位素的关系2.同位素的性质同一元素的各种核素的________不同,________相同, 化学性质______________,物理性质____________。
考点三 核外电子排布 1.原子核外电子排布规律(1)核外电子一般总是尽先排布在__________的电子层里。
(2)每个电子层最多容纳的电子数为________个。
①最外层最多容纳电子数不超过____个(K 层为最外层时不超过____个)。
②次外层最多容纳的电子数不超过______个,倒数第三层电子数最多不超过______个。
识记1-20号元素的特殊电子层结构(1)最外层有1个电子的元素:H 、Li 、Na 、K ; (2)最外层电子数等于次外层电子数的元素:Be 、Ar ; (3)最外层电子数是次外层电子数2倍的元素:C ; (4)最外层电子数是次外层电子数3倍的元素:O ; (5)最外层电子数是内层电子总数一半的元素:Li 、P ;(6)最外层电子数是次外层电子数4倍的元素:Ne ; (7)次外层电子数是最外层电子数2倍的元素:Li 、Si ; (8)电子层数与最外层电子数相等的元素:H 、Be 、Al ; (9)电子层数是最外层电子数2倍的元素:Li 、Ca ; (10)最外层电子数是电子层数2倍的元素:He 、C 、S 。
考点一 元素周期表 1.原子序数对于一个原子:原子序数=____________=____________=____________=____________-____________。
2.元素周期表 (1)编排原则:①按____________递增顺序从左到右排列;②将__________相同的元素排成一横行,共有____个横行。
③把________________相同的元素按____________递增的顺序从上到下排成一纵列,共有____列。
(2分区①分界线:沿着元素周期表中______________与____________的交界处画一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。
②各区位置:分界线左下方为__________区,分界线右上方为______________区。
③分界线附近元素的性质:既表现__________的性质,又表现____________的性质。
3.元素周期表中的特殊位置(1)过渡元素:元素周期表中部从______族到______族10个纵列共六十多种元素,这些元素都是金属元素。
(2)镧系:元素周期表第____周期中,57号元素镧到71号元素镥共15种元素。
(3)锕系:元素周期表第____周期中,89号元素锕到103号元素铹共15种元素。
(4)超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。
考点二 元素周期律1.定义元素的性质随________的递增而呈________变化的规律。
2.实质元素原子________________________的结果。
项目 同周期(左→右) 同主族(上→下) 原子结构核电荷数逐渐____ 逐渐____ 电子层数 ____ 逐渐____ 原子半径逐渐____ 逐渐____离子半径 阳离子逐渐____阴离子逐渐____r (阴离子)__r (阳离子) 逐渐____ 性质化合价最高正化合价由____→____(O、F 除外)负化合价=__________相同最高正化合价=________(O 、F 除外) 元素的金属性和非金属性 金属性逐渐 非金属性逐渐 金属性逐渐____非金属性逐渐____离子的氧化、还原性 阳离子氧化性逐渐____阴离子还原性逐渐____阳离子氧化性逐渐____阴离子还原性逐渐____ 气态氢化物稳定性 逐渐____ 逐渐____ 最高价氧化物对应水化物的酸碱性碱性逐渐 酸性逐渐碱性逐渐____酸性逐渐____4.元素金属性与非金属性的比较 (1)元素金属性强弱的判断依据①根据金属单质与水(或酸)反应的难易程度:越易反应,则对应金属元素的金属性越强。
②根据金属单质与盐溶液的置换反应:A 置换出B ,则A 对应的金属元素的金属性比B 对应的金属元素的金属性强。
③根据金属单质的还原性或对应阳离子的氧化性强弱:单质的还原性越强,对应阳离子的氧化性越弱,元素的金属性越强(Fe 对应的是Fe 2+,而不是Fe 3+)。
④根据最高价氧化物对应水化物的碱性强弱:碱性越强,则对应金属元素的金属性越强。
⑤根据电化学原理:不同金属形成原电池时,作负极的金属活泼;(A Z X )在电解池中的惰性电极上,先析出的金属其对应的元素不活泼。
(2)元素非金属性强弱的判断依据①根据非金属单质与H2化合的难易程度:越易化合,则其对应元素的非金属性越强。
②根据形成的气态氢化物的稳定性或还原性:越稳定或还原性越弱,则其对应元素的非金属性越强。
③根据非金属之间的相互置换:A能置换出B,则A对应的非金属元素的非金属性强于B对应的非金属元素的非金属性。
④根据最高价氧化物对应水化物的酸性强弱:酸性越强,则对应非金属元素的非金属性越强。
⑤根据非金属单质的氧化性或对应阴离子的还原性强弱:单质的氧化性越强,其对应阴离子的还原性越弱,元素的非金属性越强。
⑥最高价含氧酸形成的盐(同种阳离子)碱性越弱对应的非金属元素的非金属性越强。
考点三元素周期表和元素周期律的应用1.根据元素周期表中的位置寻找未知元素2.预测元素的性质(由递变规律推测)(1)比较不同周期、不同主族元素的性质。
如金属性Mg>Al,Ca>Mg,则碱性Mg(OH)2____Al(OH)3,Ca(OH)2____Mg(OH)2(填“>”、“<”或“=”);(2)推测未知元素的某些性质。
如:已知Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2____溶;再如:已知卤族元素的性质递变规律,可推知未学元素砹(At)应为____色固体,与氢____化合,HAt____稳定,水溶液呈____性,AgAt____溶于水等。
3.启发人们在一定区域内寻找新物质(1)半导体元素在金属与非金属分界线附近,如:Si、Ge、Ga等。
(2)农药中常用元素在右上方,如:F、Cl、S、P、As等。
(3)催化剂和耐高温、耐腐蚀合金材料主要在过渡元素中找,如:Fe、Ni、Rh、Pt、Pd等。
微粒半径大小比较:?考点一化学键1.概念_________ _______。
2.类型根据成键原子间的电子得失或转移可将化学键分为______和__________。
3.化学键与化学反应旧化学键的________和新化学键的________是化学反应的本质,是反应中能量变化的根本。
考点二离子键1.定义 _______ _______ ________。
2.形成条件活泼金属与活泼非金属之间化合时,易形成离子键,如第ⅠA族、第ⅡA族中的金属与第ⅥA族、第ⅦA族中的非金属化合时易形成离子键。
3.构成离子键的微粒为____ ________。
4.离子键的实质是___ _____。
5.表示方法(1)用电子式表示离子化合物的形成过程:①Na2S:______________________________________②CaCl2: _____________________________________(2)写出下列物质的电子式①MgCl2: ____________________________________②Na2O2: _____________________________________________③NaOH:_______________________________________________④NH4Cl:_______________________________________________考点三共价键1.共价键(1)定义:原子间通过____________所形成的相互作用(或化学键)。
(2)形成条件①一般__________的原子间可形成共价键。
②某些金属与非金属(特别是不活泼金属与不活泼非金属)原子之间也能形成共价键。
2.共价键的种类(1)非极性共价键:________元素的原子间形成的共价键,共用电子对____偏向任何一个原子,各原子都____________,简称__________。
(2)极性共价键:________元素的原子间形成共价键时,电子对偏向________________的一方,两种原子,一方略显____________,一方略显____________,简称________。
3.成键微粒为___ _____。
4.表示方法(1)用电子式表示①Cl2: ________________ ②N2:__________________③H2O2:_____________ ④CO2: _______________⑤HClO:_____________ ⑥CCl4:________________(2)用结构式表示①N2:____________ ②H2O:____________③CO2:________________(3)用电子式表示HCl共价键形成过程: ____________________考点四分子间作用力和氢键1.分子间作用力(1)定义:______________的作用力,又称__________。
(2)特点①分子间作用力比化学键____得多,它主要影响物质的________、________等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力存在于由共价键形成的多数____________和绝大多数气态、液态、固态非金属________分子之间。
但像二氧化硅、金刚石等由共价键形成的物质,微粒之间______________分子间作用力。
(3)变化规律一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力________,物质的熔、沸点也________。
例如,熔、沸点:I2____Br2____Cl2____F2。
