常见金属氮化物物理化学性质
2023届高三化学二轮复习——氮及其化合物课件

硝酸的化学性质
2、强氧化性和酸性
与金属单质
(1)浓硝酸+金属→高价态金属硝酸盐+NO2+水
(2)稀硝酸+金属→高价态金属硝酸盐+NO+水
(3)浓硝酸+非金属→(加热)最高价含氧酸+NO2+水 (4)与一些还原性的物质反应(硝酸可氧化H2S、SO2、Na2SO3、HI、 Fe2+等还原性物质)
根据提示写出铜与浓硝酸、稀硝酸,碳与浓硝酸反应,并分析在上述反应 中,硝酸表现出什么性质?
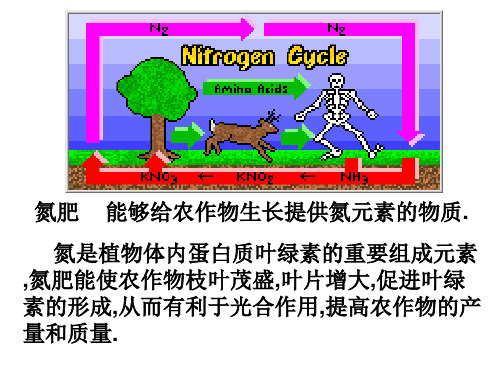
运送神州系列飞船的长征二F型火箭所使用的化学推进剂,动力燃料 都是 偏二甲肼(C2H8N2),常规氧化剂为 四氧化二氮。这种燃料的 优点是不需单独进行点火,火箭发射时只要将这两种液体在发动机燃 烧室混合即可。
氮及其化合物
学习目标
1、了解常见非金属元素N的单质及其重要化合物的制备 方法。 2、能列举、描述、辨识典型物质重要的物理和化学性质 及实验现象。 3、能用化学方程式、离子方程式正确表示典型物质的主 要化学性质。
现象为:有白烟 8NH3+3Cl2===N2+6NH4Cl, 体现了氨气的还原性和碱性
氮的存在与固定 物质间转化
性质与用途
污染与防治
课堂小结
氮的转化—纵向转化 NH3--N2—N0—NO2—HNO3
3应、的氮(化必的学修转方1程化,式—P。1纵08向,题转1化1)农村有个谚语“雷雨发庄稼”,请你写出有关反
(2)氮化镁与盐酸反应 Mg3N2+8HCl=3MgCl2+2NH4Cl
氮的存在与固定 物质间转化
性质与用途
污染与防治
氨气的制备 原理:
不能用NH4NO3跟Ca(OH)2反应制氨气;不能直接 加热氯化铵等铵盐分解制备氨气 2NH4Cl+Ca(OH)2==△==CaCl2+2NH3↑+2H2O
锌粉还原硝基当量-概述说明以及解释

锌粉还原硝基当量-概述说明以及解释1.引言1.1 概述概述:在化学反应中,还原反应是一种常见的反应类型。
而锌粉作为一种常见的还原剂,被广泛应用于许多化学过程中。
本篇文章主要讨论了锌粉如何被用来还原硝基当量的问题。
硝基当量是指一个化合物(通常是有机化合物)中含有的可以被还原剂完全还原的硝基(NO2)的数量。
而锌粉作为一种还原剂,具有很高的还原能力,可以将硝基还原为氨基(NH2)或其他更低价的氮化物。
本文将首先介绍锌粉的性质和用途,包括其化学性质、物理性质和在各个领域中的应用。
接着会介绍硝基当量的定义和计算方法,以帮助读者更好地理解硝基当量的概念。
然后,我们将重点讨论锌粉如何还原硝基当量的原理。
通过深入剖析还原反应的机制,我们将阐述锌粉在还原过程中的作用和影响因素。
同时,我们也会探讨锌粉还原硝基当量的应用,涉及到一些具体的化学反应和工业生产中的案例。
综上所述,本文旨在全面介绍锌粉还原硝基当量的相关知识,以帮助读者对这一化学过程有更深入的理解。
通过阅读本文,读者将能够了解到锌粉的性质和应用,学习硝基当量的计算方法,并理解锌粉在还原硝基当量中的原理和应用。
希望本文能够为读者在化学领域的学习和研究提供一定的帮助。
1.2文章结构文章结构部分的内容可以如下编写:1.2 文章结构本文按照以下顺序进行叙述和分析:1.引言:首先对本文进行概述,介绍锌粉还原硝基当量的基本概念和研究背景。
2.正文:接下来,将从两个方面进行讨论和分析。
2.1 锌粉的性质与用途:首先介绍锌粉的基本性质,包括化学性质、物理性质等,并探讨其在各个领域的广泛应用,如冶金、化工、医药等。
2.2 硝基当量的定义与计算方法:接着介绍硝基当量的含义和定义,并详细讲解其计算方法和数值的确定方式,以帮助读者更好地理解和应用硝基当量理论。
3.结论:最后,总结本文的主要观点和内容,强调锌粉还原硝基当量的原理和应用的重要性,并展望未来的研究方向和发展趋势。
通过以上结构的安排,本文将全面而系统地介绍锌粉还原硝基当量的相关知识,使读者能够深入了解和掌握这一领域的基本概念和应用技巧。
高一化学氮及其化合物ppt课件.ppt
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
氮气
1、氮元素的存在及单质的物理性质
存 游离态形式存在于空气中 在 化合态形式存在于多种无机物及有机物中
物 理 无色无味的气体、密度比空气小; 性 难溶于水,1体积水溶解0.02体积的氮气。
思考题
1、1molMg在足量的氮气、空气、纯氧气、二
氧化碳气体中燃烧生成 的固体质量由大到小的 排列次序是_二__氧__化__碳__>__氧__气___>_空__气__>__氮__气_____.
点燃
2Mg + O2 →2MgO
点燃
3Mg + N2 → Mg3N2
(40g) (100/3g)
2Mg + CO2 →点燃2MgO +C (46g)
质
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
工业上怎样制取氮气?利用氮气的什么性质?
空气
液化
先气化 液态空气
氮气 b.p -195.8℃
后气化
氧气 b.p -183℃
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
氮的固定------把大气中的游离态氮转化为氮的化合物 1生物固氮
豆科作物根瘤中的固氮菌常温下将空气中的氮 气转化为硝酸盐。
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
高中化学 氮气的性质和用途氮和活泼金属反应氮和非金属反应

氮气的性质和用途•氮气:氮气,常况下是一种无色无味无臭的气体,且通常无毒。
氮气占大气总量的78.12%(体积分数),是空气的主要成份。
常温下为气体,在标准大气压下,冷却至-195.8℃时,变成没有颜色的液体,冷却至-209.86℃时,液态氮变成雪状的固体。
氮气的化学性质很稳定,常温下很难跟其他物质发生反应,但在高温、高能量条件下可与某些物质发生化学变化,用来制取对人类有用的新物质。
•物理性质:(1)无色无味的气体(2)不易溶于水(3)在标准状况下密度为1.251g/L,密度比空气略小化学性质:化学性质不活泼,一般情况下不能燃烧,也不支持燃烧;在常温下难与其他物质发生反应,但在高温下也能与一些物质发生化学反应。
•用途:(1)焊接金属时做保护气(2)灯泡中填充氮气以延长灯泡的使用寿命,食品包装袋中充有氮气以防止食品腐烂变质(3)医疗上可以在液氮冷冻麻醉的条件下做手术(4)超导材料在液氮的低温环境下能显示超导性能(5)制造氮肥和硝酸(6)有些博物馆把贵重罕见的书画,墨宝保存在充满氮气的圆筒中,既可以避免氧化变质,又可防止虫蛀霉变。
•氮的化学性质:1. 氮化物反应氮化镁与水反应:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑在放电条件下,氮气才可以和氧气化合生成一氧化氮:N2+O2=放电=2NO一氧化氮与氧气迅速化合,生成二氧化氮2NO+O2=2NO2二氧化氮溶于水,生成硝酸,一氧化氮3NO2+H2O=2HNO3+NO五氧化二氮溶于水,生成硝酸,N2O5+H2O=2HNO32. 氮和活泼金属反应N2与金属锂在常温下就可直接反应:6Li+N2===2Li3NN2与碱土金属Mg、Ca、Sr、Ba在炽热的温度下作用:3Ca+N2===Ca3N2 N2与镁条反应:3Mg+N2=点燃=Mg3N2(氮化镁)3. 氮和非金属反应N2与氢气反应制氨气:N2+3H2===(可逆符号)2NH3N2与硼要在白热的温度才能反应:2B+N2===2BN(大分子化合物)N2与硅和其它族元素的单质一般要在高于1473K的温度下才能反应。
第4章氮族元素

2 NH2OH + 2 AgBr === 2 Ag + N2 + 2 HBr+ 2 H2O 2NH2OH + 4 AgBr === 4 Ag + N2O +4 HBr +H2O
1.熟悉氮元素在本族元素中的特殊性。 2、掌握氮、磷以及它们的氢化物,含氧酸 及其盐的结构、性质、制备和用途。 3、熟悉本族元素不同氧化态间的转化关系,
4、掌握砷、锑、铋单质及其化合物的性质递 变规律。 5、从结构特点上分析理解本族元素的通性和特性。
本章讲解内容
第一节 通性
第二节 氮及其化合物 第三节 磷及其化合物 第四节 砷 锑 铋
NH2OH+2Fe(OH)2+H2O=2Fe(OH)3+NH3
3.氮化物 (N— )
离子型氮化物只存在于固态,水 溶液中水解为氨: 3Mg+N2=Mg3N2 Mg3N2+6H2O=3Mg(OH)2+2NH3
间充型氮化物不服从一般化合价定律, 如TiN、Mn5N2、W2N3等,氮原子填充在 金属晶格的间隙中,化学性质稳定, 熔点高,硬度大,用于作高强度材料。 氮与非金属元素如C,Si,P等可形成共 价型氮化物,这类化合物中,氮元素 氧化数为-3,如AlN, BN, GaN, Si3N4 等,它们都是大分子物质,熔点高。
结构式:N
N
由于N2分子中存在叁键N≡N,所以N2分子具有很 大的稳定性,将它分解为原子需要吸收946 kJ•mol1的能量。N 分子是已知的双原子分子中最稳定的。 2
主要反应
加热加压催化剂
N2+3H2===========2NH3
金属氮化物

金属氮化物
金属氮化物是一类重要的无机材料,具有广泛的应用前景。
金属氮化物可以分为两类:一类是由金属和氮原子组成的化合物,如硼氮化铝、硼氮化硅等;另一类是由金属、氮和其他元素组成的化合物,如氮化镓、氮化铟等。
金属氮化物具有优异的物理、化学性质,例如高硬度、高熔点、高抗腐蚀性、高热导率等。
这些性质使得金属氮化物在电子、光电子、热电子、光伏等领域具有广泛的应用,如LED、太阳能电池、高温传感器等。
金属氮化物的制备方法包括固相反应法、气相反应法、液相反应法等多种方法。
其中,气相反应法可以得到高品质的金属氮化物,但成本较高;而液相反应法则成本较低,但得到的产物质量较差。
金属氮化物的未来发展趋势是开发高性能、低成本的制备方法,并进一步拓展其在新能源、环境保护等领域的应用。
- 1 -。
《氮气》

《氮气》【高考考点】1.掌握氮族元素的原子结构特点,理解氮族元素的相似性和递变性规律及其原因。
2.了解氮气的分子结构,掌握氮气的化学性质性质,理解氮的固定的含义。
【知识要点】一.氮族元素1.图示大气中氮循环过程2.强化记忆As、Sb两种元素的名称和符号,并注意Sb与Te的区别。
3.了解氮族元素及其单质的一些重要性质二.氮气1.氮元素的存在形态,主要化合价。
2.氮气的组成和结构:⑴氮原子结构示意图;⑵N2的电子式,性分子,晶体。
3.氮气的性质:⑴物理性质:。
⑵化学性质:①通常情况下,性质,很难与其它物质反应。
原因是。
②在高温或放电的条件下:与H2反应:,表现N2的性;与O2反应:,表现N2的性。
③与Mg(Ca、Ba)等活泼金属反应:,表现N2的性。
说明:N3-的存在——金属氮化物〖练习〗1.等质量三份金属镁分别放在足量的氧气、二氧化碳、空气中燃烧,生成固体的质量分别为m1、m2、m3,则固体质量由小到大的是。
2.等物质的量的氧气、二氧化碳、空气分别与足量的金属镁反应,生成固体的质量分别为m1、m2、m3,则固体质量由小到大的是。
4.用途:。
5.氮的固定:1.含义:2.方法:。
【高考试题】1.下列反应起到了氮的固定作用的是A.N2和H2在一定条件下生成NH3B.NO和O2生成NO2C.NH3经催化氧化生成NO D.用NH3制碳铵和硫铵2.下列元素的单质中,最易与H2反应生成氢化物的是A.硼B.氮C.氟D.碳3.常温下,有A和B两种气体组成的混合(A的相对分子质量大于B的相对分子质量),经分析混合气体中只含有氮和氢两种元素,而且不论以何种比例混合,氮和氢的质量比总大于14/3,由此可确定A为,B为,其理由是;若上述混合气体中氮和氢的质量比为7∶1,则在混合气体中A和B的物质的量之比为。
4.取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.470 g冷却后加入足量水,将反应产物加热蒸干并灼烧,得到的固体质量为0.486 g。
氮元素化学式-概述说明以及解释

氮元素化学式-概述说明以及解释1.引言1.1 概述概述是文章引言的第一个部分,用于引入主题并介绍文章内容。
在本文中,我们将探讨氮元素的化学式及其相关性质、反应和应用领域。
氮元素是一种非金属元素,化学符号为N,原子序数为7。
它在自然界中广泛存在于空气、土壤和有机物中,是地球上最丰富的元素之一。
氮元素具有丰富的化学性质,包括高电负性、不活泼、无色无味以及低溶解度等特点。
它可以与许多元素发生反应,如氢、氧、卤素等。
氮元素最著名的特点是其稳定的三键共价键结构,使其形成氮气(N2),这是大气中最主要的气体之一。
在化学反应中,氮元素可以与其他元素形成多种化合物,例如氨(NH3)、硝酸盐(NO3-)和亚硝酸盐(NO2-)等。
这些化合物在生物、工业和农业等领域有着广泛的应用。
氨是制造肥料和化肥的关键原料,可以提供植物所需的氮源。
硝酸盐则用于制造炸药和农药,具有重要的工业用途。
亚硝酸盐则用于食品加工过程中的保鲜和着色。
正是由于氮元素在生命、环境和工业中的广泛应用,对其性质和反应的深入研究具有重要意义。
通过深入了解氮元素的化学式及其特性,我们可以更好地利用和控制它的应用。
本文将重点介绍氮元素的基本性质、化学反应和应用领域,为读者提供对氮元素的全面了解和认识。
接下来,我们将在正文部分详细介绍氮元素的基本性质、化学反应和应用领域,以及对其未来的展望。
通过对氮元素的深入研究,我们可以更好地利用和开发其潜在的应用价值,为人类的生活和发展做出更大的贡献。
1.2 文章结构文章结构部分的内容应该包括对整篇文章的组织和概述,以及各个章节的主题和内容安排。
下面是文章结构部分的内容:文章结构本文将全面介绍氮元素的化学式、基本性质、化学反应以及应用领域。
文章共分为三个主要部分:引言、正文和结论。
引言部分将对氮元素进行概述,介绍其重要性和普遍存在的地方。
随后,会对文章的结构进行说明,并阐明本文的目的。
正文部分将详细探讨氮元素的基本性质、化学反应以及应用领域。
金属氮化物亚稳相及孪晶的形成机制

金属氮化物亚稳相及孪晶的形成机制1.金属氮化物的亚稳相是指在一定条件下形成的不稳定结构。
The metastable phase of metal nitrides refers to the unstable structure formed under certain conditions.2.亚稳相的形成可能受到外界温度、压力等因素的影响。
The formation of metastable phases may be influenced by external factors such as temperature and pressure.3.金属氮化物的亚稳相具有特殊的物理和化学性质。
The metastable phase of metal nitrides has special physical and chemical properties.4.孪晶是指晶体中存在两种不同取向的晶体片。
Twins refer to the presence of two crystallographically distinct orientation of crystal phases in a crystal.5.孪晶的形成与晶体生长过程和应力有关。
Twin formation is related to the crystal growth process and stress.6.金属氮化物中的孪晶形成可能受到晶格缺陷和界面能的影响。
Twin formation in metal nitrides may be influenced by lattice defects and interfacial energy.7.亚稳相和孪晶的形成机制可能涉及晶体的结构调节和能量最优配置。
The formation mechanism of metastable phases and twinsmay involve structural adjustment of crystals andoptimization of energy.8.表面能减小和热力学稳定性提高可能是亚稳相形成的原因之一。
氮化铬的溶解

氮化铬的溶解1. 简介氮化铬(CrN)是一种重要的金属氮化物材料,具有优异的物理和化学性质。
它是由铬和氮元素组成的化合物,具有高硬度、良好的耐磨性和耐腐蚀性。
在工业领域中,氮化铬被广泛应用于涂层、刀具、陶瓷等领域。
本文将介绍氮化铬的溶解过程及其相关实验方法和应用。
2. 氮化铬的溶解过程2.1 溶解介质选择氮化铬在常见酸性介质中难以溶解,因此通常需要选择适当的溶解介质来实现其溶解。
常用的溶解介质包括浓硝酸、浓盐酸、浓硫酸等。
2.2 实验步骤以下为一种常见的氮化铬溶解实验步骤:1.准备试样:将待溶解的氮化铬样品切割成适当大小,并清洗干净。
2.准备溶液:按照实验要求配制适当浓度的溶液,如浓硝酸。
3.溶解过程:将氮化铬样品放入溶液中,可以选择加热加快溶解速度。
4.溶解完毕:待样品完全溶解后,取出并进行后续实验或分析。
2.3 注意事项在进行氮化铬的溶解实验时,需要注意以下事项:1.实验操作需在通风良好的实验室中进行,避免吸入有害气体。
2.需佩戴适当的个人防护装备,如手套、护目镜等。
3.溶解过程中应控制温度和时间,以避免产生危险物质或损坏设备。
4.溶液处理后应按照相关规定进行废液处理。
3. 氮化铬溶解实验方法3.1 离子交换法离子交换法是一种常用的氮化铬溶解方法。
该方法利用强碱与氮化铬反应生成相应的盐类,并使其溶于水中。
具体步骤如下:1.准备试样:将氮化铬样品切割成适当大小,并清洗干净。
2.准备溶液:配制适量的强碱溶液,如氢氧化钠溶液。
3.溶解过程:将氮化铬样品放入强碱溶液中,加热并搅拌,使其完全溶解。
4.分离盐类:将溶液通过离子交换柱进行分离,得到纯净的氮化铬盐溶液。
3.2 高温熔融法高温熔融法是另一种常用的氮化铬溶解方法。
该方法通过将氮化铬样品与适量的熔融剂在高温下反应,使其转变为可溶性的化合物。
具体步骤如下:1.准备试样:将氮化铬样品切割成适当大小,并清洗干净。
2.准备熔融剂:选择适当的熔融剂,如碳酸钠、氯化钾等。
氮气化学知识点总结

氮气化学知识点总结氮气是一种非金属元素,其化学性质稳定,常见的氮气化学反应有氧化、还原和氮化等。
以下是对氮气化学知识点的总结:一、氮气的化学性质1.稳定性氮气在常温下是一种稳定的分子,它是由两个氮原子组成的非极性分子。
由于氮气分子中的两个氮原子之间的键合比较强,因此氮气的化学性质非常稳定。
2. 惰性氮气的化学活性较低,一般不会与其他元素反应,具有惰性。
因此,氮气对大部分常见的氧化剂和还原剂都不敏感。
3. 反应尽管氮气在常温下相对稳定,但在一定条件下,可以发生多种化学反应。
比如氧化、还原和氮化等反应。
二、氮气的氧化反应氮气可以与氧气发生氧化反应,生成氧化亚氮(NO)、二氧化氮(NO2)等化合物。
氧化亚氮和二氧化氮是一些重要的氮气的氧化产物。
1. 生成氧化亚氮当氮气和氧气在高温下反应时,会生成氧化亚氮:N2 + O2 → 2NO2. 生成二氧化氮在氧气充足的条件下,氮气会生成二氧化氮:2NO + O2 → 2NO2二氧化氮是一种重要的氮气的氧化产物,它是一种有毒气体,对人体和环境具有危害。
三、氮气的还原反应氮气可以在一定条件下发生还原反应,生成氨(NH3)等化合物。
氨是一种重要的氮化物质,用于制造肥料等化工原料。
1. 氮气的还原氨的合成是一种重要的氮气的还原反应,通常采用哈伯-波斯特过程进行合成。
该过程利用铁作为催化剂,将氮气和氢气在高温下进行反应,生成氨。
N2 + 3H2 → 2NH32. 氮氢化合物的应用氨是一种重要的氮化物质,在化工生产中具有广泛的用途。
它被用于制造化肥、合成塑料、生产医药品等。
氮氢化合物的还原反应是氮气化学中的重要反应之一。
四、氮气的氮化反应氮气可以与金属元素发生氮化反应,形成金属氮化物。
金属氮化物是一类重要的氮气化合物,具有多种应用价值。
1. 氮气的氮化反应氮气可以与一些金属元素发生氮化反应,生成金属氮化物。
例如,当氮气与钙发生反应时,可以生成氮气化钙:3Ca + N2 → Ca3N22. 金属氮化物的应用金属氮化物广泛应用于制备光学材料、电子材料等。
【精品文章】一文认识锂电池用过渡金属氮化物

一文认识锂电池用过渡金属氮化物
过渡金属氮化物是一类金属间充型化合物,兼具有共价化合物、离子晶体和过渡金属的性质,具有低而平的充放电电位平台、可逆性能好与容量大等特点,被广泛应用于锂离子电池负极材料,并已成为当前锂离子电池负极材料研究的热点之一。
一、锂过渡金属氮化物概述
1、锂过渡金属氮化物的化学式主要有Li3N结构和类萤石结构。
(1)Li3N结构
Li3N结构主要有Li3-xMN(M为Mn、Cu、Ni、Co、Fe)。
1984年,过渡金属氮化物Li1-xCuN制备成功,并对其离子电导性能进行了研究。
随后,Li7FeN2、Li7MnN4、Li2.6Co0.4N等过渡金属氮化物引起了研究者广泛关注。
(2)类萤石结构
类萤石结构主要有Li2n-1MNn(M为Sc、Ti、V、Cr等)。
电化学研究证明,除Co金属三元氮化物外,Cu、Ni、和Fe的金属三元氮化物作为负极材料通过多次充放电循环也有极高的效率。
2、过渡金属氮化物充放电反应机理
第一次放电过程中Li+驱使过渡金属氮化物M3N分解成M金属粒子并分散于形成的Li3N基体中,如式(1)中所示。
然而,通过对电极材料的一系列原位表征发现,充电过程并不是第一次放电反应的逆过程,第一次放电反应之后的反应过程可能如反应式(2)所示,在循环过程中部分金属
M参与反应。
而对于MN(M为Co、Fe、V、Cr)型过渡金属氮化物的反。
电解水制氢中的非贵金属催化剂
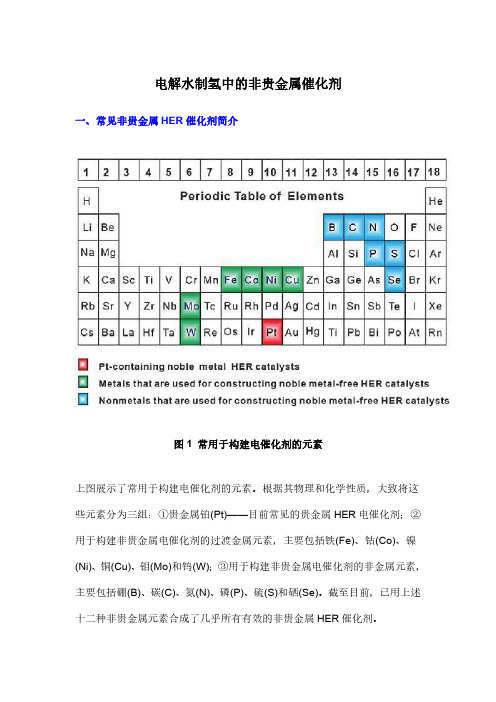
图 3 核壳结构 N-MoSe2/VG 阵列
金属碳化物
1973 年,R. B. Levy 和 M. Boudart 发现由于碳化钨和铂具有相似的 d 带电 子密度态,存在一定的类铂催化行为。上述开创性工作立即引起研究人员极 大的兴趣,同时开展了以取代高成本贵金属催化剂为目的的金属碳化物研究。 金属碳化物耐腐蚀、稳定性好、机械强度高,其电催化寿命较长。除碳化钨 外,许多研究了其他金属碳化物 HER 电催化剂也得到了广泛研究。近日,研 究人员采用自模板保护表面活性位点的策略,用 Cu-MoO2 微米棒前驱体合成 了 Mo2C/多孔石墨烯微米棒(CLCN)复合材料。该体系在酸性电解质溶液中的 电催化析氢活性远高于以往绝大多数不含非金属掺杂元素的 Mo2C 催化剂, 并在酸性、中性、碱性电解质溶液中均有优异的电化学稳定性。
金属硫化物 功能仿生催化剂的开发是一个重要的进展,为大规模可持续的氢气生产开辟 了道路。尽管自然界存在的固氮酶和氢化酶可以催化析氢反应,但是酶基器 件难以为高水平的氢气生产做出重大贡献。这些精妙的生物催化剂具有出色 的催化选择性,能够在自然环境中运作,但在极端条件下(如强酸性和碱性介 质)将迅速失活。受到固氮酶和氢化酶的结构和组成启发,研究人员利用一系 列的金属硫化物(Mo(W)S2、FeS2、NiS2、CoS2 等)作为高效 HER 电催化剂, 这在非贵金属 HER 电催化剂领域是一个意义深远的成就。近来,研究人员利 用电化学原位 XAS 谱研究了过渡金属硫化物 NiS2 在碱性溶液中电催化析氢 的活性位点,加深了在碱性条件下过渡金属硫化物 HER 反应机理的理解,并 在此基础上设计出性能优异的电催化剂以用于构筑全分解水装置。
物有更多的协调不饱和表面原子。因此,金属磷化物可能从本质上其催化活 性高于金属硫化物。
N2化学性质

氮气物理性质:单质氮在常况下是一种无色无臭的气体,在标准情况下的气体密度是1.25g·dm-3,熔点63K,沸点75K,临界温度为126K,它是个难于液化的气体。
在水中的溶解度很小,在283K时,一体积水约可溶解0.02体积的N2。
氮气在极低温下会液化成白色液体,进一步降低温度时,更会形成白色晶状固体。
通常市场上供应的氮气都盛于黑色气体瓶中保存。
化学性质氮气分子的分子轨道式为,对成键有贡献的是三对电子,即形成两个π键和一个σ键。
对成键没有贡献,成键与反键能量近似抵消,它们相当于孤电子对。
由于N2分子中存在叁键N≡N,所以N2分子具有很大的稳定性,将它分解为原子需要吸收941.69kJ/mol的能量。
N2分子是已知的双原子分子中最稳定的。
检验方法:将燃着的Mg条伸入盛有氮气的集气瓶,Mg条会继续燃烧提取出燃烧剩下的灰烬(白色粉末Mg3N2),加入少量水,产生使湿润的红色石蕊试纸变蓝的气体(氨气)反应方程式3Mg+N2=Mg3N2(氮化镁)Mg3N2+6H2O=3Mg(OH)2+2NH3由氮元素的氧化态-吉布斯自由能图也可以看出,除了NH4离子外,氧化数为0的N2分子在图中曲线的最低点,这表明相对于其它氧化数的氮的化合物来讲,N2是热力学稳定状态。
氧化数为0到+5之间的各种氮的化合物的值都位于HNO3和N2两点的连线(图中的虚线)的上方,因此,这些化合物在热力学上是不稳定的,容易发生歧化反应。
在图中唯一的一个比N2分子值低的是NH4+离子。
(详细氧化态-吉布斯自由能图请参照/jpkc/kj/kj14.ppt)由氮元素的氧化态-吉布斯自由能图和N2分子的结构均可以看出,单质N2不活泼,只有在高温高压并有催化剂存在的条件下,氮气可以和氢气反应生成氨:在放电条件下,氮气才可以和氧气化合生成一氧化氮:在水力发电很发达的国家,这个反应已用于生产硝酸。
N2与电离势小,而且其氮化物具有高晶格能的金属能生成离子型的氮化物。
pt和过渡金属氮化物-概述说明以及解释

pt和过渡金属氮化物-概述说明以及解释1.引言1.1 概述概述是文章的开篇部分,用来介绍文章的主题和背景。
在本文中,我们将讨论有关PT和过渡金属氮化物的性质和应用。
PT是指铂(Platinum)元素,它是一种常见的过渡金属,在许多领域都有广泛的应用。
过渡金属氮化物则是指由过渡金属和氮元素组成的化合物,具有多种优良的物理和化学性质。
通过研究PT和过渡金属氮化物之间的关系,可以深入了解它们的特性,并为未来的科学研究和工程应用提供指导。
在本文中,我们将首先介绍PT的性质和应用。
铂是一种稀有而贵重的金属,具有优异的耐腐蚀性和高的催化活性。
它被广泛应用于化学工业、电子技术、医学以及能源领域。
然后,我们将讨论过渡金属氮化物的合成方法和特性。
过渡金属氮化物由于其特殊的晶体结构和优良的导电性、磁性等性质,在催化剂、电子器件以及文化遗产保护等领域具有重要的应用价值。
最后,我们将探讨PT和过渡金属氮化物之间的关联性,并展望它们的未来发展。
通过研究PT与过渡金属氮化物的相互作用和协同效应,可以进一步提高它们的性能和应用范围。
同时,对于PT和过渡金属氮化物的未来发展,我们也可以探索更多的合成方法和应用领域,以满足不断增长的科技和社会需求。
综上所述,本文将系统地介绍PT和过渡金属氮化物的性质和应用,并分析它们之间的关联性。
通过深入研究这些材料,我们可以为未来的科学研究和工程应用提供重要的参考和基础。
1.2 文章结构本文将围绕着PT和过渡金属氮化物展开,旨在探讨它们的性质、应用、合成方法和特性以及它们之间的关联性。
文章分为引言、正文和结论三个部分。
在引言部分,我们将对PT和过渡金属氮化物进行概述,并介绍文章的结构和目的。
首先,我们将简要介绍PT和过渡金属氮化物的定义、组成和基本性质。
随后,我们将阐述本文的整体架构,包括每个章节的主要内容和研究方法。
最后,我们将明确文章的目的,即深入探讨PT和过渡金属氮化物之间的关联性,以及它们在未来的发展前景。
金属氮化物mof材料

金属氮化物mof材料全文共四篇示例,供读者参考第一篇示例:金属氮化物MOF材料是一种新型的功能性材料,在材料科学领域具有重要的应用前景。
MOF(金属有机框架)是由金属离子或簇与有机配体组成的晶体结构,具有高表面积、多孔结构和可控性等优点,被广泛应用于气体吸附、催化、分离等领域。
金属氮化物MOF材料则是在MOF材料的基础上,将金属与氮化物相结合,形成一种新型的功能性材料。
金属氮化物MOF材料具有良好的电化学性能和导电性能,可用于储能、催化以及传感等领域。
与传统的MOF材料相比,金属氮化物MOF材料在电催化反应中表现出更高的催化活性、稳定性和选择性。
金属氮化物MOF材料还具有优异的光催化性能,可应用于光催化分解水、光催化CO2还原等领域。
金属氮化物MOF材料的制备方法主要包括溶剂热法、水热法、溶液法等。
这些方法可以精确控制金属与氮化物的比例和结构,从而调控材料的性能。
通过调整金属与氮化物的配比、晶面结构等因素,可以实现金属氮化物MOF材料的定制化设计,开发出具有特定功能的材料。
金属氮化物MOF材料是一种具有巨大应用潜力的新型功能性材料。
通过精确控制金属与氮化物的比例和结构,可以调控材料的性能,实现定制化设计。
在能源领域,金属氮化物MOF材料展现出优异的电化学性能和光催化性能,具有广泛的应用前景。
随着材料科学的不断发展,相信金属氮化物MOF材料将在未来的能源转化和储存领域发挥重要作用,促进能源的可持续发展。
第二篇示例:金属有机骨架材料(MOFs)是一类由金属离子或团簇与有机配体通过配位键结合而成的晶体结构化合物。
MOFs具有高度可调控性、多功能性和大表面积等优点,在催化、吸附、分离、储能等领域具有广泛的应用前景。
金属氮化物MOFs是一类特殊的MOFs材料,具有金属氮化物的硬度和化学稳定性,同时又具有MOFs材料的可调控性和多功能性。
本文将探讨金属氮化物MOFs材料的合成方法、结构特点、性能及应用前景等方面的研究进展。
中国 金属氮

中国金属氮
金属氮是一种金属与氮元素形成的化合物。
根据化合物的具体成分,金属氮可以包括多种不同的化合物。
目前已知的金属氮化合物主要有以下几种:
1. 金属氮化物(nitrides):金属氮化物是由金属与氮元素直接结合形成的化合物。
其中,一些常见的金属氮化物包括氮化铝(AlN)、氮化钛(TiN)、氮化硅(Si3N4)等。
2. 金属亚氮化物(subnitrides):金属亚氮化物是由金属与氮元素形成的化合物,但其氮含量较低。
这些化合物通常具有特殊的物理和化学特性。
例如,金属亚氮化物可以有不同的晶体结构和导电性质。
常见的金属亚氮化物包括亚氮化钛
(Ti2N)、亚氮化钨(WN)等。
3. 金属氨基化物(ammines):金属氨基化物是由金属与氨分子(NH3)形成的有机金属化合物。
这些化合物通常用于化学催化和氢储存等应用领域。
金属氮化物具有许多重要的应用,如电子器件、能源储存和转化、封装材料等。
其中,氮化铝具有优异的热导率和电绝缘性能,被广泛应用于高功率电子器件的散热材料;氮化钛和氮化硅则用于制备陶瓷材料和涂层材料。
此外,金属氮化物还可以作为催化剂、阳极材料和电极材料等。
总的来说,金属氮是一类重要的化学物质,在材料科学、能源领域和化学反应中都扮演着重要角色。
三氮化钠的电子式

三氮化钠的电子式NaN3是叠氮化钠,对应的酸是HN3,氢叠氮酸。
因此NaN3是一种盐,在水中可以稳定存在,溶液呈弱碱性。
叠氮化钠余撞击会发生爆炸产生大量氮气,所以用作汽车安全气囊中提供气体的物质。
电子式如下图:N和Na形成的物质常见的是两种:Na3N和NaN3。
【Na3N】:是氮化钠(Na3N)是一种非常不稳定的碱金属氮化物。
[1] 在室温时为晶体,在低于室温时会变成非晶体,高于87℃时会分解为元素钠及氮气。
【物理性质】:氮与电负性较小的元素形可以形成二元化合物(不包括氮与氢或卤素的二元化合物及叠氮化物)。
按性质分类,氮化钠属于碱金属氮化物,又称离子型氮化物,它的热稳定性较低。
当加热至室温,Na3N会变化为结晶形式;而在87℃的时候,Na3N会分解成它的元素【化学性质】:氮化钠遇水会水解而产生NH3和NaOHNa3N+3H2O→3NaOH +NH3↑,该反应为复分解反应,是一个剧烈的放热反应。
氮化钠也会与酸反应Na3N+3HCl→3NaCl+NH3↑,NH3+HCl→NH4Cl【NaN3】:叠氮化钠亦称“三氮化钠”,化学式(NaN3),分子量65.01,白色六方系晶体,无味,无臭,纯品无吸湿性。
剧毒。
相对密度1.846。
不溶于乙醚,微溶于乙醇(25℃时0.3),溶于液氨(0℃时50.7)和水(0℃时39、10℃时40.16、100℃时55)。
虽然无可燃性,但有爆炸性。
较其他叠氮化物稳定,在真空中加热不爆炸,可逐渐分解为金属钠及氮气,是高纯度金属钠的实验室制造方法之一,也是高纯度N2实验室制造方法之一。
与酸反应产生氢叠氮酸(HN3),反应化学式如下:2NaN3+H2SO4→Na2SO4+2HN3,氢叠氮酸为低沸点(37℃)无色液体,可与水随意混溶,有难闻的臭气味,其毒性及爆炸性很强。
叠氮化钠能和大多数的碱土金属、一价或多价的重金属的盐类、氢氧化物反应,而生成叠氮化物。
特别是铜、铅、银、黄铜、青铜等反应,而生成爆炸性大的重金属叠氮化物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氨气, Eu(OH)3 , Eu2O3
无
需在干燥空气气氛中保存
稀土金属氮化物
产品名称/化学名称
纯度/粒径/形态
CAS 登录号 化学式
电
分子量
光 测试
表观(颜色/形态) 粒径大小
福
利 ICP主元素分析(确定La组分含量)
TREN(稀土氮化物总量)
纯度
北
河 样品
稳定性
电
不稳定性影响因素
水、蒸汽、潮湿、水汽、酸
氨气, Dy(OH)3 , Dy2O3 无
需在干燥空气气氛中保存
稀土金属氮化物
产品名称/化学名称
纯度/粒径/形态
CAS 登录号 化学式
电
分子量
光 测试
表观(颜色/形态) 粒径大小
福
利 ICP主元素分析(确定Er组分含量)
TREN(稀土氮化物总量)
纯度
北
河 样品
稳定性
电
不稳定性影响因素
不相容性(应避免的材料) 危险分解产物 放射性 贮存条件
光 福 利
北
产品规格 稳定性
电
光
福 利 氮化镧
99.99%/-100目/粉末
北25764-10-7 LaN
河152.91g/mol 规格 黑色粉末 -100目 确定 99.5% 99.99%(基于TREN)
电 光 福
利
北 河 不稳定
室温时 N2/Ar 环境下稳定,空气中易氧化, 高湿度或潮湿空气会使LaN水解,生成La(OH)3 和氨
不相容性(应避免的材料) 危险分解产物 放射性 贮存条件
光 福 利
北
产品规格 稳定性
电
光
福 利 氮化镨
水、蒸汽、潮湿、水汽、酸
氨气, La(OH)3 , La2O3
无
需在干燥空气气氛中保存
稀土金属氮化物
产品名称/化学名称
纯度/粒径/形态
CAS 登录号 化学式
电
分子量
光 测试
表观(颜色/形态) 粒径大小
福
利 ICP主元素分析(确定Pr组分含量)
TREN(稀土氮化物总量)
纯度
北
河 样品
稳定性
电
不稳定性影响因素
无
需在干燥空气气氛中保存
碱土金属氮化物
产品名称/化学名称
纯度/粒径/形态
CAS 登录号 化学式
电
分子量
光测试
表观(颜色/形态) 粒径大小
福
利 ICP主元素分析(确定Ca组分含量)
纯度
样品
北
河
稳定性
电
不稳定性影响因素
不相容性(应避免的材料) 危险分解产物 放射性 贮存条件
光 福 利
北
产品规格 稳定性
不相容性(应避免的材料) 危险分解产物 放射性 贮存条件
光 福 利
北
产品规格 稳定性
电
光
福 利 氮化铒
99.99%/-100目/粉末
北12020-21-2 ErN
河181.21g/mol 规格 黑色粉末
电
-100目 确定
光
99.5% 99.99% (基于TREN)
福
利
北 河 不稳定
室温时 N2/Ar 环境下稳定,空气中易氧化, 高湿度或潮湿空气会使ErN水解,生成Er(OH)3 和氨
水、蒸汽、潮湿、水汽、酸
氨气, Sr(OH)2,SrO
无
需在干燥空气气氛中保存
稀土金属氮化物
产品名称/化学名称
纯度/粒径/形态
CAS 登录号 化学式
电
分子量
光 测试
表观(颜色/形态) 粒径大小
福
利 ICP主元素分析(确定Dy组分含量)
TREN(稀土氮化物总量)
纯度
北
河 样品
稳定性
电
不稳定性影响因素
电
光
福 利 氮化钙
99.9%/-50目/粉末
北12013-82-0 Ca3N2
河148.25g/mol 规格 棕色粉末 -50目 确定 99.9%
电 光 福
利
北 不稳定 河 室温时 N2/Ar 环境下稳定,空气中易氧化,
高湿度和潮湿空气会使Ca3N2水解,生成Ca(OH)2和氨
水、蒸汽、潮湿、水汽、酸
12057-71-5
北Mg3N2
100.95g/mol
河 规格 淡黄色粉末 -100目 确定 99.9%
电 光 福
利
稳定性
北 不稳定
河 室温时 N2/Ar 环境下稳定,空气中易氧化,
高湿度或潮湿空气会使Mg3N2水解,生成Mg(OH)2和氨 水、蒸汽、潮湿、水汽、酸
氨气, Mg(OH)2 , MgO
光 福 利
北
产品规格 稳定性
电
光
福 利 氮化锶
99.9%/-50目/粉末
北12033-82-8 Sr3N2
河290.88g/mol 规格 黑色粉末 -50目 确定 99.9%
电 光 福
利
北 河 不稳定
室温时 N2/Ar 环境下稳定,空气中易氧化, 高湿度或潮湿空气会使Sr3N2水解,生成Sr(OH)2和氨
不相容性(应避免的材料) 危险分解产物 放射性 贮存条件
光 福 利
北
产品规格 稳定性
电
光
福
利 氮化镝
99.99%/-100目/粉末
北12019-88-4 DyN
河176.51g/mol 规格 灰色粉末
电
-100目 确定
光
99.5% 99.99% (基于TREN)
福
利
北 河 不稳定
室温时 N2/Ar 环境下稳定,空气中易氧化, 高湿度和潮湿空气会使DyN水解,生成Dy(OH)3和氨
氨气,Ca(OH)2,CaO
无
需在干燥空气气氛中保存
碱土金属氮化物
产品名称/化学名称
纯度/粒径/形态
CAS 登录号 化学式
电
分子量
光 测试
表观(颜色/形态) 粒径大小
福
利 ICP主元素分析(确定Sr组分含量)
纯度
样品
北
河
稳定性
电
不稳定性影响因素
不相容性(应避免的材料) 危险分解产物 放射性 稳定性
不相容性(应避免的材料) 危险分解产物 放射性 贮存条件
光 福 利
北
产品规格 稳定性
电
光
福 利 氮化铕
99.99%/-100目/粉末
北12020-58-5 EuN
河165.91g/mol 规格 黑色粉末 -100目 确定 99.5% 99.99% (基于TREN)
电 光 福
利
北 河 不稳定
室温时 N2/Ar 环境下稳定,空气中易氧化, 高湿度或潮湿空气会使EuN水解,生成Eu(OH)3 和氨
水、蒸汽、潮湿、水汽、酸
氨气, Er(OH)3 , Er2O3
无
需在干燥空气气氛中保存
稀土金属氮化物
产品名称/化学名称
纯度/粒径/形态
CAS 登录号 化学式
电
分子量
光 测试
表观(颜色/形态) 粒径大小
福
利 ICP主元素分析(确定Eu组分含量)
TREN(稀土氮化物总量)
纯度
北
河 样品
稳定性
电
不稳定性影响因素
碱土金属氮化物
产品名称/化学名称
纯度/粒径/形态
CAS 登录号
化学式 分子量
电
表观(颜色/形态) 粒径大小
光 测试 福
利 ICP主元素分析(确定Mg组分含量)
纯度
样品
北
河
稳定性 不稳定性影响因素 不相容性(应避免的材料)
电 光
危险分解产物 放射性
福
贮存条件
利
北Leabharlann 电光产品规格
福 氮化镁 利 99.9%/-100目/粉末
