氮氧化合物
氮氧化物别名

氮氧化物别名
氮氧化物,又称为氮氧化合物,是指由氮与氧元素组成的化合物。
常见的氮氧化物包括一氧化氮(NO)、二氧化氮(NO2)和氮氧化物(N2O)。
这些化合物对人类和环境都有着重要的影响。
让我们来了解一氧化氮(NO)。
一氧化氮是一种无色气体,具有刺激性气味。
它主要由汽车尾气、工业排放和燃煤等活动产生。
一氧化氮在大气中的存在时间较短,但它与其他气体反应后会形成二氧化氮,进而产生臭氧,造成空气污染。
此外,一氧化氮还参与了大气中的氮循环和臭氧层的破坏。
接下来,我们来了解二氧化氮(NO2)。
二氧化氮是一种红棕色有刺激性气体,是一氧化氮与氧气反应生成的产物。
它是一种强烈的臭氧前体和空气污染物。
二氧化氮主要由汽车尾气、工业排放和燃煤等活动产生。
长期暴露于高浓度的二氧化氮环境中会引发呼吸系统疾病,如哮喘和慢性阻塞性肺病,并对植物和动物的生长和发育产生不利影响。
让我们了解一下氮氧化物(N2O)。
氮氧化物是一种无色气体,常被称为笑气。
它主要由化肥生产、废物处理和燃煤等活动产生。
氮氧化物是温室气体的一种,对全球气候变化有着重要影响。
此外,氮氧化物还参与了大气中的氮循环,对土壤质量和水体生态系统产生影响。
总的来说,氮氧化物对人类和环境都有着重要的影响。
它们是空气污染物之一,对空气质量和气候变化产生影响。
了解氮氧化物的特性和来源,可以帮助我们采取相应的措施来减少其排放和对环境的影响,保护我们的健康和地球的可持续发展。
氮氧化物的危害

氮氧化物的危害关于《氮氧化物的危害》,是我们特意为大家整理的,希望对大家有所帮助。
氮氧化合物是由不一样的化合物构成的,二氧化氮是最关键的。
氮氧化合物有很多的伤害,它可能会造成癌症的产生。
它会对身体的人体导致十分比较严重的影响,重要的是它还会继续导致活性氧。
活性氧是对自然界的一种毁坏,多种多样物质产生反映产生氮氧化合物,最后产生酸雨的危害,而酸雨的危害又具备腐蚀。
1.NO会与血液中的血红蛋白浓度融合,使血液供氧工作能力降低,导致氧气不足;2.NO具备致癌物质功效,会对细胞分裂和遗传物质造成欠佳影响;3.在空气中,NO在02功效下能被缓慢氧化成N02,转化成的N02进到身体呼吸道,造成肺脏和支气管炎病症;4.N02是酸阿中氰化钠和亚硝酸盐的前驱体,在紫外线直射下,N02会与空气中的碳氧化合物功效,转化成光化学污染和活性氧;5.转化成的酸雨的危害和光化学污染会造成粮食作物和山林大规模枯萎,酸雨的危害还会继续浸蚀工程建筑和机器设备,光化学污染具备显著的致癌物质功效,近地质构造空气中活性氧会对神经中枢导致巨大的损害。
氮氧化合物对自然环境的环境污染早已变成一个同益比较严重的国际性问题,它对空气的影响关键有酸雨的危害和较高的路面臭氧浓度,也参加产生空气中的浮尘。
氮氧化合物做为空气的关键空气污染物之一,包含有N20、NO、N202、N203、N02、N204和N205等几类,在其中对空气造成环境污染的主要是NO 和N02,在其中NO占典型性原煤烟尘NOx的95%,其他关键为N0216l。
除此之外,NOx在空气中可产生氰化钠和磷酸盐可吸入颗粒物,同盐酸和硫氰酸钾可吸入颗粒物一起,产生长距离传送,进而加快了地区性酸雨的危害的恶变。
现有研究表明,HN03对酸雨的危害的奉献呈增长之势,降雨中N037S042‘比率在全国性范畴内慢慢提升。
现阶段因己融合对两控区的区划工作中,对S02排污开展了全方位控制,但NOx排污总产量的迅速增长以及空气浓度值和还原性的提升有可能相抵对S02的控制实际效果,使酸雨的危害的恶化趋势无法得到压根控制。
氮氧化合物的产生及转化课件

一氧化氮是一种无色无味的有毒气体,是氮氧化物中最简单的一种。它在常温下以气体形式存在,但在低温下可 以液化。一氧化氮具有自由基的性质,在空气中容易被氧化成二氧化氮。
二氧化氮
总结词
红棕色有毒气体
详细描述
二氧化氮是一种红棕色的有毒气体,有刺激性气味。它是由一氧化氮在空气中被氧化形成的。二氧化 氮对水有较大的亲和力,会形成硝酸和亚硝酸,具有强腐蚀性和毒性。
土壤污染
氮氧化物会通过大气沉降、 雨水冲刷等方式进入土壤, 造成土壤污染。
土壤生态失衡
氮氧化物的存在会影响土 壤微生物的活性,导致土 壤生态失衡,影响植物的 生长和发育。
PART 04
氮氧化合物的转化与处理
自然转化
01
自然转化是指氮氧化物在自然环境中通过化学反应转化为 其他物质的过程。
02
自然转化过程通常需要较长时间,且转化效率较低,但在某些特 定条件下,如土壤、水体等,自然转化可以起到一定的净化作用。
2023 WORK SUMMARY
氮氧化合物的产生及 转化课件
REPORTING
• 氮氧化合物的产生
CATALOGUE
PART 01
氮氧化合物的产生
自然源产生
自然源产生的氮氧化物主要来自土壤中氮肥的分解、闪电、火
01
山爆发等自然现象。
02
土壤中的微生物可以将有机氮转化为氨,再氧化成硝酸盐,这
个过程中会产生氮氧化物。
政策建议与措施
01
制定严格的氮氧化物排放标准
根据不同行业和地区的特点,制定合理的排放标准,限制氮氧化物的排
放。
02
推广清洁能源和低碳技术
鼓励使用清洁能源和低碳技术,减少化石燃料的消耗,从源头上减少氮
湖北废气氮氧化合物排放标准

湖北废气氮氧化合物排放标准1.引言1.1 概述概述部分:废气氮氧化合物排放是指工业生产与能源消耗过程中产生的含氮化合物排放到大气中的现象。
这些氮氧化物包括一氧化氮(NO)、二氧化氮(NO2)、氮氧化物(NOx)等。
湖北作为中国重要的工业基地之一,废气氮氧化合物排放对环境质量与人体健康产生了深远的影响。
废气氮氧化合物对环境的主要影响包括大气污染、酸雨的形成以及臭氧层破坏等。
这些氮氧化物在大气中与其他大气污染物相互作用,产生二次污染物,使空气质量进一步恶化。
此外,废气氮氧化合物排放还会导致酸雨的形成,对土壤、水源以及生物多样性造成危害。
此外,氮氧化物的排放还会对臭氧层造成破坏,进而增加紫外线的强度,对人类健康产生潜在危害。
湖北废气氮氧化合物排放的现状十分令人担忧。
随着湖北经济的快速发展,工业污染排放不可避免地增加,废气氮氧化合物的排放量也有所上升。
大量的化工、石化、钢铁等行业的发展使得废气氮氧化物排放成为湖北重要污染源之一。
此外,湖北地处我国中部地区,大气环境条件复杂,气象条件多变,也对废气氮氧化合物的扩散与转化产生一定的影响。
因此,有必要建立和严格执行湖北废气氮氧化合物排放标准,以减少废气氮氧化合物对环境与人类健康的危害。
本文将详细探讨湖北废气氮氧化合物排放的现状,分析影响湖北废气氮氧化合物排放的因素,并阐述建立湖北废气氮氧化合物排放标准的必要性。
通过深入研究与分析,本文旨在提出科学有效的措施,促进湖北废气氮氧化合物排放的减少与控制,保护湖北的环境质量,维护人民的身体健康。
文章结构部分的内容如下:1.2 文章结构本文将按照以下结构进行阐述湖北废气氮氧化合物排放标准的问题。
首先,在引言部分概述了本文的目的和意义,接下来在正文部分将分析废气氮氧化合物排放的意义以及湖北省的废气氮氧化合物排放现状,最后在结论部分重点讨论了影响湖北废气氮氧化合物排放的因素,并说明了建立湖北废气氮氧化合物排放标准的必要性。
通过这样的结构安排,旨在全面深入地探讨湖北省在废气氮氧化合物排放方面所面临的问题,并提出相应的解决方案和建议。
氮氧化合物标准-概述说明以及解释

氮氧化合物标准-概述说明以及解释1.引言1.1 概述氮氧化物(NOx)是指一类由氮和氧元素组成的化合物,主要包括氮氧化物(氮一氧化物)和二氧化氮。
氮氧化物广泛存在于大气中,其主要排放源包括工业生产、交通运输、能源利用和农业活动等。
这些排放源释放出的氮氧化物会对环境和人体健康产生负面影响。
氮氧化物的排放和积累会导致大气污染问题,其中二氧化氮是造成光化学烟雾的重要成分之一,与臭氧的生成有密切关系。
氮氧化物还参与大气中的气溶胶形成,对气候变化具有一定影响。
此外,氮氧化物的排放还会对水体和土壤产生负面影响,导致水体富营养化和土壤酸化。
对人体健康而言,氮氧化物是一类可导致呼吸系统疾病的有害物质。
二氧化氮进入人体后会与呼吸道中的水分反应生成硝酸,导致呼吸道炎症和气道阻塞。
氮氧化物还可诱发哮喘、慢性阻塞性肺疾病等疾病,并对免疫系统和心血管系统产生负面影响。
鉴于氮氧化物对环境和人体健康的危害,各国和地区都制定了一系列的氮氧化物标准,旨在限制氮氧化物的排放。
这些标准包括对不同行业、不同污染源的排放限值和措施要求,以确保大气中氮氧化物浓度的控制和降低。
然而,随着工业化和城市化进程的不断推进,氮氧化物的排放仍然面临许多挑战。
当前的氮氧化物标准在某些地区和行业的执行和落实存在不足,导致氮氧化物污染问题仍然突出。
因此,我们需要加强对氮氧化物排放的监管与控制,进一步提高标准的严格性和可操作性,以实现对氮氧化物污染的有效防治。
展望未来,我们应该致力于推动氮氧化物标准的进一步改进和完善。
在制定新的标准时,需要充分考虑不同行业和地区的实际情况,同时采取科学合理的控制手段,以最大程度地减少氮氧化物的排放。
此外,还应加强科学研究,深入探究氮氧化物的来源、转化和传输机制,为制定更加精准和有效的氮氧化物控制策略提供科学依据。
只有通过全社会的共同努力,才能实现氮氧化物的有效管理和环境保护。
1.2 文章结构文章结构本文主要围绕氮氧化物标准展开,从引言、正文和结论三个方面进行论述和分析。
氮氧化合物的产生及转化

氮氧化物主要来源于化石燃料的燃烧,汽车尾气、工厂废气的排放,其中,汽车尾气是城市大气中氮氧化物的主要来源之一。
开发使用洁净能源; 对工厂排放的废气进行处理 对汽车尾气进行净化处理。
(2)来源:
(3)防治:
问题解决:
汽车尾气(含烃类、CO、NO和NO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管装上催化转化器,使NO或NO2与CO反应生成可参与大气生态循环的无毒气体,请用相应的化学方程式来表示:
2)氮气跟氧气的反应
N2+O2
2NO
放电
3)氮气跟某些金属的反应
Mg3N2
N2+3Mg
点燃
在闪电作用下,游离态的氮气转化为化合态的氮化物
“雷雨发庄稼”
N2与O2
NO
O2
NO2
H2O
HNO3
闪电
矿物质
硝酸盐
氮氧化合物的产生及转化
放电
3NO2+H2O = 2HNO3+NO
2NO+O2 = 2NO2
N2+O2 2NO
高温高压 催化剂
N2+3H2 2NH3
空气: N2
氮的存在
血红蛋白中
叶绿素中
一.氮气的物理性质
氮气是无色无味密度比空气稍小,熔、沸点低,难溶于水的气体
氮气的化学性质
1)氮气跟氢气的反应(合成氨)
N2+3H2 2NH3(工业合成氨)
高温、高压 催化剂
2CO+2NO = 2CO2+N2
4CO+2NO2 = 4CO2+N2
催化剂
催化剂
若水全部充满试管,则原混合气体中NO2与O2的体积分别为___mL、_____mL。
氮氧化合物的测定

氮氧化合物的测定一、实验原理大气中的氮氧化物主要是一氧化氮和二氧化氮。
在测定氮氧化物浓度时,应先用三氧化铬将一氧化氮氧化成二氧化氮。
3NO+2CrO3→3NO2+Cr2O3(1—1)二氧化氮被吸收液吸收后,生成亚硝酸和硝酸,其中,亚硝酸与对氨基苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,据其颜色深浅,用分光光度法定量。
因为NO2(气)转变为NO2-(液)的转换系数为0.76,故在计算结果时应除以0.76。
三、试剂的配置1.亚硝酸钠标准溶液:吸取贮备液5.00mL于100mL容量瓶中,用水稀释至标线。
此溶液每毫升含5.0μgNO2。
2.三氧化铬-砂子氧化管:筛取20—40目河砂,用(1+2)的盐酸溶液浸泡一夜,用水洗至中性,烘干。
将三氧化铬与砂子按重量比(1+20)混合,加少量水调匀,放在红外灯下或烘箱内于105℃烘干,烘干过程中应搅拌几次。
称取约8g三氧化铬-砂子装入双球玻璃管内,两端用少量脱脂棉塞好,用乳胶管或塑料管制的小帽将氧化管两端密封,备用。
采样时将氧化管与吸收管用一小段乳胶管相接。
3.吸收液:称取5.0g对氨基苯磺酸,置于1000mL容量瓶中,加入50mL冰乙酸和900mL 水的混合溶液,盖塞振摇使其完全溶解,继之加入0.050g盐酸萘乙二胺,溶解后,用水稀释至标线,此为吸收原液,贮于棕色瓶中,在冰箱内可保存两个月。
保存时应密封瓶口,防止空气与吸收液接触。
采样时,按4份吸收原液与1份水的比例混合配成采样用吸收液。
4.亚硝酸钠标准贮备液:称取0.1500g粒状亚硝酸钠(NaNO2,预先在干燥器内放置24h 以上),溶解于水,移入1000mL容量瓶中,用水稀释至标线。
此溶液每毫升含100.0μgNO2-,贮于棕色瓶内,冰箱中保存。
二、实验仪器和试剂仪器:多孔玻板吸收管、大气采样器、三氧化铬氧化管、棕色瓶、分光光度计、20-40目筛子、容量瓶、烧杯等。
药品试剂:对氨基苯磺酸、冰乙酸、盐酸萘乙二胺、三氧化铬-砂子、粒状亚硝酸钠、盐酸等。
氮氧化合物的化学式

氮氧化合物的化学式氮氧化合物是氮元素和氧元素结合形成的化合物,以N-O式表示,它是一类重要的有机物质。
最早的氮氧化合物是氯氧化氮,是氯和氧的化合物,它的结构式:Cl-O-N=O。
在这是化合物中,氯原子与氧原子以及氮原子有一个含氧的共价键,氮氧化合物的性质和结构与它的组成原子有关,当氮原子和氧原子结合发生改变时,氮氧化合物的性质也随之改变。
氮氧化合物的分子式通常是N-O,其中N表示氮原子,O表示氧原子。
在这个分子式中,氮原子与氧原子之间存在一种氧化键,它由一个氧原子的一价电负性及其他一价氮原子的正电荷构成,使氮原子有一价正电荷。
正因为包含氧化键,氮氧化合物的分子具有一定的热稳定性。
氮氧化合物可分为两大类:氮氧化物和氧化氮。
前者是由氮原子和氧原子结合而成的化合物;后者是氮原子和氧原子结合成氮-氧键,形成的化合物。
氧化氮可分为氯氧化氮、硝酸盐、溴氧化氮、亚硝酸盐、亚硫酸盐等。
这些化合物都具有一定的毒性和腐蚀性,能够与氧、氢和其他元素发生反应,在包括火药、爆炸物在内的炸药中,都有所应用。
氮氧化合物在工业上也有着重要的作用,可以用来制备氨基酸和合成氨基酸,以及制造硝酸、硝酸铵、氯硝酸钠,这些化合物都是重要的有机化学品,在工业上有着重要的作用,例如用来合成某种颜料,作为农药和消毒剂使用,等等。
此外,氮氧化合物还可以用来制备胺类、活性氧化物、氰化物和含氮类物质,这些物质在药物中都有重要的作用,在药物合成上占有重要地位。
氮氧化合物在环境中也有着重要的作用,氮氧化合物与氧反应会形成臭氧,臭氧在保护地球免受太阳对大气的影响中起着重要作用。
此外,氮氧化合物反应也可以产生一系列有机物,可以被植物吸收和利用,促进植物的生长。
总而言之,氮氧化合物具有重要的化学性质,它在工业、环境和药物合成上都发挥重要作用,如果能充分利用这类化合物,将有助于我们的社会发展。
- 1 -。
氮氧化合物的产生及转化

1.生命物质的重要组成元素 2.在生产、科学研究领域的广泛应用
空气中氮气的体积分数78%,氧气的体积分 数21%,还有少量的CO2及稀有气体。氮气 是空气的主要成分,氮元素是组成蛋白质的 必需元素,是生命的重要组成元素。但空气 中氮元素的化学性质稳定,只有少数豆科植 物能够直接吸收转化加以利用。直到1919 年,德国化学家哈伯在实验室中首次人工合 成了NH3,才使大规模合成化肥成为现实。 但含氮化合物的使用也给人类生活带来了巨 大的危害!
练习
在新疆和青海交界处有一狭长山谷,每当牧民和牲畜进入 后, 风和日丽的晴天顷刻间电闪雷鸣,狂风大作,人畜往往遭 雷击 倒下。奇怪的是这里的牧草茂盛,四季常青,被当地牧民 称为“魔鬼谷”。你能用化学方程式及必要的文字叙述解释“魔 鬼谷”牧草茂盛、四季常青的原因吗?
练习
请用双线桥表示下列反应的电子转移情况: 得4e-
小结:
1、氮气(N2)的化学性质:
N2 O2 放电 2NO N 2 3Mg 点燃 Mg 3N 2
2、氮的氧化物的化学性质:
2NO O2 2NO2 3NO2 H2O 2HNO3 NO
4NO2 O2 2H2O 4HNO3 4NO 3O2 2H2O 4HNO3
生物固氮
与大豆、蚕 豆等豆科植 物共生的根 瘤菌中存在 固氮酶,能 在常温常压 下把空气中 的氮气转变 为氨。
根瘤菌
催化剂
N2+3H2
高温高压
2NH3
雷雨发庄稼?
丰收的田野 与 快乐的农民
丰收在望的田野
一场雷雨一场肥
雷雨与肥料
空气的成分
肥料的种类
转化的途径
思考讨论: 雷雨又是如何将空气中氮气生成肥料的, 它的成分是什么 ?
氮氧化合物排放量标准

氮氧化物的排放:
1、燃气锅炉氮氧化物的排放要求:在用锅炉400mg、新建燃气锅炉
200mg、重点地区150mg;
2、燃煤锅炉氮氧化物的排放要求:在用锅炉400mg、新建燃气锅300mg、重点地区200mg;
3、燃油锅炉氮氧化物的排放要求:在用锅炉400mg、新建燃气锅250mg、重点地区150mg。
法律依据:中华人民共和国国家标准《火电厂大气污染物排放标准》
(GB13223-1996)近几年我国已开始引进锅炉低氮燃烧技术,为促进该技术推广发展,及早控制火电行业氮氧化物的排放,首次规定了排放氮氧化物的标准限值;氮氧化物排放标准适用时段-1997年1月1日起环境影响报告书待审查批准的新、扩、改建火电厂。
北京1999-05-01开始实施的北京市地方环境标准《燃烧锅炉氮氧化物排放标准》相对国家标准则更为严格。
[精华]大气中氮氧化合物的测定
![[精华]大气中氮氧化合物的测定](https://img.taocdn.com/s3/m/96808dc685254b35eefdc8d376eeaeaad1f316f7.png)
大气中氮氧化合物的测定一、实验原理大气中的氮氧化物主要是一氧化氮和二氧化氮。
在测定氮氧化物浓度时,应先用三氧化铬将一氧化氮氧化成二氧化氮。
3NO+2CrO3→3NO2+Cr2O3(1—1)二氧化氮被吸收液吸收后,生成亚硝酸和硝酸,其中,亚硝酸与对氨基苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,据其颜色深浅,用分光光度法定量。
因为NO2(气)转变为NO2-(液)的转换系数为0.76,故在计算结果时应除以0.76。
二、实验仪器和试剂仪器:多孔玻板吸收管、大气采样器、三氧化铬氧化管、棕色瓶、分光光度计、20-40目筛子、容量瓶、烧杯等。
药品试剂:对氨基苯磺酸、冰乙酸、盐酸萘乙二胺、三氧化铬-砂子、粒状亚硝酸钠、盐酸等。
三、试剂的配置1.吸收液:称取5.0g 对氨基苯磺酸,置于1000mL 容量瓶中,加入50mL冰乙酸和900mL 水的混合溶液,盖塞振摇使其完全溶解,继之加入0.050g盐酸萘乙二胺,溶解后,用水稀释至标线,此为吸收原液,贮于棕色瓶中,在冰箱内可保存两个月。
保存时应密封瓶口,防止空气与吸收液接触。
采样时,按4 份吸收原液与1 份水的比例混合配成采样用吸收液。
2.三氧化铬-砂子氧化管:筛取20—40 目河砂,用(1+2)的盐酸溶液浸泡一夜,用水洗至中性,烘干。
将三氧化铬与砂子按重量比(1+20)混合,加少量水调匀,放在红外灯下或烘箱内于105℃烘干,烘干过程中应搅拌几次。
称取约8g 三氧化铬-砂子装入双球玻璃管内,两端用少量脱脂棉塞好,用乳胶管或塑料管制的小帽将氧化管两端密封,备用。
采样时将氧化管与吸收管用一小段乳胶管相接。
3.亚硝酸钠标准贮备液:称取0.1500g 粒状亚硝酸钠(NaNO2,预先在干燥器内放置24h 以上),溶解于水,移入1000mL 容量瓶中,用水稀释至标线。
此溶液每毫升含100.0μgNO2-,贮于棕色瓶内,冰箱中保存。
4.亚硝酸钠标准溶液:吸取贮备液5.00mL 于100mL 容量瓶中,用水稀释至标线。
氮氧化合物破坏臭氧机理

氮氧化合物破坏臭氧机理
臭氧层是大气中一种非常重要的气体,它能够吸收紫外线,有效
地保护着地球及其生命系统。
然而,随着全球工业和人口的增加,臭
氧层遭到了严重破坏,其中一部分原因就是氮氧化合物的排放。
那么,氮氧化合物究竟是如何破坏臭氧层的呢?
首先,氮氧化合物包括NO、NO2、N2O等物质,这些化合物可以
通过人类活动的各种途径排放到大气中,比如农业、交通运输等。
对
于破坏臭氧层而言,最重要的是NO和NO2。
这是因为它们可以参与一
系列复杂的化学反应过程,从而导致臭氧的减少。
其次,NO和NO2在大气中可以互相转化。
其中,NO可以与O3反
应生成NO2和O2,在此反应中,NO起到催化剂的作用。
然而,NO2与
O3反应生成NO和O2,这一过程会直接破坏臭氧层。
因此,NO和NO2
两种化合物的排放量越高,臭氧层遭受的破坏就越严重。
第三,NO和NO2还可以与其他物质发生反应,从而进一步破坏臭氧层。
例如,NO2可以与羟自由基(OH)反应生成硝酸,而硝酸可以与水蒸气形成云雾,这会导致雾霾天气的出现。
此外,NO2还可以与其他碳氢化合物反应,产生一系列多种臭氧污染物,例如PAN等。
综上所述,氮氧化合物破坏臭氧层的机理比较复杂,而且受到各
种因素的影响。
然而,无论是从环保角度还是全球气候变化角度考虑,减少氮氧化合物的排放对于保护臭氧层和地球环境都是非常重要的。
因此,各国政府需要采取更加有力的措施,限制氮氧化合物的排放,
保护臭氧层和我们的地球。
氮氧化合物
一般NO2、NO、O2与H2O反应,可归纳成四 种情况: (1)NO和O2混合溶于水 4NO + 3O2 + 2H2O = 4HNO3
(2)NO2和O2混合溶于水 4NO2 + O2 + 2H2O = 4HNO3 (3)NO和NO2混合溶于水 3NO2 + H2O = 2HNO3 + NO (4)NO、NO2、O2三种混合溶于水
物理
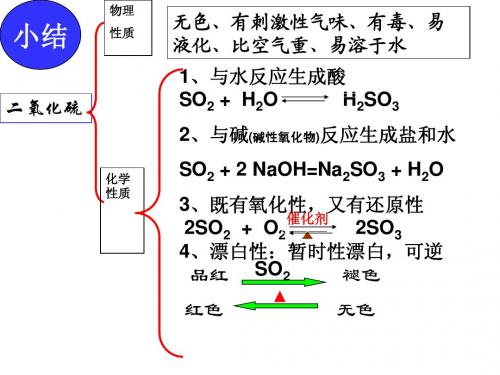
小结
二氧化硫
性质
无色、有刺激性气味、有毒、易 液化、比空气重、易溶于水 1、与水反应生成酸 SO2 + H2O H2SO3 2、与碱(碱性氧化物)反应生成盐和水
化学 性质
SO2 + 2 NaOH=Na2SO3 + H2O 3、既有氧化性,又有还原性 催化剂 2SO2 + O2 2SO3 4、漂白性:暂时性漂白,可逆 品红 SO2 褪色 红色 无色
2.一定条件下,将等体积的NO和O2混合于 一试管中,然后将试管倒立于盛水的水槽 中,充分反应后,剩余气体的体积约占原 气体总体积的( C ) : A.1/4 B.3/4 C.1/8 D.3/8
[思 考]
现给你一试管二氧化氮,将其倒置于水槽中, 问试管内会有什么变化?
红棕色气体消失,水位上升,最后水充满试管的2/3, 无色气体充满试管的 1/3(上部)
3NO2+H2O==2HNO3+NO
[再思考]
若要使得试管内的水面上升到试管顶部, 应该如何操作?
2NO+O2==2NO2 3NO2+H2O==2HNO3+NO ……
例1:标况下,50mL量筒装满水倒置水槽,先通10mLNO, 在通20mLO2,问最后剩余气体为多少? 解: 4NO+3O2+2H2O=====4HNO3 4mL 10mL 3mL X X=7.5mL
氮氧化合物

氮氧化合物都有那些?
氮的氧化物
No
N2o
No2
N2o4
N2o3
N2o5
,简单说就是nxoy,x和y有很多组合,这些就是氮氧化物。
氮氧化合物分为一氧化氮(no)和二氧化氮(no2)。
一氧化氮无色无味,与血红蛋白的结合能力比一氧化碳还强,吸入这种气体之后,更容易造成人体缺氧。
二氧化氮的毒性比一氧化氮高4~5倍。
当空气中弥漫着大量的这两种气体时,就会无声无息地置人于死地。
清洁大气中存在一定浓度的no等,在大气化学中有重要作用,no
No2和o3会达到平衡
,人为排放的大量挥发性有机物以及nox等会打破这个平衡
,导致o3及其他一些氧化性物质如pan等生成
,即光化学污染
,这是氮氧化物的主要污染机理;氮氧化物也是大气污染的一个重要指标,如大气污染物综合排放标准、锅炉大气污染物排放标准、工业炉窑大气污染物排放标准等等,都把氮氧化物作为一个必测项目。
“洛杉矶型烟雾”就是以大气的氮氧化物和碳氢化物受太阳紫外线作用所产生的一种具有刺激性的浅蓝色烟雾。
而另一种烟雾就是“伦敦烟雾”,主要是二氧化硫引起的。
氮氧化合物是破坏臭氧的原始物质,也是引起烟雾的重要因素。
燃烧生成的烟气中氮氧化合物主要是一氧化氮和二氧化氮。
二氧化氮在日光照射下与氧起光化学反应而形成一种有毒的烟雾,它刺激人的眼、鼻粘膜,从而引起病变,还会引起头痛。
当人们长期处于氮氧化合物含量过高的环境中就可能导致死亡。
氮和氧组成的化合物

氮和氧组成的化合物
氮和氧组成的化合物被称为氮氧化合物,其中氮元素属于无机实体,给这类化
学物质的化学特性带来重要影响。
氮和氧元素的结合方式有多种,包括氧化物、氢氧化物、氮氧化物等几类。
氧化物是氮和氧元素所结合所形成的物质,它们通常是元素氧与另一个元素结
合形成的,如二氧化氮(NO2)、氧氮化合物(NO)、硝酸盐(NH4NO3)等;氢氧
化物是氮和氧元素所有结合形成的化合物,其中一个为氧,另一个元素为氢。
另外,氮氧化合物是氮和氧元素共同结合形成的化合物,氮的氧化价一般为-2,因此它的最稳定的氧化物形式是羰基氧化物,如乙炔、甲烷等。
氮氧化合物在化学反应中具有重要作用,这些化合物拥有众多独特的特性,它
们是重要的原料和添加剂,在日常生活中得到广泛应用,如用于制纸、制药和化学肥料等行业。
许多精细化学品的合成,如水处理剂、精油、气体和燃料也是氮氧化合物的应用领域。
氮态应用技术拥有多种形式,常用的技术包括气体氮化、液体氮化和固体氮化。
气体氮化技术以及液体氮化技术被广泛应用于在化工反应中完成正确的反应。
固体氮化技术具有独特的特性:能够改变特定分子的结构,或使反应生成专门功能分子,以用于合成活性材料。
总之,氮和氧组成的化合物,包括氧化物、氢氧化物和氮氧化合物,在日常生
活中被广泛应用,具有重要的作用,可用于制造特殊材料药物等,并且氮态应用技术拥有多种形式,有助于化学反应的进行。
4.2.1氮氧化合物的产生与转化

自然固氮:闪电时,N2转化为NO
在闪电作用下,游离态的氮气转化为化合态的氮
二﹑氮氧化合物的性质
二﹑氮氧化合物的性质
放电
N2 + O2 ==== 2NO
(无色无味)
(红棕色,刺激性气味)
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
二﹑氮氧化合物的性质
“雷雨发庄稼”
雷雨过程中氮元素发生的变化
N2 闪 H2O O2 电 与 NO2 NO HNO3 O2
矿 物 质
硝酸盐
NO
NO2
HNO3
3 NO2 + H2O = 2 HNO3 + NO
现 象
1、试管内液面上升至2/3 2、所得溶液为无色 3、气体由红棕色变为无色
【归纳整理】二、氮氧化物的性质
NO 物理性质 化 学 性 质
H2O O2
收集方法
NO2
红棕色刺激性 气味有毒气体
3NO2+H2O=2HNO3+NO
无色无味有毒 气体微溶于水
不反应
2NO+O2=2NO2 排水法
不反应 向上排 空气法
三、氮氧化物的危害及防治
P97 1.氮氧化物有什么益处? ⑴少量的NO可以促进血管扩张 ⑵少量的NO可以增强免疫能力等 ⑶制取硝酸等 2.氮氧化物对环境有哪些危害? 3.氮氧化物的来源主要有哪些?人们采取 哪些措施防止和减少NOx对环境的污染。
催化剂
发现一氧化氮 (NO)是人体内 保护机体抵抗 心血管疾病与 其他疾病的信 号分子
1998年诺贝尔奖获得者伊格纳罗
【目标检测】 1. 常温常压下,下列气体不能共存的是 D A.SO2与O2 C.O2与N2 B.NO2与NO D.NO与O2
减少氮氧化合物的措施

减少氮氧化合物的措施
氮氧化合物是造成空气污染的主要因素之一,对于减少氮氧化合物的排放,我们可以采取以下措施:
1. 使用清洁能源:清洁能源如太阳能、风能等可以取代传统能源,减少化石燃料的燃烧,从而降低氮氧化合物的排放。
2. 推广低氮燃料:在交通、工业和家庭等领域推广低氮燃料,如低氮柴油、天然气等,可以有效降低氮氧化合物的排放。
3. 治理工业废气:加强工业废气治理,采用先进的污染治理技术,如脱硝技术、催化转化技术等,可以降低氮氧化合物的排放。
4. 加强农业管理:合理施肥、选用低氮肥、种植转基因作物等措施,可以降低氮肥的使用量,从而减少氮氧化合物的排放。
5. 增加公共交通:加强公共交通建设,鼓励市民乘坐公共交通工具,减少私家车的使用,从而降低氮氧化合物的排放。
以上措施可以降低氮氧化合物的排放,减少空气污染,保护环境和人类健康。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+2
0
+4 -2
2NO O2 2NO2
失4e-
得2e-
+4
+5
+2
3NO2 H2O 2HNO3 NO
失2e-
二﹑氮氧化合物的性质
▪ (2) NO的性质(不成盐氧化物) ▪ 颜色: 无色 ,气味: 无味
(有与毒CO类似),溶解性: O2N2发O生+反O水易 与
▪ (3)要对试题中产生的结果进行可能情况的讨论 如NO2与O2混合气体溶于水时,剩余的气体是 NO,还是O2,要进行讨论。
例1:在标况下,把一个50mL量筒装满水, 倒置于水槽中,先通入10mLNO,然后通 入20mLO2,问最后剩余气体为多少?
解: 4NO+3O2+2H2O=====4HNO3
专题4 第二单元 生产生活中的含氮化合物
氮氧化物的产生及转化
氮元素的重要作用
1.是生命物质的重要组成元素
2.在生产、科研领域有广泛应用
血红蛋白中 含有氮元素
氮是农作物生 长的必需元素
一些含氮化合 物可作为航天
飞机的燃料
一、氮氧化物的产生
1.氮的存在
游离态(大部分):
大气中(78%是N2) 化合态(小部分):
=4:1,恰好完全反应。无气体剩余。 <4:1,O2过量,剩余气体为O2。 >4:1,NO2过量,剩余气体为NO。
3NO2 + H2O = 2HNO3 + NO
▪4.NO、NO2、O2的混合气体
先:3NO2+H2O=2HNO3+NO
求出其生成NO的体积,再加上原混合 气体中的NO的体积即为NO的总体积 (相当NO和O2的混合气体)
3.氮的固定
氮的固定,简称固氮(Nitrogen fixation),是 指将游离态氮(N2)转化为化合态氮的过程。
⑴植物固氮:少数植物直接利用游离态的氮 ⑵自然固氮:雷雨发庄稼 ⑶人工固氮:哈伯人工合成氨
练习
在新疆和青海交界处有一狭长山谷,每当牧民和牲畜进入 后, 风和日丽的晴天顷刻间电闪雷鸣,狂风大作,人畜往往遭 雷击 倒下。奇怪的是这里的牧草茂盛,四季常青,被当地牧民 称为“魔鬼谷”。你能用化学方程式及必要的文字叙述解释“魔 鬼谷”牧草茂盛、四季常青的原因吗?
NO遇空气即变红棕色--检验、鉴定NO气体
▪ (3) NO2的性质 ▪ 颜色:红棕色 ,气味: 刺激性气味, 毒 性 :
有毒,密度: 比空气大,能与水发生反应,化学 方程式为 3NO2+H2O===2HNO3+NO
NO2和溴蒸汽能使湿润KI-淀粉试纸变蓝.
▪ [想一想1]溴蒸气与NO2都是红棕色气体, 你能说出一种简单的鉴别方法吗?
V剩=V(NO)原+13V(NO2)
2.NO和O2的混合气体 NO和O2的混合气体溶于水时涉及反应:
2NO + O2 = 2NO2 ×3 +) 3NO2 + H2O = 2HNO3 + NO ×2
4NO + 3O2 + 2H2O = 4HNO3
V(NO):V(O2)
=4:3,恰好完全反应。无气体剩余。
<4:3,O2过量,剩余气体为O2。 >4:3,NO过量,剩余气体为NO。
3.NO2和O2的混合气体 NO2和O2的混合气体溶于水时涉及反应:
3NO2 + H2O = 2HNO3 + NO ×2
+) 2NO + O2 = 2NO2 4NO2 + O2 + 2H2O = 4HNO3
V(NO2):V(O2)
4mL 3mL
10mL x
X=7.5mL
现有氧气20mL,所以O2过量, 应根据NO的体积计算,剩余氧气有12.5mL.
▪ 【即时巩固1】 向盛有15 mL NO气体、 倒立于水槽的试管中通入O2,充分反应后, 试管中还剩余气体3 mL,则通入的O2体积 可能是( )
▪ ①9 mL ②12.25 mL ③14.25 mL ④
4.氮氧化物的产生
雷雨过程中氮元素发生的变化
N2和O2闪电 NO O2
NO2 H2O
土壤
HNO3
NO3-
相关反应:
放电
N2 + O2
2NO (无色)
2NO + O2 = 2NO2 (红棕色) 3NO2 + H2O = 2HNO3 + NO
“雷雨发庄稼”
练习
请用双线桥表示下列反应的电子转移情况: 得4e-
混合气通过水洗
[思 考]
现给你一试管二氧化氮,将其倒置于水槽中, 问试管内会有什么变化?
红棕色气体消失,水位上升,最后水充满试管的2/3, 无色气体充满试管的 1/3(上部)
3NO2+H2O==2HNO3+NO
1.NO和NO2的混合气体 NO和NO2的混合气体溶于水时仅涉及反应:
3NO2+H2O===2HNO3+NO 可利用气体体积变化的差值进行计算。
KNO3、NaNO3、 蛋白质、核酸等
2.氮气的性质及用途
氮气是无色无味密度比空气稍小,难溶于水的气 体,熔点-209.86℃、沸点-195.8℃低,难液化
结构式为N≡ N,结构稳定,是所有双原子分 子中最稳定的,这决定了其化学性质很不活泼。
用途: ①代替稀有气体作焊接金属的保护气(防止高 温时金属氧化); ②N2或Ar气混和气体充填灯泡,防止钨丝氧化 或挥发; ③保存粮食、水果,低氧高氮,使害虫窒息而 死; ④液氮作深度致冷剂。
后:4NO+3O2+2H2O=4HNO3
▪ 【规律技巧】
▪ (1)注意剩余气体不可能是NO2,也不可能 是NO与O2的混合气体。
▪ (2)计算中可能用到的化学反应 ▪ 3NO2+H2O===2HNO3+NO ▪ 4NO2+O2+2H2O===4HNO3 ▪ 4NO+3O2+2H2O===4HNO3
▪ 提示:溶于水后生成的气体及溶液均无色 的为NO2,溶液呈橙黄色的为溴蒸气。或 通入AgNO3溶液,产生浅黄色沉淀的是溴 蒸气,无沉淀的是NO2。
现学现用
1、如何收集NO和NO2 气体?能否颠倒过来?
NO只能排水法,(若用排空气法收集则)得到NO2 NO2只能上排气法(若用排水法收集则得)到NO 2、如何集除去NO中NO2 ?
15.0 mL
▪ A.①②
B.②③
▪ C.①③
D.③④
▪ 【解析】 此题属于混合气体与水反应的 计算,应分析讨论试管中剩余的3 mL气体 为何物,依据有关反应方程式进行计算。
▪ (1)若剩余气体是NO,则反应的NO为15 mL-3 mL=12 mL。
