无机化学实验报告:Ds区元素(铜、银、锌、镉、汞)
实验三十四ds区:铜银锌镉汞

实验三十四 ds区:铜 银 锌 镉 汞一、实验目的l.了解铜、银、锌、镉、汞的氢氧化物的酸碱性和热稳定性。
2.了解铜、银、锌、镉、汞的配合物的性质和应用。
3.掌握Cu(I),Cu(II)重要化合物的性质和相互转化条件。
4.熟悉Hg22+,Hg2+的转化,并了解锌镉汞离子的鉴定反应。
二、实验原理铜银锌镉汞分别属ds区中IB和ⅡB列。
在水溶液中分别可以Cu2+、Ag+、Zn2+、Cd2+、Hg2+、Hg22+的水合离子存在,也可以它们的某些配离子存在。
Cu(I)在高温或干态时表现稳定,在水溶液中只可以某些配离子形式存在。
1.Cu2+、Ag+、Zn2+、Cd2+、Hg2+与常见试剂NaOH、NH3·H2O、KI的反应参见附录十七。
重点注意以下几个异同点。
(1)由于它们的氢氧化物热稳定性相差甚大,因而与NaOH作用分别得到Cu(OH)2、Ag2O、Zn(OH)2、Cd(OH)2、HgO。
Cu(OH)2在加热时分解生成黑色的CuO。
这些氢氧化物的酸碱性按Cu—Ag—Zn—Cd—Hg的顺序碱性增强。
Zn(OH)2为典型的两性。
Cd(OH)2则主要呈碱性反应,仅缓慢溶于热的浓强碱。
Cu(OH)2也呈两性,但其碱性大于酸性。
(2)与适量氨水反应时,Cu2+生成相应的碱式盐沉淀。
Ag+生成AgO沉淀。
Zn2+、Cd2+生成Zn(OH)2、Cd(OH)2,而Hg2+则生成氨基汞盐的沉淀物。
与过量的NH3·H2O反应大都生成氨配合物。
但HgNH2Cl不溶于过量NH3·H2O,硝酸氨基汞在有大量铵盐存在时可溶于过量NH3·H2O。
HgCl2+2NH3 HgNH2Cl↓+NH4Cl(白色)2Hg(NO3)2+4NH3十H2O HgO·HgNH2NO3↓+3NH4NO3(白色)Hg22+与过量氨水反应时,同时发生歧化反应;生成氨基汞化合物和汞。
2Hg2(NO3)2+4NH3+H2O HgO·HgNH2NO3↓+2 Hg↓+ 3NH4NO3(3)Cu2+与I-反应即生成Cu2I2白色沉淀,此处I-既作还原剂又作沉淀剂。
无机化学实验报告文档

2020无机化学实验报告文档Contract Template无机化学实验报告文档前言语料:温馨提醒,报告一般是指适用于下级向上级机关汇报工作,反映情况,答复上级机关的询问。
按性质的不同,报告可划分为:综合报告和专题报告;按行文的直接目的不同,可将报告划分为:呈报性报告和呈转性报告。
体会指的是接触一件事、一篇文章、或者其他什么东西之后,对你接触的事物产生的一些内心的想法和自己的理解本文内容如下:【下载该文档后使用Word打开】无机化学实验报告1Ds区元素(铜、银、锌、镉、汞)【学习目标】认知目标:掌握铜、银、锌、镉、汞的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。
技能目标:掌握Cu+\Cu2+及Hg22+\Hg2+相互转化条件,正确使用汞;思想目标:培养学生观察现象、思考问题的能力。
【教学安排】一课时安排:3课时二实验要点:1、铜、银、锌、镉、汞氢氧化物或氧化物的生成和性质;2、锌、镉、汞硫化物的生成和性质;3、铜、银、锌、汞的配合物;4、铜、银、汞的氧化还原性。
【重点、难点】Cu+\Cu2+及Hg22+\Hg2+相互转化条件;这些元素的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。
【教学方法】实验指导、演示、启发【实验指导】一、铜、银、锌、镉、汞氢氧化物或氧化物的生成和性质1、铜、锌、镉操作:0.5mL0.2mol·L-1MSO4→2mol·L-1NaOH→↓→2mol·L-1H2SO4;↓→2mol·L-1NaOH指导:离子Cu2+实验现象H2SO4NaOH溶解释及原理Cu2++OH-=Cu(OH)2↓Cu(OH)2+2H+=Cu2++2H2OCu(OH)2++OH-=[Cu(OH)4]2-Zn2++OH-=Zn(OH)2↓方程式同上溶溶浅蓝↓溶Zn2+Cd2+结论白↓白↓溶不溶Cd2++OH-=Cd(OH)2↓Zn(OH)2、Cu(OH)2具有两性,以碱性为主,能溶于浓的强碱中生成四羟基合M(Ⅱ)酸根配离子。
无机化学实验报告:ds区元素(铜银锌镉汞)
浅蓝↓ ↓溶 红↓溶 解,有红 色固体 Cu
↓溶,深 蓝色
Cu2+ +OH-=Cu(OH)2↓ Cu(OH)2+OH-=[Cu(OH)4]22 [Cu(OH)4]2- + C6H12O6= Cu2O↓+ C6H12O7 +4OH-+2H2O
被O2氧化成Cu(Ⅱ)
c)
CuCl
10 mL 0.5 mol·L-1 CuCl2→3mLHCl浓 、Cu屑→ △至绿色消失→几滴+10 mL H2O→如有白↓→ 全部倾入 100mLH2O,洗涤至无蓝色。
离子氨水过量解释及方程式cu无色zn结论cu与氨会生成溶解度很小的氨基硝酸汞或氨基氯化汞所以它们不形成氨基配合物
实验九 Ds 区元素(铜、银、锌、镉、汞)
【学习目标】 认知目标:掌握铜、银、锌、镉、汞的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。 技能目标:掌握Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件,正确使用汞; 思想目标:培养学生观察现象、思考问题的能力。
操作: :0.5 mL 0.2 mol·L-1 CuSO4、AgNO3ol·L-1氨水。
注意:
离子 Cu2+
氨水
过量
↓浅蓝 溶
解释及方程式 Cu2++2OH-=Cu(OH)2↓ Cu(OH)2 + 4NH3=Cu(NH3)42+ +2OH-
操作 0.5 mL 0.2 mol·L-1 Hg(NO3)2 →0.2mol·L-1KI →↓→KI 固体至↓溶解
现象 橙红↓ ↓溶
解释 Hg2++2I-=HgI2↓
无机化学实验报告-D

无机化学实验报告-DS区元素实验11 ds 区元素(铜、银、锌、镉、汞)的性质一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质; 6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu (+2,+1) Zn(+2) Ag Cd Ag (+1) Cd(+2) Au Hg Au (+1,+3) Hg(+2,+1) 蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO 。
AgOH 在常温下极易脱水而转化为棕色的Ag 2O 。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨水反应时分别生成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨水反应时,如果没有大量的NH 4+存在,并不生成氨配离子。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ Hg↓黑+NH 4Cl(观察为灰色)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,而是白色的CuI :Cu2++ I - = 2CuI↓白 + I 2将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2]-的溶液。
将溶液稀释,得白色CuCl 沉淀:Cu + Cu2++ 4Cl - = 2[CuCl 2]-[CuCl 2]-←稀释→CuCl↓白 + Cl -卤化银难溶于水,但可利用形成配合物而使之溶解。
例如:AgCl + 2NH 3 = [Ag(NH 3)2]++ Cl -红色HgI 2难溶于水,但易溶于过量KI 中,形成四碘合汞(II)配离子:HgI 2 + 2I -= [HgI 4]2-黄绿色Hg 2I 2与过量KI 反应时,发生歧化反应,生成[HgI 4]2-和Hg :Hg 2I 2+ 2I - = [HgI 4]2-+ Hg↓黑三、实验内容 1、氧化物的生成和性质(1) C u 2O 的生成和性质Cu 2+ + 2OH - =Cu(OH)2↓ 蓝色 Cu(OH)2 + 2OH - = [Cu(OH)4]-2- 蓝色2[Cu(OH)4]2-+ C 6H 12O 6 (葡萄糖) =Cu 2O↓(红) + 4OH -+C 16H 12O 7+2H 2O或:2Cu 2+ + 5OH - +C 6H 12O 6 = Cu 2O↓+ C 6H 11O 7- + 3H 2O (须加热)分析化学上利用此反应测定醛,医学上利用此反应检查糖尿病。
铜银锌镉汞实验报告

铜银锌镉汞实验报告铜银锌镉汞实验报告引言:本次实验旨在研究铜、银、锌、镉和汞这五种金属元素的性质和反应。
通过实验观察和数据分析,我们将探究它们的物理特性、化学性质以及它们在实际应用中的重要性。
一、实验材料和方法1. 实验材料:- 铜片、银片、锌片、镉片、汞片- 硝酸铜溶液、硝酸银溶液、硝酸锌溶液、硝酸镉溶液、硝酸汞溶液- 氯化钠溶液、硝酸钠溶液、氯化铵溶液、硫酸铵溶液- 高锰酸钾溶液、盐酸、氢氧化钠溶液2. 实验方法:- 实验一:铜、银、锌、镉和汞的物理性质测定- 实验二:铜、银、锌、镉和汞的化学性质研究二、实验结果和分析1. 实验一:铜、银、锌、镉和汞的物理性质测定通过测量铜、银、锌、镉和汞的密度、熔点和沸点,我们得到了以下结果: - 铜的密度为8.96 g/cm³,熔点为1083°C,沸点为2567°C。
- 银的密度为10.49 g/cm³,熔点为961.78°C,沸点为2162°C。
- 锌的密度为7.13 g/cm³,熔点为419.53°C,沸点为907°C。
- 镉的密度为8.65 g/cm³,熔点为321.07°C,沸点为767°C。
- 汞的密度为13.55 g/cm³,熔点为-38.83°C,沸点为356.73°C。
通过对比这些数据,我们可以看出不同金属元素的物理性质存在明显的差异。
例如,铜具有较高的密度和熔点,而汞则具有较低的熔点和沸点。
2. 实验二:铜、银、锌、镉和汞的化学性质研究在实验二中,我们研究了铜、银、锌、镉和汞的化学性质。
以下是我们观察到的一些现象和反应:- 铜和硝酸反应产生铜离子和氮氧化物气体。
- 银和盐酸反应生成银离子和氯化银沉淀。
- 锌和硫酸反应生成锌离子和氢气。
- 镉和氯化铵反应生成镉离子和氯化铵沉淀。
- 汞和氯化钠反应生成汞离子和氯化钠沉淀。
实验二十一 ds区金属(铜、银、锌、镉、汞)

与s区元素相比,离子有较强的极化力,变 形性大,其化合物有一定的共价性。
φ /V
A
CuO+
AgO+ Au3+
1.8 2.1 ~1.41
Cu2+
Ag2+ Au+
0.152 1.98 ~1.68
Cu+
Ag+ Au
0.521 0.799
Cu
Ag
ds ⅡB族 区
Zn
锌
Cd
铬
Hg
汞
价层电子构型 3d104s2
HNO3
NH3∙H2O或 NaOH
浓HNO3: 浓HCl 二、锌、镉、汞硫化物的生成和性质 = 1:3
颜色 CuS Ag2S ZnS CdS HgS
稀HCl 浓HCl 浓HNO3 王水
三、铜、银、锌、汞的配合物 1. 氨合物的生成
2. 汞配合物的生成和应用
(1)不能加入过量的KI固体; ( K2[HgI4]+KOH称为“奈斯勒试剂”,是 用于检验NH4+的方法之一。)
< -0.2 0.789
Cd Hg
2+
易发生: Hg2+ + Hg → Hg22+
实验内容
一、铜、银、锌、镉、汞氢氧化物或氧化 物的生成和性质 1. 铜、锌、镉氢氧化物的生成和性质
Cu(OH)2 Zn(OH)2 Cd(OH)2
颜色
H2SO4 NaOH
2. 银、汞氧化物的生成和性质
AgOH Ag2O 颜色 Hg(OH) HgO 2
思考题
• Cu(I)和Cu(II)稳定存在和转化的条件是 什么? • 在AgNO3中加入NaOH为什么得不到 AgOH? • 用平衡移动原理说明在Hg2(NO3)2溶液中 通入H2S气体会生成什么沉淀?
d区金属(铜、银、锌、镉、汞)P144

实验三 ds 区金属(铜、银、锌、镉、汞)实验目的 了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性。
掌握Cu(I)、Cu(Ⅱ)重要化合物的性质及相互转化条件。
试验并熟悉铜、银、锌、镉、汞的配位能力,以及+22Hg 和Hg 2+的转化。
实验用品仪器:试管(10 mL)、烧杯(250 mL)、离心机、离心试管 固体药品:碘化钾、铜屑 液体药品:HCl (2mol · L -1、浓)、H 2SO 4 (mol · L -1)、HNO 3 (2 mol · L -1、浓)、NaOH (2 mol · L -1、6 mol · L -1、40%)、氨水(2 mol · L -1、浓)、CuSO 4 (0.2 mol · L -1)、ZnSO 4 (0.2 mol · L -1)、CdSO 4 (0.2 mol · L -1)、CuCl 2 (0.5 mol · L -1)、Hg(NO 3)2 (0.2 mol · L -1)、SnCl 2 (0.2 mol · L -1)、AgNO 3 (0.1 mol · L -1)、Na 2S (0.1 mol · L -1)、KI (0.2 mol · L -1)、KSCN (0.1 mol · L -1)、Na 2S 2O 3 (0.5 mol · L -1)、NaCl (0.2 mol · L -1)、金属汞、葡萄糖溶液 (10%) 材料:pH 试纸、玻璃棒实验内容一 铜、银、锌、镉、汞氢氧化物或氧化物的生成和性质 1.铜、锌、镉氢氧化物的生成和性质 向三支试管分别盛有0.5 mL0.2 mol · L -1CuSO 4、ZnSO 4、CdSO 4溶液的试管中滴加新配制的2 mol·L -1NaOH 溶液,观察溶液颜色及状态。
ds区金属铜银锌镉汞

实验 ds 区金属(铜、银、锌、镉、汞)一、实验目的:1、了解铜、银、锌、镉、汞的氧化物或氢氧化物的酸碱性、硫化物的溶解性。
2、掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件。
3、试验并熟悉铜、银、锌、镉、汞的配位能力,以及Hg2 2+ 和Hg 2+ 的转化。
二、实验用品:仪器:试管、烧杯、离心机、离心试管固体药品:碘化钾、铜屑液体药品: HCl(2mol/L、 浓)、 H2SO4(2mol/L)、 HNO3(2mol/L、 浓)、 NaOH(2mol/L、 6mol/L、 40%)、氨水(2mol/L、浓)、CuSO4(0.2mol/L)、ZnSO4(0.2mol/L)、CdSO4(0.2mol/L)、 CuCl2(0.5mol/L) 、 Hg(NO3)2(0.2mol/L) 、 SnCl2(0.2mol/L) 、 AgNO3(0.1mol/L) 、 Na2S(0.1mol/L)、KI(0.2mol/L)、KSCN(0.1mol/L)、Na2S2O3(0.5mol/L)、NaCl(0.2mol/L)、 金属汞、葡萄糖溶液(10%)材料:pH试纸、玻璃棒三、实验内容:(一)铜、银、锌、镉、汞氧化物或氢氧化物的生成和性质1、铜、锌、镉氢氧化物的生成和性质在分别装有 0.5mL0.2mol/L CuSO4、ZnSO4、CdSO4 溶液的三支试管中滴加新配制 的2mol/L NaOH溶液,观察溶液颜色及状态。
将各沉淀分成两份:分别加入2mol/L H2SO4 和2mol/L NaOH,观察现象。
CuSO4 + 2NaOH === Cu(OH)2↓(兰)+ Na2SO4ZnSO4 + 2NaOH === Zn(OH)2↓(白) + Na2SO4CdSO4 + 2NaOH === Cd(OH)2↓(白)+ Na2SO4Cu(OH)2 + H2SO4 === CuSO4 + 2H2OCu(OH)2 + 2NaOH === Na2[Cu(OH)4]Zn(OH)2 + H2SO4 === ZnSO4 + 2H2OZn(OH)2 + 2NaOH === Na2[Zn(OH)4]Cd(OH)2 + H2SO4 === CdSO4 + 2H2OCd(OH)2 酸性特别弱,不易溶于强碱中,只缓慢溶于热、浓的强碱中。
铜银锌镉汞实验报告

铜银锌镉汞实验报告1. 掌握铜、银、锌、镉和汞的一些基本性质;2. 了解铜银锌镉汞的化学反应特点,如氧化性、还原性等;3. 通过实验,观察和比较不同金属的反应性能。
实验仪器和试剂:1. 实验仪器:试管、试管夹、玻璃棒、显微镜;2. 试剂:铜片(Cu)、银片(Ag)、锌片(Zn)、镉片(Cd)、汞片(Hg)、稀硝酸(HNO3)、盐酸(HCl)、硫酸(H2SO4)、氯化钠(NaCl)、二氧化硫(SO2)。
实验步骤:1. 用试管夹夹住铜片,放入试管中加热,观察反应现象;2. 同样的方法加热银片、锌片、镉片和汞片,观察反应现象;3. 将铜片分别与盐酸、硫酸进行反应,观察反应现象;4. 将铜片分别与氯化钠、硝酸进行反应,观察反应现象;5. 将银片、锌片、镉片和汞片分别与盐酸、硫酸、氯化钠、硝酸进行反应,观察反应现象。
实验结果与分析:1. 铜片被加热后,表面出现黑色氧化物。
2. 银片被加热后,表面出现明显的火花和白色氧化物。
3. 锌片被加热后,表面出现明显的火花和白色氧化物。
4. 镉片被加热后,表面出现明显的火花和白色氧化物。
5. 汞片被加热后,没有明显的反应现象。
6. 铜片与盐酸反应,产生气泡和生成蓝绿色溶液。
7. 铜片与硫酸反应,产生气泡和生成蓝色溶液。
8. 铜片与氯化钠反应,没有明显的反应现象。
9. 铜片与硝酸反应,产生气泡和生成蓝绿色溶液。
10. 银片与盐酸反应,产生气泡和生成白色沉淀。
11. 银片与硫酸反应,没有明显的反应现象。
12. 银片与氯化钠反应,产生气泡和生成白色沉淀。
13. 银片与硝酸反应,产生气泡和生成白色沉淀。
14. 锌片与盐酸反应,产生气泡和产生明亮的火花。
15. 锌片与硫酸反应,产生气泡和产生明亮的火花。
16. 锌片与氯化钠反应,没有明显的反应现象。
17. 锌片与硝酸反应,产生气泡和产生明亮的火花。
18. 镉片与盐酸反应,产生气泡。
19. 镉片与硫酸反应,产生气泡。
20. 镉片与氯化钠反应,没有明显的反应现象。
实验:ds 区元素

实验二十:ds区金属(铜、银、锌、镉、汞)〔实验目的〕1.了解铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性;2.掌握Cu(Ⅰ)、Cu(Ⅱ)重要化合物的性质及相互转化条件;3.试验并熟悉铜、银、锌、镉、汞的配位能力,以及Hg22+和Hg2+的转化。
〔实验原理〕铜族元素包括铜、银、金,位于周期表ⅠB族;锌族元素包括锌、镉、汞,位于周期表ⅡB 族。
由于铜、锌族元素价电子层构型为(n-1)d10ns1、(n-1)d10ns2,都属ds区,故一并进行讨论。
一、铜族元素已知铜族元素价电子构型为(n-1)d10ns1,铜族元素原子不仅可以失去ns电子,也可进一步失去部分d电子。
因此铜族元素都有+1、+2、+3三种氧化态。
但由于其稳定性不同,铜常见的氧化态为+2,银为+1,金为+3。
1.铜的化合物①Cu(Ⅰ)的化合物:Cu(Ⅰ)的化合物在固态晨稳定性高于Cu(Ⅱ),但在溶液中容易被氧化为Cu(Ⅱ)。
Cu溶液为无色。
几乎所有的Cu(Ⅰ)化合物都难溶于水,其溶解度顺序为:CuCl>CuBr>CuI>CuSCN>CuCN>Cu2S物质颜色溶解性化学性质Cu2O 红色不溶于水。
弱碱性;对热稳定。
CuOH 黄色或橙色不溶于水。
不稳定,生成后立即分解为Cu2O。
CuX 白色CuCl、CuBr、CuI都不溶于水,溶解度按顺序降低Cu2+ + 2Cl- + Cu = 2CuCl→H[CuCl2] CuCl + CO + HCl → Cu(CO)Cl5H2OCu2S 黑色在盐Cu(Ⅰ)中是最小的3Cu2S+16HNO3(浓)=6Cu(NO3)2+4NO+8H2O+3SCu2S + 4CN- = 2[Cu(CN)2]-+ S2-配合物无色溶于水,由于为d10型离子,因此一般为无色。
[Cu(NH3)2]+ + O2→[Cu(NH3)4]+ [Cu(NH3)2]+ + CO → [Cu(NH3)2(CO)]+②Cu(Ⅱ)的化合物:Cu(Ⅱ)为d9构型,它的化合物或配合物因Cu2+可发生d-d跃迁而呈现颜色。
铜银锌镉汞实验报告

铜银锌镉汞实验报告
实验目的:通过观察和比较铜、银、锌、镉、汞这五种金属在不同条件下的性质和反应,了解它们的化学特性和应用价值。
实验原理:铜、银、锌、镉和汞都是金属元素,其化学性质不同,会在不同的条件下发生不同的化学反应。
本实验针对这五种金属分别进行了以下实验:
1.铜的性质:将几片铜片放入酸性溶液中,观察铜的腐蚀现象。
铜在酸性溶液中会发生氧化反应,生成二氧化硫和水,在反应过程中铜会逐渐腐蚀而消失。
5.汞的性质:将汞液加热至其汽化并生成蒸气,利用紫外线照射汞蒸气,观察汞的光谱现象。
汞蒸气通过紫外线激发,会发生原子发光和激发发光现象,产生不同波长的光谱线。
实验步骤:
1.铜的实验
将几片铜片放入小烧杯中,加入适量的稀酸性溶液,观察铜的腐蚀现象,记录下变化过程。
实验结果:
1.铜的实验:铜在酸性溶液中发生了氧化反应,逐渐腐蚀而消失。
2.银的实验:银在氧化银溶液中发生了还原反应,生成纯银和氧化物。
5.汞的实验:汞蒸气通过紫外线激发,产生多种不同波长的光谱线。
实验分析:
1.铜、锌、镉作为常见的金属元素,其腐蚀性都比较强,能够在酸性环境下发生氧化反应。
而银和汞的化学性质则较为特殊,银在氧化银溶液中通过还原反应得到纯银,汞的蒸汽能够被紫外线激发产生原子发光和激发发光现象。
2.铜、锌、镉和银都是重要的工业金属元素,广泛应用于化学工业、电子工业、医药工业等领域。
铜、银、锌和镉还可以被用于制作家居饰品、珠宝饰品等日用品。
而汞的应用范围较为狭窄,由于其毒性较大,现在已经很少被使用。
实验七ds区金属铜银锌镉汞

四、铜、银、汞的氧化还原性
1.氧化亚铜的生成和性质
mol·L-1CuSO4+6mol·L-1NaOH
至沉淀溶解
溶液+葡萄糖,水浴,加热
沉淀+·L-1H2SO4,加热至沸
沉淀+浓NH3·H2O
浅蓝↓ 深蓝溶液
黄 暗红↓
暗红↓ 黑↓
暗红↓ 无色溶液 蓝色溶液
ZnS+2HCl=ZnCl2+H2S↑
ZnS+2HCl=ZnCl2+H2S↑
3ZnS+6HCl+2HNO3=3ZnCl2+2NO↑+3S↓+4H2O
·L-1CdSO4+1d1mol·L-1Na2S
沉淀+2mol·L-1HCl
沉淀+浓HCl
沉淀+王水
黄↓
沉淀不溶解
沉淀溶解
沉淀溶解
Cd2++S2-=CdS↓
Cd+2HCl浓=CdCl2+H2S↑
3CdS+6HCl+2HNO3=3CdCl2+2NO↑+3S↓+4H2O
·L-1HgNO32+1d1mol·L-1Na2S
沉淀+2mol·L-1HCl
沉淀+浓HCl
沉淀+王水
黑↓
沉淀不溶解
沉淀不溶解
沉淀溶解
Hg2++S2-=HgS↓
HgS+12HCl+2HNO3=3H2HgCl4+ 2NO↑+3S↓+4H2O
mol·L-1AgNO3+2mol·L-1NaOH
无机化学实验第四版实验二十一:ds区金属(铜,银,锌,镉,汞)
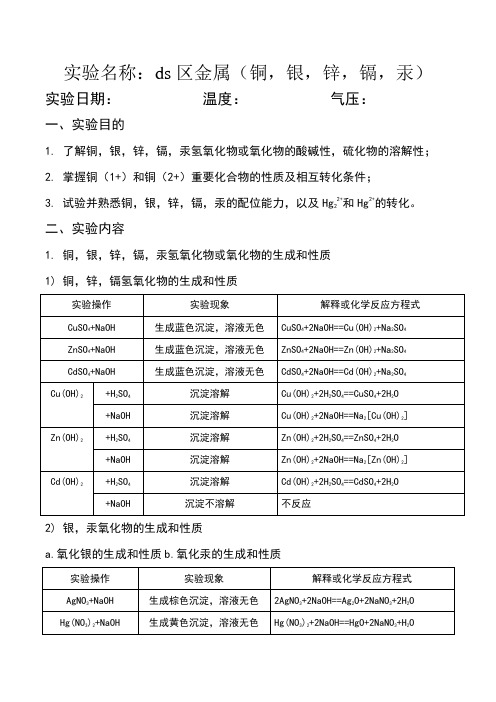
实验名称:ds区金属(铜,银,锌,镉,汞)实验日期:温度:气压:
一、实验目的
1.了解铜,银,锌,镉,汞氢氧化物或氧化物的酸碱性,硫化物的溶解性;
2.掌握铜(1+)和铜(2+)重要化合物的性质及相互转化条件;
3.试验并熟悉铜,银,锌,镉,汞的配位能力,以及Hg22+和Hg2+的转化。
二、实验内容
1.铜,银,锌,镉,汞氢氧化物或氧化物的生成和性质
1)铜,锌,镉氢氧化物的生成和性质
2)银,汞氧化物的生成和性质
a.氧化银的生成和性质
b.氧化汞的生成和性质
2.锌,镉硫化物的生成和性质
根据实验现象并查阅有关数据,填充下表,并对铜,银,锌,镉,汞硫化物的溶解情况作出结论,并写出有关反应方程式。
3.铜,银,锌,汞的配合物1)氨合物的生成
2)汞配合物的生成和性质
4.铜,银,汞的氧化还原性1)氧化亚铜的生成和性质
2)氯化亚铜的生成和性质
3)碘化亚铜的生成和性质
4)汞(2+)和汞(1+)的相互转化
a.Hg2+的氧化性+转化为Hg22+和Hg2+的歧化反解。
实验九 Ds区元素(铜、银、锌、镉、汞

实验目的 1、掌握铜、银、锌、镉、汞的氢氧化物或氧化物的酸碱性, 硫化物的溶解性及配位性。 2、掌握Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件,正确使 用汞。
铜(Cu)
一、铜的基本知识介绍
铜是人类最早使用的金属。早在史前时代,人们就开始采掘露 天铜矿,并用获取的铜制造武器、式具和其他器皿,铜的使用 对早期人类文明的进步影响深远。 铜是一种存在于地壳和海洋中的金属。铜在地壳中的含量约 为0.01%,在个别铜矿床中,铜的含量可以达到3-5%。 自然界中的铜,多数以化合物即铜矿物存在。铜矿物与其他 矿物聚合成铜矿石,开采出来的铜矿石,经过选矿而成为含 铜品位较高的铜精矿。
黄铜
白铜
银(Ag)
一、银的物理性质 银Ag在地壳中的含量很少,仅占1×10-5%,在自然界中有单质 的自然银存在,但主要以化合物状态产出。 纯银为银白色,熔点960.8℃,沸点2210℃,密度10.49克/厘 米3。银是面心立方晶格,塑性良好,延展性仅次于金,但当 其中含有少量砷As、锑Sb、铋Bi时,就变得很脆。
银是导电性和导热性最高的金属;银的反光能力特别强,经抛 光后能反射95%的可见光。
二、银的化学性质
原子序数47,原子量107.8682。 化学稳定性较好,在常温下不氧化。但在所有贵金属中,银的化学性质最 活泼; 约240°C时能与臭氧直接反应; 常温下能与卤素逐渐化合; 银不与除硝酸外的稀酸或强碱反应,但能与浓硫酸反应;硝酸银是重要的 可溶性银盐,其它银盐一般不溶于水。 易溶于热的浓硫酸,微溶于热的稀硫酸;在盐酸和“王水”中表面生成氯 化银薄膜;与硫化物接触时,会生成黑色硫化银。此外,银能与任何比例 的金或铜形成合金,与铜、锌共熔时极易形成合金,与汞接触可生成银汞 齐。
ds区金属

ds区金属:铜 银 锌 镉 汞一、实验目的l.熟悉铜、银、锌、镉、汞氢氧化物的酸碱性质和热稳定性;2.熟悉铜、银、锌、镉、汞配合物的性质和应用;3.掌握Cu(I)、Cu(II)重要化合物的性质和相互转化条件;4.熟悉Hg22+、Hg2+的转化,了解锌、镉、汞离子的鉴定反应。
二、实验原理铜、银、锌、镉、汞,分别属于ds区IB和ⅡB簇,常见水合离子有Cu2+、Ag+、Zn2+、Cd2+、Hg2+、Hg22+。
Cu(I)在高温或干态时表现稳定,在水溶液中只以一些配离子形式存在。
室温下,Cu2+、Ag+、Zn2+、Cd2+、Hg2+与适量NaOH反应,分别形成Cu(OH)2、Ag2O、Zn(OH)2、Cd(OH)2、HgO,Cu(OH)2在加热时分解生成黑色的CuO。
这些(氢)氧化物中,Zn(OH)2为典型的两性;Cu(OH)2也呈两性,但其碱性大于酸性;Cd(OH)2则主要呈碱性反应,仅缓慢溶于热的浓强碱液中;Ag2O与HgO基本上呈碱性。
Cu2+、Ag+、Zn2+、Cd2+与适量氨水反应时,Cu2+生成相应的碱式盐沉淀。
Ag+生成AgO沉淀,Zn2+、Cd2+生成Zn(OH)2、Cd(OH)2,它们与过量的NH3·H2O 反应都生成氨配合物。
与此不同,在氨水作用下,氯化汞生成氯化氨基汞盐沉淀物,硝酸汞则生成硝酸氨基氧汞。
在有大量铵盐存在时硝酸氨基氧汞可溶于过量NH3·H2O形成氨配合物,但HgNH2Cl不溶于过量NH3·H2O。
HgCl2+2NH3 =Hg(NH2)Cl↓(白色)+NH4Cl2Hg(NO3)2+4NH3+ H2O = HgO·Hg(NH2)NO3↓(白色)+3NH4NO3 Hg22+与过量氨水反应时,同时发生歧化反应,生成氨基汞化合物和汞。
2Hg2(NO3)2+4NH3+H2O = HgO·Hg(NH2)NO3↓+2 Hg↓+ 3NH4NO3Cu2+与I-反应即生成CuI白色沉淀。
无机化学实验报告-DS区元素

实验11 ds 区元素(铜、银、锌、镉、汞)的性质一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质; 6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu (+2,+1) Zn(+2) Ag Cd Ag (+1) Cd(+2) Au Hg Au (+1,+3) Hg(+2,+1)蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO 。
AgOH 在常温下极易脱水而转化为棕色的Ag 2O 。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨水反应时分别生成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨水反应时,如果没有大量的NH 4+存在,并不生成氨配离子。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ Hg↓黑+NH 4Cl(观察为灰色)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,而是白色的CuI :Cu2+ +I- =2CuI↓白+I2将CuCl2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl2]-的溶液。
将溶液稀释,得白色CuCl沉淀:Cu +Cu2+ +4Cl-=2[CuCl2]-[CuCl2]-←稀释→CuCl↓白+Cl-卤化银难溶于水,但可利用形成配合物而使之溶解。
例如:AgCl +2NH3 =[Ag(NH3)2]+ +Cl-红色HgI2难溶于水,但易溶于过量KI中,形成四碘合汞(II)配离子:HgI2 +2I- =[HgI4]2-黄绿色Hg2I2与过量KI反应时,发生歧化反应,生成[HgI4]2-和Hg:Hg2I2+2I- =[HgI4]2-+Hg↓黑三、实验内容1、氧化物的生成和性质(1)Cu2O的生成和性质Cu2++2OH-=Cu(OH)2↓ 蓝色Cu(OH)2+2OH- = [Cu(OH)4]-2-蓝色2[Cu(OH)4]2-+C6H12O6(葡萄糖) =Cu2O↓(红) +4OH-+C16H12O7+2H2O或:2Cu2+ + 5OH- +C6H12O6 = Cu2O↓+ C6H11O7- + 3H2O (须加热)分析化学上利用此反应测定醛,医学上利用此反应检查糖尿病。
ds区

观察现象( 土黄色→褐色↓ )
离心洗涤沉淀后:
① + 2.0 mo1· 1 HNO3 L
② + 2.0 mo1· 1氨水 L
观察现象 (无色溶液)
观察现象 (无色溶液)
反应方程式:
2Ag+ + 2OH- = 2Ag(OH)
2Ag(OH) 分解
Ag2O + H2O
Ag2O + 2HNO3 = 2AgNO3 + H2O
继续+6.0 mo1〃L1氨水有何变化?(↓溶解呈无色液+Hg少量)
反应方程式:
Cu2++2NH3•H2O = Cu(OH)2+2NH4+ Cu(OH)2+4NH4+ =Cu(NH3)42- +2OH2Ag+ + 2NH3 + H2O = AgO + 2NH4+ AgO + 4NH3 + H2O = 2[Ag(NH3)2]+ + 2OHZn+ + 2NH3 •H2O = Zn(OH)2 + 2NH4+ Zn(OH)2 + 2NH3 + 2NH4+ =Zn(NH3)42- + 2H2O
观察现象(沉淀略减少)
(注意安全:会溅出,不要试管对着人)
反应方程式: Zn2+ + 2OH- = Zn(OH)2↓ (白色)
Zn(OH)2+2H+ = Zn2+ + 2H2O
Zn(OH)2+2OH- = Zn(OH) 42-
Cd2+ +2OH-=Cd (OH)2
无机化学实验第四版实验二十一:ds区金属(铜,银,锌,镉,汞)知识讲解

实验名称:ds区金属(铜,银,锌,镉,汞)实验日期:温度:气压:
一、实验目的
1.了解铜,银,锌,镉,汞氢氧化物或氧化物的酸碱性,硫化物的溶解性;
2.掌握铜(1+)和铜(2+)重要化合物的性质及相互转化条件;
3.试验并熟悉铜,银,锌,镉,汞的配位能力,以及Hg22+和Hg2+的转化。
二、实验内容
1.铜,银,锌,镉,汞氢氧化物或氧化物的生成和性质
1)铜,锌,镉氢氧化物的生成和性质
2)银,汞氧化物的生成和性质
a.氧化银的生成和性质
b.氧化汞的生成和性质
2.锌,镉硫化物的生成和性质
根据实验现象并查阅有关数据,填充下表,并对铜,银,锌,镉,汞硫化物的溶解情况作出结论,并写出有关反应方程式。
3.铜,银,锌,汞的配合物
1)氨合物的生成
2)汞配合物的生成和性质
4.铜,银,汞的氧化还原性1)氧化亚铜的生成和性质
2)氯化亚铜的生成和性质
3)碘化亚铜的生成和性质
4)汞(2+)和汞(1+)的相互转化
a.Hg2+的氧化性
b.Hg2+转化为Hg22+和Hg2+的歧化反解。
ds区元素

ds区元素(铜、银、锌、镉、汞)的性质【摘要】ds区元素是指元素周期表中的ⅠB、ⅡB两族元素,包括铜、银、金、锌、镉、汞6种自然形成的金属元素和Rg、Uub2种人工合成元素。
ds区的名称是因为它们的电子构型都是d10s1(ⅠB)或d10s2(ⅡB)。
ds区是d区元素的一部分,ds区元素都是过度金属。
但由于它们的d层是满的,所以体现的性质与其他过渡金属有所不同(比如说最高的氧化态只能达到+3)。
【关键字】元素过渡酸碱性;一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质;6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu(+2,+1)Zn(+2)Ag Cd Ag(+1)Cd(+2)Au Hg Au(+1,+3)Hg(+2,+1)蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO。
AgOH在常温下极易脱水而转化为棕色的Ag2O。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨水反应时分别生成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨水反应时,如果没有大量的NH 4+存在,并不生成氨配离子。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ Hg↓黑+NH 4Cl(观察为灰色)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,而是白色的CuI :Cu2++ I -= 2CuI↓白 + I 2将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2]-的溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Hg2++4SCN =Hg (SCN) 42
- -
-
Zn2++Hg (SCN) 42 =Zn[Hg (SCN) 4]↓
) (反应速度相当缓慢,如有Zn2+存在时,Co2+与试剂的反应加快。
四、铜、银、汞的氧化还原性。 内容 操作 现象 解释
0.5 mL 0.2 mol·L-1 CuSO4 →过量 6 mol·L-1 NaOH→ → 1mL 10% 葡 萄糖溶液△→ ↓→ 两份 (黄↓→红↓) 2 mol·L-1 H2SO4 →静置→△ 1mL 浓氨水→静 置
[问题讨论] 1、使用汞应注意什么?为什么要用水封存?
1、 选用什么试剂溶解? 物质 试剂 Cu(OH)2 稀 HCl CuS 热稀HNO3 CuBr2 氨水 AgI Na2S2O3
4、区别:Hg(NO3)2 、Hg2(NO3)2、AgNO3 物质 KI 液 过量氨水 Hg(NO3)2 红色↓ 白色↓ Hg2(NO3)2 灰色↓ 灰黑色↓ AgNO3 黄色↓ 先产生白色↓后溶解
2、Hg2+ 转化为Hg22+ 0.2 mol·L-1 Hg2+ →1 滴金属汞 清夜→0.2 mol·L-1NaCl 清夜→0.2 mol·L-1NH3·H2O
金属汞溶解 白色↓ 灰色↓
Hg2+ + Hg=Hg22+ Hg22+ +2Cl =Hg2Cl2↓白色
-
Hg22++2NH3+NO3-=[ NH2 Hg] NO3↓+2Hg↓+NH4+
Ag+
Ag2O 褐↓
HNO3 溶 溶 无色
氨水 溶 NaOH 不溶
Ag2O+ 4NH3 + H2O =2Ag(NH3)2+ +2OH
-
Hg2+ 结论
HgO 黄↓
HgO + 2H+=Hg2+ +H2O
AgOH、Hg(OH)2沉淀极不稳定,脱水生成成碱性的Ag2O、HgO。
二、锌、镉、汞硫化物的生成和性质; 操作: :0.5 mL 0.2 mol·L-1 ZnSO4、CdSO4、Hg(NO3)2→1 mol·L-1Na2S→ (浓 HCl、王水)。 指导: 离子 溶解性 Zn2+ Cd2+ Hg2+ 结论 结论 溶解性 硫化物 CuS Ag2S ZnS CdS HgS 颜色 黑 黑 白 黄 黑 稀 HCl 不溶 溶 溶 溶 不溶 浓 HCl 不溶 溶 溶 溶 不溶 浓HNO3 溶(△) 溶 溶 溶 不溶 王水 溶 溶 溶 溶 溶 Ksp 1.6×10 2×10 6×10
2+
【重点、难点】
实验指导、演示、启发
实验现象
H2SO4 NaOH 溶
解释及原理 Cu2+ +OH-=Cu(OH)2↓ Cu(OH)2+2H+=Cu2++2H2O Cu(OH)2++OH-=[Cu(OH)4]2-
浅蓝↓
溶
Zn
2+
白↓
Zn2+ +OH-=Zn(OH)2↓方程式同上
溶 溶
Cd2+ 结论
白↓
浅蓝↓ ↓溶 红 ↓ 溶 解,有红 色固体 Cu ↓溶,深 蓝色
Cu2+ +OH-=Cu(OH)2↓ Cu(OH)2+OH-=[Cu(OH)4]22 [Cu(OH)4]2- + C6H12O6= Cu2O↓+ C6H12O7 +4OH-+2H2O
Cu2O
被O2氧化成Cu(Ⅱ)
c) 10 mL 0.5 mol·L-1 CuCl2→3mLHCl浓 、 Cu屑→ △至绿色消失→几滴+10 mL H2O→如有白↓→ 全部倾入 100mLH2O,洗涤至无蓝色。 CuCl 3mL 浓氨水 白↓分两份 3mLHCl浓 [指导]: ↓溶解 ↓溶解 CuCl + 2NH3=Cu(NH3)2+ + Cl
-5
→↓→2 mol·L-1HCl
实验现象 HCl稀 溶 溶 不溶 HCl浓 溶 溶 不溶 王水 溶 溶 溶
-
解释及原理 M2+ + S2 =MS↓ MS + H+ = M2+ + H2S
ZnS 白↓ CdS 黄↓ HgS 黑↓
臭↑(H2S) ,CuS、CdS易溶于酸,最难溶的是HgS,须用王水溶解。
-
银镜反应
3、CuI 的生成和性质 操作 0.5 mL 0.2 mol·L CuSO4 → 0.2 mol·L-1 KI → 棕黄色 →0.5 mol·L-1 Na2S2O3 4、汞(Ⅱ)和汞(Ⅰ)的转化 操作 1、Hg 的氧化性 0.2 mol·L-1 Hg(NO3)2 →0.2 mol·L-1SnCl2
溶
不溶
Cd2+ +OH-=Cd(OH)2↓
Zn(OH)2、Cu(OH)2具有两性,以碱性为主,能溶于浓的强碱中生成四羟基合M(Ⅱ)酸根配离子。 Cd(OH)2碱性比Zn(OH)2强,仅能缓慢溶于热浓强碱。
2、银、汞氧化物的生成和性质 操作: :0.5 mL 0.1 mol·L-1 AgNO3 →2 mol·L-1NaOH→ →↓+ 2 mol·L-1HNO3(2 mol·L-1 NH3·H2O) :0.5 mL 0.2 mol·L-1 Hg(NO3)2 → 2 mol·L-1NaOH→ →↓+ 2 mol·L-1HNO3(40% NaOH) 指导: 离子 实验现象 解释及原理
-
Ag+
2+
Ag2O↓褐
溶Ag(NH3)2+ 溶 Zn(NH3)42+无色 不溶
Ag2O+ 4NH3 + H2O =2Ag(NH3)2+ +2OH Zn2++2OH =Zn(OH)2↓
-
-
Zn 2、汞 合 物 和 应
↓白 ↓白
Zn(OH)2 + 4NH3=Zn(NH3)42+ +2OH
-
Hg
2+
结论 内容 操作
橙红↓ ↓溶
HgI2+2KI=K2[HgI4](无色)
碘 配 合 物
红棕↓
a) b)
K2[HgI4]与KOH混合溶液(奈斯勒试剂)可用于鉴出微量的NH4+。 在 HCl 下可溶解 HgS: 白↓ ↓溶 白↓ Hg2++2SCN =Hg (SCN) 2↓
-
5d 0.2mol·L-1Hg(NO3)2 →0.1mol·L-1 KSCN 白↓→ KSCN → ZnSO4(可用于鉴定Zn2+) SCN 配 合 物 结论
-49 -36 -28
7.1×10 2×10
-52
三、铜、银、锌、汞的配合物 1、氨配和物的生成 操作: :0.5 mL 0.2 mol·L-1 CuSO4、AgNO3、ZnSO4、Hg(NO3)2 →2mol·L-1氨水→2mol·L-1氨水。
离子 注意: Cu2+
氨水 ↓浅蓝 溶
过量
-
解释及方程式 Cu2++2OH =Cu(OH)2↓ Cu(OH)2 + 4NH3=Cu(NH3)42+ +2OH
Cu2+ 、Ag+、Zn2+可生成氨配合物。Hg2+ Hg22+与氨会生成溶解度很小的氨基硝 酸汞(或氨基氯化汞) ,所以它们不形成氨基配合物。 现象
-1 -1
的 配 生 成 用
解释 Hg2++2I =HgI2↓
-
0.5 mL 0.2 mol·L Hg(NO3)2 →0.2mol·L KI →↓→KI 固体至↓溶解 → 40% KOH→ 氨水 (可用于鉴定NH4+) 结论
(由适量→过量)
2+ -1
现象 棕黄色 白色↓
2+
-
解释及方程式 2Cu +4I =2CuI↓+I2 2S2O32 +I2=S4O62 +2 I (碘量法测定Cu2+的基础)
- - -
现象
适量: 白色↓ 过量: 灰黑↓
4+
解释及方程式 Sn 量少 - Hg2+ + Sn2++4Cl = Hg2Cl2↓白色+SnCl62Sn4+量多 Hg2Cl2+Sn2++4Cl = 2Hg↓黑色+ SnCl62-
实验九
【学习目标】
Ds 区元素(铜、银、锌、镉、汞)
认知目标:掌握铜、银、锌、镉、汞的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。 技能目标:掌握Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件,正确使用汞; 思想目标:培养学生观察现象、思考问题的能力。 【教学安排】 一 二 课时安排:3 课时 实验要点:1、铜、银、锌、镉、汞氢氧化物或氧化物的生成和性质; 2、锌、镉、汞硫化物的生成和性质; 3、铜、银、锌、汞的配合物; 4、铜、银、汞的氧化还原性。 Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件; 这些元素的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。 【教学方法】 【实验指导】 一、铜、银、锌、镉、汞氢氧化物或氧化物的生成和性质 1、铜、锌、镉 操作:0.5mL 0.2 mol·L-1MSO4→2 mol·L-1NaOH→↓ →2 mol·L-1H2SO4; ↓→2 mol·L-1 NaOH 指导: 离子 Cu
