2021年高考化学复习学与练试题:第23讲 化学平衡状态 化学平衡的移动(学生版)
高考化学总复习 第七章 23 化学平衡的移动和化学反应进行的方向

应用勒夏特列原理分析问题时应注意
(1)不要把v正增大与化学平衡向正反应方向移动等同,只有v正>v逆 时,才使化学平衡向正反应方向移动。
(2)不要把化学平衡向正反应方向移动与反应物转化率的提高等同, 当反应物总量不变时,化学平衡向正反应方向移动,反应物的转化率提 高;当增大一种反应物的浓度,使化学平衡向正反应方向移动时,会使另 一种反应物的转化率提高,而本身的转化率降低。
改变 □13 ___影__响__平__衡__的__一__个_____条件,平衡就向着 □14 ___减__弱__这__种__改__变_____的
方向移动。
减弱:平衡移动只能减弱条件改变对平衡的影响,不能完全消除这种
改变,更不能扭转这种改变。
微助学 一个实质
化学平衡移动的实质是外界条件影响了化学反应速率,使得v正≠v 逆,平衡将发生移动。
<v(逆)
方向
减慢不 变
v(正)< 逆反应方
不变减慢 v(逆) v(正) 向正反应
>v(逆)
方向
改变条件 反应特征
改变条件瞬间
v(正)
v(逆)
增大压强
m+n=p+ q m+n>p +q m+n
<p+q
加快
减小压强
m+n=p+ q m+n>p +q m+n
<p+q
减慢
加快 减慢
达到新平
衡前v(正) 与v(逆)关
2.外界条件对平衡的影响 对于反应mA(g)+nB(g) pC(g)+qD(g) ΔH
改变条件
增大c(A) 增大c(C)
减小c(A) 减小c(C)
反应特征 可逆反应 可逆反应
改变条件瞬间
v(正)
v(逆)
达到新平
2021年高考化学一轮复习讲练测 专题8.3 化学平衡移动(讲) Word版
第三讲化学平衡移动1、理解影响化学平衡的因素(浓度、温度、压强、催化剂等),生疏其一般规律。
2、理解化学平衡常数的定义并能进行简洁计算。
3、能正确分析化学平衡图像。
一、化学平衡移动1、概念可逆反应达到平衡状态以后,若反应条件(如温度、压强、浓度等)发生了变化,平衡混合物中各组分的浓度也会随之转变,从而在一段时间后达到新的平衡状态。
这种由原平衡状态向新平衡状态的变化过程,叫做化学平衡的移动。
2、过程3、平衡移动方向与反应速率的关系(1)v正> v逆,平衡向正反应方向移动。
(2)v正= v逆,平衡不移动。
(3)v正< v逆,平衡向逆反应方向移动。
4、平衡移动会伴随着哪些变化(1)反应速率的变化(引起平衡移动的本质,但速率变化也可能平衡不移动),主要看v正与v逆是否相等,假如v正≠v逆,则平衡必定要发生移动,如v正、v逆同时转变相同倍数,则平衡不移动。
(2)浓度的变化,平衡移动会使浓度变化,但是浓度的变化不肯定使平衡移动。
(3)各组分百分含量的变化。
(4)平均相对分子质量的变化。
(5)颜色的变化(颜色变化,平衡不肯定发生移动)。
(6)混合气体密度的变化。
(7)转化率的变化。
(8)温度变化5、影响因素若其他条件不变,转变下列条件对化学平衡的影响如下:平衡体系条件变化速率变化平衡变化速率变化曲线任一平衡体系增大反应物的浓度v正、v逆均增大,且v正′>v逆′正向移动减小反应物的浓度v正、v逆均减小,且v逆′>v正′逆向移动任一平衡体系增大生成物的浓度v正、v逆均增大,且v逆′>v正′逆向移动减小生成物的浓度v正、v逆均减小,且v正′>v逆′正向移动正反应方向为气体体积增大的放热反应增大压强或上升温度v正、v逆均增大,且v逆′>v正′逆向移动减小压强或降低温度v正、v逆均减小,且v正′>v逆′正向移动任意平衡或反应前后气体化学计量数和相等的平衡正催化剂或增大压强v正、v逆同等倍数增大平衡不移动负催化剂或减小压强v正、v逆同等倍数减小【典型例题1】【山东滕州一中2022届10月月考】肯定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g) + O2(g) 2SO3(g),达到平衡后转变下述条件,SO3(g)的平衡浓度不转变的是()A保持温度和容器内压强不变,充入1molSO3 B.保持温度和容器体积不变,充入1molSO3C.保持温度和容器内压强不变,充入1molO2 D.保持温度和容器内压强不变,充入1molAr【点评】对于有气体参与的反应,充入反应体系中的气体时肯定看清容器的体积是否转变,容器的体积不变,充入反应体系中的气体,可以增大该物质的浓度,使平衡移动。
2021高三化学人教版:化学平衡状态和平衡移动含答案

教课资料范本2021高三化学人教版:化学均衡状态和均衡挪动含答案编辑: __________________时间: __________________考纲定位重点网络1.认识化学反响的可逆性及化学均衡的成立。
2.掌握化学均衡的特色。
3.理解外界条件 (浓度、温度、压强、催化剂等 )对化学均衡的影响,能用有关理论解说其一般规律。
4.认识化学均衡的调控在生活、生产和科学研究领域中的重要作用。
可逆反响与化学均衡状态1.可逆反响[示例 ] 2 mol SO2和 2 molO2在必定条件下的密闭容器中发生2SO2(g)+ O2(g)2SO3(g),均衡时的 O2物质的量范围为 1_mol<n(O2)<2_mol。
2.化学均衡状态(1)观点必定条件下可逆反响进行到必定程度时,反响物和生成物的浓度不再随时间的延伸而发生变化,正反响速率与逆反响速率相等,这类状态称为化学均衡状态。
(2)成立在必定条件下,把某一可逆反响的反响物加入固定容积的密闭容器中。
反应过程以下:反响错误 !开始时反响错误 !进行时达到错误 !均衡时以上过程可用如图表示:;若开始加入生成物,从逆反响成立均衡,则 v -t图为。
由此,化学均衡状态的成立能够从正反响成立,也能够从逆反响方向成立,也能够从正、逆两反响方向同时成立,即均衡成立与反响门路没关。
(3)特色3.判断化学均衡状态的两种方法(1)动向标记: v正=v逆≠ 0①同种物质:同一物质的生成速率等于耗费速率。
②不一样物质:一定注明是“异向”的反响速率关系。
如aA +bBcC+dD,错误 ! =错误 ! 时,反响达到均衡状态。
(2)静态标记:各样“量”不变①各物质的质量、物质的量或浓度不变。
②各物质的百分含量 (物质的量分数、质量分数等)不变。
③温度、压强 (化学反响方程式两边气体体积不相等)或颜色 (某组分有颜色 )不变。
[ 基础判断 ](1)工业上合成氨的反响,SO2的催化氧化反响, Cl2溶于水的反响,二次电池的反响均为可逆反响。
2021届高考化学一轮复习检测题:第23讲 化学平衡状态 化学平衡的移动

一、选择题1.在1 L定容的密闭容器中,可以证明可逆反应N2+3H22NH3已达到平衡状态的是()A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2B.1个N≡N键断裂的同时,有3个H—H键生成C.其他条件不变时,混合气体的密度不再改变D.v正(N2)=2v逆(NH3)解析:选B。
c(N2)∶c(H2)∶c(NH3)=1∶3∶2不能说明各物质的浓度不变,不一定为平衡状态,A错误;1个N≡N键断裂的同时,有3个H—H键生成,说明正、逆反应速率相,气体质量在反应前后守恒,容器等,反应达到平衡状态,B正确;混合气体的密度ρ=mV体积不变,故密度始终不变,所以密度不变的状态不一定是平衡状态,C错误;v正(N2)=2v逆(NH3)时,正、逆反应速率不相等,未达到平衡状态,D错误。
2.反应X(g)+Y(g)2Z(g)ΔH<0,达到平衡时,下列说法正确的是()A.减小容器体积,平衡向右移动B.加入催化剂,Z的产率增大C.增大c(X),X的转化率增大D.降低温度,Y的转化率增大解析:选D。
该反应前后气体分子数相等,减小容器体积(加压),平衡不发生移动,A 项错误;加入催化剂可同时同倍数地改变正、逆反应速率,故平衡不发生移动,Z的产率不变,B项错误;增大c(X),平衡正向移动,但X的转化率减小,C项错误;此反应是放热反应,降低温度,平衡正向移动,Y的转化率增大,D项正确。
3.下列事实不能用化学平衡移动原理解释的是()A.在强碱存在的条件下,酯的水解反应进行较完全B.加催化剂,使N2和H2在一定条件下转化为NH3C.可用浓氨水和NaOH固体快速制取氨D.加压条件下有利于SO2与O2反应生成SO3解析:选B。
应注意区别化学平衡移动原理和化学反应速率理论的应用范围,加催化剂只能提高化学反应速率,故B项不能用化学平衡移动原理解释。
4.可逆反应:2NO2(g)2NO(g)+O2(g)在容积固定的密闭容器中达到平衡状态的标志是()①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部解析:选A。
高考化学一轮复习(二)化学平衡状态 化学平衡的移动试题

回夺市安然阳光实验学校化学平衡状态化学平衡的移动1.下列关于化学平衡的说法中正确的是( )A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度B.当一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等都等于0C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变D.化学平衡不可以通过改变条件而改变2.(2015·福州模拟)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。
判断该分解反应已经达到化学平衡的是( )A.2v(NH3)=v(CO2)B.密闭容器中c(NH3)∶c(CO2)=2∶1C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变3.将NO2装入带有活塞的密闭容器中,当反应2NO2(g)N2O4(g)达到平衡后,改变某个条件,下列叙述正确的是( )A.升高温度,气体颜色加深,则此反应为吸热反应B.慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍D.恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅4.在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:2A(g)+B(g)2C(g) ΔH>0。
达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )x yA 通入A气体B的转化率B 加入催化剂A的体积分数C 增大压强混合气体的总物质的量D 升高温度混合气体的总物质的量5.(2015·芜湖质检)在一体积可变的密闭容器中,加入一定量的X、Y,发生反应m X(g)n Y(g) ΔH=Q kJ/mol。
反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:气体体积/Lc(Y)/(mol/L)温度/℃1 2 4100 1.00 0.75 0.53200 1.20 0.90 0.63300 1.30 1.00 0.70A .m >nB .Q <0C .温度不变,压强增大,Y 的质量分数减少D .体积不变,温度升高,平衡向逆反应方向移动 6.密闭容器中一定的混合气体发生反应:x A(g)+y B(g)z C(g),平衡时,测得A 的浓度为0.50 mol/L ,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A 的浓度为0.30 mol/L ,有关叙述不正确的是( )A .平衡向逆反应方向移动B .B 的转化率降低C .x +y >zD .C 的体积分数升高7.在相同温度下,将H 2和N 2两种气体按不同比例通入相同的恒容密闭容器中,发生反应:3H 2+N 22NH 3。
高中化学必修课---化学平衡的移动知识讲解及巩固练习题(含答案解析)

高中化学必修课---化学平衡的移动知识讲解及巩固练习题(含答案解析)【学习目标】1、通过实验探究温度、浓度和压强对化学平衡的影响;2、能利用相关理论解释外界条件对平衡移动的影响。
【要点梳理】要点一、化学平衡移动【高清课堂:反应之事合久必分分久必合-化学平衡移动】1.定义。
化学平衡研究的对象是可逆反应,化学平衡是有条件的动态平衡,在一定条件下才能保持平衡状态,当影响化学平衡的条件(浓度、压强、温度)改变时,原平衡就会被破坏,反应混合物里各组分的含量会随之改变,引起v正≠v逆,然后在新条件下重新建立平衡。
这种可逆反应中旧化学平衡的破坏、新化学平衡的建立过程叫做化学平衡的移动。
2.原因。
化学平衡移动的原因是反应条件的改变,移动的结果是正、逆反应速率发生变化,平衡混合物中各组分的含量发生相应的变化。
3.标志。
(1)从反应速率来看:如有v正=v逆,到v正≠v逆,再到v正'=v逆',有这样的过程表明化学平衡发生了移动。
(2)从混合物组成来看:各组分的含量从保持一定到条件改变时含量发生变化,最后在新条件下各组分的含量保持新的一定,同样表明化学平衡发生了移动。
4.方向。
平衡移动的方向由v(正)、v(逆)的相对大小来决定:(1)若外界条件的改变引起v(正)>v(逆),则化学平衡将向正反应方向(或向右)移动。
(2)若外界条件的改变引起v(正)<v(逆),则化学平衡将向逆反应方向(或向左)移动。
(3)若外界条件的改变虽引起v(正)和v(逆)的变化,但v(正)和v(逆)仍保持相等,则称化学平衡不发生移动(或没有被破坏)。
要点诠释:平衡移动过程可表示为:一定条件下的化学平衡平衡被破坏新条件下的新化学平衡v(正)=v(逆)v(正)≠v(逆)v'(正)=v'(逆)各组分的含量保持不变→各组分的含量不断变化→各组分的含量又保持不变要点二、外界条件对化学平衡的影响【高清课堂:反应之事合久必分分久必合-化学平衡移动】1.浓度对化学平衡的影响。
化学平衡状态 化学平衡的移动(讲)-2023年高考化学一轮复习讲练测(全国通用)(解析版)

第21讲化学平衡状态化学平衡的移动目录第一部分:网络构建(总览全局)第二部分:知识点精准记忆第三部分:典型例题剖析高频考点1、考查可逆反应的特点高频考点2、考查化学平衡状态的判断高频考点3、考查化学平衡的移动方向的判断高频考点4、考查等效平衡的应用高频考点5、考查勒夏特列原理的应用高频考点6、考查化学平衡图像分析高频考点7、考查化学平衡原理在工农业生产中的应用正文第一部分:网络构建(总览全局)第二部分:知识点精准记忆知识点一可逆反应与化学平衡状态1.可逆反应(1)概念:在同一条件下,既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。
(2)特点:三同一小①相同条件下;②同时进行;③反应物与生成物同时存在;④任一组分的转化率都小于100%。
(3)表示:在方程式中用“”表示。
2.化学平衡状态(1)概念:在一定条件下的可逆反应中,当反应进行到一定程度时,正反应速率和逆反应速率相等,反应物的浓度和生成物的浓度保持不变的状态。
(2)建立:对于只加入反应物从正向建立的平衡:以上过程可以用速率-时间图像表示如下(3)化学平衡的特点3.化学平衡状态的判断 化学反应 m A(g)+n B(g)p C(g)+q D(g)是否平衡 混合物体系中各成分的含量①各物质的物质的量或物质的量分数一定 平衡 ②各物质的质量或质量分数一定 平衡 ③各气体的体积或体积分数一定 平衡 ④总体积、总压强、总物质的量一定不一定平衡 正、逆反 应速率之 间的关系①单位时间内消耗了m mol A ,同时也生成了m mol A平衡 ②单位时间内消耗了n mol B ,同时也消耗了p mol C 平衡 ③v (A)∶v (B)∶v (C)∶v (D)=m ∶n ∶p ∶q不一定平衡 ④单位时间内生成了n mol B ,同时也消耗了q mol D不一定平衡 压强①其他条件一定、总压强一定,且m +n ≠p +q 平衡 ②其他条件一定、总压强一定,且m +n =p +q 不一定平衡 混合气体的平均相对分子质量 ①平均相对分子质量一定,且m +n ≠p +q平衡②平均相对分子质量一定,且m +n =p +q 不一定平衡温度任何化学反应都伴随着能量变化,当体系温度一定时 平衡 气体密度(ρ) ①只有气体参加的反应,密度保持不变(恒容密闭容器中)不一定平衡 ②m +n ≠p +q 时,密度保持不变(恒压容器中) 平衡 ③m +n =p +q 时,密度保持不变(恒压容器中)不一定平衡 颜色 反应体系内有色物质的颜色稳定不变(其他条件不变)平衡【归纳总结】(1)动态标志:v 正=v 逆≠0①同种物质:同一物质的生成速率等于消耗速率。
高考化学三轮复习专题集训化学平衡的移动
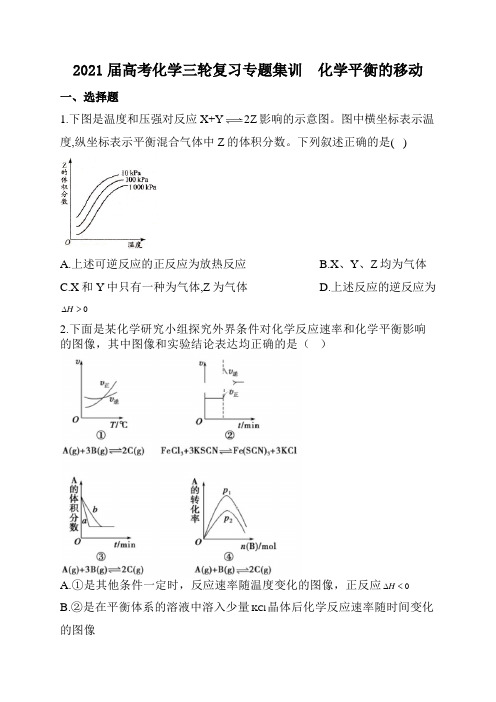
2021届高考化学三轮复习专题集训化学平衡的移动一、选择题1.下图是温度和压强对反应X+Y2Z影响的示意图。
图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
下列叙述正确的是( )A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气体C.X和Y中只有一种为气体,Z为气体D.上述反应的逆反应为∆>H2.下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是()A.①是其他条件一定时,反应速率随温度变化的图像,正反应0H∆<B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像C.③是在有无催化剂存在下建立的平衡过程图像,a 是使用催化剂时的曲线D.④是一定条件下,向含有一定量A 的容器中逐渐加入B 时的图像,压强12P P >3.臭氧是理想的烟气脱硝剂,其脱硝反应为: ()()232NO g O g +()()252N O g O g +,反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )A.升高温度,平衡常数减小B.0~3s 内,反应速率为: ()120.2v NO mol L -=⋅C.1t 时仅加入催化剂,平衡正向移动D.达平衡时,仅改变x,则x为()c O24.已知反应2H 2(g)+CO(g)CH3OH(g)的平衡常数如下表,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列大小比较正确的是( )温度/℃500 700 800平衡常数K 2.50 0.34 0.15A.平衡常数:K(a)>K(c),K(b)=K(d)B.正反应速率:v(a)>v(c),v(b)=v(d)C.达到平衡所需时间:t(a)=t(c),t(b)>t(d)D.平均相对分子质量:()(),()()=>M a M c M b M d: 物质X Y Z初始浓度/1⋅0.1 0.2 0mol L-平衡浓度/1⋅0.05 0.05 0.1mol L-A.反应达到平衡时,X的转化率为50%B.反应可表示为3+2Z,其平衡常数为1600X YC.增大压强可使平衡向生成Z 的方向移动,平衡常数增大D.改变温度可以改变此反应的平衡常数6.在25℃时,密闭容器中X 、Y 、Z 三种气体的初始浓度和平衡浓度如下表: 物质XY Z 初始浓度/(mol·L -1) 0.10.2平衡浓度/(mol·L -1) 0.05 0.05 0.1 A.反应达到平衡时,X 的转化率为50% B.反应可表示为X+3Y2Z,其平衡常数为1600C.增大压强使平衡向生成Z 的方向移动,平衡常数增大D.改变温度可以改变此反应的平衡常数7.下列说法正确的是( )A. 0H ∆<、0S ∆>的反应在温度低时不能自发进行B. ()43NH HCO s ()()()322 NH g H O g CO g ++,1185.57?H kJ mol -∆=+⋅能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向C.焓变和熵变都与反应的自发性有关,因此焓变或熵变均可单独作为反应自发性的判据D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向8.下列说法正确的是( )A.凡是放热反应都是自发的,凡是吸热反应都是非自发的B.自发反应一定是熵增大,非自发反应一定熵减小或不变C.自发反应在恰当条件下才能实现D.自发反应在任何条件下都能实现 9.下列判断错误的是( )①反应NH 3(g)+HCl(g)=NH 4Cl(s)在室温下可自发进行,则该反应的ΔH>0 ②CaCO 3(s)=CaO(s)+CO 2(g)室温下不能自发进行,说明该反应的ΔH<0 ③一定温度下,反应MgCl 2(l)=Mg(l)+Cl 2(g)的ΔH>0、ΔS>0④常温下,反应C(s)+CO 2(g)=2CO(g)不能自发进行,则该反应的ΔH>0 A.①③ B.②③ C.②④ D.①②10.反应X(g) + Y(g) 2Z(g)0H ∆<,达到平衡时,下列说法正确的是( )A.减小容器体积,平衡向右移动B.加入催化剂,Z 的产率增大C.增大c(X),X 的转化率增大D.降低温度,Y 的转化率增大11.下图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )A.正反应是吸热反应B.若A 、B 是气体,则D 是液体或固体C.逆反应是放热反应D.A 、B 、C 、D 均为气体 二、非选择题12、合成氨技术的创立开辟了人工固氮的重要途径,其重要原理为N 2+3H22NH 3,反应的平衡常数值和温度的关系如下: 温度/℃ 360 440 520K 值 0.036 0.010 0.0038(1).①由表中数据可知正反应为 _____(填“放热”或“吸热”)反应。
2021届高考化学总复习 第3单元《化学平衡的移动》综合训练(学生版)

第3单元《化学平衡的移动》综合训练1. 对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物的浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了适宜的催化剂A.②⑤B.①②C.③⑤D.④⑥2.已知:可逆反应2SO2(g)+O2(g)2SO3(g) ΔH<0,在一定条件下达到平衡后,改变下列条件一定能使该平衡向正反应方向移动的是( )A.升温增压 B.降温增压 C.升温减压D.降温减压3.反应2A(g)2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是 ( )A.加压 B.降温 C.减少E的浓度D.加催化剂4.下列反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是 ( ) A.SO2(g)+NO2(g)SO3(g)+NO(g) ΔH<0B.C(s)+CO2(g)2CO(g) ΔH>0C.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0D.H2S(g)H2(g)+S(s) ΔH>05.在一密闭容器中,反应a A(g)b B(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则 ( )A.平衡向正反应方向移动了 B.物质A的转化率减小了C.物质B的质量分数减小了 D.a>b6.反应C(s)+CO2(g)2CO(g) ΔH=+172.5 kJ·mol-1,描述平衡体系的物理量y随温度或压强(用x表示)的变化关系如图所示。
下列判断正确的是( )A.x表示压强,y表示平衡混合物中CO 2的转化率B.x表示压强,y表示混合气体的平均相对分子质量C.x表示温度,y表示平衡混合物中CO2的转化率D.x表示温度,y表示平衡混合物中CO的体积分数7.[2020-2020学年浙南名校联盟高二上期末]某恒温恒容密闭容器中存在反应:X(g)+2Y(g)Z(g) ΔH=-a kJ∙mol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。
2021届高考化学备考一轮热点强化:化学平衡状态和平衡移动【解析版】

化学平衡状态和平衡移动1.下列说法正确的是( )A .H 2(g)+I 2(g)⇌2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变B .C(s)+H 2O(g)⇌H 2(g)+CO(g),碳的质量不再改变说明反应已达平衡C .若压强不再随时间变化能说明反应2A(?)+B(g)⇋2C(?)已达平衡,则A 、C 不能同时是气体D .1 mol N 2和3 mol H 2反应达到平衡时H 2转化率为10%,放出的热量为Q 1;在相同温度和压强下,当2 mol NH 3分解为N 2和H 2的转化率为10%时,吸收的热量为Q 2,Q 2不等于Q 1 答案 B解析 A 项,该可逆反应的反应前后气体的化学计量数不发生变化,当缩小反应容器体积,相当于加压,正逆反应速率同等程度增加,错误;B 项,在建立平衡前,碳的质量不断改变,达到平衡时,质量不变,因而碳的质量不再改变说明反应已达平衡,正确;C 项,若压强不再改变说明反应达到平衡,表明反应前后气体的化学计量数不等,故A 、C 可能均为气体,错误;D 项,易知N 2(g)+3H 2(g)⇋2NH 3(g) ΔH ,合成氨气实际参与反应n (H 2)=3 mol ×10%=0.3 mol ,因而Q 1=0.33×|ΔH |=0.1|ΔH |,分解氨气时实际消耗的n (NH 3)=2 mol ×10%=0.2 mol ,Q 2=0.22×|ΔH |=0.1|ΔH |,则Q 1=Q 2,错误。
2.(双选)将一定量的X 加入某密闭容器中,发生反应:2X(g)3Y(g)+Z(g),混合气体中X 的物质的量分数与温度关系如图所示:下列说法正确的是 ( )A.该反应的ΔH>0B.压强大小有p3>p2>p1C.平衡后加入高效催化剂使平均摩尔质量增大D.在该条件下M点X平衡转化率为【解析】选A、D。
根据图象知,升高温度,X的物质的量分数减小,说明反应向正方向移动,正反应是吸热反应,A正确;该反应减小压强,X转化率增大,压强大小关系有:p3<p2<p1,B错误;催化剂不会使平衡发生移动,气体相对分子质量M r不变,C错误;M点对应的平衡体系中,X的物质的量分数为0.1,则:2X(g)3Y(g)+Z(g)n(起始/mol): 1 0 0n(转化/mol):2x 3x xn(平衡/mol):1-2x3x x=0.1,x=,X转化率为==,D正确。
2021鲁科版高考化学一轮复习训练课时分层训练(二十三)化学平衡状态和平衡移动(含解析)

课时分层训练(二十三) 化学平衡状态和平衡移动(建议用时:45分钟)A级基础达标1.可逆反应N2(g)+3H2(g)2NH3(g),在容积为10 L的密闭容器中进行,开始时加入2 mol N2和3 mol H2,达平衡时,NH3的浓度不可能达到( )A.0.1 mol·L-1B.0.2 mol·L-1C.0.05 mol·L-1D.0.15 mol·L-1B[2 mol N2和3 mol H2反应,假设反应能够进行到底,则3 mol H2完全反应,生成2 mol NH3,此时NH3的浓度为0.2 mol·L-1,但由于是可逆反应,不能完全反应,所以NH3的浓度达不到0.2 mol·L-1。
]2.对于反应2SO2(g)+O2(g)2SO3(g),一定条件下达到平衡时,下列关于平衡状态的说法不正确的是( )A.v正(SO2)=2v逆(O2)B.n(SO2)∶n(O2)=2∶1C.c(SO2)的浓度不再变化D.恒温恒容下的体系压强不变B[平衡时,各组分的量保持恒定,但不一定为某一比值。
]3.对于反应:N2O4(g)2NO2(g) ΔH>0,现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )D[从开始至平衡,由于容器容积增大,密度减小,达平衡后密度不变,A错;反应过程中,反应热不会变化,不是变量无法判断是否达到平衡状态,与图像不符,B错;N2O4的正反应速率逐渐减小,最后保持不变,NO2的反应速率应从零开始,逐渐增大,最后保持不变,C错;转化率一定时达到平衡,D对。
]4.一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )①混合气体的密度不再变化时②容器内气体的压强不再变化时③混合气体的总物质的量不再变化时④B的物质的量浓度不再变化时⑤混合气体的平均相对分子质量不再改变的状态⑥当v正(B)=2v逆(C)A.①④⑤⑥ B.②③⑥C.②④⑤⑥ D.只有④A[A为固态,反应正向进行时气体质量增大,逆向进行时气体质量减小,所以,密度不变时平衡,①正确;该反应前后气体体积不变,所以压强不变时不一定平衡,②错误;该反应前后气体物质的量相等,所以混合气体的总物质的量不变不一定平衡,③错误;B的浓度不变,说明反应达到平衡,④正确;混合气体的平均相对分子质量不再改变的状态,说明气体的质量不变,正、逆反应速率相等,反应达到平衡,⑤正确;v正(B)=2v逆(C)时,说明正、逆反应速率相等,反应达到平衡,⑥正确。
2021届高考化学一轮复习精品学案:第23讲 化学平衡状态 化学平衡的移动

2021届高考化学一轮复习精品学案
第23讲化学平衡状态化学平衡的移动
考点一可逆反应化学平衡状态
[知识梳理]
一、可逆反应
二、化学平衡状态
1.概念:一定条件下的可逆反应,当反应进行到一定程度时,正反应速率和逆反应速率相等,反应体系中所有参加反应的物质的质量或浓度保持不变的状态,称为化学平衡状态,简称化学平衡。
2.建立
在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。
反应过程如下:
建立过程可用下图表示:。
2021年高考化学考点模拟训练卷:化学平衡状态 化学平衡的移动

化学平衡状态化学平衡的挪动1.COCl2(g) CO(g)+Cl2(g)ΔH>0,当反响到达平衡时,以下措施:①升温②恒容通惰性气体③增加CO浓度④减压⑤加催化剂⑥恒压通入惰性气体,能进步COCl2转化率的是()A.①②④B.①④⑥C.②③⑤D.③⑤⑥答案B2.:可逆反响2SO2(g)+O2(g) 2SO3(g)ΔH<0,在一定条件下到达平衡后,改变以下条件均可以使平衡向正反响方向挪动的是()A.升温增压B.降温增压C.升温减压D.降温减压答案B3.在1 L定容的密闭容器中,可以证明可逆反响N2(g)+3H2(g) 2NH3(g)已到达平衡状态的是() A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2B.一个N≡N键断裂的同时,有3个H—H键生成C.其他条件不变时,混合气体的密度不再改变D.2v正(N2)=3v逆(NH3)答案B4.一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:以下说法正确的选项是(A.反响可表示为2X+3Y2Z,其平衡常数为8 000B.增大压强使平衡向生成Z的方向挪动,平衡常数增大C.假设将容器的体积压缩至1 L,那么X的体积分数减小,浓度增大D.假设升高温度时,Z的浓度增大,那么温度升高时正反响速率增大,逆反响速率减小,平衡朝正反响方向挪动答案C5.据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反响的化学方程式为2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)。
以下表达正确的选项是()A.当v(CO2)=2v(CH3CH2OH)时,反响一定到达平衡状态B.当平衡向正反响方向挪动时,平衡常数一定增大C.增大压强,可进步CO2和H2的转化率D.一样条件下,2 mol氢原子所具有的能量等于1 mol氢分子所具有的能量答案C6.Cr的相对原子质量为52,复原沉淀法是处理含铬(含Cr2O2-7和CrO2-4)工业废水的常用方法,过程如下:转化过程中反响为2CrO2-4(aq)+2H+(aq) Cr2O2-7(aq)+H2O(l)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
『高考复习|学与练』『汇总归纳·备战高考』
2021年高考化学一轮复习学与练
第23练 化学平衡状态 化学平衡的移动
一、选择题(每题只有一个正确答案)
1.反应N
2(g)+3H 2(g)2NH 3(g) ΔH <0,若在恒压绝热容器中发生,下列选项表明
反应一定已达平衡状态的是(
)A .容器内的温度不再变化
B .容器内的压强不再变化
C .相同时间内,断开H -H 键的数目和生成N -H 键的数目相等
D .容器内气体的浓度c(N 2)∶c(H 2)∶c(NH 3)=1∶3∶2
2.下列说法正确的是
A .H(g)+I 2(g) ⇌ 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B .C(s)+H 2O(g) ⇌ H 2(g)+CO(g),碳的质量不再改变说明反应已达平衡
C .若压强不再随时间变化能说明反应2A(?)+B(g) ⇌ 2C(?)已达平衡,则A 、C 不能同时是气体
D .1 mol N 2和3 mol H 2反应达到平衡时H 2转化率为10%,放出的热量为Q 1;在相同温度和压强下,当2 mol NH 3分解为N 2和H 2的转化率为10%时,吸收的热量为Q 2,Q 2不等于Q 1
3.如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。
当其他条件相同时,在Ⅰ、Ⅱ中分别加入和,开始时容器的体积均为,发生如下反应2mol X 2mol Y V L 并达到平衡状态:。
此时Ⅰ中X 、Y 、Z 的物质的量之比为2X(?)+Y(?)aZ(g) 1∶3∶2。
下列判断正确的是( )
A .a=2
B .若Ⅱ中气体的密度随时间的变化关系如图Ⅲ所示,则X 、Y 中只有一种为气体
C .若X 、Y 均为气体,则在平衡时X 的转化率:Ⅰ<Ⅱ
D .若X 为固体、Y 为气体,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
4.对于可逆反应,在一定条件下达到平衡状态,2A(s)+3B(g)C(g)+2D(g) Δ<0H 下列有关叙述正确的是( )
①增大物质A 的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,减小
v 正③压强增大一倍,平衡不移动,、不变
v 正v 逆④增大物质B 的浓度,>v v 正逆
⑤加入催化剂,物质B 的转化率提高
A .①②⑤
B .④
C .②③④
D .④⑤
5.在1 L 密闭容器中通入2 mol NH 3,在一定温度下发生反应:2NH 3
N 2+3H 2,达到平衡状态时,N 2的物质的量分数为a %,维持容器的容积和温度不变,分别通入下列几组物质,达到平衡状态时,容器内N 2的物质的量分数仍为a %的是
A .3 mol H 2和1 mol NH 3
B .2 mol N 2和3 mol H 2
C .1 mol N 2和3 mol NH 3
D .0.1 mol NH 3、0.95 mol N 2、2.85 mol H 2
6.将和置于密闭容器中,在一定温度下发生反应:21mol I (g)22mol H (g)2L 。
后达到平衡状态,HI 的体积分数随时22I (g)+H (g)2HI(g) ΔH<0 10min φ(HI)间变化的关系如图中曲线Ⅱ所示。
若改变反应条件,的变化如图中曲线Ⅰ所示,φ(HI)则该条件可能是( )
A .恒容条件下升高温度
B .恒温恒容条件下加入合适的催化剂
C .恒温条件下扩大容器的容积
D .增大的浓度
2H 7.有甲、乙两个等容积的容器,甲为恒容容器,乙为体积可变的恒压容器,如图所示,开始时均充入和,达到平衡后再向两容器中各充入。
下22mol SO 2
1mol O 21mol N 列有关说法正确的是( )
A .充入前,甲、乙中含量相等
2N 2SO
B .充入后,甲中平衡正向移动,乙中平衡逆向移动
2N C .充入后,甲中含量不变,乙中含量减小
2N 3SO 3SO D .充入
后,甲、乙两容器中平衡不移动2N 8.对于任何一个气体反应体系,采取以下措施一定会使平衡移动的是
A .加入反应物
B .升高温度
C .对平衡体系加压
D .使用催化剂9.在密闭容器中发生下列反应a A(g) c C(g)+d D(g),压缩容积到原来的一半,当再次达到平衡时,D 的浓度为原平衡的1.8倍,下列叙述正确的是( )
A .A 的转化率变大
B .平衡向正反应方向移动
C .A 的体积分数变大
D .a >c +d
10.已知可逆反应2NO 2(g )⇌N 2O 4(g ),下列状态合理且可以判断该反应已经达到平衡的是
①ν(正)=ν(逆)≠0的状态 ②NO 2全部转化成N 2O 4的状态 ③c(NO 2)=c(N 2O 4)的状态 ④N 2O 4不再分解的状态 ⑤NO 2的百分含量不再改变的状态 ⑥体系颜色不再发生变化的状态
A .①④⑥
B .①⑤⑥
C .①③⑥
D .②⑤⑥
11.右图是恒温下某化学反应的反应速率随反应时间变化的示意图。
下列叙述与示意图不相符合的是( )
A .反应达平衡时,正反应速率和逆反应速率相等。
