高中化学必修二 思维导图----化学键
2019年人教版化学必修二:第2章-思维导图【1】(含答案)

化学·必修2(人教版)1.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。
然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。
由此可见()A.NH4HCO3和盐酸的反应是放热反应B.该反应中,热能转化为产物内部的能量C.反应物的总能量高于生成物的总能量D.反应离子方程式为:NH4HCO3+HCl―→NH4Cl+CO2↑+H2O答案:B2.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。
已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。
则反应S(s)+3F2(g)===SF6(g)的能量变化为()A.放出1 780 kJ的能量B.放出1 220 kJ的能量C.放出450 kJ的能量 D.吸收430 kJ的能量答案:B3.已知H2(g)+Br2(l)===2HBr(g)ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:H2/g Br2/g HBr/g1 mol分子中的化学键断裂时需要吸收436 a 369的能量/kJ则表中a为()A.404B.260C.230D.200答案:D4.(双选题)已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):H2(g)+Cl2(g)―→2HCl(g)+Q1,H2(g)+Br2(g)―→2HBr(g)+Q2。
有关上述反应的叙述正确的是()A.Q1>Q2B.生成物总能量均高于反应物总能量C.生成1 mol HCl气体时放出Q1热量D.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量答案:AD5。
已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571。
6 kJ·mol-1(表示2 mol H2燃烧放出571.6 kJ的热量),CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890 kJ·mol-1(表示1 mol CH4燃烧放出890 kJ的热量)。
高中化学必修2思维导图(Word版)
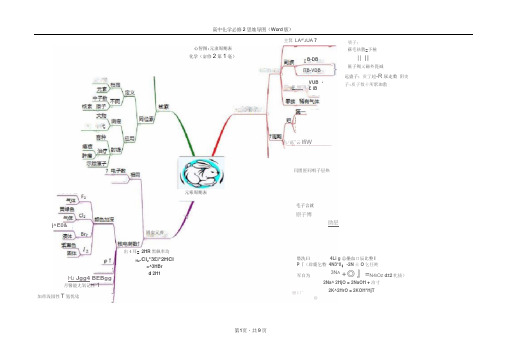
j^E0&主箕LA^'J UA 7心智图:元隶周期表化学(宓修2第1毫)B-DBITB-VDB却_畑飞之VUB ・£I B元寒周期表園实元養H J Jgg4 BEBgg月醫能尢氧记性1出4耳= 2HR黑飙率均Hz.Cl z*3£i*2HCl=^3HBrd 2H1加帝浅园性T氢忧唸占/菇"云lfiW* -----------JL-L -------------------------- 1--------------------------------------------嘖子;蘇毛祛敷=予極II II匾子羯乂磁外毘减远蛊子;贡亍超-R尿走数阴吏子:质子数十所駅珈敷闫匱匪同唱子层热毛子言就原子博助层塔洗曰4Li g总壘血口辰比整IP『(辟鹿乞特4N3*0;-2N士O乞任盹3N A+◎』=N4I O Z d±2牝拔)2Na^ 2HjO = 2NaOH + 泊寸2K^2HrO = 2KOH*HjT军白为屉卜厂◎H 原子子站斎武核电荷參堵勺打同誨牟宣走文元拱 元青哥朝潼叱学强心皆暨;元袞周期律化学锂化学(必悸2第1童)隔吉寿于乍毛力丑□r 贸性原子克:”空王咗托丄,屋_裁勻同N 「鳏论伽皐牛旳 fflMa 力酋WHHS 胡転占步輕理性质焉响舷性广莊匪辜議羸物廣寻找启发 fc ---- « J -------- 1 備/_■ : 兀魁隹凰不意圏宣口同匱或广—-电子昨叭 西石策子捋嵩!匚二—.它三玄塔二一 尉卜聽亍竝司"L]同主察桓同吾丢性晅子字效1一 E助层里孑救WL內吾+ ]r 4化台•'介医匪敷斗_原于半径暑13个V 电子敷 r ~《葩.塀呈苣之鱼寻梅心音圍:代学反应与能星 化宝(必修2第2章】•佶能与捣詬rs乏卫奉r wr 化学反应与蕃量学能与邑聽原电池丈A連□決:毛子不下取;禹子不上岸 爾垃匣©謹:如正还 禅池B 進謹:色過艺虽大割吏良应複门f *・严 「・r ・严厂 -----------------------------------'.叱円頁衣豈尺矽淞亶『圭豌牛1甘厂 —’ L -------- 卑检吁间 」H_U 便垦删浏严nnoi/(L-5) .袤云mol/CL-min ;j^B8y ― ----- --------il-t > Q 晅护•反应AH -Q L - Q /------------- ------------二” < D 京註乏二2)^册舷匝T 辭「 疋反帆_—TTA RB3®C T亦Yu 原电乜电輕罢甞近正視2屮f -H :T対E Zn ■ 2e- -Zn^ 靱云 rn ^ZH 1 -Zn 1- + HrT住期殺:Cu'- +Je- =Cu卿:2HK>-4e =O ;t*4H^总豈・M : ^Cu-^^H^O =£M ^Cu-0s r-H4H- 平衡丽珈師:直更标衣①¥丘-唾 g ■各柜琳室聞不娈 闻按耗:◎::总合住翌、总£3糕、总需底的垦科SB?阎的适毒恋 更②互处師空度或平垢相灯舒质星不墮冇间适而迪* 卷台休的廉色不輔时问应莊而逝 言瘻蘇任何时聞戒立:叵捷标志墓孤住趣恵呵竇⑥融侪电I® 达平斬也就是.交星不更砖池巨二二乂若乜冋更屋池裝餐老能-化我云皿二吨子兰垢tuSG-高中化学必修2思维导图(Word 版)心智囹:眉简单的有机物-甲烷昨(必想2第3韋)C-C 柜唾fe5a P=fl.717j/L j正匸荀W 空可希 同茎X 崔海唇■;…*时取1换代r ~\^TSC.H. + 心 愈” 0 4- 3H E O 匸丸事XiSM 不同强分辰茗体优■曲同分毛同廿予式 CH 4+CI J ^ fH^Cb 十 Cb CHClj + CL 庄整nci-bCHzCi 伺部麻那那卫斗Hd + CH^LCW 机君判】 t 呈邑nci 十匚HCM 氮访]制聞) -^£>HCI * <XL (四氣化瑕・灭火剂「有机海册Ik 上亦确皤申不竝 最简单的有WMir 甲烷 砂二样 冒英粗區 碍同元索 H-C -HH具一烷ZT 端 (T 烷两科同分吳梅樹 道式匚“甩“沁nn c;比曲+』$lq 逑+3丰1)円Q 前離点T兰一股一直T遇性俸取亡卜卯工+dj[垂诸中不证M :曰C^HiiJ^^CiHis-CiH^儘行子氏毎H 可以裂代谀朗4 乎6CO j + 3H;a火皓明亮「有、:T黒奉色代亦岫取代壽---------------------------------------―—1 + HO-NO;■| J(m^M)加.成PJ不迂奎KMnQ.逗化雅0+HO-SOjH-20住旳一^0 环己做加5皈劇平輕SOsH+H:OKMnOi 逐鱼80.代躍海蜒鱼KMnO*JH亦于萼 6 竝-nCO2 +伯幻垃威22磁c=c乙値来自石油和煤的两种基本化工嗣屁辱杓疾I 石fruk'MX低行于一壹分子■* -C-C-加虑反应一―.至使一皿CjFL + 3Oj 磁.JCOj + 2HjO(>d® 瞻・SSJ®CH;・ CH; * HCI - CHjCH^I (制気乙境CHi-CHj:+Br:- <H:BrChr8r f涙水歸iM = £H= + KQ +詈姿_■• *3山T戲乙對胃嗓加庄水平SMK丁 CHj=CH7+ HZ Ni> CHjCHi汽,Cl-I;-}? (MSJE®心智閏:来自石油和淇的两种基車化工恵料化学(魁修2第』章)nCHi = CHi乙晞聊匸或反应和肚聚豆应驴主KWrO-tISfigj CHjOII,——CHjY — H -H —O — I M 5 :—- 乙蒔 一—严军葢牛甘H 俎 右H 艇换□II-匚Hi —C —C^Czhii +HjO乙薛己塞拡取弋堆汩£连世疑中HCHXOOHOCHjCHrOH + SOj最基—COOH乙辱I 匯基—CHOI 赵—NO : r-la<Ot * 2CI~liCOO H=2C HjCOONa + CO :1 + HQ 霁鞍幡称Ch J €OOH>H ;CO=■■工盏穗、竺唾吵釉[L17贰沸蛊才吏虹炬石笈旦醴可 口M — 廿 _— _ ir^ja_»_^jL-rr~n g5i llCH J C-OHP<HjO *握址哥 亡u 或Aq 眈理性■鱼ZCHjCHfQH + Qj —— iCHsCHC+ZHjO 朋弓吃渦盡 门忙、"552 HH 7CHX>H+2lMa — JtHjCHiONa^MjT -舅ii 发 平屢IN 可质应 心宵團:生活中两种常见前有阴化学(凶02第垣)生活中两种常见的右翊滋H£6匪奩X.墓怛恫右智團;基本营养物庾此学(必修2第月章)I Q097僚蛋兰更麦芽请疥砖唐聲芝C<脂册憨BTF竝存在q脣9S IT(SkoCUh 亠riH£坐炮淀粉{或肝進襄)变黄疑雋打毛唳廉克蛊曲旨肪竝■c=cW匪匚计七Qx + H卫涅赫吏莓曲^±/—出薜歸病基本营舷质在■輛飪sq + GHq苇萄睹寻雀nQHizOt野華密比淒S+E<TX M作用内匪阳H退里議窘丈.... ............. <...... 1SS柞用]「加1u tt——忒.圣丁盘W*・,3*™ ■-=--———S ____有參二::匚热m髯杏活洩全寻-冒环令壬■聯戟术込4毎方旬裁禺伍廿4------- J潯水缺膏理幵再匚利用翠全原矿沏的幵勵」用右冒聞;开发^用金廣矿物和画水熒再化学(必惶2 S4M)毎水j籃利巨區海水如這源的开发利用、沖口列益臺csra , ■I~^^41薊鬭垦金黒览驾金畧資通.—盍于沁愛TS 咖査成本海水水誑浪利用m LixlOfl37%«ffi球环星>妁&_飞金寓飾?HgO 5^; 2Hg * C J F酣肿4Ag + Oil■- gF^Of * 3C0 2F* -H 3C0;(髙啡轶}阻J6*氛I臺墨2宅+ Al工id答心彬:?fuiS + Oz=^r Xu 亠50二叹1 去聞]Fe 十Cu 5(□二=FeSO^ +MgCL =Sfi= Mg Yb f 2A I7O54AI + 5O3t JNaCi 2Na + CIJ熔融塢融冬“u煖融g 蛊監需零f H WOWQH1°瞬也匪QMi 屮^\Tjfc±7心曾團:资砖合利用 环境懈护化字滋修2第4章)気上三■亟一%左碇酸兮裂化羊ct 合成“m 匕的单之CH ; =匚缶 拒节一£衬YH :I - ■“ ’fflW星盘聚化煤石油去愿吒资源煤合利用 环境探护:变忧隧戎屋二意贾遇士主乙殊8密气汽化盲工东二右-M 璽严曲■ 一生成物血垦._ 100旺丿CwHji 豐专z ■* C S H U +C I M H 血瞰血压* *T/Ure^=wt —I*三三n 犀合磴歆目生产甲磐不同洗点各锻廿乱冃台老気黃桝气。
高中化学全套思维导图(高清版)

2020-2-269:09:5【老师】俸・KH 高中化経套思“.版).pdf (18.11MB )髙中化学全套思谁导图(高清版),pdf}来目群文件打开打开文骸 转发三1【老师】俸自己没有思维导图的可以借鉴。
1 /43高中化学 第一章 从实验学化学第一节化学实验基础知识取用固体取用液体防火与灭火常见危险与安全措施了解实验安全常识及意外事故处理方法学法指导操作的先后顺序 操作的注意事项 操作的目的 适用范围化学与人类健康 不溶性固体与液体的分萬 实验安全化学与环境保护分离溶于溶液中的固体溶质适用范围1 .蒸发过程不断搅拌I 注意事项蒸发是否易潮解.物质的提纯是将混合物中的少 量杂质除去而得到纯净物质将物质的分 萬与提纯混淆吸取少量液体用滴管 (专用,垂直悬滴,不倒置)实验基本操作物质分离提 纯必须遵循注意防火、防爆炸、防倒吸不増、不减、易分离、易复原2.当大量固体析岀时,停止加热,余热蒸干知识 梳理 化学实解通过动手实验,熟练掌握常用化学 仪器的使用方法和操作注意事项 较多液体用倾倒法 (瓶塞倒放,标签向手心,抓住物质的特性寻找突破口物质检验和实验综合题块状固体用锻子 粉末状用药匙中及故取用药 品的仪器的意的热覗分离 仪器热源,温度可达400 - 500 r酒劈/龜精不超过2/3,不少于1/4,用外 / 5,不对火,不吹灯,先灭后添酒精喷灯温度可达I 000 X ) 水浴漏斗loop 以下 普通漏斗长颈漏斗分液 漏斗主要 用途萃取,分液, 反应加液体用器常仪冷凝管 洗气瓶于燥管注意事项用前先检査是否漏液, 分液时上层液体从上口倒岀,下层液体从下层放出,放液时应打开分液漏斗上玻璃塞或将塞 上的凹槽对准上口小孔。
使漏斗内外大气压相等反应器1 是否易被氧化 是否易燃、易爆 是否易与空W 中某些成分作用 是否易挥发、,1 尹华 是否具有毒性、 腐蚀度便于取用 防止变质 防独、防爆等 细口瓶、产口瓶、 通瓶 塑料瓶、赢r 笑是器等剂质试性则原仪器据依学剂保化试的存密封:水封、 油封、蜡封方式/开放式存放阴凉、避光处(干燥器中存放利用沸点不同,除去难挥发和不挥发的杂质适用范围1.蒸憎烧瓶加热要垫石棉网,温度、 计的水银球与支管口下缘位于同一水平线注意事项2.冷水是下口进,上口出3.要加碎瓷片,防暴沸在互不相溶的溶剂里溶解度差别较大的溶质适用范围1 .溶液总量不超过漏斗容积的3/4 2.把分液漏斗放在铁架台上静置、分层注意事项蒸饌分液3.打开塞子,先从下口放出下层 液体,再从上口倒出上层液体其他基本 操作计量仪器玻璃仪器的洗涤药品的取用药品的保存 装置气密性检验溶液的配勉气体的收集和体积的测量量筒试管、柑垠、隔网可加热或液浴烧杯、烧瓶、 蒸憎烧瓶、锥形瓶 乂_不能加热集气瓶、试剂瓶、滴瓶、 启普发生器主要用途粗略量取液体,精度0.1 mL刻度由下而上增大,无0刻度线, 读数平视。
新人教版高中化学高一化学必修二知识点思维导图

高一化学必修 第二册化工生产中的重要非金属元素硫及其化合物氮及其化合物无机非金属材料硫二氧化硫硫酸不同价态含硫物质的转化硫元素位于元素周期表的第三周期第VIA族硫黄为黄色晶体,难溶于水,微溶于酒精,易溶于二硫化碳具有氧化性、还原性二氧化硫为无色气体,有刺激性气味的有毒气体,密度比空气大易溶于水,其水溶液显酸性二氧化硫具有漂白作用,但生成的化合物不稳定工业上常用二氧化硫来漂白纸浆,毛,丝等,此外,也可用于杀菌消毒,还有一种食品添加剂硫酸是重要的化工原料,可用于生产化肥,农药,炸药,染料和盐类等稀硫酸浓硫酸常见的硫酸盐硫酸根离子检验具有酸的通性溶于水完全电离可与酸碱指示剂作用可以活泼金属碱、碱性氧化物及其盐反应吸水性:能够吸收气体、液体中的水分,故常作干燥剂脱水性:能把有机物中的氢元素和氧元素按水的组成比脱去强氧化性与金属反应与非金属反应(加热)常温下能使铁,铝发生钝化硫酸钙,硫酸钡,硫酸铜硫酸根离子和钡离子反应生成不溶于稀盐酸的白色硫酸钡沉淀通过氧化还原反应可实现不同价态含硫物质的互相转化利用氧化剂,可将硫元素从低价态转化到高价态利用还原剂,可将硫元素从高价态转化到低价态氮气氮的固定一氧化氮二氧化氮氨铵盐硝酸酸雨及防治无色无味,难溶于水的气体化学性质不活泼,通常情况下难以与其他物质发生化学反应具有还原性和氧化性含义:将大气中游离态的氮转化为氮的化合物的过程自然固氮:如豆科植物的根瘤固氮,雷电作用人工固氮:如工业合成氨无色无味有毒性气体,且不溶于水一氧化氮不能和碱反应,是不成盐氧化物,不是酸性氧化物一氧化氮和氧气反应生成二氧化氮是红棕色有刺激性气味的有毒气体,易溶于水和碱反应生成硝酸根离子和亚硝酸根离子,不是酸性氧化物和水反应生成硝酸和一氧化氮无色有刺激性气味的气体,密度比空气小,易液化极易溶于水'且与水的水溶液呈碱性浓盐酸与氨反应生成氯化氨晶体;氨的催化氧化是工业制硝酸的基础氨气和二氧化碳在催化剂加热的条件下生成一氧化氮和水氯化铵和氢氧化钙在加热的条件下生成氨气和氯化钙和水湿润的红色石蕊试纸→变蓝氨盐在碱和加热的条件下生成氨气浓盐酸→白烟硝酸是无色,易挥发,有刺激性气味的液体酸性:在水中能电离不稳定性:浓硝酸见光或受热会分解产生二氧化氮是大气中的氮氧化物与硫氧化物以及他们在大气中发生反应后的生成物溶于雨水形成的直接损伤农作物,破坏森林和草原,使土壤、湖泊酸化加速建筑物、桥梁、工业设备、运输工具和电缆的腐蚀防治强氧化性铜与稀硝酸反应生成硝酸铜和一氧化氮和水铜与浓硝酸反应生成硝酸铜和二氧化氮和水浓硝酸与炭在加热的条件下生成二氧化氮和二氧化碳和水调整能源结构,发展清洁能源研究煤的脱硫技术,减少二氧化碳和氮氧化物的排放加强工厂废气的回收处理改进汽车尾气的处理技术,控制尾气排放铵盐是无色或白色的晶体,绝大多数易溶于水;农业上常用做化肥,如硫酸铵,碳酸氢铵,硝酸铵等;氯化铵受热分解生成氨气和氯化氢;氯化氨溶液与氢氧化钠溶液共热生成氨气和水和氯化钠硅酸盐材料新型无机非金属材料硅:高纯硅广泛用于信息技术和新能源技术等领域,以及光伏电站、人造卫星、硅太阳能电池二氧化硅:可用来生产光导纤维新型陶瓷:不再限于传统的硅酸盐体系,在光学,热学,电学,磁学等方面具有很多新的特性和功能碳纳米材料:主要包括富勒烯、碳纳米管、石墨烯等,在能源、信息、医药等领域有着广泛的应用前景第五章 化工生产中的重要非金属元素化学反应与能量化学能与热能在任何的化学反应中总伴有能量的变化当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量主要原因一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小E反应物总能量 > E生成物总能量,为放热反应;E反应物总能量 < E生成物总能量,为吸热反应常见的放热反应和吸热反应常见的放热反应所有的燃烧与缓慢氧化酸碱中和反应金属与酸反应制取氢气大多数化合反应特殊:C+CO₂=加热=2CO是吸热反应常见的吸热反应以C、H₂、CO为还原剂的氧化还原反应C(s)+H₂O(g)=加热=CO(g)+ H₂(g)铵盐和碱的反应Ba(OH)₂·8H₂O+NH₄Cl=BaCl₂+2NH₃↑+10H₂O大多数分解反应KClO₃、KMnO₄、CaCO₃的分解等能源的分类一次能源常规能源可再生资源不可再生资源新能源可再生资源不可再生资源二次能源一次能源经过加工、转化得到的能源称为二次能源电能(水电、火电、核电)、蒸汽、工业余热、酒精、汽油、焦炭等化学能与电能化学能转化为电能的方式火力发电化学能→热能→机械能→电能缺点:环境污染、低效原电池将化学能直接转化为电能优点:清洁、高效原电池原理概念把化学能直接转化为电能的装置叫做原电池原电池的工作原理通过氧化还原反应(有电子的转移)把化学能转变为电能构成原电池的条件电极为导体且活泼性不同两个电极接触(导线连接或直接接触)两个相互连接的电极插入电解质溶液构成闭合回路电极名称及发生的反应负极较活泼的金属作负极,负极发生氢化反应电极反应式:较活泼金属-ne⁻=金属阳离子负极现象正极较不活泼的金属或石墨作正极,正极发生还愿反应电极反应式:溶液中阳离子+ne⁻=单质正极的现象:一般有气体放出或正极质量增加原电池正负极的判断方法依据原电池两极的材料较活泼的金属作负极(K,Ca,Na太活泼,不能作电极)较不活泼金属或可导电非金属(石墨)、氧化物(MnO₂)等作正极根据电流方向或电子流向(外电路)的电流由正极流向负极电子则由负极经外电路流向原电池的正极根据内电路离子的迁移方向阳离子流向原电池正极,阴离子流向原电池负极根据原电池中的反应类型负极正极原电池电极反应的书写方法原电池反应所依托的化学反应原理是氧化还原反应,负极反应是氧化反应,正极反应是还原反应①写出总反应方程式②把总反应根据电子得失情况,分成氧化反应、还原反应③氧化反应在负极发生,还原反应在正极发生,反应物和生成物对号入座,注意酸碱介质和水等参与反应原电池的应用原电池的总反应式一般把正极和负极反应式相加而得加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快比较金属活动性强弱设计原电池金属的腐蚀化学电源基本类型干电池活泼金属作负极,被腐蚀或消耗充电电池燃料电池两极都参加反应的原电池,可充电循环使用两电极材料均为惰性电极,电极本身不发生反应,而是由引入到两极上的物质发生反应水能、风能、生物质能煤、石油、天然气等化石能源太阳能、风能、地热能、潮汐能、氢能、沼气核能失电子,发生氧化反应,现象通常是电极本身消耗,质量减小得电子,发生还原反应,现象是常伴随金属的析出或H₂的放出负极溶解,负极质量减少第六章 化学反应与能量化学反应与能量化学反应的速率和限度化学反应的速率概念化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示计算公式v(B)=|Δc(B)|/Δt=|Δn(B)|/V·Δt单位mol/(L·s)或mol/(L·min)B为溶液或气体,若B为固体或纯液体不计算速率以上所表示的是平均速率,而不是瞬时速率重要规律速率比=方程式系数比变化量比=方程式系数比影响化学反应速率的因素内因由参加反应的物质的结构和性质决定的(主要因素)外因温度:升高温度,增大速率催化剂:一般加快反应速率(正催化剂)浓度:增加C反应物的浓度,增大速率(溶液或气体才有浓度可言)压强:增大压强,增大速率(适用于有气体参加的反应)其它因素:如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、 原电池等也会改变化学反应速率化学反应的限度——化学平衡基本情况在一定条件下,当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度,即化学平衡状态影响因素可逆反应温度、反应物浓度、压强等催化剂只改变化学反应速率,对化学平衡无影响在相同的条件下同时向正、逆两个反应方向进行的反应叫做可逆反应通常把由反应物向生成物进行的反应叫做正反应;而由生成物向反应物进行的反应叫做逆反应在任何可逆反应中,正方应进行的同时,逆反应也在进行可逆反应不能进行到底,即是说可逆反应无论进行到何种程度,任何物质(反应物和生成物)的物质的量都不可能为0特征逆:化学平衡研究的对象是可逆反应动:动态平衡,达到平衡状态时,正逆反应仍在不断进行等:达到平衡状态时,正方应速率和逆反应速率相等,但不等于0。
2019年人教版化学必修二:第1章-思维导图【3】(含答案)

化学·必修2(人教版)1.(双选题)下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )A.原子半径Z>Y>XB.气态氢化物的稳定性:R>WC.WX3和水反应形成的化合物是离子化合物D.Y和Z两者最高价氧化物对应的水化物能相互反应解析:根据O与F没有负价,可知X为O,其右边相邻的为F,又因为Y、Z、W、R是短周期元素,所以Y 为Na,Z为Al,W为S,R为Cl。
根据周期律,可知答案选得B、D两项。
答案:BD2.下列关于化学键的叙述,正确的一项是( )A.离子化合物中一定含有离子键B.单质分子中均不存在化学键C.离子化合物中一定不含有共价键D.含有共价键的化合物一定是共价化合物答案:A3.科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(结构如下图所示)。
已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )A.分子中N、O间形成的共价键是非极性键B.分子中四个氮原子共平面C.该物质既有氧化性又有还原性D.15.2 g该物质含有6.02×1022个原子(已知:NH3分子结构属于三角锥形)解析:N与O之间形成的是极性键;由N—N—N键角为108.1°说明4个N不在一个平面,其结构为三角锥形,相当于NH3结构中3个H原子换成3个NO2;由N原子平均化合价为+3可知该物质既能发生氧化反应,又能发生还原反应;由分子式,可知15.2 g该物质的物质的量为0.1 mol,所含原子的物质的量为1 mol,故原子总数为6.02× 1023。
答案:C4.下列说法正确的是( )A.形成离子键的阴、阳离子间只存在静电吸引力B.HF、HCl、HI的热稳定性和还原性均依次减弱C.第三周期非金属元素含氧酸的酸性从左到右依次增强D.元素周期律是元素原子核外电子排布周期性变化的结果解析:离子键的作用还包括静电斥力,故A项错;HF、HCl、HI的还原性逐渐增强,故B项错;第三周期非金属元素最高价含氧酸的酸性从左到右依次增强,并不是含氧酸的酸性,故C项错。
高中化学知识结构网络图.doc

高中化学知识结构网络图化学基本概念和基本理论元素与化合物有机化学基础化学计算化学实验化学工业知识化学基本概念和基本理论物质的分类组成原子的粒子间的关系核电荷数( Z) =核内质子数 =核外电子数质量数( A) =质子数( Z)+中子数( N)元素周期律与周期表化学键与分子结构晶体类型与性质晶体类型离子晶体分子晶体原子晶体金属晶体性质比较组成粒子阴、阳离子分子原子金属阳离子和自由电子结构粒子间作用离子键范德华力共价键金属键熔沸点较高低很高有高有低硬度硬而脆小大有大有小、有延展性易溶于极性溶剂,极性分子不溶于任何溶难溶(钠等溶解性难溶于非极性溶易溶于极性溶剂与水反应)物理剂剂性质晶体不导电,溶晶体不导电;于水后能电离能溶于水的其水不良(半导体良导体(导导电性的,其水溶液可溶液导电;熔化导Si)电传热)导电;熔化不导电电NaCl 、NaOH 干冰、白磷金刚石、 SiO2 Na 、 Mg 、典型实例AlNa2O、 CaCO3 冰、硫磺晶体硅、 SiCFe、Cu 、Zn 化学反应类型离子反应氧化还原反应的有关概念的相互关系化学反应中的能量变化化学平衡弱电解质的电离平衡溶液的酸碱性盐类的水解酸碱中和滴定电化学返回页顶元素与化合物钠及其化合物碱金属氯及其化合物卤素氧族元素硫的重要化合物碳及其化合物硅及其化合物材料氮族元素氮和磷氨硝酸镁和铝铁及其化合物铜及其化合物返回页顶有机化学基础烃不饱和链烃芳香烃分通式类结构特点化学性质物理性质同分异构①与卤素取代反应烷C n H 2n+2 烃(n≥ 1)烯C n H2n 烃(n≥ 2)炔C n H 2n-2 烃(n≥ 2)苯及其C n H 2n-6 同(n≥ 6) 系物①C-C 单键②链烃①含一个 C C键②链烃①含一个 C C键②链烃①含一个苯环②侧链为烷烃基(光照 )②燃烧③裂化反应①与卤素、 H :、 H2O等发生加成反应②加聚反应③氧化反应:燃烧,被 KMnO 4酸性溶液氧化①加成反应②氧化反应:燃烧,被 KMnO4 酸性溶液氧化①取代反应:卤代、硝化、磺化②加成反应③氧化反应:燃烧,苯的同系物能被KMnO 4酸性溶液氧化一般随分子碳链异构中碳原子数的增多,沸点升高,液态时密度增大。
分子结构与性质思维导图

分子结构
与性质
共价键 类
型
按电子云重叠方式分
σ键---头碰头
π键---肩并肩
按电子对是否偏移
极性键A-B
非极性键A-A 按电子对来源分
配位键
普通共价键
特征
方向性 饱和性
键参数
键能 键长
键角
化学键的稳定性
决定分子的立体构型 分
子的空
间构型
分子的性质
配合物
配位键
组成
外界
内界 中心原子/离子
配位体
配位原子
配位数 手
性 含
氧 酸 的 酸
性 分
子 的 极
性
分子间作用
力与氢键 分
子 的 熔 沸
点 溶
解
度
常见分子的空间构型 直线型
V 形 平面三角形
三角锥形
正四面体
理论解释与判断方法
价层电子对互斥理论 杂化轨道理论
等电子体
决定分子组成
决定分子立体结构。
化学思维可视化教学研训工作室2017年春期高一化学《化学键》小规律总结、解题模型建构、绘制思维导图

人教版高一化学必修二第一章第三节《化学键》班级 姓名 组别一、离子键的三个“一定”和两个“不一定”1.三个“一定”(1)离子化合物中一定含有离子键;(2)含有离子键的物质一定是离子化合物;(3)离子化合物中一定含有阴离子和阳离子。
2.两个“不一定”(1)离子化合物中不一定含有金属元素,如NH 4Cl 、NH 4NO 3?NH 4HCO 3等;(2)含有金属元素的化合物不一定是离子化合物,如AlCl 3。
二、共价键与化合物的关系1.两个“一定”(1)共价化合物中一定只含有共价键;(2)共价化合物中一定不含离子键。
2.两个“不一定”(1)含共价键的物质不一定是共价化合物,也可能是单质,如O 2、N 2、H 2、Cl 2等;(2)含共价键的化合物不一定是共价化合物,也可能是离子化合物,如NaOH 中含有O —H 共价键,Na 2O 2中含 有O —O 共价键,NH 4Cl 中含有N —H 共价键,但它们都是离子化合物。
三、在书写共价分子的电子式时应注意1.各原子最外层的电子即便未参与成键也必须全部标出;2.要正确标出共用电子对的对数;3.中学阶段要求掌握的物质的电子式,一般都满足稳定结构;4.电子式书写中原子的排列顺序不一定是分子式中原子的排列顺序,如HClO 的电子式为:四、共价化合物中8电子稳定结构的判断规律1.对原子序数不大于5的元素,形成化合物时,一般不可能为8电子稳定结构,如HCl 中的H ,BeCl 2中的Be , BF 3中的B 等。
2.对原子序数大于5的元素,形成化合物时,若|元素化合价|+原子最外层电子数=8,则该化合物中该元素满 足8电子稳定结构;否则不满足。
如CO 2中的C :|+4|+4=8,满足,O :|-2|+6=8,也满足;PCl 5中的P : |+5|+5=10≠8,不满足,Cl :|-1|+7=8,满足。
如:下列各组物质中,分子中的所有原子都满足最外层8电子结构的是( )A .BeCl 2、PCl 5B .PCl 3、N 2C .COCl 2(光气)、SF 6D .XeF 2、BF 3解析 题中所有原子最外层满足8电子结构的物质仅有:PCl 3、N 2、COCl 2,故正确选项为B 。
2019年人教版化学必修二:第1章-思维导图【2】(含答案)

化学·必修2(人教版)1.短周期金属元素甲~戊在元素周期表中的相对位置如右图所示:下面判断正确的是( )A.原子半径:丙<丁<戊B.金属性:甲>丙C.氢氧化物碱性:丙>丁>戊D.最外层电子数:甲>乙解析:同周期从左到右原子半径逐渐减小,金属性逐渐减弱,其氢氧化物碱性逐渐减弱,故A项错,C项正确;同主族从上到下金属性逐渐增强,故B项错;同周期最外层电子数逐渐增大,故D项错。
答案:C2.(双选题)短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第ⅤA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则( )A.原子半径:丙>丁>乙B.单质的还原性:丁>丙>甲C.甲、乙、丙的氧化物均为共价化合物D.乙、丙、丁的最高价氧化物对应的水化物能相互反应解析:甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,该氢化物应为NH3,则乙是N,甲是H;甲、乙、丙、丁的原子序数依次增大,且都是短周期元素,甲和丙同主族,则丙为Na,丁的最外层电子数和电子层数相等,则丁为Al。
综上所述B错,单质的还原性:丙>丁>甲;C错,丙的氧化物是氧化钠和过氧化钠,它们都是离子化合物。
答案:AD3.下表是元素周期表的一部分,有关说法正确的是( )A.e的氢化物比d的氢化物稳定B.a、b、e三种元素的原子半径:e>b>aC.六种元素中,c元素单质的化学性质最活泼D.c、e、f的最高价氧化物对应的水化物的酸性依次增强解析:周期表中主要从金属性和非金属性递变推及到物质性质的递变。
答案:D4.(2018·广东高考)(双选题)元素R、X、T、Z、Q在元素周期表中的相对位置如下图所示,其中R单质在暗处与H2剧烈化合并发生爆炸。
则下列判断正确的是( )A.非金属性:Z<T<XB.R与Q的电子数相差26C.气态氢化物稳定性:R<T<QD.最高价氧化物的水化物的酸性:T>Q解析:R单质在暗处与H2A项错,非金属性Cl>S,而且Ar是稀有气体,没有非金属性;B项错,F跟Br原子核外电子数相差18;C项错,气态氢化物HF>HCl>HBr;D项正确,Cl非金属性比Br强。
人教版化学必修二:第2章-思维导图【1】(含答案)

人教版化学必修二:化学·必修2(人教版)1.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。
然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。
由此可见() A.NH4HCO3和盐酸的反应是放热反应B.该反应中,热能转化为产物内部的能量C.反应物的总能量高于生成物的总能量D.反应离子方程式为:NH4HCO3+HCl―→NH4Cl+CO2↑+H2O 答案:B2.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。
已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。
则反应S(s)+3F2(g)===SF6(g)的能量变化为()A.放出1 780 kJ的能量B.放出1 220 kJ的能量C.放出450 kJ的能量D.吸收430 kJ的能量答案:B3.已知H2(g)+Br2(l)===2HBr(g)ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:则表中a为()A.404B.260C.230D.2004.(双选题)已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):H2(g)+Cl2(g)―→2HCl(g)+Q1,H2(g)+Br2(g)―→2HBr(g)+Q2。
有关上述反应的叙述正确的是()A.Q1>Q2B.生成物总能量均高于反应物总能量C.生成1 mol HCl气体时放出Q1热量D.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量答案:AD5.已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1(表示2 mol H2燃烧放出571.6 kJ的热量),CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890 kJ·mol-1(表示1 mol CH4燃烧放出890 kJ的热量)。
