(技术规范标准)核酸、蛋白技术参数资料、分子量标准及常用试剂的配制
核酸提取与纯化试剂配方

核酸提取与纯化试剂配方核酸提取和纯化是分子生物学研究中常用的重要步骤。
核酸提取与纯化试剂包括溶解、提取、纯化和测定等步骤。
下面将详细介绍核酸提取与纯化试剂的配方和使用方法。
1. 细胞裂解缓冲液的配方:- 25mM Tris-HCl pH 8.0- 50mM EDTA- 1% SDS- 100μg/ml RNase A将以上试剂按比例混合制备成细胞裂解缓冲液,用于裂解细胞并保护核酸的完整性。
2. 提取缓冲液的配方:- 0.1M Tris-HCl pH 8.0- 0.14M NaCl- 0.001M EDTA- 1% SDS将以上试剂按比例混合制备成提取缓冲液,用于将细胞裂解液中的核酸与蛋白质分离。
3. 过滤缓冲液的配方:- 5M ammonium acetate- 100% isopropanol将5M乙酸铵与等量的100%异丙醇混合制备成过滤缓冲液,用于将核酸从提取液中沉淀。
4. 洗涤缓冲液的配方:- 70% ethanol将绝对乙醇与等量的去离子水混合制备成洗涤缓冲液,用于洗涤核酸沉淀,去除残留的盐类和蛋白质。
5. 纯化缓冲液的配方:- 10mM Tris-HCl pH 8.0- 1mM EDTA将以上试剂按比例混合制备成纯化缓冲液,用于重溶核酸并去除污染物。
使用步骤如下:1. 将待提取的细胞悬浮在细胞裂解缓冲液中,彻底裂解细胞膜。
2. 加入RNase A,在室温下孵育30分钟,酶解RNA。
3. 加入等体积的提取缓冲液,混合均匀后离心,将上清液转移至新离心管,保留上清液,其中含有DNA。
4. 加入等体积的过滤缓冲液,混合均匀后离心,将上清液抽取并丢弃,沉淀中包含核酸。
5. 加入洗涤缓冲液,混合均匀后离心,将上清液抽取并丢弃,重复一次洗涤步骤,确保去除残留的盐类和蛋白质。
6. 倒掉洗涤缓冲液,将离心管倒置在吸水纸上,待离心管底部的液滴完全干燥,避免残留的洗涤缓冲液影响纯化后的核酸。
7. 加入适量的纯化缓冲液,将沉淀重溶,确保核酸的完整性。
生物实验常用缓冲液和酶的配制

实验室常用技术参数资料一、核酸及蛋白质常用数据1.核苷三磷酸的物理常数2.常用核酸的长度与分子量3.常用核酸蛋白换算数据(1)重量换算1μg=10-6g1pg=10-12g1ng=10-9g 1fg=10-15g(2)分光光度换算:1A260双链DNA=50μg/ml1A260单链DNA=30μg/ml1A260单链RNA=40μg/ml(3)DNA摩尔换算:1μg 100bp DNA=1.52pmol=3.03pmol末端1μg pBR322 DNA=0.36pmol1pmol 1000bp DNA=0.66μg1pmol pBR322=2.8μg1kb双链DNA(钠盐)=6.6×105道尔顿1kb单链DNA(钠盐)=3.3×105道尔顿1kb单链RNA(钠盐)=3.4×105道尔顿(4)蛋白摩尔换算:100pmol分子量100,000蛋白质=10μg100pmol分子量50,000蛋白质=5μg100pmol分子量10,000蛋白质=1μg氨基酸的平均分子量=126.7道尔顿(5)蛋白质/DNA换算:1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质10,000MW蛋白质=270bp DNA30,000MW蛋白质=810bp DNA50,000MW蛋白质=1.35kb100,000MW蛋白质=2.7kb DNA4.常用蛋白质分子量标准参照物5.常用DNA分子量标准参照物续上表二、常用缓冲液1.分子克隆常用缓冲液2.磷酸缓冲液(1)25℃下0.1mol/L磷酸钾缓冲液的配制※(2)25℃下0.1mol/L磷酸钠缓冲液的配制※※:用蒸馏水将混合的两种1mol/L贮存液稀释至1000ml,根据Henderson-Hasselbalch方程计算其pH 值:pH=pK’+1g([质子受体]/[质子供体])在此,pK’=6.86(25℃)。
3.电泳缓冲液测序凝胶加样缓冲液98%去离子甲酰胺10mol/L EDTA(pH8.0)0.025%二甲苯青FF0.025%溴酚蓝甲酰胺:许多批号的试剂级甲酰胺,其纯度符合使用要求,无须再进行处理。
核酸检验试剂配制方案

核酸检验试剂配制方案核酸检验是一项非常重要的实验室技术,用于检测和分析DNA和RNA的序列和结构。
核酸检验试剂的配制是核酸检验工作中的关键环节,下面是一个700字的核酸检验试剂配制方案。
一、试剂准备1. Tris-HCl缓冲液:将121.14g Tris-HCl溶解在800ml去离子水中,调pH至7.5,加去离子水至1L。
2. EDTA溶液:将186.1g EDTA二钠溶解在800ml去离子水中,加去离子水至1L。
3. NaCl溶液:将58.44g NaCl溶解在800ml去离子水中,加去离子水至1L。
4. Lyse Buffer溶液:将10ml Tris-HCl缓冲液、1ml EDTA溶液、8ml NaCl溶液混合,加去离子水至50ml。
5. 2×载脂体缓冲液:将40ml Tris-HCl缓冲液、8ml EDTA溶液、70ml NaCl溶液混合,加去离子水至200ml。
6. 蛋白酶K溶液:将1mg的蛋白酶K溶解在1ml去离子水中。
7. 合成引物:按需要合成引物序列,并与合成公司确认纯度和浓度。
二、试剂配制1. DNA提取试剂配制:将1ml Lyse Buffer溶液和10μl蛋白酶K溶液混合,制成DNA 提取试剂。
2. PCR反应液配制:将50μl 2×载脂体缓冲液、5μl DNA模板、1μl合成引物、3μl MgCl2、1μl dNTP混合,加去离子水至100μl,制成PCR反应液。
3. 电泳缓冲液配制:将242g Tris和36g boric acid溶解在800ml去离子水中,加去离子水至1L,pH调至8.0,加入20ml 0.5M EDTA混合,最终体积调至1L。
4. DNA标记液配制:将1μl DNA样品和9μl DNA加载缓冲液混合,制成DNA标记液。
5. 试剂保存温度:将所有试剂保存在适宜的温度下,避免阳光直射和高温。
三、注意事项1. 试剂配制时要严格按照实验室的操作规程进行,避免实验污染。
实验室常用技术参数资料 试剂配方
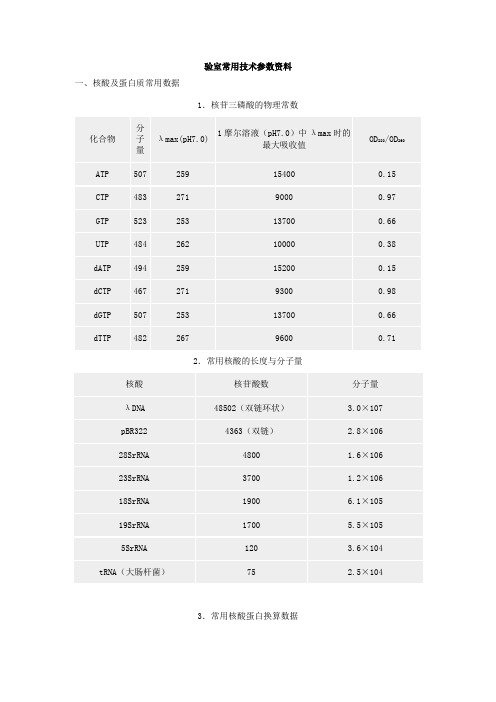
验室常用技术参数资料一、核酸及蛋白质常用数据1.核苷三磷酸的物理常数2.常用核酸的长度与分子量3.常用核酸蛋白换算数据(1)重量换算1μg=10-6g 1pg=10-12g1ng=10-9g 1fg=10-15g (2)分光光度换算:1A260双链DNA=50μg/ml1A260单链DNA=30μg/ml1A260单链RNA=40μg/ml(3)DNA摩尔换算:1μg 100bp DNA=1.52pmol=3.03pmol末端1μg pBR322 DNA=0.36pmol1pmol 1000bp DNA=0.66μg1pmol pBR322=2.8μg1kb双链DNA(钠盐)=6.6×105道尔顿1kb单链DNA(钠盐)=3.3×105道尔顿1kb单链RNA(钠盐)=3.4×105道尔顿(4)蛋白摩尔换算:100pmol分子量100,000蛋白质=10μg 100pmol分子量50,000蛋白质=5μg 100pmol分子量10,000蛋白质=1μg 氨基酸的平均分子量=126.7道尔顿(5)蛋白质/DNA换算:1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质10,000MW蛋白质=270bp DNA30,000MW蛋白质=810bp DNA50,000MW蛋白质=1.35kb100,000MW蛋白质=2.7kb DNA4.常用蛋白质分子量标准参照物5.常用DNA分子量标准参照物续上表二、常用缓冲液1.分子克隆常用缓冲液2.磷酸缓冲液(1)25℃下0.1mol/L磷酸钾缓冲液的配制※(2)25℃下0.1mol/L磷酸钠缓冲液的配制※※:用蒸馏水将混合的两种1mol/L贮存液稀释至1000ml,根据Henderson-Hasselbalch 方程计算其pH值:pH=pK’+1g([质子受体]/[质子供体])在此,pK’=6.86(25℃)。
核酸与蛋白质生物计量关键技术及基标准体系创建和应用

核酸与蛋白质生物计量关键技术及基标准体系创建和应用大家好,今天我们来聊聊一个非常有趣的话题:核酸与蛋白质生物计量关键技术及基标准体系创建和应用。
让我们来解释一下这个话题的背景。
在生物学、医学、食品科学等领域,我们需要对核酸和蛋白质进行定量分析,以便更好地了解它们的结构和功能。
而这些分析结果需要有一个统一的标准体系来进行比较和评估。
因此,研究核酸与蛋白质生物计量关键技术及基标准体系创建和应用就显得尤为重要。
核酸和蛋白质到底是什么呢?简单来说,核酸是生物体内携带遗传信息的分子,包括DNA和RNA两种类型;而蛋白质则是生物体内发挥各种功能的大分子,如酶、抗体、肌红蛋白等。
它们在生物体内的组成和作用非常复杂,因此对其进行定量分析也是一项非常具有挑战性的任务。
为了解决这个问题,科学家们开发出了一些关键技术。
其中之一就是高通量测序技术。
这种技术可以快速地测定大量的核酸序列,从而获得有关其结构和功能的信息。
另一个关键技术是质谱法。
这种方法可以通过测量蛋白质分子的质量和电荷来确定其种类和浓度。
还有一些其他的方法,如荧光光谱法、红外光谱法等,也可以用于核酸和蛋白质的定量分析。
除了这些关键技术之外,还需要建立一套基标准体系来进行定量分析的结果比较和评估。
这个体系需要包括一系列已知浓度的标准品,以及对应的计算方法和参考值。
只有这样才能确保不同实验之间的结果具有可比性和可靠性。
现在,让我们来看看核酸与蛋白质生物计量关键技术及基标准体系创建和应用在实际生活中的应用吧!比如说,在医学领域中,医生们可以使用这些技术来检测患者体内的病毒或细菌感染情况;在食品科学领域中,研究人员可以利用这些技术来评估食品中的营养成分含量;在环境科学领域中,科学家们可以用这些技术来监测大气中的污染物含量等等。
核酸与蛋白质生物计量关键技术及基标准体系创建和应用已经成为了现代科技发展的重要组成部分。
我想说的是,虽然这篇文章使用了比较多的专业术语和技术名词,但其实它也是可以用通俗易懂的方式来表达的。
核酸提取与纯化试剂配方

核酸提取与纯化试剂配方核酸提取与纯化试剂的配方主要包括缓冲液、酶、洗涤剂和溶剂等组分。
缓冲液是核酸提取与纯化试剂的核心组成部分,它提供了适宜的pH和离子浓度,有助于维持核酸的稳定性和纯净性。
常用的缓冲液有Tris-HCl缓冲液、EDTA缓冲液等。
酶是核酸提取与纯化试剂中的重要成分,主要用于消化细胞膜和细胞核膜,释放核酸。
常用的酶有蛋白酶K、RNase A等。
洗涤剂用于去除细胞残渣、蛋白质和其他杂质,保证提取的核酸纯净。
一般常用的洗涤剂有SDS、NaCl等。
溶剂则用于溶解和洗涤核酸,常用的溶剂有乙醇、异丙醇等。
核酸提取与纯化试剂的使用方法如下:1. 准备样品:首先需要准备待提取核酸的样品,可以是细胞、组织或体液等。
样品的获取和保存要遵循一定的规范,以保证提取的核酸质量和纯度。
2. 细胞破碎:将样品加入破碎缓冲液中,使用超声波、机械破碎或冻融等方法破碎细胞,释放核酸。
破碎缓冲液中含有适量的酶,可以帮助破碎细胞膜和细胞核膜。
3. 消化蛋白质:加入蛋白酶K等消化酶,消化样品中的蛋白质,以便更好地分离核酸。
4. 沉淀核酸:加入酒精或其他沉淀剂,使核酸沉淀下来。
离心沉淀后,将上清液倒掉,留下核酸沉淀。
5. 洗涤核酸:用洗涤缓冲液洗涤核酸沉淀,去除杂质和残留的试剂,保证核酸的纯净。
6. 溶解核酸:用适量的溶剂溶解核酸,使其溶解均匀,并保持其稳定性。
7. 储存核酸:将提取纯化的核酸存储在低温下,以保持其稳定性和纯净性,以备后续实验使用。
核酸提取与纯化试剂的配方和使用方法是分子生物学实验中的基础知识,掌握好这些知识对于研究人员的实验顺利进行具有重要意义。
在实验过程中,需要注意各个步骤的操作规范和试剂的质量控制,以确保提取到高质量的核酸样品。
此外,在实际应用中,还可以根据具体的实验需求进行一定的调整和优化,以获得更好的实验结果。
提取与纯化核酸是分子生物学研究中的重要步骤,核酸提取与纯化试剂的配方和使用方法在实验室中得到广泛应用。
核酸、蛋白质杂交用相关试剂、缓冲液的配制方法

核酸、蛋白质杂交用相关试剂、缓冲液的配制方法20×SSC20×SSPE Buffer50×Denhardt’s溶液■组份浓度 3.0 M NaCl,0.3 M 柠檬酸钠■配制量 1 L■配制方法 1. 称量下列试剂,置于1 L烧杯中。
NaCl 175.3 g柠檬酸钠·2H2O 88.2 g2. 向烧杯中加入约800 ml的去离子水,充分搅拌溶解。
3. 滴加14 N HCl,调节pH值至7.0后,加去离子水将溶液定容至1 L。
4. 高温高压灭菌后,室温保存。
■组份浓度 3.0 M NaCl,0.2 M NaH2PO4,0.02 M EDTA■配制量 1 L■配制方法 1. 称量下列试剂,置于1 L烧杯中。
NaCl 175.3 gNaH2PO4·H2O 27.6 gNa2EDTA·2H2O 7.4 g2. 向烧杯中加入约800 ml的去离子水,充分搅拌溶解。
3. 加NaOH调节pH值至7.4(约6.5 ml的10 N NaOH)。
4. 加去离子水将溶液定容至1 L。
5. 高温高压灭菌后,室温保存。
■组份浓度1%(W/V) Ficoll 4001%(W/V) Polyvinylpyrrolidone1%(W/V) BSA■配制量 500 ml■配制方法 1. 称量下列试剂,置于500 ml烧杯中。
Ficoll 400 5 gPolyvinylpyrrolidone 5 gBSA 5 g2. 加去离子水约400 ml,充分搅拌溶解。
3. 加去离子水将溶液定容至500 ml。
4. 用0.45 μm滤器过滤后,分装成每份25 ml。
5. -20℃保存。
0.5 M磷酸盐BufferSalmon DNA (鲑鱼精DNA)DNA变性缓冲液■组份浓度 0.5 M Na2HPO4■配制量 1 L■配制方法 1. 称量134 g Na2HPO4·7H2O置于1 L烧杯中。
实验室常用技术参数资料-百度文库(精)

常见实验用溶液的配制方法一 . 常用贮液与溶液1mol/L亚精胺(Spermidine : 溶解 2.55g 亚精胺于足量的水中,使终体积为10ml 。
分装成小份贮存于 -20℃。
1mol/L精胺(Spermine :溶解 3.48g 精胺于足量的水中,使终体积为 10ml 。
分装成小份贮存于 -20℃。
10mol/L乙酸胺(ammonium acetate :将 77.1g 乙酸胺溶解于水中,加水定容至 1L 后,用 0.22um 孔径的滤膜过滤除菌。
10mg/ml牛血清蛋白 (BSA:加 100mg 的牛血清蛋白(组分 V 或分子生物学试剂级,无 DNA 酶于 9.5ml 水中(为减少变性,须将蛋白加入水中,而不是将水加入蛋白,盖好盖后,轻轻摇动,直至牛血清蛋白完全溶解为止。
不要涡旋混合。
加水定容到 10ml ,然后分装成小份贮存于 -20℃。
1mol/L二硫苏糖醇(DTT :在二硫苏糖醇 5g 的原装瓶中加 32.4ml 水,分成小份贮存于 -20℃。
或转移 100mg 的二硫苏糖醇至微量离心管,加 0.65ml 的水配制成 1mol/L二硫苏糖醇溶液。
8mol/L乙酸钾(potassium acetate :溶解 78.5g 乙酸钾于足量的水中,加水定容到100ml 。
1mol/L氯化钾(KCl :溶解 7.46g 氯化钾于足量的水中,加水定容到 100ml 。
3mol/L乙酸钠(sodium acetate :溶解 40.8g 的三水乙酸钠于约 90ml 水中,用冰乙酸调溶液的 pH 至 5.2,再加水定容到 100ml 。
0.5mol/L EDTA:配制等摩尔的 Na2EDTA 和 NaOH 溶液(0.5mol/L,混合后形成EDTA 的三钠盐。
或称取 186.1g 的 Na2EDTA·2H2O 和 20g 的 NaOH ,并溶于水中,定容至 1L 。
1mol/L HEPES :将 23.8gHEPES 溶于约 90ml 的水中,用 NaOH 调 pH (6.8-8.2,然后用水定容至 100ml 。
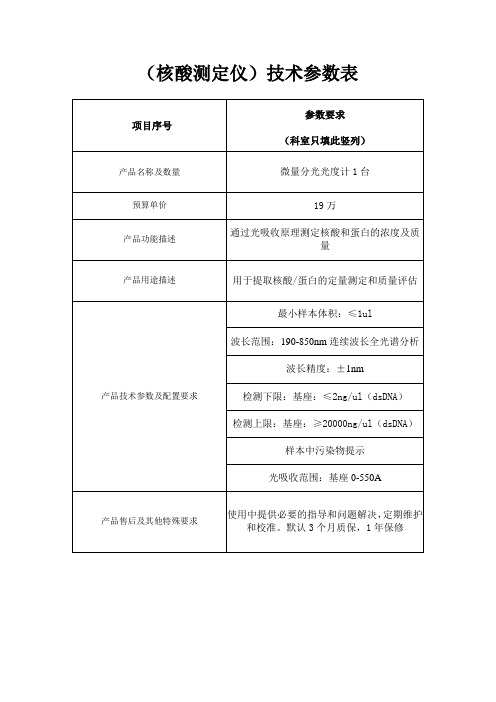
核酸测定仪技术参数表
能够适配“支链DNA信号扩增法”检测信号
检测上限:≥RLU
本底噪声:≤100RLU
重复性:CV≤2%
稳定性:R≤3%
可自动分析检测结果
产品售后及其他特殊要求
使用中提供必要的指导和问题解决,定期维护和校准。默认3个月质保,1年保修
检测下限:基座:≤2ng/ul(dsDNA)
检测上限:基座:≥20000ng/ul(dsDNA)
样本中污染物提示
光吸收范围:基座0-550A
产品售后及其他特殊要求
使用中提供必要的指导和问题解决,定期维护和校准。默认3个月质保,1年保修
(化学发光免疫分析仪)技术参数表
项目序号
参数要求学发光免疫分析仪1台
预算单价
8万
产品功能描述
通过分析杂交后化学发光信号判断是否存在目的基因(HPV E6/E7 RNA)
产品用途描述
用于宫颈肿物组织定性检测人乳头病毒(HPV)的致癌基因片段mRNA的检测
开展人乳头瘤病毒(HPV)基因分型即E6E7 mRNA检测项目,提示宫颈致癌基因的活动度,进一步评估宫颈癌的风险度。
(核酸测定仪)技术参数表
项目序号
参数要求
(科室只填此竖列)
产品名称及数量
微量分光光度计1台
预算单价
19万
产品功能描述
通过光吸收原理测定核酸和蛋白的浓度及质量
产品用途描述
用于提取核酸/蛋白的定量测定和质量评估
产品技术参数及配置要求
最小样本体积:≤1ul
波长范围:190-850nm连续波长全光谱分析
波长精度:±1nm
新冠快速核酸检测系统技术参数

新冠快速核酸检测系统技术参数1、样本容量:&16*0.2ml离心管(5-100ul),适应常规0.2ml8联管及单管。
2、反应灵敏度:10-lOlOCopies。
3、荧光染料:Fl:FAM、SYBRGreenI;F2:HE*、VIC、JOE、TET、YE1.1.OW;F3:R0*;F4:CY5。
4、通道数:四通道。
5、光学系统:高亮度1.ED扫描,光电传感器扫描检测,免校准。
6、热盖温度范围:30—110°C。
7、检测试剂:开放式检测试剂耗材(通用常规PCR项目)。
8、温控范围:30°C・100°C。
9、均匀性:W±0」°C。
10、温控精度:《士0.19。
11、升温速率:28°C/s(MA*)。
12、荧光强度检测重复性:CVW0.5%。
13、荧光线性:线性回归系数一、20.995。
14、仪器通讯接口:USB2.0(可进行文件导入、导出)。
15、软件:仪器可直接进行结果及数据分析,并配套电脑版专用分析软件。
16、触控屏独立操作,无需连接电脑即可操作分析。
17、具有NMPA注册认证。
新冠核酸检测技术方案为落实《国务院应对新冠疫情联防联控机制关于做好新冠疫情常态化防控工作的指导意见》(国发明电(202x)14号)和省应对新冠疫情应急指挥部要求,进一步提升全省新冠核酸检测能力,全面推进扩大核酸检测,使新冠核酸检测保“量”保“质”保“安全”,为做好常态化疫情防控工作提供有力技术支撑,制订此技术方案。
一、适用范围适用于**省区域内开展新冠核酸检测的实验室。
二、生物安全防护要求(一)防护用品。
医用外科口罩、N95及以上防护口罩、全面型呼吸防护器或护目镜和面屏、医用防护服、防水隔离衣、工作服、工作鞋、乳胶手套、防水靴套、医用防护帽。
(二)相关操作过程人员生物安全防护要求。
样本采集、样本核酸提取人员须三级生物安全防护:N95口罩(必要时可在外加戴医用外科口罩)、医用防护帽、工作服、外着防护服(必要时加戴穿防水隔离衣)、工作鞋、防水靴套、双层乳胶手套、护目镜(必要时可加戴面屏)或全面型呼吸防护器。
核酸、蛋白技术参数资料、分子量标准及常用试剂的配制

核酸、蛋白技术参数资料、分子量标准及常用试剂的配制核酸、蛋白技术参数资料、分子量标准及常用试剂的配制•一、核酸及蛋白质常用数据1.核苷三磷酸的物理常数化合物分子量λmax(pH7.0)1摩尔溶液(pH7.0)中λmax时的最大吸收值OD280/OD26ATP 507259 15400 0.15CTP 483271 9000 0.97GTP 523253 13700 0.66UTP 484262 10000 0.38dAT49259 15200 0.15P 4dCT P 467271 9300 0.98dGT P 507253 13700 0.66dTT P482267 9600 0.71 2.常用核酸的长度与分子量核酸核苷酸数分子量λDNA48502(双链环状)3.0×107 pBR322 4363(双链) 2.8×106 28SrRNA 4800 1.6×106 23SrRNA 3700 1.2×106 18SrRNA 1900 6.1×105 19SrRNA 1700 5.5×105 5SrRNA 120 3.6×104tRNA(大肠杆75 2.5×104菌)3.常用核酸蛋白换算数据(1)重量换算1μg=10-6g1pg=10-12g 1ng=10-9g1fg=10-15g (2)分光光度换算:1A260双链DNA=50μg/ml 1A260单链DNA=30μg/ml 1A260单链RNA=40μg/ml (3)DNA摩尔换算:1μg 100bpDNA=1.52pmol=3.03pmol末端1μg pBR322 DNA=0.36pmol 1pmol 1000bp DNA=0.66μg 1pmol pBR322=2.8μg 1kb双链DNA(钠盐)=6.6×105道尔顿1kb单链DNA(钠盐)=3.3×105道尔顿1kb单链RNA(钠盐)=3.4×105道尔顿(4)蛋白摩尔换算:100pmol分子量100,000蛋白质=10μg100pmol分子量50,000蛋白质=5μg100pmol分子量10,000蛋白质=1μg 氨基酸的平均分子量=126.7道尔顿(5)蛋白质/DNA换算:1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质10,000MW蛋白质=270bp DNA 30,000MW蛋白质=810bp DNA50,000MW蛋白质=1.35kb 100,000MW蛋白质=2.7kb DNA4.常用蛋白质分子量标准参照物(1)高分子量标准参照(2)中分子量标准参照(3)低分子量标准参照肌球蛋白分子量磷酸化酶B97,400碳酸酐酶31,00肌球蛋白212,000牛血清白蛋白66,200大豆脻蛋白酶21,500β-半乳糖甘酶B 116,000谷氨酶脱氢酶55,000抑制剂磷酸化酶B 97,400卵白蛋白42,700马心肌球蛋白16,900牛血清白蛋白66,200醛缩酶40,000溶菌酶14,400过氧化氢酶` 57,000碳酸酐酶31,000肌球蛋白(F1)8,100醛缩酶40,大豆脻21,肌球蛋6,000 蛋白酶500 白(F2)200抑制剂肌球蛋白(F3)2,500溶菌酶14,4005.常用DNA分子量标准参照物λD NA/HindⅢλDNA/EcoRⅠλ/HindⅢ+EcoRⅠpBR322/HaeⅢ23130 21226 21227 587 123 9416 7421 5148 405 104 6557 5804 4973 504 89 4361 5643 4268 458 80 2322 4843 3530 434 64 2027 3530 2027 267 57 564 1904 234 51 125 1584 213 211375 192 18974 184 11831 124 7564125常用抗生素溶液抗生素贮存液a 工作浓度浓度保存条件严紧型质粒松弛型质粒氨苄青霉素50mg/ml(溶于水)-20℃20μg/ml60μg/ml羧苄青霉素50mg/ml(溶于水)-20℃20μg/ml60μg/ml氯霉素34mg/ml(溶于乙醇)-20℃25μg/ml170μg/ml卡那霉素10mg/ml(溶于水)-20℃10μg/ml50μg/ml链霉素10mg/ml(溶于水)-20℃10μg/ml50μg/ml四环素b 5mg/ml(溶于乙醇)-20℃10μg/ml50μg/mla:以水为溶剂的抗生素贮存液通过0.22μm 滤器过滤除菌。
核酸测定SOP

核酸测定SOP1.目的规定核酸含量测定试验方法,指导检验人员实验操作,保证检验结果的正确性。
2.范围本SOP适用于原液核酸含量测定。
3.定义无4.职责4.1.QC负责本规程的起草、修订、培训及执行。
4.2.QA、QC组长、质量管理部经理负责本规程的审核。
4.3.质量总监负责批准本规程。
4.4.QA负责本规程执行的监督。
5.引用标准《中华人民共和国药典》2020年版三部。
6.材料6.1.仪器设备:紫外-可见分光光度计及光程为1cm的石英比色皿;台式离心机。
6.2.试剂及溶液:12%三氯乙酸溶液:称量12g三氯乙酸,用水溶解并定容至100ml。
7.流程图无8.程序8.1.原理核酸于260nm波长处有较大吸光度值。
蛋白质对其有干扰,用三氯乙酸沉淀去除蛋白质再进行比色。
8.2.供试品测定8.2.1.方法一:量取供试品约3ml,于260nm波长处用光程为1cm的石英比色皿测定其吸光度,水做空白对照。
(适用于A群脑膜炎球菌多糖原液和C群脑膜炎球菌多糖原液)8.2.2.方法二:量取供试品3ml于适宜的尖底离心管中,加等体积的12%三氯乙酸混匀,静置30分钟,以每分钟4000转离心,离心40分钟,取上清液,同时做空白对照,于260nm波长处用光程为1cm的石英比色皿测定其吸光度。
(适用于PPD 原液)8.3.计算按E1cm1%=200计算核酸含量,即核酸含量(㎎/ml)=测得OD值×50×样品稀释倍数/1000核酸含量(mg/g) = 测得OD值×50×样品稀释倍数/1000÷固体总量(g/ml)其中:E1cm1%=200表示当核酸浓度为1%(g/ml),液层厚度为1cm时的吸光度数值为200。
9.EHS无10.派生记录《核酸含量测定记录》11.相关文件《UV-2550分光光度计使用、清洁保养SOP》12.注意事项供试品溶液的吸光度读数,以在0.2~0.8为宜。
新冠病毒核酸检测实验室配套新冠检测配套试剂及耗材技术要求

新冠病毒核酸检测实验室配套新冠检测配套试剂及耗材技术要求1、新冠核酸提取试剂①样品类型:鼻咽拭子、血清、血浆、尿液、脑脊液和其他无细胞体液,细胞培养上清液②样品量:100µl-560µl③规格:能提供1人份/板、8人份/板、16人份/板的核酸提取试剂能满足各种标本量的提取任务,减少试剂无谓的损耗④洗脱体积为50 µl-100 µl⑤无酚/氯仿抽提,健康环保⑥重复性强,产量高,核酸回收率>90%⑦不需添加蛋白酶K、直接接入样本就上机提取⑧生产厂家通过ISO13485生产体系验证和高新技术企业认证2、新冠核酸扩增试剂①检测基因:ORF1ab基因、N基因。
②检测方法:实时荧光定量PCR法。
③产品具有国家药品监督管理局医疗器械注册证明(提供扫描件或影印件)④上机反应时间:75分钟以内⑤荧光通道:3个荧光通道,可在一个管子中同时检测ORF1ab基因、N基因和内标基因(RNaseP),无需分成多管⑥检测操作:预混反应试剂可直接分装,无需混合步骤;也可提供单人份包装,直接加入样本即可上机检测⑦灵敏度(LOD):≤500 copies/mL,中检院灵敏度检测中可检出S1-S6水平(137copies/mL )⑧重复性:中检院检测国家精密性参考品Ct值的CV≤0.7%⑨质量控制:含有阴阳性质控品及内标对照,监测样本的核酸提取、PCR扩增等过程中出现的假阴性、假阳性事件。
采用UNG酶-dUTP反应体系,防止气溶胶污染导致的假阳性3、一次性病毒采样管①双拭子:采样拭子型号:A型(口腔),B型(鼻腔)②包装及规格:独立包装,管身≥5ml,保存液≥3ml③每支采样管配单独的标本运输袋4、八连管①医疗级聚丙烯材质制成②可配套投标方案中的PCR仪器上使用5、过滤吸嘴①独立盒装,96支/盒②环氧乙烷灭菌。
超微量核酸蛋白测定仪技术参数

超微量核酸蛋白测定仪技术参数1.用途:用于核酸,蛋白浓度定量分析2、技术参数2.1样品检测体积范围:至少为 0.5~2uL;2.2 波长范围:至少为190nm~840nm;2.3 波长准确度:≤1nm;2.4 吸光率精度:≤0.002A(1mm光程);2.5 吸光率准确性:≤2%(0.76A,257nm条件下);2.6 吸光率范围:至少为0.02~3002.7检测时间:≤5秒2.8 检测范围:至少为2ng/μL~15000ng/μL(双链DNA);0.1 mg/ml~100mg/ml(BSA);2.9 光程:至少包括 0.05,0.1,0.2,1mm, 且可自动校正2.10 样品台清洁方式:擦镜纸擦拭2.11 线型硅CCD阵列检测器:至少为2048像素2.12 软件:永久免费升级2.12.1自动分析功能:具备2.12.2结果存储、输出功能:具备2.12.3自动计算、显示260/280,260/230比值的功能:具备2.13 比色杯检测指标:2.13.1 加热控温精度: ≤±0.5℃ (37℃)2.13.2 搅拌速度范围:至少为150—850 rpm2.13.3 光路径:至少包括10, 5, 2, 1 mm;2.13.4 检测下限:≤0.4 ng/μl (dsDNA);2.13.5检测上限:≥750 ng/µl (dsDNA);2.13.6检测时间:< 3 s2.14配套专用电脑:配套专用电脑1台3售后及技术服务3.1安装、调试及培训3.1.1在货物到达使用现场后,卖方按买方通知时间派技术人员到买方的项目现场,在买方技术人员在场的情况下开箱清点货物,组织安装、调试,直至设备正常运行,并承担因此发生的一切费用。
3.1.2卖方负责对买方技术人员、操作人员进行现场免费培训,培训内容包括设备操作、设备维护及简单的设备维修等,直至技术人员、操作人员能够熟练掌握为止。
设备软件更新需按照厂家日程安排与客户及时沟通,完成培训。
核酸电泳相关试剂、缓冲液的配制方法

三、核酸电泳相关试剂、缓冲液的配制方法50×TAE Buffer (pH8.5)组份浓度 2 M Tris-醋酸,100 mM EDTA配制量 1 L配制方法 1.称量下列试剂,置于1 L烧杯中。
Tris 242 gNa2EDTA·2H2O37.2 g2.向烧杯中加入约800 ml的去离子水,充分搅拌溶解。
3.加入57.1 ml的乙酸,充分搅拌。
4.加去离子水将溶液定容至l L后,室温保存。
10×TBE Buffer (pH8.3)组份浓度 890 mM Tris-硼酸,20 mM EDTA配制量 1 L配制方法 l.称量下列试剂,置于l L烧杯中。
Tris 108 gNa2EDTA·2H2O7.44 g硼酸55 g2.向烧杯中加入约800 ml的去离子水,充分搅拌溶解。
3.加去离子水将溶液定容至l L后,室温保存。
10×MOPS(3-吗啉基丙磺酸)Buffer组份浓度 200 rnM MOPS,20 mM NaOAc,10 mM EDTA配制量 1 L配制方法 1.称41.8 g MOPS,置于1 L烧杯中。
2.加约700 ml DEPC处理水,搅拌溶解。
3.使用2 N NaOH调节pH值至7.0。
4.再向溶液中加入下列试剂。
1 M NaOAc(DEPC处理) 20 ml 0.5 M EDTA(pH8.0)(DEPC处理) 20 ml5.用DEPC处理水将溶液定容至1 L。
6.用0.45 m滤膜过滤除去杂质。
7.室温避光保存。
注:溶液见光或高温灭菌后会变黄。
变黄时也可使用,但变黑时不要使用。
溴乙锭 (10 mg/ml)组份浓度 10 mg/ml溴乙锭配制量 100 ml配制方法 1.称量1 g溴乙锭,加入到100 ml容器中。
2.加入去离子水100 ml,充分搅拌数h完全溶解溴乙锭。
3.将溶液转移至棕色瓶中,室温避光保存。
4.溴乙锭的工作浓度为0.5 g/ml。
核酸检测试剂技术要求

核酸检测试剂一、基本要求:1.试剂名称:核酸检测试剂(进口)2.用途:对献血者血液标本进行乙肝病毒DNA、丙肝病毒RNA,人类免疫缺陷病毒RNA检测。
要求HBV/HCV/HIV单管联检试剂。
3.数量:65000人份.[乙型肝炎病毒丙型肝炎病毒人类免疫缺陷病毒(1+2)型核酸检测试剂盒(PCR—荧光法):乙型肝炎病毒丙型肝炎病毒人类免疫缺陷病毒(1+2)型核酸质控试剂(PCR-荧光法)].4.★试剂适用设备:可以在现有S201设备上使用。
5.适用检测样本种类:血清及EDTA、ACD抗凝血浆。
6.★试剂原理基于荧光PCR技术的汇集模式或基于TMA技术的单检模式。
二、技术要求:1.试剂必须通过美国FDA批准或欧洲CE(IVD)认可,以保证产品技术和质量达到国际认可水平,投标试剂的注册标准应具有进字号的注册许可,投标人需在投标文件中提供相关证明文件。
2.试剂可检测到的基因亚型要求覆盖:HBV A—H所有亚型;HCV 1—6亚型;HIV-1 M组A-G所有亚型、O组、N组;HIV-2组.3.检测灵敏度(≥95%可信限):HBV DNA≤20 IU/ml;HCV RNA≤50 IU/ml;HIV RNA≤51 IU/ml;临床特异性≥99。
7%。
4.★根据国家相关机构质控要求进行质控,试剂含有内标质控(Internal Control),为RNA内标或RNA\DNA双内标,全程监控检测过程,包括核酸提取,扩增及检测步骤,以防止技术性的假阴性。
系统内部有UNG酶防扩增污染控制。
5.试剂使用时操作简便,不需要用专用设备进行孵育融化。
不需要人工配制或分装,不需要开盖,试剂封闭操作,能有效防止交叉污染。
试剂包装容器需带条形码,满足检测设备自动扫描、自动读取判断试剂组分的需要。
6.装载样本及对应耗材试剂后,无需人工值守,直至试验结束接收结果,避免试验污染。
7.实验结束后,试剂架等材料无需84消毒液浸泡处理,方便操作人员对实验室的维护。
病毒核酸检测标准化:标准物质的种类及制备

XXXX医院病毒核酸检测标准化:标准物质的种类及制备病毒核酸检测(nucleic acid test, NAT)现已广泛应用于血液及其制品的病毒筛查、临床抗病毒药物治疗疗效监测等。
但核酸检测容易受到检测样本的基质效应和检测病毒的基因变异等多种因素的影响,使得不同的实验室应用不同的方法学进行核酸检测的结果,在量值、灵敏度和特异性方面常出现较大的差异。
为使不同实验室,不同方法间检测的结果具有可比性,就必须使检测标准化,而标准物质是检测标准化的核心。
第一部分标准物质的种类由于血清中病毒核酸的量值不能单独应用物理和(或)化学的方法进行准确测定,必须通过一定的核酸扩增或杂交过程并经相应的数据处理后才能推测出血清中病毒核酸的原始数值。
所以传统意义的一级参考测量程序(物理和化学方法)和一级标准物质在核酸检测中还不存在。
病毒核酸检测标准物质目前通常分为国际标准物质、国家或地区标准物质和实验室内部的工作制剂等三个等级。
1.核酸检测用国际标准物质(reference material)是指由WHO多中心研究后由专门委员会认可的,经过稳定性和组成完整性检验的,在国际范围内用作有关量的其他标准定值基础的物质,目前均由英国国家生物学标准物质和质控物研究所(National Institute for Biological Standards and Control,NIBSC)研制并提供。
NIBSC于1997年建立了第一代HCVRNA核酸检测用国际标准,分别于1999年、20年、22年和23年建立了第一代HIV-1 RNA、HBV DNA、Human paravovirus B19 和HAVRNA核酸检测用国际标准。
核酸检测用国际标准物质没有高纯度要求,其产量也没必要满足常规实验室要求,通常制备一批次可供5〜10年应用。
2.国家或地区标准物质主要面向一个国家或地区。
在有国际标准物质的情况下,可溯源至国际标准,如卫生部临床检验中心研制的HBV DNA和HCVRNA国家标准物质。
核酸和蛋白质基本性质及操作注意事项

Tm=69.3十0.41(%G十C) (Marmur-Doty关系式 ) = 十 % 十 关系式
形成氢键的特点:特异性很强 形成氢键的特点: 高度的方向性
2.碱基堆集力 . 同一条链中的相邻碱基之间的非 特异性作用力, 特异性作用力,即疏水作用力和 Van der Waal力。 力
(1)加入能减弱疏水作用的试剂可以 加入能减弱疏水作用的试剂可以 消除碱基堆集作用。 消除碱基堆集作用。 (2)DNA样品加热时,碱基堆集作 样品加热时, 样品加热时 用减少,同时伴随A260的增加。 的增加。 用减少,同时伴随 的增加 (3)能够断裂氢键的试剂对于单链 能够断裂氢键的试剂对于单链 DNA的碱基堆集作用没有影响.但 的碱基堆集作用没有影响. 的碱基堆集作用没有影响 是将双链DNA碱基堆集作用减少到 是将双链 碱基堆集作用减少到 变性DNA的程度。 变性 的程度。 的程度
双螺旋的直径为2nm, , 双螺旋的直径为 碱基堆积距离为 0.34nm, , 两个核苷酸之间的夹 角36°, ° 每圈螺旋含10个核苷 每圈螺旋含 个核苷 螺距3.4nm。 酸,螺距 。
二、决定双螺旋结构状态的因素
1.氢键: 在每一个碱基上都有适于形成氢键的供氢体如氨基和羟基以及受氢 .氢键: 在每一个碱基上都有适于形成氢键的供氢体如氨基 羟基以及受氢 氨基和 体如酮基和亚氨基。 为溶解温度) 体如酮基和亚氨基。 (Tm为溶解温度) 酮基 为溶解温度
3.带负电荷的磷酸基的静电斥力
正离子(如 可以中和带负电荷的磷酸基团, 正离子 如Na+) 可以中和带负电荷的磷酸基团,有效地 屏蔽了磷酸基之间的静电斥力, 屏蔽了磷酸基之间的静电斥力,促进了双螺旋结构的稳 定。
4.碱基分子内能
当由于温度等因素使碱基分子内能增加时. 当由于温度等因素使碱基分子内能增加时.碱基的定向排 列遭受破坏,从而削弱碱基的氢键结合力和碱基的堆集力, 列遭受破坏,从而削弱碱基的氢键结合力和碱基的堆集力, 会使DNA双螺旋结构受到破坏。(如加热、高温) 双螺旋结构受到破坏。 如加热、高温) 会使 双螺旋结构受到破坏
核酸制备技术实验报告

一、实验目的1. 理解核酸的基本结构和功能。
2. 掌握从生物样本中提取核酸的方法。
3. 学习核酸纯化和定量分析的基本技术。
4. 了解核酸在分子生物学研究中的应用。
二、实验原理核酸是生物体内携带遗传信息的分子,包括DNA和RNA。
DNA主要存在于细胞核中,而RNA则主要存在于细胞质中。
核酸的提取、纯化和定量分析是分子生物学研究的基础。
三、实验材料1. 样本:动物组织、植物组织、细菌等。
2. 试剂:酚/氯仿、异丙醇、无水乙醇、RNA酶抑制剂、DNA/RNA提取试剂盒等。
3. 仪器:高速离心机、分光光度计、电泳仪等。
四、实验步骤1. 样本处理将样本研磨成粉末,加入适量缓冲液,进行匀浆处理。
2. 酚/氯仿抽提将匀浆液与酚/氯仿混合,剧烈振荡,使蛋白质、脂质等杂质与核酸分离。
3. 离心分离将混合液在高速离心机中以适当速度离心,分离出上层水相(含核酸)和下层有机相(含杂质)。
4. RNA酶抑制剂处理向上层水相中加入RNA酶抑制剂,防止RNA降解。
5. DNA/RNA提取试剂盒提取按照试剂盒说明书进行操作,提取DNA/RNA。
6. 纯化将提取的DNA/RNA通过酚/氯仿、异丙醇、无水乙醇等步骤进行纯化。
7. 定量分析使用分光光度计测定DNA/RNA的浓度,计算其含量。
8. 电泳分析将纯化的DNA/RNA进行琼脂糖凝胶电泳,观察其条带,判断核酸的纯度和完整性。
五、实验结果与分析1. 提取结果成功提取到DNA/RNA,通过分光光度计测定,其浓度在正常范围内。
2. 纯化结果电泳结果显示,提取的DNA/RNA纯度较高,无杂质条带。
3. 定量结果通过分光光度计测定,DNA/RNA的浓度符合预期。
4. 电泳结果DNA/RNA条带清晰,无降解现象。
六、实验讨论1. 核酸提取过程中,选择合适的样本和试剂至关重要。
2. 酚/氯仿抽提和离心分离是提取核酸的关键步骤,需严格控制操作条件。
3. RNA酶抑制剂的使用可防止RNA降解,提高提取效率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
核酸、蛋白技术参数资料、分子量标准及常用试剂的配制•一、核酸及蛋白质常用数据1.核苷三磷酸的物理常数2.常用核酸的长度与分子量3.常用核酸蛋白换算数据(1)重量换算1μg=10-6g 1pg=10-12g 1ng=10-9g 1fg=10-15g (2)分光光度换算:1A260双链DNA=50μg/ml 1A260单链DNA=30μg/ml 1A260单链RNA=40μg/ml (3)DNA摩尔换算:1μg 100bp DNA=1.52pmol=3.03pmol末端1μg pBR322 DNA=0.36pmol 1pmol 1000bp DNA=0.66μg 1pmol pBR322=2.8μg 1kb双链DNA(钠盐)=6.6×105道尔顿1kb 单链DNA(钠盐)=3.3×105道尔顿1kb单链RNA(钠盐)=3.4×105道尔顿(4)蛋白摩尔换算:100pmol分子量100,000蛋白质=10μg 100pmol分子量50,000蛋白质=5μg 100pmol分子量10,000蛋白质=1μg 氨基酸的平均分子量=126.7道尔顿(5)蛋白质/DNA换算:1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质10,000MW蛋白质=270bp DNA 30,000MW蛋白质=810bp DNA 50,000MW蛋白质=1.35kb 100,000MW蛋白质=2.7kb DNA4.常用蛋白质分子量标准参照物5.常用DNA分子量标准参照物a:以水为溶剂的抗生素贮存液通过0.22μm滤器过滤除菌。
以乙醇为溶剂的抗生素溶液无须除菌处理。
所有抗生素溶液均应放于不透光的容器保存。
b:镁离子是四环素的拮抗剂,四环素抗性菌的筛选应使用不含镁盐的培养基(如LB培养基)。
五、常用贮存液的配制1.30%丙烯酰胺溶液【配制方法】将29g丙烯酰胺和1g N,N’-亚甲双丙烯酰胺溶于总体积为60ml的水中。
加热至37℃溶解之,补加水至终体积为100ml。
用Nalgene滤器(0.45μm孔径)过滤除菌,查证该溶液的pH值应不大于7.0,置棕色瓶中保存于室温。
【注意】丙烯酰胺具有很强的神经毒性并可以通过皮肤吸收,其作用具累积性。
称量丙烯酰胺和亚甲双丙烯酰胺时应戴手套和面具。
可认为聚丙烯酰胺无毒,但也应谨慎操作,因为它还可能会含有少量未聚合材料。
一些价格较低的丙烯酰胺和双丙烯酰胺通常含有一些金属离子,在丙烯酰胺贮存液中加入大约0.2体积的单床混合树脂(MB-1Mallinckrodt),搅拌过夜,然后用Whatman 1号滤纸过滤以纯化之。
在贮存期间,丙烯酰胺和双丙烯酰胺会缓慢转化成丙烯酰和双丙烯酸。
2.40%丙烯酰胺【配制方法】把380g丙烯酰胺(DNA测序级)和20g N,N’-亚甲双丙烯酰胺溶于总体积为600ml的蒸馏水中。
继续按上述配制30%丙烯酰胺溶液的方法处理,但加热溶解后应以蒸馏水补足至终体积为1L。
【注意】见上述配制30%丙烯酰胺的说明,40%丙烯酰胺溶液用于DNA序列测定。
3.放线菌素D溶液【配制方法】把20mg放线菌素D溶解于4ml 100%乙醇中,1:10稀释贮存液,用100%乙醇作空白对照读取OD440值。
放线菌素D(分子量为1255)纯品在水溶液中的摩尔消化系数为21,900,故而1mg/ml的放线菌素D溶液在440nm处的吸光值为0.182,放线菌素D的贮存液应放在包有箔片的试管中,保存于-20℃。
【注意】放线菌素D是致畸剂和致癌剂,配制该溶液时必须戴手套并在通风橱内操作,而不能在开放在实验桌面上进行,谨防吸入药粉或让其接触到眼睛或皮肤。
药厂提供的作治疗用途的放线菌素D制品常含有糖或盐等添加剂。
只要通过测量贮存液在440nm波长处的光吸收确定放线菌素D的浓度,这类制品便可用于抑制自身引导作用。
4.0.1mol/L腺苷三磷酸(ATP)溶液【配制方法】在0.8ml水中溶解60mg ATP,用0.1mol/L NaOH调至pH值至7.0,用蒸馏水定容1ml,分装成小份保存于-70℃ 5.10mol/L乙酸酰溶液【配制方法】把770g乙酸酰溶解于800ml水中,加水定容至1L后过滤除菌。
6.10%过硫酸铵溶液【配制方法】把1g过硫酸铵溶解于终量为10ml的水溶液中,该溶液可在4℃保存数周。
7.BCIP溶液【配制方法】把0.5g的5-溴-4-氯-3-吲哚磷酸二钠盐(BCIP)溶解于10ml 100%的二甲基甲酰胺中,保存于4℃ 8.2×BES缓冲盐溶液【配制方法】用总体积90ml的蒸馏水溶解1.07g盐溶液BES[N,N-双(2-羟乙基)-2-氨基乙磺酸]、1.6g NaCl和0.027g Na2HPO4,室温下用HCl调节该溶液的pH值至6.96、然后加入蒸馏水定容至100ml,用0.22μm滤器过滤除菌,分装成小份,保存于-20℃。
9.1mol/L CaCl2溶液【配制方法】在200ml蒸馏水中溶解54g CaCl2·6H2O,用0.22μm滤器过滤除菌,分装成10ml小份贮存于-20℃。
【注意】制备感受态细胞时,取出一小份解冻并用蒸馏水稀释至100ml,用Nalgene滤器(0.45μm孔径)过滤除菌,然后骤冷至0℃。
10.2.5mol/L CaCl2溶液【配制方法】在20ml蒸馏水中溶解13.5g CaCl2·6H2O,用0.22μm 滤器过滤除菌,分装成1ml小份贮存于-20℃。
11.1mol/L二硫苏糖醇(DTT)溶液【配制方法】用20ml 0.01mol/L乙酸钠溶液(pH5.2)溶解3.09g DTT,过滤除菌后分装成1ml小份贮存于-20℃。
【注意】DTT或含有DTT的溶液不能进行高压处理。
12.脱氧核苷三磷酸(dNTP)溶液【配制方法】把每一种dNTP溶解于水至浓度各为100mmol/L左右,用微量移液器吸取0.05mol/l Tris碱分别调节每一dNTP溶液的pH值7.0(用pH试纸检测),把中和后的每种dNTP溶液各取一份作适当稀释,在下表中给出的波长下读取光密度计算出每种dNTP的实际浓度,然后用水稀释成终浓度为50mmol/L的比色杯光径为1cm时,吸光度=εM 13.0.5mol/l EDTA(pH8.0)溶液【配制方法】在800ml水中加入186.1g二水乙二胺四乙酸二钠(EDTA-Na·2H2O),在磁力搅拌器上剧烈搅拌,用NaOH调节溶液的pH值至8.0(约需20g NaOH颗粒)然后定容至1L,分装后高压灭菌备用。
【注意】EDTA二钠盐需加入NaOH将溶液的pH值调至接近8.0,才能完全溶解。
14.溴化乙锭(10mg/ml溶液)【配制方法】在100ml 水中加入1g溴化乙锭,磁力搅拌数小时以确保其完全溶解,然后用铝箔包裹容器或转移至棕色瓶中,保存于室温。
【注意】小心:溴化乙锭是强诱变剂并有中度毒性,使用含有这种染料的溶液时务必戴上手套,称量染料时要戴面罩。
15.2×HEPES缓冲盐溶液【配制方法】用总量为90ml的蒸馏水溶解1.6g NaCl、0.074g KCl、0.027g Na2PO4·2H2O、0.2g葡聚糖和1gHEPES,用0.5mol/l NaOH调节pH值至7.05,再用蒸馏水定容至100ml。
用0.22μm滤器过滤除菌,分装成5ml小份,贮存于-20℃。
16.IPTG 溶液【配制方法】IPTG为异丙基硫代-β-D-半乳糖苷(分子量为238.3),在8ml 蒸馏水中溶解2g IPTG后,用蒸馏水定容至10ml,用0.22μm滤器过滤除菌,分装成1ml 小份贮存于-20℃。
17.1mol/L乙酸镁溶液【配制方法】在800ml水中溶解214.46g四水乙酸镁,用水定容至1L过滤除菌。
18.1mol/L MgCl2溶液【配制方法】在800ml水中溶解203.4g MgCl2·6H2O,用水定容至1L,分装成小份并高压灭菌备用。
【注意】MgCl2极易潮解,应选购小瓶(如100g)试剂,启用新瓶后勿长期存放。
19.β-巯基乙醇(BME)溶液【配制方法】一般得到的是14.4mol/L 溶液,应装在棕色瓶中保存于4℃。
【注意】BME或含有BME的溶液不能高压处理。
20.NBT溶液【配制方法】把0.5g氯化氮蓝四唑溶解于10ml 70%的二甲基甲酰胺中,保存于4℃。
21.酚/氯仿溶液【配制方法】把酚和氯仿等体积混合后用0.1mol/L Tris·HCl(pH7.6)抽提几次以平衡这一混合物,置棕色玻璃瓶中,上面覆盖等体积的0.01mol/l Tris·HCl(pH7.6)液层,保存于4℃。
【注意】酚腐蚀性很强,并可引起严重灼伤,操作时应戴手套及防护镜,穿防护服。
所有操作均应在化学通风橱中进行。
与酚接触过的部位皮肤应用大量的水清洗,并用肥皂和水洗涤,忌用乙醇。
22.10mmol/L苯甲基磺酰氟(PMSF)溶液【配制方法】用异丙醇溶解PMSF成1.74mg/ml(10mmol/L),分装成小份贮存于-20℃。
如有必要可配成浓度高达17.4mg/ml 的贮存液(100mmol/L)。
【注意】PMSF严重损害呼吸道粘膜、眼睛及皮肤,吸入、吞进或通过皮肤吸收后有致命危险。
一旦眼睛或皮肤接触了PMSF,应立即用大量水冲洗之。
凡被PMSF污染的衣物应予丢弃。
PMSF在水溶液中不稳定。
应在使用前从贮存液中现用现加于裂解缓冲液中。
PMSF在水溶液中的活性丧失速率随pH值的升高而加快,且25℃的失活速率高于4℃。
pH值为8.0时,20μmmol/l PMSF水溶液的半寿期大约为85min,这表明将PMSF溶液调节为碱性(pH>8.6)并在室温放置数小时后,可安全地予以丢弃。
23.磷酸盐缓冲溶液(PBS)溶液【配制方法】在800ml蒸馏水中溶解8g NaCl、0.2g KCl、1.44g Na2HPO4和0.24g KH2PO4,用HCl调节溶液的pH值至7.4加水定容至1L,在15lbf/in2(1034×105Pa)高压下蒸气灭菌20min。
保存于室温。
24.1mol/L乙酸钾(pH7.5)溶液【配制方法】将9.82g乙酸钾溶解于90ml纯水中,用2mol/L 乙酸调节pH值至7.5后加入纯水定容到1L,保存于-20℃。
25.乙酸钾溶液(用于碱裂解)【配制方法】在60ml 5mol/L乙酸钾溶液中加入11.5ml冰乙酸和28.5ml 水,即成钾浓度为3mol/L而乙酸根浓度为5mol/L的溶液。
26.3mol/L乙酸钠(pH5.2和pH7.0)溶液【配制方法】在80ml水中溶解408.1g三水乙酸钠,用冰乙酸调节pH值至5.2或用稀乙酸调节pH值至7.0,加水定容到1L,分装后高压灭菌。
