【实用】医院台账-药品不良反应报告表
2020医院台账-药品不良反应报告表

不良反应/事件的结果:痊愈□好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□导致死亡□
关联性评价
报告人评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告人信息
联系电话:
职业:医生□药师□护士□其他□
电子邮箱:
签名:
报告单位信息
单位名称:
联系人:
电话:
报告日期:年月日
生产企业请
填写信息来源
医疗机构□ 经营企业□个人□文献报道□上市后研究□其他□
药 品 不 良 反 应 / 事 件 报 告 表
首次报告□ 跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□ 生产企业□ 个人□ 其他□
患者姓名:
性别:男□女□
出生日期:年月日
或年龄:
民族:
体重(kg):
联系方式:
原患疾病:
医院名称:
病历号/门诊号:
既往药品不良反应/事件:有□无□不详□
备注
家族药品不良反应/事件:有□无□不详□
相关重要信息:吸烟史□ 饮酒史□ 妊娠期□ 肝病史□ 肾病史□ 过敏史□其他□
药品
批准文号
商品名称
通用名称
(含剂型)
生产厂家
生产批号
用法用量
(次剂量、途径பைடு நூலகம்日次数)
药品不良反应、事件报告表
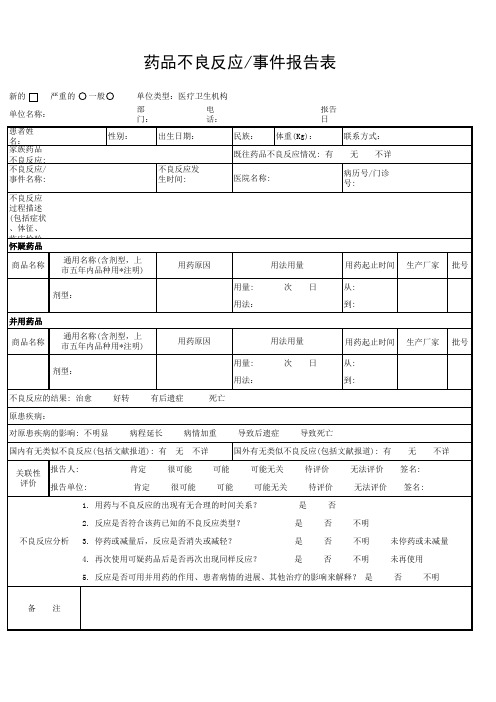
国内有无类似不良反应(包括文献报道): 有 关联性 评价 报告人: 肯定
国外有无类似不良反应(包括文献报道): 有 可能 可能 可能无关 可能无关 待评价 待评价 是 是 是 是 否 不明 不明 无法评价 无法评价
很可能 很可能
报告单位: 肯定
1. 用药与不良反应的出现有无合理的时间关系? 2. 反应是否符合该药已知的不良反应类型? 不良反应分析 3. 停药或减量后,反应是否消失或减轻? 4. 再次使用可疑药品后是否再次出现同样反应?
药品不良反应/事件报告表
新的 严重的 一般 单位类型:医疗卫生机构 部门: 性别: 无 不详 不良反应发生时间: 医院名称: 不良反应过程描述(包括症状、体征、临床检验等)及处理情况: 病历号/门诊号: 出生日期: 电话: 民族: 体重(Kg): 报告日期: 联系方式: 无 不详 单位名称: 患者姓名: 家族药品不良反应: 有 不良反应/事件名称:
既往药品不良反应情剂型,上 市五年内品种用*注明) 剂型: 用法: 并用药品 商品名称 通用名称(含剂型,上 市五年内品种用*注明) 剂型: 用法: 不良反应的结果: 治愈 原患疾病: 对原患疾病的影响: 不明显 病程延长 无 病情加重 不详 导致后遗症 导致死亡 无 签名: 签名: 不详 好转 有后遗症 死亡 用药原因 用量: 用法用量 次 日 用药起止时间 从: 到: 生产厂家 批号 用药原因 用量: 用法用量 次 日 用药起止时间 从: 到: 生产厂家 批号
否 否 否
未停药或未减量 未再使用 否 不明
不明
5. 反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释? 是
备 注
报告人职业:
报告人职务/职称:
报告人签名:
药品不良反应报告表

药品不良反应报告表(生产、经营企业使用)
企业名称:电话:报告日期:年月日
患者姓名
性别:男□女□
出生日期:年月日
民族:
体重:(kg)
家族药品不良反应:有□无□不详□
病历号/门良反应情况
电话
有□无□不详□
原患疾病:
不良反应名称:
商品名
国际非专利名
批号
剂型
年销售量
年产量
怀疑引起
不良反应
的药品
并用
药品
曾在国内、外发生的不良反应情况(包括报刊杂志报道情况)
国内:
国外:
其它:
报告人职务、职称:
报告人签名:
不良反应发生时间:
年月日
不良反应的表现:
不良反应处理情况:
不良反应的结果治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日
对原患疾病的影响:不明显□病程延□病情加重□表现:导致死亡□
关联性评价:
省级ADR监测机构:肯定□很可能□可能□不太可能□未评价□无法评价□签名:
国家ADR监测中心:肯定□很可能□可能□不太可能□未评价□无法评价□签名:
药物不良反应报告表

药物不良反应报告表
药物不良反应报告表是一种重要的医学文书,它记录了药物治疗中的不良反应情况,有助于医生进行有效的治疗和防止病人出现不良后果。
以下是一份药物不良反应报告表的范例,供医生参考:
一、基本信息
姓名:xxx 性别:男/女年龄:xx岁住址:xxxxxxxx
病史:xxxxx
二、用药信息
药品名称:xxxxx 厂家:xxxxx 批号:xxxxx
用药剂量:xxxxx 用药时长:xxxxx
给药方式:口服/注射等
三、不良反应信息
表现症状:xxxxx
发生时间:xxxxx
严重程度:轻/中/重
处理方法:xxxxx
是否再次应用药品:是/否四、病人反应信息
语言描述:xxxxx
病人签字:_________
五、报告人信息
报告人姓名:xxxxx
报告人联系方式:xxxxx
报告日期:xxxxx
以上为药物不良反应报告表的基本信息和范例,医生们在进行
药物治疗时应该注意认真记录患者的药物使用情况和不良反应状况,及时进行统计和分析,以便更有效地进行治疗和预防。
同时,医生也应该积极鼓励患者配合填写不良反应报告表,共同维护医
学治疗的公平、科学和安全。
药品不良反应报告表(模版)

附表1药品不良反应 / 事件报告表(书写模版)首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□电子邮箱:签名:报告单位信息单位名称:联系人:电话:报告日期:年月日生产企业请医疗机构□经营企业□个人□文献报道□上市后研究□其他□填写信息来源备注药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
药物不良反应登记表范文

药物不良反应登记表范文一、患者基本信息。
1. 姓名:张三。
2. 性别:男。
3. 年龄:35岁。
4. 联系方式:138xxxxxxxx。
5. 职业:程序员(天天对着电脑敲代码,可忙乎了)二、用药情况。
1. 药物名称:[具体药名],这药据说对[病症]效果很好,才用的。
2. 用药目的:治疗感冒引起的头疼、咳嗽啥的,感冒可把我折腾惨了,就指望着这药让我快点好呢。
3. 用药剂量和用法:按照说明书上写的,一次吃两粒,一天三次,就像每天按时打卡上班一样,我可不敢乱吃。
4. 开始用药时间:[具体日期],就从那天开始,踏上了这有点“坎坷”的用药之旅。
三、不良反应情况。
1. 不良反应发生时间:吃了大概两次药之后,就感觉不太对劲了。
就像突然有个小怪兽在身体里捣乱一样。
2. 不良反应的症状。
头晕目眩:感觉脑袋像个拨浪鼓,晕乎乎的,看东西都有点重影,就像喝醉了酒似的,可我滴酒未沾啊。
肠胃不舒服:肚子里咕噜咕噜直叫,像是有一群小动物在开音乐会,然后就开始拉肚子,一趟趟跑厕所,我都快和厕所“结拜”了。
皮肤瘙痒:身上就像有无数只小蚂蚁在爬,忍不住想去挠,挠得身上一道道红印子,都快成“花脸猫”了。
3. 不良反应的严重程度:对我来说,这算是中度的不良反应吧。
虽然没有到完全不能动的地步,但也严重影响了我的正常生活,工作都没法好好干了,代码敲得错误百出。
四、采取的措施。
1. 自行处理情况:我先自己停了药,然后喝了好多温水,想着把这“坏东西”都排出去,还吃了点家里备着的止泻药,但是皮肤瘙痒和头晕没什么改善。
2. 就医情况:实在扛不住了,就赶紧跑去医院。
医生又是检查又是询问的,最后给我开了点药来缓解这些不良反应,还让我好好休息。
五、对不良反应的看法或疑问。
我就想知道,这药怎么会有这么大的反应呢?是不是我体质特殊啊?以后再用药可真得小心点了,可不想再经历一次这样的“折磨”了。
这药以后还能不能用呢?希望能有个明确的说法,不然心里老是犯嘀咕。
药品不良反应报告表

不良反应的结果:治愈□ 好转□ 有后遗症□
表现: 死亡□ 直接死因□ 死亡时间: 年 月 日
对原患疾病的影响:不明显□ 病程延长□ 病情加重□ 导致后遗症□ 导致死亡□
关联性评价
省级ADR监测机构:肯定□很可能□可能□不大可能□未评价□无法评价□签名:
国家ADR监测中心:肯定□很可能□可能□不大可能□未评价□无法评价□签名:
药品不良反应报告
企业名称:Байду номын сангаас电话: 报告日期: 年 月 日
患者姓名
性别:
男□女□
出生日期: 年 月 日
民族
体重(kg)
国家药品不良反应:
有□无□不详□
病历号/门诊号
工作单位或住址:
电话:
既往药品不良反应情况:有□无□不详□
原患疾病:
不良反应名称:
不良反应发生时间:
年 月 日
不良反应的表现:
(包括临床检验)
商品名
国际非专利名
生产企业
批号
剂型
进货渠道
生产日期
怀疑引起不良反应的药品
并用药品
曾在国内、外发生的不良反应情况(包括报刊杂志报道情况)
国内:
国外:
其它:
报告人单位: 职务: 报告人签名:
药品不良反应报表

附表1药品不良反应/ 事件报告表新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□单位名称:郑州煤炭工业(集团)有限责任公司总医院部门:电话:报告日期:年月日◇不良反应/事件分析1.用药与不良反应/事件的出现有无合理的时间关系?有□无□2.反应是否符合该药已知的不良反应类型?是□否□不明□3.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□4.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□5.反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否□不明□◇严重药品不良反应/事件是指有下列情形之一者:①引起死亡□②致畸、致癌或出生缺陷□③对生命有危险并能够导致人体永久的或显著的伤残□④对器官功能产生永久损伤□⑤导致住院或住院时间延长□◇编码规则:省(自治区、直辖市) 市(地区)县(区)单位年代流水号□□□□□□□□□□□□□□□□□□□注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和国行政区划代码填写。
单位编码第一位如下填写:医疗机构1、军队医院2、计生机构3、生产企业4、经营企业5。
个人报告单位编码一栏填写6000◇注:通用名称一栏,首次获准进口5年内的进口品种用*注明国家药品不良反应监测中心药品不良反应监测中心通信地址:北京市崇文区法华南里11号楼二层通信地址:邮编:100061 邮编:电话:(010)67164979 电话:传真:(010)67184951 传真:E – mail :report@ E – mail药品不良反应报告表要点填写详细要求1、报告日期:是指不良反应报告填写时间。
2、体重:①注意以千克(公斤)为单位。
②如果不知道准确的体重,请做一个最佳的估计。
3、联系方式:①最好填写患者的联系电话或者移动电话。
②如果填写患者的通信地址,请附上邮政编码。
4、家族药品不良反应/事件:①根据实际情况正确选择。
药品不良反应报告表(示范模板)

附表1药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降(80/50mmHg)等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一下相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。
药品不良反应事件报告表

单位名称: 患者姓名: 不良反应/事件名称: 部门: 性别: 无 不详 电话: 出生日期: 民族: 报告日期: 体重: 无 年 月 日 既往药品不良反应/事件情况:有 不良反应/事件发生时间:
家族药品不良反应/事件:有
不
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
事件报告表
报告日期: kg 联系方式: 无 不详 月 日 病历号/单位:
不良反应/事件情况:有
年
剂量
用药起止时间 用法
用药原因
直接死因:
死亡时间:
表现 1有 2无 3不详
导致死亡
类似不良反应
签名: 签名: 5无法评价 5无法评价 签名: 签名:
3不明 4未停药或未减量 4未再使用 3不明
1是 1是 1是 1是
2否 2否 2否 2否 1是 3不明 3不明 3不明 2否
5. 反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?
严重药品不良反应/事件是指下列情形之一者: 1、引起死亡 2、致畸、致癌、致出生缺陷 3、对生命有危险并能够导致人体永久的或显著的伤残 4、对器官功能产生永久损伤 5、导致住院或住院时间延长 报告人职业: 1、医生 2、医师 3、护士 4、其他 报告人:
批准文号 商品名称
通用名称(含剂型)
生产厂家
批号
怀疑药品
并用药品
不良反应/事件的结果:治愈 原患疾病: 对原患疾病的影响: 1不明显 国内有无类似不良反应好转ຫໍສະໝຸດ 有后遗症表现:死亡:
2病程延长3病情加重4导致后遗症 1有 2无 3不详 国外有无类似不良反应
报告人: 1肯定 关联性评价 报告单位: 1肯定
药品不良反应报告表模板

药品不良反应报告表模板注意事项:填写药品不良反应报告表时,需要注意以下几点:一、药品不良反应事件名称及描述1.要分类描述皮疹和瘙痒,描述发生部位和形态;2.多种过敏反应可以直接描述为“过敏反应”或“过敏样反应”,其他症状需要分类描述;3.过敏性休克需要描述临床表现和体征,包括呼吸道阻塞、微循环障碍、中枢神经系统症状和皮肤过敏症状,以及体温、心率、血压、呼吸频率等;4.血象异常需要描述不良反应发生前后的指标和实验室检查;5.消化道反应需要具体描述相关症状,如腹泻、呕吐等。
二、药品不良反应发生后采取的措施及转归1.需要详细描述采取的治疗措施,如立即停药、给予抗过敏治疗、给予升白细胞治疗、给予物理降温等;2.需要描述患者采取对症治疗后的转归。
备注:填写药品不良反应/事件报告表时,可以参考提供的模板。
在上报药品不良反应时,应按照国家规定的时限进行上报。
患者因慢性鼻窦炎入院治疗,给予克林霉素0.6克/1日2次静脉滴注抗感染,并在2月4日行右侧副鼻窦开放+右侧下鼻甲部分切除术,术后使用醋酸去氨加压素止血。
2月5日夜间患者出现恶心、呕吐,呕吐物为胃内容物,无头痛、头昏、畏寒、发热、意识障碍等不适,予以胃复安10mg肌注治疗。
患者持续呕吐至次日清晨缓解。
怀疑为药品所致不良反应,停止使用醋酸去氨加压素及克林霉素。
次日患者未再出现胃肠道不适。
患者因消化道出血导致缺铁性贫血,伴胃肠炎入院治疗。
在7月5日至8日期间,一直给予氨甲环酸氯化钠止血,并在7月8日给予头孢硫脒对症胃肠炎。
同时,因患者头晕,给予参麦注射液。
实验室检查血红蛋白(Hbg):50g/L,中重度贫血。
7月9日患者症状缓解,未继续给予参麦。
7月10日患者主诉头晕,继续给予参麦对症,在静脉滴注参麦注射液10分钟后出现不明诱因的寒战,持续20分钟,血压:104mmHg/68mmHg,心率:98次。
立即停药,给予氢化可的松琥珀酸钠150mg静脉滴注及异丙嗪25mg肌肉注射,在氢化可的松静滴后15分钟左右出现高热,体温38.5度,伴有呼吸困难,呼吸频率:22次。
药品不良反应报告表1

药品不良反应/事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构经营企业□生产企业□个人□其他□
并用药品:若输液到A出现反应,则当天在A药之前是否有用过可能引起该反应的B药或者是C药,则B、C药为并用药品,或者在A药之前未用药,则并用药品可以不写
若A、B、C药同时用了几天才出现不良反应,经过分析,怀疑A药是主要引起反应的药品,则A药为怀疑药品,若B、C药也有可能引起该反应,则B、C药为并用药品
不良反应/事件的结果:痊愈□好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□导致死亡□
关联性评价
报告人评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告人信息
联系电话:
职业:医生□药师□护士□其他□
电子邮箱:
签名:
报告单位信息
单位名称:
联系人:
电话:
报告日期:年 月 日
生产企业请
填写信息来源
医疗机构□经营企业□个人□文献报道□上市后研究□其他□
用法用量
(次剂量、途径、日次数)
用药起止间
用药原因
怀疑药品
并用药
品
不良反应/事件名称:药品不良反应
不良反应/事件发生时间:2015年11月26日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
药品不良反应事件报告表模版

药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1、如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2、如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3、如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4、如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5、如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。
大家应当按照规定时限完整的对药品不良反应进行上报。
附表药品不良反应 / 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□。
药品不良反应报告表

报告人评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告人信息
联系电话:
职业:医生□药师□护士□其他□
电子邮箱:
签名:
报告单位信息
单位名称:
联系人:
电话:
报告日期:年 月 日
生产企业请
填写信息来源
医疗机构□经营企业□个人□文献报道□上市后研究□其他□
不良反应/事件的结果:痊愈□好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□导致死亡□
相关重要信息:吸烟史□饮酒史□妊娠期□肝病史□肾病史□过敏史□其他□
药品
批准文号
商品名称
通用名称
(次剂量、途径、日次数)
用药起止时间
用药原因
怀疑药品
并用药
品
不良反应/事件名称:
不良反应/事件发生时间: 年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
备注
药品不良反应/事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
患者姓名:
性别:男□女□
出生日期:年 月 日
或年龄:
民族:
体重(kg):
联系方式:
原患疾病:
医院名称:
病历号/门诊号:
药品不良反应报告表

对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□导致死亡□
关联性
评价
省级ADR监测机构:肯定□很可能□可能□不大可能□未评价□无法评价□
签名:
国家ADR监测中ቤተ መጻሕፍቲ ባይዱ:肯定□很可能□可能□不大可能□未评价□无法评价□
签名:
商品名称
国际非专利名
生产企业
批号
剂型
进货渠道
生产日期
怀疑引起不良反应的药品
并用药品
曾在国内、外发生的不良反应情况(包括报刊杂志报道情况)
国内:
国外:
其他:
报告人单位:职务:报告人签字:
药品不良反应报告表
企业名称:电话:报告日期:
患者姓名:
性别:
男□女□
出生日期:
年月日
民族:
体重(kg)
国家药品不良反应:
有□无□不详□
病历号/门
诊号
工作单位或住址:
电话:
既往药品不良反应情况:有□无□不详□
原患疾病:
不良反应名称:
不良反应发生时间:
不良反应的表现:
(包括临床检验)
不良反应处理情况:
不良反应的结果:治愈□好转□有后遗症□
药品不良反应报告表范例 .doc

药品不良反应报告表范例 .doc
药品不良反应记录
日期:xxxx年xx月xx日
药品名称:xxxx
制剂规格:xxxx
生产企业:xxxx
患者信息:
姓名:xxx
性别:xxx
年龄:xxx
病情/疾病诊断:xxx
不良反应记录:
1.反应名称:xxxx
发生时间:xxxx年xx月xx日xx时xx分
反应描述:患者出现了xxxx的症状,包括xxxx。
症状持续时间约为xx小时/天。
患者对此感到不适,并报告给医生。
处理措施:对患者的症状进行了观察,同时给予了xxxx的治疗。
结果:患者在接受治疗后,症状逐渐缓解,并在xx天后完全消失。
2.反应名称:xxxx
发生时间:xxxx年xx月xx日xx时xx分
反应描述:患者出现了xxxx的症状,包括xxxx。
症状持续时间约为xx小时/天。
患者对此感到不适,并报告给医生。
处理措施:对患者的症状进行了观察,同时给予了xxxx的治疗。
结果:患者在接受治疗后,症状逐渐缓解,并在xx天后完全消失。
备注:
1.患者的不良反应于xx年xx月xx日报告给医生,并得到及时处理。
2.对患者的不良反应进行了详细的记录,包括症状的描述、发生时间、处理措施和疗效结果。
3.患者在接受治疗后的症状得到缓解,并无其他严重不良反应发生。
以上是患者使用该药品期间出现的不良反应的详细记录。
如有进一步需要,请及时与我联系。
医师签名:xxxx
日期:xxxx年xx月xx日。
药品不良反应报告表
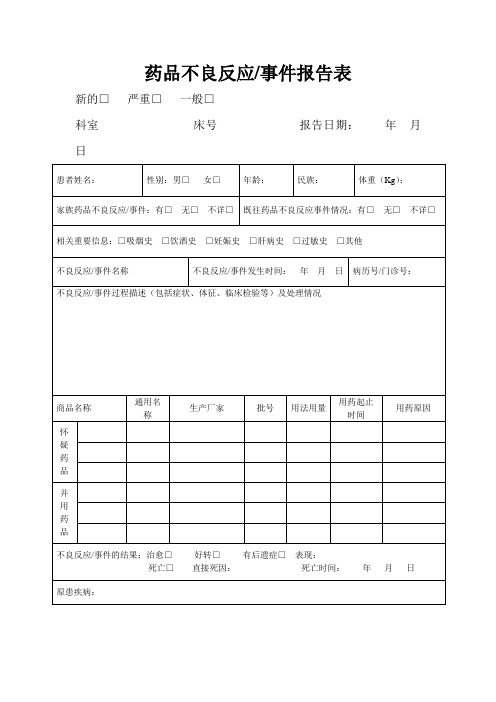
药品不良反应/事件报告表
新的□严重□一般□
科室床号报告日期:年月日
患者姓名:性别:男□女□年龄:民族:体重(Kg):
家族药品不良反应/事件:有□无□不详□既往药品不良反应事件情况:有□无□不详□相关重要信息:□吸烟史□饮酒史□妊娠史□肝病史□过敏史□其他
不良反应/事件名称不良反应/事件发生时间:年月日病历号/门诊号:
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况
商品名称通用名
称
生产厂家批号用法用量
用药起止
时间
用药原因
怀
疑
药
品
并
用
药
品
不良反应/事件的结果:治愈□好转□有后遗症□表现:
死亡□直接死因:死亡时间:年月日原患疾病:
对原患疾病的影响:不明显□病程延长□病情加重□
导致后遗症□表现:导致死亡□。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
相关重要信息:吸烟史□ 饮酒史□ 妊娠期□ 肝病史□ 肾病史□ 过敏史□其他□
药品
批准文号
商品名称
通用名称
(含剂型)
生产厂家
生产批号
用法用量
(次剂量、途径、日次数)
用药起止时间
用药原因
怀疑药品
并用药
品
不良反应/事件名称:
不良反应/事件发生时间:年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
\
不良反应/事件的结果:痊愈□好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□导致死亡□
药 品 不 良 反 应 / 事 件 报 告 表
首次报告□ 跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□ 生产企业□ 个人□ 其他□
患者姓名:
性别:男□女□
出生日期:年月日
或年龄:
民族:
体重(kg):
联系方式:
原患疾病:
医院名称:
病历号/门诊号:
既往药品不良反应/事件:有□无□不详□
关联性评价
报告人评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位评价: 肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告人信息
联系电话:
职业:医生□药师□护士□其他□
电子邮箱:
签名:
报告单位信息
单位名称:
联系人:
电话:
报告日期:年月日
生产企业请
填写信息Байду номын сангаас源
医疗机构□ 经营企业□个人□文献报道□上市后研究□其他□
备注
