电位滴定法优秀课件
合集下载
电位滴定法.ppt

永停电位滴定法的应用
重氮滴定:取供试品适量,精密称定,置烧杯中, 可加水40ml与盐酸溶液(1→2)15ml,而后置电磁搅拌 器上,搅拌使溶解,再加溴化钾2g,插入铂-铂 电极后,将滴定管的尖端插入液面下约2/3处,用亚 硝酸钠滴定液(0.1mol/L或0.05mol/L)迅速滴定,随滴随 搅拌,至近终点时,将滴定管的尖端提出液面, 用少量水淋洗尖端,洗液并入溶液中,继续缓缓 滴定,至电流计指针突然偏转,并不再回复,即 为滴定终点。 水分测定:用作水分测定的终点指示时,可调节 R<[1]>使电流计的初始电流为5~10μA,待滴定 到电流突增至50~150μA,并持续数分钟不退回, 即为滴定终点。
电位滴定法与永停滴定法
北京市药品检验所 周立春
电位滴定法的原理
电位滴定法是一种利用电极电位的突越来确定终 点的分析方法。进行电位滴定时,在溶液中插入 待测离子的指示电极和参比电极组成化学电池, 随着滴定剂的加入,由于发生化学反应,待测离 子浓度不断发生变化,指示电极的电位随着发生 变化,在计量点附近,待测离子的浓度发生突变, 指示电极的电位发生相应的突跃。因此,测量滴 定过程中电动势的变化,就能确定滴定反应的终 点,求出试样的含量。
手动计算实例(一)
以0.1000mol/LAgNO3滴定25.00mlNaCl试 样溶液,E为电池电动势(v-伏或mv-毫 伏),V为体积—ml
加入AgNO3的体 积V(ml)
E/v
5.00 15.00 20.00 22.00 23.00 24.00
0.062 0.085 0.107 0.123 0.138 0.146
药典中收载的品种
非水滴 酸碱滴 硝酸汞 银量法 碘量法 永停滴
定
定
电位滴定法测氯离子ppt课件

3、氯化物对人和温血动物的危害
水中氯化物浓度超过1500mg/L时,对牛、羊、猪等 家畜和家禽有危害,当浓度超过4000mg/L时,可以使 上述动物死亡。但是当水中阳离子为镁,氯化物浓度 为100mg/L时,即可使人致毒。
4、氯化物对生生物的危害
一般认为氯化物对淡水生物的毒性很小,但当水中 氯化物的浓度较高时,可以致鱼类死亡。氯化物对水 生物的毒性不仅与氯化物的浓度有关,也与水中存在 的阳离子有密切关系。
2、水样的测定
水样如果比较清洁,可取适量水样(氯化物含量不超过 10mg)置于250 ml烧杯中,加硝酸使pH3~5,按标定硝酸银 标准溶液的方法进行电位滴定。
污染较小的水样可加硝酸处理。如果水样中含有机物、 氰化物、亚硫酸盐或者其他干扰物,可于100ml水样中加1+1 硫酸,使溶液呈酸性,煮沸5分钟除去挥发物。必要时,再 加入适量硫酸使溶液保持酸性,然后加入3 ml过氧化氢煮沸 15分钟,并经常添加蒸馏水保持溶液体积在50 ml以上。加 入氢氧化钠溶液使呈碱性,再煮沸5分钟,冷却后过滤,用 水洗沉淀和滤纸,洗涤液和滤液定容后供测定用。亦可在 煮沸冷却后定容,静置使沉淀,取上清液进行测定。取适 量经预处理的水样,加硝酸使呈酸性,并过量0.5 ml(约10 滴),然后标定硝酸银标准溶液的方法进行电位测定。
和相对应的阳离子共同作用,使水产生不同的味觉, 使水质产生感官性状的恶化。如当水中氯化物浓度为 250mg/L,阳离子为钠时,人就会察觉出咸味。 2、氯化物对植物的危害
通常情况下,植物对低或稍高浓度的氯化物,出一 些特别敏感的植物种类外,都有一定忍耐能力,当氯 化物为100—350mg/L时,才会对一般植物有致毒作用。
在人类的生存活动中,氯化物有很重要的生理作用 和工业用途。
电位滴定法PPT课件

• 例如:对应于 24.30ml: 同理,对应于24.40ml:
第28页/共43页
滴定终点确定的方法
1、E-V 曲线法
以加入滴定剂的体积V (ml)为横坐标、对应的 电动势E(mv)为纵坐标, 绘制 E-V曲线,曲线上的 拐点所对应的体积为滴定
终点。
第29页/共43页
2、△E/△V —V曲线
曲线的一部 分用外延法绘 制,其最高点 对应于滴定终 点时所消耗滴 定剂的体积。
第32页/共43页
计算示例 吸取Cl-和I-混合液25.00mL,稀释到100.00mL,以0.1000mol•L-1的AgNO3 溶液滴定.以银电极作指示电极,饱和甘汞电极作参比电极,加入AgNO3的体 积及相应的E值如下表所示.计算Cl-及I-在化学计量点时所消耗AgNO3的体 积,并计算原来溶液中Cl-及I-的浓度各是多少?以g/L表示之。 (已知:Ksp,AgCl=1.8×10-10, Ksp,AgI=8.3×10-17,
(3) 指示电极:铂电极 标准溶液:K4[Fe(CN)6; 滴定对象:Pd2+、Cd2+、Zn2+、Ba2+ 等。
第20页/共43页
参比电极:甘汞电极;
氧化还原滴定
指示电极:铂电极;
(1)标准溶液:高锰酸钾; 滴定对象:I-、NO3-、Fe2+ 、V4+、Sn2+、 C2O42-。
(2)标准溶液: K4[Fe(CN)6; 滴定对象:Co2+ 。
以满足所有电极能够浸没在样品溶液中。注意搅拌子不能触到电极以及滴 定管头。
第13页/共43页
技巧与提示(瑞士万通电位滴定仪)
3如果由于样品数据的错误输入或公式的错误而造成结果错误,无 需重新滴定,只要将相关数值重新输入或修改后仪器重新计算结 果。
第28页/共43页
滴定终点确定的方法
1、E-V 曲线法
以加入滴定剂的体积V (ml)为横坐标、对应的 电动势E(mv)为纵坐标, 绘制 E-V曲线,曲线上的 拐点所对应的体积为滴定
终点。
第29页/共43页
2、△E/△V —V曲线
曲线的一部 分用外延法绘 制,其最高点 对应于滴定终 点时所消耗滴 定剂的体积。
第32页/共43页
计算示例 吸取Cl-和I-混合液25.00mL,稀释到100.00mL,以0.1000mol•L-1的AgNO3 溶液滴定.以银电极作指示电极,饱和甘汞电极作参比电极,加入AgNO3的体 积及相应的E值如下表所示.计算Cl-及I-在化学计量点时所消耗AgNO3的体 积,并计算原来溶液中Cl-及I-的浓度各是多少?以g/L表示之。 (已知:Ksp,AgCl=1.8×10-10, Ksp,AgI=8.3×10-17,
(3) 指示电极:铂电极 标准溶液:K4[Fe(CN)6; 滴定对象:Pd2+、Cd2+、Zn2+、Ba2+ 等。
第20页/共43页
参比电极:甘汞电极;
氧化还原滴定
指示电极:铂电极;
(1)标准溶液:高锰酸钾; 滴定对象:I-、NO3-、Fe2+ 、V4+、Sn2+、 C2O42-。
(2)标准溶液: K4[Fe(CN)6; 滴定对象:Co2+ 。
以满足所有电极能够浸没在样品溶液中。注意搅拌子不能触到电极以及滴 定管头。
第13页/共43页
技巧与提示(瑞士万通电位滴定仪)
3如果由于样品数据的错误输入或公式的错误而造成结果错误,无 需重新滴定,只要将相关数值重新输入或修改后仪器重新计算结 果。
电位滴定法ppt课件

介电常数大,E值读数稳定,但突跃不明显;介电 常数小,突跃明显,易于滴定,但E值读数不稳定。
2. 氧化还原滴定:
➢ 常用电极:铂Pt电极作指示电极, 甘汞电极作参比电极。
精品课件
19
第十二节 电位滴定法的应用和指示电极的选择
3、沉淀滴定 指示电极:根据不同的沉淀反应来采用不同的指示电极. 如:硝酸盐标准溶液滴定卤素可用银电极做指示电极 参比电极:双盐桥甘汞电极
E E2 E1 V V2 V1
精品课件
10
(c)二阶微商法(等于零点):又称二阶微分滴定曲 线,纵坐标Δ2Ε/ΔV 2=0的点即为滴定终点。通过后点 数据减前点数据的方法逐点计算二阶微商。
2E V2
E E V 2 V 1
V
内插法:取二阶微商的正、负转化处的两个点的 体积值V+,V-。
V终V V 2E2V V V 2E2 V 2E2
精品课件
21
应用及计算示例
V /ml 24.00 24.10 24.20 24.30 24.40 24.50 24.60 24.70
E /V 0.174 0.183 0.194 0.233 0.316 0.34 0.351 0.358
V' /ml Δ E/ Δ V V" /ml
24.05 24.15 24.25 24.35 24.45 24.55 24.65
精品课件
16
自动电位分析仪简介
商品电位滴定仪有半 自动、全自动两种。全 自动电位分析仪至少包 括两的单元,即更换试 样系统(取样系统)和 测量系统,测量系统包 括自动加试剂部分(量 液剂)以及数据处理部 分。仪器结构框架如下 图:
精品课件
17
第十二节 电位滴定法的应用和指示电极的选择
2. 氧化还原滴定:
➢ 常用电极:铂Pt电极作指示电极, 甘汞电极作参比电极。
精品课件
19
第十二节 电位滴定法的应用和指示电极的选择
3、沉淀滴定 指示电极:根据不同的沉淀反应来采用不同的指示电极. 如:硝酸盐标准溶液滴定卤素可用银电极做指示电极 参比电极:双盐桥甘汞电极
E E2 E1 V V2 V1
精品课件
10
(c)二阶微商法(等于零点):又称二阶微分滴定曲 线,纵坐标Δ2Ε/ΔV 2=0的点即为滴定终点。通过后点 数据减前点数据的方法逐点计算二阶微商。
2E V2
E E V 2 V 1
V
内插法:取二阶微商的正、负转化处的两个点的 体积值V+,V-。
V终V V 2E2V V V 2E2 V 2E2
精品课件
21
应用及计算示例
V /ml 24.00 24.10 24.20 24.30 24.40 24.50 24.60 24.70
E /V 0.174 0.183 0.194 0.233 0.316 0.34 0.351 0.358
V' /ml Δ E/ Δ V V" /ml
24.05 24.15 24.25 24.35 24.45 24.55 24.65
精品课件
16
自动电位分析仪简介
商品电位滴定仪有半 自动、全自动两种。全 自动电位分析仪至少包 括两的单元,即更换试 样系统(取样系统)和 测量系统,测量系统包 括自动加试剂部分(量 液剂)以及数据处理部 分。仪器结构框架如下 图:
精品课件
17
第十二节 电位滴定法的应用和指示电极的选择
电位法及永停滴定法—电位滴定法(分析化学课件)

电位滴定法测亚铁离子含量 三、操作步骤 1.仪器准备 (1)安装滴定台 连接电极杆,
装入搅拌器、溶液杯支架,在溶液杯 中放入搅拌珠,锁紧搅拌器和溶液杯。
电位滴定装置图
14
电位滴定法测亚铁离子含量 (2)安装滴定管 在溶液杯中插入 滴定管,连接输液管,利用接口螺 母旋紧,不得有泄漏现象,插入温 度计传感器,接口插入对应的插座,连接搅拌器接 口。
1.在待测溶液中插入合适的指示电极和参比电极组成 原电池;
2.待测溶液与滴定液发生化学反应,使待测离子的浓 度不断变化;
3.指示电极的电位也相应发生变化;
4.在化学计量点附近,指示电极的电位发生突然变 化,导致电池电动势发生突变;
5.通过测量电动势的变化,可确定终点。
8
电位滴定法原理
1.准确度高 电
尖峰所对应的V值即为
化学计量点的体积
△E/△V- 曲线
3
确定化学计量点的方法(三) 2E / V—2 V 曲线法
又称二阶微商法,用 2E / V 2 对滴定液体积作图,得 到一条具有两个极值的曲线,如下图所示。
曲线上为零时所对 应的体积,即为化 学计量点的体积。
4
确定化学计量点的方法 在实际的电位滴定中传统的操作方法正逐渐被 自动电位滴定所取代,自动电位滴定能判断滴定终 点,并自动绘制出E-V曲线,E / V - V 曲线,在很大 程度上提高了测定的灵敏度和准确度。
确定化学计量点的方法 进行电位滴定时,每加一次滴定剂,测量一次 电动势,直到超过化学计量点为止。这样就得到一 系列的滴定剂用量V和相应的电动势E数据。下面介 绍几种图解法确定化学计量点的方法:
1
确定化学计量点的方法
(一)E-V曲线法
以滴定液体积V为横坐标,电位计读数值(电池
电位滴定法的基本原理确定终点的方法PPT课件

工程
在滴定过程中,随着滴定剂的不断参加,电极电 位E不断发生变化,电极电位发生突跃时,说明 滴定到达终点。
指示电极的选择
电位滴定法如何确定滴定终点
1、绘制E-V曲线法 以参加滴定剂的体积为 横坐标,E为纵坐标作 滴定曲线,所的曲线的 拐点即为滴定终点。 做两条余与滴定曲线相切, 并与横轴夹角为45度的直线 A、B,再做横轴h垂直于横 轴使夹在AB间的线段被曲 线交点C平分,即C点就是拐 点。
答:缺乏之处:电位滴定法比其他两 种方法相对操作复杂。比电位分析 法操作时间长。 2、电位滴定法是如何确定滴定终点 的?
谢谢
采用特殊仪器测 量物质的物理或 物理化学性质的 参数来确定物质 的成,含量及 化学结构。
在滴定过程中 通过测量电位 变化以确定滴 定终点的方法
仪器分析
电位分析法
电位滴 定法
利用物质的电 学或电化学性 质确定参数
根本原理: 工选 组 间 溶 数程温极电要成的择液有度电准位适电电的关位、位确滴宜 池 位 电 。液的值的定的 ,差 阻体影电,法测指 、〕接因响与通池不量示界此表的 过需电电电,征某电极待些池及测物的参溶理电比液量流电性〔或极找如待浊比质电与不两测时较的量待到电溶,困化,测适终极液电难学溶宜点之有解,参液的或的颜指者指色示根示或剂本就浑。
2、绘制ΔE/ΔV—V曲线法
以参加滴定剂的体积为 为横坐标,以ΔE/ΔV为 纵坐标,画出滴定曲线。 曲线的最高点即为滴定 终点。由最高点引横轴 的垂线,交点就是消耗 滴定剂的体积。
3、
以参加滴定剂的体积 为横坐标,以 为纵坐标。画出曲线, 图中C点即为滴定终 点。
C
总结问题: 1、电位滴定法与电位分析法、普通 滴定方法比较有哪些优点,哪些缺 乏?
在滴定过程中,随着滴定剂的不断参加,电极电 位E不断发生变化,电极电位发生突跃时,说明 滴定到达终点。
指示电极的选择
电位滴定法如何确定滴定终点
1、绘制E-V曲线法 以参加滴定剂的体积为 横坐标,E为纵坐标作 滴定曲线,所的曲线的 拐点即为滴定终点。 做两条余与滴定曲线相切, 并与横轴夹角为45度的直线 A、B,再做横轴h垂直于横 轴使夹在AB间的线段被曲 线交点C平分,即C点就是拐 点。
答:缺乏之处:电位滴定法比其他两 种方法相对操作复杂。比电位分析 法操作时间长。 2、电位滴定法是如何确定滴定终点 的?
谢谢
采用特殊仪器测 量物质的物理或 物理化学性质的 参数来确定物质 的成,含量及 化学结构。
在滴定过程中 通过测量电位 变化以确定滴 定终点的方法
仪器分析
电位分析法
电位滴 定法
利用物质的电 学或电化学性 质确定参数
根本原理: 工选 组 间 溶 数程温极电要成的择液有度电准位适电电的关位、位确滴宜 池 位 电 。液的值的定的 ,差 阻体影电,法测指 、〕接因响与通池不量示界此表的 过需电电电,征某电极待些池及测物的参溶理电比液量流电性〔或极找如待浊比质电与不两测时较的量待到电溶,困化,测适终极液电难学溶宜点之有解,参液的或的颜指者指色示根示或剂本就浑。
2、绘制ΔE/ΔV—V曲线法
以参加滴定剂的体积为 为横坐标,以ΔE/ΔV为 纵坐标,画出滴定曲线。 曲线的最高点即为滴定 终点。由最高点引横轴 的垂线,交点就是消耗 滴定剂的体积。
3、
以参加滴定剂的体积 为横坐标,以 为纵坐标。画出曲线, 图中C点即为滴定终 点。
C
总结问题: 1、电位滴定法与电位分析法、普通 滴定方法比较有哪些优点,哪些缺 乏?
电化学分析法 电位滴定法 分析化学课件

每次使用前都应自动清洗和排空滴定管路原存放液体; 分析结束后排空计量管液体,并清洗; 长期未用或需更换滴定液时,可采用纯化水或乙醇多次清 洗滴定管单元及管路。
五、应用示例
在《中国药典》2020年二部中有187种原料药及其制剂采用电位滴定法进行含量测定。
滴定方法
水溶液氧化还原法 水溶液中和法
非水溶液中和法 水溶液银量法
二、确定滴定终点的方法
用内插法计算化学计量点
在化学计量点附近,滴定液近似直线段,故在实际 工作中常不做图,利用内插法计算滴定终点体积。
式中
为滴定终点体积; 为曲线过零前某点的体积;
的体积;
为曲线过零前的二级微商值;
零后的二级微商值。
为曲线过零后某点 为曲线过
二、确定滴定终点的方法
用内插法计算化学计量点
利用表中的数据,用内插法计算化学计量点时消耗的滴定液体积为多少ml?
解 从表查得加入滴定液体积为24.30ml时,其二级微商Δ2E/ΔV 2 = 4400。
加入24.40ml滴定剂时,Δ2E/ΔV 2 =-5900。设化学计量点(Δ2E/ΔV 2 = 0) 时,加入滴定液的体积为,则按下式进行比例计算:
二、确定滴定终点的方法
△E/△V- 曲线法
如图(b)所示。该曲线可看作E-V曲线的 一阶导数曲线,所以该法又称为一级微商 法。峰状曲线的最高点(极大值)所对应 的体积即为化学计量点的体积。
△2E/△V 2-V 曲线法
如图 (c)所示。曲线上△2E/△V 2为 零时所对应的体积,即为化学计量点 的体积。
随着滴定液的加入,滴定液与待测液发生 化学反应,使待测离子的浓度不断降低,因而 指示电极的电位也相应发生变化。
毫伏电 位计
甘汞电极 滴定杯
五、应用示例
在《中国药典》2020年二部中有187种原料药及其制剂采用电位滴定法进行含量测定。
滴定方法
水溶液氧化还原法 水溶液中和法
非水溶液中和法 水溶液银量法
二、确定滴定终点的方法
用内插法计算化学计量点
在化学计量点附近,滴定液近似直线段,故在实际 工作中常不做图,利用内插法计算滴定终点体积。
式中
为滴定终点体积; 为曲线过零前某点的体积;
的体积;
为曲线过零前的二级微商值;
零后的二级微商值。
为曲线过零后某点 为曲线过
二、确定滴定终点的方法
用内插法计算化学计量点
利用表中的数据,用内插法计算化学计量点时消耗的滴定液体积为多少ml?
解 从表查得加入滴定液体积为24.30ml时,其二级微商Δ2E/ΔV 2 = 4400。
加入24.40ml滴定剂时,Δ2E/ΔV 2 =-5900。设化学计量点(Δ2E/ΔV 2 = 0) 时,加入滴定液的体积为,则按下式进行比例计算:
二、确定滴定终点的方法
△E/△V- 曲线法
如图(b)所示。该曲线可看作E-V曲线的 一阶导数曲线,所以该法又称为一级微商 法。峰状曲线的最高点(极大值)所对应 的体积即为化学计量点的体积。
△2E/△V 2-V 曲线法
如图 (c)所示。曲线上△2E/△V 2为 零时所对应的体积,即为化学计量点 的体积。
随着滴定液的加入,滴定液与待测液发生 化学反应,使待测离子的浓度不断降低,因而 指示电极的电位也相应发生变化。
毫伏电 位计
甘汞电极 滴定杯
电位滴定实验PPT课件
• 4、清洗电极,将仪器复原,洗净玻璃仪器。
实验报告
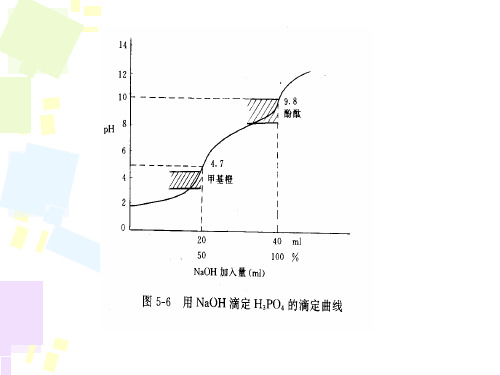
1、列表:V PH ΔPH/ ΔV ⊿2PH/⊿V2 2、绘出pH-V曲线,并在图中标出滴定终点。 3、用内插法计算出滴定终点。
酸度计的使用
• 1、仪器安装 • 2、PH校正 • 3、测量未知液 • 4、整理复原
注意事项
• 1.电极安装、校正仪器。 • 2.转子勿丢
电位滴定终点的确定:
1.E ~V曲线法 滴定终点:曲线上转折点(斜率最大处)对应V 特点:应用方便
但要求计量点处电位突跃明显 2.⊿E/⊿V~ V曲线法 曲线:具一个极大值的一级微商曲线 滴定终点:尖峰处(⊿E/⊿V极大值)所对应V 特点:在计量点处变化较大,因而滴定准确;
但数据处理及作图麻烦 3.⊿2E/⊿V2~ V曲线法 曲线:具二个极大值的二级微商曲线 滴定终点:⊿2E/⊿V2由极大正值到极大负值与
纵坐标零线相交处对应的V
V PH ΔPH
2.00 2.12 4.02 2.34 ………. ……
11.80 3.97
11.90 4.14
12.00 4.47
12.10 4.72
0.17 0.33 0.25
…… .....
ΔV
0.10 0.10 0.10
ΔPH/ ΔV
V
⊿2PH/⊿V2
1.7
11.85
1.6
3.3
11.95
-0.8
2.5
12.05
内插法:
()︰()=()︰() 得(ml)
操作步骤
• 1、用标准缓冲溶液校准PH计(调“定位”,调“斜 率”)。
• 2、吸取磷酸,加蒸馏水30ml。放入转子,磁力搅拌。插 入电极。
• 3、用滴定。开始每2ml记录PH和V ,至第一计量点附近 ()每加两滴记录PH,第二计量点附近()又每加两滴 就记行电位滴定时,是将一个指示电极和一个参比电极浸入
实验报告
1、列表:V PH ΔPH/ ΔV ⊿2PH/⊿V2 2、绘出pH-V曲线,并在图中标出滴定终点。 3、用内插法计算出滴定终点。
酸度计的使用
• 1、仪器安装 • 2、PH校正 • 3、测量未知液 • 4、整理复原
注意事项
• 1.电极安装、校正仪器。 • 2.转子勿丢
电位滴定终点的确定:
1.E ~V曲线法 滴定终点:曲线上转折点(斜率最大处)对应V 特点:应用方便
但要求计量点处电位突跃明显 2.⊿E/⊿V~ V曲线法 曲线:具一个极大值的一级微商曲线 滴定终点:尖峰处(⊿E/⊿V极大值)所对应V 特点:在计量点处变化较大,因而滴定准确;
但数据处理及作图麻烦 3.⊿2E/⊿V2~ V曲线法 曲线:具二个极大值的二级微商曲线 滴定终点:⊿2E/⊿V2由极大正值到极大负值与
纵坐标零线相交处对应的V
V PH ΔPH
2.00 2.12 4.02 2.34 ………. ……
11.80 3.97
11.90 4.14
12.00 4.47
12.10 4.72
0.17 0.33 0.25
…… .....
ΔV
0.10 0.10 0.10
ΔPH/ ΔV
V
⊿2PH/⊿V2
1.7
11.85
1.6
3.3
11.95
-0.8
2.5
12.05
内插法:
()︰()=()︰() 得(ml)
操作步骤
• 1、用标准缓冲溶液校准PH计(调“定位”,调“斜 率”)。
• 2、吸取磷酸,加蒸馏水30ml。放入转子,磁力搅拌。插 入电极。
• 3、用滴定。开始每2ml记录PH和V ,至第一计量点附近 ()每加两滴记录PH,第二计量点附近()又每加两滴 就记行电位滴定时,是将一个指示电极和一个参比电极浸入
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
以醇类为溶剂的氢氧化钠电位滴定法
▪ 通常醇类溶剂的的加入量以30-70ml为宜, 盐酸的加入量一般为5ml左右,对于那些分 子结构中含有2分子盐酸的药物以及第一个 突跃点已经足够大的样品也可以只加醇, 不加盐酸(如:盐酸氟桂利嗪等)。该方 法通常有两个突跃点,第一个突跃是滴定 游离酸根,第二个突跃点是滴定键合酸根 的。因此在标准中应说明以第几个突跃点 所消耗的体积计算,以避免误操作做成结 果不准确。
电位滴定分析法的装置
1. 手动电位滴定装置
2. 自动电位滴定装置
电位滴定法的操作步骤
▪ 关键: ▪ 确定滴定反应至化学计量点时,所消耗的滴
定剂(标准溶液)的体积。 ▪ 步骤: ▪ 1、根据预测定数据,取一定量的待测试液; ▪ 2、用标准溶液进行滴定,并记录相应的电
位; ▪ 3、根据所得数据,按上述普通作图法,一
加乙酸酐的高氯酸电位滴定法
▪ 该方法最重要的就是溶剂的筛选,通常可 采用冰醋酸-乙酸酐的溶剂组合,通过调整 两者的比例,达到终点易观察的要求。当 样品在冰醋酸中溶解性差时,可采用甲酸 等其他溶剂进行溶解(如盐酸赛庚啶等品种)。
以醇类为溶剂的氢氧化钠电位滴定法
▪ 凡是可溶于或略溶于醇类溶剂的品种,可 优先考虑使用该方法。正是由于要求样品 在醇类溶剂中的溶解性,使该方法对样品 的适用范围有一定的局限性
阶、二阶导数法来确定终点。
手动计算实例(一)
▪ 以0.1000mol/LAgNO3滴定25.00mlNaCl试 样溶液,E为电池电动势(v-伏或mv-毫 伏),V为体积—ml
手动计算实例(二)
全自动电位滴定仪的特点
▪ 1.直观的、程序化的操作界面 2.字母输入方式简洁明了
▪ 3. 滴定曲线拟合准确,突跃终点明 确 4. 打印机打印出结果 5.结果准确可靠
电位滴定法的应用及电极的选择(一)
电位滴定法的应用及电极的选择(二)
电位滴定法的应用及电极的选择(三)
进口产品的介绍
国内产品的介绍
▪
北京先驱公司电位滴定仪
▪ 北京潮声电位滴定仪
永停电位滴定法
▪ 永停滴定法采用2支相同的铂电极,当在电 极间加一低电压(例如50mV)时,若电极在溶 液中极化,则在未到滴定终点前,仅有很 小或无电流通过;但当到达终点时,滴定 液略有过剩,使电极去极化,溶液中即有 电流通过,电流计指针突然偏转,不再回 复。反之,若电极由去极化变为极化,则 电流计指针从有偏转回到零点,也不再变 动。
E-V关系曲线
导数曲线
▪ 若突跃不明显,则可绘制ΔE/ΔV--ΔV的一 阶导数曲线,曲线上将出现极大值。极大 值对应的滴定体积即为终点。也可绘制 Δ2E/ΔV2对V的二阶导数曲线,图中 Δ2E/ΔV2等于零的点即为滴定终点。可用 作图法或计算法确定终点。作图或计算法 手续较麻烦。
导数曲线
▪ A:一阶导数曲线 ▪ B:二阶导数曲线
电位滴定法优秀课件
电位滴定法的原理
▪ 电位滴定法是一种利用电极电位的突越来确定终 点的分析方法。进行电位滴定时,在溶液中插入 待测离子的指示电极和参比电极组成化学电池, 随着滴定剂的加入,由于发生化学反应,待测离 子浓度不断发生变化,指示电极的电位随着发生 变化,在计量点附近,待测离子的浓度发生突变, 指示电极的电位发生相应的突跃。因此,测量滴 定过程中电动势的变化,就能确定滴定反应的终 点,求出试样的含量。
Hale Waihona Puke 药典中收载的品种非水滴定中的汞盐革除
▪ 1)加乙酸酐的高氯酸电位滴定法; ▪ 2)以醇类为溶剂的氢氧化钠电位滴定法;
加乙酸酐的高氯酸电位滴定法
▪ 与原来采用醋酸汞滴定的方法一致,只是 通过溶剂的选择,使终点突跃增大从而取 代汞盐的使用。由于适量乙酸酐的加入不 仅是溶质的碱性增强,而且使滴定突跃明 显增加,其结果是既革除了汞盐的污染, 又能排除人为因素的干扰。因此该方法也 是2010版药典中采用最多的方法,共有盐酸 二甲双胍等31个品种采用该方法。
电位滴定法的特点
▪ 1. 准确度较高,与普通容量分析一样,测 定误差可低至0.2%。
▪ 2. 能用于难以用指示剂判断终点的混浊 或有色溶液的滴定。 3.用于非水滴定。某些有机物的滴定需 要在非水溶液中进行,一般缺乏合适的指 示剂,可采用电位滴定。 4.适于连续滴定和自动滴定。
滴定终点的确定
▪ 以电池电动势(或指示电极的电位)对加 入的滴定剂体积作图,可得到E-V关系曲 线。对反应物系数相等的反应来说,曲线 突跃的中点(转折点)即为计量点。对反 应物系数不等的反应,曲线突跃的中点与 计量点稍有偏离,但偏差很小,可以忽略, 仍可用突跃中点作为滴定终点。
永停电位滴定法的应用
▪ 重氮滴定:取供试品适量,精密称定,置烧杯中, 可加水40ml与盐酸溶液(1→2)15ml,而后置电磁搅拌 器上,搅拌使溶解,再加溴化钾2g,插入铂-铂 电极后,将滴定管的尖端插入液面下约2/3处,用亚 硝酸钠滴定液(0.1mol/L或0.05mol/L)迅速滴定,随滴随 搅拌,至近终点时,将滴定管的尖端提出液面, 用少量水淋洗尖端,洗液并入溶液中,继续缓缓 滴定,至电流计指针突然偏转,并不再回复,即 为滴定终点。 水分测定:用作水分测定的终点指示时,可调节 R<[1]>使电流计的初始电流为5~10μA,待滴定 到电流突增至50~150μA,并持续数分钟不退回, 即为滴定终点。
