标准操作规程SOP空模板
sop模板下载

竭诚为您提供优质文档/双击可除sop模板下载篇一:产品sop模板篇二:操作sop模版上海市普陀区中心医院(上海中医药大学附属普陀医院)标准操作规程(sop)心肺复苏sop制订人:(签名)(日期)审核人:(签名)(日期)批准人:(签名)(日期)颁发日期:生效日期1心肺复苏sopⅠ.目的用于建立心肺复苏的操作规程,确保心肺复苏的正确性和规范性。
Ⅱ.适用范围适用于外科重症监护科临床工作。
Ⅲ.规程2Ⅳ.参考依据20xxaha心肺复苏指南Ⅴ.附件见下页3篇三:sop模板-标准操作流程编写程序标准操作流程编写程序编制部门:商务部文件审核:文件批准:批准日期:20xx.05.25修改记录第1页共7页1目的指导文件编写者能够高效的编写出符合文件编写标准程序的文件来。
2范围此文件适合所有编写标准操作流程的文件编写人员。
第2页共7页3职责3.1sop文件编写总负责人对程序的有效性负责。
3.2编写sop文件的相关人员执行本程序,并反馈修改信息。
3.3sop文件编写总负责人根据此程序对各部门文件编写人进行培训。
3.4各主过程负责人对文件的编写和修改的有效性负责。
4定义4.1sop:sop是标准操作程序(standardoperationprogram)英文的第一个字母的缩写。
为各部门共性的、可以固化的业务活动。
4.2工具书:制定的作为岗位快速参考的文件,例如:公差,目标值等贴或放在工作区域附近用于员工工作时参考的文件,这类文件主要包括操作方法,测试标准,流程图等限于特定岗位使用的操作指南,可以作为程序文件的一部分,也可以单独使用。
4.3附件:指sop文件中所引用的文件,执行文件的同时也必须同时执行的文件,主要包括管理规定,规章制度和标准,可以作为程序文件的一部分,也可以单独使用。
4.4流程体系:共由四部分组成,sop-规范制度-表单-手册。
其中,规范为各部门之间在共性流程操作之上的不同的业务管理细的规定,是对sop的支持和补充;表单是与sop,和管理规范相匹配的单据、附件等文件;手册是已经固化的指导我们进行sop操作或执行规范制度的指南性文件。
体检sop标准作业流程模板

体检sop标准作业流程模板下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!体检SOP标准作业流程模板详解在医疗健康领域,体检是一项至关重要的工作,它可以帮助我们及时发现并预防潜在的健康问题。
SOP-001标准操作规程(SOP)的制定、管理及使用规程
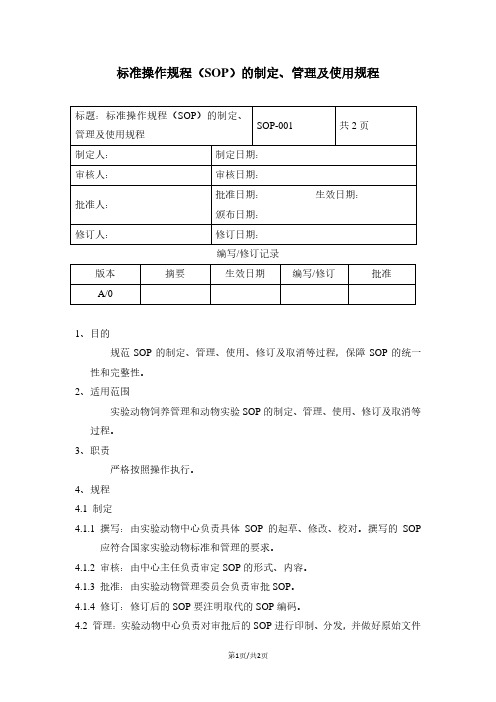
标准操作规程(SOP)的制定、管理及使用规程
编写/修订记录
1、目的
规范SOP的制定、管理、使用、修订及取消等过程,保障SOP的统一性和完整性。
2、适用范围
实验动物饲养管理和动物实验SOP的制定、管理、使用、修订及取消等过程。
3、职责
严格按照操作执行。
4、规程
4.1 制定
4.1.1 撰写:由实验动物中心负责具体SOP的起草、修改、校对。
撰写的SOP
应符合国家实验动物标准和管理的要求。
4.1.2 审核:由中心主任负责审定SOP的形式、内容。
4.1.3 批准:由实验动物管理委员会负责审批SOP。
4.1.4 修订:修订后的SOP要注明取代的SOP编码。
4.2 管理:实验动物中心负责对审批后的SOP进行印制、分发,并做好原始文件
的归档等工作;确保各工作人员在工作中认真执行。
4.3 使用:本标准操作规程供进入动物实验设施的动物饲养管理人员和动物实验
操作人员使用。
4.4 取消:由于仪器、设备的更换和其它原因,应取消SOP时,首先写出报告,
说明取消原因和日期,经机构负责人同意,签字后移交档案室保存,备查。
4.5 对标准操作规程进行取消和修订,需填写《B-SOP-001-1标准操作规程(SOP)
的管理及使用记录表》。
检验项目标准操作规程(SOP)【范本模板】

检验项目标准操作规程(SOP)- 1 —检验标本的采集一、标本的正确采集标本采集必须符合2个条件,即必须满足检测结果正确性的各项要求和检测结果必须能真实地反映检验对象当前病情,避免干扰因素的存在。
二、标本的贮存标本采集后尽快送至实验室,若不能及时送检,已采集的标本要按检验规定的贮存条件,如室温、冰浴、温浴或防腐贮存,将标本直立置于稳定、干燥、避光、密闭的环境中,避免振摇,以免标本遗洒或溶血影响检测结果。
三、标本的运送必须保证运送后标本所分析的结果与刚采集标本后分析的结果一致。
四、标本的签收临床工作人员从口才采集标本并将标本从临床运送到实验室及实验室人员接收临床标本,均应按标准化要求进行,做到认真核对,包括标本来源、标本属性、检查项目、标本采集和运送是否合乎要求等,标本送出人员和标本接收人员都要做认真的记录并签字存档。
五、标本的处理1、实验室接收标本后应及时正确地予以处理,否则会影响检测结果的准确性.2、如果取血后未尽快转送或分离血清、血浆,血清与血块簪时间接触可发生变化。
3、实验室接收标本后处理应注意事项:(1)、时间:实验室接收标本后应尽快予以分类和离心。
①、促凝标本应尽早处理,可在采血5-15分钟后离心;②抗凝标本可采血后立即离心;③非抗凝(无促凝)标本采血30-60分钟后离心;④抗凝全血标本(全血细胞分析、ESR等)不需要离心。
(2)、温度:一般标本为室温(最好是22-25℃)放置;冷藏标本(对温度依赖性分析物)应保持在2-8℃直到温度控制离心。
(3)、采血管放置:应管口(盖管塞)向上,保持垂直立位放置。
(4)、采血管必须封口:管塞移去后会使血PH改变,影响检测结果,封口可以减少污染、蒸发、喷洒和溢出等。
六、分析前的可变因素1、生物因素:可引起所检测物质在体内的变化,此种变化与检测方法无关,分为可变的和固定的生物因素.2、干扰因素:在收集和分析标本过程中,干扰因素常导致分析结果与被测物真实浓度不符。
设备sop标准生产流程模板

设备sop标准生产流程模板The standard operating procedure (SOP) for manufacturing processes is crucial for ensuring the quality and consistency of products. It is a set of step-by-step instructions that guide workers through complex tasks, ensuring that they adhere to best practices and safety protocols. SOPs are especially important in the manufacturing industry, where the slightest deviation from the standard process can lead to defects, safety hazards, and production delays.制定制造流程的标准操作规程(SOP)对于确保产品的质量和一致性至关重要。
它是一套逐步指导工人完成复杂任务的说明,确保他们遵守最佳实践和安全协议。
SOP在制造业尤为重要,因为即使是对标准流程的细微偏离,也可能导致瑕疵、安全隐患和生产延误。
First and foremost, the SOP for standard manufacturing processes should be meticulously documented with clear and detailed instructions. This documentation should be easily accessible to all employees involved in the production process. By providing a clear roadmap for completing each task, workers are less likely to make mistakes or take shortcuts that could compromise the quality of theend product. Moreover, detailed SOPs serve as valuable training tools for new employees, ensuring that they receive consistent and comprehensive instruction on how to perform each step of the manufacturing process.首先,标准制造流程的SOP应当细致记录,说明清晰而详细。
感控标准操作规程(SOP)制定与执行

添加标题
添加标题
添加标题
添加标题
监督频率:根据规程的重要性和 复杂性确定
监督内容:检查规程的执行情况, 发现问题及时纠正和改进
6感控标准操作规程(SOP)的
修订与完善
确定规程的修订时机
法律法规的变化:根据新的法 律法规要求进行修订
技术进步的影响:根据新技术 的发展和更新进行修订
操作流程的优化:根据实际工 作情况和效率提升需要进行修 订
感控标准操作 规程(SOP) 的执行与监督
感控标准操作 规程(SOP) 的修订与完善
1
单击添加章节标题
2感控标准操作规程(SOP)的
制定
确定规程的制定目标
确保医疗质量和 安全
预防和控制医院 感染
提高工作效率和 患者满意度
符合法律法规和 行业标准要求
确定规程的适用范围
感控标准操作规程(SOP)的制 定需要明确其适用范围,包括但 不限于医疗机构、实验室、公共 场所等。
适用范围应包括但不限于人员、 设备、环境、操作流程等方面, 以确保规程的完整性和实用性。添加标题添加标题 Nhomakorabea添加标题
添加标题
确定适用范围时,需要考虑到不 同场所的特点和需求,以便制定 出更具针对性和可操作性的规程。
确定适用范围后,需要根据实际 情况进行定期评估和调整,以确 保规程的持续有效性和适用性。
确定规程的制定依据
确定规程的执行流程
制定详细的执 行计划,包括 时间、地点、
人员等
明确各环节的 责任人,确保 执行过程的顺
利进行
定期对执行情 况进行检查和 评估,确保规 程的严格执行
对执行过程中 出现的问题进 行及时处理和 纠正,确保规
程的有效性
SOP标准作业指导书格式(操作规程)

yes
发现问题?
no
批准和执行
纳入SOP清单
适时更新
操作指引
6
3、SOP编写流程(1)
• 1、流程描述
喷涂
坩埚检查
坩埚拉进 喷涂室
坩埚预热
配料
喷料
打检
开查
坩坩
埚
埚
包
装
箱
将 将 坩将 收调 调 备 调 喷
检
坩 车 埚治 紧整 节 料 配 涂
查
埚 推 放具 加加 配
溶
搬 进 进放 热热 料
液
上 喷 加于 器器 器
因此,必须对作业流程、作业方法、作业条件加以规定并贯彻执行, 使之标准化。
标准化有以下四大目的:技术储备、提高效率、防止再发、教育训 练。
标准化的作用主要是把企业内的成员所积累的技术、经验,通过文 件的方式来加以保存,而不会因为人员的流动,整个技术、经验跟着流 失。达到个人知道多 少,组织就知道多少,也就是将个人的经验(财富) 转化为企业的财富;
操作步骤和应遵守的事项 • (2)是作业员的作业指导书 • (3)是检验员用于指导工作的依据
操作指引
3
2、SOP的作用
• 1、作用
• 1)将企业积累下来的技术﹑经验记录在标准
文件中,以免因技术人员的流动而使技术流失;
•
2)使操作人员经过短期培训,快速掌握较为先进合
理的操作技术;
•
3)根据作业标准,易于追查不良品产生的原因;
Review ):关键工序控制点回顾,关键工序 是对产品质量起重要、关键作用的工序,通过 建立关键工序控制点并实施严格的质量控制, 以提高产品质量的过程控制能力。
操作指引
返回 12
标准操作规程制定 SOP

标准操作规程制定 SOP为使伦理委员会起草、审核、批准、发布和修订SOP 的工作有章可循,使伦理委员会制定修订SOP 的工作,符合我国国家食品药品监督管理局《药物临床试验质量管理规范》(2003 年),《医疗器械临床试验规定》(2004 年),《药物临床试验伦理审查工作指导原则》(2010 年),国家中医药管理局《中医药临床研究伦理审查管理规范》(2010 年),国家卫生计生委和国家食品药品监管总局《干细胞临床研究管理办法(试行)》(2015 年)48 号,国家卫计委《涉及人的生物医学研究伦理审查办法》(2016 年)11 号,国家卫生健康委《体细胞治疗临床研究和转化应用管理办法(试行)》(征求意见稿)(2019 年),重庆市医学会医学伦理专业委员会《儿童临床试验伦理审查规范》,市卫生健康委员会《市涉及人的生命科学和医学研究伦理审查规范试行》(2019 年),国家卫生健康委医学伦理专家委员会《涉及人的临床研究伦理审查委员会建设指南》(2019 版)等法规、政策与指南的规定,特制定本规程。
1. 本SOP 适用于伦理委员会起草、审核、批准、发布和修订工作。
2. 对SOP 文体、格式、版面、术语及编码系统等进行统一编制。
3. 职责:3.1. 伦理委员会秘书:3.1.1. 组织SOP 制定或修订工作组。
3.1.2. 协调SOP 的修订、审批、发布工作。
3.1.3. 现行版本SOP 的发布与存档,废止SOP 的处理。
3.1.4. 培训与执行SOP。
3.1.5. 组织SOP 审核与修订工作。
3.2. SOP 制定或修订工作组:3.2.1. 列出SOP 清单,规定格式和编码。
3.2.2. 组织SOP 的讨论、修订、审核。
3.2.3. 征求、汇总各方意见、修改定稿。
3.2.4. 定期复审、修订SOP。
3.3. 伦理委员会主任委员:3.3.1. 审核、批准SOP。
3.4. 伦理委员会委员和相关工作人员:3.4.1. 登录网络阅读最新版本的SOP。
标准操作规程(SOP)

标准操作规程(SOP)戴安HPLC标准操作规程(SOP)⼀、准备⼯作:1、泵:A、流动相:①、流动相是否充⾜:(主要是有机相或者是单⼀通道的缓冲盐体系),⼀般应在所预计的消耗量之上加150ml,以保证仪器运⾏过程中不会出现流动相短缺;②、流动相是否新鲜:(主要是⾼纯⽔及缓冲盐流动相),⼀般情况下⼀次制得的纯⽔或缓冲盐流动相应在连续的24⼩时内使⽤完,如未使⽤完也应弃去不⽤,并重新配制新鲜的流动相。
特殊情况⾄少应重新过滤并脱⽓。
B、柱塞清洗液:清洗液是否新鲜及匹配:对于常规的流动相(⼀般指不含盐或离⼦对等添加剂的流动相),配制50%甲醇作为清洗液,在连续不超过4天⼯作的情况下可以两周⼀换;若超过4天,则⼀周⼀换。
对于含盐或其它添加剂的流动相,配制5%甲醇(或⾼纯⽔)作为清洗液,在连续使⽤时,应每⽇更换;中间如有较长时间不⽤,则应改为50%甲醇作为保存液,并在下次使⽤时,根据所使⽤的流动相配制适宜的清洗液。
*:若泵超过半个⽉以上不⽤,应将柱塞清洗溶剂管(蠕动泵下压部分)抽出,再下次使⽤时放回原位置,以保证清洗管道的正常使⽤。
C、溶剂管道:①、管道中的⽓泡:在泵长期不⽤时,由于脱⽓机停⽌⼯作,流动相会重新溶剂环境中的⽓体,⽽产⽣的⽓泡会对柱、泵及检测器产⽣不同程度的影响,因此要求在停泵后重新使⽤时应先观察A、B、C、D四溶剂管道进⽐例阀部分是否存在⽓泡,如⽆,在泵启动后等待5分钟后(脱⽓机⾃动脱⽓),再启动泵流速;若有,则选择相应的通道(按泵⾯板上的相应字母并保持约3秒钟),打开PURGE阀后,按⾯板上的PURGE键进⾏流动相⾃动脱⽓(可选择再次按键关闭,或等待5分钟后仪器⾃动停⽌),完成后先关闭PURGE 阀,再启动泵流速。
②、流动相快速替换:由于流动相通道有限,当在同⼀个通道中更换流动相时,应⾸先打开PURGE阀,再按泵⾯板上的PURGE键进⾏快速溶剂替换(流动为6ml/min,持续5分钟),完成后再关闭PURGE阀,按要求进⾏系统的过渡或平衡。
标准操作规程SOP-02

已修改
编号:S0P-02
标准操作规程
(厂房与设施)
新乡同心药业有限公司
目录
1.洁净厂房内表面维护、保养标准操作规程 SOP-02-101
2.厂房检查记录 SOP-02-101-a
3.厂房检修保养记录 SOP-02-101-b
4.洁净厂房温湿度监控规程 SOP-02-102
5.洁净室温、湿度记录 SOP-02-102-a
6.洁净厂房压差监控规程 SOP-02-103
7.洁净室压差记录 SOP-02-103-a
新乡同心药业有限公司GMP管理文件
标准操作规程
附件1:SOP-02-101-a
厂房检查记录
注:1、如检查内容符合使用要求,则为“正常”,若不符合要求则说明内容。
2、以上检查记录确定整改方案和施工计划。
附件2:SOP-02-101-b
厂房检修保养记录
新乡同心药业有限公司GMP管理文件
标准操作规程
附件:
温湿度检测记录
房间:编号:SOP-02-102-a
新乡同心药业有限公司GMP管理文件
标准操作规程
附件:SOP-02-103-a
洁净室压差检测记录(1)
洁净室压差检测记录(2)
洁净室压差检测记录。
临床检验科操作SOP【范本模板】

BO%
嗜碱性细胞分类
%
EO#
嗜酸性细胞计数
×109/L
32563 7F33缳939876 9BC4鯄Rr38090 94CA铊k
BO#
嗜碱性细胞计数
×109/L
(5)特殊规定
在检验血常规时,科室所有工作人员及同志如发现以下样本结果过高可过低,务必作登记,复查和及时报告,以备查询。
MO%
单核细胞分类
%
NE%(GR)
中性细胞分类
%
LY#
淋巴细胞计数
×109/L
MO#
单核细胞计数
×109/L
NE#
中性细胞计数
×109/L
RBC
红细胞计数
×1012/L
39707 9B1B鬛Vh24695 6077恷d
HGB
血红蛋白
g/L
HCT
红细胞压积
MCV
平均红细胞体积
fl
MCH
平均红细胞血红蛋白含量
8、易燃,易爆试剂应分开存放远离火源和电源。
9、供应商所送的试剂必须先经药库清点才能接受,检验科人员清点后必须在货单上签字,有出入者必须向科主任或试剂管理员、组长报告,再将货单交给试剂管理员,以便月底结帐.
10、科室试剂管理员:钟梁。
(五)实习生管理制度
1、科室按实习大纲安排实习时间表,如遇特殊情况科室统一安排。
2、实习生必须服从实习单位和科室的直接管理,遵守实习单位的规章制度,参加实习单位的政治、业务学习和有关活动、会议。
3、实习生必须加强医德医风修养,文明行医,礼貌待人,主动热情为病人服务。
4、实习生应在指导老师指导下进行实习和工作,一切实验结果均须指导老师签名后方能发出报告.不得擅自签名发出报告,指导老师应严格把关逐步培养学生独立工作能力.
标准操作规程【范本模板】
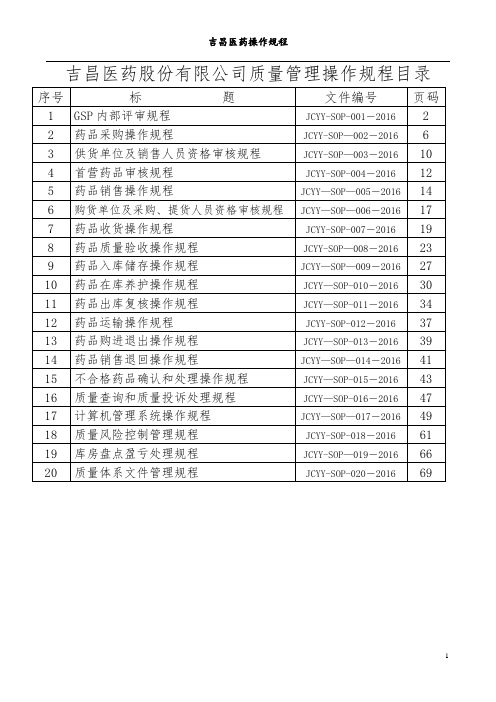
吉昌医药股份有限公司质量管理操作规程目录1.目的:质量管理体系内部审核是通过对企业质量管理体系的运行情况进行全面的检查与评价,以核实企业质量管理工作开展的充分性、适宜性和有效性,从而不断改进质量管理工作,确保质量管理体系持续有效的运行。
2.引用文件:2.1《药品经营质量管理规范》及其附录。
2.2 公司《质量管理体系内部审核制度》。
3.适用范围:本规程适用于公司质量管理体系的内部审核。
4 。
定义:4。
1质量管理:在质量方面指挥和控制组织的协调活动.4。
2质量控制:质量管理的一部分,致力于满足质量要求。
4。
3质量管理体系:在质量方面指挥和控制组织的管理体系。
4。
4评审:为确定质量管理达到规定目标的适宜性、充分性和有效性所进行的活动。
4.5审核:为获得审核证据并对其进行客观的评价,以确定满足审核准则的程度所进行的系统的、独立的并形成文件的过程。
5. 职责:5。
1 公司质量管理体系内部审核小组:负责组织质量管理体系的内部审核。
5。
2 公司质量管理部:负责组织审核员具体开展质量管理体系内部审核工作。
5.3 审核员:负责对审核中发现的问题,提出不符合报告,并下达“纠正和预防措施通知单"。
6 .审核范围:质量管理体系内部审核包括:6.1 质量管理机构的设立及职责的发挥;6。
2 质量管理文件的制定及执行情况;6。
3 药品经营质量管理相关人员的配置及职责履行的情况和发挥;6.4 各类人员岗前培训和质量管理的培训、人员健康管理情况;6。
5 设施设备的配置、使用情况;6。
6 药品购进管理:6。
6。
1 供货方合法资格审核;6。
6.2 购进药品合法性审核;6.6。
3 供货方销售人员资格审核;6。
6。
4引进药品合法性审核;6.6.5 购进记录及收货记录审核;6。
7药品入库质量检查验收的管理;6。
8 药品储存、养护管理:6。
8.1药品规范储存管理;6。
8.2药品储存环境温湿度监控管理;6。
9 药品出库与运输管理:6。
标准操作规程格式

标准操作规程(SOP)的格式制定者(签名):日期:年月日审核者(签名):日期:年月日确认者(签名):日期:年月日批准者(签名):日期:年月日标准操作规程(SOP)的格式1 前言标准操作规程(SOP)是实验室质量体系中重要的部份,SOP的写作需要遵循一定的格式规范,使SOP简洁明了、层次清晰、规范统一。
2 适用范围本公司所用SOP的撰写。
3 正文3.1 SOP应选用A4纸单面打印。
3.2 SOP的封面3.2.1 页面设置:页边距(上、下2.0 cm、左3.0cm、右2.5cm),方向为纵向,文档网格每页42行,跨度为17.3磅。
3.2.2 中文字体采用“宋体”,英文字符的字体采用“Times New Roman”。
3.2.3 字符间距为“标准”,行距为“1.5倍行距”。
3.2.4 第1行用四号字体空1行。
3.2.5 单元格左右边距为0.15厘米,插入1个2行2列指定宽度为14cm表格(表格第1列宽度9.07cm,第2列宽度4.93cm),第1行第2列拆分为两个1.13cm的单元格,第2行第2列拆分为两个行高为0.85 cm的单元格,表格外边框设置为黑色2.25磅实线,内网格线设置为黑色1磅实线。
第1列第1行表格里写“标准操作规程”,四号字,每字之间空2格。
回车,写英文“Standard Operation Procedure”,四号字,每个英文单词之间空1格。
表格的第1列第2行居中写“杭州先导医药科技有限责任公司”。
第1列单元格格式设置为垂直居中。
第2列表格单元格格式设置为左对齐居中,第1行写“编号:”,右侧为SOP编号,均为小四号字;第2行写“生效日期:”,为小四号字;第3行写“附录:”,右侧为该SOP的附录数量,均为小四号字;第4行写“代替:”,右侧为被代替的原SOP编号,均为小四号字。
3.2.6 用四号字体空2行后写该SOP的题目,居中,字体为宋体二号加粗加下划线。
3.2.7 用四号字体空2行,再空15格写“制定者(签名):”,“制定者”间每字空一格,画下划线18格,均为四号字。
标准操作规程 sop

标准操作规程 sop
《标准操作规程(SOP):确保工作流程高效稳定》
标准操作规程(SOP)是指在特定工作流程中,为了保证工作
的高效稳定进行而规定的一系列操作步骤和规范。
它为员工提供了明确的工作指导,保证了工作流程的稳定性和质量的一致性。
在各行各业中,SOP被广泛应用于生产制造、实验室实验、医疗卫生和服务行业等方面。
SOP通常由质量管理部门或者相关的专业人员编制,其内容
包括具体的操作步骤、安全注意事项、质量标准、相关条例法规等。
通过遵循SOP,员工可以在工作中准确无误地完成任务,减少错误和事故的发生,提高工作效率和质量。
SOP的编制和执行对于企业的管理和运营非常重要。
它可以
帮助企业建立起一套科学的管理制度,提高工作的规范化程度,减少资源浪费和降低成本。
同时,SOP也可以帮助企业确保
产品质量,提升客户满意度,增强企业在市场竞争中的优势。
同时,SOP也需要定期进行审查和更新,确保其与实际工作
流程保持一致。
在实际执行SOP的过程中,员工也需要不断
反馈经验和意见,以便SOP的不足之处能够得到及时的修改
和改进。
总之,SOP对于企业的管理和生产运营都具有非常重要的意义。
它不仅可以帮助企业提高工作的效率和质量,同时也是企
业持续改进的一个重要工具。
因此,企业在制定SOP时需要充分考虑各方面的因素,确保其能够真正发挥其应有的作用。
医院感染标准操作规程sop【范本模板】

重点部位医院感染预防与控制1、手术部位医院感染预防与控制标准操作规程一、手术前1、择期手术患者应尽可能待手术部位以外感染治愈后再行手术。
2、充分控制糖尿病手术患者的血糖水平,尤其避免术前高血糖。
3、尽可能缩短术前住院时间。
4、若无禁忌症,术前应使用抗菌皂或皂液洗澡。
5、避免不必要的备皮,确需备皮应术前即刻进行,尽量使用不损伤皮肤的方法如剪毛或脱毛。
6、需要做肠道准备的患者,术前一天分次口服非吸收性抗菌药物即可.7、有明显皮肤感染的工作人员,未治愈前不宜参加手术。
二、手术中1、有预防用药指征者,应切皮前30min或麻醉诱导期静脉给药。
手术时间超过3小时,或超过所用药物半衰期的2倍以上,或失血量大(>1500ml),术中应追加一剂。
2、严格遵循《医务人员外科手消毒标准操作规程》。
3、手套穿孔率较高的手术,如部分骨科手术,应戴双层手套。
4、做好术前皮肤消毒。
5、术中应主动加温,保持患者正常体温。
6、手术野冲洗应使用温(37℃)的无菌生理盐水。
7、需引流的切口,首选闭式引流,应远离切口部位戳孔引流,位置适当确保充分引流。
三、手术后1、接触切口以及切口敷料前后均必须进行手卫生。
2、换药操作应严格遵守无菌操作原则。
3、除非必要,尽早拔除引流管。
2.医院内肺炎预防与控制标准操作规程医院内肺炎(HAP)是我国最常见的医院感染类型,呼吸机相关肺炎(V AP)是其中的重要类型,预后较差。
1、对存在HAP高危因素的患者,建议使用含0.2%的氯己定(洗必泰)漱口或口腔冲洗,,每2—6h一次。
2、如无禁忌症,应将床头抬高约30°。
3、鼓励手术后患者(尤其是胸部和上腹部手术患者)早期下床活动。
4、指导患者正确咳嗽,必要时予以翻身、拍背,以利于痰液引流。
5、提倡积极使用胰岛素控制血糖在80—110mg/dl。
6、吸痰时应严格遵循无菌操作原则,吸痰前、后,医务人员应做手卫生.7、应对医务人员定期进行有关预防措施的教育培训。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
页 码:第6页共6页
页 码:第3页共6页
昆明市第一人民医院药物临床试验机构
文件类别:设计规范
文件编号:XH-DS-001-2012/01
版 次:2012/01
文 件 名 称:药物临床试验方案设计规范
页 码:第5页共6页
昆明市第一人民医院药物临床试验机构
文件类别:设பைடு நூலகம்规范
文件编号:XH-DS-001-2012/01
版 次:2012/01
版本更新记录
版本号
起效日期
失效日期
制(修)订理由简报
2012/01
2016-012-01
原始版
审查记录
审查日期
签名
审查日期
签名
1
5
2
6
3
7
4
8
昆明市第一人民医院药物临床试验机构
文件类别:标准操作规程
文件编号:HX-DS-001-2016/01
版 次:2016/01
文 件 名 称:药物临床试验方案设计规范
页 码:第1页共6页
1目的:为了规范呼吸专业组药物临床试验方案的设计,按照药物管理法、药物注册管理办法、GCP及其相关规定的要求,特制订本规程。
2范围:本规程适用于呼吸专业组各类临床试验方案设计。
3职责:呼吸专业组研究人员对本规程实施负责。
4修订(制订)理由:原始版。
5依据:《GCP》。
6定义:
7程序内容:
昆明市第一人民医院药物临床试验机构
文件类别:设计规范
文件编号:XH-DS-001-2012/01
版 次:2012/01
文 件 名 称:药物临床试验方案设计规范
页 码:第2页共6页
昆明市第一人民医院药物临床试验机构
文件类别:设计规范
文件编号:XH-DS-001-2012/01
版 次:2012/01
文 件 名 称:药物临床试验方案设计规范
编号:HX-DS-001-2016/01 机密
严重不良反应及报告的SOP
版本号:2012/01
页数:页(包括封面)
颁布日期:2016-12-01
起效日期:2016-12-01
起草人: 2016年 11 月 16 日
审核人: 2016 年 11月 16 日
批准人:李梅华 2016 年 11 月 16 日
