2005物理化学与有机化学解析
2005物理化学与有机化学
S2= [H-G+T1S1]/T2= [-2909.9-15957+300×191.83]/200=193.41 J/K.mol
S= 193.41-191.83=1.58 J/K.mol
∵S= Cpln(T2/T1)+Rln(p1/p2)=3.5Rln(200/300)+Rln(5p /p2)=1.58
Qp=H=(G+TS)=G +TS=-nFE+Qr
Qp=-10270 J
(3)∵Cp= d(H)/dT
J.K-1
(4)对于题给的反应,可以设计为下列电池:
(-)Cu| CuSO4(m)|CuHg(s), Hg(l) (*O=H++OH-在298K时的弛豫时间=37s,试求该反应的正向和逆向反应速率常数kf和kr。
M武汉大学
2005年攻读硕士学位研究生入学考试试题答案
科目名称:物理化学和高分子化学科目代码:
注意:所有的答题内容必须答在答题纸上,凡答在试题或草稿纸上的一律无效。
物理化学部分(75分)
k: 1.381×10-23J·K-1h: 6.626×10-34J·s
1.(15分)一.有一双原子分子理想气体,T1=300K,p1=5p ,Sm (300K,5 p )=191.83 J/K.mol,经历一途径到达末态,已知此始末两态间的G=15957 J/mol,G-F=-831.4 J。试求:此始末两态间的U、H、S、F;以及末态的温度和压力?
(1)分别写出相区A、B、C、D、E、F的相态、相数和自由度;
(2)指明图中自由度为零的地方,并标明相态。
(3)绘出点x的溶液体系降温过程的步冷曲线;
(4)北极爱斯基摩人根据季节的变换,从海水中取出淡水,根据相图分析其科学依据;
(2021年整理)2005物理化学

(完整版)2005物理化学编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整版)2005物理化学)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整版)2005物理化学的全部内容。
(完整版)2005物理化学编辑整理:张嬗雒老师尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布到文库,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是我们任然希望 (完整版)2005物理化学这篇文档能够给您的工作和学习带来便利。
同时我们也真诚的希望收到您的建议和反馈到下面的留言区,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请下载收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为〈(完整版)2005物理化学> 这篇文档的全部内容。
青岛科技大学2005年研究生入学考试试卷(A)考试科目:物理化学(答案全部写在答案纸上)一.填空与选择题(每题3分,共30分)1。
某系统为被隔板分隔成等体积两部分的刚性绝热箱,左边装空气,压力为 200kPa,右边也为空气,压力为 100kPa。
抽掉隔板后,至两边空气的压力相等,此过程 W0 和∆U0 (填〉,〈或 =).2。
0℃,101。
3kPa下,1mol冰溶化成水,吸热 6.02kJ,此过程∆G =。
3.动电电位为双电层的电位,只有在和作反向移动时,才能显出电位差。
4.质量摩尔浓度为1mol·kg—1的 Na2SO4水溶液,平均活度系数为γ± ,该溶液的平均活度a±=γ± 。
5. 非理想气体进行某不可逆循环,则.(A)∑δQ/T = 0 (B) ∑δQ/T 〈0 (C) ∑δQ/T > 0 (D)∆S > 0 6。
物理化学B-第一章-热力学第一定律

处于热力学平衡的系统必须满足 下列平衡:
热平衡 热
力
学 力平衡 平
衡
相平衡
物质平衡
化学平衡
(1) 热平衡(thermal equilibrium):
如果没有绝热壁存在,系统内各部分之间 以及系统与环境之间没有温度差别。
热力学第零定律
如果系统A与B成热平衡,系统B与C成热平衡, 则系统A与C也必然成热平衡。一切互为热平衡的 物体具有相同的温度。(热平衡定律)
(2) 一般Q ≠-Q逆, W ≠-W逆; 但Y =- Y逆
6、内能 (Internal energy)
热力学能(thermodynamic energy)
系统的能量
动能 势能
机械能
➢ 定义:
内能
是系统内部所有粒子的各种运动和相互作用 的能量总和,包括体系内分子运动的平动能、转动 能、振动能、电子及核的能量以及分子与分子相互 作用的位能等能量。也叫热力学能,用符号 U 表 示,单位焦耳(J)。
3、平衡状态的描述与状态函数
(1) 定义:用于描述系统状态的各宏观物理性 质(如物质的量、温度、压力、体积等)称为 系统的热力学性质,习惯称为状态函数。
容量性质:与n成正比,有加和性。 (广延性质) 如m,V;是n的一次齐函数
(2) 分类:
强度性质:与n无关,无加和性。 如T,p,Vm;是n的零次齐函数
-
A+B
C
(4) 可逆过程的重要性
实际过程能量利用的极限
实际过程状态函数的变化计算(如熵函数)
§1-5 热的计算 (How to calculate heat)
1、 等容热(Qv)
过程特点:dV=0
W=0
U QV (W W ) QV W
[物理化学(上册)完整习题答案解析]第五版高等教育出版社
![[物理化学(上册)完整习题答案解析]第五版高等教育出版社](https://img.taocdn.com/s3/m/18541d01a45177232f60a2e2.png)
第一章 气体pVT 性质1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下:1 1TT p V p V V T V V ⎪⎪⎭⎫⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂=κα 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT111 )/(11-=⋅=⋅=⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=T TVV p nR V T p nRT V T V V p p V α 1211 )/(11-=⋅=⋅=⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂-=p p V V pnRT V p p nRT V p V V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时?解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为mol RT pV n 623.1461815.300314.8300106.1213=⨯⨯⨯== 每小时90kg 的流量折合p 摩尔数为13353.144145.621090109032-⋅=⨯=⨯=h mol M v Cl H C n/v=(14618.623÷1441.153)=10.144小时1-3 0℃、101.325kPa 的条件常称为气体的标准状况。
试求甲烷在标准状况下的密度。
解:33714.015.273314.81016101325444--⋅=⨯⨯⨯=⋅=⋅=m kg M RT p M V n CH CH CHρ 1-4 一抽成真空的球形容器,质量为25.0000g 。
充以4℃水之后,总质量为125.0000g 。
若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。
试估算该气体的摩尔质量。
解:先求容器的容积33)(0000.10010000.100000.250000.1252cm cm V l O H ==-=ρn=m/M=pV/RTmol g pV RTm M ⋅=⨯-⨯⨯==-31.301013330)0000.250163.25(15.298314.841-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。
化学有机物物理化学性质及方程式

烷烃:化学性质不活泼,尤其是直链烷烃。
它与大多数试剂如强酸、强碱、强氧化剂,强还原剂及金属钠等都不起反应,或者反应速率缓慢。
但是在适当的温度、压力和催化剂的条件下,也可与一些试剂反应。
主要有:氧化、裂化和取代等反应。
烯烃:1`与X2,H2,H2O,HX等加成反应2`加聚反应3 氧化反应炔烃加成反应;氧化反应苯易进行取代,只在特定条件下进行加成和氧化反应,主要:硝化反应;卤代反应;磺化反应苯的同系物氧化反应,取代反应(甲苯和溴能发生取代反应,但条件不同,取代位置不同,发生在苯环上,即侧链对苯环的影响,发生在侧链上,即类似烷烃的取代反应,还能继续进行。
)加成反应物理性质烷烃都是无色的,碳原子数5-11时常温常压下为液态,以下为气态,以上为固态。
标准状况下密度都比水小。
熔点和沸点都很低,并且熔点和沸点随分子量的增加而升高.烯烃物理性质和烷烃相似,如烯烃是不溶于水的,虽然在水中的溶解度比烷烃还略大一点。
烯烃还能与某些金属离子以π键相结合,从而大大增加烯烃的溶解度,生成水溶性较大的配合物。
烯烃也易于苯、乙醚、氯仿等非极性有机溶剂中。
一般C2~C4的烯烃是气体,C5~C18的为气体,C19以上的高级烯烃为固体。
烯烃的沸点也随着分子量的增加而升高,双键在碳链终端的烯烃的沸点比相应的烷烃为固体。
烯烃的沸点也随着分子量的增加而升高,双键在碳链中间的沸点比相应的烷烃还略低一点。
与烷烃一样,直链烯烃的沸点比带支链的高炔烃和烷烃,烯烃基本相似. 炔烃的沸点,相对密度等都比相应的烯烃略高些.4个碳以下的炔烃在常温常压下为气体.随着分子中碳原子数的增多,它们的沸点也升高苯无色有特殊气味的液体,易挥发,比水轻,不溶于水苯的同系物在性质上跟苯有许多相似之处,如燃烧时都发生带有浓烟的火焰,都能发生取代反映等,不能使溴水褪色(不发生反应),但能使溴水层褪色(物理性质)归纳同系物的物理性质不同,但有相同的官能团,所以化学性质相似烷烃.烯烃.炔烃物理性质相似检举回答人的补充 2010-08-29 17:48 物理性质烷烃都是无色的,碳原子数5-11时常温常压下为液态,以下为气态,以上为固态。
[物理化学(上册)完整习题答案解析]第五版高等教育出版社
![[物理化学(上册)完整习题答案解析]第五版高等教育出版社](https://img.taocdn.com/s3/m/ef45d9fe240c844769eaee4b.png)
第一章 气体pVT 性质1-1物质的体膨胀系数V α与等温压缩系数T κ的定义如下:11TT p V pV V T V V⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫⎝⎛∂∂=κα 试导出理想气体的V α、T κ与压力、温度的关系? 解:对于理想气体,pV=nRT111 )/(11-=⋅=⋅=⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=T T VV p nR V T p nRT V T V V p p V α 1211 )/(11-=⋅=⋅=⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎪⎭⎫ ⎝⎛∂∂-=p p VV pnRT V p p nRT V pV V T T T κ 1-2 气柜内有121.6kPa 、27℃的氯乙烯(C 2H 3Cl )气体300m 3,若以每小时90kg 的流量输往使用车间,试问贮存的气体能用多少小时?解:设氯乙烯为理想气体,气柜内氯乙烯的物质的量为mol RT pV n 623.1461815.300314.8300106.1213=⨯⨯⨯== 每小时90kg 的流量折合p摩尔数为 133153.144145.621090109032-⋅=⨯=⨯=h mol M v Cl H Cn/v=(14618.623÷1441.153)=10.144小时1-3 0℃、101.325kPa 的条件常称为气体的标准状况。
试求甲烷在标准状况下的密度。
解:33714.015.273314.81016101325444--⋅=⨯⨯⨯=⋅=⋅=m kg M RT p M V n CH CH CHρ 1-4 一抽成真空的球形容器,质量为25.0000g 。
充以4℃水之后,总质量为125.0000g 。
若改用充以25℃、13.33kPa 的某碳氢化合物气体,则总质量为25.0163g 。
试估算该气体的摩尔质量。
解:先求容器的容积33)(0000.10010000.100000.250000.1252cm cm V l O H ==-=ρn=m/M=pV/RTmol g pV RTm M ⋅=⨯-⨯⨯==-31.301013330)0000.250163.25(15.298314.841-5 两个体积均为V 的玻璃球泡之间用细管连接,泡内密封着标准状况条件下的空气。
2005年高考化学试题解析

2005年普通高等学校招生全国统一考试理科综合能力测试(Ⅱ)化学试题6.分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是()A.12 B.14 C.16 D.18思路点拨:组成原子的基本粒子(质子、中子和核外电子)之间的基本关系体现在两个重要的等式(质量关系式和电量关系式)上,理解了这两个等式就容易解答本题。
镁是12号元素,其原子核内质子数为12,该同位素的质量数为28,所以该原子核内的中子数为28-12=16。
正确解答:C小结点评:原子结构是高考的常考知识点,虽然经常结合最新的科技成果考查,但需要用到的知识点一般都很基本。
7.下列说法正确的是()A.常温常压下,只有一种元素的单质呈液态B.周期表中所有元素都是从自然界中发现的C.过渡元素不全是金属元素D.常温常压下,气态单质的分子都是由非金属元素的原子形成的思路点拨:本题考查的是元素周期表的基本知识,需要根据化学常识逐一筛选。
常温常压下,呈液态的单质有Hg和Br2;周期表中铀后面的元素多数是人工进行核反应制得的元素,叫做超铀元素;过渡元素全部都是金属元素。
正确解答:D小结点评:元素周期表是我们学习化学的工具,必须熟悉其基本结构和各种元素的基本性质。
8.下列单质中,最容易跟氢气发生反应的是()A.O2B.N2C.F2D.Cl2思路点拨:本题需要根据元素的非金属性强弱作出判断。
因为F的非金属性最强,所以F2最容易与H2发生反应,混合即发生爆炸。
正确解答:C小结点评:判断元素金属性和非金属性强弱的实验依据有很多,需要在学习中不断归纳总结,这也是我们进行一些实验设计的原理和依据。
9.N A代表阿伏加德罗常数,下列说法正确的是()A.在同温同压下,相同体积的任何气体单质所含的原子数目相同B.2 g氢气所含的原子数目为N AC.在常温常压下,11.2 L氮气所含的原子数目为N AD.17 g氨气所含的电子数目为为10N A思路点拨:根据阿伏加德罗定律,在同温同压下,相同体积的任何气体单质所含的分子数目相同,原子数目不一定相同;2 gH2即1molH2,所含H原子的数目为2N A;在常温常压下,11.2 L氮气的物质的量小于0.5mol,所含的N原子数目小于N A;1个NH3分子中有10个电子,所以1molNH3中有10mol(即10N A个)电子。
物理化学原理在有机化学教与学中的应用(四)——氢化热与有机分子稳定性的关系

烃的氢化热数据 中我们紧紧围绕“ 兴趣 ” 做文章 . 从兴趣 的激发到
兴趣 的延续 再 到高潮 的 引发最后 到 兴趣 的再 生 一
按组的序号一字排好 , 大家一起大声读 出来 : w—
E L 一 0 M— E!这 时课 堂里 响起 了热烈 的 — —C 一
体. 课堂气氛和谐热烈 。 充分调动了学生学习的积 那样 ,学习中经常取得成功体验可能会导致更大 极性 , “ 使学生易学 、 好学、 乐学 。 体现了新课程背景 的学 习兴趣 . 改善 学生 作为 学 习的 自我 概念 。 并 学 下化学 教学 的有 效Байду номын сангаас 校 学 习将变 得更 具有 吸 引力 .学生精 神 涣散 的 问
多, 氢化 热 越小 , 烃就 越稳 定 。根 据表 1中 的氢 烯 化热 数 据 。 烯烃 的稳定 性顺 序一 般 如下 :
R2 C C= R2> R C=C 2 HR > RC = HR~ R2 H C C= C H2 RCH= H2> C = > C H2 CH2
和不 同碳架的烯烃 的相对稳定性 通过 比较各种 烯烃的氢化热( 见表。 , 以发现双键上有取代基 1可 ) 的烯烃的氢化热要小些 , 取代基越多烯烃越稳定。 例如 . 乙烯的氢化热为 17 . o 1 中一个氢 3 .k m ]. 2 J .其 - 被 甲基 取 代 后 的丙 烯 的氢 化 热为 159k . o- 2 . Jm 1. 1 而乙烯的四个氢都被甲基取代后的 23 二甲基一 .一 2 丁烯 的氢化热 只有 111 JmO1 一 .k . 1 1 - 烯烃 的稳定性还可以用超共轭效应 ( 一种 由 于 C C双键的 1 电子云和相邻 的 c H盯键 电子 = 『 — 云相互交盖而引起的离域效应 . 叫做 仃 霄超共 也 一 轭效应 ) 来解释。以丙烯为例 ( 参见 图 1 , ) 由于甲 基上三个 c H仃键 电子的离域 .使得丙烯 c c — — 单键的键长缩短为 010姗 ( . 5 一般烷烃 的 c C单 — 键的键长为 014n , . m)分子因共轭而稳定 。 5 同理 , 在 2 丁烯 中.有六个 C H键与双键发生超共轭 一 — 效 应 : 在 1 丁烯 中 , 而 一 仅有 两 个 C H键 与 双键 发 — 生 超共 轭效 应 故 2 丁烯 比 1丁烯 稳 定 。 一 一
2005年全国理综(浙江)化学试题分析与启示

(3)让学生以研究者的身份,在教师指导 下研究一些综合实验,激发学生的创新意 识。
(4)强化化学实验方案设计的训练。
(5)定期开放化学实验h 室
19
3.重视综合,提升能力品质
(1)要精心组织教学内容
金属钠的性质复习教学片断:
问题: (1)将金属钠久置于空气中发生哪些化 学反应?请写出反应的化学方程式。
h
9
28题存在的主要问题是: (1)不熟悉常见仪器的使用。 (2)没有真正弄懂实验的基本原理和目的。
(3)不懂得实验数据的处理。 (4)方法设计不合理。 (5)抓不住答题关键,词不达意。
h
10
29.苏丹红一号(sudan I)是一种偶氮染料,不能作为食品添加 剂使作。它是由苯胺和2—萘酚为主要原料制备的,它人的结构简 式如下所示:
第(2)问:主要是漏选A、C,漏选AC,或 多选了D。
第(3)问:漏答碳碳双键;只答“双键”; 其它如C=C、不饱和键等均是不规范的表述; 有些漏答醛基或“醛”字写错,不少同学还 答成羧基、酮基等。
h
13
第(4)问:没有作答。在结构简式的书写上,将 两个羧基写在了苯环的间位上;另一种典型的错 误是羧基中各原子的连接顺序错误或错写,常见 的有:—OOCH、—C-O-O-H、—COH、H2OC—等。 至于化学方程式的书写,一种是由于E的结构简式 错误,导致方程式错误,另一种主要是没有配平, 将NaHCO3写成Na2CO3的也不少。
物,两种一溴代物的结构简式分别是
,E与碳酸氢钠反应的
化学方程式是
(5)若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式
( 分 子 式 ) 为 C12H14O4 的 新 化 合 物 , 该 反 应 的 化 学 方 程 式
历年解析2005年高考理综化学试题分析和

⏹掌握NE5000E/80E/40E产品的体系结构⏹掌握NE5000E/80E/40E的单板构成⏹掌握NE5000E/80E/40E换板操作⏹了解NE5000E/80E/40E升级操作2005年高考理综化学试题分析和2006年高考形势展望及化学复习备考建议(提纲)湖北黄冈中学郭淑春一、2005年全国理科综合试卷化学试题特点2005年理科综合试卷化学试题所考查的知识全部都是教材中必修和选修内容。
1、回归课本2002~2005年各套综合试卷化学试题都体现了对基础知识的管理,对课本的重视。
这种导向将有利于中学教学立足基础,脱离“题海”。
2、突出对主干知识的考查所有试题考查内容全部是中学化学核心知识,重点知识,题目不偏、不怪。
每套试卷都涉及了基本概念和基本理论、常见元素及化合物、有机化学基础、化学计算、化学实验五部分内容。
其中第I卷是以考查基本概念、基本理论和基本计算技能为主,考虑到无机和有机分值的比例,第I卷中有机题较少(新课程卷中几乎没有)。
第Ⅱ卷基本上为元素及化合物推断题、物质结构推断题、有机推断题、计算题、实验题等。
其中实验题以考查课本上无机化学的典型实验为主。
3、注重对化学《考试说明》中理解和掌握层次要求的内容的考查。
4、注重对能力的考查,例如获取知识能力、理解能力、分析综合能力、表达能力、推理能力(各套侧重点有所不同)等。
5、实现了以学科内综合的原则。
6、题型相对稳定,稳中有变,稳中有新。
7、不回避常规题的解题思路和方法,如差量法、守恒法、关系式法、讨论法等,但涉及巧算巧解、复杂计算明显减少。
从近几年理科综合试卷来看,选择题不回避传统题型即多年测试中逐渐形成的精品题型,已是不争的事实。
因为这些题不仅能有效考查学生掌握和应用知识的能力和程度,又能有效控制试卷难度和得分率。
第Ⅱ卷均为翻新题或原创题,以考查学生能力为主。
第I卷常规题型主要表现在离子共存的判断和离子方程式的书写、氧化还原反应方程式的书写及应用、阿伏加德罗定律及应用、热化学方程式的书写及应用、弱电解质电离平衡、盐溶液pH值或离子浓度大小的判断、物质鉴别、物质燃烧的计算、原子结构相关知识和分子结构相关知识的应用、元素周期律和元素周期表知识的应用、pH值计算等。
2005年全国高考理综卷(浙江卷)化学试题分析2005年全国高考理综卷(浙江卷)化学试题分析

2005年全国高考理综卷(浙江卷)化学试题分析一、对化学试题的总体评价1.紧扣教学大纲和考试大纲的考试范围和能力要求化学试题所涉及的知识内容均无超越教学大纲规定的范围,重点对中学化学的基础知识、主干知识进行了考查,虽然在27题中对CaC2的结构要求偏高,但由于题中另有关于CaC2化学性质的较为显现的补充说明,考生只要调用原有认识结构中的CaC2知识仍可顺利解决问题。
除此之外,其余各题均为考生所熟悉的知识内容。
05年的“理综”考试大纲中对原先只能反映理、化、生三个学科在理科基础上的共性要求的能力(即五种能力:理解能力、推理能力、设计和完成实验的能力、获取知识的能力、分析综合能力)作了修改,重新分解为三门学科各自的能力,如化学学科主要考查观察能力、实验能力、思维能力、自学能力。
今年“理综”的化学试题较好地体现了对这些能力的考查,全卷中只考查“是什么”的题、只要求学生单纯通过回忆和再现知识能解的题几乎没有,各题均较好地提供了一个问题背景,要求学生运用掌握的知识来分析解决问题。
第II卷中26、27题均需考生要有较强的逻辑思维能力才能做出正确的推论,28题较为全面的考查了学生的化学实验能力,29题是一个较为典型的“信息给予题”,题中给出的“苏丹红一号”、“苯胺”、“2-萘酚”等都是学生不曾学过的物质,但考生只要掌握有机官能团的基本性质,掌握同分异构的基本概念和判断方法,同时具备了运用以上知识解决问题的能力,均可顺利作答。
2.知识覆盖面大从上表可以看出今年的试题中涉及中学化学的知识点15个,占中学化学学科主要知识点(25个)的60%,由于化学试题题量较小,知识点的覆盖率达到60%左右已属不易,可见命题者已考虑尽可能增大知识的覆盖面,尽可能较为全面地考查学生的化学学科知识和能力。
3.试题平稳,难度适中全卷化学试题题型常见,知识分块清晰,保持了较好的稳定性。
05年的考试大纲中对“试题难度”取消了原先的难题、中难题、容易题比例2:5:3的限定,而只笼统提“试卷包括容易题、中等难度题和难题,以中等难度题为主。
物理化学第四版印永嘉答案

物理化学第四版印永嘉答案【篇一:2、《物理化学》教学大纲(化学专业)】xt>一、课程基本信息(一)课程中文名称:物理化学(二)课程英文名称:physical chemistry (三)课程代码:15030100 15030101 (四)课程属性及模块:专业必修课(五)授课学院:理学院(六)开课学院:理学院(七)教材及参考书目教材:《物理化学》(第五版)上册,傅献彩,沈文霞等编,高等教育出版社,2005年《物理化学》(第五版)下册,傅献彩,沈文霞等编,高等教育出版社,2006年参考书:《物理化学核心教程》(第二版),沈文霞编,科学出版社,2009年《物理化学》,万洪文,詹正坤主编,高等教育出版社,2009年《物理化学简明教程》(第四版),印永嘉等编,高等教育出版社,2009年《物理化学学习指导》,孙德坤沈文霞等编,高等教育出版社,2009年《物理化学核心教程学习指导》,沈文霞等编,科学出版社,2009年《化学热力学基础》,李大珍编,北京师范大学出版社,1982年《物理化学》,朱文涛编,清华大学出版社,1995年《物理化学教程》(修订版),姚允斌,朱志昂编,湖南科技出版社,1995年(八)课程定位及课程简介《物理化学》是化学及相关学科的理论基础。
是化学、化工、冶金、材料等专业本科生必修的专业主干基础课之一。
它是从化学现象与物理现象的联系入手,借助数学、物理学等基础科学的理论及其提供的实验手段,来探求化学变化中最具普遍性的基本规律的一门学科。
它是先行课程无机化学、分析化学、有机化学普适规律的理论归纳和定量探讨,是后续专业知识深造和科研工作的理论基础,也是连接化学与其它学科的桥梁。
(九)课程设计基本理念依据“以学生为中心”的教育教学理念,本课程的教学目的主要是:(1)使学生在已学过的一些先行课程(无机化学、有机化学、分析化学、高等数学、普通物理学)的基础上,对化学运动作理论和定量探讨。
(2)使学生能系统地掌握物理化学的基本知识和基本原理,加深对自然现象本质的认识;(3)使学生学会物理化学的科学思维方法,培养学生提出问题、研究问题的能力,培养他们获取知识并用来解决实际问题的能力。
物理 化学 第一章 课件

(3) 量的数值
特定单位表示的数值,量与单位的比值。{A}= A/[A]。在图、表中常用到。 如 T/K =300。图中横坐标表示为x/[x], 如 T/K; 纵坐标 y/[y], 如 p/kPa。
20
图1.1.2 300 K下N2, He, CH4的 pVm-p 等温线
21
0.2.2 对数中的物理量 lnA 或 logA
0 绪 论
0.1 课程简介
0.1.1 什么是物理化学
化学:无机化学 有机化学 物理化学 分析化学 (高分子化学)
物理化学是化学的理论基础,是用物理的原理和方法来 研究化学中最基本的规律和理论,所研究的是普遍适用于各 个化学分支的理论问题——理论化学(化学中的哲学)。 研究化学变化中的普遍规律,不管是有机还是无机,化 学变化及相关的物理变化都是物理化学研究的对象。
作业/考题中若有 1 mol, 25℃,常数如π,e,二分之一等..., 约 定有效数字位数为无限多位。
24
第1章 气体的pVT关系
• 物质的聚集状态 气体、液体、固体。
宏观性质:p, V, T,ρ, U…
p, V, T 物理意义明确,易于测量
状态方程 联系 p, V, T 之间关系的方程。
液体和固体,其体积随压力和温度的变化很小,常 忽略不计;气体在改变压力和温度时,其体积会发生较 大变化,通常只讨论气体的状态方程。
物理化学
溶 液 化 学
9
0.1.3 本课程 物理化学B 的主要内容
绪论 气体的 pVT 关系 热力学第一定律 热力学第二定律 多组分系统热力学 化学平衡 相平衡 电化学 界面现象 化学动力学
胶体化学
10
0.1.4 关于本课程
物理化学第四版印永嘉答案

物理化学第四版印永嘉答案【篇一:2、《物理化学》教学大纲(化学专业)】xt>一、课程基本信息(一)课程中文名称:物理化学(二)课程英文名称:physical chemistry (三)课程代码:15030100 15030101 (四)课程属性及模块:专业必修课(五)授课学院:理学院(六)开课学院:理学院(七)教材及参考书目教材:《物理化学》(第五版)上册,傅献彩,沈文霞等编,高等教育出版社,2005年《物理化学》(第五版)下册,傅献彩,沈文霞等编,高等教育出版社,2006年参考书:《物理化学核心教程》(第二版),沈文霞编,科学出版社,2009年《物理化学》,万洪文,詹正坤主编,高等教育出版社,2009年《物理化学简明教程》(第四版),印永嘉等编,高等教育出版社,2009年《物理化学学习指导》,孙德坤沈文霞等编,高等教育出版社,2009年《物理化学核心教程学习指导》,沈文霞等编,科学出版社,2009年《化学热力学基础》,李大珍编,北京师范大学出版社,1982年《物理化学》,朱文涛编,清华大学出版社,1995年《物理化学教程》(修订版),姚允斌,朱志昂编,湖南科技出版社,1995年(八)课程定位及课程简介《物理化学》是化学及相关学科的理论基础。
是化学、化工、冶金、材料等专业本科生必修的专业主干基础课之一。
它是从化学现象与物理现象的联系入手,借助数学、物理学等基础科学的理论及其提供的实验手段,来探求化学变化中最具普遍性的基本规律的一门学科。
它是先行课程无机化学、分析化学、有机化学普适规律的理论归纳和定量探讨,是后续专业知识深造和科研工作的理论基础,也是连接化学与其它学科的桥梁。
(九)课程设计基本理念依据“以学生为中心”的教育教学理念,本课程的教学目的主要是:(1)使学生在已学过的一些先行课程(无机化学、有机化学、分析化学、高等数学、普通物理学)的基础上,对化学运动作理论和定量探讨。
(2)使学生能系统地掌握物理化学的基本知识和基本原理,加深对自然现象本质的认识;(3)使学生学会物理化学的科学思维方法,培养学生提出问题、研究问题的能力,培养他们获取知识并用来解决实际问题的能力。
物理化学原理在有机化学教与学中的应用(共2篇)

物理化学原理在有机化学教与学中的应用(共2篇)本文从网络收集而来,上传到平台为了帮到更多的人,如果您需要使用本文档,请点击下载按钮下载本文档(有偿下载),另外祝您生活愉快,工作顺利,万事如意!第1篇:物理化学原理在有机化学教与学中的应用有机化学教与学中常常涉及化合物的稳定性判断,分析和讨论有机分子的稳定性是有机化学的重要内容之一,因为物理有机化学的反应性与其稳定性是密切相关的。
可燃物质B的标准摩尔燃烧焓是指在标准压力下,反应温度时,单位量的物质B完全燃烧为同温下的指定产物时的标准摩尔焓变,用符号表示为ΔcHθm(B,相态,T),下标“c”和“m”分别表示燃烧和反应进度为1mol。
燃烧产物指定为:该化合物中C变为CO2(g),H变为H2O(l),S变为SO2(g),N变为N2(g),Cl成为HCl(水溶液),金属成为游离状态。
燃烧焓可以很精确地测量,它是重要的热化学数据。
本文以烷烃、环烷烃和烯烃的稳定性为例,介绍燃烧焓在有机化学中的应用。
一、烷烃同分异构体的相对热化学稳定性烷烃和所有其他碳氢化合物一样,都是可燃的。
烷烃完全燃烧,生成CO2(g)和H2O(l),并放出大量的热:CnH2n+2+O2(g)→nCO2(g)+(n+1)H2O(l)ΔrHθm(T)=Δc Hθm(CnH2n+2,T)燃烧焓的测定数据表明:直链烷烃分子每增加一个CH2,其燃烧焓数值的增加基本上是一个定值,即约为-·mol-1。
例如,甲烷、乙烷、丙烷和丁烷标准摩尔燃烧焓分别为-·mol-1、-·mol-1、-·mol-1和-·mol-1。
利用烷烃异构体燃烧焓的大小可以推测烷烃异构体的相对热化学稳定性。
在烷烃的同分异构体中,支链烷烃的燃烧焓比直链烷烃大。
支链越多,燃烧焓越大。
实验数据表明:在烷烃异构体中,支链最多的燃烧焓最大,也最稳定。
烷烃异构体燃烧时生成的产物相同,均为CO2(g)和H2O(l),反应消耗O2(g)的量和生成产物的量也相同。
国际化学领域三大综述

国际化学领域三大综述引言化学作为一门基础科学,对人类社会的发展有着深远影响。
本文将从不同的角度,对国际化学领域的三大重要综述进行介绍,包括有机化学、无机化学和物理化学。
每个领域都具有独特的特点和应用,对于推动现代科技和实现可持续发展有着重要的作用。
一、有机化学综述有机化学研究有机物的结构、性质和反应。
它关注碳元素的化学特性,并研究碳与其他元素的化合物。
有机化学为药物合成、材料科学、农业和生物化学等领域的发展做出了重要贡献。
1.1有机化学的历史自十九世纪末以来,有机化学经历了许多重要的发展阶段。
从最初对天然有机物的研究,到合成有机化合物的探索,有机化学取得了许多重要的成果。
例如,由于有机化学的发展,人类成功合成了许多天然产物,如抗生素和药物。
1.2有机化学的应用有机化学在药物合成、材料科学、农业和生物化学等领域具有广泛的应用。
例如,药物化学家利用有机化学的原理和方法合成新的药物,以治疗各种疾病。
另外,有机化学还对塑料、杂化材料和纳米材料的合成和性能提升起着关键作用。
二、无机化学综述无机化学研究无机物质的结构、性质和合成方法。
与有机化学不同,无机化学研究不包括含碳的化合物,而关注其他元素和它们的化合物。
无机化学在材料科学、催化剂和能源领域有重要的应用。
2.1无机化学的发展无机化学的发展历史源远流长,它起源于古埃及和古希腊时期。
然而,真正系统的无机化学理论是在十九世纪末和二十世纪初建立起来的。
无机化学发展的重要里程碑之一是周期表的提出,这一发现极大地推动了对无机元素属性和周期性变化的研究。
2.2无机化学的应用无机化学在材料科学和能源领域有着广泛的应用。
例如,无机材料如半导体和磁性材料在电子和磁性设备中起着关键作用。
此外,催化剂是无机化学的又一个重要应用领域,用于促进化学反应,提高反应速率和选择性。
三、物理化学综述物理化学研究物质的性质、构造和变化的物理行为。
它是化学和物理学的交叉学科,借助物理学的原理和方法解释化学现象。
物理化学类课后习题答案大全

物理化学类课后习题答案大全【物理化学类课后习题答案大全】�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�} 【物理化学类课后习题答案大全】�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}�}《大学物理》完整习题答案《传热学》课后习题答案(第四版)《有机化学》习题答案(汪小兰主编)《分析化学》课后习题答案(第五版,高教版)《物理化学》习题解答(天津大学, 第四版,106张)《大学基础物理学》课后答案(共16个单元)《物理化学》习题答案与课件集合(南大)《大学物理学》习题解答《物理化学》习题答案(南大,第五版)《高分子化学》习题答案(第四版)《普通化学(第五版)》习题详解(配套浙大编的)《结构化学基础》习题答案(周公度,北大版)《数学物理方法》(第三版)习题答案《有机化学》课后习题答案(胡宏纹,第三版)《固体物理》习题解答(方俊鑫版)大学物理习题及答案《大学物理》课后答案(陈信义)上下册的《电磁场与电磁波》(第4版)习题答案及自学辅导《工程光学》习题答案《仪器分析》课后答案(第三版,朱明华编)《光学教程》习题答案(第四版,姚启钧原著)大学物理实验绪论课指导书及参考答案《分析化学》习题答案(第三版,上册,高教版)流体输配管网习题详解(重点)《简明结构化学》课后习题答案(第三版,夏少武)《大学物理》课后习题答案(第一册)《固体物理》习题解答(阎守胜版)《流体力学》实验分析答案(浙工大版)生物化学笔记《光学》习题答案及辅导(赵凯华)电工学课后习题答案《控制电机》习题答案《分析化学》习题解答《原子物理学》习题答案(褚圣麟版)《普通物理》习题答案(磁学,电学,热学)高分子化学(整理)《材料物理导论》习题解答(科学出版社,第二版)大学物理实验《分析化学》课后答案,高教第五版材料化学课后答案啊!!!!!!!!!!!!!!!《现代电工学》习题答案(顾伟驷,科学出版社)大学物理课后部分习题答案(理工版!)大学物理作业解答北邮的通信原理合订本的课后习题详解《化工热力学》习题与习题答案第五版普通物理学课后习题答案(程守洙)第一册有机化学一到四章课件大学物理第一册课后练习题解高分子物理第三版,课后习题答案大学物理答案化工原理修订版上册 (夏清陈常贵著) 课后答案《分析化学》思考题答案(第四版,武汉大学版)传热学课后习题答案建工出版社《现代基础化学》(化学工业出版社)课后习题答案感谢您的阅读,祝您生活愉快。
2005年全国高考理科综合化学试题分析

2005年全国高考理科综合化学试题分析一、2005年化学试题特点1、回归基础,突出主干,难度适宜2005年化学试题从整体上看,重视基础,突出主干,知识覆盖面广,关注对常规方法和基本问题的考查,试题源于教材但又有创新,对基础知识的考查有一定深度,比较准确地展现了考生在学习中存在的问题,命题质量很高。
(1)元素化合物知识的考查涉及的元素化合物知识有:BF3、H2O、SiCl4、PCl5、NH3、NH4Cl、Ca(OH)2、H2、Cl2、CaC2、N2、O2、Si、Na2CO3、NaOH、CO2、H2SO4、CO、CaCl2、C2H2等,这些物质的化学性质学生必须掌握,与《考试大纲》基本一致,比2004年涉及的元素化合物有所增加。
(2)基本概念和基本理论的考查涉及的基本概念和理论有:元素周期律、原子结构、离子共存、电解原理、化学平衡、热化学方程式、化学方程式、晶体结构、同分异构体、酯化反应、结构简式等,大多仍是往年高考的热点知识。
(3)基础的有机化学有机化学以轰动世界饮食业的违禁食品添加剂苏丹红1号为载体而延伸的有机化学试题更是体现了高考化学大纲所确定的关注社会热点,崇尚科学服务大众的宗旨。
重点考查了分子式、结构简式、官能团的名称、羧酸的性质以及酯化反应的知识,这些考点都不是教材难点。
(4)基础的化学实验考查了Na2CO3、NaOH、CO2的性质,也考查了天平的使用、干燥剂浓H2SO4、碱石灰的的使用、实验设计等基本问题,较04年更有实验的味道。
(5)基础的化学计算与04年相比,05年试题中没有化学计算题大题,且多数凭借观察、心算、推算即可完成,此种考法淡化了繁杂的计算过程,而加大了思维能力的考查力度。
如13题同时给出被燃气体乙炔的质量ag和生成二氧化碳的物质的量1mol,以此来考查学生思维的敏捷性;28题给出U型管的三个质量bg、cg、dg,以考查学生思维的严谨性和准确性。
2、重视能力立意,全面考查理科能力素质(1)识图看表能力用图、表描述自然科学的研究成果比文字更直观,因此看懂图、表所包含的信息,并从中提取所需的信息,找出规律,是现在高考对考生能力方面提出的一个重要要求,也是考生将来继续学习的基本能力。
中国石油大学(北京)2005年《物理化学》考研试题与答案

2 du=δQ + δW ,在恒 p、W’=0
3 Cl- ,Cu2+, CuCl2→Cu+Cl2
五 证明题(15 分)
证明: C p
-
CV
= ⎜⎛ ⎝
∂H ∂T
⎟⎞ ⎠
p
-
⎜⎛ ⎝
∂U ∂T
⎟⎞ ⎠V
= ⎜⎛ ⎝
06 抽真空可以使容器中的水在室温时沸腾,这是因为
A. 水蒸气压增大了
B. 水蒸气压减小了
C. 水温升高了
D. 压力降低水的沸点降低了
07 一定温度下,二组分液体组成理想溶液时,其混合过程的△H
A. △H>0 B. △H<0
C. △H =0 D.不确定.
08 某同位素的一级放射性半衰期为 10 天 ,如开始时其净质量为8克,40天后其净质 量为
体系的体积将如何变化,为什么,请举例说明。 5 什么是相变和相变热。
四 填空题(15 分,请注意填写在答题本上)
1 已知,△fHmø( NO, g ,T=298K)=90.37 kJ/mol, △fGmø (NO, g , T=298K)=86.96 kJ/mol,反应
2NO=N2+O2 在恒压下,298K 的反应热效应为
A.0.5 克 B.4.0 克 C.2.0 克 D.1.0 克
09 电解硫酸铜溶液时,析出 128 克铜(原子量为 64)需要多少库仑的电量
A.96500
B. 48250
C. 193000
D. 386000
10 一组盐溶液被分别加到等体积的同一种带负电的溶胶溶液中,假定盐溶液的摩尔浓度相
重磅!无机化学,有机化学,物理化学,分析化学知识点总结讲解

无机化学,有机化学,物理化学,分析化学知识点总结讲解无机化学元素化学、无机合成化学、无机高分子化学、无机固体化学、配位化学(即络合物化学)、同位素化学、生物无机化学、金属有机化学、金属酶化学等。
有机化学普通有机化学、有机合成化学、金属和非金属有机化学、物理有机化学、生物有机化学、有机分析化学。
物理化学结构化学、热化学、化学热力学、化学动力学、电化学、溶液理论、界面化学、胶体化学、量子化学、催化作用及其理论等。
分析化学化学分析、仪器和新技术分析。
包括性能测定、监控、各种光谱和光化学分析、各种电化学分析方法、质谱分析法、各种电镜、成像和形貌分析方法,在线分析、活性分析、实时分析等,各种物理化学性能和生理活性的检测方法,萃取、离子交换、色谱、质谱等分离方法,分离分析联用、合成分离分析三联用等。
无机化学第一章:气体第一节:理想气态方程1、气体具有两个基本特性:扩散性和可压缩性。
主要表现在:⑴气体没有固定的体积和形状。
⑵不同的气体能以任意比例相互均匀的混合。
⑶气体是最容易被压缩的一种聚集状态。
2、理想气体方程:为气体摩尔常数,数值为=8.3143、只有在高温低压条件下气体才能近似看成理想气体。
第二节:气体混合物1、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。
2、Dlton分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。
3、(0℃=273.15KSTP下压强为101.325KPa=760mmHg=76cmHg)第二章:热化学第一节:热力学术语和基本概念1、系统与环境之间可能会有物质和能量的传递。
按传递情况不同,将系统分为:⑴封闭系统:系统与环境之间只有能量传递没有物质传递。
系统质量守恒。
⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物质传递。
⑶隔离系统:系统与环境之间既没有能量传递也没有物质传递。
2、状态是系统中所有宏观性质的综合表现。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
M 武汉大学
2005年攻读硕士学位研究生入学考试试题答案
科目名称:物理化学和高分子化学科目代码:
注意:所有的答题内容必须答在答题纸上,凡答在试题或草稿纸上的一律无效。
物理化学部分(75分)
k: 1.381×10-23 J·K-1h: 6.626×10-34J·s
1.(15分)一.有一双原子分子理想气体,T1=300K,p1=5p,S m(300K,5 p)=191.83 J/K.mol,经历一途径到达末态,已知此始末两态间的∆G=15957 J/mol,∆G-∆F=-831.4 J。
试求:此始末两态间的∆U、∆H、∆S、∆F;以及末态的温度和压力?
解:∵∆G=∆(F+pV)
∴∆G-∆F=∆(F+pV)-∆F=∆ (pV)=RT2-RT1= -831.4 J
T2= T1+(-831.4/R)= 300-100=200 K
∆U=C V∆T=2.5R·(200-300)=-2078.5 J
∆H=C p∆T=3.5R·(200-300)=-2909.9 J
∆F= ∆G+831.4=16788.4 J
∆G=∆H-∆(TS) =∆H-(T2S2-T1S1)
S2= [∆H-∆G+T1S1]/T2= [-2909.9-15957+300×191.83]/200=193.41 J/K.mol
∆S= 193.41-191.83=1.58 J/K.mol
∵∆S= C p ln(T2/T1)+Rln(p1/p2)=3.5Rln(200/300)+Rln(5p/p2)=1.58
Rln(5p/p)=1.58-3.5Rln(2/3)=1.58+11.80=13.38
ln(5p/p2)=1.609p2=1p
解得:∆U=-2078.5 J∆H=-2910 J∆F= 16788.4 J
∆S= 1.58 J/K T2=200K p2=1p
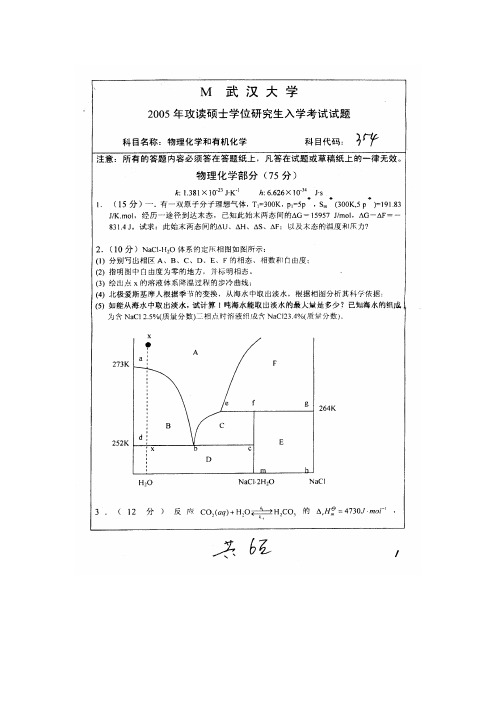
2.(10分)NaCl-H2O体系的定压相图如图所示:
(1) 分别写出相区A、B、C、D、E、F的相态、相数和自由度;
(2) 指明图中自由度为零的地方,并标明相态。
(3) 绘出点x的溶液体系降温过程的步冷曲线;
(4) 北极爱斯基摩人根据季节的变换,从海水中取出淡水,根据相图分析其科学依据;
(5) 如能从海水中取出淡水,试计算1吨海水能取出淡水的最大量是多少?已知海水的组
成为含NaCl 2.5%(质量分数)三相点时溶液组成含NaCl23.4%(质量分数)。
273K
A
F x
a
4730=m 33.5=-m S 0.00210s 正反应的的活化能;m 在此温度范围内不变,且)由阿仑尼乌斯方程m r m H ≈∆
m 在此温度范围内不变,可求得4730m r m r m G H T S =∆-⋅∆=-exp exp m a G ⎛⎫-∆==⎪⎭不包括在平衡常数表示式或速率方程式中,且近似认为2.216a =。
