晶体结构的计算历年高考题汇总
新教材适用2024版高考化学二轮总复习:晶体结构分析和有关计算教师用书

突破点3晶体结构分析和有关计算命题角度1原子间距离、原子坐标与配位数判断1.(化学式确定)(1)(2023·浙江1月选考)Si 与P 形成的某化合物晶体的晶胞如图。
该晶体类型是_共价晶体__,该化合物的化学式为_SiP 2__。
(2)(2022·天津选考)钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内。
由晶胞图判断该氧化物的化学式为_Na 2O__。
【解析】(1)Si 与P 形成的某化合物晶体的晶胞如图可知,原子间通过共价键形成的空间网状结构,形成共价晶体;根据均摊法可知,一个晶胞中含有8×18+6×12=4个Si,8个P,故该化合物的化学式为SiP 2。
(2)钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内,则晶胞中有8个钠,氧有8×18+6×12=4个,钠氧个数比为2∶1,则该氧化物的化学式为Na 2O。
2.(配位数)(2022·重庆选考)X 晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
(1)晶胞中与同一配体相连的两个[Zn 4O]6+的不同之处在于_与Zn 2+相连的双键氧原子不在对称轴的同侧__。
(2)X 晶体中Zn 2+的配位数为_4__。
【解析】(1)由X 晶胞的组成单元的对角面可知,晶胞中与同一配体相连的两个[Zn 4O]6+的不同之处在于与Zn 2+相连的双键氧原子不在对称轴的同侧。
(2)1个[Zn 4O]6+上、下、左、右、前、后共有6个L 2-,每个L 2-与[Zn 4O]6+形成2个Zn←O 配位键,1个[Zn 4O]6+含有4个Zn←O 配位键,1个[Zn 4O]6+中Zn 2+形成的配位键数目为6×2+4=16,1个Zn 2+的配位数为4。
3.(原子距离与坐标)(2021·山东选考)XeF 2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_2__个XeF 2分子。
高考化学晶体试题及答案

高考化学晶体试题及答案一、选择题(每题5分,共20分)1. 下列关于晶体的描述中,正确的是:A. 晶体具有固定的熔点B. 非晶体没有固定的熔点C. 晶体和非晶体在结构上没有区别D. 晶体和非晶体在物理性质上完全相同答案:A2. 晶体的X射线衍射图谱可以用来确定晶体的:A. 化学成分B. 晶体结构C. 晶体颜色D. 晶体密度答案:B3. 下列物质中,属于晶体的是:A. 玻璃B. 珍珠C. 石英D. 沥青答案:C4. 晶体的熔点与其结构稳定性的关系是:A. 无关B. 结构越稳定,熔点越高C. 结构越不稳定,熔点越高D. 结构稳定性与熔点无关答案:B二、填空题(每题5分,共20分)1. 晶体的熔点与非晶体相比,晶体具有_________。
答案:固定的熔点2. 晶体的X射线衍射图谱可以用来确定晶体的_________。
答案:晶体结构3. 石英是一种常见的_________。
答案:晶体4. 晶体的熔点与其结构稳定性的关系是:结构越稳定,熔点越_________。
答案:高三、简答题(每题10分,共20分)1. 简述晶体与非晶体在物理性质上的主要区别。
答案:晶体具有规则的几何形状和固定的熔点,而非晶体没有固定的熔点,其物理性质也不如晶体规则。
2. 晶体的X射线衍射图谱有何应用?答案:晶体的X射线衍射图谱可以用来确定晶体的晶体结构,这对于研究材料的物理和化学性质至关重要。
四、计算题(每题20分,共40分)1. 已知某种晶体的熔点为1000℃,其在标准大气压下的熔化热为200 J/g。
求该晶体1kg在熔化过程中吸收的热量。
答案:晶体1kg在熔化过程中吸收的热量为200,000 J。
2. 假设一种晶体在熔化过程中,其温度从800℃升高到1000℃,已知其熔化热为150 J/g。
求该晶体在熔化过程中每克吸收的热量。
答案:该晶体在熔化过程中每克吸收的热量为150 J。
2024全国高考真题化学汇编:认识晶体
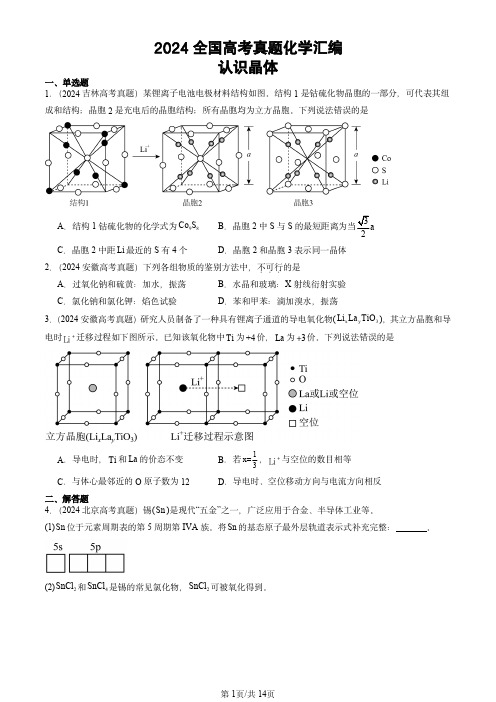
2024全国高考真题化学汇编认识晶体一、单选题1.(2024吉林高考真题)某锂离子电池电极材料结构如图。
结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。
下列说法错误的是A .结构1钴硫化物的化学式为98Co SB .晶胞2中S 与S 的最短距离为当3a 2C .晶胞2中距Li 最近的S 有4个D .晶胞2和晶胞3表示同一晶体2.(2024安徽高考真题)下列各组物质的鉴别方法中,不可行...的是A .过氧化钠和硫黄:加水,振荡B .水晶和玻璃:X 射线衍射实验C .氯化钠和氯化钾:焰色试验D .苯和甲苯:滴加溴水,振荡3.(2024安徽高考真题)研究人员制备了一种具有锂离子通道的导电氧化物(x y 3Li La TiO ),其立方晶胞和导电时+Li 迁移过程如下图所示。
已知该氧化物中Ti 为+4价,La 为3 价。
下列说法错误的是A .导电时,Ti 和La 的价态不变B .若1x=3,+Li 与空位的数目相等C .与体心最邻近的O 原子数为12D .导电时、空位移动方向与电流方向相反二、解答题4.(2024北京高考真题)锡(Sn )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第5周期第IVA 族。
将Sn 的基态原子最外层轨道表示式补充完整:。
(2)2SnCl 和4SnCl 是锡的常见氯化物,2SnCl 可被氧化得到。
①2SnCl 分子的VSEPR 模型名称是。
②4SnCl 的Sn Cl —键是由锡的轨道与氯的3p 轨道重叠形成σ键。
(3)白锡和灰锡是单质Sn 的常见同素异形体。
二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn 原子周围与它最近且距离相等的Sn 原子有个。
②若白锡和灰锡的晶胞体积分别为31v nm 和32v nm ,则白锡和灰锡晶体的密度之比是。
(4)单质Sn 的制备:将2SnO 与焦炭充分混合后,于惰性气氛中加热至800C ,由于固体之间反应慢,未明显发生反应。
晶体结构的分析与计算题和答案

晶体结构的分析与计算1.常见共价晶体结构的分析2.常见分子晶体结构的分析3.常见离子晶体结构的分析684F-:8;Ca2+:41.AB型化合物形成的晶体结构多种多样。
下图所示的几种结构所表示的物质最有可能是分子晶体的是()A.①③B.②⑤C.⑤⑥D.③④⑤⑥2.如图为几种晶体或晶胞的示意图:请回答下列问题:(1)上述晶体中,微粒之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为______________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的离子键________(填“大于”或“小于”)MgO 晶体的离子键,原因是___________________________________________________________。
(4)CaCl2晶体中Ca2+的配位数________。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_______________________________________________________________________________。
3.[2017·全国卷Ⅲ,35(5)]MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。
MnO 也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为________nm。
4.Li2O具有反萤石结构,晶胞如图所示。
已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为N A,则Li2O的密度为________________________________________g·cm-3(列出计算式)。
5.[2018·全国卷Ⅱ,35(5)]FeS2晶体的晶胞如图所示。
高考微专题复习——晶体密度计算(附参考答案)
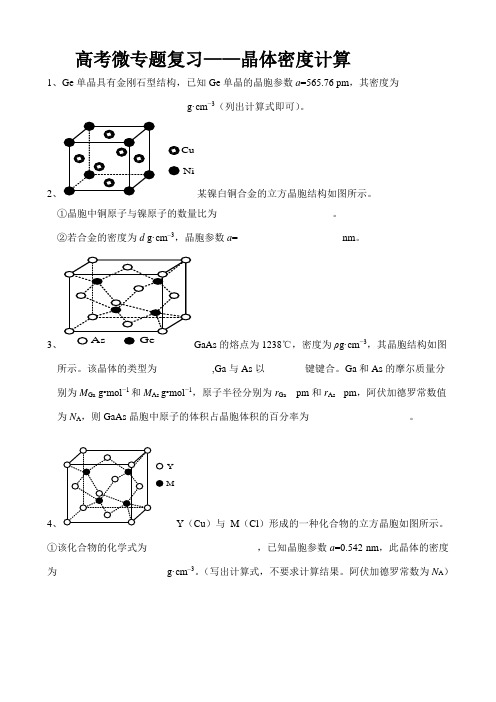
高考微专题复习——晶体密度计算1、Ge单晶具有金刚石型结构,已知Ge单晶的晶胞参数a=565.76 pm,其密度为_________________________g·cm−3(列出计算式即可)。
2、CuNi某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为_______________________。
②若合金的密度为d g·cm–3,晶胞参数a=_____________________nm。
3、GaAs的熔点为1238℃,密度为ρg·cm−3,其晶胞结构如图所示。
该晶体的类型为___________,Ga与As以________键键合。
Ga和As的摩尔质量分别为M Ga g•mol−1和M As g•mol−1,原子半径分别为r Ga pm和r As pm,阿伏加德罗常数值为N A,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
4、YMY(Cu)与M(Cl)形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为______________________,已知晶胞参数a=0.542 nm,此晶体的密度为______________________g·cm–3。
(写出计算式,不要求计算结果。
阿伏加德罗常数为N A)5、(O)和B(Na)能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为____________;晶胞中A原子的配位数为____________;列式计算晶体F的密度(g·c m¯3)___________________________________。
6、Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_________,列式表示Al单质的密度为________________________g·cm¯3(不必计算出结果)7、金刚石晶胞含有_______个碳原子。
选修3高考考点点点过:6.晶体结构的计算(含解析)

【考点概括】1.晶胞化学式的计算晶体中微粒的摆列拥有周期性,晶体中最小的构造重复单元称为晶胞,利用“均派法” 能够计算一个晶胞中的粒子数,进而确立晶体的化学式。
“均派法”的基本思想是晶胞中随意地点上的一个粒子被 n 个晶胞共用,那么每个晶胞对这个原子分得份额就是里波及的晶胞有立方晶胞、六方晶胞、三棱晶胞,以立方晶胞最为常有。
常有考题( 1)立方晶胞:每个极点上的粒子被8 个晶胞共用,每个粒子只有属于该晶胞;每条棱上的粒子被 4 个晶胞共用,每个粒子只有属于该晶胞;每个面心上的粒子被 2 个晶胞共用,每个粒子只有属于该晶胞;晶胞内的粒子完整属于该晶胞。
( 2)六方晶胞:每个极点上的粒子被 6 个晶胞共用;每条横棱上的粒子被 4 个晶胞共用;每条纵棱上的粒子被 3 个晶胞共用;每个面心上的粒子被 2 个晶胞共用;晶胞内的粒子完整属于该晶胞。
( 3)三棱晶胞:每个极点上的粒子被12 个晶胞共用;每条横棱上的粒子被 4 个晶胞共用;每条纵棱上的粒子被 6 个晶胞共用;每个面心上的粒子被 2 个晶胞共用;晶胞内的粒子完整属于该晶胞。
2.晶体密度及微粒间距离的计算(1) 晶体微粒与M、ρ之间的关系:若 1 个晶胞中含有 x 个微粒,则 1mol晶胞中含有 xmol33为晶胞的体积,微粒,其质量为 xM g(M 为微粒的相对“分子”质量 );1 个晶胞的质量为ρag(a33ρ为晶胞的密度 ),则 1mol 晶胞的质量为ρa N A g,所以有xM =ρa N A。
( 2)金属晶体中体心立方聚积、面心立方聚积中的几组公式(设棱长为 a):面对角线长=2 a;体对角线长=3a;体心立方聚积4r= 3a(r 为原子半径 );面心立方聚积4r= 2a(r为原子半径 )。
( 3)空间利用率的计算:空间利用率=晶胞据有的微粒体积晶胞体积。
【过关练习】1.下列图是甲、乙、丙三种晶体的晶胞,则甲晶体中x 与 y 的个数比是 ______,乙中 a 与 b 的个数比是 ______,丙中一个晶胞中有________个 c 离子和 ________个 d 离子。
晶体结构的计算历年高考题汇总

选修3:物质结构与性质晶体结构的计算35.[化学一选修3:物质结构与性质](15分)(2018年全国卷I)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。
回答下列问题:.L1图(b)(5)Li2O具有反萤石结构,晶胞如图“)所示。
已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为N A,则Li2O的密度为g-cm-3 (列出计算式)。
35.[化学——选修3:物质结构与性质](15分)(2018年全国卷II)(5)FeS2晶体的晶胞如图6)所示。
晶胞边长为Q nm、FeS2相对式量为M,阿伏加德罗常数的值为N A,其晶体密度的计算表达式为g-cm-3;晶胞中Fe z+位于S2所形成的正八面体的体心,该正八面体的边长为nm。
235.[化学——选修3:物质结构与性质](15分)(2018年全国卷III)锌在工业中有重要作用,也是人体必需的微量元素。
回答下列问题:(1)Zn原子核外电子排布式为。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为。
六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为N A, Zn的密度为g-cm r (列出计算式)。
35.[化学——选修3:物质结构与性质](15分)(2017年全国卷III)(5)MgO具有NK1型结构(如图),其中阴离子采用面心立方最密堆积方式,X 射战衍射实验测得MgO的晶胞蓼数为a=0」20ni】i,则]10上)为nm.MnO也属于NaCl型结构,晶胞参数为M =0.448mn,则武Mn计)为IIIII035.[化学——选修3:物质结构与性质](15分)(2017年全国卷I)《4)KlOm品体培一种性能良好的非线性光学材料,具有的钛矿型的立方结构,边长为a=0,448nm,品胞中K、I\ Q分别处于顶角、体心、面心位置.如图所示工K与OI词的最母距离为个数为<5>在KI6品胞结构的另一种衣示中.I处于存顶角位汽,则K处于位置,。
高考化学晶胞的相关计算专项训练知识点及练习题附解析

高考化学晶胞的相关计算专项训练知识点及练习题附解析一、晶胞的相关计算1.铁(Fe)、铜(Cu)、银(Ag)是常见的金属元素,它们的单质及其化合物在生活中有广泛应用。
(1)Ag 与 Cu 在同一族,则 Ag 在周期表中________ (填“s”、“p”、“d”或“ds”)区;[Ag(NH3)2]+中Ag+空的 5s 轨道和 5p 轨道以sp 杂化成键,则该配离子的空间构型是________。
(2)基态 Cu+的简化电子排布式为________。
(3)表中是 Fe 和 Cu 的部分电离能数据:请解释 I2(Cu)大于 I2(Fe)的主要原因:________。
元素Fe Cu第一电离能 I1/kJ·mol-1759746第二电离能 I2/kJ·mol-115611958(4)亚铁氰化钾是食盐中常用的抗结剂,其化学式为 K4[Fe(CN)6]。
①CN-的电子式是________;1mol 该配离子中含σ 键数目为________。
②该配合物中存在的作用力类型有________ (填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力(5)氧化亚铁晶体的晶胞结构如图所示。
已知:氧化亚铁晶体的密度为ρg•cm﹣3,N A代表阿伏加德罗常数的值。
在该晶胞中,与 Fe2+紧邻且等距离的 Fe2+数目为________,Fe2+与O2﹣最短核间距为________pm。
2.Mg、Ni、Cu、Zn 等元素在生产、生活中有着广泛的应用。
回答下列问题:(1)Mg、Ni、Cu 等金属可能形成金属互化物。
金属互化物的结构类型丰富多样,确定某种金属互化物是晶体还是非晶体可通过___________测定。
(2)根据 Cu、Zn 的原子结构比较第一电离能:I1(Cu)_________ I1(Zn)(填“大于”、“等于”或“小于”),理由是_____________________。
高中化学晶胞的相关计算专项训练知识归纳总结含答案

高中化学晶胞的相关计算专项训练知识归纳总结含答案一、晶胞的相关计算1.2Mg Si 具有反萤石结构,晶胞结构如图所示,其晶胞参数为0.635nm 。
下列叙述错误的是( )A .Si 的配位数为8B .紧邻的两个Mg 原子的距离为0.6352nm C .紧邻的两个Si 原子间的距离为20.635⨯nm D .2Mg Si 的密度计算式为()337A 76g cm 0.63510N --⋅⨯2.2020年,自修复材料、自适应材料、新型传感材料等智能材料技术将大量涌现,为生物医疗、国防军事以及航空航天等领域发展提供支撑。
(1)我国科研工作者基于丁二酮肟氨酯基团的多重反应性,研制了一种强韧、自愈的超级防护材料,其中的分子机制如图所示。
Cu 在元素周期表中位于_____区,M 层中核外电子能量最高的电子云在空间有_____个伸展方向。
C 、N 、O 第一电离能由大到小的顺序为_____________(2)氧化石墨烯基水凝胶是一类新型复合材料,对氧化石墨烯进行还原可得到还原氧化石墨烯,二者的结构如图所示:还原石墨烯中碳原子的杂化形式是______,上图中氧化石墨烯转化为还原石墨烯时,1号C 与其相邻 C原子间键能的变化是_____________(填“变大”、“变小”或“不变”),二者当中在水溶液中溶解度更大的是____________ (填物质名称),原因为__________________(3)砷化硼是近期受到广泛关注一种III—V半导体材料。
砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:B:(0,0,0);(,,0);(,0,);(0,,);……As:(,,);(,,);(,,);(,,)请在图中画出砷化硼晶胞的俯视图...........___________,已知晶体密度为dg/cm3,As半径为a pm,假设As、B原子相切,则B原子的半径为_________pm(写计算表达式)。
3.补铁剂常用于防治缺铁性贫血,其有效成分般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。
专题75 晶体结构与性质(教师版)十年(2013-2022)高考化学真题分项汇编(全国通用)

专题73晶体结构与性质1.【2022年山东卷】AlN、GaN属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在N-Al键、N-Ga键。
下列说法错误的是A.GaN的熔点高于AlN B.晶体中所有化学键均为极性键C.晶体中所有原子均采取3sp杂化D.晶体中所有原子的配位数均相同【答案】A【解析】Al和Ga均为第ⅢA元素,N属于第ⅤA元素,AlN、GaN的成键结构与金刚石相似,则其为共价晶体,且其与金刚石互为等电子体,等电子体之间的结构和性质相似。
AlN、GaN晶体中,N原子与其相邻的原子形成3个普通共价键和1个配位键。
A.因为AlN、GaN为结构相似的共价晶体,由于Al原子的半径小于Ga,N—Al的键长小于N—Ga的,则N—Al的键能较大,键能越大则其对应的共价晶体的熔点越高,故GaN 的熔点低于AlN,A说错误;B.不同种元素的原子之间形成的共价键为极性键,故两种晶体中所有化学键均为极性键,B说法正确;C.金刚石中每个C原子形成4个共价键(即C原子的价层电子对数为4),C原子无孤电子对,故C原子均采取sp3杂化;由于AlN、GaN与金刚石互为等电子体,则其晶体中所有原子均采取sp3杂化,C说法正确;D.金刚石中每个C原子与其周围4个C原子形成共价键,即C原子的配位数是4,由于AlN、GaN与金刚石互为等电子体,则其晶体中所有原子的配位数也均为4,D说法正确。
综上所述,本题选A。
Cu Se是一种钠离子电池正极材料,充放电过程中正极材料立方晶2.【2022年山东卷】2-x胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。
下列说法正确的是A .每个2-x Cu Se 晶胞中2+Cu 个数为xB .每个2Na Se 晶胞完全转化为2-x Cu Se 晶胞,转移电子数为8C .每个NaCuSe 晶胞中0价Cu 原子个数为1-xD .当2x y -Na Cu Se 转化为NaCuSe 时,每转移(1-y)mol 电子,产生(1-x)molCu 原子【答案】BD【解析】A .由晶胞结构可知,位于顶点和面心的硒离子个数为8×18+6×12=4,位于体内的铜离子和亚铜离子的个数之和为8,设晶胞中的铜离子和亚铜离子的个数分别为a 和b ,则a+b=8-4x ,由化合价代数和为0可得2a+b=4×2,解得a=4x ,故A 错误;B .由题意可知,Na 2Se 转化为Cu 2-x Se 的电极反应式为Na 2Se-2e -+(2-x)Cu=Cu 2-x Se+2Na +,由晶胞结构可知,位于顶点和面心的硒离子个数为8×18+6×12=4,则每个晶胞中含有4个Na 2Se ,转移电子数为8,故B 正确;C .由题意可知,Cu 2-x Se 转化为NaCuSe 的电极反应式为Cu 2-x Se+e -+Na +=NaCuSe+(1-x)Cu ,由晶胞结构可知,位于顶点和面心的硒离子个数为8×18+6×12=4,则每个晶胞中含有4个NaCuSe ,晶胞中0价铜而个数为(4-4x),故C 错误;D .由题意可知,Na y Cu 2-x Se 转化为NaCuSe 的电极反应式为Na y Cu 2-x Se+(1-y)e -+Na +=NaCuSe+(1-x)Cu ,所以每转移(1-y)电子,产生(1-x)mol 铜,故D 正确;故选BD 。
高中化学——晶胞的结构与计算专题练习(带答案)

高中化学——晶胞的结构与计算专题练习(带答案解析)一、单选题1.快离子导体是一类具有优良导电能力的固体电解质。
图1(Li3SBF4)和图2是潜在的快离子导体材料的结构示意图。
温度升高时,NaCl晶体出现缺陷,晶体的导电性增强。
该晶体导电时,③迁移的途径有两条:途径1:在平面内挤过2、3号氯离子之间的狭缝(距离为x)迁移到空位。
途径2:挤过由1、2、3号氯离子形成的三角形通道(如图3,小圆的半径为y)迁移到空位。
已知:氯化钠晶胞参数a=564pm,r(Na+)=95pm,r(Cl-)=185pm下列说法不正确的是A.第二周期元素中第一电离能介于B和F之间的元素有4种B.图1所示晶体中,每个Li+与4个呈四面体结构的离子相邻C.氯化钠晶体中,Na+填充在氯离子形成的正八面体空隙中D.温度升高时,NaCl晶体出现缺陷,晶体的导电性增强,该晶体导电时,③迁移的途径可能性更大的是途径12.某铜的氯化物常作工业催化剂,其晶胞结构如图所示,晶胞中C、D两原子核间距为298pm。
N,则下列说法正确的是设阿伏加德罗常数的值为AA.Cu的+2价比+1价稳定,是因为最外层电子达到半充满结构CuClB.此氯化物的化学式为2C.晶胞中Cu位于Cl形成的四面体空隙D .Cu 与Cl倍 3.Al x CoO y 的立方晶胞如图所示,已知处在体心处的原子为Co ,晶胞参数anm ,下列说法错误的是A .x=1,y=3B .该晶胞的密度为23-33A1.3410g cm a N ⨯⋅ C .该晶胞的俯视图为D .晶体中一个Al 周围与其最近的O 的个数为64.某立方晶系的锑钾()Sb K -合金可作为钾离子电池的电极材料,下图表示1/8晶胞。
下列说法中错误的是A .该晶胞的体积为33038a 10cm -⨯B .K 和Sb 原子数之比为3:1C .与K 最邻近的Sb 原子数为4D .该晶胞的俯视图为5.2CaC 的晶胞与NaCl 相似,但由于22C -的结构导致晶胞沿一个方向拉长(如图),已知2CaC 的摩尔质量为1M g mol -⋅,若阿伏加德罗常数的值为A N ,下列说法错误..的是A .2Ca +填充在22C -围成的八面体空隙中B .每个2Ca +周围等距紧邻的22C -有6个C .两个最近2Ca +D .2CaC 晶体密度的计算式为3230A 4g cm 10M N a b --⋅⨯ 6.某镁镍合金储氢后所得晶体的立方晶胞如图1(为便于观察,省略了2个图2的结构),晶胞边长为apm 。
2024全国高考真题化学汇编:几种简单的晶体结构模型

2024全国高考真题化学汇编几种简单的晶体结构模型一、单选题1.(2024甘肃高考真题)2β-MgCl 晶体中,多个晶胞无隙并置而成的结构如图甲所示,其中部分结构显示为图乙,下列说法错误的是A .电负性:Mg<ClB .单质Mg 是金属晶体C .晶体中存在范德华力D .2+Mg 离子的配位数为32.(2024山东高考真题)下列物质均为共价晶体且成键结构相似,其中熔点最低的是A .金刚石(C)B .单晶硅(Si )C .金刚砂(SiC )D .氮化硼(BN ,立方相)3.(202432234QR+YW +XZ +W Z QWXZ +YW R ,其中W 、X 、Y 、Z 、Q 、R 分别代表相关化学元素。
下列说法正确的是A .原子半径:W<X<Y B .第一电离能:X Y Z C .单质沸点:Z<R<QD .电负性:W<Q<R4.(2024吉林高考真题)下列化学用语或表述正确的是A .中子数为1的氦核素:12He B .2SiO 的晶体类型:分子晶体C .2F 的共价键类型:p-p σ键D .3PCl 的空间结构:平面三角形5.(2024贵州高考真题)我国科学家首次合成了化合物[K(2,2,2-crypt)][K@Au 12Sb 20]。
其阴离子[K@Au 12Sb 20]5-为全金属富勒烯(结构如图),具有与富勒烯C 60相似的高对称性。
下列说法错误的是A .富勒烯C 60是分子晶体B .图示中的K +位于Au 形成的二十面体笼内C .全金属富勒烯和富勒烯C 60互为同素异形体D .锑(Sb)位于第五周期第ⅤA 族,则其基态原子价层电子排布式是5s 25p 36.(2024河北高考真题)从微观视角探析物质结构及性质是学习化学的有效方法。
下列实例与解释不符的是选项实例解释A 原子光谱是不连续的线状谱线原子的能级是量子化的B224CO CH O l CC 、、键角依次减小孤电子对与成键电子对的斥力大于成键电子对之间的斥力CCsCl 晶体中+Cs 与8个-Cl 配位,而NaCl 晶体中+Na 与6个-Cl 配位+Cs 比+Na 的半径大D 逐个断开4CH 中的C-H 键,每步所需能量不同各步中的C-H 键所处化学环境不同A .AB .BC .CD .D7.(2024浙江高考真题)X 、Y 、Z 、M 四种主族元素,原子序数依次增大,分别位于三个不同短周期,Y 与M 同主族,Y 与Z 核电荷数相差2,Z 的原子最外层电子数是内层电子数的3倍。
高考晶体有关计算汇总

原子
(5)硅原子与 Si—O 共价键之比为 1:4,1mol Si O2
晶体中有 4mol 共价键
(6)密度=8×6N0 Ag×·ma3ol-1 (a 为晶胞边长,NA 为阿伏
加德罗常数)
(1)每个原子与另外 4 个不同种类的原子形成正四面
体结构
(2)密度:ρ(SiC)=4×4N0 Ag×·ma3ol-1;
F-的配位数不同
4、常见金属晶体结构分析
(1)金属晶体的四种堆积模型分析
堆积模型
简单立方 堆积
体心立方 堆积
面心立方 最密堆积
六方最密 堆积
K Fe 8
Cu Ag Au 12
Mg Zn Ti 12
晶胞占有
的原子数
1
2
4
6或2
原子半径
(r)与立方 体边长为
a=2r
3 a=4r
刚 石
原子半径(r)与
个六元环共用,一个六元环实际拥有 1 个碳原子 2
边长(a)的关 (4)C 原子数与 C—C 键数之比为 1∶2,12g 金刚石中
系: 3 a=8r
有 2 mol 共价键 (5)密度=8×1N2 Ag×·ma3ol-1 (a 为晶胞边长,NA 阿伏加德
罗常数)
(1) SiO2 晶体中最小的环为 12 元环,即:每个
高考晶体有关计算汇总
一、常见晶体(晶胞)的结构
1、常见原子晶体结构分析
晶体
晶体结构
结构分析
(1)每个碳与相邻 4 个碳以共价键结合,形成正四面
体结构,键角均 109°28′
(2)每个金刚石晶胞中含有 8 个碳原子,最小的碳环为
6 元环,并且不在同一平面(实际为椅式结构),碳原
晶胞结构分析与计算(解析版)

必刷题晶胞结构分析与计算建议完成时间:60分钟选择题:精选20题实际完成时间:分钟非选择题:精选0题1(2023·广东广州·统考三模)研究者利用冷冻透射电子显微镜,在石墨烯膜上直接观察到了自然环境下生成的二维晶体,其结构如图所示。
下列说法正确的是A.石墨烯属于烯烃,可发生加成反应B.石墨烯中碳原子的杂化轨道类型为sp2C.二维晶体的化学式为CaCl2D.二维晶体中Ca和Cl的配位数均为6【答案】B【详解】A.石墨烯属于碳单质,不含有H元素,不属于烯烃,不能发生加成反应,故A错误;B.石墨烯为平面结构,C的价层电子对数为3,故碳原子的杂化轨道类型为sp2,故B正确;C.每个Ca周围距离最近的Cl有3个,每个Cl周围距离最近的Ca有3个,故二维晶体的化学式为CaCl,故C错误;D.由C分析知,二维晶体中Ca和Cl的配位数均为3,故D错误;故选B。
2(2023·重庆沙坪坝·校考模拟预测)X为一种由汞(Hg)、锗(Ge)、锑(Sb)形成的可作潜在拓扑绝缘体材料的新物质,其晶胞如图所示(底面为正方形)。
下列说法错误的是A.X的化学式为GeHgSb2B.与Hg 距离最近的Sb 的数目为4C.若晶胞中原子1的坐标为(0,0,0),则原子2的坐标为34,34,34D.设X 的最简式的分子量为M r ,则X 晶体的密度为4M r ×1021N A a 2c g ⋅cm -3【答案】C【详解】A .X 中含Hg 个数为4×14+6×12=4,Ge 个数为8×18+4×12+1=4,Sb 个数为8,则X 的化学式为GeHgSb 2,故A 正确;B .以右侧面的Hg 分析,与Hg 距离最近的Sb 的数目为4,故B 正确;C .若晶胞中原子1的坐标为(0,0,0),则原子2在上面那个立方体的体对角线的四分之一处,其z 坐标为12+12×14=58,则其坐标为34,34,58 ,故C 错误;D .设X 的最简式的分子量为M r ,则X 晶体的密度为M r g ⋅mol -1N A mol -1×4(a ×10-7cm )2×c ×10-7cm =4M r ×1021N A a 2c g ⋅cm -3,故D 正确。
6 热考题型特训7 晶胞结构的相关计算

热考题型特训7 晶胞结构的相关计算1.(2020·新高考天津卷)Fe 、Co 、Ni 是三种重要的金属元素。
CoO 的面心立方晶胞如图所示。
设阿伏加德罗常数的值为N A ,则CoO 晶体的密度为______g·cm -3;三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为________________。
解析:根据CoO 晶胞的结构,利用均摊法得出,1个CoO 晶胞中有4个Co 2+和4个O 2-,故CoO 晶体的密度为m (晶胞)V (晶胞)=4×(59+16)(a ×10-7)3·N A g·cm -3=3×1023a 3·N Ag·cm -3。
因为Fe 、Co 、Ni 的二价氧化物是离子化合物,Fe 2+、Co 2+、Ni 2+半径依次减小,晶体的离子键依次增强,熔点依次升高,故熔点顺序是NiO>CoO>FeO 。
答案:3×1023a 3·N A NiO>CoO>FeO2.(2021·重庆适应性考试)已知MgO 具有NaCl 型晶体结构,其结构如图所示。
已知MgO 晶胞边长为 0.42 nm ,则MgO 的密度为________g/cm 3(保留小数点后一位);相邻Mg 2+之间的最短距离为________nm(已知2=1.414;结果保留小数点后两位),每个Mg 2+周围具有该距离的Mg 2+个数为________。
解析:由氧化镁的晶胞结构可知,位于顶点和面心的氧离子的个数为8×18+6×12=4,位于棱上和体心的镁离子的个数为12×14+1=4,则每个晶胞中含有4个MgO ,设氧化镁的密度为d ,由晶胞质量公式可得4×406.02×1023 g =(0.42×10-7cm)3d,解得d=4×406.02×1023×0.423×10-21g/cm3≈3.6 g/cm3;氧化镁晶胞中相邻Mg2+之间的最短距离为面对角线的一半,即2×12×0.42 nm≈0.30 nm;每个Mg2+周围具有该距离的Mg2+个数为12。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3:物质结构与性质选修晶体结构的计算I)分)(2018年全国卷:物质结构与性质]35.[化学—选修3(15作为负极材料的电池具有小而轻、能量密度大等优良性是最轻的固体金属,采用LiLi能,得到广泛应用。
回答下列问题:
,阿伏加德罗常0.4665 nmO具有反萤石结构,晶胞如图(b)所示。
已知晶胞参数为(5)Li2N的密度为数的值为,则LiO g·cm(列出计算式)。
3?2A
35.[化学——选修3:物质结构与性质](15分)(2018年全国卷II)
aM,阿伏加德罗FeS)所示。
晶胞边长为相对式量为nm、5()FeS晶体的晶胞如图(c22?N;晶胞中·cmFe位于常数的值为,其晶体密度的计算表达式为___________g2+3A?2所形成的正八面体的体心,该正八面体的边长为______nm。
S2
35.[化学——选修3:物质结构与性质](15分)(2018年全国卷III)
锌在工业中有重要作用,也是人体必需的微量元素。
回答下列问题:
(1)Zn原子核外电子排布式为________________。
word
编辑版.
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。
acN,Zn 的密度为cm六棱柱底边边长为,阿伏加德罗常数的值为cm,高为A-3(列出计算式)
________________g·cm。
35.[化学——选修3:物质结构与性质](15分)(2017年全国卷III)
35.[化学——选修3:物质结构与性质](15分)(2017年全国卷I)
word
编辑版.
III)3:物质结构与性质](15分)(2016年全国卷37.[化学——选修
(15分)(2016年全国卷II):物质结构与性质37.[化学——选修3](4)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为
②若合金的密度为d,晶胞参数为nm。
37.[化学——选修3:物质结构与性质](15分)(2016年全国卷I)
(6)已知Ge单晶的晶胞参数a=565.76pm,其密度为(列出计算式即可)
word
编辑
版.
)(2016年四川高考
年海南高考)2016
(
年全国卷II)(201515]3[37.化学——选修:物质结构与性质(分)
word
编辑
版.
I)(2015(15分)年全国卷[37.化学——选修3:物质结构与性质]碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:(5)
金刚石晶体石墨烯晶体
原子在个C C①在石墨烯晶体中,个六元环,每个六元环占有原子所连接
同一平面。
个六元C②在金刚石晶体中,C原子所连接的最小环也为六元环,每个原子连接原子在同一平面。
个C 环,六元环中最多有
年全国卷II)(201415]3[37.化学——选修:物质结构与性质(分)
word
编辑版.
(2014年全国卷I):物质结构与性质37.[化学——选修3](15分)(4) Al单质为面心立方晶体,其晶胞参数a=0.405nm ,晶胞中铝原子的配位数为。
列式表示Al单质的密度(不必计算出结果)
21)(2013年浙江高考
(2013年山东高考32)
37.[化学——选修3:物质结构与性质](15分)(2013年全国卷II)
word
编辑
版.
年全国卷(2012)(化学——选修[3:物质结构与性质]15分).37
文档可自行编辑修改内容,(此文档部分内容来源于网络,如有侵权请告知删除,供参考,感谢您的配合和支持)
word
编辑版.。
