蛋白质组学定量研究常见方法-PPT课件
合集下载
蛋白质组学研究技术-PPT精品文档

二维凝胶电泳(2-DE)—目前唯一能将 数千种蛋白质同时分离与展示的分离技 术 工作原理是根据蛋白质的两个一级属性: 等电点和分子量的特异性,将蛋白质混 合物通过等电聚焦电泳(IEF)和聚丙烯 酰胺凝胶电泳(SDS-PAGE),在两个水 平上进行分离。 1975年首先由O’Farrell等创立
2019/7/11
2019/7/11
21
第一节 概述
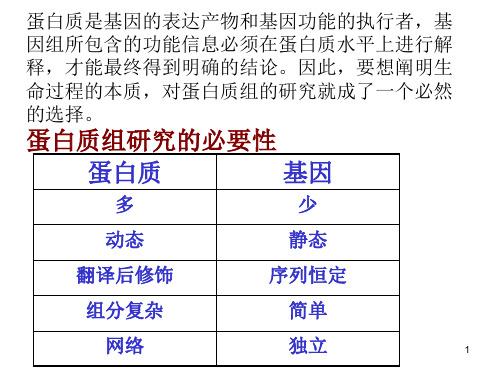
蛋白质组学研究范围及意义
表达蛋白质组学研究 选择具有重要生物学意义且已完成DNA测
序的生物体,鉴定出生物体/某种组织(细胞) 所表达的全部蛋白质,建立其蛋白质表达谱数 据库。 进展较快的领域:一些重要的疾病及微生物组。 有难度的领域:估计人类的蛋白质组由50万个 蛋白质组成,真核生物细胞表达的蛋白质也超 出1万个
2019/7/11
9
第一节 概述
2019成立了中国人类蛋白质组组织 (CHHUPO),并分别于2019年9月、 2019年8月以及2019年8月召开了中 国蛋白质组学首届、第二届及第三届 学术大会,2019年10月在中国北京召 开了第三届国际蛋白质组学会议。
2019/7/11
10
第一节 概述
科技部已将疾病蛋白质组研究列入我 国“973”计划项目和“863”计划项 目;国家自然科学基金委员会也将 “蛋白质组研究”列为重点项目。
第一节 概述
基因与其编码产物蛋白的非线性关系
mRNA水平的基因表达研究取得进展,但 mRNA与蛋白质间的相关系数仅为0.4~0.5, mRNA的种类与含量不能代表蛋白质的种类与 含量。支原体的蛋白质数目较基因多24%,对 于人,蛋白质的数目至少多3倍。 蛋白质自身特点难以从DNA和mRNA水平得到 解答:复杂的翻译后修饰、蛋白质的亚细胞定 位或迁移、蛋白质-蛋白质相互作用等
蛋白质组学及技术介绍PPT通用课件.ppt

拖尾"point streaking") 。
3.二相SDS-PAGE
丙烯酰胺/甲叉双丙烯 酰胺溶液
分离胶缓冲液
10%(w/v)过硫酸铵 溶液
(30.8%T,2.6%C):30%(W/V)丙烯酰胺和 0.8%甲叉双丙烯酰胺的水溶 液。将 300g 丙烯酰胺和 8g 甲叉双丙烯酰胺溶解于去离子水中,最后用去离
研究 内容
蛋白质的研究内容主要有两方面:
1、结构蛋白质组学:主要是蛋白质表达模型的研究,包括蛋白质氨基酸序列 分析及空间结构的解析种类分析及数量确定; 2、功能蛋白质组学:主要是蛋白质功能模式的研究,包括蛋白质功能及蛋白 质间的相互作用。
研究 内容
蛋白质组学可分为三个主要领域: 1、蛋白质的微特性以供蛋白质的规模化鉴定和他们的后翻译饰; 2、“差异显示”蛋白质组学供蛋白质水平与疾病在广泛范围的有力应用比 较; 3、应用特定的分析技术如质谱法(包括串联质谱法、生物质谱法)或酵母 双杂交系统以及其他蛋白质组学研究新技术研究蛋白质-蛋白质相互作用。
该方法所研究的蛋白均是在体内经过翻译后修饰的,并且是可 分离的天然状态的相互作用蛋白复合物,能够反映正常生理条件下的 蛋白质间相互作用
蛋白质相互作用
2、酵母双杂交系统:
该系统利用真核细胞调控转录起始过程中,DN A结合结构域(binding domain,BD)识别DNA上的特异序列并使转录激活结构域(activation domain, AD)启动所调节的基因的转录这一原理,将己知蛋白X和待研究蛋白Y的基 因分别与编码AD和BD的序列结合,通过载体质粒转入同一酵母细胞中表 达,生成两个融合蛋白。若蛋白X和Y可以相互作用,则AD和BD在空间上 接近就能形成完整的有活性的转录因子,进而启动转录,表达相应的报告 基因;反之,如果X和Y之间不存在相互作用,报告基因就不会表达。这样, 通过报告基因的表达与否,便可确定是否发生了蛋白质的相互作用。
3.二相SDS-PAGE
丙烯酰胺/甲叉双丙烯 酰胺溶液
分离胶缓冲液
10%(w/v)过硫酸铵 溶液
(30.8%T,2.6%C):30%(W/V)丙烯酰胺和 0.8%甲叉双丙烯酰胺的水溶 液。将 300g 丙烯酰胺和 8g 甲叉双丙烯酰胺溶解于去离子水中,最后用去离
研究 内容
蛋白质的研究内容主要有两方面:
1、结构蛋白质组学:主要是蛋白质表达模型的研究,包括蛋白质氨基酸序列 分析及空间结构的解析种类分析及数量确定; 2、功能蛋白质组学:主要是蛋白质功能模式的研究,包括蛋白质功能及蛋白 质间的相互作用。
研究 内容
蛋白质组学可分为三个主要领域: 1、蛋白质的微特性以供蛋白质的规模化鉴定和他们的后翻译饰; 2、“差异显示”蛋白质组学供蛋白质水平与疾病在广泛范围的有力应用比 较; 3、应用特定的分析技术如质谱法(包括串联质谱法、生物质谱法)或酵母 双杂交系统以及其他蛋白质组学研究新技术研究蛋白质-蛋白质相互作用。
该方法所研究的蛋白均是在体内经过翻译后修饰的,并且是可 分离的天然状态的相互作用蛋白复合物,能够反映正常生理条件下的 蛋白质间相互作用
蛋白质相互作用
2、酵母双杂交系统:
该系统利用真核细胞调控转录起始过程中,DN A结合结构域(binding domain,BD)识别DNA上的特异序列并使转录激活结构域(activation domain, AD)启动所调节的基因的转录这一原理,将己知蛋白X和待研究蛋白Y的基 因分别与编码AD和BD的序列结合,通过载体质粒转入同一酵母细胞中表 达,生成两个融合蛋白。若蛋白X和Y可以相互作用,则AD和BD在空间上 接近就能形成完整的有活性的转录因子,进而启动转录,表达相应的报告 基因;反之,如果X和Y之间不存在相互作用,报告基因就不会表达。这样, 通过报告基因的表达与否,便可确定是否发生了蛋白质的相互作用。
蛋白组学定量蛋白质组学.ppt

但是仅仅进行鉴定并不能提供用以阐明蛋白质的功 能的全部信息,监控蛋白质的表达水平对阐明细胞 体内存在的各种生物进程是非常重要的。因此,定 量蛋白质组学作为蛋白质组学研究的重要一部分被 提出来。
2
常用研究方法
以质谱技术为基础的化学标记定量方法 荧 光 差 示 双 向 凝 胶 电 泳 技 术 ( F-2D-
质量变化依赖于氮原子数目,因此对未 知的蛋白质难以进行定量。
10
(二)稳定同位素标记的必需氨基酸体 内标记(SILAC法)
高等动物细胞的生长中需要一些必需氨基酸的摄入,如赖氨酸 (Lys)、亮氨酸(Leu)、苯丙氨酸(Phe)等,这些氨基酸细胞自身 无法合成,需要从外界摄入补充。
在培养细胞时,可以在培养介质中特异的加入用稳定同位素标 记的某一种必需氨基酸,在经过适当的培养时间后,细胞中合 成的含有这类氨基酸的蛋白质几乎都掺入了标记的氨基酸 。
31
MCAT策略流程:定性
Lys只在Trypsin酶切后的末端,所以产生的b离子都没有被修饰;所有的y 离子带Lys,因此被修饰。
在MS/MS图谱上,所有的b离子是单一条带出现,所有的y离子是成对出现, 丰度比例一样,且相差同样的m/z。
容易区分b离子和y离子,容易读出氨基酸序列。
32
MCAT策略流程:定量
36
–COOH羧基标记
通过对羧基酯化进行 标记
用H和D标记的甲醇酯 化标记,来定量研究 蛋白质表达量的差异
37
羧基酯化标记进行蛋白定量研究
比例=2 : 1
38
缺点:
特异性不是很好,在C末端和Asp和 Glu残基上都有标记,且效率不均
采用的标记条件容易引起天冬酰胺 (Asn)和谷氨酰胺(Gln)的去酰胺
2
常用研究方法
以质谱技术为基础的化学标记定量方法 荧 光 差 示 双 向 凝 胶 电 泳 技 术 ( F-2D-
质量变化依赖于氮原子数目,因此对未 知的蛋白质难以进行定量。
10
(二)稳定同位素标记的必需氨基酸体 内标记(SILAC法)
高等动物细胞的生长中需要一些必需氨基酸的摄入,如赖氨酸 (Lys)、亮氨酸(Leu)、苯丙氨酸(Phe)等,这些氨基酸细胞自身 无法合成,需要从外界摄入补充。
在培养细胞时,可以在培养介质中特异的加入用稳定同位素标 记的某一种必需氨基酸,在经过适当的培养时间后,细胞中合 成的含有这类氨基酸的蛋白质几乎都掺入了标记的氨基酸 。
31
MCAT策略流程:定性
Lys只在Trypsin酶切后的末端,所以产生的b离子都没有被修饰;所有的y 离子带Lys,因此被修饰。
在MS/MS图谱上,所有的b离子是单一条带出现,所有的y离子是成对出现, 丰度比例一样,且相差同样的m/z。
容易区分b离子和y离子,容易读出氨基酸序列。
32
MCAT策略流程:定量
36
–COOH羧基标记
通过对羧基酯化进行 标记
用H和D标记的甲醇酯 化标记,来定量研究 蛋白质表达量的差异
37
羧基酯化标记进行蛋白定量研究
比例=2 : 1
38
缺点:
特异性不是很好,在C末端和Asp和 Glu残基上都有标记,且效率不均
采用的标记条件容易引起天冬酰胺 (Asn)和谷氨酰胺(Gln)的去酰胺
蛋白质组学研究方法课件

质谱法测序
1.肽段质量指纹图谱(PMF)
步骤:蛋白被蛋白酶专一 性酶解后,用质谱检测生 成的肽段,形成由各肽段 质量组成的质谱图,将得 到的质量谱图与数据库中 通过计算得到的理论谱图 进行比较,进行鉴定。
代表方法: 2DPAGE-MALDI-TOF
Proteomics 2004, 4, 619-626. 蛋白质组学研究方法课J.件Biotechnol. 2003, 106, 147-156.
蛋白质组学研究方法课件
1.样品制备
• 样品的制备是实验成败的关键,需 根据不同的研究目的来决定具体的 实验方法。
• 蛋白样品的有效溶解是成功分离蛋 白质的最关键的因素之一。可以根 据样品性质的不同,选用具有单一 的增溶作用的溶液,还可用含多种 变性剂、去垢剂、还原剂的复杂混 合溶液,以使样品中非共价结合的 蛋白质复合物和聚集体完全破坏。
双向凝胶电泳(2-DE)原理:
先根据蛋白质的等电点不同在pH梯度介质 中进行第一次分离,即等电聚焦(isoelectric focusing, IEF),然后根据蛋白质分子量的不同 进行第二次分离,即SDS-聚丙烯酰胺凝胶电泳
完整的实验步骤包括: 样品分离、等电聚焦、平衡、第二向分离、 染色、成像、软件分析、蛋白质鉴定
• 电压范围:25~10,000 V • 电流范围:2.4mA • 温控范围:10-25℃,内置Peltier 半导体制冷,精确控温。 • 胶条容量:容纳24个7cm胶条,12个11、17、18、
24cm胶条 • 聚 焦 槽:7、11、17、18、24cm
蛋白质组学研究方法课件
PROTEAN IEF Cell 等电聚焦电泳仪
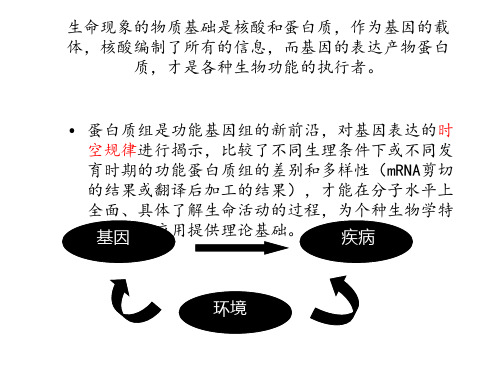
的功能蛋白质组指的是在特定时间、
特定环境和试验条件下基因组活跃表
蛋白质组学-PPT课件

iTRAQ 结构
iTRAQ包括三部分:报告部分、肽反应部分、平 衡部分。 1、报告部分:有八种,因此iTRAQ可同时标记8 组样品。 2、肽反应部分:能与肽N端及赖氨酸侧链发生共 价连接而标记上肽段,几乎可以标记所有蛋白质。 3、平衡部分:保证iTRAQ标记的同一肽段的质荷 比相同。
辉骏生物:fitgene/
辉骏生物:fitgene/
免费服务热线:400-699-1663
2:蛋白质组学研究内容
2.1:蛋白质的表达模式 (1)生理、病理或不同发育状态下蛋白质组表达差异蛋白质信息库。 (2)蛋白质及其组成质点的分离、分析、鉴定。 2.2:蛋白质的功能模式 (1)蛋白质结构分析。 (2)蛋白之间相互作用,翻译后修饰,细胞定位等。
3: 化学标记法—iTRAQ
简介:
iTRAQ试剂是可与氨基酸末端氨基及赖氨酸侧链氨基连接的胺标记同重元素。在质谱图 中,任何一种iTRAQ试剂标记不同样本中的同一蛋白质表现为相同的质荷比。 在串联质谱 中,信号离子表现为不同质荷比(113-119,121)的峰,因此根据波峰的高度及面积,可以 鉴定出蛋白质和分析出同一蛋白质不同处理的定量信息。
辉骏生物:fitgene/
免费服务热线:400-699-1663
1:双向电泳
基于2D-PAGE 的经典定量分 析方法。 1、样品准备 和定量:抽提 对照组和各种 不同实验组的 蛋白质。 2、蛋白质分 离:蛋白质经 过2D-PAGE分离 后染色(银染、 考染等)。 3、蛋白质的 定性与定量分 析:通过与对 照组相Image Master 7.0分 析出实验组中 差异点,质谱 鉴定差异点蛋 白质,同时应用 软件分析出其 表达量的变化。
辉骏生物:fitgene/
蛋白质组学ppt
电转印到膜上
图像分析
Western blot检测
选择目标蛋白斑点,胶内酶切
质谱分析(MALDI/TOF或ESI/MS/MS)
获得肽质量指纹谱或肽序列标签
数据库检索鉴定蛋白质
Western blot、 免疫组化验证 蛋白质并确定 其定位
根据氨基酸序 列合成寡核苷 酸探针,克隆 基因
蛋白质功能研究,包 括蛋白质生物活性、 抗体制备、蛋白质相 互作用等方面
7
3.2.3 蛋白质组研究技术
一、双向凝胶电泳技术 二、液相色谱技术 三、生物质谱技术与蛋白质鉴定 四、蛋白质相互作用的研究技术
8
一、双向凝胶电泳技术 (一)2-DE的概念 two dimensional gel electrophoresis
• 2-DE是指第一向的固相pH梯度(immobilized pH gradient,IPG)等电聚焦电泳与第二向SDSPAGE组成的分离系统,也称双向聚丙烯酰胺凝 胶电泳,简称2-DE。等电聚焦电泳是基于蛋白质 等电点(pI)的差异进行分离,SDS-PAGE则是 根据蛋白质分子量(Mw)的不同进行分离。
22
(三)双向凝胶电泳图谱的计算机分析 • 细胞或组织样本经2-DE分离后,得到一张含有成
百上千个蛋白质斑点的凝胶电泳图谱。凝胶图谱 分析包括确定蛋白质斑点的位置、大小、染色深 浅、pI和分子量;图谱间的比较、差异蛋白质斑 点的确定;图谱质量的优化、数据的储存管理、 数据库分析等内容。借助先进的计算机技术和生 物信息学工具,能客观、有效地从电泳图谱中提 取到有价值的信息。
记等
19
(一)考马斯亮蓝染色
考马斯亮蓝染色是最常用的蛋白质染色 方法。考马斯亮蓝R-250化学名为三苯基甲 烷,R代表红蓝色。考马斯亮蓝R-250与蛋 白质的碱性基团可逆结合,染色线性范围 可达1~55μg,灵敏度为30~100ng蛋白质 。考马斯亮蓝染色的最大优点是染色重复 性好,操作简便,不影响后续的质谱鉴定 ,灵敏度比常用的氨基黑高100倍,但低于 银染色和荧光染色,不能满足对低丰度蛋 白质的检测要求,样品用量大。
iTRAQ定量蛋白质组学PPT课件

自带),混匀,分别加入各管样品中,室温反应1h,之后各加入3倍体积的水,使 标记试剂分解。标记和样品对应关系如下:4R—117,未知—118,BOO6— 119,11R—121; (7) 合并各管标记好的样品,真空冷冻干燥。
xx
iTRAQ详细实验步骤
4: 除盐,此步操作是将标记过程中的标记试剂和相关buffer的盐 除去,以便于后续分析。
• 1:蛋白质提取
可以选择提取蛋白质常用的各种溶液,裂解液里最好不要包括下面试 剂,因为这些试剂会干扰iTRAQ试剂的标记反应。
xx
xx
xx
iTRAQ详细实验步骤
2:蛋白质定量 (1) 可以采用Bradford方法及其他方法定量初步 (2) 定量取各组样本的蛋白质进行SDS-APGE电泳,银染 定量,根据每个涌道染色情况微调蛋白浓度,保证后续 实验中每组样本的蛋白量相同。
xx
iTRAQ技术优势
➢ 灵敏度高:可检测出低丰度蛋白;
➢ 分离能力强:可分离出酸/碱性蛋白,小于10KD或大于200KD的蛋白、 难溶性蛋白等;
➢ 适用范围广:可以对任何类型的蛋白质进行鉴定,包括膜蛋白、核蛋 白和胞外蛋白等。
➢ 高通量:可同时对8个样本进行分析,特别适用于采用多种处理方式 或来自多个处理时间的样本的差异蛋白分析;
xx
Time(min) 5 90 95
100 105 120
B% 5% 35% 80% 80% 5% stop
质谱鉴定:MS扫描范围400-1800 MS/MS扫描范围100-2000
IDA 采集模式 一个图谱选择四个最强的母离子进行串级扫描。
xx
iTRAQ详细实验步骤
7: 数据检索
(1)蛋白质检索 检索软件:Protein Pilot 3.0 (ABI ,USA)
xx
iTRAQ详细实验步骤
4: 除盐,此步操作是将标记过程中的标记试剂和相关buffer的盐 除去,以便于后续分析。
• 1:蛋白质提取
可以选择提取蛋白质常用的各种溶液,裂解液里最好不要包括下面试 剂,因为这些试剂会干扰iTRAQ试剂的标记反应。
xx
xx
xx
iTRAQ详细实验步骤
2:蛋白质定量 (1) 可以采用Bradford方法及其他方法定量初步 (2) 定量取各组样本的蛋白质进行SDS-APGE电泳,银染 定量,根据每个涌道染色情况微调蛋白浓度,保证后续 实验中每组样本的蛋白量相同。
xx
iTRAQ技术优势
➢ 灵敏度高:可检测出低丰度蛋白;
➢ 分离能力强:可分离出酸/碱性蛋白,小于10KD或大于200KD的蛋白、 难溶性蛋白等;
➢ 适用范围广:可以对任何类型的蛋白质进行鉴定,包括膜蛋白、核蛋 白和胞外蛋白等。
➢ 高通量:可同时对8个样本进行分析,特别适用于采用多种处理方式 或来自多个处理时间的样本的差异蛋白分析;
xx
Time(min) 5 90 95
100 105 120
B% 5% 35% 80% 80% 5% stop
质谱鉴定:MS扫描范围400-1800 MS/MS扫描范围100-2000
IDA 采集模式 一个图谱选择四个最强的母离子进行串级扫描。
xx
iTRAQ详细实验步骤
7: 数据检索
(1)蛋白质检索 检索软件:Protein Pilot 3.0 (ABI ,USA)
《蛋白质组学》课件

蛋白质组学技术
本节将介绍蛋白质组学常用的实验技术和分析方法,包括质谱、二维电泳、 蛋白质结构预测等。
蛋白质组学应用领域
本节将探讨蛋白质组学在生物医药、农业和环境科学等领域的应用,展示其 广泛的研究价值。
蛋白质组学研究的重要性
本节将详细解释为何蛋白质组学研究对于解决生物学中的关键问题和推动科学进步具有重要意义。
《蛋白质组学》PPT课件
欢迎观看《蛋白质组学》PPT课件,本课程将介绍蛋白质组学的概念、技术、 应用领域和重要性,以及它的发展趋势。
课程介绍
本节将介绍蛋白质组学的基本概念和研究对象,以及在生物学研究中的重要 性。
蛋白质组学概述
本节将对蛋白质组学的研究内容、方法和技术进行概述,帮助您理解蛋白质组学的基本原理。
蛋白质组学的发展趋势
本节将展望析和应用拓展等方面。
结论和要点
本节将总结蛋白质组学课程的要点和结论,帮助您加深对蛋白质组学的理解 和应用。
蛋白质组学PPT课件

功能蛋白质组学 结构蛋白质组学
.
11
人类蛋白质组学研究进展
2001年成立国际人类蛋白质组组织(HUPO), 2003.12.15启动两个首批行动计划 1.人类肝脏蛋白质组计划(HLPP)由中国军事医学科学
院副院长贺福初院士领导,16国80多个实验室参加。 中国第一次领导重大国际协作计划。 2. 人类血浆蛋白质组计划(HPPP)由美国科学家牵头, 13国47个实验室参加。
双向电泳后的凝胶
经染色后蛋白呈现二维
分布图: 水平方向反映出蛋
白在pI上的差异, 垂直方向反映出它
聚焦后凝 胶放置在 SDS凝胶 上,进行 第二向电 泳
们在分子量上的差别。
第二向电泳: SDS-PAGE
pH9
.
pH9
pH3
分子量大 分子 量小
pH3
18
(1)等电聚焦 凝胶电泳 ( IFE)
利用载体两 性电解质在电场 作用下沿电场方 向在凝胶内形成 一个连续而稳定 的pH梯度。
根据一定的配方计算后,将适宜的IPG试剂添加至混 合物中用于凝胶聚合,在聚合中缓冲基团通过乙烯键共 价聚合至聚丙烯酰胺骨架中而形成pH梯度。通过这种方 式生成的IPG不会发生电渗作用,因而可以进行特别稳 定的IEF分离达到真正的平衡状态。
.
5
第一节 蛋白质组及蛋白质组学基本概念
.
6
什么是蛋白质组?
蛋白质组(proteome):
PROTEOME = PROTE in +genOME Proteins expressed by a genome.
是指“特定细胞、组织乃至机体作为一个 生命单元中所有蛋白质的集合,即生命体中携 带的基因信息在某一时段所表达的全部蛋白质。
蛋白质组学的研究方法和进展ppt课件

垂直方向反映出它们在分子量上的差别。
双向电泳方法的主要步骤:
1. 样品准备 2. 第一向:固相pH梯度等电聚焦 3. 第二向:SDS-PAGE电泳 4. 染色: 考马氏亮兰或银染 5. 图像分析:肉眼或自动扫描
Isoelectric Focusing (IEF) with IPG strips
3-4 mm
遗传或药理学扰动的分子解剖 植物蛋白质组学
进 展(国际)
1996年,澳大利亚建立了世界上第一个蛋白质 组研究中心(APAF)
美国NCI——肺、直肠、乳腺和卵巢等肿瘤的 蛋白质组数据库
NCI与FDA——有关癌症不同发病阶段和治疗 阶段的蛋白质组数据库
英国、法国、德国、日本等国也分别投入巨资 进行蛋白质组学的研究
70 - 240 mm
gel
Plastic backing
固相pH梯度等电聚焦电泳(第一向)示意图
Second Dimension: SDS-PAGE
IEF SDSPAGE
SDS-PAGE电泳(第二向)示意图
Expression Proteomics with 2D Gel Electrophoresis
进 展(国内)
国家自然科学基金委于1997年设立了重大项 目“蛋白质组学技术体系的建立”
1998年启动了蛋白质组学研究 中国科学院生物化学研究所、军事医学科学
院与湖南师范大学已启动蛋白质组研究 中国科学院上海生命科学研究院、军事医学
科学院与复旦大学相继成立了专门的蛋白质 组学研究中心
科技部已将疾病蛋白质组研究列入我国 “973”计划项目和“863”计划项目; 国家自然科学基金委员会也将“蛋白质组 研究”列为重点项目。
Protein Identification
双向电泳方法的主要步骤:
1. 样品准备 2. 第一向:固相pH梯度等电聚焦 3. 第二向:SDS-PAGE电泳 4. 染色: 考马氏亮兰或银染 5. 图像分析:肉眼或自动扫描
Isoelectric Focusing (IEF) with IPG strips
3-4 mm
遗传或药理学扰动的分子解剖 植物蛋白质组学
进 展(国际)
1996年,澳大利亚建立了世界上第一个蛋白质 组研究中心(APAF)
美国NCI——肺、直肠、乳腺和卵巢等肿瘤的 蛋白质组数据库
NCI与FDA——有关癌症不同发病阶段和治疗 阶段的蛋白质组数据库
英国、法国、德国、日本等国也分别投入巨资 进行蛋白质组学的研究
70 - 240 mm
gel
Plastic backing
固相pH梯度等电聚焦电泳(第一向)示意图
Second Dimension: SDS-PAGE
IEF SDSPAGE
SDS-PAGE电泳(第二向)示意图
Expression Proteomics with 2D Gel Electrophoresis
进 展(国内)
国家自然科学基金委于1997年设立了重大项 目“蛋白质组学技术体系的建立”
1998年启动了蛋白质组学研究 中国科学院生物化学研究所、军事医学科学
院与湖南师范大学已启动蛋白质组研究 中国科学院上海生命科学研究院、军事医学
科学院与复旦大学相继成立了专门的蛋白质 组学研究中心
科技部已将疾病蛋白质组研究列入我国 “973”计划项目和“863”计划项目; 国家自然科学基金委员会也将“蛋白质组 研究”列为重点项目。
Protein Identification
蛋白质组学的基本研究方法PPT课件

(3)还原剂用于断裂二硫键,常用的有DTT(二硫苏糖醇)、TDF (二硫赤藓糖)
和TBP(三丁基膦)
使用注意点:
样品离心前在室温下至小保持1小时,使完全变性和溶解;样品含尿素不可加热,
已防蛋白修饰;样品类型不同,选择裂解液的- 组成也不同。
12
(二)蛋白质分步提取技术
-
13
Sample Preparation
μg/ml DNase I 、 5 μg/ml RNase A 。
对大部分细胞提取,第一步与第二步往往出现相同的图谱,最后一步因
膜蛋白提取出来而完全不同。若先将细胞器分级提取,再联合上述方法,
效果将更好。
-
16
(三)亚细胞蛋白质的提取
1、细胞中亚细胞的分离
据蛋白的大小和密度的差异进行分离。细胞破碎后,先低速离心从胞质溶 液中分离出细胞核和未破碎的细胞,得到上清溶液;随后对上清溶液进行密 度梯度分离,得到线粒体、溶酶体等亚细胞器;然后对亚细胞内的蛋白质进 行分离提取。
-
3
2、蛋白质组学研究技术进展
(1)1975年,2-DE技术建立 (2)上世纪80年代,固相化pH梯度凝胶问世,使2D-E的重复性
和加样量改善 (3)上世纪末期,MALDI-TOF-MS和ESI-MS可精确测定相对分子
量和微量 (4)快速多肽序列 (5)90年代,多图象分析与大规模数据处理软件问世,复杂蛋
更多的离液剂进行清洗,可去掉与膜作用不强的非膜蛋白,从而富集膜蛋
白。另外膜蛋白通常位于两相去污系统中相对较丰富的一相。
B、摸蛋白的特性
低丰度、大多偏碱性、难溶于等电聚焦的水相介质中。
C、为了从二维电泳凝胶图谱中分离出膜蛋白,首先必须服从三个条件
蛋白质组学PPT课件
蛋白质组定义
1,基因组表达的全部蛋白质。 2,在一种细胞/组织内存在的全部蛋白 质。
Proteome
• 1994 M.Wilkins and K.W.Williams
•
Macquarie University in Sydney
• Total Proteins Complement of a Genome
环境
ቤተ መጻሕፍቲ ባይዱ
REAL COMPLEXITY…
IS IN CELLULAR ROTEOMES • BEYOND THE GENOME… • Tissue Specific Expression • Alternate Splicing, (1/3 of all genes) • Post-Translational Modifications
Functional
Proteomics
• During human development, cell express different proteins
• Normal and cancer cells express different proteins
• Cell treated with and without drug express different proteins
– Types and Level:
– Signal Sequence cleavage – Glycosylation
– Phosphorylation – Farnylation – Isoprenylation – Acetylation
• All combine > 100-1000 fold increase in complexity
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
辉骏生物:fitgene/
免费服务热线:400-699-1663
1:双向电泳
基于2D-PAGE 的经典定量分 析方法。 1、样品准备 和定量:抽提 对照组和各种 不同实验组的 蛋白质。 2、蛋白质分 离:蛋白质经 过2D-PAGE分离 后染色(银染、 考染等)。 3、蛋白质的 定性与定量分 析:通过与对 照组相Image Master 7.0分 析出实验组中 差异点,质谱 鉴定差异点蛋 白质,同时应用 软件分析出其 表达量的变化。
4:化学标记法—ICAT
ICAT法的缺点: (1)它不能用于标记不含半胱氨酸或半胱氨酸含量低的蛋白质。 (2)ICAT分子量相对较大(约500Da),与蛋白质连接后可能会造成分子 的空间位阻 (3)ICAT分子量相对较大(约500Da),由于在MS分析中标签仍保留在每 个肽上,使得在碰撞诱导解吸(CID)条件下,很容易被片段化,那么标签特 异化的片段离子就会使串联质谱分析标记肽段的过程复杂化, (4) ICAT分子量相对较大(约500Da),这对小肽而言是一个较大的修饰 物,会增加数据库搜索的复杂性 (5)标记时通常需要延长时间来保证ICAT与蛋白质充分结合,这可能会造 成赖氨酸、组氨酸、色氨酸、酪氨酸发生氨基酸局部衍化。 (6)与原子结合的硫醚键化学稳定性较低,可能会自发发生β -消除反应 使部分标签断裂。
蛋白质组学定量研究常见方法
辉骏生物:fitgene/
免费服务热线:400-699-1663
蛋白质组学定量研究常见方法
1:常规双向电泳 2:DIGE 3:15N等同位素标记 4:ICAT 5:iTRAQ 6:SILAC
辉骏生物:fitgene/
免费服务热线:400-699-1663
辉骏生物:fitgene/
免费服务热线:400-699-1663
5: 化学标记法—iTRAQ
简介:
iTRAQ试剂是可与氨基酸末端氨基及赖氨酸侧链氨基连接的胺标记同重元素。在质谱图 中,任何一种iTRAQ试剂标记不同样本中的同一蛋白质表现为相同的质荷比。 在串联质谱 中,信号离子表现为不同质荷比(113-119,121)的峰,因此根据波峰的高度及面积,可以 鉴定出蛋白质和分析出同一蛋白质不同处理的定量信息。
辉骏生物:fitgene/
免费服务热线:400-699-1663
4:化学标记法—ICAT
A: ICAT试剂结构,包括3个部分, SH反应集团, biotin标签,同位素臂, 试剂具有两种形式:重型(含8个氘) 和轻型(不含氘) B: ICAT标记定量技术流程,来源不同 处理的蛋白质分别用重型ICAT试剂和 轻型ICAT试剂标记,标记后等量混合, 胰蛋白酶酶切,亲和纯化得到ICAT标 记的多肽,质谱分析,依据MS质谱峰 图强度进行定量,MS/MS鉴定肽段。
1:常规双向电泳
一、双向电泳概述: 双向电泳(Two-dimensional electrophoresis)的基本原理是利用 蛋白质的等电点(pI)和分子量(Mr)不同而分离蛋白质:第一向电泳—— 等电聚焦(Isoelectric Focusing,IEF)根据蛋白质的等电点不同将蛋 白质分离,第二向电泳——十二烷基硫酸钠—聚丙烯酰胺凝胶电泳 (Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis, SDS—PAGE)利用蛋白质的分子量大小不同将蛋白质分离。 双向电泳一次可以从细胞、组织或其它生物样本中分离上千种蛋白 质,凝胶上的斑点都对应着样品中的蛋白质,且各种蛋白质的等电点,分 子量和含量的信息都能通过质谱鉴定和软件分析获得。因此其在蛋白质组 分析、疾病标志物检测、细胞差异分析、药物开发、癌症研究等领域都得 到了广泛的应用。 二:双向电泳分离蛋白质混合物具有以下优势: 1、经典方法、应用范围广、适用于各类材料; 2、经济实惠,可大规模多个样本筛选和分析。
2:DIGE
简介: DIGE — 双向荧光差异凝胶电泳,利用荧光染料(Cy2, Cy3, Cy5) 能与蛋白质赖氨酸的氨基反应而使蛋白质被标记,标记后蛋白质的等电 点和分子量基本不受影响,等量混合标记好的蛋白质后进行双向电泳, 蛋白质表达量的变化则通过不同荧光的强度来体现。 技术优势: 1:高效性,同一块凝胶上可以电泳两个样品,减轻了工作量; 2:与常规银染相比灵敏度更高; 3:检测动态范围更大; 4:定量精确, 采用内标而消除了胶与胶之间的实验误差; 5:统计学分析,ImageMaster7.0(DIGE)软件可以得到统计学 可信的结果,降低了操作者之间的偏差。
辉骏生物:fitgene/免费服务热线:400-69-16632:DIGE
DIGE荧光定量方法流程图. 1、样品准备:提取对照组和 不同实验组的蛋白质,定量,cy3 和cy5交叉标记,同时将所有实 验组与对照组的样品等量混合后 cy2标记,作为内标。 2、蛋白质分离:等量混合三 种荧光素标记后的蛋白质,2DPAGE电泳分离,荧光显色。 3、蛋白质定量分析:Image Master 7.0(DIGE)分析同一蛋 白质不同处理后的表达量变化。
15
优点: 15 高效性: N标记法是体内标记技术,标记效率可高达95%; 重现性:降低由于样品制备不同而造成的实验内差异; 15 灵活性:在培养基中添加同位素标记 N ,操作方便。
缺点: 14 15 (1)只有已知蛋白质的氨基酸序列,才可以对 N/ N标记的蛋白质或肽段的相应质 量位移进行预测。 15 14 15 (2)由于使用的 N培养基纯度>96%,无法完全置换 N,所以 N标记的肽段在质谱中 会有额外的同位素峰。
3:代谢标记法— N标记法
简介: 15 在培养基中添加 N,细胞经过若干代培养后,蛋白质将完全被同位素标记,等量混 合标记与没有标记同位素的样本、液相色谱和SDS-PAGE分离,质谱鉴定和定量。 根据质谱谱图中成对峰的面积之比可判断出同一肽段在不同样品中的含量变化,根 据二级谱图对肽段进行序列测定从而鉴定蛋白质。
