过渡元素的结合规律
元素周期表中的过渡金属元素

元素周期表中的过渡金属元素元素周期表是一张记录了所有已知元素的表格,它按照一定规律排列了元素的原子序数和化学性质。
其中,过渡金属元素是周期表中的一类重要元素。
本文将介绍过渡金属元素的定义、特性以及在各个领域的应用。
一、过渡金属元素的定义过渡金属元素是指元素周期表中第4至第11族的元素,它们的电子配置在填充d轨道时出现了不规则的变化。
这类元素包括钛(Ti)、铬(Cr)、铁(Fe)、镍(Ni)等,共有38个元素。
过渡金属元素以其独特的物理和化学特性而备受关注。
二、过渡金属元素的特性过渡金属元素具有一系列独特的特性,使其在化学、材料科学以及生物学等领域具有重要应用价值。
1. 变价性:过渡金属元素的最外层电子数较少,因此它们容易失去或吸收电子,表现出多样的化合价态。
例如,铁在+2和+3价之间变化,形成不同的化合物。
2. 高熔点和良好的热导性:过渡金属元素由于其复杂的电子结构和强大的金属键,具有相对较高的熔点和良好的热导性。
因此,它们常被用于高温环境下的合金制备和热传导材料。
3. 催化性能:过渡金属元素在催化反应中起到重要作用。
它们能够改变反应的速率和方向,提高反应的效率。
例如,铂是许多重要催化剂的组成部分,广泛应用于汽车排放控制和化学工业中。
4. 彩色化合物的形成:过渡金属元素形成的化合物常常具有鲜艳的颜色。
这是由于它们d轨道电子的能级结构引起的。
例如,铜(II)离子形成的化合物呈现出蓝色,铬(III)离子形成的化合物呈现出绿色。
三、过渡金属元素的应用由于其独特的化学性质和物理特性,过渡金属元素在许多领域有着广泛的应用。
1. 工业领域:过渡金属元素被广泛应用于材料工程、电子工业和制药工业等领域。
例如,钢中的铁是由铁和碳以及其他过渡金属元素组成的合金,具有高强度和抗腐蚀性。
2. 能源产业:某些过渡金属元素在能源领域具有重要的作用。
铂、钴等元素被用作燃料电池的催化剂,提高其效率和稳定性。
铬和钒等元素则广泛应用于储能材料中。
元素周期表中的过渡金属元素及其性质研究

地壳中过渡金属元素的种类和分布
地壳中过渡金属元素的开采难度和成本
地壳中过渡金属元素的应用领域和价值
地壳中过渡金属元素的丰度排名
过渡金属元素在自然界中的分布:主要存在于地壳中,如铁、铜、锌等
开采方法:根据元素性质和矿床类型选择合适的开采方法,如露天开采、地下开采等
镍的化合物:硫酸镍、氯化镍、硝酸镍等
Hale Waihona Puke 铜元素:原子序数29,位于元素周期表第四周期
铜的物理性质:红色金属,具有良好的导电性和导热性
铜的化学性质:在空气中稳定,不易氧化,但在高温下可与氧气反应生成氧化铜
铜的化合物:包括氧化铜(CuO)、硫酸铜(CuSO4)、氯化铜(CuCl2)等,具有不同的物理和化学性质
汇报人:
元素周期表中的过渡金属元素及其性质研究
目录
添加目录标题
过渡金属元素概述
过渡金属元素的物理性质
过渡金属元素的化学性质
常见过渡金属元素及其化合物
过渡金属元素在自然界中的存在和开采
添加章节标题
过渡金属元素概述
过渡金属元素位于周期表的第4、5、6周期
过渡金属元素包括铁、钴、镍、铜、锌、钼、钨、钽、铌、钌、铑、钯、银、金、铂、汞等
过渡金属元素在工业上广泛应用,如铁、铜、铝等
过渡金属元素在生物体内具有重要作用,如铁、锌等
过渡金属元素在环保领域也有广泛应用,如铬、锰等
过渡金属元素在化学实验中常用作催化剂,如镍、铂等
过渡金属元素的物理性质
过渡金属元素的原子结构:原子半径、电离能、电子亲和能等
电子排布:过渡金属元素的电子排布规律和特点
原子结构对物理性质的影响:如熔点、沸点、导电性等
地球化学元素共生组合关系及结合规律

Geochemistry
College of geological science & engineering,
Shandong university of science & technology
3、与各种阴离子结合的阳离子也组成特征各异
的共生元素组合various paragenetic
计算方法:以氟电负性(最大)为4.0,根据热化学键和分
子键能计算其相对值,无绝对值。
Geochemistry
College of geological science & engineering,
Shandong university of science & technology
规律:(1)同周期,从左至右,电负性递增。
(2)同主族,从上至下,电负性递减。
(3)过渡元素,d轨道存在空轨道,电负性变化不大。
Geochemistry
College of geological science & engineering,
Shandong university of science & technology
应用:
(1)判断元素金属性和非金属性。
(1)元素电子亲和能:气态原子获取一个电子成为-1价离子所释
放的能量。
M(g)+e-→M-(g)
其意义:衡量元素非金属性,电子亲和能越大,越易获得电
子,非金属性越强。
(2)元素电负性:元素的第一电离能和电子亲和能之和。用χ表
示。
意义:原子在化合物中吸引价电子的能力,元素电负性大,
吸引电子能力强,易形成阴离子;电负性小,吸收电子能力越弱。
过渡元素的结合规律

第五节 元素的结合规律
2. 晶体场理论的地球化学意义
(2)过渡金属离子氧化倾向性的强弱
锰结核的实例:
大洋中锰结核是重要的锰矿资源,且伴生有Fe、Co、Ni、Cu等金属。
锰结核中富集Mn, Fe, Co, Cu, Ni,但富集程度有差异。其中:
b. 分裂后d轨道中电子的排布-高自旋状态和低自旋状态
电子成对能(PE):当一个轨道中已
有一个电子时,若在该轨道填入相反
的电子与之成对,而必须克服的电子
与电子之间的静电排斥作用能,称为
电子成对能。
d轨道电子的自旋状态决定于:CFSE vs PE
当
当
CFSE > PE
CFSE < PE
d电子更易排布在能级低的轨道成对,电子低自旋排布
将强烈选择八面体位置。
第五节 元素的结合规律
2. 晶体场理论的地球化学意义
(1) 过渡元素离子从岩浆中结晶进入硅酸盐的情况
过渡元素离子从岩浆中结晶进入硅酸盐矿物的顺序
R是百分之x的岩浆固结后岩浆中某元素浓度和该元素在原始岩浆中浓度比值。
M2+离子:Ni>(Cr)>(Cu)>Co>Fe>Mn>=Zn
位于八面体结晶场中的过渡离子,与它处于四面体结晶场的情况相比,稳
ห้องสมุดไป่ตู้定程度增大,这就促使离子优先占据八面体配位位置。
八面体择位能的实际意义:
位于八面体晶体场中的一个离子,与它处于四面体晶体场中的情况相比,在能量
上降低,或者说其稳定程度增大,这就促使离子优先占据八面体配位位置。
化学教学:过渡金属元素

配位化合物
6-3.2
配位化合物
配位化合物-混成轨域与几何形状
具有平面四边形及八面体形结构之错合物,有可 能具有几何异构物。
例如:二氯二氨铂,
具有顺式与反式两种异构物,如图:
例如:卤素离子、氰离子、硫氰离子 (SCN-)、 一氧化碳、氨和水等。
若配位子中有两个以上的原子具有孤对电子,可同时 和中心金属形成键结,则称为 多牙 配位子,
例如: 乙二胺( 化学式: H2N-CH2-CH2-NH2 ),
• 常以 en 表示, • 分子中两个氮原子皆具有一对孤对电子,可分别与中心金
6-3.1 常见过渡金属元素的性质
一.Fe
由鼓风炉炼铸而得的铁称为生铁,又称铸铁, 含有约2 ∼ 4.5%的碳,
质脆缺乏韧性及强度。 再经由一连串的热处理程序,可使其中的含碳
量减少,并使其结构重组,而形成所谓碳钢; 碳钢依其含碳量可分为:
低碳钢、中碳钢及高碳钢, 其机械性质不同,各有不同用途。如表: 炼铁产生的熔渣则可用来制造水泥。
动画:金属错合物
第二价称为配位数 (coordination number),
即中心金属与配位子间的键结数目。
例如:黄血盐 K4[Fe(CN)6], 中心为氧化数+2 的亚铁离子,其配位数为 6。
6-3.2
配位化合物
常见过渡金属离子的配位数
配位数多寡与中心金属的大小、电荷数与电子组 态有关,
一般最常见到之配位数为 6, 其次则为 4 配位和 2 配位。
为强调配位化合物中错离子的部分, 一般会以 [ ] 括号标记。
6-3.2
配位化合物
配位化合物的发现
配位化合物早在 1700 年代即被发现,但直至1890
2020年高中化学·强化讲义 第53节 过渡元素简介

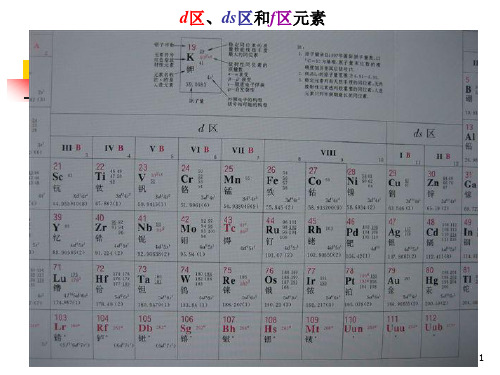
第53节过渡元素简介一、过渡元素简介过渡元素在元素周期表中的位置和外围电子层排布从元素周期表上可以看到,表的中部从ⅢB 族到ⅡB 族10个纵行,包括镧系和锕系,共有63种元素,这些元素包括了第VI 族和全部副族元素,人们习惯上把它们叫做过渡元素。
过渡元素的价层电子构型为1~101~2(1)ds n n (Pd 为0ns )。
在元素周期表中,它们处于s 区元素和p 区元素之间。
从性质上看,s 区元素的单质均为活泼元素,形成的化合物以离子型为主,其氧化数单一,离子没有颜色;p 区元素只有部分是金属元素,形成的化合物多为共价型,含有多种氧化数;d 区介于s 区和p 区之间。
因此,人们又称d 区元素为过渡元素。
它们分属于第四周期到第七周期,如图11-1所示过渡元素原子的电子层排布有共同的特征。
从图中可以看出,它们的最外电子层上都有1~2个s 电子(Pd 除外),随着原子序数的递增,增加的电子大多填充在次外层的d 轨道上其中镧系和锕系元素的原子,增加的电子主要填充在倒数第三层的f 轨道上,少数填充在次外层的d 轨道上。
过渡元素原子的外围电子层排布反映了它不同于主族元素原子的核外电子排布的特征。
例如,钪(Sc )的外围电子层排布为3d4s2,铀(U )的外围电子层排布为5f6d7s2。
过渡元素的许多性质,都跟它们的外围电子层排布有关。
二、过渡元素的通性过渡元素原子的最外层一般只有1~2个电子,在化学反应中较易失去,故它们都是金属元素。
相对于主族元素而言,过渡元素的特性及其性质变化规律主要表现在以下几个方面1.单质的物理性质过渡元素的单质有些是高熔点、高沸点、密度大、硬度大、导电和导热性良好的金属。
在金属元素中,熔点最高的是钨,密度最大的是锇,硬度最大的是铬。
例如:铂的密度是21.45g/cm 3,约是铝的8倍;钨的熔点是3410℃,是所有金属中最难熔的。
造成这些特性的原因是过渡元素的单质因原子半径小,采取最紧密堆积,原子之间除了有电子外,还用部分d电子参与成键,在金属键之外有部分共价键,因此结合牢固。
过渡元素化学活泼性变化规律

过渡元素化学活泼性变化规律过渡元素是周期表中3B到3G族元素的统称。
它们具有许多共同特征,其中包括化学活泼性的变化规律。
活泼性是指元素与其他物质发生化学反应的倾向程度,而过渡元素的活泼性则受到电子排布和核电荷的影响。
本文将探讨过渡元素化学活泼性的变化规律及其影响因素。
过渡元素电子排布的影响过渡元素的电子排布主要集中在d轨道上,d轨道电子能级复杂,这种复杂性导致了过渡金属的化学性质具有不确定性。
一般来说,过渡金属的化合物具有不同的化合价数,使其在化学反应中表现出多样性。
电子排布的复杂性也影响了过渡金属的物理性质,如磁性和导电性。
核电荷的影响核电荷是过渡金属原子核所带正电荷的大小,在同一周期内,核电荷增加,原子半径减小,活泼性增加。
从左到右,原子核对外部电子的吸引作用逐渐增强,使得元素的活泼性逐渐增加。
因此,在同一族元素中,活泼性随着周期表的位置而变化。
过渡金属的氧化还原性过渡金属的氧化还原性体现为标准电极电势的变化。
在一般的情况下,过渡金属离子具有多种氧化态,它们之间有较大的氧化还原性差距。
金属离子的氧化还原电位反映了金属在化学反应中的还原倾向,而活泼性与还原性密切相关。
丰富的氧化态使过渡金属在催化和电化学方面有着重要应用。
影响过渡元素活泼性的其他因素在实际化学反应中,除了电子排布和核电荷,还有许多其他因素会影响过渡元素的活泼性。
例如,配位数、配体取代作用、溶液中的配位效应等都对活泼性有着重要的影响。
在复杂的化学反应中,这些因素综合作用,使活泼性的预测变得更加复杂。
总的来说,过渡元素化学活泼性的变化规律受到多种因素的影响,包括电子排布、核电荷、氧化还原性等。
了解这些规律有助于我们更好地理解过渡金属元素在化学反应中的行为,为材料科学和催化化学的发展提供理论基础。
过渡元素

油状 绿色
MnO2+O2+O3
MnO42- +CO2 MnO2 + CO2 Mn2++CO2
由软锰矿制备KMnO4
软锰矿 粉碎
氧化剂
OH- △
K2MnO4 墨绿色
常用的氧化剂有O2、KNO3和KClO3。反应介质为KOH或K2CO3。
2MnO2+4KOH+O2 == 2K2MnO4+2H2O 3MnO2+6KOH+KClO3 == 3K2MnO4+KCl+3H2O MnO2+K2CO3+KNO3 == K2MnO4+KNO2+CO2↑
过渡元素的通性
具有部分填充d或f壳层电子的元素。 狭义:(n-1)d1~8ns1~2 ⅢB~Ⅷ 8列 10列
广义:(n-1)d1~10ns1~2 ⅢB~ⅡB
过渡元素全部为金属,其化合物颜色多、 变 价多、形成配合物多。
• (n-1)d1~10ns1~2 (Pd:4d105s0) • d电子数较多. • d电子可部分或全部成键. • d轨道未充满可接受孤电子
1.33V -0.41V -0.91V 2-————Cr3+————Cr2+————Cr
Ea
θ:
Cr2O7
酸性介质氧化性强,碱性介质还原性强
Cr2O7
酸 性 Cr3+ 介 质 MnO 4-+H+
Ag+
2- +ຫໍສະໝຸດ SO42-S2O82-
H2O2 碱 性 CrO2- 介 质 Br2
CrO42-+H2O
化学反应中的过渡金属配位机制

化学反应中的过渡金属配位机制过渡金属配位化学是现代化学中一个重要且广泛的领域。
过渡金属元素能够形成稳定的配合物,这是由于它们具有未填满的d轨道,这些电子可以与配体中的原子轨道相重叠形成配位键。
通过深入研究过渡金属配位机制,我们可以更好地理解和设计化学反应以及新型配合物的合成。
一、配位键的形成机制过渡金属配位化合物的形成涉及配体和过渡金属离子之间的配位键的形成。
配体是指可以提供一个或多个电子对给过渡金属离子的化合物或离子。
配位键的形成机制包括配体提供电子对,通过共价键形成以及配体和金属之间的电荷转移。
在形成配位键时,配体中的原子轨道与过渡金属离子中的未填满的d轨道重叠,产生一个共价键。
这种配位键的形成可以通过Donor-Acceptor模型来解释,即配体作为电子给体,提供电子给金属离子作为受体。
二、配位数与配位键的影响过渡金属离子的配位数是指围绕中心金属离子所形成的配位键数目。
配位数取决于过渡金属元素的电子结构以及配体的性质。
常见的配位数有4、5、6等。
配位数的变化会影响到配位化合物的性质和化学行为。
不同配位数的配合物在稳定性、溶解度、光谱性质等方面表现出不同的特点。
此外,配位数的变化还会影响到反应的速度和机理。
三、配位发生的动力学概念了解配位发生的动力学概念对于理解过渡金属配位机制至关重要。
配位发生包括两个方面:配合物的形成和解离。
配合物的形成速率取决于配体和过渡金属离子之间的反应速率以及配体的浓度。
配体的取代反应可以通过互变反应速率常数来评估,而配体的电子效应和空间位阻则会影响反应速率。
配合物的解离取决于配合物中配体与金属之间的键强度、水解能力以及其它配体促进解离的因素。
理解配合物的解离机理可以帮助我们设计更稳定的配位化合物或者利用溶剂效应来控制反应速率。
四、配位理论的应用过渡金属配位机制的研究在很多领域中都有着广泛的应用。
例如,配位化合物在催化反应、药物设计、材料科学等方面起着重要的作用。
通过深入研究过渡金属配位机制,可以开发新的催化剂,设计具有特殊功能的材料,并提供新的药物研究方向。
元素周期表的过渡元素特点

元素周期表的过渡元素特点元素周期表是化学中最为重要的基础性工具之一,它分布了各种不同类型的元素,并将它们按照一定的规律排列。
其中,过渡元素是元素周期表中的一类特殊元素,它们在化学反应中具有独特的性质和特点。
本文将介绍过渡元素的特点,并探讨其在实际应用中的意义。
一、电子结构的特殊性过渡元素的电子结构较为特殊,其外层电子结构不符合象征法则。
一般来说,过渡元素的外层电子数介于2至8之间,这使得它们在反应中表现出多样的氧化态。
例如,铁原子的电子结构为1s² 2s² 2p⁶ 3s²3p⁶ 4s² 3d⁶,其中3d电子可以通过氧化反应使铁原子的氧化态从+2变化到+6。
这一特性赋予了过渡元素广泛的化学活性和催化能力。
二、金属性质的显著特点过渡元素大部分为金属元素,其具有许多典型的金属性质。
首先,它们具有良好的导电性和导热性,能够在电路和热传导中发挥重要作用。
其次,过渡元素具有较高的硬度和强度,使其成为制造强度高的合金和强韧材料的重要组成部分。
此外,过渡元素还能够发生氧化还原反应,并在反应中形成带有不同电荷的离子,从而广泛应用于蓄电池和电解质中。
三、配位物性质的多样性过渡元素在形成配合物时具有丰富的多样性。
它们能够与不同数量和类型的配体形成稳定的配合物,并呈现出不同的配位数和几何构型。
例如,铜离子在形成配合物时可以呈现出四面体、正方形或八面体的构型,这取决于配体的类型和数量。
这一特点使得过渡元素在配位化学和催化反应中具有广泛的应用价值。
综上所述,元素周期表中的过渡元素具有独特的特点和性质。
其电子结构的特殊性赋予了过渡元素多样的氧化态和催化能力。
过渡元素作为金属元素,具有良好的导电性和导热性,并在氧化还原反应中发挥重要作用。
此外,过渡元素在形成配合物时呈现出多样的配位数和几何构型。
这些特点使得过渡元素在化学领域中具有广泛的应用和重要的地位。
深入了解和研究过渡元素的特点,将有助于我们更好地理解化学反应的本质和发展新的化学材料及技术。
过渡金属Fe,Al,Cu

I.铁Fe一、铁的结构和性质1.铁是26号元素,位于第四周期第训I族,属于过渡元素。
原子结构示意图:主要化合价:+2, +32.铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/cm 3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3.铁是较活泼的金属元素,在金属活动性顺序表中排在氢的前面。
①跟非金属反应:点燃点燃△3Fe+2O2 == Fe3O42Fe+3Cl2 ==2FeCl3 Fe+S= FeSFe+I2= FeI2②跟水反应:3Fe+4H20==(高温)==Fe3O4+4H2炼铁料化学原理铁矿石、焦炭、石灰石、空气在高温下用还原剂从铁矿石里还原出来I①还原剂的生成炼钢生铁、空气(或纯氧、氧化铁)、生石灰、脱氧剂在高温下用氧化剂把生铁里过多的碳和其它氧化为气体或炉清除去I ______________________________________________________________________________________①氧化:2Fe+02fBi温 2FeOC+O2=CO2CO +C 同温2CO 2FeO氧化铁水里的Si、Mn、C等。
如 C+FeO②铁的还原亘ie+COTFe2O3+3CO )高2Fe+3CO2②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。
③炉渣的生成③脱氧,并调整Mn、Si含量CaCO3向温 CaO+CO22FeO+SiEL=E2Fe+SiO2③跟酸作用:Fe+2H+=Fe2++H t (遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应2不产生H2,且氧化性酸过量时生成Fe3+)④与部分盐溶液反应:Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+4.炼铁和炼钢的比较1.过渡元素位于周期表中中部从niB〜ii B族十个纵行,分属于第四周期至第七周期。
过渡元素都是金属,又叫过渡金属。
过渡元素半径变化规律及解释

过渡元素半径变化规律及解释过渡元素半径变化规律,其实听起来有点复杂,但我们一起来聊聊,让它变得轻松些。
大家知道,过渡元素就是那些在元素周期表中间,像个明星一样闪闪发光的家伙,它们包括铁、铜、镍等等。
说起它们的半径变化,哎,真的是个有趣的话题。
想象一下,一条过渡元素的长河,随着元素的不同,水位时高时低,真是让人忍不住想要跳进去游泳。
先说说元素的周期性变化。
一般来说,元素的半径随着原子序数的增加而逐渐减小。
这就好比一个越来越紧凑的派对,原本你在一个宽敞的大厅里,后来慢慢变成了一个小房间,大家都挤在一起,空间变小了,但每个人的热情却丝毫不减。
这是因为随着原子序数增加,原子核的正电荷也增加,这种电荷吸引电子,让电子跑得更近,更贴心。
所以,半径就像是被施了魔法,越来越小。
然后,我们再聊聊这个现象背后的原因。
就像一位无形的导演,控制着舞台上的每一个角色。
过渡元素中,d轨道的电子逐渐填充,这可真是个神奇的过程。
当我们看着电子们在不同轨道中舞动时,会发现,d轨道的电子并不特别想参与进来,反而让周围的s轨道电子变得更加紧张,产生了一种“电子间的竞争”,这时候,原子半径就更小了,简直是心机满满。
不能忽视的是,随着我们从左到右移动,元素的电负性也是在悄悄变化的。
电负性就像一个强势的女王,慢慢提升了大家的自我要求。
在这种情况下,元素对电子的吸引力增加,导致了半径的进一步缩小。
这种变化,就像生活中一个人从懵懂青涩到成熟稳重,越是走向成熟,越能吸引到其他人靠近。
再说到纵向变化,也就是从上到下的变化。
纵向上,元素的半径可就大不相同了。
想象一下,从高处往下看,感觉一览众山小,但实际情况是,越往下走,空间越大,半径也随之变大。
这主要是因为能级的增加。
就像楼房越盖越高,住的人自然得往上搬,电子们也得在新的层次上安家。
于是,半径就越来越大,就像一个在聚会上越吃越多的小伙伴,身材也自然跟着水涨船高。
有趣的是,过渡元素的半径变化还跟它们的化学性质密切相关。
化学元素周期表序号和化合价规律总结

化学元素周期表序号和化合价规律总结化学元素周期表是化学家们对元素的分类和组织的一种重要工具,通过周期表,我们可以更好地理解元素的性质和特点。
其中,元素的序号和化合价也是周期表中的两个重要概念,它们在化学反应和化学方程中扮演着不可或缺的角色。
本文将对元素周期表序号和化合价规律进行总结和说明。
一、化学元素周期表序号元素周期表是由俄罗斯化学家门捷列夫提出的,他根据元素的原子序数和化学性质将元素进行了分类和组织。
元素的原子序数或者称为序号,指的是元素原子核中质子的数量,也是唯一标识元素的特征之一。
元素周期表按照原子序数的递增顺序,从左上方第一行开始,往右和往下进行排列。
第一行的元素只包括氢和氦,它们是最轻的元素,只有一个质子。
随着原子序数的增加,元素逐渐排列在周期表的不同阶梯和周期中。
周期表的每一周期都代表着一个能级或一层,从第一周期到第七周期,元素的原子序数依次递增。
每一个周期中,元素的性质和特点都会表现出明显的周期性变化。
例如,第一周期的元素是典型的金属,而第二周期的元素呈现出明显的非金属性质。
此外,元素周期表中的主族元素和过渡元素也是根据元素的序号进行划分的。
主族元素是周期表中的1A到8A族元素,它们的化合价规律相对简单,与其序号有直接的关联。
过渡元素出现在周期表的中间区域,它们的原子序数较大,化合价规律相对复杂一些。
总之,元素的序号在周期表中决定了元素的位置和分类,它们是了解元素性质和特点的重要指标。
二、化学元素化合价规律化合价指的是元素在化学反应中与其他元素结合时所呈现的电荷数。
化合价规律是指相同族元素在化合物中的最常见化合价的规律性变化。
1. 主族元素的化合价规律主族元素的化合价规律相对简单,通常等于它们的族号。
例如,第一族元素的化合价通常为+1,第二族元素的化合价通常为+2。
这是因为主族元素的外层电子数目决定了它们的化合价。
然而,主族元素并不总是呈现相同的化合价,有时会出现例外情况。
例如,氧气属于第16族,通常的化合价是-2,但在一些化合物中也可以表现出+2的化合价。
无机化学——过渡元素

3CH3CH2OH+2K2Cr2O7+8H2SO4=3CH3COOH+
2K2SO4+2Cr2(SO4)3+11H2O 应用于检验酒后开车。检验过氧化氢的存在,生成Cr(O2)2O。 实验室中常用的铬酸洗液是用热的饱和重铬酸钾溶液与浓硫
V2O5:为两性偏酸性的氧化物,是一种重要的催化剂。 2NH4VO3=V2O5+2NH3+H2O V2O5+Ca=V+CaO V2O5+NaOH=Na3VO4+3H2O V2O5+6HCl=2VOCl2+Cl2+H2O VO2++Fe2++H+=VO2++Fe3++H2O 2VO2++C2O42-+4H+=2VO2++2CO2+2H2O
三、Zr和Hf的分离 钾和铵的氟锆酸盐和氟铪酸盐在溶解度上有明显的差别,可利 用此性质来分离Zr和Hf。
金属钛
钛
钛合金
钛合金
镍钛合金
镍钛合金
蓝宝石含钛刚玉
蓝 宝 石 含 钛 刚 玉
四、金属钛的制备
工业上常用FeTiO3为原料来制金属钛 1、矿石中含有FeO、Fe2O3杂质,先用浓硫酸处理
FeTiO3+3H2SO4=FeSO4+Ti(SO4)2(TiOSO4)+3H2O FeO+H2SO4=FeSO4+H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 2、加入单质铁把Fe3+离子还原为Fe2+离子,冷却至273K以下 使FeSO4·7H2O结晶析出。加热煮沸Ti(SO4)2和TiOSO4 TiOSO4 (TiOSO4)+ H2O =H2TiO3↓+H2SO4 3、分离煅烧 H2TiO3=TiO2+H2O 4、碳氯法 TiO2+2C+2Cl2=TiCl4+2CO 5、在1070K用熔融的镁在氩气氛中还原TiCl4可得海棉钛,再 经熔融制得钛锭。TiCl4+2Mg=2MgCl2+Ti
过渡元素

(3)还原法
原理:用还原剂还原化合物(如氧化物等)来制取单 质,一般常用的还原剂是焦炭,CO、H2、活泼金属等。
例: 高炉炼铁: Fe2O3+3CO 2Fe+3CO2 铝热剂法: Fe2O3+2Al 2Fe+Al2O3 应用范围:用于制取活泼性不是很强的金属及以正氧 化值存在的非金属单质。 氧化物能否被还原,可以用消耗1mol O2生成氧化物过 程的△G变化对温度作图(见p322图8-5,Ellingham图)来 分析。 一些金属还可以从卤化物中用还原法提取,也可采用 电解、水溶液电积等方法提取。
0 5 10 15 20 24
3d
r/a0
8.2.2(n-1)d与ns轨道能级高低
▲ 电子组态:由n,l表示的电子排布方式。 ● 多电子原子核外电子的填充顺序:
1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p…
▲ 过渡元素在周期表中为何延迟出现?3d排在4s之后,4d 在5s后,4f,5d在6s后,5f,6d在7s后。 ● 电子在原子轨道中的填充顺序,并不是原子轨道能级高低 的顺序,填充次序遵循的原则是使原子的总能量保持最低。 填充次序表示,随Z增加电子数目增加时,外层电子排布的规 律。(见 图8-4,p317)
2、单质的制取方法 通常有五种:物理分离法,热分解法,还原法,氧
化法和电解法。 (1)物理分离法 原理:单质与杂质在某些物理性质(如密度、沸
点等)上有显著差异的特点。 例: “沙里淘金”(密度差异);
应用范围:分离、提取以单质状态存在,且某些物理 性质与杂质差异较大的元素。
过渡元素半径变化规律及解释

过渡元素半径变化规律及解释过渡元素在化学中扮演着重要的角色,通过其半径的变化,我们可以深入了解周期表中元素性质的变化规律。
本文将对过渡元素的半径变化规律及其解释进行详细探讨。
过渡元素的半径变化规律在周期表中,过渡元素的原子半径随着周期数的增加呈现出规律性的变化。
一般来说,同一周期内,原子序数越大的元素,其原子半径越小;而在同一族内,原子序数越大的元素,其原子半径也越小。
以3d过渡元素为例,从左到右逐渐增加周期数,我们可以观察到原子半径先减小后增大的变化趋势。
这是因为在向右移动时,正电荷核子数量增加,电子壳层中的电子数量也增加,使得电子云密度增大,原子半径减小;而在某个点之后,电子的屏蔽效应开始发挥作用,使得原子半径逐渐增大。
过渡元素半径变化规律的解释过渡元素半径变化规律的背后是原子结构的变化。
原子的半径主要受到原子核中的正电荷数量、外层电子数目以及电子云的屏蔽效应等因素的影响。
随着周期表中元素周期数的增加,原子核中的正电荷数量增加,电子云受到更强的吸引力,原子半径减小。
然而,电子排布的规律性也会对半径变化产生影响。
在同一周期内,电子层次的变化导致原子半径呈现出周期性的增减。
另外,屏蔽效应也是影响原子半径的重要因素。
随着电子层次的增多,内层电子对外层电子产生屏蔽效应,减弱了外层电子与核子的相互作用力,使得原子半径逐渐增大。
总而言之,过渡元素的半径变化规律是受多种因素相互作用的结果,只有综合考虑这些因素,才能全面解释过渡元素半径的变化趋势。
结论通过本文的探讨,我们了解到过渡元素的半径变化规律具有一定的周期性。
这种周期性变化不仅反映了原子结构的特点,也为我们理解元素的性质和化学反应过程提供了重要的参考。
更深入的研究过渡元素半径的变化规律,将有助于我们在化学领域取得更多的科研成果和应用发展。
在实际应用中,通过对过渡元素半径变化规律的研究,我们可以合理设计材料结构、优化工艺流程,提高材料性能和化学反应的效率,为科学技术的进步做出更大的贡献。
元素周期表中的过渡金属元素特性

元素周期表中的过渡金属元素特性元素周期表是现代化学学科的基本工具之一,它将所有已知的化学元素组织成特定的顺序。
在这个表中,过渡金属元素占据了一整个区域,包括3d系列和4d系列的元素,它们具有特殊的化学和物理性质,对于我们理解和应用元素周期表是非常重要的。
本文将重点探讨过渡金属元素的特性。
一、原子结构过渡金属元素的共同特点是它们的原子结构中有一个或多个未填满的d轨道。
这意味着过渡金属元素的电子结构在外层电子的填充上有一些特殊规律。
以铁(Fe)为例,其电子结构为1s² 2s² 2p⁶ 3s² 3p⁶ 4s²3d⁶,其中未填满的3d轨道成为其特征。
二、物理性质过渡金属元素常常具有良好的导电性和热导率。
这是由于它们的原子结构中的未填满d轨道,能够容纳更多的电子和形成更复杂的电子结构,从而增强导电性能。
此外,过渡金属元素的硬度通常较高,且具有高熔点和高密度。
这些物理性质使得过渡金属元素在工业和科学研究中有广泛的应用。
三、化学性质1. 变价性:过渡金属元素通常具有多种变价态。
由于其未填满的d轨道,过渡金属元素可以通过失去或获得d轨道中的电子来形成不同的化合物。
这种多变价性使得过渡金属元素在催化剂、电池等领域有着重要的应用。
2. 形成配合物的能力:过渡金属元素具有形成配合物的能力,这是由于它们的d轨道可以接受配体的电子对并与之形成稳定的配合物。
这种能力使得过渡金属元素在生物学、医药化学和材料科学等领域具有广泛的应用。
3. 催化活性:由于其特殊的电子结构和变价性,过渡金属元素经常作为催化剂在化学反应中发挥着重要的作用。
例如,铂(Pt)常用来催化氢气和氧气的结合以产生水,铁(Fe)则在哈伯-博什过程中用作氨的合成催化剂。
四、应用领域过渡金属元素在许多领域都有着广泛的应用。
例如,铁、钴(Co)和镍(Ni)被广泛建筑和汽车制造业用作钢铁的合金成分。
铜(Cu)是一种重要的导电金属,广泛应用于电子、电力和通信行业。
过渡元素

铜的重要化合物 银的重要化合物 金的重要化合物
氧化物与氢氧化物 在Cu2+离子的溶液中加入强碱,即生成淡蓝色的氢 氧化铜Cu(OH)2絮状沉淀: Cu2+ + 2OH- == Cu(OH)2↓ Cu(OH)2受热分解变成黑色的氧化铜CuO: Cu(OH)2 ===== CuO + H2O Cu(OH)2微显两性,既能溶于酸,也能溶于浓NaOH: Cu(OH)2 + H2SO4 == CuSO4 + 2H2O Cu(OH)2 + 2OH-(浓) == [Cu(OH)4]2-
单质铜的化学性质 在电位顺序中,铜在氢之后,所以铜不能与稀 盐酸或稀硫酸作用放出氢气。但铜容易被硝酸或热 浓硫酸等氧化性酸氧化而溶解: 3Cu + 8HNO3(稀) == 3Cu(NO3)2 + 2NO↑+4H2O Cu + 4HNO3(浓) == Cu(NO3)2 + 2NO2↑+ 2H2O Cu + 2H2SO4(浓) ===== CuSO4 + SO2↑+ 2H2O
Ag2O是氧化剂,它容易被CO或H2O2还原: Ag2O + CO = 2Ag + CO2 Ag2O和MnO2、Co2O3、CuO的混合物能在室温 下,将CO迅速氧化成CO2,因此常用于防毒面 具中。
硝酸银 硝酸银AgNO3 是最重要的可溶性的银盐,是一 种重要的化学试剂,它的制法是:将银溶于硝酸, 然后蒸发并结晶即可得到无色透明的斜方晶体 AgNO3: Ag + 2HNO3(浓) = AgNO3 + NO2↑ + H2O 3Ag + 4HNO3(稀) = 3AgNO3 + NO↑ + 2H2O
第17章过渡金属元素ppt课件
CO CO CO CO
Ni(CO)4 四面体
问 实测:Ni—C键长184 pm,理论:Ni—C键长198 pm;
题 CO把电子给予Ni,Ni上负电荷过剩,使该化合物不稳定, 而事实Ni(CO)4十分稳定。
19
CO的分子轨道式
接受Ni的d电子
(1σ)2 (2σ)2 (3σ)2 (4σ)2 (1π)4 (5σ)2 (2π)0 (6σ)0
V(OH)2 弱B
V(OH)3 更弱B
V(OH)4 AB
HVO3 A
Cr(OH)2 B
Cr(OH)3 BA
H2CrO4 A
Fe(OH)2 B
Fe(OH)3 BA
同一元素低价态化合物碱性比高价态碱性强。
八、配合物:
形成配合物倾向 比主族Mn+大得多:
① (n-1) d 与 ns 能量相近,(n-1)d电子参与成键; ② d 区 Mn+: (9 17)e构型, (强极化力 + 大变形性)。
2. 羰基簇合物 (分子中含有M—M键的化合物) 过渡元素能和CO形成许多羰基簇合物。 羰基簇合物中金属原子多为低氧化态并具有适宜的d轨道。
双核和多核羰基簇合物中羰基与金属原子的结合方式: (1) 端基(1个CO和1个成簇原子相连);(2) 边桥基(1个CO 与2个成簇原子相连);(3) 面桥基(1个CO与3个成簇原子相 连)。
OsO4
Fe(VI) 和 Ni(VI) 具有强氧化性
FeO42- 高铁酸根 NiO42- 高镍酸根 Z *↑,不是所有(n-1)d电子都参与成键。
5
3. 氧化态的稳定性
(1) 同一周期
IIIB
VIIB
VIII
最高氧化态
+3
过渡元素
变 浅
VO43- 淡黄 NbO43-无色 TaO43-无色
CrO42-黄色 MoO42-淡黄 WO42-淡黄
MnO4-紫红色 TcO4-淡红 ReO4-淡红
变 浅
(d)同种元素在同一化合物中存在不同氧化态时,这种
混合价态的化合物常常呈现颜色,而且该化合物的颜色比
相应的单一价态化合物的颜色深
例如:
普鲁士兰 黄血盐 赤血盐
(2)物质显色的若干规律(常温,太阳光)
(a)绝大多数具有d1-9电子组态的过渡元素和f1-13
电子组态的稀土元素的化合物都有颜色
f 区
Ce3+ Pr3+
Nd3+
Pm3+ Sm3+ Eu3+ Gd3+
Tb3+
Dy3+
Ho3+
Er3+
Tm3+ Yb3+
无色 黄绿 红紫 粉红 淡黄 粉红 无色 粉红 淡黄 黄色 桃色 淡绿 无色
原子 半径 pm 181 160 143 136 136 133 135 138 144 149
第一电离 能
氧化值
kJ·mol-1 606.4 3
642.6 2, 3, 4
642.3 2, 3, 4, 5
691.2 0, 2, 3, 4, 5, 6
708.2 0, 4, 5, 6, 7
707.6 0, 3, 4, 5, 6, 7, 8
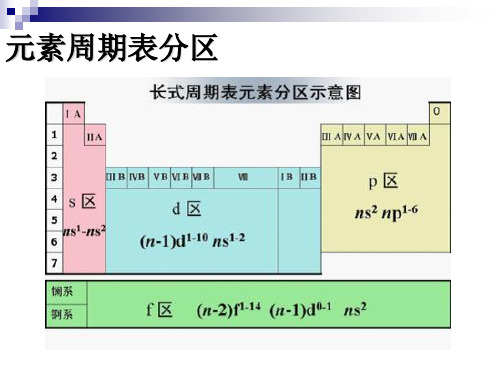
元素周期表分区
一、过渡元素的通性
1、过渡元素的氧化态 2、原子半径的变化规律 3、过渡元素单质的性质 4、过渡元素离子的颜色 5、过渡金属及其化合物的磁性 6、过渡元素易形成配合物 7、形成多碱、多酸
一、过渡元素的通性
1、过渡元素的氧化态
(1)大多数过渡元素有可变的氧化数
(2)第一过渡系,随原子序数增加,氧化态升高, 高氧化态趋于稳定,当d电子超过5时,3d轨道趋向 稳定,低氧化态趋于稳定;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
八面体择位能的实际意义:
位于八面体晶体场中的一个离子,与它处于四面体晶体场中的情况相比,在能量 上降低,或者说其稳定程度增大,这就促使离子优先占据八面体配位位置。 如V3+、Cr3+、Mn3+、Ni2+、Cu2+具有高的OSPE,在氧化物和含氧盐类等矿物中 将强烈选择八面体位置。
第五节 元素的结合规律
Burns (2005)
第五节 元素的结合规律
2. 晶体场理论概要
c. 八面体择位能(OSPE)
同一元素且配位体相同时,2种配位方式的分裂能关系一般为:
八面体择位能 (the octahedral site preference energy, 简称OSPE ): 八面体与四面体的晶体场稳定能之差。 意义是什么?
d-block
d亚层和f亚层未充满
结构不稳定, 易形成变价离子 Fe2+、 Fe3+、 Mn2+ 、Mn3+ 、Mn4+
f-block
第一过渡系元素:Sc-Zn
第二过渡系元素:…
第五节 元素的结合规律
2. 晶体场理论概要 晶体场理论的几个基本要点:
1) 简化的模型(前提):中心离子和配位体之间的作用是单纯的静电 引力,并把配位体当作点带负电的点电荷来处理。不考虑配位体的 轨道电子对中心离子的作用; 2) 晶体场理论只能用于具有离子键的矿物,如硅酸盐、碳酸盐矿物等 ,不适用于共价键矿物; 3) 过渡金属阳离子d轨道的能级取决于: A. 晶体场的强度(周围配位体的类型) B. 电场的对称性(配位体的对称性)—影响晶体场分裂能
2)了解晶体场对过渡元素行为的控制及晶体场理论在
地球化学中的应用
第二章总结
元素的地球化学分类(性质,丰度) 元素的结合规律(一般规律,微量元素结合规律,
过渡元素结合规律)
元素的结合规律 1.元素结合的一般规律(常量元素) (1)键性对应结合规律 (2)电价对应结合规律 2.微量元素的结合规律 (1)两种元素电价相同,半径较小者优先进入晶格 (2)两种离子半径相似而电价不同时,较高价的离子优 先进入矿物晶格 (3)若是过渡元素,其还受晶体场稳定能影响 3.过渡元素的结合规律
第五节 元素的结合规律
2. 晶体场理论的地球化学意义
(2)过渡金属离子氧化倾向性的强弱
锰结核的实例: 大洋中锰结核是重要的锰矿资源,且伴生有Fe、Co、Ni、Cu等金属。 锰结核中富集Mn, Fe, Co, Cu, Ni,但富集程度有差异。其中: 强氧化的锰结核:相对富集Co 弱氧化性锰结核:相对富集Ni
电子成对能(PE):当一个轨道中已
有一个电子时,若在该轨道填入相反 的电子与之成对,而必须克服的电子 与电子之间的静电排斥作用能,称为 电子成对能。
d轨道电子的自旋状态决定于:CFSE vs PE 当 当
CFSE > PE CFSE < PE
d电子更易排布在能级低的轨道成对,电子低自旋排布 d电子更倾向在能级高的轨道, 电子高自旋排布
第五节 元素的结合规律
2. 晶体场理论概要
c.四面体中的d轨道能级分裂 四面体晶体场分裂能Δt: t2g与eg轨道能级间的能量之差
晶体场稳定能:
CFSE=n(e2g)×−2/5Δ t + n(t2g)×3/5Δt
Burns (2005)
第五节 元素的结合规律
2. 晶体场理论概要
c. 四面体中的d轨道能级分裂
元素的结合规律
一、元素结合规律的概念 二、元素的基本性质 三、元素的地球化学亲和性 四、元素的地球化学分类 五、元素的结合规律
1. 主量元素的结合规律 2. 微量元素的结合规律 3. 过渡元素的结合规律
第五节 元素的结合规律
过渡元素结合规律的问题:
对于有些过渡族元素的共生结合,用戈尔德斯密特的类质同像规则和 林伍德的电负性法则均难以解释。如:
2. 晶体场理论的地球化学意义
(1) 过渡元素离子从岩浆中结晶进入硅酸盐的情况
过渡元素离子从岩浆中结晶进入硅酸盐矿物的顺序
R是百分之x的岩浆固结后岩浆中某元素浓度和该元素在原始岩浆中浓度比值。
M2+离子:Ni>(Cr)>(Cu)>Co>Fe>Mn>=Zn M3+离子: Cr>(Mn)>(Co)>V>(Ti)>(Fe)>=Sc,Ga
Co 2+: (t2g)5 (eg)2
用晶体场稳定能 解释:
Co 3+: (t2g)6
12/5 Δo Ⅲ Ni 3+: (t2g)6 (eg)1
CFSE: Ni 2+: CFSE:
4/5 Δo Ⅱ (t2g)6 (eg)2 6/5 Δo Ⅱ
9/5 Δo Ⅲ
第五节 元素的结合规律
3. 过渡元素的结合规律:晶体场理论解释 1)晶体场理论概要 掌握下列最关键的基本概念: 晶体场分裂能;晶体场稳定能;八面体择位能
第五节 元素的结合规律
2. 晶体场理论概要 相关名词回顾:
(1) 简并、五重简并 : 5个d轨道能级相同 (2) 配位体: 指元素周围的质点或离子
(3)轨道能级分裂:
由原来相同能级变为不同
第五节 元素的结合规律
2. 晶体场理论概要
(4) 晶体场分裂 (以八面体场为例)
晶体场分裂:静电作用对中心离子电子层的影响 主要体现在配位体所形成的负电荷对中心离子的 d电子亚层起作用,从而使原来简并的5个Δo: 八面体晶体场中,t2g与eg轨道能级间的能量之 差。
第五节 元素的结合规律
2. 晶体场理论概要
a.八面体中的d轨道能级分裂
晶体场效应是d轨道能级平均升高了Es,习惯将Es取作0点。
简并能级重 心提升Es
第五节 元素的结合规律
2. 晶体场理论概要
a.八面体中的d轨道能级分裂
������ Δo ������
������ Δo ������
晶体场稳定能(CFSE):d轨道电子能级分裂后的d轨道电子 能量总和相对于未分裂前d轨道电子能量总和的差值。 CFSE=n(t2g) ×−2/5Δo+n(eg) ×3/5Δo
第五节 元素的结合规律
2. 晶体场理论概要
b. 分裂后d轨道中电子的排布-高自旋状态和低自旋状态
第五节 元素的结合规律
2. 晶体场理论概要
c.八面体择位能(OSPE, octahedral site preference energy)
八面体与四面体的晶体场稳定能之差。反映了一个过渡离子对氧化
结构中八面体位置亲和性的大小。
八面体择位能的实际意义:
位于八面体结晶场中的过渡离子,与它处于四面体结晶场的情况相比,稳 定程度增大,这就促使离子优先占据八面体配位位置。
半径 第一电离能 电负性 Ni2+ :0.78Å, 882kJ/mol, 1.9
Mg2+ :0.78Å,
735kj/mol,
1.3
二元系
玄武岩浆
理想状态二元体系
?
这就需要用新的理论来解释---晶体场理论 ——是研究过渡元素化学键的理论模型。
White (2014)
1. 过渡元素的电子结构
电负性、键性、 亲氧和亲硫性等
d电子的排布原则: 在保证总能量最低 的情况下,尽可能 分占不同轨道且自 旋平行。
晶体场稳定能(CFSE):d轨道电子能级分裂后的d轨道电子能量 总和相对于未分裂前d轨道电子能量总和的差值。
CFSE=n(t2g) ×−2/5Δo+n(eg) ×3/5Δo
b. 分裂后d轨道中电子的排布-高自旋状态和低自旋状态
