第2章药物的物理化学相互作用
第2章+药物的物理化学相互作用

发生在极性分子与极性分子之间
分子的极性越大,分子间的取向力越大
2020/2/27
大连理工大学
2.诱导力(induction force )
存在于极性分子与非极性分子之间 还存在于极性分子与极性分子之间
2020/2/27
大连理工大学
3.色散力(dispersion force )
色散力存在于极性分子与极性分子之间、 极性分子与非极性分子之间、非极性分子 与非极性分子之间。
复方碘溶液
2020/2/27
大连理工大学
2.混悬剂、乳剂
由于粒子及液滴的相互作用使混悬 剂及乳剂发生聚集,造成不稳定。
需加入絮凝剂、助悬剂等稳定剂
3.高分子溶液剂、溶胶剂
大连理工大学
二、对固体制剂成型性的影响
固体制剂大多由微粉加工 · 干燥状态下固体粒子相互接触产生的范德
华力、静电力以及粉粒间接触点吸附液体薄膜 的表面张力使其发生相互的粘附,会阻碍固体 物料的混合。因此常采用交互加入少量水润湿 药物或适量表面活性剂来提高混合的效果。
2020/2/27
大连理工大学
3.对药物稳定性的影响
制成络合物提高药物稳定性 维生素B2与吡啶类络合抑制维生素B2降解 苯佐卡因与咖啡因配伍(形成分子缔合物)
2020/2/27
大连理工大学
二、药物的物理化学作用对制剂成型的影响 (一)对液体制剂成型性的影响
1.低分子溶液剂 利用助溶、潜溶制备低分子溶液剂
药物发生络合作用; 因此药物的相互作用对多种制剂的成型均
存在较大的影响。
2020/2/27
大连理工大学
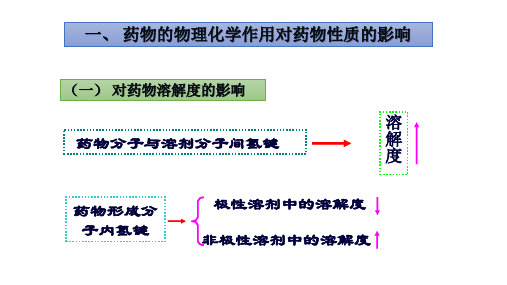
一、药物的物理化学作用对物在溶剂中溶解规律“结构相似者相溶” 结构相似:分子的化学键、分子间作用力以 及分子相对大小等结构性质。
药物相互作用课件

单击添加副标题
药物相互作用
一 基本概念
单击添加标题
单击添加标题
联合用药 同时或间隔一定时间使用两种或两种以上的药物 联合用药的目的 提高疗效 减轻副作用 减缓耐受性 延缓耐药性 治疗多种或复杂的病症
DRUG INTERACTION
由于药物之间或药物-机体-药物之间的反应,改变了药物原来的体内过程、组织对药物的感受性或药物的理化性质,而产生单种药物所没有的药理作用或不良反应(药物相互作用,或药物交互作用)
02
氯丙嗪与普萘洛尔合用时,由于前者抑制了后者药物代谢酶的活性,使普萘洛尔血药浓度上升,引起心率缓慢,血压降低,甚至休克
02
氯丙嗪抑制其他药物代谢酶活性
长期服用格列本脲的糖尿病患者因细菌感染而服用甲氧苄氨嘧啶/磺胺甲噁唑,结果导致低血糖发生 。
磺胺类药物通过肝脏代谢,竞争性地抑制了CYP2C9活性,导致磺脲类药物代谢减弱,作用增强,产生低血糖
药物相互作用的研究对象
药物相互作用的结果
药效增强或减弱
毒副作用增加或减轻
药物理化性质变化
出现始料不及的不良反应
/CONTENTS
国家药监局下发紧急通知,要求立即停用“黄柏胶囊”(“梅花K”)
黄柏
黄柏为芸香科植物黄柏或黄皮树的树皮,含有多种生物碱(小檗碱、棕榈碱、黄柏碱等),具有清热除湿、泻火解毒、清退虚热等功效; 常与抗菌药物配伍,如治疗埃希大肠杆菌所致细菌性腹泻等
04
药理效应的协同、拮抗
基本形式
01
02
03
04
普萘洛尔拮抗-肾上腺素受体激动剂
酚妥拉明拮抗-肾上腺素受体激动剂
纳络酮拮抗吗啡
二--药物的物理化学相互作用PPT课件

药物分子络合物主要靠分子间力、氢键及电荷 转移等分子间的相互作用而形成。
种类: 传荷络合物 氢键络合物
特点:
键能较小,属于弱键型的络合物
.
11
药物传荷络合物
传荷络合物(charge transfer complex, CTC):在电荷转移 体系中,电性差别较大的两个分子间,多电子的分子(电子供体) 向缺电子的分子(电子受体)转移电 子(或迁移负电荷),这 两个分子之间产生电荷迁移力,因而结合成分子络合物,称传荷 络合物。.Biblioteka 13 络合物在制剂中的应用
络合物在制剂中 的应用
助溶
增加药物的稳定性: 少量咖啡因↑苯佐卡因在水溶 液中的稳定性。(传荷)
吡唑酮类物质抑制核黄素光照 分解。(传荷与氢键)
菸酰胺、咖啡因、吡多辛等可 防止氯丙嗪的光照分解。(传 荷)
改变药物的溶解度: 加入络作剂,生成可溶性络合 物,可增大药物的溶解度。
五、疏水相互作用
胶束(表面活性剂章节)
.
15 第二节 药物的物理化学相互作用 对药物及制剂性质的影响
溶解度
稳定性
熔点、 沸点
对药物性质的影响
.
16 对药物性质的影响
氢键对物质性质的影响 (1) 有分子间氢键的化合物的熔点和沸点比没有氢键的
同类化合物为高。
例: HF, HCl, HBr和HI中哪个物质熔沸点最高? HF的熔、沸点最高。
1
第二章 药物的物理化学相互作用
.
2 第一节 药物的物理化学 相互作用类型
一、范德华力
二、氢键
三、传荷络合作用
四、离子参与的相互作用
五、疏水相互作用
.
一、范德华力( van der Waals )
药物的相互作用 ppt课件

pH
0h
0.5h
1h
2h
3h
4h
色泽
淡黄 深棕 深棕 深棕 深棕 深棕
4.0
含量(%) 36.92 6.27
0.64
0.18
0.05
0.01
色泽
微黄 淡紫红 紫红 紫
紫
紫
5.0
含量(%) 68.97 56.54 39.76 18.78 10.85 4.92
色泽
无
淡蓝紫 篮紫 篮紫 篮紫 篮紫
6.0
含量(%) 67.59 65.74 58.19 53.06 44.18 41.63
PH范围
3.2-5.5 3.5-5.5 4.5-7.0 4.5-7.5 6.0-7.5 3.6-6.5 5.0-7.0
备注
含Ca2+ 含Ca2+ 含C媒的影响
5%或10%葡萄糖注射液pH为3.2~5.5,属于酸性溶液, 一些碱性药品不能加入到葡萄糖液中。
如:呋塞米注射液为加碱制成的钠盐制剂,碱性较高, 不得使用GS、GNS等偏酸性的溶媒输注,宜选用NS为溶 媒。
色泽
无
无
无
淡紫 淡紫 淡紫
7.0
含量(%) 98.97 98.70 98.12 98.89 98.86 98.81
色泽
无
无
无
无
无
淡紫
7.5
含量(%) 98.13 99.28 97.99 97.13 97.96 96.99
色泽
无
无
无
无
无
无
8.0
含量(%) 99.65 98.29 98.42 98.01 96.87 97.35
PPT课件
14
药物相互作用 PPT课件

二、药物动力学方面的相互作用——代谢 ※酶的抑制作用 ※酶的诱导作用 ※肠道CYP和P-糖蛋白的影响
24
二、药物动力学方面的相互作用—代谢
药物代谢的主要场所是肝脏,肝脏进行生物转化主要依赖于 微粒体中的多种酶系,其中最重要的是细胞色素P450混合功能 氧化酶系(CYP)
1、酶的抑制作用 酶抑制作用: 使肝药酶数量减少或活性降低,减慢本身或其 他药物的代谢,导致药效增强、不良反应发生 率增加。 酶抑制剂: 氯霉素,西咪替丁,环丙沙星,保泰松等
21
二、药物动力学方面的相互作用——分布
1、竞争血浆蛋白结合部位
➢ 大部分药物以不同程度与血浆蛋白可逆性结合, 结合部位发生竞争性相互置换;
➢ 置换后,游离型药物增多,药效增强。
➢ 蛋白结合率高的、治疗窗狭窄的药物被置换后具 有明显的临床意义
22
二、药物动力学方面的相互作用——分布
2、改变组织分布量 改变组织血流量 组织结合位点上的竞争置换
20%~50%,其功能主要是参与药物在肠道的首过 消除。
27
二、药物动力学方面的相互作用——排泄
※ 改变尿液pH值 ※ 干扰肾小管分泌 ※ 改变肾脏血流量
28
二、药物动力学方面的相互作用——排泄
1、改变尿液pH值 酸性尿液中,弱酸药物大部分以非解离存在;
弱碱药的情况相反,大部分以解离形式存在,随尿 液排出多。
➢不是任何药物都可以随意加入任何静脉输液中 ➢注意存在无外观变化的配伍禁忌
12
二、药动学相互作用 影响药物吸收的相互作用 影响药物分布的相互作用 影响药物代谢的相互作用 影响药物排泄的相互作用
13
二、药物动力学方面的相互作用——吸收
※ 胃肠道PH值的影响 ※ 结合与吸附的影响 ※ 胃肠运动的影响 ※ 对肠吸收功能的影响 ※ 肠道菌群的改变
第二章药物的物理化学相互作用

第二章药物的物理化学相互作用
汇报人:
202X-12-25
目录
药物与溶剂的相互作用药物与生物膜的相互作用药物与蛋白质的相互作用药物的光化学性质与稳定性
01
CHAPTER
药物与溶剂的相互作用
溶解度
药物在溶剂中的溶解度取决于药物分子与溶剂分子间的相互作用,包括极性、氢键、范德华力等。
溶解速率
药物的溶解速率影响其在体内的吸收和分布,溶解速率快的药物具有更好的生物利用度。
是指物质吸收光子后发生的化学反应,包括激发态的生成、能量转移和化学键断裂等过程。
光化学反应
物质吸收光子后,电子从基态跃迁至激发态,获得足够的能量进行化学反应。
激发态
激发态分子将能量转移给其他分子,导致后者发生化学反应。
能量转移
在某些光化学反应中,激发态分子能够断裂化学键,生成新的物质。
化学键断裂
THANKS
Байду номын сангаас溶解过程的影响因素
温度、压力、搅拌速度、药物颗粒大小等都会影响药物的溶解过程。
分配系数
药物在溶剂和油相之间的分配系数决定了其在生物膜(如细胞膜)上的分布和穿透能力。
分配平衡
药物在溶剂和油相之间的分配达到平衡时,其浓度在两相中均达到最大。
分配过程的影响因素
药物的极性、油水分配系数、温度等都会影响其在生物膜上的分配。
03
02
01
药物的渗透系数决定了其在生物膜上的穿透速度和能力。
渗透系数
渗透过程的动力学
渗透与吸收
药物通过被动扩散或主动转运方式透过生物膜,其动力学过程受多种因素影响。
药物的渗透速度和程度直接影响其在体内的吸收和生物利用度。
药物相互作用课件课件

第1页,此课件共95页哦
现代医学和药学的发展,大大促进了患者的多药并用。 老年患者,每天同时服用4~5种药的情况极为普遍。 ADR, 尤其是药物相互作用(DDI/drug-drug interaction)所致的
ADR因此而日趋严重。
处方医师、药师和患者必须认真考虑这一重要而现实的问题。
含多价阳离子药物
氟喹诺酮类
1 含Ca2+、Mg2+、Al3+
抗酸药物
四环素类
2 Fe2+制剂
3 补钙制品
4 Bi3+
形成络合物或鳌合物
临床应避免抗生素与该类药物同时服用,必须合用 时,服药时间应间隔3小时
24
第24页,此课件共95页哦
▪ 胃肠运动的影响:
药物吸收主要部位:小肠上部 影响因素:
胃排空、肠蠕动速率
4 10
28
54
6
第6页,此课件共95页哦
联合用药:是指同时或相隔一定时间内使用两 种或两种以上的药物。
临床联合用药意义: 1 提高药物疗效;
2 减少药物的某些副作用; 3 延缓机体耐受性或病原体耐药性的产生,可延长疗
程,从而提高药物的效果。
7
第7页,此课件共95页哦
药物相互作用的结果:
加强:疗效提高,毒性也可加大 减弱:毒性减轻,疗效也可降低 理想:疗效提高,同时毒性减轻 避免:毒性加大,而疗效降低
舒普深、特治星、特美汀、强力阿莫仙等 亚胺培南+西拉司丁 泰能 磺胺甲恶唑+TMP 复方新诺明(SMZ-Co) 氯沙坦钾+氢氯噻嗪 海捷亚
10
第10页,此课件共95页哦
临床应避免产生的不良药物相互作用: 毒性加大和/或疗效降低!
第2章 药物的物理化学相互作用2020
增加药物的稳定性:
改变药物的溶解度:
少量咖啡因↑苯佐卡因在水
加入络合剂,生成可溶性络
溶液中的稳定性。(传荷)
合物,增大药物的溶解度(
吡唑酮类物质抑制核黄素光
助溶)。
照分解。(传荷与氢键)
加入络合剂,生成难溶性或
菸酰胺、咖啡因、吡多辛等
不溶性络合物。
可防止氯丙嗪的光照分解。 (传荷)
咖啡因在水中的溶解度为1∶46,若与苯甲酸钠 以1∶1形成CTC,能使水溶性提高到1∶1.1。
氢键用 --- 表示,如 X-H --- Y,其 中 X,HY原可子以附是近同有种电原负子性,大也,可且以r是小不的同元元 素素的如原F子,。O,N 的原子,即氢键接受体
1 氢键的形成
当两个水分子充分靠 近时,带部分正电荷的氢 原子与另一分子中含有孤 电子对、带负电荷的氧原 子产生相互吸引,这种吸 引力称为分子间的氢键作 用。
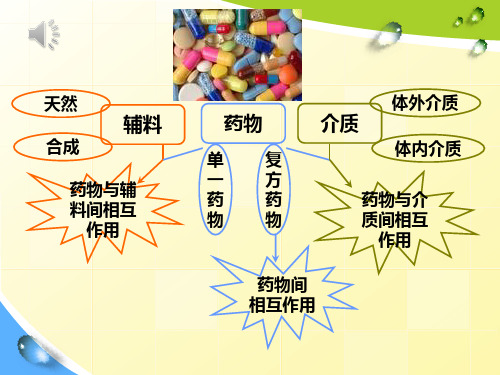
天然 合成
辅料
药物与辅 料间相互
作用
药物
单复 一方 药药 物物
介质
体外介质 体内介质
药物与介 质间相互
作用
药物间 相互作用
这些相互作用会影响到:
药物的物理化学性质。
药剂学如中熔涉点及、的沸界点面、溶现解象度、、混稳悬定剂性絮等凝 、乳剂稳定性、散剂及胶囊剂的粉体聚集、 气雾剂中粉末或液滴分散、颗粒压片等。
非极性分子在极性水中倾向于积聚 的现象就是疏水相互作用。
疏水链表面整齐地排列着一层水分子
疏水链互相聚集,把周围排列有序 的水分子排挤出来。
疏水分子的聚集是一个热力学的自发过程。
能量下降
疏水基团的相互作用对表面活性剂 在水中形成胶束起着至关重要的作用。
(二)离子-偶极作用力和 离子-诱导偶极作用力
药物相互作用

为了治疗支气管炎,服用克拉霉素500mg/次,2次/d
给药第4天,出现呕吐和精神错乱而住院
服用克拉霉素前地高辛血药浓度为1.0ng/mI,入院时 升高到3.7ng/ml。血清肌酐浓度为0.7mg/dl。心电图 显示QTc间隔延长(0.44s)。
停顿服用地高辛和克拉霉素
症状2 日内改进
入院后第3天地高辛血药浓度下降至1.0ng/ml,心电图 检验也正常
三环类抗抑郁药
吩噻嗪类抗精神病药
抗组胺药(H1拮抗剂)
促进
胃动力药:胃复安 (甲 氧氯普胺)、吗丁林
泻药:大黄、番泻叶
药物相互作用
第19页
处方二
地高辛 0.25mg qd P.O.
胃复安 1#
Tid P.O.
•胃复安可增强胃排空速度 •与地高辛适用时 •使地高辛吸收还未完成时即排出体外 •可使地高辛血药浓度降低30%左右
同时患者因为便秘而一直服用氧化镁 (600mg/d)。
服用诺氟沙星前,Pa:+,3天后,痰检Pa:++,8天 后,Pa: ++;临床症状未见改进。
停用诺氟沙星。
改静脉注射头孢磺啶钠1g。
临床症状改进,白细胞计数和血沉检验、体温均恢复
正常。 药物相互作用
第25页
(5)改变肠道菌群
地高辛+克拉霉素?
(2)餐后服用可使药品生物利用度增加,如普萘洛尔、 苯妥英钠、螺内酯、氢氯噻嗪、维生素B2等。
药物相互作用
第32页
普通未尤其强调需餐前或餐时服用药品,均可餐后 半小时服用。但需注意:若一日三次给药仅按“餐” 服药势必造成白天血药浓度过高,而夜间达不到有 效血药浓度,故应尽可能间隔8小时,如早上、下午、 晚上3次给药,这么血药浓度平稳,药效可靠。
药物相互作用ppt课件

2018/8/7
32
3、影响药物的代谢
酶抑制可使药物消除减慢,血药浓度升高,但能否引起 有临床意义的相互作用取决于多种因素。 (1)目标药的毒性及治疗窗的大小:红霉素酶抑制→阿 斯咪唑代谢↓、心脏毒性↑ (2)是否存在其他代谢途径:如唑吡坦约由5种酶代谢 (3)与能抑制多种CYP的药物合用:如西咪替丁,已报道 有70多种药物与之合用后有不同程度的代谢↓ 酶抑制常导致药物作用↑或毒性↑,但也有例外: 奎尼丁酶抑制→可待因生成吗啡↓→药效↓
ห้องสมุดไป่ตู้
阴离子交换树脂 与 酸性药物 亲和力强;
如:降脂药考来烯胺与阿司匹林、地高辛、华法林等有很强的亲 和力
吸附剂 与抗生素同服可明显减少吸收。
多价金属离子:钙、镁、铝
注意:上述情况服用时应间隔2-3h以上。
2018/8/7
19
分析下列处方是否合理? Rp 硫酸亚铁片 0.3g×100 sig. 0.3g tid po Tab VitC 100mg×20 sig. 100mg tid po 氧氟沙星胶囊 0.1g ×24 sig. 0.3g bid po
案例二
分析下面处方是否合理? Rp 氟哌酸 片 0.2g×10 sig. 0.4g bid po 普鲁本辛片 15mg×10 sig. 15mg prn po 吗丁啉片 10mg ×30 sig. 10mg bid po
2018/8/7
24
普鲁本辛可解除胃肠平滑肌痉挛,作用较强、较 持久,主要用于缓解胃肠痉挛性疼痛。应在疼痛 时服用,必要时4h后可重复1次。 多潘立酮为胃肠动力药,在饭前15-30min服用。 二者作用拮抗,不宜同时应用。抗酸药和抑制分 秘药可降低多潘立酮的口服生物利用度(F),不宜 与本品同时服用。 因此,建议两药服用时间间隔4h以上。
69药物的物理化学相互作用对药物及制剂性质的影响1
荷正负电荷的药物
不溶性聚 合物盐
延长作用时间 稳定释药速度 提高生物利用度 掩盖不良气味
盐酸曲马多含有氨基氮原子 的镇痛药,具有较大苦味, 需口服给药。顺应性差
制成含药树脂速释混悬剂, 口服--感觉不到苦味
抑制分解 异丙嗪和奋乃静 + 咖啡因(电子受体)
提高抗抗氧化能努力,增加其稳定性
二、 药物的物理化学作用对制剂成型性的影响
(一)对液体制剂成型性影响 分子间或分子内作用力
稳定性 溶解度
1.潜溶剂 2.高分子溶液 3.乳剂 4.溶胶剂
水+乙醇
甲硝唑溶解度增加5倍
不同pH值溶解度、稳定性不同
双电层结构的形成
3.药物溶解度提高,但络合剂达到一定浓度时偏离直线
(咖啡因—磺胺嘧啶)
S1
溶
.
解 S2 度
S3
C1
C2
(一) 对药物溶解度的影响
增溶(solubilization) 指某些难溶药物在表面 活性剂作用下,在溶剂 中溶解度增大并形成澄 清溶液的过程 1g增溶剂能增溶药物的 克数称增容量
表面活性剂增溶
(二)、对药物熔点和沸点的影响
掩盖不良气味 大蒜油+CYD,可消除其臭味
2.固体分散体
(三)、其它
难溶性药物制成固体分散体后,药物以分子、胶体、无定型或微晶状态 分散在载体中,比表面积增加,溶出速度加快。 阿司匹林-PEG 20000(1:9)固体分散体,其药物溶出速度显著高于原 料药及物理混合物。 尼莫地平-PEG固体分散体可提高尼莫地平体外溶出度。
一、 药物的物理化学作用对药物性质的影响
(一) 对药物溶解度的影响
溶
药物分子与溶剂分子间氢键
药物相互作用PPT课件

Drug Interactions
一、药物相互作用概述—— Drug Interactions
某一种药物的作用由于其他药物或化学物质的 存在而受到干扰和影响,使该药的疗效发生变 化或产生药物不良反应。
相关概念
❖ 药物相互作用 一种药物由于用药前后或用药同时应用另
一种药物而产生的药理效应改变
用比那些不经常使用的药物更重要,例如乙醇、非甾体抗炎 药、抗酸剂等
④ 合并用药数目越多,药物所发生的相互作用越复杂,不良反
应发生率越高
为了避免各种药物合并或相继使用时可能带
来的有害影响,要注意以下问题: ①用药必须严格遵照医嘱,千万不可自己随意
添加未经医师处方的其他药物
②凡是能用一种药物治疗时,绝不同时或相继
6
二、药物相互作用的临床意义
在有临床意义的药物相互作用中, 有益的药物相互作用是很少的,而 不良的药物相互作用和有争议的药 物相互作用是较普遍的,即大多数 的药物相互作用中包含了不安全因 素。
1 – Disintegration 2 – Dssolution 3 – Passive Diffusion 4 – Active Transport
VVV V
注射剂配伍变化发生的原因: 1、沉淀 1)溶剂系统改变:含有非水溶剂(含有乙醇、丙二醇甘 油等)的注射剂加入水性溶液中。 如:氯霉素注射液加入到葡萄糖或氯化钠注射液;
物理化学方面的相互作用——注射剂配伍
2、变色:药物与药物之间发生化学反应 酚类药物及其衍生物、含酚类的药物与铁盐 3、聚合:有些药物在放置过程中,在溶液中会形成 聚合物。聚合物进入体内会引起过敏,形成与时间与 温度有关。 如:青霉素、氨苄西林、头孢噻啶; 4、降效:复方氯化钠注射液可加速氨苄西林的降解
第二章药物的理化相互作用

第二章药物的理化相互作用展开全文第一节作用类型一、范德华力(1)取向力(dipole-dipole attraction):因极性分子取向产生的分子间作用力(2)诱导力(induction force):极性分子的永久偶极和非极性分子的瞬间诱导偶极之间产生的静电相互作用力(3)色散力(despersion force):瞬间偶极和瞬间诱导偶极间相互作用力二、氢键(hydrogen bond):定义:氢原子与其他电负性大的原子形成一种较强的、具饱和性和方向性的范德华力键分类:1、分子间氢键 2、分子内氢键三、传荷络合作用(charge transfer complex)定义:两个电性差异大的分子接触时,电子多的向电子少的转移部分电子形成稳定的络合物。
四、离子键(ionic bond)定义:阴、阳离子接触到一定距离时,引力与斥力达到平衡形成稳定的化学键离子型药物+极性溶剂=离子-偶极作用离子型药物+非极性溶剂=离子-诱导偶极作用力五、疏水相互作用(hydrophobic interactions)定义:非极性分子在极性水中倾向于积聚的现象如有盗版,举报属实免费赠送本书内容,客服微信Y1778837892第二节药物理化性质对药物制剂的影响一、药物理化学作用对药物性质的影响(一)溶解度:1、结构相似者溶(分子化学键、分子间相互作用力、分子大小)2、溶质、溶剂结构不相似者不溶3、形成分子间氢键任意比例互溶,分子内氢键在非极性溶剂中增大、极性溶剂中降低(二)溶、沸点影响分子间氢键:上升,需要破坏该键消耗能量分子内氢键:降低,该键降低了范德华力(三)对药物稳定性影响制成络合物可提高稳定性二、对剂型形成的影响(一)液体制剂:1、混合溶剂可提高溶解度2、高分子溶液等电位稳定性提高(二)固体制剂:范德华力、氢键在压片的正作用和储存时的负作用(三)其他:1、环糊精包合物2、离子交换树脂:带有酸性或碱性高分子基团的功能性高分子聚合物,可通过离子键与正/负电荷的药物形成水不溶聚合物盐,达到延长作用时间,稳定释药速度,提高生物利用度作用。
《药理学》药物相互作用 ppt课件

络合反应
(如华法林、阿司匹 难溶复合物
林、洋地黄毒苷、地 高辛、甲状腺素等)
减少吸收
ppt课件
21
第一节 药动学的相互作用
影响药物吸收的相互作用-方式
1. 离子作用; 2. 吸附作用; 3. pH的影响; 4. 食物的影响; 5. 胃肠道运动的影响; 6. 肠吸收功能; 7. 其他。
ppt课件
22
2006 修正草案《药物开发过程中药物代谢/药 物相互作用研究;体外研究》。
ppt课件
9
概 述 – 药物相互作用现状
发生率2.2%~70.3%
有临床症状的DI发生率为11.1% ①多种代谢途径,代偿; ②药物治疗窗广,药源性损害不明显; ③ADR掩盖,漏报; ④疾病症状掩盖; ⑤回顾性研究
ppt课件
ppt课件
27
第一节 药动学的相互作用 影响药物吸收的相互作用
食物的影响
通常延迟或减少药物吸收 原因:①食物减慢胃排空 ②药物被稀释或吸附在食物上 ③改变pH值 例:四环素 空腹服用C血=3~8×饭后30min服用C血
但有的药物在进食情况下吸收增加
ppt课件
28
第一节 药动学的相互作用
影响药物吸收的相互作用-方式
ppt课件
12
概 述 – 药物相互作用分类
1. 药代动力学方面药物相互作用; 2. 药效学方面药物相互作用; 3. 体外药物的相互作用; 4. 中西药之间的相互作用。
ppt课件
13
第一节 药动学的相互作用
➢ 药动学方面的相互作用 是指一种药物使另一种并用的药物发生药动学的改
变,使后一种药物在作用部位浓度增减而致药效增强或减 弱。 药物代谢动力学(简称药动学)
药剂学第9版课件:第一章 绪论

一、药剂学的性质
药物制剂: 指剂型确定以后的具体药物品种, 称为药物制剂,简称制剂(Preperations)。 例如银翘片、氯化钠注射液、阿莫西林胶囊
辅料:填充剂 、崩解剂、黏合剂、润滑剂、 增溶剂、助悬剂、乳化剂、pH调节剂、等渗 调节剂、矫味剂、防腐剂。
相关学科:化学学科、物理化学、高分子材 料学、机械原理、高等数学、生理学、解剖 学、药理学、生物化学、临床药物治疗学
机、高效包衣锅、 挤出滚圆 制粒机、离心制粒机
18
四、药剂学的分支学科
物理药剂学
工业药剂学
临床药剂学
药剂学
生物药剂学
分子药剂学
药物动力学
19
四、药剂学的分支学科
物理药剂学(Physical Pharmaceutics)是运用物理化学 的原理,研究和解释药物制造和 储存过程中存在的现象和规律, 用以指导剂型和制剂设计,推动 具有普遍意义的新剂型和新技术 及其应用。
药剂学 Pharmaceutics
第一章 绪论
1
第一章 绪论
第八章
第二章 药物的物理化学相互作用 第九章 第三章 药物溶解与溶出及释放 第十章
第四章 药物多晶型 第五章 表面活性剂 第六章 微粒分散体系 第七章 流变学基础
第十一章 第十二章 第十三章 第十四章 第十五章
第十六章
药物制剂设计 液体制剂的单元操作 液体制剂
7
二、药剂学的重要性
1.可以改变药物作用速度 ---注射剂、气雾剂起效快,片剂、胶囊 起效慢
2.可以降低或消除原料药的毒副作用 - 缓、控释制剂
布洛芬在乙醇、丙酮、 三氯甲烷或乙醚中易溶, 在水中几乎不溶;
8
二、药剂学的重要性
药物相互作用PPT课件

(二)药物动力学方面的相互作用——分布
❖ 竞争蛋白结合部位 ❖ 改变组织血流量
(二)药物动力学方面的相互作用——分布
1、竞争蛋白结合部位
➢ 大部分药物以不同程度与血浆蛋白可逆性结合,结 合部位发生竞争性相互置换;
左旋多巴是依靠主动转运从小肠中吸收。蛋白质中的芳 香氨基酸能与左旋多巴竞争同一载体系统,因此高蛋白饮食可 降低左旋多巴的疗效。
•高脂肪食物:增加难溶药物(灰黄霉素、异维甲酸)的吸收 •牛奶及富含离子的食物:影响四环素类药物吸收。
SUCCESS
THANK YOU
2020/10/1
药物与食物之间的相互作用——乙醇
; 抗凝血药:华法林(99%,9L)
物理化学方面的相互作用——注射剂配伍
3)直接反应:药物直接与输液中一种成份反应 如:
四环素与钙盐、铁盐、铝盐、镁盐 4)电解质的盐析:亲水胶体或蛋白质药物与电解质
配伍;
物理化学方面的相互作用——固体药物之间
1、潮解,结块 1)药物间反应成水分 2)含结晶水药物与其他药物配伍后,结晶水减少
或释放出结晶水。 如:碳酸钠与醋酸铅
在下列情况时尤其注意药物相互作用
① 对重症病人和老年人来说,由于使用药物的种类多,维持自
身内环境稳定的代偿能力降低等,药物相互作用更容易产生 严重后果
② 有些药物的治疗安全范围狭窄、量效曲线陡直,容易受到药
物相互作用的影响,引起疗效和安全性的变化,如抗凝药、 降糖药、抗癫痫药等
③ 常用药和在某些特定情况下经常合并使用的药物,其相互作
药物相互作用
Drug Interactions
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017/9/6
2017/9/6
17
3.对药物稳定性的影响
制成络合物提高药物稳定性 维生素B2与吡啶类络合抑制维生素B2降解
苯佐卡因与咖啡因配伍
2017/9/6
2017/9/6
18
二、药物的物理化学作用对制剂成型的影响
(一)对液体制剂成型性的影响 1.低分子溶液剂 利用助溶、潜溶制备低分子溶液剂 复方碘溶液
8
对物质熔沸点的影响
分子间氢键:物质熔点、沸点升高。 物质熔化或气化时,要克服纯粹的分子间力外,还必须 提高温度,额外供应能量来破坏分子间的氢键,所以这些
物质的熔点、沸点比同系列氢化物的高。
分子内氢键:熔、沸点常降低。 分子内形成氢键,那么相应的分子间的作用力就会减少, 分子内氢键会使物质熔沸点降低.
&3 药物与包材的相互作用
作用类型 迁移和吸附
评价包装的适用性,研究包装与药品间
的相容性
2017/9/6
2017/9/6
23
我国的相容性要求
相容性:Compatibility 考察药品包装材料与药物之间是否发生迁 移或吸附等现象,进而影响药物质量而进 行的一种试验 。 可控环境 实验模型 相互的或单方面的迁移、变质
2017/9/6
2017/9/6
19
2.混悬剂、乳剂
由于粒子及液滴的相互作用使混悬剂
及乳剂发生聚集,造成不稳定。
需加入絮凝剂、助悬剂等稳定剂
3.高分子溶液剂、溶胶剂
2017/9/6
20
二、对固体制剂成型性的影响
固体制剂大多由微粉加工
· 干燥状态下固体粒子相互接触产生的范德华 力、静电力以及粉粒间接触点吸附液体薄膜的表
要广集百家;
详:详细,要全面细致, 力避遗漏;
实: 要心领神会、准确把握文章的精髓。
30
“述”
即评述,评述是对所读文章的精髓,众 家的学说进行列举、归纳、重组、评述包 括:
☆肯定、 否定;
☆点贬谬误、褒誉创新、
就要评的合理,述的透彻.
31
综述报告基本要求:
1、按论文格式规范要求,文中引用参考文献应有角码标
1.对药物溶解度的影响
药物在溶剂中溶解规律“结构相似者相溶”
结构相似:分子的化学键、分子间作用力以及分子 相对大小等结构性质。 溶质和溶剂能形成分子内氢键,则溶解度增加 水和乙醇可以任意比例互溶。 药物分子内形氢键,在极性溶剂中溶解度减小, 在非极性溶剂中的溶解度增大。
2017/9/6
2017/9/6
2017/9/6
2017/9/6
14
&2 药物的物理化学作用对药物性质的影响
我们知道胶束的形成是通过疏水作用力;
在溶液剂设计加入助溶剂其原理是通过与药
物发生络合作用; 因此药物的相互作用对多种制剂的成型均存 在较大的影响。
2017/9/6
2017/9/6
15
一、药物的物理化学作用对药物性质的影响
第二章
药物的物理化学相互作用
药剂教研室
王秀
2017/9/6
2017/9/6 1
教学目标
掌握 药物分子间作用力类型; 熟悉 分子间作用力对药物性质、制剂 成 型性的影响; 了解 药物与包材、蛋白的相互作用。
2017/9/6
2017/9/6
2
&1 药物的物理化学相互作用类型
一、范德华力 二、氢键 三、传荷络合作用 四、离子参与的相互作用 五、疏水相互作用
2017/9/6
6
二、氢键(hydrogen bond)
分子间氢键 分子内氢键
2017/9/6
2017/9/6 7
氢键对药物性质的影响
氢键对物质溶解度的影响 在极性溶剂中,如果溶质分子与溶剂分子之
间可以形成氢键,则溶质的溶解度增大。
HF和NH3在水中的溶解度较大。
2017/9/6
2017/9/6
示,如[5] 。
2、字数 ≥3000字/篇。 3、参考文献 ≥10篇,其中英文文献≥3篇,查近5年的文 献。引用的文献全文及综述以文件夹形式写清学号、 姓名发至备检。
4、综述不得直接从网上复制,查实即为 0分。
5、请于 完成并上交。
32
1.1 尽量选择依从性高的 例1:儿科药物制剂设计及剂型新开发 给药途径及制剂
2017/9/6
2017/9/6
24
玻璃容器相容性试验重点考察项目
玻璃中碱性离子的释放对药液pH的影响 有害金属元素的释放 不同温度(尤其冷冻干燥时)、不同酸碱 度条件下玻璃的脱片 含有着色剂的避光玻璃被某些波长的光线 透过,使药物分解 容器密封性
2017/9/6
2017/9/6
25
面张力使其发生相互的粘附,会阻碍固体物料的
混合。因此常采用交互加入少量水润湿药物或适 量表面活性剂来提高混合的效果。
2017/9/6
2017/9/6
21
三、其他
包合物
固体分散体
无定型药物系统 离子交换树脂
提高难溶性药物的溶解度及溶出速率
提高稳定性、延长作用时间、稳定释药等
2017/9/6
22
3.1 妥洛特罗贴剂 3.2 哌甲酯贴剂
中国药学杂志 2012, 47(10):760-765
33
例2:多囊脂质体的研究进展
前言
1.1制备方法不同; 1.2结构与粒径大小不同 1.3组成不同 1.4被包裹药物性质不同 1.5给药途径不同 1.6缓释时间不同
1、MVL与普通脂质体的区别
2、MVL的制备
2017/9/6
2017/9/6
3
一、范德华力(Van der Waals' force )
1.取向力(dipole-dipole attration )
发生在极性分子与极性分子之间 分子的极性越大,分子间的取向力越大
2017/9/6
2017/9/6 4
2.诱导力(induction force )
16
2对药物沸点和熔点的影响
要使液体气化,破获分子间的氢键,需消耗更 多的能量,要使晶体破坏,也要破坏一部分分子间
分子间形成氢键时熔点沸点增高
氢键。 分子内形成氢键时药物的熔点、沸点降低 分子内形成氢键,则会使药物的熔点、沸点等 物理性质降低,主要是由于分子内氢键的形成消弱 了分子间范德华引力和氢键力。
塑料容器相容性试验考察项目
水蒸气、氧气的渗入 水分、挥发性药物的透出 酯溶性药物、抑菌剂向塑料的转移 塑料对药物的吸附 溶剂与塑料的作用 塑料中添加剂、加工时分解产物对药物的影响 微粒 密封性
2017/9/6
2017/9/6
26
胶塞相容性试验重点考察项目
通常作为容器的塞、垫圈 鉴于橡胶配方的复杂性,应重点考察其中各 种添加物的溶出对药物的作用 橡胶对药物的吸附以及填充材料在溶液中的 脱落 在进行注射剂、粉针、口服溶液剂等试验时, 瓶子应倒置或侧放,使药液能充分与橡胶塞 接触
2017/9/6
9
对粘度的影响
分子间有氢键的液体,一般粘度较
大。例如甘油、磷酸、浓硫酸等多羟基
化合物,由于分子间可形成众多的氢键,
这些物质通常为粘稠状液体。
2017/9/6
10
三、传荷络合作用
概念:电性差别比较大的两个分子相互接触时, 电子多的分子(电子供体)缺电子的分子(电 子受体)转移部分电子而结合成稳定的络合物, 称为传荷络合物;或称电子转移复合物(CTC) 传荷络合物的意义:在药物配伍中可以助溶, 增加水溶性,提高稳定性。
存在于极性分子与非极性分子之间 还存在于极性分子与极性分子之间
2017/9/6
2017/9/6
5
3.色散力(dispersion force )
色散力与相互作用的分子变形有关,变 形越大,色散力越大。 色散力存在于极性分子与极性分子之间、 极性分子与非极性分子之间、非极性分子 与非极性分子之间。
2017/9/6
2017/9/6
2017/9/6
11
四、离子参与的相互作用
离子键 离子-偶极作用力
离子与极性分子作用
离子-诱导偶极作用力
离子与非极性分子作用
影响药物的溶解度、溶出等。
2017/9/6
2017/9/6
12
NaCl的形成示意 图 失去电子 化合价升高 被氧化
0 0 +1 -1
2Na+ Cl2 = 2NaCl
2017/9/6
2017/9/6
27
&4药物与蛋白质的相互作用
自学
2017/9/6
28
药剂学综述
××药物制剂新进展;
药用新辅料研究进展; 药物新剂型研究现状; 制剂生产工艺新进展;
生物技术药物制剂的研究与进展;
中药新剂型的研究与开发;
……
29
综述
综而述之
“综” 就是广、详、实
广:范围要广,即阅读的文献要广,
二次乳化法及影响因素 3.1 抗肿瘤 3.2 抗感染 3.2.1 中枢神经系统感染 3.2.2 病毒性视网膜炎 3.2.3细菌性角膜炎 3.2.4细菌性软组织和手术感染 3.3 治疗疼痛 3.4 包封大分子物质
34
3、MVL的应用
结语
中国新药杂志 2006, 15(15):1243-1246
35
得到电子 化合价降低 被还原
