小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求jiuqiang
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求深圳上泰生物

小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)性能指标1.性能指标1.1外观外观应符合表1要求。
表1 试剂盒内各组成的外观性状1.2装量液体试剂装量要求不低于标示量。
1.3水分含量校准品质控品的水分含量应不超过5%。
1.4试剂空白吸光度在主波长,1cm光径下,试剂空白吸光度≤0.20。
1.5分析灵敏度测定1.17mmol/L人血清样本时,试剂与样本反应产生的吸光度值应≥0.05。
1.6线性范围1.6.1试剂盒在[0.20,3.00] mmol/L范围内,线性相关系数r≥0.990。
1.6.2在[0.20,1.20] mmol/L范围内,线性绝对偏差应不超过±0.12 mmol/L;在(1.20,3.00] mmol/L范围内,线性相对偏差应不超过±10%。
1.7精密度1.7.1重复性变异系数(CV)应≤5%。
1.7.2批间差试剂盒批间相对极差R应≤10%。
1.8准确度回收率应在90%~110%。
1.9分析特异性当抗坏血酸≤60mg/dL,胆红素≤15mg/dL、血红蛋白≤500mg/dL、脂肪乳剂≤1.5%时,对试剂检测结果的偏差影响在±10%以内。
1.10量值溯源应明确分析物的量值溯源。
1.11校准品赋值结果及其不确定的的表示方式应使用规范的表示方式,主要表示方式可选择:a)赋值结果±扩展不确定度;b)赋值结果,扩展不确定度。
1.12校准品正确度量值传递的正确度应符合E≤1。
n1.13质控品赋值准确度在用校准品校准后的生化分析仪上测试定值质控品,结果应在制造商指定的赋值范围内。
1.14校准品均匀性1.14.1瓶内均匀性:CV瓶内应不大于10%。
1.14.2瓶间均匀性:CV瓶间应不大于10%。
1.15质控品均匀性1.15.1瓶内均匀性:CV瓶内应不大于10%。
1.15.2瓶间均匀性:CV瓶间应不大于10%。
低密度脂蛋白胆固醇(LDL—C)测定试剂(盒)(直接消除法)产品技术要求新产业

医疗器械产品技术要求编号:
低密度脂蛋白胆固醇(L DL-C)测定试剂(盒)(直接消除法)
2.性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物。
2.2净含量
试剂装量的应按表 2,液体装量的最大允许负偏差应为 5%。
表 2 净含量
2.3试剂空白吸光度
试剂(盒)以纯化水为空白在 37 ℃±1℃ 、546 nm 波长、1 cm 光径条件下,试剂空白吸光度应≤0.10。
2.4分析灵敏度
试剂(盒)测试 133 mg/dL 的被测物时,吸光度变化(ΔA)应在 0.700~1.000 的范围内。
2.5线性范围
试剂(盒)在(0~380) mg/dL范围内的分析性能应符合如下要求:
a)线性相关系数r≥0.990;
b)(0~50) mg/dL 范围内,线性绝对偏差应在±5mg/dL 以内;(50~380) mg/dL 范围内,线性相对偏差应在±10%以内。
2.6测量精密度
2.6.1重复性
用校准品重复测试所得结果的变异系数CV≤5%。
2.6.2批间差
试剂(盒)批间相对偏差R≤8%。
2.7准确度
校准品的相对偏差 B 在±10%以内。
2.8分析特异性
血红蛋白浓度在 500 mg/dL 内、甘油三酯浓度在 1000 mg/dL 内、胆红素浓度在 40 mg/dL 内,对试剂检测结果的偏差影响应在±10%以内。
低密度脂蛋白胆固醇测定试剂盒(终点法)产品技术要求beijian

低密度脂蛋白胆固醇测定试剂盒(终点法)
适用范围:本产品用于体外定量测定人血清中低密度脂蛋白胆固醇的含量。
1.1规格
具体产品规格见下表:
1.2组成成分
磷钨酸 10mmol/L
2.1 外观
2.1.1 外包装完整无破损;
2.1.2 试剂:无色澄清透明无杂质液体。
2.2 净含量
净含量不低于标示值。
2.3 试剂空白吸光度
在波长600~630nm、37℃条件下,试剂空白吸光度小于0.6。
2.4 线性
2.4.1 线性范围
[1.30,5.20]mmol/L,相关系数r>0.990。
2.4.2 线性偏差
(2.00,5.20]mmol/L线性范围内,相对偏差不超过±10%;
[1.30,2.00]mmol/L线性范围内,绝对偏差不超过±0.50mmol/L。
2.5 分析灵敏度
检测浓度为3.11mmol/L的样本时,吸光度变化不小于0.08。
2.6 重复性
测试高、低浓度的新鲜人血清或质控品,重复测试10次,低值:CV≤10%;高值:CV≤5%。
2.7 批间差
用三个不同批号的试剂测试同一样本,重复测试3次,相对极差R≤10%。
2.8 准确度
相关系数r>0.990;相对偏差不超过±10%。
2.9 稳定性
原包装试剂2~8℃避光储存,有效期12个月。
效期后1个月内产品应符合2.3、2.4和2.8的要求。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求zsbk

小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)适用范围:本试剂用于体外定量测定人血清中小而密低密度脂蛋白胆固醇的含量。
1.1包装规格试剂1(R1):60mL×1,试剂2(R2):20 mL×1;试剂1(R1):60mL×2,试剂2(R2):20 mL×2;试剂1(R1):45mL×1,试剂2(R2):15 mL×1;试剂1(R1):15mL×1,试剂2(R2): 5 mL×1;校准品(选配)(冻干粉):1mL×1;2mL×1;质控品(选配)(冻干粉,2个水平):冻干粉型1mL×2;2mL×2。
1.2规格划分说明根据净含量和复溶体积划分规格。
1.3主要组成成分2.1 外观试剂盒中各组件的外观应满足:2.2.1 试剂1(R1)应为无色至淡褐色液体,无沉淀及絮状物,外包装完整无破损;2.2.2 试剂2(R2)应为淡黄色至黄色液体,无沉淀及絮状物,外包装完整无破损;2.2.3 校准品应为白色或淡黄色冻干粉,复溶后应为无色或淡黄色溶液,无混浊,无未溶解物,外包装完整无破损;2.2.4 质控品应为白色或淡黄色冻干粉,复溶后应为无色或淡黄色溶液,无混浊,无未溶解物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长600nm(580 nm~620nm)(光径1cm)处,试剂空白吸光度(A)应≤0.05。
2.4 准确度与已上市同类试剂分别测定40例血清样本,计算两组数据的相关系数(r)及测值的相对偏差,在[4,70]mg/dL范围内,线性相关系数r应≥0.975;在[4,30]mg/dL范围内,线性绝对偏差应不超过±4.5mg/dL;在(30,70]mg/dL 范围内,线性相对偏差应不超过±15%。
2.5分析灵敏度对应于浓度为40mg/dL的样本所引起的吸光度变化在0.02~0.20之间。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求jiuqiang
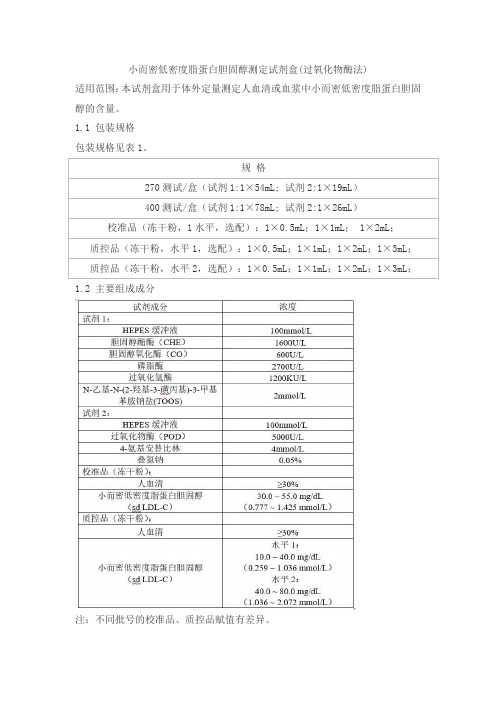
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)适用范围:本试剂盒用于体外定量测定人血清或血浆中小而密低密度脂蛋白胆固醇的含量。
1.1 包装规格包装规格见表1。
1.2 主要组成成分注:不同批号的校准品、质控品赋值有差异。
2.1 外观试剂1为无色到淡褐色液体,目测不得有任何沉淀及絮状悬浮物;试剂2为淡黄色到黄色液体,目测不得有任何沉淀及絮状悬浮物;校准品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物;质控品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量液体试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A600nm下测定空白吸光度应≤ 0.05。
2.4 准确度与已上市产品进行比对试验:在 [4.0,100.0] mg/dL([0.104,2.59] mmol/L)区间内,相关系数r≥0.975,在 [4.0,30.0] mg/dL([0.104,0.777] mmol/L)区间内测定的绝对偏差应不超过±3 mg/dL (±0.0777 mmol/L),在(30,100.0] mg/dL ((0.777,2.59] mmol/L)区间内测定的相对偏差应不超过±10%。
2.5 分析灵敏度样本浓度为100.0 mg/dL(2.59 mmol/L)时,其吸光度变化在0.0500~0.2500之间。
2.6 线性区间在[4.0,100.0] mg/dL([0.104,2.59] mmol/L)区间内,线性相关系数r≥0.990, 在[4.0,30.0] mg/dL([0.104,0.777] mmol/L)区间内测定的绝对偏差应不超过±3 mg/dL(±0.0777 mmol/L),在(30,100.0] mg/dL((0.777,2.59] mmol/L)区间内测定的相对偏差应不超过±10%。
sdLDL-C小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求

医疗器械产品技术要求编号:小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)1.产品型号/规格及其划分说明R1:2×15ml 、R2:2×5mL ;校准品(选配):1×2ml ;质控品(选配):2×1ml (2个水平,每个水平1mL )。
2.性能指标2.1外观2.1.1试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰、准确、牢固。
2.1.2 R1为无色液体,R2为无色或淡黄色液体。
2.2净含量液体试剂净含量应不少于标示值。
2.3试剂空白吸光度试剂空白吸光度A cm nm1600应<0.5。
2.4分析灵敏度测试(1.02±0.2)mmol/L 的样品,吸光度差值( A )应≥0.01。
2.5线性范围在[0.1~2.6]mmol/L 内线性相关系数r≥ 0.990。
在[0.1,0.5]mmol/L 范围内,绝对偏差≤0.5mmol/L ;在(0.5,2.6]mmol/L 范围内,相对偏差应不超过±15%。
2.6精密度2.6.1 重复性变异系数,CV 应≤10%。
2.6.2批间差相对极差,R ≤15%。
2.7准确度相对偏差应不超过±15%。
2.8 校准品、质控品2.8.1校准品、质控品外观白色或微黄色冻干品。
2.8.2校准品、质控品的准确度相对偏差在±15.0%范围内。
2.8.3校准品、质控品的均一性变异系数CV≤10.0%。
2.8.4校准品、质控品的批内瓶间差批内瓶间差CV≤15.0%。
3 检验方法检测条件:a)生化分析仪波长600nm;温度37℃±0.1℃。
b)恒温装置、准确加样器、生化分析仪。
测试方法按说明书规定,因不同机型使用试剂最终浓度相同。
在此推荐以本公司的BECKMAN或HITACHI全自动生化分析仪进行测试。
3.1 外观目测检查,应符合2.1的要求。
3.2 净含量用通用量具测量,应符合2.2的要求。
低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接法-保护性试剂法)产品技术要求kemei

低密度脂蛋白胆固醇(LDL-C)测定试剂盒(直接法-保护性试剂法)适用范围:本试剂盒用于体外定量测定人血清中低密度脂蛋白胆固醇(LDL-C)的浓度。
1.1包装规格1.2主要组成成分2.1外观2.1.1试剂1应为无色或淡黄色透明溶液,无混浊,无未溶解物;2.1.2试剂2应为无色或淡黄色透明溶液,无混浊,无未溶解物;2.1.3校准品应为无色至淡黄色固体;2.1.4质控品应为无色至淡黄色固体。
2.2净含量液体试剂的净含量应不少于标示值。
2.3试剂空白LDL-C试剂盒在波长(600±20)nm处测定空白样品的吸光度值,应不大于0.0500。
2.4分析灵敏度LDL-C试剂盒测试1.00mmol/LLDL-C时,吸光度差值(ΔA)应大于0.0300。
2.5准确度测定国际参考物质SRM1951,测定结果的相对偏差不大于10%。
2.6精密度2.6.1重复性重复测试(2.50±0.50)mmol/L和(5.00±1.00)mmol/L的样品,所得结果的变异系数CV应不大于3%;2.6.2批间差测试(2.50±0.50)mmol/L的样本,所得结果的批间相对极差应不大于10%;2.7线性范围LDL-C试剂盒在[0.30,10.00] mmol/L范围内,线性相关系数(r)应不小于0.995;在[0.30,3.00] mmol/L区间内,线性绝对偏差应不超过±0.30mmol/L;在(3.00,10.00] mmol/L区间内,线性相对偏差应不超过±10%。
2.8质控品赋值有效性重复测定质控品,测定结果应在质控范围内。
2.9稳定性原包装的试剂盒在2℃~8℃密封避光贮存,有效期为12个月。
原包装校准品与质控品在2℃~8℃密封避光贮存,有效期为18个月。
在有效期满后2个月内,试剂性能应符合2.1、2.3、2.4、2.5、2.6.1、2.7、2.8的要求。
2.10校准品/质控品批内瓶间差批内瓶间差的变异系数(CV)应≤3%。
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)产品技术要求jiuqiang
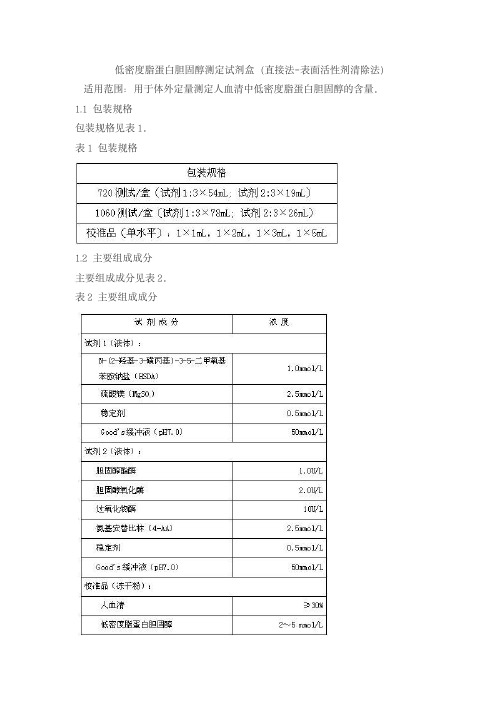
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)适用范围:用于体外定量测定人血清中低密度脂蛋白胆固醇的含量。
1.1包装规格包装规格见表1。
表1包装规格1.2主要组成成分主要组成成分见表2。
表2主要组成成分注:不同批号的校准品赋值有差异。
2.1外观试剂1为无色至淡黄色透明液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色至淡黄色透明液体,目测不得有任何沉淀及絮状悬浮物;校准品为淡黄色或黄色粉末状物质,复溶后为淡黄色或黄色液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2净含量应不少于标示量。
2.3试剂空白吸光度试剂空白:A604nm下测定空白吸光度应≤0.0500。
2.4准确度使用国际参考物质SRM1951,对试剂盒进行测试,其测量结果的相对偏差应不超过±10%。
2.5分析灵敏度测定1.0mmoL/L样本时,吸光度差值(ΔA)应>0.03。
2.6线性区间试剂盒线性在[0.3,12]mmoL/L区间内:线性相关系数(r)应不小于0.995;在[0.3,3.0]mmol/L区间内,测定的线性绝对偏差应不超过±0.3mmoL/L,在(3.0,12]mmoL/L区间内测定的线性相对偏差应不超过±10%。
2.7精密度2.7.1重复性重复测试(2.50±0.50)mmol/L和(5.00±1.00)mmol/L的样本,所得结果的变异系数(CV)应不大于3%。
2.7.2批间差测试(2.50±0.50)mmol/L的样本,所得结果的批间相对极差(R)应不大于10%。
2.8校准品批内瓶间差校准品的瓶间差应不大于10%。
2.9稳定性2.9.1试剂稳定性试剂盒在2℃~8℃密封避光保存,有效期为18个月。
取到效期后的样品检测外观、试剂空白吸光度、分析灵敏度、线性、重复性、准确度应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
小而密低密度脂蛋白胆固醇(sdLDL-C )测定试剂盒 (过氧化物酶法)产品技术要求参考

医疗器械产品技术要求编号:小而密低密度脂蛋白胆固醇(sdLDL-C)测定试剂盒(过氧化物酶法)1.产品型号/规格及其划分说明1.1包装规格试剂1(R1):2×60mL、试剂2(R2):2×20mL;试剂1(R1):1×48mL、试剂2(R2):1×16mL;试剂1(R1):2×48mL、试剂2(R2):2×16mL;试剂1(R1):1×60mL、试剂2(R2):1×20mL;试剂1(R1):2×30mL、试剂2(R2):2×10mL;试剂1(R1):1×30mL、试剂2(R2):1×10mL;试剂1(R1):1×24mL、试剂2(R2):1×8mL;试剂1(R1):1×18mL、试剂2(R2):1×6mL;试剂1(R1):1×15mL、试剂2(R2):1×5mL;试剂1(R1):1×12mL、试剂2(R2):1×4mL;256测试/盒(试剂1(R1):1×39mL、试剂2(R2):1×13mL)。
校准品(选配):1×1mL。
质控品(选配):2×1mL。
1.2主要组成成分产品主要组成成分见表1。
表1主要组成成分1.3适用范围本产品用于体外定量测定人血清或血浆中小而密低密度脂蛋白胆固醇(sdLDL-C)的含量。
2性能要求2.1外观试剂盒各组分应齐全、完整,液体无渗漏。
包装标签文字符号应清晰。
液体双试剂:R1:无色至褐色澄清液体;R2:无色至淡黄色澄清液体。
校准品:冻干品,复溶后为无色至淡黄色澄清液体。
质控品:冻干品,复溶后为无色至淡黄色澄清液体。
2.2装量液体试剂的净含量不得低于标示体积。
2.3空白吸光度在37℃、(600nm±10%范围内的)波长、1cm光径条件下,用纯化水(或生理盐水)作为样品加入试剂测试时,空白吸光度应≤0.05。
胆固醇测定试剂盒(CHOD-PAP法)产品技术要求beiken

胆固醇测定试剂盒(CHOD-PAP法)适用范围:本产品用于体外定量测定人血清中胆固醇的浓度。
1.1包装规格试剂的包装规格见表1的规定。
表1 包装规格1.2主要组成成分试剂盒由单一液体试剂组成,主要的组成成分见表2。
表2试剂盒组成成分2. 1外观试剂为淡红色溶液,透明、无沉淀及絮状悬浮物,外包装完整无破损。
2. 2 净含量试剂的净含量应不少于标示值。
2. 3 试剂空白吸光度在500nm的波长测试时,1cm光径下测定吸光度值应不大于0.100。
2. 4 分析灵敏度测试0.008mmol/L的总胆固醇引起的吸光度变化值应≥0.0001。
2.5 线性范围本产品的线性范围是[18.75,1000]mg/dl或[0.5,25.8]mmol/L,线性相关系数r 应不小于0.990。
在[18.75,192]mg/dL或[0.5,5]mmol/L范围内的绝对偏差应不超过±19.2mg/dL 或0.5mmol/L,在(192,1000]mg/dL或(5,25.8]mmol/L 范围内的相对偏差应不超过±10%。
2.6 精密度2.6.1批内精密度批内精密度应不大于4.0%。
2.6.2批间差批间差应不大于6.0%。
2.7准确度测试标准物质(编号及来源:GBW09178a、GBW09179卫生部临床检验中心),所得准确度偏差应不超过±10%。
2.8 稳定性:试剂盒贮存在2℃~8℃条件下,有效期为24个月。
产品在有效期末测试2.1、2.3、2.4、2.5、2.6.1、2.7,结果符合各项要求。
胆固醇测定试剂盒(CHOD-PAP法)产品技术要求lepu

胆固醇测定试剂盒(CHOD-PAP法)
适用范围:用于体外定量测定人血清中胆固醇的含量。
1.1 规格
2×60mL;4×45mL;6×60mL;2×40mL;1×5L;1×20L。
1.2主要组成成分
试剂主要组分:
2.1 净含量
应不低于试剂瓶标示装量。
2.2 外观
试剂:为浅粉色或淡红色液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白
在505nm(500nm~550nm)波长下,试剂空白吸光度应不大于0.100。
2.4 分析灵敏度
测试5.0mmol/L的被测物时,吸光度变化(ΔA)应不低于0.0060。
2.5 准确度
用参考物质(GBW09179)对试剂(盒)进行测试,实测值与标示值的相对偏差应在±10%内。
2.6 重复性
变异系数(CV)应不大于4%。
2.7 线性
2.7.1在[0.5,15]mmol/L区间内,线性相关系数r应不低于0.9900;
2.7.2 [0.5,1.5)mmol/L区间内绝对偏差应不超过±0.15mmol/L;[1.5,
15]mmol/L区间内相对偏差应不超过±10%。
2.8 批间差
相对极差应不大于6.0%。
2.9 稳定性
取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,检测结果应符合2.2、2.3、2.4、2.5、2.6、2.7的要求。
小而密测定试剂说明书(1)

小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)说明书【产品名称】通用名称:小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)【检验原理】本测定基于特殊的表面活性剂和酶,进而选择性与特定的脂蛋白反应。
第一步:在胆固醇脂酶(CHE)、胆固醇氧化酶(CO)、磷脂酶和过氧化氢酶(catalase)的作用下,先清除非sdLDL-C 成份,即:乳糜微粒、VLDL和IDL, L LDL和HDL。
CHE&COCM, VLDL, IDL, L LDL, HDLCholestenone + Fatty acid + H2O2CatalaseH2O2H2O + O2第二步:在试剂R2中的表面活性剂作用下,sd LDL-C发生特殊显色反应。
CHE&COsd LDL-C Cholestenone + Fatty acid + H2O2POD2 H2O2 +4-氨基安替比林+ TOOS 醌类染料+4 H2O【储存条件及有效期】原包装试剂在2℃~8℃避光条件下存放有效期为12个月;生产日期及失效日期见标签。
【主要组成成分】注:1.不同批号试剂不可以混用。
【检验方法】1.检测条件测定样本时,无需每次都进行质控管和校准管测定,只测定空白管和样本管即可。
2.结果计算计算方法:样品浓度(μg/mL)=ΔAT/ΔAS×校准液浓度式中:ΔAT:以空白管吸光度为对照的样品管吸光度变化率;ΔAS:以空白管吸光度为对照的校准管吸光度变化率;【参考区间】年轻人(20-44岁男性):0.246 – 1.393 mmol/L (9.5 – 53.8 mg/dL)年轻人(20-54岁女性):0.243 – 1.109 mmol/L (9.4 - 42.8 mg/dL)老年人(45-79岁男性、55-79岁女性):0.264- 1.362 mmol/L (10.2- 52.6 mg/dL )以上参考区间,仅供参考。
各实验室应当通过实验建立预期的正常参考区间。
低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)产品技术要求首医

低密度脂蛋白胆固醇测定试剂盒(直接法-表面活性剂清除法)适用范围:本试剂盒用于定量测定血清中低密度脂蛋白胆固醇的含量。
1.1包装规格试剂1:3×60mL,试剂2:3×20mL;试剂1:6×30mL,试剂2:3×20mL;试剂1:2×60mL试剂2:2×20mL1.2产品组成试剂1:Goods缓冲液30mmol/L,多聚阴离子0.5%。
试剂2:胆固醇氧化酶6KU/L,胆固醇脂酶1KU/L,过氧化物酶25KU/L,4-氨基安替比林2.5mmol/L。
2.1 外观试剂1为无色透明溶液;试剂2为无色或略带黄色透明溶液;试剂盒各组分齐全、完整,液体无渗漏,包装标签文字符号清晰牢固不易脱落,外包装完整无破损。
2.2 装量液体试剂的净含量应不少于标示值。
2.3 试剂空白吸光度在600nm波长、1cm光径条件下,试剂空白吸光度应不大于0.050。
2.4 分析灵敏度测定1.00mmol/L低密度脂蛋白胆固醇时,吸光度的变化在0.0769±0.0140范围内。
2.5准确度采用比对试验,相关系数r2≥0.95,相对偏差应不超过±10%。
2.6 精密度2.6.1 重复性用血清样品或质控样品重复测试所得的变异系数(CV)应不大于5.0%。
2.6.2 批间差试剂(盒)批间相对极差应不大于6.0%。
2.7线性试剂线性在[0.30,7.80]mmol/L区间内:a) 线性相关系数|r|应不小于0.990;b) [0.30,3.00]mmol/L区间内,线性绝对偏差应不超过±0.30mmol/L;(3.00,7.80]mmol/L区间内,线性相对偏差应不超过±10%。
2.8稳定性原包装试剂2~8℃避光保存有效期12个月,到效期末进行检验,检验结果应符合2.3、2.5、2.7的要求。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求baiding

小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)适用范围:用于体外定量测定人血清中小而密低密度脂蛋白胆固醇的含量。
1.1 规格校准品(选配):1×1mL;质控品(选配):水平1:1×1mL,水平2:1×1mL。
1.2 组成注:校准品靶值、质控品质控范围详见包装标签。
2.1 外观2.1.1试剂1:无色到淡褐色液体,无可见不溶物。
2.1.2试剂2:淡黄色到黄色液体。
2.1.3校准品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.4质控品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.5包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 试剂空白吸光度试剂空白吸光度≤0.05。
2.4 分析灵敏度样本浓度为50mg/dL时,吸光度差值应≥0.02。
2.5 线性区间在[8,100] mg/dL的范围内,线性相关系数r≥0.990。
测试浓度在[8,30] mg/dL 时;绝对偏差应不超过±3mg/dL;测试浓度在(30,100] mg/dL时,相对偏差应不超过±10%。
2.6 精密度2.6.1重复性用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度与已上市产品进行对比试验,在[8,100] mg/dL的范围内,线性相关系数r≥0.975。
测试浓度在[8,30] mg/dL时,绝对偏差应不超过±3mg/dL;测试浓度在(30,100] mg/dL时,相对偏差应不超过±10%。
2.8 质控品赋值有效性测试结果在质控范围内。
2.9 校准品/质控品瓶内重复性校准品/质控品瓶内重复性(CV)应不大于10%。
2.10 校准品/质控品批内瓶间差校准品/质控品批内瓶间差(CV)应不大于10%。
小而密低密度脂蛋白胆固醇(sd LDL—C)测定试剂盒(过氧化物酶法)产品技术要求mairui

2性能指标2.1外观R1试剂应为澄清透明的液体,无沉淀、悬浮物和絮状物;R2试剂应为澄清透明的液体,无沉淀、悬浮物和絮状物;校准品复溶前应为浅黄色冻干粉末,复溶后应为浅黄色液体。
试剂盒各组分应齐全、完整,液体无渗漏;包装标签文字符号应完整、清晰。
2.2净含量液体试剂的净含量应不少于标示值,标示值见表1。
2.3试剂空白吸光度试剂以水为空白在37℃±1℃,605nm波长条件下,吸光度应小于0.05 A。
2.4分析灵敏度当样本浓度为0.52 mmol/L 时,吸光度变化应不小于0.01 A。
2.5线性范围试剂盒在(0.104 ~ 2.59)mmol/L范围内:a)线性相关系数r应不小于0.9900;b)当样本浓度不大于0.777 mmol/L 时,线性绝对偏差应不大于±0.078 mmol/L;当样本浓度大于0.777 mmol/L 时,线性相对偏差应不大于±10.0%。
2.6测量精密度2.6.1重复性变异系数:CV应不大于10.0%。
2.6.2批间差相对偏差:R应不大于10.0%。
2.7准确度1测定企业参考品,测定结果与靶值的相对偏差应不大于±10.0%。
2.8分析特异性血红蛋白浓度在500 mg/dL内、内源性酯浓度在600 mg/dL内、胆红素浓度在40mg/dL 内、抗坏血酸在50mg/dL内,对试剂检测结果的偏差影响在±10.0%范围内。
2.9校准品均一性试剂盒校准品的瓶内均一性:CV应不大于10.0%。
2.10生物安全性校准品的HBsAg、HIV抗体、HCV抗体、梅毒螺旋体TP抗体检测应为阴性。
2。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)产品技术要求万泰德瑞

小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)组成:试剂1:Good’s缓冲液100mmol/L胆固醇酯酶1600U/L胆固醇氧化酶600U/L脂蛋白脂肪酶2700U/L过氧化氢酶1200KU/LN-乙基-N-磺基羟丙基-间-甲苯胺钠盐2mmol/L试剂2:Good’s缓冲液100mmol/L过氧化物酶5000U/L4-氨基安替比林4mmol/L校准品(冻干粉):磷酸缓冲液,人血清(含量≥5%),小而密低密度脂蛋白胆固醇,目标浓度:42.5mg/dL,批特异,具体浓度见瓶签。
质控品(冻干粉):磷酸缓冲液,人血清(含量≥5%),小而密低密度脂蛋白胆固醇,质控品水平1靶值范围:10.0~40.0mg/dL,质控品水平2靶值范围:40.0~80.0mg/dL,批特异,具体浓度见瓶签。
适用范围:用于体外定量测定人血清中小而密低密度脂蛋白胆固醇的含量。
2.1 外观试剂1:无色至淡褐色液体;试剂2:淡黄色至黄色液体;校准品:冻干粉,复溶后为无色或淡黄色液体;质控品:冻干粉,复溶后为无色或淡黄色液体。
2.2 装量液体成分应不少于标示值。
2.3 试剂空白吸光度试剂空白吸光度应不大于0.05。
2.4 分析灵敏度40mg/dL样本的吸光度变化在0.0200~0.1200范围内。
2.5 准确度用已上市试剂盒和本公司试剂盒同时测试至少40例线性范围内的不同浓度的血清样本,其相关系数(r)不小于0.975;在[4.0,30.0]mg/dL区间内,线性绝对偏差不超过±4.5mg/dL,(30.0,100.0]mg/dL区间内,线性相对偏差应不超过±15%。
2.6 精密度2.6.1 重复性变异系数(CV)应不大于10%。
2.6.2 批间差测试一个浓度样本,批间相对极差(R)应不大于15%。
2.7 线性在[4.0,100.0]mg/dL区间内,线性相关系数(r)应不小于0.990;[4.0,30.0]mg/dL区间内,线性绝对偏差不超过±4.5mg/dL,(30.0,100.0]mg/dL区间内,线性相对偏差应不超过±15%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小而密低密度脂蛋白胆固醇测定试剂盒(过氧化物酶法)
适用范围:本试剂盒用于体外定量测定人血清或血浆中小而密低密度脂蛋白胆固醇的含量。
1.1 包装规格
包装规格见表1。
表1 包装规格
包装规格
试剂1:3×20mL、试剂2:1×20mL
试剂1:1×60mL、试剂2:1×20mL
试剂1:2×60mL、试剂2:2×20mL
试剂1:3×60mL、试剂2:3×20mL
试剂1:6×60mL、试剂2:2×60mL
试剂1:4×90mL、试剂2:2×60mL
试剂1:2×90mL、试剂2:1×60mL
试剂1:1×45mL、试剂2:1×15mL
试剂1:2×45mL、试剂2:2×15mL
试剂1:24×3.8mL、试剂2:12×2.6mL
试剂1:12×3.8mL、试剂2:6×2.6mL
试剂1:1×18mL、试剂2:1×6mL
试剂1:6×60mL、试剂2:2×45mL
试剂1:4×90mL、试剂2:2×45mL
试剂1:2×90mL、试剂2:1×45mL
试剂1:1×60mL、试剂2:1×15mL
试剂1:2×60mL、试剂2:2×15mL
试剂1:1×40mL、试剂2:1×10mL
试剂1:2×40mL、试剂2:2×10mL
试剂1:1×20mL、试剂2:1×5mL
试剂1:24×3.8mL、试剂2:6×3.8mL
试剂1:1×50mL、试剂2:1×10mL
试剂1:2×50mL、试剂2:2×10mL
试剂1:2×60mL、试剂2:2×12 mL
试剂1:1×25mL、试剂2:1×5 mL
试剂1:30×3.8mL、试剂2:6 ×3.8mL
校准品(冻干粉,1水平):1×0.5mL;1×1mL;1
×2mL;
质控品(冻干粉,水平1):1×0.5mL;1×1mL;1
×2mL;1×3mL;
质控品(冻干粉,水平2):1×0.5mL;1×1mL;1
×2mL;1×3mL;
1.2 主要组成成分
表2 主要组成成分
2.1 外观
试剂1为无色到淡褐色液体,目测不得有任何沉淀及絮状悬浮物;
试剂2为淡黄色到黄色液体,目测不得有任何沉淀及絮状悬浮物;
校准品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物;
质控品为白色或淡黄色粉末状物质,复溶后为无色或淡黄色液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量
试剂的净含量应不少于标称量。
2.3 试剂空白吸光度
A600nm下测定空白吸光度应≤ 0.05。
2.4 准确度
与已上市产品进行比对试验:相关系数r≥0.975,在[0.104,0.777] mmol/L([4.0,30.0] mg/dL)区间内测定的绝对偏差应不超过± 0.0777 mmol/L (± 3 mg/dL),在(0.777,2.59] mmol/L ((30,100.0] mg/dL)区间内测定的相对偏差应不超过±10%。
2.5 分析灵敏度
样本浓度为2.59 mmol/L (100.0 mg/dL)时,其吸光度变化在
0.0500~0.2500之间。
2.6 线性范围
在[0.104,2.59] mmol/L([4.0,100.0] mg/dL)区间内,线性相关系数r≥0.990, 在[0.104,0.777] mmol/L([4.0,30.0] mg/dL)区间内测定的线性偏差应不超过± 0.0777 mmol/L (± 3 mg/dL),在(0.777,2.59] mmol/L ((30,100.0] mg/dL)区间内测定的线性偏差应不超过±10%。
2.7 测量精密度
2.7.1 重复性
对不同浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差
随机抽取三批试剂盒的批间相对极差(R)应不大于15%。
2.8 瓶间差
校准品、质控品的瓶间差应≤10%。
2.9 质控品赋值有效性
使用质控品进行测定,所得结果应在靶值范围内。
2.10 稳定性
2.10.1 试剂稳定性
试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
2.10.2 校准品复溶稳定性
复溶后校准品在2℃~8℃保存1天,取到效期后校准品与新鲜复溶的校准品同时测定,测试结果间的相对偏差应在±10%之内。
2.10.3 质控品复溶稳定性
复溶后质控品在2℃~8℃保存1天,取到效期后质控品与新鲜复溶的质控品同时测定,测试结果间的相对偏差应在±10%之内。
2.11 溯源性
试剂盒校准品溯源至企业工作校准品,按《GB/T 21415-2008体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,与日本电化生研株式会社校准品比对赋值。
