金属腐蚀学总复习
高考总复习-高三化学一轮复习考点优化设计(第四辑):考点五十八 金属的腐蚀与防护 含解析

聚焦与凝萃1.理解金属发生电化学腐蚀的原因、金属腐蚀的危害;2.掌握金属腐蚀的防护措施。
解读与打通常规考点一、金属的腐蚀(1)金属腐蚀:指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
(2)金属腐蚀的本质:是金属原子失去电子变成阳离子的过程。
可以表示为;M—ne—=M n+即金属腐蚀的过程中,金属发生氧化反应。
(3)金属腐蚀的分类:①化学腐蚀金属跟接触到的物质(如O2、Cl2、SO2等)直接发生化学反应而引起的腐蚀叫做化学腐蚀.这类反应是金属跟氧化剂之间的氧化还原反应.例如,铁跟氯气直接反应而腐蚀;钢管被原油中的含硫化合物腐蚀;铁遇到碘易发生反应(Fe+I2=FeI2) 而被腐蚀等。
②电化学腐蚀不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失电子而被氧化,这种腐蚀叫做电化学腐蚀。
例如:钢铁在潮湿空气中所发生的腐蚀a.吸氧腐蚀在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜,这层水膜里含有少量H+和OH—,还溶解了氧气等气体,结果在钢铁表面形成了一层电解质溶液,它跟钢铁里的铁和少量的碳恰好形成无数微小的原电池。
在这些原电池里,铁是负极,碳是正极。
铁失去电子而被氧化:负极:2Fe-4e-=2Fe2+正极:2H2O+O2+4e—=4OH-正极吸收了氧气,所以又叫吸氧腐蚀。
电化学腐蚀是造成钢铁腐蚀的主要原因.b.析氢腐蚀在潮湿的显酸性的空气中(例CO2、SO2、H2S等),钢铁表面吸附了一层薄薄的水膜显酸性,则钢铁中的主要成分铁与杂质碳及水膜形成原电池.电极反应式为:负极:Fe—2e—=Fe2+正极:2H++2e—=H2↑总的原电池反应为:Fe+2H+=Fe2++H2↑二、金属的防护:主要是破坏原电池的形成条件,特别是防止发生吸氧腐蚀。
具体方法有:①将金属合金化,改变金属结构,如生成不锈钢;②在金属表面覆加保护层;③金属经钝化处理,形成特殊的保护膜;④对金属进行电化学保护.隐性考点1.判断金属腐蚀快慢的规律不纯的金属或合金,在潮湿的空气中形成微电池发生电化学腐蚀,活泼金属因被腐蚀而损耗,金属被腐蚀得快慢与下列两种因素有关:(1)与构成微电池的材料有关,两极材料的活动性差别越大,电动势越大,氧化还原反应的速率越快,活泼金属被腐蚀的速率就越快。
金属腐蚀理论总复习题

金属腐蚀理论及腐蚀控制复习题第一章 绪论 思考题1.举例说明腐蚀的定义,腐蚀定义中的三个基本要素是什么,耐蚀性和腐蚀性概念的区别。
答:腐蚀的定义:工程材料和周围环境发生化学或电化学作用而遭受的破坏 举例:工程材料和周围环境发生相互作用而破坏三个基本要素:腐蚀的对象、腐蚀的环境、腐蚀的性质。
耐蚀性:指材料抵抗环境介质腐蚀的能力。
腐蚀性:指环境介质对材料腐蚀的强弱程度。
2.金属腐蚀的本质是什么,均匀腐蚀速度的表示方法有哪些?答:⑴金属腐蚀的本质:金属在大多数情况下通过发生化学反应或是电化学反应后,腐蚀产物变为化合物或非单质状态;从能量观点看,金属与周围的环境组成了热力学上不稳定的体系,腐蚀反应使体系能量降低。
⑵均匀腐蚀速度的表示方法:深度:年腐蚀深度 (p V )V P =t h ∆=8.76d -V △h 是试样腐蚀后厚度的减少量,单位mm;V -代表失重腐蚀速度; t 是腐蚀时间,单位y ;d 是金属材料的密度;V P 所以的单位是mm/y 。
失重:失重腐蚀速度(-V )-V = StW -∆=St W W 10- W0代表腐蚀前金属试样的质量,单位g ; W1代表腐蚀以后经除去腐蚀产物处理的试样质量,单位g ;S 代表试样暴露的表面积,单位m 2; t 代表腐蚀的时间,单位h 。
计算题计算题1. 根据表1中所列数据分别计算碳钢和铝两种材料在试验介质中的失重腐蚀速度V- 和年腐蚀深度Vp ,并进行比较,说明两种腐蚀速度表示方法的差别。
表1解:由题意得:(1)对碳钢在30%HNO 3( 25℃)中有: V ˉ=△W ˉ/st=(18.7153-18.6739)/45×2×(20×40+20×3+40×30)×0.000001=0.4694 g/㎡∙h又d=m/v=18.7154/20×40×0.003=7.798g/cm2∙hVp=8.76Vˉ/d=8.76×0.4694/7.798=0.53mm/y(25℃)中有:对铝在30%HNO3Vˉ=△Wˉ铝/st=(16.1820-16.1347)/2×(30×40+30×5+40×5)×45×10-6=0.3391g/㎡∙h/v=16.1820/(30×40×5×0.001)=2.697g/cm3d=m铝说明:碳钢的Vˉ比铝大,而Vp比铝小,因为铝在腐蚀的时候产生的是点腐蚀( 25℃)有:(2)对不锈钢在20%HNO3表面积S=2π×0.0152+2π×0.015×0.004=0.00179 m2Vˉ=△Wˉ/st=(22.3367-22.2743)/0.00179×400=0.08715 g/ m2∙h 试样体积为:V=π×1.52×0.4=2.827 cm3d=W/V=22.3367/2.827=7.901 g/cm3Vp=8.76Vˉ/d=8.76×0.08715/7.901=0.097mm/y对铝有:表面积S=2π×0.022+2π×0.02×0.005=0.00314 m2Vˉ=△Wˉ/st=(16.9646-16.9151)/0.00314×20=0.7882 g/ m2∙h试样体积为:V=π×22×0.5=6.28 cm3d=W/V=16.9646/6.28=2.701 g/cm3Vp=8.76Vˉ/d=8.76×0.7882/2.701=2.56mm/y试样在98% HNO3(85℃)时有:对不锈钢:Vˉ=△Wˉ/st=(22.3367-22.2906)/0.00179×2=12.8771 g/ m2∙hVp=8.76Vˉ/d=8.76×12.8771/7.901=14.28mm/y对铝:Vˉ=△Wˉ/st=(16.9646-16.9250)/0.00314×40=0.3153g/ m2∙hVp=8.76Vˉ/d=8.76×0.3153/2.701=1.02mm/y说明:硝酸浓度温度对不锈钢和铝的腐蚀速度具有相反的影响。
高三化学一轮复习——金属腐蚀与防护

第22讲金属腐蚀与防护【复习目标】理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
【课前预习】金属的腐蚀与防护1、化学腐蚀与电化腐蚀【课堂交流】【典型例题1】如图烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为________⑤⑥【规律总结】【变式1】(2010山东卷)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以铝材为阳极,在H 2SO 4 溶液中电解,铝材表面形成氧化膜,阳极电极反应为___________________________________________。
取少量废电解液,加入NaHCO ,溶液后产生气泡和白色沉淀,产生沉淀的原因是__________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是_______________________。
(3)利用右图装置,可以模拟铁的电化学防护。
若X 为碳棒,为减缓铁的腐蚀,开关K 应置于______处。
若X 为锌,开关K 置于M 处,该电化学防护法称为_______。
【规律总结】金属的防护方法【变式2】(2012山东∙13)下列与金属腐蚀有关的说法正确的是( )A .图a 中,插入海水中的铁棒,越靠近底端腐蚀越严重B .图b 中,开关由M 改置于N 时,Cu-Zn 合金的腐蚀速率减小C .图c 中,接通开关时Zn 腐蚀速率增大,Zn 上放出气体的速率也增大D .图d 中,Zn-MnO 2干电池自放电腐蚀主要是由MnO 2的氧化作用引起的海水 图a图b图c图d2 4Cl 糊状物【课后巩固】1、(2011浙江∙10)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。
导致该现象的主要原因是液滴之下氧气含量比边缘少。
下列说法正确的是()A.液滴中的Cl-由a区向b区迁移B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-4OH-C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-Cu2+2、(2012青岛一模)13下列说法正确的是()A.铅蓄电池放电时铅电极发生还原反应B.电解饱和食盐水时在阳极得到氯气,阴极得到金属钠C.给铁钉镀铜可采用CuSO4作电镀液D.生铁浸泡在食盐水中发生析氢腐蚀3、(2012四川∙11)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:()CH3CH2OH-4e-+ H2O = CH3COOH + 4H+。
腐蚀与防腐_综合复习题和答案

课堂作业1、材料的失效形式包括腐蚀、磨损和断裂。
2、腐蚀是金属与周围环境之间发生化学或电化学反应而导致的破坏性侵蚀。
3、腐蚀研究的着眼点在材料。
4、腐蚀具有自发性、普遍性和隐蔽性的特点。
5、腐蚀是一种材料和环境间的反应,这是腐蚀与摩擦现象分界线。
6、强调化学或电化学作用时称为腐蚀,强调力学或机械作用作用时则称为磨擦磨损。
7、腐蚀是被腐蚀金属氧化。
8、对均匀腐蚀的衡量有质量指标和强度指标。
9、根据环境介质可分为自然和工业环境。
10、自然环境腐蚀可分为大气、土壤、海水腐蚀11、根据受腐蚀材料可分为金属和非金属。
12、依据腐蚀机理腐蚀可分为化学腐蚀和电化学腐蚀13、电化学腐蚀由阳极、阴极和电子转移三个既相互独立又紧密联系的过程组成。
14、阳极过程是失电子的过程,其结果是金属的离子化。
15、阴极过程是得电子的过程,其结果介质中的离子夺取电子发生还原反应的还原过程。
16、外电路的金属氧化过程与溶液中的阴极还原过程组成了电荷的转移通道。
17、根据腐蚀形态腐蚀可分为普遍性腐蚀和局部腐蚀。
18、化学腐蚀分为气体腐蚀和在非电解质溶液中的腐蚀。
思考题1、从导体中形成电流的荷电粒子来看,可将导体分成两类电子和离子导体。
2、电极系统是由电子相和离子相组成,并且有电荷穿过界面中一个相到另一个相。
3、在电极系统中伴随着两个非同类导体之间的电荷转移而在两相界面发生的化学反应,称为电极反应。
4、参比电极,指的也是某一特定环境下的电极系统及相应的电极反应,而不是仅指电子导体材料。
5、金属失去电子的过程称为阳极过程。
阳极过程往往伴随着金属的离子水化进入溶液,材料被腐蚀。
6、负电性金属正离子进入溶液,金属上带有阳离子。
7、正电性金属位于溶液中时,溶液中的金属正离子在金属表面,溶液一侧有多余的负离子8、气体电极是溶液中的H+和OH-从金属上夺取电子,使得金属带有正电性。
9、气体电极包括氢电极和氧电极。
10、用于作为标准电极的是氢电极。
腐蚀与防护复习题(2)

《金属腐蚀与防护》复习题2022.6第一章绪论.什么是金属的腐蚀?局部腐蚀主要有哪些类型?1.金属腐蚀速度的三种主要表达方式?为什么可以用阳极溶解电流来评价金属腐蚀的速度?2.化学腐蚀和电化学腐蚀的共性与差异?其次章电化学腐蚀热力学.平衡电极电位是如何定义的?在什么条件下才可能建立体系的平衡电极电位?铁放在酸性溶液中能够建立起平衡电极电位吗?平衡电极电位对金属的腐蚀的倾向和腐蚀的速度有什么影响?1.什么是非平衡电极电位?它通常是如何获得的?2.标准电极电位的定义?标准电极电位是如何获得的?3.对参比电极的最基本要求是什么?4.电化学腐蚀发生的根本条件是什么?合金中杂质或其次相的存在对金属腐蚀倾向和腐蚀速度有何影响?5.金属发生腐蚀时,外表至少会有几个电极反响?金属在无氧的自身离子中性溶液中会始终发生溶解腐蚀吗?为什么?金属在有氧的自身离子中性溶液中会始终发生溶解腐蚀吗?6. 一根装运弱酸性化学溶液的碳钢管,由于匀称腐蚀,一年要更换一次。
为了改善管子的耐腐蚀性能,提高使用寿命,对管子内外表实施了化学镀Ni-P非晶镀层的处理,可是管子在投入使用不到2个月却发生了穿孔泄漏。
请从电化学腐蚀的角度分析其可能成因。
第三章电化学腐蚀动力学.什么是电极的极化现象?极化发生的本质缘由是什么?极化对金属腐蚀的速度有什么影响?1.试解释金属的自腐蚀电位和自腐蚀电流的含义?自腐蚀电位是平衡电极电位吗?他们与金属的腐蚀速度有什么关系?金属铁板放置在3%NaCl水溶液中,稳定一段时间后,通过试验测得的开路电位是平衡电位吗?2.阳极极化有儿种类型?成因是什么?3.由图3.11,分析溶液中硫化物及金属中其次相的存在对金属腐蚀速度的影响。
4.塔菲尔方程的基本表达式〃=成立图3.11钢在非氧化酸中的腐蚀极化图5 .电化学极化(活化极化)和浓差极化的形成缘由是什么?第四章析氢腐蚀与吸氧腐蚀•依据n 产曲+6log 九,分析影响析氢过电 位的因素。
金属腐蚀理论复习题

金属腐蚀理论复习题金属腐蚀理论及腐蚀控制复习题第一章绪论思考题1.举例说明腐蚀的定义,腐蚀定义中的三个基本要素是什么,耐蚀性和腐蚀性概念的区别。
答:腐蚀的定义:工程材料和周围环境发生化学或电化学作用而遭受的破坏举例:工程材料和周围环境发生相互作用而破坏三个基本要素:腐蚀的对象、腐蚀的环境、腐蚀的性质。
耐蚀性:指材料抵抗环境介质腐蚀的能力。
腐蚀性:指环境介质对材料腐蚀的强弱程度。
2.金属腐蚀的本质是什么,均匀腐蚀速度的表示方法有哪些?答:⑴金属腐蚀的本质:金属在大多数情况下通过发生化学反应或是电化学反应后,腐蚀产物变为化合物或非单质状态;从能量观点看,金属与周围的环境组成了热力学上不稳定的体系,腐蚀反应使体系能量降低。
⑵均匀腐蚀速度的表示方法:①深度:年腐蚀深度?hV-VP==△h 是试样腐蚀后厚度的减少量,单位mm;V-代表失重腐蚀速度;t td是腐蚀时间,单位y;d是金属材料的密度;VP所以的单位是mm/y。
②增重:W0?W1?W?V= =W0代表腐蚀前金属试样的质量,单位g;W1代表腐蚀以StSt+后经除去腐蚀产物处理的试样质量,单位g;S代表试样暴露的表面积,单位m2;t代表腐蚀的时间,单位h。
③失重:失重腐蚀速度(V?) ?W?W0?W1V= = W0代表腐蚀前金属试样的质量,单位g;W1代表腐StSt?蚀以后经除去腐蚀产物处理的试样质量,单位g;S代表试样暴露的表面积,单位m2;t 代表腐蚀的时间,单位h。
计算题计算题 1. 根据表1中所列数据分别计算碳钢和铝两种材料在试验介质中的失重腐蚀速度V- 和年腐蚀深度Vp,并进行比较,说明两种腐蚀速度表示方法的差别。
表1 解:题意得:对碳钢在30%HNO3( 25℃)中有:Vˉ=△Wˉ/st =()/45×2×(20×40+20×3+40×30)×= g/㎡?h 又d=m/v=/20×40×=/cm2?h Vp=ˉ/d=×/=/y 对铝在30%HNO3(25℃)中有:Vˉ=△Wˉ铝/st =()/2×(30×40+30×5+40×5)×45×10-6 =/㎡?h d=m铝/v=/(30×40×5×)=/cm3 说明:碳钢的Vˉ比铝大,而Vp比铝小,因为铝在腐蚀的时候产生的是点腐蚀对不锈钢在20%HNO3( 25℃)有:表面积S=2π×+2π××= m2 Vˉ=△Wˉ/st=()/×400= g/ m2?h 试样体积为:V=π××= cm3 d=W/V=/= g/cm3 Vp=ˉ/d=×/=/y 对铝有:表面积S=2π×+2π××= m2 Vˉ=△Wˉ/st=()/×20= g/ m2?h 试样体积为:V=π×22×= cm3 d=W/V=/= g/cm3 Vp=ˉ/d=×/=/y 试样在98% HNO3(85℃)时有:对不锈钢:Vˉ=△Wˉ/st =()/×2= g/ m2?h Vp=ˉ/d=×/=/y 对铝:Vˉ=△Wˉ/st=()/×40=/ m2?h Vp=ˉ/d=×/=/y 说明:硝酸浓度温度对不锈钢和铝的腐蚀速度具有相反的影响。
高考化学一轮总复习 第6章 第3节电解池 金属的腐蚀与

课
破
时
H+,溶液的 pH 发生变化。C.电解过程中 H2O 电离出的 H+
提 升
提 素
参与反应,c(OH-)增大,Cr3+与 Fe3+都与 OH-结合为沉淀。 练
验
探 究
组(勿忘水溶液中的 H+和 OH-)。
菜单
高三总复习·化学
(3)然后排出阴、阳两极的放电顺序
切
脉 搏
阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+
考
点 突
>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
课
破
时
阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。
切 脉
阳极反应式_____________________________;
搏
考 点
阴极反应式______________________________;
突 破
总反应化学方程式____________________________。
课 时
提
提
(4)用铜作电极电解盐酸溶液
升 练
素
养 实
阳极反应式_________________________;
菜单
高三总复习·化学
切
脉 搏
考点一 电解方程式的书写
考
点
突 破
[考题引领]
课 时
(1)(2014·四川高考)MnO2 可作超级电容器材料。用惰性
提 升
提
练
素 养
电极电解 MnSO4 溶液可制得 MnO2,其阳极的电极反应式是
金属的电化腐蚀学点归纳

• 二、金属的电化学防护 • 1.金属防护的思路 • 防止金属与化学物质接触;防止金属与环境形成 原电池。 • 2.防护方法 • (1)改变金属的内部组成和结构:如不锈钢(钢 中加入一定量的镍和铬)。 • (2)加保护层:金属表面镀上一层纯金属(如铁 上镀锌)、涂漆、涂油、制成氧化膜保护(钢铁 制品表面生成Fe3O4、在铝制品表面生成Al2O3)
• (3)电化学保护法
牺牲阳极的阴极保护 法
外加电流的阴极保护法
依据 构成
原电池原理
电解原理
将被保护的金属与电源负极相连, 作阴极,另一附加的惰性电极与 电源正极相连接,作阳极。
将被保护金属与比其更活泼 的金属连接在一起,更活泼 的金属作阳极(负极),被 保护的金属作阴极(正极)
原理
更活泼金属作阳极 (负极),不断被腐 蚀,作阴极(正极) 的金属得到保护
保护海轮外壳及石油管道
通电后,电子流向被保护的金 属(阴极),在该金属表面积 累了大量的负电荷,从而抑制 该金属失去电子,阻止金属被 腐蚀 保护土点归纳
一、金属腐蚀快慢的判断 金属的腐蚀在不同环境下有快有慢,不同的环境 其腐蚀速率也不相同,那么金属腐蚀快慢的决定 因素是什么呢? 1.电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀>有防护措施的腐蚀; 2.对同一种金属来说,腐蚀的快慢: 强电解质溶液>弱电解质溶液>非电解质溶液; 3.活泼性不同的两金属,活泼性差别越大,腐蚀越 快; 4.对同一种电解质溶液来说,电解质溶液浓度越大, 腐蚀越快。
• 典例剖析:一根铁丝插入煮沸过的蒸馏水中,铁丝上有三 点:A(水面以下)、B(水面)、C(水面以上)。问: • (1)A、B、C三点哪点腐蚀最快? • (2)若向蒸馏水中加入少量食盐,B处的腐蚀速率将如何 变化? • (3)若将蒸馏水换成:①0.1mol/LH2SO4溶液;② 1mol/LH2SO4溶液;③18.4mol/LH2SO4溶液。则A处腐蚀由 快到慢的顺序是—— • 答案:(1)B点腐蚀最快 • (2)B处腐蚀的速率将加快 • (3) ② > ① > ③ • 方法指导: 金属的电化学腐蚀快慢与金属所处的环境有关, 在分析金属腐蚀时要抓住金属所处的环境。
金属腐蚀学总复习
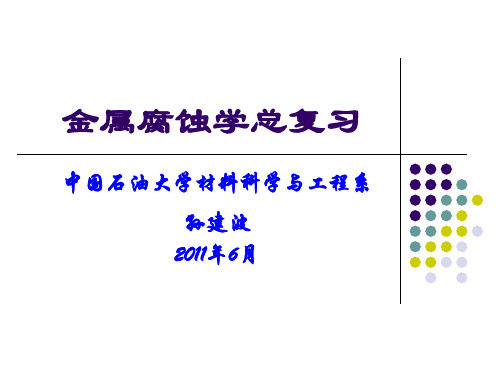
M M + ne →
+
Ec0 Ecorr
ic n → nH + ne H 2 2
电量平衡时: 电量平衡时:
ia = ic = icorr,Ecorr
Ea0 icorr i
外加电流极化时,电量平衡被破坏, 外加电流极化时,电量平衡被破坏,阴、阳极之间的电 流差值由外电流来补偿 阴极极化: 阴极极化: iC= ic- ia 阳极极化: 阳极极化: i =i -i
金属腐蚀学总复习
中国石油大学材料科学与工程系 孙建波 2011年 2011年6月
期末考试试题形式(闭卷) 期末考试试题形式(闭卷)
一. 二. 三. 四. 五. 填空题( 分 每空1分 填空题(20分,每空 分) 判断题(10分,每题1分) 判断题( 分 每题 分 问答题( 分 问答题(45分,6~8题) 题 计算题( 分 每题10分 计算题(20分,每题 分) 建议题( 分 建议题(5分)
14
2.局部腐蚀2.局部腐蚀-大阴极小阳极现象 局部腐蚀
Ig e IC2
电偶腐蚀的引申 局部腐蚀大阴极小 阳极现象普遍性。 阳极现象普遍性。 力场作用下的应力 集中。 集中。
IA1 A1 C1
IC1 S2
15
局部腐蚀的闭塞电池效应
所谓“闭塞电池” 所谓“闭塞电池”乃是由于在腐蚀体系内金属钝化膜破裂 后形成的蚀坑、隙缝及裂纹等的几何形状或腐蚀产物在其坑 后形成的蚀坑、 口的覆盖而使腐蚀介质的扩散受到抑制所形成的腐蚀电池。 口的覆盖而使腐蚀介质的扩散受到抑制所形成的腐蚀电池。 诱发活性阴离子吸附 酸化过程加速阳极自 催化快速溶解 促进应力存在下的耦 合腐蚀 诱发阴极析氢形成氢 损伤
氢腐蚀机理
在高温高压下, 进入金属,发生合金组分与H的化学反应,生成氢化物等, 在高温高压下,H进入金属,发生合金组分与H的化学反应,生成氢化物等,导致合 金强度下降,发生沿晶界开裂。如脱氧、 金强度下降,发生沿晶界开裂。如脱氧、碳。
高考化学考点复习《金属的腐蚀与防护》真题练习含答案
高考化学考点复习《金属的腐蚀与防护》真题练习含答案1.[2022·广东卷]为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3% NaCl溶液中。
一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是()A.加入AgNO3溶液产生沉淀B.加入淀粉碘化钾溶液无蓝色出现C.加入KSCN溶液无红色出现D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成2.[2022·上海卷]浓硫酸贮存罐的钝化金属保护法示意图如图,其原理是利用可钝化的金属与直流电源相连,控制合适的电压,使金属贮存罐表面形成致密的钝化膜,以有效减缓金属腐蚀。
下列选项错误的是()A.金属贮存罐可用钢制材料B.电子沿导线流入辅助电极C.贮存浓硫酸的金属罐与电源负极相连D.电压高到一定程度有可能会加剧腐蚀3.[2023·河北石家庄月考]点蚀又称为孔蚀,是一种集中于金属表面很小的范围并深入到金属内部的腐蚀形态。
某铁合金钝化膜破损后的孔蚀如图,下列说法正确的是()A.为防止孔蚀发生可以将外接电源正极与金属相连B.孔蚀外每吸收2.24 L O2,可氧化0.2 mol FeC.由于孔蚀中Fe3+水解导致电解质酸性增强D.孔隙中可以发生析氢腐蚀4.[2023·宁夏育才中学考试]港珠澳大桥的设计使用寿命高达120年,主要的防腐方法有:①钢梁上安装铝片;②使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预留钢铁腐蚀量。
下列分析不合理的是()A.防腐涂料可以防水、隔离O2,降低吸氧腐蚀速率B.防腐过程中铝和锌均作为负极,失去电子C.钢铁在海水中发生吸氧腐蚀时正极反应为O2+4e-===2O2-D.方法①②③只能减缓钢铁腐蚀,未能完全消除5.下列与金属腐蚀有关的说法,正确的是()A.图1中,铁钉易被腐蚀B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极6.[2023·福建永安三中月考]铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。
腐蚀复习提纲 (1)

题型:填空,名词解释,简答题,分析题第1章金属电化学腐蚀基本理论1.掌握腐蚀的定义与分类。
腐蚀—指材料由于环境作用引起的破坏或变质。
金属腐蚀—指金属表面与周围介质发生化学或电化学作用而遭受破坏的现象。
按腐蚀机理金属腐蚀可分为化学腐蚀、电化学腐蚀、物理溶解三大类。
按破坏的特征金属腐蚀可分为全面腐蚀、局部腐蚀。
2.化学腐蚀:金属与电介质直接发生化学作用而引起的破坏。
腐蚀介质直接与金属表面的原子相互作用而产生腐蚀,没有电流产生,为单纯的氧化还原反应。
电化学腐蚀:金属表面与电解质水溶液或熔盐所形成局部电池所产生的腐蚀。
表现为阳极失去电子,阴极得到电子以及产生电流。
3.熟练掌握常见的局部腐蚀类型。
应力腐蚀破坏:拉应力与腐蚀介质联合作用发生开裂破坏。
腐蚀疲劳:腐蚀介质与交变应力或脉冲应力作用下产生的腐蚀。
磨损腐蚀:摩擦副在腐蚀介质中产生的腐蚀。
孔腐蚀:腐蚀集中在某些活性点上,蚀孔直径等于或小于蚀孔深度。
晶间腐蚀:腐蚀沿晶间进行,使晶粒间失去结合力,金属强度急剧降低。
缝隙腐蚀:发生在铆接、螺纹连接、焊接接头、密封垫片等缝隙处的腐蚀。
电偶腐蚀:在电解液中,异种金属接触时,电位较正金属促使电位较负的金属加速其腐蚀。
4.掌握金属腐蚀的历程。
金属腐蚀的本质就是金属与周围介质作用变成化合物的过程,即氧化还原反应。
根据氧化还原反应发生的条件不同,将金属的腐蚀历程分为两种类型:化学腐蚀(Chemical corrosion),其特点是氧化剂直接与金属表面的原子碰撞,化合而形成腐蚀产物,即氧化还原在反应粒子相碰撞的瞬间直接于碰撞的反应点上完成。
例如高温气体中活泼金属的初期氧气过程。
电化学腐蚀(Electrochemical corrosion),其特点是金属的腐蚀存在两个同时进行却相互独立的氧化还原过程,即阳极反应(anode reaction)和阴极反应(cathode reaction)。
例如锌在含氧中性水溶液中的腐蚀。
高中化学复习知识点:金属的化学腐蚀与电化学腐蚀

C.燃气灶的中心部位容易生锈,主要是由于在高温下铁发生化学腐蚀较快,C选项错误;
D.用牺牲镁块的方法来防止地下钢铁管道的腐蚀,构成的是原电池,镁比铁活泼,所以镁块作原电池的负极被腐蚀,钢铁管道作正极被保护,D选项正确;
(2)对同一金属来说,在不同溶液中腐蚀速率的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶液中。
(3)活动性不同的两种金属,活动性差别越大,腐蚀速率越快。
(4)对同一种电解质溶液来说,电解质浓度越大,金属腐蚀越快。
7.B
【解析】
【分析】
【详解】
A.图-1为电解池,要保护钢铁,则钢铁应该作电解池阴极,所以a为电源负极,故A错误;
7.每年由于腐蚀造成的钢铁损失约占年产量的10~20%,金属的防腐十分重要。钢铁防腐方法有许多种,图—1与图—2是两个典型的例子。对其中原理的描述正确的是()
A.图—1:a为电源正极B.图—1:辅助电极上发生氧化反应
C.图—2:电流方向d→cD.图—2:金属A可以是耐腐蚀的金属铜
8.关于金属腐蚀和防护原理的叙述中,错误的是( )
3.C
【解析】
【分析】
【详解】
A.金属腐蚀就是金属原子失去电子被氧化的过程,故A错误;
B.合金不一定都比纯金属易被腐蚀,比如不锈钢合金,故B错误;
C.将金属与外加直流电源的负极相连,金属作电解池的阴极,金属受到一定的保护,可以防止金属被腐蚀,故C正确;
D.根据金属活动顺序表:Zn、Fe、Sn,镀锌铁中Fe作正极,镀锡铁中Fe作负极,因此镀锡铁比镀锌铁更容易被腐蚀,故D错误。
C.水库铁闸与直流电源正极相连做阳极,加快腐蚀,应该是与电源的负极相连可减缓腐蚀,C不正确;
高考化学知识点金属的电化学腐蚀与防护(基础)

高考总复习金属的电化学腐蚀与防护【考纲要求】1.金属腐蚀的种类,探究金属发生电化学腐蚀的原因。
2.了解金属腐蚀的危害,防止金属腐蚀的措施。
【考点梳理】考点一:金属腐蚀1.定义:金属腐蚀是指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
2.本质:金属腐蚀的实质都是金属原子失去电子被氧化生成金属阳离子的过程。
M-ne-==M n+(M代表金属元素)。
3.类型:(1)化学腐蚀:金属或合金直接与具有腐蚀性的化学物质接触发生氧化还原反应而消耗的过程。
(2)电化学腐蚀:不纯金属或合金与电解质溶液接触发生原电池反应而消耗的过程。
考点二:金属的电化学腐蚀12(1)种类:吸氧腐蚀与析氢腐蚀(2)吸氧腐蚀与析氢腐蚀的比较(以钢铁为例)【高清课堂:399291金属腐蚀的一般规律】3.金属腐蚀的快慢一般规律(1) 在同一电解质溶液中,电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。
(2) 在不同溶液中,金属在电解质溶液中的腐蚀>金属在非电解质溶液中的腐蚀;金属在强电解质溶液中的腐蚀>金属在弱电解质溶液中的腐蚀。
(3) 有保护措施的条件下,无防护条件的腐蚀>有一般防护条件下的腐蚀>牺牲阳极的阴极保护法条件下的腐蚀>外接电源(负极)的阴极保护法条件下的腐蚀。
(4) 对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
(5) 由于金属表面一般不会遇到酸性较强的溶液,故吸氧腐蚀是金属腐蚀的主要形式,只有在金属活动性顺序表中排在氢以前的金属才可能发生析氢腐蚀,而位于氢之后的金属腐蚀时只能是吸氧腐蚀。
考点三:金属的电化学防护1.在金属表面覆盖保护层。
①在钢铁表面涂矿物性油脂、油漆或覆盖搪瓷、塑料等物质;②用电镀、热镀、喷镀的方法,在钢铁表面镀上一层耐腐蚀的金属,如铁上镀锌、锡、铬等;③用化学方法使钢铁表面生成一层致密而稳定的氧化膜保护(表面钝化),如钢铁制品表面生成Fe3O4,在铝制品表面生成Al2O3。
高三化学一轮复习 电化学 专题1.3 金属腐蚀及电化学计算(2021年整理)

专题1—2 化学腐蚀及电化学计算【考纲要求】1.理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
2。
掌握电化学计算的方法与类型【教学过程】【例题解析】例1.说一说金属钠、镁、铝、铁、铜、银在空气中的变化的情况。
例2。
下列Fe片(铁钉)不受到被腐蚀的是。
【共同整合,知识提升】一、金属的腐蚀1.金属腐蚀的本质:金属原子失去电子变成金属阳离子,金属发生氧化反应。
2.金属腐蚀的类型(1)类型化学腐蚀电化学腐蚀条件金属与接触到的物质直接反应不纯金属接触到电解质溶液发生原电池反应本质M-n e-===M n+M-n e-===M n+现象金属被腐蚀较活泼金属被腐蚀区别电流产生电流产生联系腐蚀比腐蚀普遍得多,腐蚀速率更快,危害也更严重【问题情境】例3。
如图所示,甲、乙两试管中各放一枚铁钉,甲试管中为NH4Cl溶液,乙试管中为NaCl溶液,数天后导管中观察到的现象是________,甲中正极反应为,乙中正极反应为_________________。
【共同整合,知识提升】3.析氢腐蚀与吸氧腐蚀(以钢铁的腐蚀为例)类型析氢腐蚀吸氧腐蚀条件水膜酸性较强(pH≤4。
3)水膜酸性很弱或呈中性电极反应负极Fe-2e-===Fe2+正极总反应式Fe+2H+===Fe2++H2↑2Fe+O2+2H2O===2Fe(OH)2联系腐蚀更普遍【问题情境】例4。
如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为()A.②①③④⑤⑥B.⑤④③①②⑥ C.⑤④②①③⑥ D.⑤③②④①⑥【共同整合,知识提升】4.判断金属腐蚀快慢的规律(1)对同一电解质溶液来说,腐蚀的快慢:电解池原理引起的腐蚀〉原电池原理引起的腐蚀>化学腐蚀〉有防护措施的腐蚀。
(2)对同一金属来说,腐蚀的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶液中(浓度相同)。
(3)活泼性不同的两种金属,活泼性差异越大,腐蚀越快。
(4)对同一种电解质溶液来说,电解质浓度越大,金属腐蚀速率越快。
高考化学复习-金属的电化学腐蚀与防护

金属的电化学腐蚀与防护知识与技能目标(1)知道金属腐蚀的两种类型(化学腐蚀和电化学腐蚀)。
(2)能解释金属发生电化学腐蚀的原因,认识金属腐蚀的危害。
(3)掌握化学腐蚀与电化学腐蚀的比较 (4)掌握影响金属腐蚀快慢的比较 一、金属的电化学腐蚀 (一)金属腐蚀:1、定义:是指金属或合金跟接触的气体或液体发生氧化还原反应而腐蚀损耗的过程。
2、本质:M – ne- → Mn+(氧化反应)3、类型:化学腐蚀——直接反应 电化学腐蚀——原电池反应 (二)化学腐蚀1、定义:金属与接触到的干燥气体(如 、 、 等)或非电解质液体(如 )等直接发生化学反应而引起的腐蚀。
如:钢管被原油中的 腐蚀,2、影响因素:与接触物质的氧化性越强、温度越高,化学腐蚀越 。
(三)电化学腐蚀:1、定义:不纯的金属跟电解质溶液接触时。
会发生 反应 的金属失去电子而被 。
如 在潮湿的空气中生锈。
[实验探究]:将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入下图具支试管中,观察导管中2、类型:⑴ 吸氧腐蚀:中性或酸性很弱或碱性条件下,易发生 腐蚀。
负极:2Fe - 4e- = 2Fe 2+正极:O 2 + 2H 2O + 4e-= 4OH -电池反应:2Fe+ O 2 +2 H 2O =2Fe(OH)2 进一步反应:4Fe(OH)2 +O 2 + 2H 2O = 4 Fe(OH)32Fe(OH)3+ x H 2O =Fe 2O 3·xH 2O+3 H 2O ⑵析氢腐蚀:当钢铁处于酸性环境中 负极:Fe - 2e - = Fe 2+正极:2H ++ 2e- =H 2↑电池反应:Fe + 2H +=Fe 2++ H 2↑食盐水 浸泡过 的铁钉⑶析氢腐蚀和吸氧腐蚀比较析氢腐蚀 吸氧腐蚀 条 件 水膜呈 水膜呈负极(Fe 极)电极反应正极(C 极)总反应联系3、化学腐蚀与电化学腐蚀的比较:例1、如图, 水槽中试管内有一枚铁钉,放置数天观察:⑴若液面上升,则溶液呈 性, 发生 腐蚀,电极反应式为:负极: 正极:⑵若液面下降,则溶液呈 性,发生 腐蚀, 电极反应式为:负极: 正极:例2、钢铁在锈蚀过程中,下列5种变化可能发生的是 ( ) ①Fe 由+2价转化为+3价 ②O 2被还原 ③产生H 2 ④F e (O H )3失水形成Fe 2O 3·H 2O ⑤杂质碳被氧化除去A . ①②B . ③④C . ①②③④D . ①②③④⑤ 二、金属的电化学防护 1、牺牲阳极的阴极保护法原电池的负极(阳极)的金属被腐蚀原电池的正极(阴极)的金属被保护⑴原理:形成原电池反应时,让被保护金属做 极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
高考化学总复习考点知识专项训练25---金属的腐蚀与防护

高考化学总复习考点知识专项训练---金属的腐蚀与防护一、选择题1、相同材质的铁在图中的四种情况下最不易被腐蚀的是( )答案 C2.下列有关金属铁的腐蚀与防护,说法正确的是( ) A .在钢铁表面进行发蓝处理,生成四氧化三铁薄膜保护金属 B .当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 C .铁与电源正极连接可实现电化学保护D .阳极氧化处理铝制品生成致密的保护膜属于电化学保护法答案 A3、下列关于金属腐蚀的说法正确的是( ) A .金属在潮湿空气中腐蚀的实质是: M +n H 2O===M(OH)n +n2H 2↑B .金属的化学腐蚀的实质是:M -n e -===M n +,电子直接转移给氧化剂C .金属的化学腐蚀必须在酸性条件下进行D.在潮湿的环境中,金属的电化学腐蚀一定是析氢腐蚀答案 B4.(2019·福建上杭第一中学高二上10月月考)如图所示是探究铁发生腐蚀的装置图,下列说法正确的是()A.若B处液面上升,A溶液可能是酸性溶液B.若A为NaCl溶液,B、C液面始终保持不变C.可能产生Fe2O3·n H2OD.腐蚀的总反应式一定是2Fe+O2+2H2O===2Fe(OH)2答案 C5、(2019·吉林白城一中高二上期末)下列装置图有关说法正确的是()A.装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大B.装置①中K键闭合时,片刻后可观察到滤纸a附近变红色C.装置②中铁腐蚀的速率由大到小的顺序是只闭合K1>只闭合K3>只闭合K2>都断开D.装置③中当铁制品上析出1.6 g铜时,电源负极输出的电子数为0.025N A答案 B6、一定条件下,碳钢腐蚀与溶液pH的关系如下,下列说法不正确的是()pH 2 4 6 6.5 8 13.5 14腐蚀快慢较快慢 较快主要产物Fe2+Fe3O4Fe2O3FeO-2A.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-===2H2OB.在pH<4溶液中,碳钢主要发生析氢腐蚀C.在pH>6溶液中,碳钢主要发生吸氧腐蚀D.在煮沸除氧气的碱性溶液中,碳钢腐蚀速率会减缓答案 A7、我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。
高考化学金属的腐蚀与防护一轮复习小题训练(原卷版)

金属的腐蚀与防护1.下列有关金属腐蚀的说法中正确的是()A.金属腐蚀指不纯金属与接触到的电解质溶液进行化学反应而损耗的过程B.电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生2.下列关于钢铁腐蚀说法正确的是( )A.电化学腐蚀是造成钢铁腐蚀的主要原因B.钢铁腐蚀的负极为Fe-3e-=Fe3+C.弱酸性条件下钢铁发生析氢腐蚀D.镀锡铁器破损时镀层金属仍可以保护铁器3.下列有关镀锌钢管(锌盐溶液作电解质溶液)的说法正确的是( )A.电镀时,钢管作阳极,锌棒作阴极B.钢管镀锌过程中,阴阳两极的质量变化一定不相等C.镀锌的目的是在钢管表面形成Fe—Zn合金,增强钢管的耐腐蚀能力D.钢管镀锌过程中,阴极的电极反应式为Zn2++2e-=Zn4.化学与生活、生产有着密切关系,下列叙述中正确的是()A.钢铁发生析氢腐蚀时,H+得电子释放出H2,钢铁被腐蚀B.钢铁发生吸氧腐蚀时,OH-失电子释放出O2,钢铁被腐蚀C.船底镶嵌锌块,锌发生还原反应而被消耗,以保护船体D.外加电源的正极连接在海水中的钢铁闸门上,可保护闸门5.某地下了一场酸雨,在这种环境中的铁制品极易被腐蚀。
对该条件下铁制品发生电化学腐蚀的叙述正确的是( )A.该电化学腐蚀是析氢腐蚀B.正极反应式:O 2+4e-=2O2-C.原电池反应减缓了铁制品的腐蚀D.负极反应式:Fe-3e-=Fe3+6.如图所示的钢铁腐蚀中,下列说法正确的是( )A.碳表面发生还原反应B.钢铁被腐蚀的最终产物为FeOC.生活中钢铁制品的腐蚀以图①所示为主D.图②中,正极反应式为O2+4e-+2H2O═4OH-7.如图装置中,小试管内为红墨水,具支试管内盛有pH=4的久置的雨水和生铁片。
实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。
2025版高考化学总复习第6章化学反应与能量第22讲电解池金属的腐蚀与防护考点三金属的腐蚀与防护

第22讲电解池金属的腐蚀与防护考点三金属的腐蚀与防护自主小练1.易错辨析:正确的打“√”,错误的打“×”。
(1)电化学腐蚀比化学腐蚀的速率大得多。
( √ )[提示]电化学腐蚀是金属作原电池的负极而被加速腐蚀。
(2)钢铁的析氢腐蚀和吸氧腐蚀中都是铁作负极。
( √ )[提示]钢铁的析氢腐蚀和吸氧腐蚀中都是活泼金属铁作负极。
(3)钢铁设备与金属铜捆绑即可被保护。
( × )[提示]钢铁设备作为原电池的正极才能被保护。
(4)钢铁设备与直流电源的正极相连即可被保护。
( × )[提示]钢铁设备作为电解池的阴极才能被保护。
(5)把金属铬、镍等加入普通钢中能增强钢铁的耐腐蚀性。
( √ )[提示]钢铁中加入金属铬、镍等形成不锈钢。
(6)钢铁的发蓝处理能增强其耐腐蚀性。
( √ )[提示]钢铁的发蓝处理是在其表面形成一层致密的四氧化三铁保护膜。
(7)原电池分为正、负极,电解池分为阴、阳极,所以牺牲阳极的阴极保护法应用的是电解池原理。
( × )[提示]牺牲阳极的阴极保护法是应用原电池原理防腐。
(8)在铁板上镀锌是因为锌比铁活泼,形成原电池而保护铁不易被腐蚀。
( × )[提示]在铁板上镀锌是因为在铁板表面形成一层锌保护膜,可以阻止铁与空气的接触,与原电池无关,锌层破损后才与原电池有关。
(9)钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀。
( √ )(10)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物。
( × )[提示]Cu在潮湿的空气中腐蚀生成Cu2(OH)2CO3。
(11)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用。
( × )[提示]如Fe件上镀Zn,若保护层破损后,在潮湿的空气中,Fe、Zn构成原电池,Zn 作负极,仍然对Fe起到保护作用。
(12)外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池。
二者均能有效地保护金属不容易被腐蚀。
高二化学金属的腐蚀和防护期末复习题

学年高二化学金属的腐蚀和防护期末复习题化学是重要的基础科学之一,为大家推荐了高二化学金属的腐蚀和防护期末复习题,请大家仔细阅读,希望你喜欢。
一.选择题1.下列有关金属腐蚀的说法中正确的是:① 金属的腐蚀全部是氧化还原反应。
② 金属的腐蚀可分为化学腐蚀和电化腐蚀,只有电化腐蚀才是氧化还原反应,③ 因二氧化碳普遍存在,所以钢铁的电化腐蚀以析氢腐蚀为主。
④ 无论是析氢腐蚀还是吸氧腐蚀,总是金属被氧化。
A. ①③B. ②③C. ①④D. ①③④2.下列事实不能用电化学理论解释的是A.轮船水线以下的船壳上装上一定数量的锌块B.银质奖章久置后表面变暗C.黄铜(铜锌合金)制作的铜锣不易产生铜绿D.铁质器件附有铜质配件,在接触处易生铁锈3.5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首。
普通铜器时间稍久容易出现铜绿,其主要成分是Cu2(OH)2CO3 。
这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是A.它们的表面都电镀上一层耐腐蚀的黄金B.环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去C.铜的金属活动性比氢小,因此不易被氧化D.它们是含一定比例金、银、锡、锌的铜合金4.在铁制品上镀上一定厚度的锌层,以下设计方案正确的是A.锌作阳极,镀件作阴极,溶液中含有锌离子B.铂作阴极,镀件作阳极,溶液中含有锌离子C.铁作阳极,镀件作阴极,溶液中含有亚铁离子D.锌用阴极,镀件作阳极,溶液中含有锌离子5.下列过程需要通电才可进行的是:①电离;②电解;③电镀:④电化腐蚀。
A.①②③B.②③C.②④⑤D.全部6. 菜刀上沾有食盐水后,置于空气中一段时间会生锈,其原理是正极负极A .Fe= Fe2+ +2eˉ 2H2O+O2+4eˉ= 4OHˉB.2H++2eˉ= H2 Fe= Fe2++2eˉ目C.2H2O+O2+4eˉ = 4OHˉ Fe= Fe3++3eˉD.2H2O+O2+4eˉ = 4OHˉ Fe= Fe2++2eˉ7.金属及其制品在腐蚀介质中很容易被腐蚀,其使用寿命大为降低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
R Ri Re
y y y 1 1 ( ) ne kS ( nc na ) kS kS ne nc na
Cathode : Overall :
y ne ( nc na ) kS
M M 2 2e 1 O 2e O 2 2 2 M 1 O2 MO 2
金属腐蚀学总复习
中国石油大学材料科学与工程系 孙建波 2013年6月
期末考试试题形式(闭卷)
一. 二. 三. 四. 五. 六.
填空题(15分,每空0.5分) 判断题(15分,每题1分) 名词解释(10分,每题2分) 简答题(18分,约6题) 综合分析题(12分,每题6分) 计算题(15分,2题)
离子导体型氧化物 间隙型氧化物 半导体型氧化物
金属间化合物(反Schottky型缺陷)
金属氧化物膜的晶体结构 金属氧化膜的完整性与保护性
薄膜完整性(PBR推导计算) 薄膜保护性影响因素
21
氧化膜的完整性与保护性影响因素
PB ratio : VOX M M VM nA OX
氢鼓泡机理
过饱和的氢原子在缺陷位置析出,形成氢分子,在局部区域造成高H压。氢浓度达到 某个临界值时,可以诱发裂纹。在氢源源不断向裂纹中提供H2的情况下,裂纹或缺 陷中氢压不断增大以至形成“鼓泡”,并促进裂纹进一步扩展。
氢腐蚀机理
在高温高压下,H进入金属,发生合金组分与H的化学反应,生成氢化物等,导致合 金强度下降,发生沿晶界开裂。如脱氧、碳。
2
考试时间和地点
时间:6月23日(星期日)
具体时间待定?
地点:待定?
答
地点:工科D503
疑
时间:6月20日
上午8:30~11:30
下午2:00~5:00
3CLeabharlann ntents (selected)
1 2 3
腐蚀热力学与动力学 腐蚀形态各论-局部腐蚀 高温氧化
4
腐蚀控制
4
1.热、动力学
△G → E0
14
2.局部腐蚀-大阴极小阳极现象
Ig
e IC1 A1 C1 S2 IC2
电偶腐蚀的引申
IA1
局部腐蚀大阴极小 阳极现象普遍性。
力场作用下的应力 集中。
15
局部腐蚀的闭塞电池效应
所谓“闭塞电池”乃是由于在腐蚀体系内金属钝化膜破裂 后形成的蚀坑、隙缝及裂纹等的几何形状或腐蚀产物在其坑 口的覆盖而使腐蚀介质的扩散受到抑制所形成的腐蚀电池。
Pc tan
dEc dIc
I corr
Pc R Pa
Ec Ea Pc Pa R
9
实测极化曲线与理想极化曲线的比较
腐蚀金属电极:共轭反应 起点:腐蚀体系的混合电 位 容易直接测得,外加电流 试验研究中经常采用
E Ec0 Ecorr
理想电极:单电极反应 起点:电极反应的平衡电 位 难以直接测量 腐蚀过程理论分析——腐 蚀极化图
热力学的 不均匀性
电极电位 ——平衡电极电势和非平衡电极电势
计算 ——Nernst方程:
电 化 学 腐 蚀 的 热 力 学
RT a还原态 EE In nF a氧化态
测量:几种常用参比电极
E-pH图 三线、三区、氢线和氧线
主要用途及局限性 (趋势、产物、防护)
5
E-pH图分析推论
金属防护的方法 阴极保护
24
Wagner理论分析
由速度常数可对氧化过程分析如下: 当金属的氧化反应的△ G=0 ,即 K=0时,为平衡态,金属不能 进行氧化,即不会生成氧化膜。当△G为负值时,则K随E的增大而 增加,说明氧化速度有增大的可能性; 当氧化膜的 κ 值愈大,则Kp值愈大,金属的氧化速度愈大;反 之κ 值愈小,Kp值愈小,膜生长速度愈大;若生成的氧化物是绝缘 的,则氧化过程中止。这是耐热合金的理论依据之一,说明通过加 入高电阻(低比电导)的氧化物,,可显著提高合金的耐热性; 当ne=na+nc时,ne(na+nc)的值最大,此时κ也最大。根据氧化膜 中电子或离子迁移倾向的大小,加入适当的合金元素,减少电子或 离子的迁移速度,从而提高合金的抗氧化性。 通常半导体型氧化膜中,电子导电比离子导电高 1000 倍。离子 迁移率是金属氧化的控制步骤。
25
提高合金抗氧化的可能途径
通过选择性氧化生成优异 的保护膜 生成尖晶石结构氧化膜
合金元素与氧亲和力必须大于基体与氧的 合金元素比基体离子半径小,易于表面 扩散形成连续致密的保护膜 在极易产生扩散的温度下加热 尖晶石的熔点要高 蒸气压要低 离子扩散速度小 Hauffe原子价规律
E Ec0
Ecorr
Ea0 icorr i
Ea0 lgic
orr
lgi
10
实测极化曲线与理想极化曲线的关系
没有外加电流极化,金属在酸中自腐蚀 E ia 共轭反应: n+
M M ne
Ec0 Ecorr
ic n nH ne H2 2
电量平衡时:
ia ic icorr,Ecorr
Idt dy S dy IM nF M dt nFS E Ene ( nc na ) kS I R y dy MEkne ( nc na ) 1 dt nF y 2 MEkne ( nc na ) y2 t C k pt C nF
E Ec0 Ecorr E Ec0 Ecorr
Ea0 icorr i
Ea0 lgic
orr
lgi
13
思考题与习题(2)
(1)什么是极化?何谓电化学极化?何谓浓差极化? (2)如何运用腐蚀极化图解释电化学腐蚀? (3)发生析氢腐蚀的必要条件,影响因素和主要控制方法? (4)发生耗氧腐蚀的必要条件,过程特点和影响因素? (5)比较析氢腐蚀和耗氧腐蚀的特点? (6)何谓钝化?钝化的本质是什么?发生自钝化的条件是什么?画出金 属的钝化曲线,说明其含义?讨论影响金属钝化的主要因素? (7)金属Fe在25℃,3%NaCl溶液中腐蚀, 测出其腐蚀电位为0.544V(SCE),试计算电极控制程度。 (8)写出塔菲尔公式,并说明它适用于什么体系和什么范围。 (9)写出线性极化时的极化公式,并说明各参数的含义 (10)何为共轭反应?混合电位?
膜的完整性 PBR应该在1-2之间; 膜的致密性 组织致密,金属与O2-离子扩散系数小,电导率低; 膜的稳定性; 膜与基体的附着性; 薄膜与基体的膨胀系数越接近越好; 薄膜的应力要小,以免造成薄膜的机械损伤。
22
氧化动力学与机理
动力学测量方法
氧化速度的参量表征(金属消耗量、氧的消耗量、生成氧化物的量) 氧化速度测定方法(质量法:连续/不连续称重,热天平;容量法; 压力法)
ia M M n+ ne
N
GM
ic n nH ne H2 2
Ecorr
ic n nH ne H2 2
0 Ea
iC ia ic
i
ic
iA
ia
i
iC( Ec P)= ic( EcM)- ia( EcG)
iA( EaQ)= ia( EaN)- ic( EaF)
减小氧化物的晶格缺陷浓 度,降低离子的扩散速度
增强氧化膜与基体金属的 附着力(稀土元素Y、La、 Ce等)
n型半导体:掺杂高价金属
19
3. 金属高温氧化
高温氧化的可能性与方向性
M O2 MO2 G G 0 RT ln K a MO2 1 K a M ao 2 pO2 G RT ln pO2 pO2 ,e pO2 pO2 ,e pO2 pO2 ,e pO2 ,e pO2 G 0, G 0, G 0, M O2 MO2 M O2 MO2 M O2 MO2
2 判断腐蚀倾向性的热力学方法有哪些?
3 试用标准电位值判断在不含强氧化剂溶液中
Fe 腐蚀时生成 Fe2+ 或 Fe3+ ? Cu 腐蚀时生成 Cu+ 或 Cu2+ ?
4 什么是腐蚀原电池?分类?特点?
5 pH-电位图中直线、点及区域代表何意义,如何用于 判断腐蚀倾向性及腐蚀产物,有何用处和不足之处。
氧化膜生长速率表示方法(△W-y 关系推导)
氧化的动力学规律
直线规律(rectilinear)
抛物线规律 (parabolic)
立方规律 (cubic)
氧化机理介绍
正/反对数规律 (logarithmic) 循环氧化动力学
23
Wagner理论
电化学模型:
Anode :
金属氧化物的高温稳定性
一定温度下,蒸气压越小,氧化物越稳定。易挥发,则无保护作用。 金属和金属氧化物熔点越高越稳定;
多元氧化物避免形成低熔共晶。
20
金属氧化物的结构与性质
金属氧化物结构类型
阳离子导体(Frenkel型缺陷,AgCl )
阴离子导体(反Frenkel型缺陷,PbCl2 ) 混合离子导体(Schottky型缺陷,NaCl )
7
动力学:
极化的概念、类型与腐蚀动力学方程 极化曲线与测量方法 Evans腐蚀极化图与应用
Ec,0 Ecorr A
Ea,0 icorr
实测极化曲线与Evan极化图
B
lg i
8
极化类型、腐蚀电池与等效电路、腐蚀电流
