基础化学第三版习题答案18章
整理基础化学第三版习题答案1-8章

整理人 尼克 基础化学第三版习题答案18章课后习题参考答案第一章复习题参考答案:1、D2、C3、A4、D5、B6、ABCD7、ABCD8、ABCD9、ABCD 10、ACD 11、ABCD 12、BCD 13、ABC第二章复习题参考答案:1、C2、A3、B4、B5、D6、ABC7、ABCD8、ABCD9、AD 10、ABCD第三章复习题参考答案:1、D2、B3、D4、C5、C6、ABCD7、ABCD8、ABC9、AC 10、ACD第四章复习题参考答案:1、C2、B3、B4、D5、D6、C 7、AC8、AB9、ABCD 10、ABCD11、BCD 12、CD第五章复习题参考答案:1、D2、B3、D4、D5、A6、A7、B8、D 9、D 10、D 11、D 12、ABCD 13、ABCD第六章复习题参考答案:1、B2、B3、B4、A5、CB6、B7、DE8、ACDE9、ABCDE 10、ABCDE 11、ABCDE 12、ABCDE 13、ABCE 14、ABCDE 第七章复习题参考答案:1、C2、D3、B4、C5、A6、ABC7、ABCDE8、ABCDE9、BCD 10、ABCDE第八章复习题参考答案:1、C2、C3、A4、A5、C6、ABE7、ABE8、BDE9、ABCE 10、BCDE第九章复习题参考答案:1、A2、B3、B4、C5、B6、B7、B8、A9、C 10、C11、CDE 12、BCD 13、ABDE 14、ACE 15、BCDE整理丨尼克本文档信息来自于网络,如您发现内容不准确或不完善,欢迎您联系我修正;如您发现内容涉嫌侵权,请与我们联系,我们将按照相关法律规定及时处理。
基础化学第三版习题答案1_8章

习题答案第一章绪论1、求 O.OIOkgNaOH 、0.100kg ( 1Ca 2+)、0.10kg (丄 Na z CO s )的物质的2 2量。
解:(1) m(NaOH) = 0.010kg M(NaOH) = 40g mol -1(2)m(1 Ca 2+) = 0.100kg M (丄 Ca 2+) = 40g mol -12 2n (2Ca 2+) = 100= 5.0(mol)2 20(3) m(^Na 2CO 3)= 0.10kg M^Na z CO s ) = 53gmol -12 2n( Na 2CO 3)=100= 1.89 (mol)532、下列数值各有几位有效数字?(1) 1.026 4 位(2) 0.02083 位(3) 0.003 1 位 (4) 23.40 4 位 (5) 3000 无数位 (6) 1.0 X 10-32 位3、应用有效数字计算规则,计算下列各式:第二章溶液与胶体1、在25°C 时,质量分数为0.0947的稀硫酸溶液的密度为1.06gL -1 ,在该温 度下纯水的密度为0.997 g L -1。
计算H 2SO 4的物质的量分数、物质的量浓度和 质量摩尔浓度 解:设取稀硫酸溶液1L ,则n( NaOH)= 亦=0.25 (mol)(1) 21.10 - 0.263 + 2.3 = 23.1 (2) 3.20X 23.45X8.912 = 667(3)3.22 23.17 1.26 103=5.93 X 10-35.4 4.32 10’ 2.325 2.15= 4.6 X 10-2/\ 1.06 X 1000 X 0.0947 , z 八 n (H 2SO 4) = = 1.02 (mol)98 n(H 2O ) == 53.31(mol)18n(H 2SO 4)1C (H 2SO 4)=24= 1.02 (mol |T)b(H 2S°4)=忤= 1000 1.06" -0.0947)= ^^O 12、醚的正常沸点为34.5 C,在40 C 时往100g 乙醚中至少加入多少摩尔不挥发 溶质才能防止乙醚沸腾? 解:△T b = K b ?b B(4。
基础化学第三版习题标准答案-章

基础化学第三版习题答案-章————————————————————————————————作者:————————————————————————————————日期:习 题 答 案第一章 绪论1、求0.010kgNaOH 、0.100kg (21Ca 2+)、0.10kg (21Na 2CO 3)的物质的量。
解:(1)m (NaOH) = 0.010kg M (NaOH) = 40g ·mol -1n (NaOH) =4010= 0.25 (mol) (2)m (21Ca 2+) = 0.100kg M (21Ca 2+) = 40g ·mol -1 n (21Ca 2+) =20100= 5.0(mol) (3)m (21Na 2CO 3) = 0.10kg M (21Na 2CO 3) = 53g ·mol -1 n (Na 2CO 3) =53100= 1.89 (mol) 2、下列数值各有几位有效数字?(1)1.026 4位 (2)0.0208 3位 (3)0.003 1位(4)23.40 4位 (5)3000 无数位 (6)1.0×10-3 2位 3、应用有效数字计算规则,计算下列各式:(1)21.10 - 0.263 + 2.3 = 23.1 (2)3.20×23.45×8.912 = 667(3)31026.117.2322.3⨯⨯= 5.93×10-3(4)=⨯⨯⨯-15.2325.21032.44.52 4.6×10-2 4、(1) 以H 2SO 4为基本单元,M(H 2SO 4)=98g/mol ; (2) 以HSO 4-为基本单元,M(HSO 4-)=97g/mol ; (3) 以3H 2SO 4为基本单元,M(3H 2SO 4)=294g/mol 。
5、答:甲的报告更为合理,百分比小数点后保留两位有效数字。
基础化学第三版习题答案18章

(2) (18.7g·L-1NaC3H5O3)+(生理盐水)
(3) (12.5g·L—1NaHCO3)+(生理盐水)
试通过计算回答上述三种混合液就是等渗、低渗还就是高渗溶液?
解:
(1)
(2)
(3)
上述三种混合溶液得渗透浓度均在等渗溶液浓度范围之内,故都就是等渗溶液、
第三章电解质溶液与离子平衡
课后习题
1。
2。
化学式
HS—
HCO3-
CO32—
ClO-
OH—
H2O
NH3
[Cu(H2O)4]2+
性质
两性
两性
碱性
碱性
碱性
两性
两性
酸性
共轭酸
H2S
H2CO3
HCO3—
HClO
H2O
H3O3—
NH4+
共轭碱
S2-
CO32-
OH—
NH2—
[Cu(H2O)4OH]+
3.
(1) ;
解:
8、欲配制pH=5。00得缓冲溶液500mL,现有6mol·L-1得HAc34.0mL,问需加入NaAc·3H2O(M=136。1g·mol-1)多少克?如何配制?
解:(1)
m =49.38g
(2)加入水得体积
9、临床检验得知甲、乙、丙三人血浆中HCO3—与溶解得CO2浓度分别为:
甲[HCO3-]=24.0m mol·L-1[CO2]溶解=1、2m mol·L—1
n(Ca2+)== 5、0(mol)
(3)m(Na2CO3) = 0。10kgM(Na2CO3)= 53g·mol-1
邢其毅《基础有机化学》(第3版)(下册)笔记和课后习题(含考研真题)详解(18-19章)【圣才出品】

第18章含氮芳香化合物芳香亲核取代反应18.1复习笔记一、芳香硝基化合物硝基与苯环直接相连的化合物称为芳香硝基化合物(aromatic nitro compound)。
1.芳香硝基化合物的结构(1)根据分子中所含硝基的数目,可以分为一元、二元、三元或多元芳香硝基化合物。
一元芳香硝基化合物的通式为Ar-N02,与亚硝酸酯(nitrite)Ar0-N=0互为同分异构体。
(2)硝基的结构是对称的。
在芳香族硝基化合物中,硝基氮、氧上的p轨道与苯环上的p轨道一起形成一个更大的共轭体系。
硝基苯的结构如图l8-1所示。
图18-1硝基苯的结构图2.芳香硝基化合物的物理性质(1)一元芳香硝基化合物都是高沸点的液体,多数是有机化合物的良好溶剂。
(2)最简单的芳香硝基化合物是硝基苯(nitrobenzene),它是淡黄色的油状液体,沸点211℃,具有苦杏仁味,不溶于水,而溶于多种有机溶剂中。
有毒。
(3)常用硝基苯做Friedel—Crafts反应的溶剂。
(4)二元或多元芳香硝基化合物一般为无色或黄色的固体。
3.芳香硝基化合物的重要化学性质(1)还原反应①在催化氢化或较强的化学还原剂的作用下,硝基可以直接被还原为氨基。
②在适当条件下用温和还原剂还原,则生成各种中间的还原产物,如亚硝基苯(nitrosobenzene)和苯基羟胺(phenylhydroxylamine)。
苯甲基羟胺在弱酸性及中性溶液中可以制备得到,但在强酸性还原体系中,由于很活泼,很容易转变成苯胺。
③硝基苯的最终还原产物是苯胺(aniline),苯胺是有机合成的重要中间体。
在酸性或中性条件中,硝基苯主要发生单分子还原反应(unimolecular reduction)。
各产物之间的关系如图18-2所示:图18-2硝基苯单分子还原情况很难用还原的方法制备亚硝基苯,但它可通过苯胺或苯基羟胺的适当氧化来制备。
苯酚等活泼芳香族化合物与亚硝酸作用时可在羟基等活性基团的对位直接引入亚硝基。
2018基础化学课后习题参考答案

一、判断题 4 ×1.氧化数在数值上就是元素的化合价。 ×2.NH4+中,氮原子的氧化数为-3;ClO-中,氯原子的氧化数为+7。 ×3.两根银丝分别插入盛有 0.1 mol·L-1 和 1 mol·L-1 AgNO3 溶液的烧杯中,且用盐桥和导线将 两只烧杯中的溶液连接起来,便可组成一个原电池。 √4.在设计原电池时,EӨ值大的电对应是正极,而EӨ值小的电对应为负极。 √5.原电池中盐桥的作用是盐桥中的电解质中和两个半电池中过剩的电荷。 √6.标准电极电势表中的EӨ值是以标准氢电极作参比电极而测得的标准电极电势值。 √7.电极电势大的氧化态物质氧化能力强,其还原态物质还原能力弱。 一、 判断题 5 1.配合物在水溶液中全部电离成外界离子和配离子,配离子在水溶液中也能全部离解为中心 离子和配位体。() 2.中心离子的配位数等于配合物中配位体的数目。() 3.复盐就是配合物。() 4.配合物转化为沉淀时,难溶电解质的溶解度愈小,则愈易转化。(√) 5.配离子在任何情况下都能转化为另一种配离子。() 6.酸度对配合物稳定性无影响。() 7.任何氧化还原反应都能改变配位平衡移动的方向。() 8.配合物转化为沉淀时,配合物的稳定常数越大愈易转化。() 一、 判断题 6
左手按前面滴定操作方法滴加溶液右手运用腕力摇动锥形瓶使溶液向同一方向作圆周运动边摇边滴滴定时当接近终点时应一滴或半滴地加入并用洗瓶吹入少量水冲洗锥形瓶内壁使附着的溶液全部流下直至终反应题chchchptchchchchchchkmnohcchcl无水alclcoohchclalcl
基础化学课后习题参考答案
,E Sn4 / Sn2
0.154V
ห้องสมุดไป่ตู้,E Fe2 / Fe
0.44V 。
在标准状态下,下列各组物质中能共存的是 C 。
基础化学第三版习题答案章

习 题 答 案第一章 绪论1、求、0.100kg (21Ca 2+)、0.10kg (21Na 2CO 3)的物质的量。
解:(1)m (NaOH) = 0.010kg M (NaOH) = 40g ·mol -1n (NaOH) =4010= (mol) (2)m (21Ca 2+) = M (21Ca 2+) = 40g ·mol -1 n (21Ca 2+) =20100= (mol) (3)m (21Na 2CO 3) = M (21Na 2CO 3) = 53g ·mol -1n (Na 2CO 3) =53100= (mol) 2、下列数值各有几位有效数字(1) 4位 (2) 3位 (3) 1位 (4) 4位 (5)3000 无数位 (6)×10-3 2位 3、应用有效数字计算规则,计算下列各式: (1) - + = (2)×× = 667(3)31026.117.2322.3⨯⨯= ×10-3 (4)=⨯⨯⨯-15.2325.21032.44.52×10-24、(1) 以H 2SO 4为基本单元,M(H 2SO 4)=98g/mol ;(2) 以HSO 4-为基本单元,M(HSO 4-)=97g/mol ; (3) 以3H 2SO 4为基本单元,M(3H 2SO 4)=294g/mol 。
5、答:甲的报告更为合理,百分比小数点后保留两位有效数字。
第二章 溶液与胶体1、在25o C 时,质量分数为的稀硫酸溶液的密度为1.06g ·L -1,在该温度下纯水的密度为0.997 g ·L -1。
计算H 2SO 4的物质的量分数、物质的量浓度和质量摩尔浓度。
解:设取稀硫酸溶液1L ,则n(H 2SO 4) =980947.0100006.1⨯⨯ = (mol)n(H 2O) = 18)0947.01(100006.1-⨯⨯ = (mol)c (H 2SO 4) =Vn )SO H (42 = (mol ·l -1) x(H 2SO 4) =)O H ()SO H ()SO H (24242n n n + =31.5302.102.1+=b(H 2SO 4) =)O H ()SO H (242m n =)0947.01(06.1100002.1-⨯⨯= (mol ·kg -1)2、醚的正常沸点为℃,在40℃时往100g 乙醚中至少加入多少摩尔不挥发溶质才能防止乙醚沸腾 解: B b b •=Δb K T0.12.0234.5)-(40n⨯= n =3、苯的凝固点为5.50℃, K f = K·kg·mol -1。
《基础化学》课后习题参考答案(无机部分)
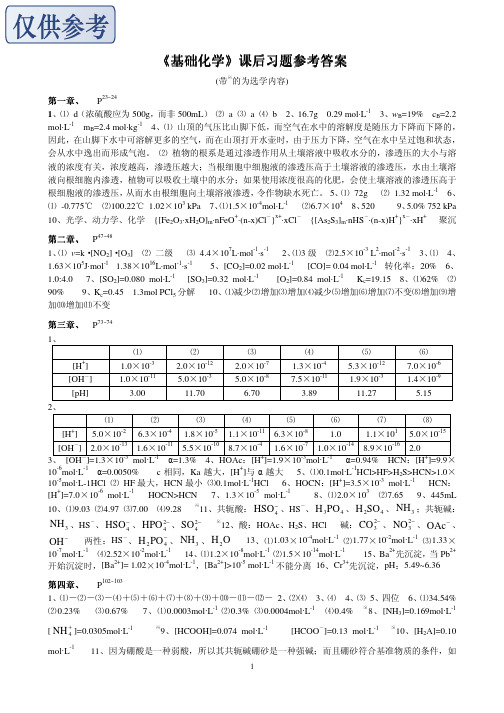
⑵
-2
⑶
-4
⑺ 1.1×10
1
⑻ 5.0×10-15
+
5.0×10
6.3×10
1.8×10
-5
1.1×10
-11
6.3×10
-8
1.0
[OH ] 2.0×10-13 1.6×10-11 5.5×10-10 8.7×10-4 1.6×10-7 1.0×10-14 8.9×10-16 2.0 3、 [OH-]=1.3×10-3 mol·L-1 α=1.3% 4、HOAc:[H+]=1.9×10-3mol·L-1 α=0.94% HCN:[H+]=9.9× -6 -1 + 10 mol·L α=0.0050% c 相同,Ka 越大,[H ]与 α 越大 5、⑴0.1mol·L-1HCl>HF>H2S>HCN>1.0× 10-5mol·L-1HCl ⑵ HF 最大,HCN 最小 ⑶0.1mol·L-1HCl 6、HOCN:[H+]=3.5×10-3 mol·L-1 HCN: + -6 -1 -5 -1 3 [H ]=7.0×10 mol·L HOCN>HCN 7、1.3×10 mol·L 8、⑴2.0×10 ⑵7.65 9、445mL 10、⑴9.03 ⑵4.97 ⑶7.00 ⑷9.28
2
1 ⑷m = 0 2
5、 n ≥ 3 、 l = 0,1 、 l = 0 、 m = 0 、 m s = ±
2
1 2
2s
n 2 2
m 0 0
ms +1/2 -1/2
2p3
※
2 2 2
1 1 1
0 +1 -1
+1/2 +1/2 +1/2
基础化学第三版习题答案章

习 题 答 案第一章 绪论1、求0.010kgNaOH 、0.100kg (21Ca 2+)、0.10kg (21Na 2CO 3)的物质的量。
解:(1)m (NaOH) = 0.010kg M (NaOH) = 40g ·mol -1n (NaOH) =4010= 0.25 (mol) (2)m (21Ca 2+) = 0.100kg M (21Ca 2+) = 40g ·mol -1 n (21Ca 2+) =20100= 5.0(mol) (3)m (21Na 2CO 3) = 0.10kg M (21Na 2CO 3) = 53g ·mol -1 n (Na 2CO 3) =53100= 1.89 (mol) 2、下列数值各有几位有效数字?(1)1.026 4位 (2)0.0208 3位 (3)0.003 1位(4)23.40 4位 (5)3000 无数位 (6)1.0×10-3 2位 3、应用有效数字计算规则,计算下列各式:(1)21.10 - 0.263 + 2.3 = 23.1 (2)3.20×23.45×8.912 = 667(3)31026.117.2322.3⨯⨯= 5.93×10-3(4)=⨯⨯⨯-15.2325.21032.44.52 4.6×10-2 4、(1) 以H 2SO 4为基本单元,M(H 2SO 4)=98g/mol ; (2) 以HSO 4-为基本单元,M(HSO 4-)=97g/mol ; (3) 以3H 2SO 4为基本单元,M(3H 2SO 4)=294g/mol 。
5、答:甲的报告更为合理,百分比小数点后保留两位有效数字。
第二章 溶液与胶体1、在25o C 时,质量分数为0.0947的稀硫酸溶液的密度为1.06g ·L -1,在该温度下纯水的密度为0.997 g ·L -1。
化学基础第三版课后答案

化学基础第三版课后答案【篇一:1现代基础化学(第二版) 课后答案(第三版也可用) 化学工业出版社】44-46 1. e = -b/n2 (b= 2.18? 10-18 j?e = -b/52 + b/22 = 4.58 ? 10-19 j hv = ?e, ?? = c ? = c ? h ? ?e= 434 nm 3.①②不存在;③④存在4.ni 3s2 3p6 3d8 4s2的四个量子数是:3s2: n= 3, l=0, m=0, ms = +1/2; n= 3 , l=0, m=0, ms = -1/23p6: n= 3, l=1, m=-1, ms = +1/2; n= 3, 1=1, m=-1, ms = -1/2; n= 3, 1=1, m=0, ms = +1/2n= 3, 1=1, m=0, ms = -1/2; n= 3, 1=1, m=1, ms = +1/2; n= 3, 1=1, m=1, ms = -1/2 3d8: n= 3, 1=2, m=-2, ms = +1/2; n= 3, 1=2, m=-2, ms = -1/2; n= 3, 1=2, m=-1, ms = +1/2n= 3, 1=2, m=-1, ms = -1/2; n= 3, 1=2, m=0, ms = +1/2; n= 3, 1=2, m=0, ms = -1/2 n= 3, 1=2, m=1, ms = +1/2; n= 3, 1=2, m=2, ms =+1/2 4s2: n= 4, 1=0, m=0, ms = +1/2; n= 4, 1=0, m=0, ms = -1/25.① 3d ②4f ③2s ④3d ⑤1s ⑥3p; 结果:⑤③⑥① = ④②6.①n=4;②l=1;③m=0;④ms=1/2 或-1/2 7.8.① n3;3d ②l = 1;2p ③m= -1 /0/+1; 3p ④ ms = +1/2 或-1/2,4s 9.48cd 4s24p64d105s2. 10.①有三个19k;24cr;29cu②均第四周期, k: s区,,ia族;cr: d区vib族;cu: ds区ib族11.(1) ar: 1s22s22p63s23p6 (2)fe: 1s22s22p63s23p64s23d6 (3) i:1s22s22p63s23p63d104s24p64d105s25p5 ; (4) ag:1s22s22p63s23p63d104s24p64d105s112.①(1)ca: s区, 第四周期,iia族;(2) cl: p区,第三周期,viia; 1(3) ti: d区,第四周期,ivb;(4) hg: ds区, 第六周期, iib族② ca:+2,cl: +7,ti: +4,hg: +2 ③ (1)(3)(4)(2) 13.铁原子3d64s2;26fe14.48;[kr]4d105s2, iib族;48cd15.甲:3s23p5,viia,非金属,电负性高;乙:3d24s2,ivb,金属,电负性低。
基础化学第三版习题解答

述溶液加入一定体积的ωB= 的 H2SO4(相对密度 d = kg·L-1)配制成
1 000 mL 浓度为 mol·L-1 的 H2SO4 溶液?
解:500 mL mol ·L-1H2SO4 中,
n(H2SO4) = c1V1 = 500× = (mmol)
300 mL 0mol ·L-1H2SO4 中,
溶液变稀,乙溶液变浓,直到二者蒸气压相等,两溶液的浓度不再变化。
(3) 设当达到系统蒸气压平衡时,从乙溶液转移到甲溶液的水的质量为 y g,平衡时两
20.0 y)g
18.02g mol-1
18.02g mol-1
(20.0 y)g
1.68g
液的密度为 1.13 kg·L-1,计算此溶液的质量摩尔浓度、物质的量浓度和摩尔分数。
解:
bB
95 / 98 (400 5) 103
2.4(mol
kg -1)
cB
500
95 / 98 10 3 /1.13
2.2(mol L1)
x(H2SO 4 )
(95
95 / 98 / 98 ) (405
1.68g
0.996
18.02g mol-1 342g mol-1
20.0g
18.02g mol-1
xA 20.0g
0.997 2.45g
18.02g mol-1 690g mol-1
乙溶液溶剂的摩尔分数大,所以乙溶液的蒸气压大。
(2) 在同一个恒温密闭的钟罩里,乙溶液的蒸气压大,乙溶液的水会向甲溶液转移,甲
量。
解:两份非电解质的溶液在同一温度下结冰,说明两溶液的质量摩尔浓度相同。设某
非电解质的摩尔质量为 MB g·mol-1,有
基础化学课后习题答案

基础化学课后习题答案在基础化学课后习题中,通常会涉及到化学反应原理、化学计量学、化学键、物质的分类、化学平衡、溶液的浓度计算等方面的问题。
以下是一些基础化学课后习题的典型答案示例:1. 化学反应原理- 题目:解释为什么铁在氧气中燃烧会产生火花?- 答案:铁在氧气中燃烧是一个氧化反应。
当铁与氧气接触时,铁原子失去电子形成Fe²⁺或Fe³⁺离子,而氧气获得电子形成O²⁻离子。
这个过程中释放出大量的能量,表现为火花和热量。
2. 化学计量学- 题目:计算2摩尔的氢气(H₂)与1摩尔的氧气(O₂)反应生成水的摩尔数。
- 答案:根据化学方程式 \(2H_2 + O_2 \rightarrow 2H_2O\),2摩尔的氢气与1摩尔的氧气完全反应生成2摩尔的水。
3. 化学键- 题目:描述离子键和共价键的区别。
- 答案:离子键是由正负离子之间的静电吸引力形成的,通常存在于金属和非金属之间。
共价键则是由两个原子共享电子对形成的,通常存在于非金属元素之间。
4. 物质的分类- 题目:区分纯净物和混合物。
- 答案:纯净物是由单一物质组成的,具有固定的化学组成和性质。
混合物则是由两种或两种以上的物质混合而成,没有固定的化学组成。
5. 化学平衡- 题目:解释勒夏特列原理。
- 答案:勒夏特列原理指出,如果一个处于平衡状态的化学反应系统受到外部条件的改变(如温度、压力或浓度的变化),系统会自动调整以减少这种改变的影响,从而重新达到平衡状态。
6. 溶液的浓度计算- 题目:如果将50毫升的0.1摩尔/升的盐酸溶液稀释到200毫升,计算稀释后的浓度。
- 答案:稀释前后溶质的物质的量不变。
稀释前的盐酸物质的量为\(50 \text{ mL} \times 0.1 \text{ mol/L} = 5 \text{ mmol}\)。
稀释后的浓度为 \(5 \text{ mmol} / 200 \text{ mL} = 0.025\text{ mol/L}\)。
基础化学第三版习题答案1-8章

习题答案第一章绪论1、求0.010kgNaOH、0.100kg (1Ca2+)、0.10kg (1 Na z CO s)的物质的量。
2 2解:(1) m(NaOH) = 0.010kg M(NaOH) = 40g • mol-1n(NaOH) = 10 = 0.25 (mol)(2)m(1Ca2+) = 0.100kg M(1Ca2+) = 40g - mol-12 2n(1Ca2+) = 100 = 5.0(mol) 220(3)m(1 Na2CO3) = 0.10kg M(1 Na a CO s) = 53g - mol-12 2n(Na2CO3) = 100 = 1.89 (mol) 532、下列数值各有几位有效数字?(1) 1.026 4位(2) 0.0208 3位(3) 0.003 1 位(4) 23.40 4 位(5) 3000 无数位(6) 1.0X 10-3 2 位3、应用有效数字计算规则,计算下列各式:(1) 21.10 - 0.263 + 2.3 = 23.1 (2) 3.20X 23.45X 8.912 = 6672 /C、 3.22 23.17 -3 /八 5.4 4.32 10 ,八―八-2(3) --------- 3- = 5.93X 103(4) ---------------- 4.6X 1021.26 1032.325 2.154、(1)以H2SO4为基本单元,M(H2SO,=98g/mol ;(2)以HSO4-为基本单元,M(HSO4-)=97g/mol ;(3)以3H2SO4为基本单元,M(3H2SO,=294g/mol。
5、答:甲的报告更为合理,百分比小数点后保留两位有效数字。
第二章溶液与胶体1、在2SC 时,质量分数为0.0947的稀硫酸溶液的密度为1.06g • L -1,在该温 度下纯水的密度为0.997 g ・L -1。
计算H 2SO 4的物质的量分数、物质的量浓度和 质量摩尔浓度。
2018基础化学课后习题参考答案

B. 加入 2.0 mol·L-1NaOH
C. 加入 0.10 mol·L-1EDTA
D. 降低溶液的 pH 值
11.在沉淀反应中,加入易溶电解质会使沉淀的溶解度增加,该现象称为( B )。
A. 同离子效应 B. 盐效应
C. 酸效应
D. 配位效应
二、选择题 4
1.下列离子中 S 的氧化数最高的是 D 。
D )。
B. C6H12O6> HAc> NaCl > CaCl2 D. CaCl2>HAc> C6H12O6>NaCl
A.溶液的沸点升高
B.溶液的凝固点下降
C.溶液具有渗透压
D.溶液的蒸气压下降
二、选择题 2
1.在一定温度下,可逆反应 A(g) + 3B(g)
2C(g)达到平衡的标志是(C )。
A.A 的分解速率与 B 的分解速率相等 B.单位时间内生成 n molA,同时生成 3n molB
√1.可以通过增加平行试验的次数减小测定过程中的偶然误差。 ×2.NaOH 标准溶液可用直接配制法配制。 ×3.偶然误差是由一些偶然因素的变动引起的,无法减小。 ×4.某测定的精密度越好,则该测定的准确度越好。
×6.在分析数据中,所有的“0”均为有效数字。 √9.试剂误差可通过空白试验减免。 ×10.滴定时,操作者不慎从锥形瓶中溅失少许试液,属于系统误差。 一、 判断题 8 ×1.只要金属离子能与 EDTA 形成配合物,都能用 EDTA 直接滴定。 √3.游离金属指示剂本身的颜色一定要与指示剂-金属离子配合物的颜色有差别。 √ 的七种形式中,只有Y4-能与金属离子直接配位,溶液的酸度越低,Y4-的浓度
二、选择题 1
1.浓度均为 0.1mol∙kg-1 的蔗糖、HAc、NaCl和Na2SO4 水溶液,其中蒸气压最大的是( A )。
基础化学第三版习题答案18章(供参考)

习 题 答 案第一章 绪论一、求0.010kgNaOH 、0.100kg (21Ca 2+)、0.10kg (21Na 2CO 3)的物质的量。
解:(1)m (NaOH) = 0.010kg M (NaOH) = 40g ·mol -1n (NaOH) =4010= 0.25 (mol) (2)m (21Ca 2+) = 0.100kg M (21Ca 2+) = 40g ·mol -1 n (21Ca 2+) =20100= 5.0(mol) (3)m (21Na 2CO 3) = 0.10kg M (21Na 2CO 3) = 53g ·mol -1 n (Na 2CO 3) =53100= 1.89 (mol) 二、以下数值各有几位有效数字?(1)1.026 4位 (2)0.0208 3位 (3)0.003 1位(4)23.40 4位 (5)3000 无数位 (6)1.0×10-3 2位 3、应用有效数字计算规那么,计算以下各式:(1)21.10 - 0.263 + 2.3 = 23.1 (2)3.20×23.45×8.912 = 667(3)31026.117.2322.3⨯⨯= 5.93×10-3 (4)=⨯⨯⨯-15.2325.21032.44.52 4.6×10-2 4、(1) 以H 2SO 4为大体单元,M(H 2SO 4)=98g/mol ; (2) 以HSO 4-为大体单元,M(HSO 4-)=97g/mol ; (3) 以3H 2SO 4为大体单元,M(3H 2SO 4)=294g/mol 。
五、答:甲的报告更为合理,百分比小数点后保留两位有效数字。
第二章 溶液与胶体一、在25o C 时,质量分数为0.0947的稀硫酸溶液的密度为1.06g ·L -1,在该温度下纯水的密度为0.997 g ·L -1。
2018基础化学课后习题参考解答

×3.难溶电解质的 Ksp 越小,其溶解度也越小。 ×4.控制一定的条件,沉淀反应可以达到绝对完全。 ×5.CaCO3 和 PbI2 的溶度积非常接近,皆约为 10-8,故两者的饱和溶液中,Ca2+及 Pb2+离子 的浓度近似相等。
√6.难溶电解质的溶度积和溶解度都是表示其溶解能力的大小。 ×7.向 BaCO3 饱和溶液中加入 Na2CO3 固体,会使 BaCO3 溶解度降低,溶度积减小。 ×8.根据同离子效应,欲使沉淀完全,必须加入过量的沉淀剂,且过量越多,沉淀越完全。 √10.同类型的难溶电解质,Ksp 较大者可以转化为 Ksp 较小者,二者 Ksp 差别越大,转化反 应就越完全。
√1.可以通过增加平行试验的次数减小测定过程中的偶然误差。 ×2.NaOH 标准溶液可用直接配制法配制。 ×3.偶然误差是由一些偶然因素的变动引起的,无法减小。 ×4.某测定的精密度越好,则该测定的准确度越好。
×6.在分析数据中,所有的“0”均为有效数字。 √9.试剂误差可通过空白试验减免。 ×10.滴定时,操作者不慎从锥形瓶中溅失少许试液,属于系统误差。 一、 判断题 8 ×1.只要金属离子能与 EDTA 形成配合物,都能用 EDTA 直接滴定。 √3.游离金属指示剂本身的颜色一定要与指示剂-金属离子配合物的颜色有差别。 √4.EDTA 的七种形式中,只有Y4-能与金属离子直接配位,溶液的酸度越低,Y4-的浓度
二、选择题 1
1.浓度均为 0.1mol∙kg-1 的蔗糖、HAc、NaCl和Na2SO4 水溶液,其中蒸气压最大的是( A )。
A.蔗糖
B.HAc
C. NaCl
D. Na2SO4
2.下列水溶液中凝固点最低的是( D )。
A.0.2mol·L-1C12H22O11
基础化学第三版习题答案章

基础化学第三版习题答案章集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]习 题 答 案第一章 绪论1、求、0.100kg (21Ca 2+)、0.10kg (21Na 2CO 3)的物质的量。
解:(1)m (NaOH) = 0.010kg M (NaOH) = 40g ·mol -1n (NaOH) =4010= (mol) (2)m (21Ca 2+) = M (21Ca 2+) = 40g ·mol -1 n (21Ca 2+) =20100= (mol) (3)m (21Na 2CO 3) = M (21Na 2CO 3) = 53g ·mol -1 n (Na 2CO 3) =53100= (mol) 2、下列数值各有几位有效数字(1) 4位 (2) 3位 (3) 1位 (4) 4位 (5)3000 无数位 (6)×10-3 2位 3、应用有效数字计算规则,计算下列各式: (1) - + = (2)×× = 667(3)31026.117.2322.3⨯⨯= ×10-3(4)=⨯⨯⨯-15.2325.21032.44.52×10-2 4、(1) 以H 2SO 4为基本单元,M(H 2SO 4)=98g/mol ; (2) 以HSO 4-为基本单元,M(HSO 4-)=97g/mol ; (3) 以3H 2SO 4为基本单元,M(3H 2SO 4)=294g/mol 。
5、答:甲的报告更为合理,百分比小数点后保留两位有效数字。
第二章 溶液与胶体1、在25o C 时,质量分数为的稀硫酸溶液的密度为1.06g ·L -1,在该温度下纯水的密度为0.997 g ·L -1。
计算H 2SO 4的物质的量分数、物质的量浓度和质量摩尔浓度。
解:设取稀硫酸溶液1L ,则n(H 2SO 4) = 980947.0100006.1⨯⨯ = (mol)n(H 2O) = 18)0947.01(100006.1-⨯⨯ = (mol)c (H 2SO 4) =Vn )SO H (42 = (mol ·l -1) x(H 2SO 4) = )O H ()SO H ()SO H (24242n n n + =31.5302.102.1+=b(H 2SO 4) =)O H ()SO H (242m n =)0947.01(06.1100002.1-⨯⨯= (mol ·kg -1)2、醚的正常沸点为℃,在40℃时往100g 乙醚中至少加入多少摩尔不挥发溶质才能防止乙醚沸腾 解: B b b •=Δb K T 0.12.0234.5)-(40n⨯= n =3、苯的凝固点为5.50℃, K f = K·kg·mol -1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
习 题 答 案第一章 绪论1、求0.010kgNaOH 、0.100kg (21Ca 2+)、0.10kg (21Na 2CO 3)的物质的量。
解:(1)m (NaOH) = 0.010kg M (NaOH) = 40g ·mol -1n (NaOH) =4010= 0.25 (mol) (2)m (21Ca 2+) = 0.100kg M (21Ca 2+) = 40g ·mol -1 n (21Ca 2+) =20100= 5.0(mol) (3)m (21Na 2CO 3) = 0.10kg M (21Na 2CO 3) = 53g ·mol -1 n (Na 2CO 3) =53100= 1.89 (mol) 2、下列数值各有几位有效数字?(1)1.026 4位 (2)0.0208 3位 (3)0.003 1位(4)23.40 4位 (5)3000 无数位 (6)1.0×10-3 2位 3、应用有效数字计算规则,计算下列各式:(1)21.10 - 0.263 + 2.3 = 23.1 (2)3.20×23.45×8.912 = 667(3)31026.117.2322.3⨯⨯= 5.93×10-3(4)=⨯⨯⨯-15.2325.21032.44.52 4.6×10-2 4、(1) 以H 2SO 4为基本单元,M(H 2SO 4)=98g/mol ; (2) 以HSO 4-为基本单元,M(HSO 4-)=97g/mol ; (3) 以3H 2SO 4为基本单元,M(3H 2SO 4)=294g/mol 。
5、答:甲的报告更为合理,百分比小数点后保留两位有效数字。
第二章 溶液与胶体1、在25o C 时,质量分数为0.0947的稀硫酸溶液的密度为1.06g ·L -1,在该温度下纯水的密度为0.997 g ·L -1。
计算H 2SO 4的物质的量分数、物质的量浓度和质量摩尔浓度。
解:设取稀硫酸溶液1L ,则n(H 2SO 4) =980947.0100006.1⨯⨯ = 1.02 (mol)n(H 2O ) =18)0947.01(100006.1-⨯⨯ = 53.31(mol)c (H 2SO 4) =Vn )SO H (42 = 1.02 (mol ·l -1) x(H 2SO 4) =)O H ()SO H ()SO H (24242n n n + =31.5302.102.1+= 0.0188b(H 2SO 4) =)O H ()SO H (242m n =)0947.01(06.1100002.1-⨯⨯= 0.106(mol ·kg -1)2、醚的正常沸点为34.5℃,在40℃时往100g 乙醚中至少加入多少摩尔不挥发溶质才能防止乙醚沸腾? 解: B b b •=Δb K T n = 0.22mol3、苯的凝固点为5.50℃, K f = 5.12 K·kg·mol -1。
现测得1.00g 单质砷溶于86.0g 苯所得溶液的凝固点为5.30℃,通过计算推算砷在苯中的分子式。
解:g/mol 7.2971086)3.55.5(112.53f A B f B =⨯⨯-⨯=∆•=-T m m K M 4、有两种溶液在同一温度时结冰,已知其中一种溶液为1.5g 尿素[CO(NH 2)2]溶于200g 水中,另一种溶液为4.28g 某未知物溶于100g 水中,求该未知物的摩尔质量(尿素的摩尔质量为60g·mol -1)。
解:由B f f b K T •=∆可得两种溶液的质量摩尔浓度相等。
M=342.4 g ·mol -15、测得泪水的凝固点为 - 0.52℃,求泪水的渗透浓度及在310 K 时的渗透压力。
解:B f f b k T •=∆ 0.52 = 1.86×B b稀水溶液中B B b c ≈ m ol 28.0B =c6、排出下列稀溶液在310 K 时,渗透压力由大到小的顺序(1) c (C 6H 12O 6) = 0.20mol·L -1 (2) c (NaCl) = 0.20mol·L -1 (3) c (Na 2CO 3) = 0.20mol·L -1解:(1) Cos = c (C 6H 12O 6) = 0.20mol·L -1(2) Cos = ic (NaCl) = 2×0.20 = 0.40mol·L -1 (3) Cos = ic (Na 2CO 3) = 3×0.20 = 0.6mol·L -1 渗透压大小:(3)>(2)>(1)7、生理盐水、50g·L -1的葡萄糖(C 6H 12O 6)溶液、12.5g·L -1的碳酸氢钠(NaHCO 3)溶液和18.7g·L -1的乳酸钠(NaC 3H 5O 3)溶液均为临床上常用的等渗溶液。
现取其体积,按下列配方配成三种混合液:(1)21(50g·L -1C 6H 12O 6) +21(生理盐水) (2) 31(18.7g·L -1NaC 3H 5O 3) +32(生理盐水)(3) 31(12.5g·L -1NaHCO 3) +32(生理盐水)试通过计算回答上述三种混合液是等渗、低渗还是高渗溶液? 解:16126L mol 278.018050)O H Cos(C -•==(1) 1-6126L 293mmol 2V c(NaCl)2V )O H C ( Cos •=⨯+⨯=c(2) 1-353L mmol 7.1633V2V c(NaCl)2V )O H NaC (2 Cos •=⨯⨯+⨯⨯=c(3) 1-L mmol 5.3043V2V c(NaCl)2V NaHCO3)(2 Cos •=⨯⨯+⨯⨯=c上述三种混合溶液的渗透浓度均在等渗溶液浓度范围之内,故都是等渗溶液。
8、将1.01g 胰岛素溶于适量水中配制成100ml 溶液,测得298K 时该溶液的渗透压力为4.34kPa ,试问该胰岛素的摩尔质量为多少? 解:RT VM m RT c B BB ==∏ 9、什么是分散系?根据分散相粒子的大小,液体分散系可分为哪几种类型? 答:由一种或几种物质以较小的颗粒分散在另一种物质中所形成的系统,这种系统称为分散系统,简称分散系(dispersed system)。
液体分散系按其分散相直径的大小不同可分为真溶液、胶体分散系和粗分散系三类。
(1-100nm)10、0.05 mol·L -1的KBr 溶液50ml 和0.01 mol·L -1的AgNO 3溶液30ml 混合以制备AgBr 溶胶,试写出此溶胶的胶团结构式,并比较下述电解质溶液AlCl 3、MgSO 4、K 3[Fe(CN)6]对此溶胶的聚沉能力。
解:m ol 105.2050.005.03KBr -⨯=⨯=nKBr 过量,故溶胶是负溶胶。
胶团结构:[(AgBr)m ·nBr -·(n-x)K +]x-·xK + 聚沉能力:AlCl 3>MgSO 4>K 3[Fe(CN)6] 11、什么是凝胶?产生凝胶的条件有哪些?答:大分子溶液(明胶、琼脂等)或某些溶胶(H 2SiO 3溶胶、Al(OH)3溶胶)在适当条件下形成外观均匀并具有一定形状的弹性半固体。
这种半固体称为凝胶。
产生凝胶的条件:①浓度达到一定程度;②温度低到一定程度;③加入少量的电解质。
12、溶胶具有稳定性的原因有哪些?用什么方法可破坏其稳定性。
答:溶胶相对稳定的原因有如下方面:(1)动力学稳定性 (2)胶粒表面水化层的保护作用(3)胶粒的带电。
引起溶胶聚沉的因素很多,例如加入电解质、溶胶的相互作用、加热、溶胶的浓度等。
第三章 电解质溶液与离子平衡课后习题 1. 2.3. (1)1610100.710.0109.4][H ---+⋅⨯=⨯⨯=⋅=L mol c K a ;07.5100.7lg ]H lg[6=⨯-=-=-+pH(2)131014a -10429.110.0109.410][OH ----⋅⨯=⨯⨯=⋅=⋅=L mol c K K c K w b ;15.1110429.1lg 14]OH lg[143=⨯+=+=--pH(3)16514a 10333.3020.0108.110][H ----+⋅⨯=⨯⨯=⋅=⋅=L mol c K K c K b w ;48.510333.3lg ]H lg[6=⨯-=-=-+pH 。
(4)102.010005001717.0-L mol V M m c ⋅=⨯=⋅=;145-100.602.0108.1][OH ---⋅⨯=⨯⨯=⋅=L mol c K b ;78.01100.6lg 14]OH lg[144=⨯+=+=--pH4.]M []MOH []OH [+-=bK ;且:]M []OH [+-=; 所以:c K b =-]OH [; 15226.11142185.01079.1)10(]OH [--+--⋅=⨯==L mol K c b 。
5.]HB []B []H [-+⋅=a K ;1.002.01.01.0)02.005.0(1.0]B []HB [][H ⨯-⨯⨯=⋅=-+a a K K ;25.5=pH ;1625.510623.510]H [---+⋅⨯==L mol ;代入上式:610749.3-⨯=a K6.HB=H ++B - ]HB []B []H [-+⋅=a K ;1551050100501.050100)50100(1.0101]B []HB [][H ----+⋅=+⨯+-⨯⨯⨯=⋅=L mol K a ;HB = H + + B - c(1-α) cα c(α+1)ααα-+=⋅=-+1)1([HB]][B ][H c K a ;代入数据:ααα-+⨯⨯=-1)(311.01025; ααα-+=⨯-1)1(1034; 4103)1(-⨯≈+αα;以为:1<<α所以:4103-⨯≈α。
7.混合后形成NaHCO 3 :NaHCO 3发生水解和电离:21]H [a a K K ⋅=+ ;31.8)25.1037.6(21)(2121=+=+=a a pK pK pH8.-++↔+HS O H O H S H 322;8211010.5]S H []HS []H [--+⨯=⋅=a K ;所以代入数据:81010.50.1]HS [0.3--⨯=⨯;8101.70]HS [--⨯=-+-+↔+232SO H O H HS ;15221020.1]HS []S []H [---+⨯=⋅=a K ;所以代入数据:15-821020.1101.70]S [0.3--⨯=⨯⨯;12321008.6]S [---⋅⨯=L mol 。
