高中化学竞赛辅导—元素及其化合物分析
高中化学竞赛-硼族元素
高中化学奥林匹克竞赛辅导硼族元素一、硼族元素简介硼族元素包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl),在周期表中处于第Ⅲ A族。
硼族元素的价电子构型为n s2n p1,除硼外其余元素均为金属元素,金属性随原子序数的增加而增强。
B的半径较小,失去三个电子非常困难,因此硼不能形成简单阳离子B3+,只能通过共用电子对形成共价化合物。
Al、Ga、In、Tl在水溶液中可以形成M3+。
因为惰性电子对效应,Tl3+具有强氧化性。
在硼族元素形成的共价分子中,中心原子最外层只有6个电子,未达到8电子的外层结构,属于缺电子化合物,它们具有一个空p轨道,可以接受孤对电子形成配位键,是强的路易斯酸。
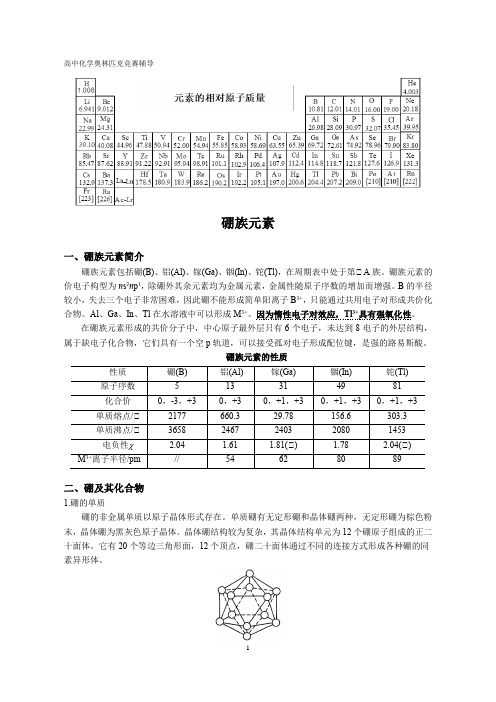
硼族元素的性质二、硼及其化合物1.硼的单质硼的非金属单质以原子晶体形式存在。
单质硼有无定形硼和晶体硼两种,无定形硼为棕色粉末,晶体硼为黑灰色原子晶体。
晶体硼结构较为复杂,其晶体结构单元为12个硼原子组成的正二十面体。
它有20个等边三角形面,12个顶点,硼二十面体通过不同的连接方式形成各种硼的同素异形体。
晶体硼的化学活性较低,无定形硼较活泼。
常温下,硼能与F 2反应,高温下能与N 2、O 2、S 等非金属单质反应。
无定形硼可被热的浓硝酸、浓硫酸氧化成硼酸,也能与强碱作用放出氢气。
2B+N 22BN(与金刚石C 2互为等电子体,是原子晶体) B+3HNO 3(浓)B(OH)3+3NO 2↑2B+2NaOH+2H 2O2NaBO 2+3H 2↑(与Al 的性质相似)2.硼的氧化物及含氧酸硼最重要的氧化物是B 2O 3,熔融B 2O 3能溶解许多金属氧化物,形成具有特征颜色的偏硼酸盐,这个反应用于定性分析,称为硼珠实验:CuO+B 2O 3Cu(BO 2)2(蓝色) NiO+B 2O 3Ni(BO 2)2(绿色) B 2O 3的水化物为硼酸H 3BO 3或B(OH)3。
H 3BO 3是白色的片状晶体,具有片层结构,层和层 之间存在范德华力,容易发生滑动,其中氢键对其结构的形成具有支配的作用。
高中化学的化学元素与化合物总结

高中化学的化学元素与化合物总结在高中化学学习中,化学元素与化合物是重要的基础知识。
化学元素是构成物质的基本单元,而化合物是由不同元素通过化学反应结合而成的物质。
本文将对高中化学的化学元素与化合物进行总结,以帮助学生更好地理解和应用这一知识。
一、化学元素化学元素是由相同类型的原子组成的纯粹物质。
在化学元素周期表中,元素按照原子序数递增的顺序排列,并按照相似性分为不同的族和周期。
每个元素都有独特的原子结构和特性。
1. 元素符号:每个元素都有一个独特的符号,由拉丁文名称的第一个或前几个字母组成。
例如,氢元素的符号是H,氧元素的符号是O。
2. 原子序数和原子量:元素的原子序数是指元素的原子核中所含有的质子的数量,也是元素在周期表中的位置。
原子量是指一个元素的平均原子质量,可以通过许多同位素的相对丰度加权平均得到。
3. 周期表:化学元素周期表是按照元素的原子序数和性质排列的表格。
在周期表中,元素按照原子序数递增的顺序排列,并按照相似性分为不同的族和周期。
二、化合物化合物是由两种或更多种元素通过化学反应形成的物质。
化合物的形成是由于元素之间的化学键形成,如共价键或离子键。
1. 分子式:化合物可以通过分子式来表示。
分子式由元素符号和下标组成,下标表示相应元素原子的数量。
例如,水的分子式是H2O,表示它由两个氢原子和一个氧原子组成。
2. 电离和离子式:某些化合物在溶液中可以电离,形成离子。
离子式用来表示化合物中离子的组成和数量。
例如,氯化钠的离子式是Na+Cl-,表示它在溶液中电离为钠离子和氯离子。
3. 化合物的命名:化合物根据其组成和性质进行命名。
有机化合物通常根据它们的功能基团和碳原子数进行命名,无机化合物通常使用化学元素的名称进行命名。
三、常见化学元素与化合物1. 常见化学元素:常见化学元素包括氢、氧、碳、氮、铁、铜、锌等。
这些元素在自然界和生活中广泛存在,并且在许多化学反应和化合物中起重要作用。
2. 常见化合物:常见化合物包括水、二氧化碳、盐酸、硫酸、葡萄糖等。
2017-2018高中化学竞赛辅导(试题、讲解及答案)--锗锡及其化合物(word版)

3 2 元素化学 20:锗锡及其化合物(时间:2.5 小时 满分:100 分)第一题(4 分)推理一种元素某元素的离子 R 2+有 5 个电子层,最外层有 2 个电子,R(NO )是它的一种常见盐。
R 的元 素符号是 ,R 元素在周期表中的位置是 ,配制澄清 R(NO 3)2 溶液的方法 是。
第二题(8 分)锡同素异形体的晶体结构灰锡为立方面心金刚石型结构,晶胞参数 a =648.8pm 。
1.写出晶胞中八个 Sn 原子的原子分数坐标;2.计算 Sn 的原子半径;3.灰锡的密度为 5.77g/cm 3,求 Sn 的原子量;4.白锡为四方晶系,a =583.1pm ,c =318.2pm ,晶胞中含四个锡原子,请通过计算说明 由白锡变为灰锡,体积是膨胀还是收缩?5.已知白锡中 Sn -Sn 平均键长为 310pm ,判别哪一种晶型中的 Sn -Sn 键强?哪一种 Sn 的配位数高?第三题(18 分)锡与其化合物的性质锡、铅都是组成青铜的重要成分,也是人类较早利用的金属之一。
锡是柔软的银白色金属, 熔点 231 摄氏度。
在自然界很少有游离状态的锡存在,它主要的矿石是分布在花岗岩上层的锡 石(SnO 2);人们在实践中发现,锡也具有良好的延展性,可以展成极薄的薄片,而且在常温 下,锡还不易被氧化,由于这些性能,所以有时锡被用来包裹器具。
埃及、印度人很早就用锡 来镀铜器,在我国,也曾从殷墟出土过数具虎面铜盔,其中有一具很完整,内部的红铜尚好, 外面镀了一层很厚的锡。
镀层精美,至今光耀如新,这说明当时的人们已认识到铜外镀锡,不 仅美观,还可防腐蚀,并且已掌握了镀锡的技术。
1.Sn 和盐酸、硫酸的反应类似与铁,已知锡分别溶于浓盐酸、浓硫酸(加热)和浓硝酸 的反应产物中锡的存在形式各不相同,请写出反应方程式;2.锡石的化学式是SnO2,地质工作者为了确定某矿石是锡石常用的一种方法是:用小刀或小锤取出一小粒矿石,放在锌片上,再往放矿石位置的锌片上滴一两滴稀盐酸,锌片会马上起泡。
高中化学无机化学竞赛辅导课件.ppt
• d区元素的化合物
• 离子极化对ds区元素化合物性质的影响
•
颜色
•
溶解
•
HgF2 HgCl2 HgBr2 HgI2 水解性质
• Hg2+ 与卤素及拟卤离子形成的配合物 HgX42-
• HgNH2X
4) 常见配位化合物及配位数 Cu(I) Cu(NH3)2+ CuCl3- Cu(CN)43Cu(II) 配位数通常为4 CuCl42- Cu(NH3)42+ Cu(CN)42Ag(I) 配位数通常为2 Ag(NH3)2+ Ag(S2O3)23- Ag(CN)2Zn(II) 配位数为4和6 ZnCl42- Zn(NH3)42+ Zn(NH3)62+ Cd(II) 常见配位数为4 Hg(II) 配位数为4 与卤素和类卤离子
• 氢键
•
强弱次序:
F—H ···F > O—H ···O > O—H ···N &g ···Cl > O—H ···S
特点: 是特殊的分子间作用力
具有方向性和饱和性
晶体结构
1. 晶格和点阵、晶胞 晶系:立方 四方 正交 单斜 三斜 三方 六方
2. 金属晶体—堆积 非密置层的堆积:简单立方和体心立方 密堆积:立方密堆—面心立方 六方密堆—六方晶胞 空间利用率及配位数
• 离子晶体 • CsCl 负离子成简单立方堆积,正离子占据立方体间隙。
NaCl 负离子成面心立方堆积,正离子占据八面体体间隙。
ZnS 负离子成面心立方堆积,正离子占据四面体间隙。
• 分子晶体
• 共价晶体
•
金刚石和石墨的结构
• 离子极化 • 离子的极化能力 • 离子的变形性 • 离子极化对键型和晶型的影响
高中化学竞赛辅导 无机化学 15.1硼及其化合物知识点素

第十五章 硼族元素Chapter 15 The Boron Family ElementsBoron (B) Aluminum (Al) Gallium (Ga) Indium (In)Thallium (Tl)Electron configuration :n s 2n p 1§15-1 硼及其化合物 Boron and its Compounds一、General Properties1.硼的化学性质与Si 有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧化态的情况很少。
硼与金属形成非化学计量的化合物(nonstoichiometric compounds ),M 4B 、M 2B 、MB 、M 3B 4、MB 2、MB 6等。
(1) B 2O 3与SiO 2都是固态酸性氧化物,Al 2O 3是两性,CO 2是气态酸性; (2) H 3BO 3与H 4SiO 4都是很好的酸; (3) 多硼酸盐与多硅酸盐结构相似;(4) 硼烷、硅烷可形成多种可燃性气态物质,而AlH 3是固态。
2.在自然界中,硼以硼砂(borax ):Na 2B 4O 7·10H 2O ,四水硼砂(kernite ):Na 2B 4O 7·4H 2O ,天然硼酸 ( sassolite ):H 3BO 3存在。
3.硼在自然界中丰度之所以低,是因为Li He B 734210105+→+n ,所以硼材料可作为核反应堆的减速剂和生物防护。
二、The Simple Substance1.Boron has several allotropic forms. 无定形硼为棕色粉末, The crystals ofboron are black. 高熔沸点(m.p. 2300℃,b.p. 2550℃)单质硼有多种复杂的晶体结构,其中最普通的一种是α - 菱形硼,其基本结构单元为正二十面体的对称几何构型,然后由B 12的这种二十面体的布起来组成六方晶系的α - 菱形硼。
化学竞赛高中知识讲解教案

化学竞赛高中知识讲解教案
主题:化学竞赛高中知识讲解
时间:1小时
目标:通过本次讲解,学生能够掌握化学竞赛高中知识的重要概念和解题方法,提高解题能力。
一、引入(5分钟)
介绍化学竞赛的重要性,以及高中化学知识在竞赛中所起的作用。
激发学生学习的兴趣。
二、知识讲解(30分钟)
1. 元素周期表的结构和特点
2. 化学键的种类和特点
3. 化学反应的类型和特点
4. 配平及配位化学
5. 元素的性质及周期规律
6. 化学平衡及化学反应速率
三、解题方法讲解(15分钟)
1. 理解题意,分析问题
2. 运用化学知识解题
3. 多做练习,提高解题速度和准确率
四、练习环节(5分钟)
提供一些化学竞赛相关的练习题目,让学生动手解题,加深对知识的理解。
五、讨论交流(5分钟)
让学生分享自己的解题方法和经验,交流讨论解题中的难点和疑惑。
六、总结(5分钟)
总结本次讲解的重点内容,强调学生需要多做练习,才能提高解题能力。
鼓励学生在平时多加练习,准备好下次的竞赛挑战。
希望通过本次讲解,学生能够对化学竞赛的知识有一个更清晰的认识,提高解题能力,取得更好的成绩。
祝学生们在化学竞赛中取得优异的成绩!。
元素与化合物解析

元素与化合物解析化学是研究物质的性质、组成及其变化的科学。
而在化学中,元素和化合物是最基本的概念。
本文将深入探讨元素和化合物的概念、性质及其解析方法。
一、元素解析元素是指由同一种原子组成的纯物质。
我们可以通过一系列方法来解析元素。
1.1 原子结构分析元素的解析可以从其原子结构入手。
根据现代原子理论,原子由原子核和绕核运动的电子组成。
通过原子核的质量数和原子核外电子的数目,我们可以确定一个元素的化学性质和位置。
1.2 元素周期表元素周期表是对元素分类排列的一种工具。
根据元素的原子序数(即元素的核电荷数),我们可以了解元素的周期性规律和性质。
从而可以通过元素周期表来解析元素。
1.3 光谱分析光谱分析是一种利用物质对辐射的吸收、发射或散射特性进行分析的方法。
不同元素吸收、发射的光波长是独特的,通过对物质的光谱分析,我们可以解析其中元素的成分。
二、化合物解析化合物是由两个或两个以上的元素以一定的比例结合而成的物质。
解析化合物的方法主要包括以下几种。
2.1 分解分析分解分析是将化合物加热至一定温度,使其分解为原子或离子的方法。
通过观察产物,我们可以得知原始物质的组成。
例如,加热二氧化锰可以分解为氧气和二氧化锰。
2.2 挥发分析挥发分析是利用化合物成分的挥发性差异进行分析的方法。
根据不同成分挥发的特点,可以通过加热或者使用适当的溶剂来实现化合物的挥发分析。
2.3 光谱分析光谱分析同样适用于化合物的解析。
通过对化合物进行光谱分析,我们可以了解其中元素的成分和结构。
典型的光谱分析方法包括红外光谱、紫外-可见光谱和质谱。
三、元素与化合物解析在实际应用中的意义元素与化合物的解析在实际应用中具有重要意义。
3.1 见证法医学应用元素与化合物的解析经常被应用于法医学领域。
通过对尸体组织或血液中元素和化合物的分析,可以揭示出个体的身份、死因以及死亡的环境。
3.2 环境分析元素与化合物解析对环境监测与治理起到了重要作用。
通过对土壤、水源、空气等中的元素和化合物进行准确分析,可以帮助我们了解环境的污染程度和污染源。
高中化学竞赛辅导无机化学15.1硼及其化合物知识点素材

第十五章 硼族元素Chapter 15 The Boron Family ElementsBoron (B) Aluminum (Al) Gallium (Ga) Indium (In)Thallium (Tl)Electron configuration :n s 2n p 1§15-1 硼及其化合物 Boron and its Compounds一、General Properties1.硼的化学性质与Si 有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧化态的情况很少。
硼与金属形成非化学计量的化合物(nonstoichiometric compounds ),M 4B 、M 2B 、MB 、M 3B 4、MB 2、MB 6等。
(1) B 2O 3与SiO 2都是固态酸性氧化物,Al 2O 3是两性,CO 2是气态酸性; (2) H 3BO 3与H 4SiO 4都是很好的酸; (3) 多硼酸盐与多硅酸盐结构相似;(4) 硼烷、硅烷可形成多种可燃性气态物质,而AlH 3是固态。
2.在自然界中,硼以硼砂(borax ):Na 2B 4O 7·10H 2O,四水硼砂(kernite ):Na 2B 4O 7·4H 2O,天然硼酸 ( sassolite ):H 3BO 3存在。
3.硼在自然界中丰度之所以低,是因为Li He B 734210105+→+n ,所以硼材料可作为核反应堆的减速剂和生物防护。
二、The Simple Substance1.Boron has several allotropic forms. 无定形硼为棕色粉末, The crystals ofboron are black. 高熔沸点(m.p. 2300℃,b.p. 2550℃)单质硼有多种复杂的晶体结构,其中最普通的一种是α - 菱形硼,其基本结构单元为正二十面体的对称几何构型,然后由B 12的这种二十面体的布起来组成六方晶系的α - 菱形硼。
高中化学竞赛辅导元素及其化合物

(一)主族元素及其化合物一、氢和稀有气体 (一)氢氢位于周期表的第一周期IA 族,具有最简洁的原子构造。
氢在化学反响中有以下几种成键状况:1、氢原子失去1个电子成为H + 。
但是除了气态的质子外,H + 总是及其它的原子或分子相结合。
2、氢原子得到1个电子形成H -离子,主要存在于氢和IA 、IIA 中(除Be 外)的金属所形成的离子型氢化物的晶体中。
3、氢原子和其它电负性不大的非金属原子通过共用电子对结合,形成共价型氢化物。
此外,及电负性极强的元素相结合的氢原子易及电负性极强的其它原子形成氢键。
(二)稀有气体1、稀有气体的存在、性质和制备(1)存在:稀有气体的价电子构造称为饱和电子层构造,因此稀有气体不易失去电子、不易得到电子,不易形成化学键,以单质形式存在。
(2)物性:稀有气体均为单原子分子,He 是全部单质中沸点最低的气体。
(3)制备:①空气的液化 ②稀有气体的分别 2、稀有气体化合物 (1)氟化物①制备:氙和氟在密闭的镍反响器中加热就可得到氙氟化物F 2 + Xe (过量)→ XeF 2 F 2 + Xe (少量)→ XeF 4 F 2 + Xe (少量)→ XeF 6②性质:(a )强氧化性:氧化实力按XeF 2——XeF 4——XeF 6依次递增。
一般状况被复原为单质。
NaBrO 3 + XeF 2 + H 2O → NaBrO 4 + 2HF + XeXeF2 + H2→ 2HF + Xe XeF2+ 2Cl- → 2F- + Xe + Cl2XeF4+ Pt →2PtF4+ Xe(b)及水反响:氙氟化物及水反响活性不同2XeF2 + 2H2O = 2Xe + 4HF + O2(在碱中快速反响) 6XeF4+ 12H2O = 2XeO3+ 4Xe+ 3O2+ 24HF二、s区元素(一)通性1、它们的价电子构型为ns1~2,内层为稀有气体稳定电子层构造。
价电子很易失去呈+1、+2氧化态。
高中化学竞赛知识点总结

高中化学竞赛知识点总结引言高中化学竞赛是对学生在化学知识和实验技能方面的综合考核。
为了能在竞赛中取得好成绩,掌握一些重要的知识点是非常重要的。
本文将对高中化学竞赛的知识点进行总结,帮助学生更好地备战竞赛。
1. 元素与化合物1.1 元素是构成物质的基本单位,可以根据元素周期表进行分类。
1.2 化合物是由两种或两种以上元素通过化学反应结合而成的物质。
1.3 元素和化合物的命名规则需要熟悉,包括离子化合物和共价化合物。
2. 化学方程式2.1 化学方程式描述了化学反应的物质变化过程。
2.2 化学方程式需要平衡,即反应物和生成物的原子数目要相等。
2.3 反应物的摩尔比可以通过化学方程式推导得到。
3. 化学键与化学键能3.1 化学键是原子之间的相互作用力,常见的化学键有离子键、共价键和金属键。
3.2 化学键能是形成或断裂化学键时释放或吸收的能量。
3.3 化学键的强弱与元素的电负性有关,电负性差异越大,化学键越偏离离子键,电负性差异越小,化学键越接近共价键。
4. 酸碱中和反应4.1 酸是指能够产生H+离子的物质,碱是指能够产生OH-离子的物质。
4.2 酸碱中和反应是指酸和碱反应生成盐和水的化学反应。
4.3 酸碱中和反应的平衡可以通过酸碱指示剂或pH值来判断。
5. 氧化还原反应5.1 氧化还原反应是指物质失去电子的过程称为氧化,物质获得电子的过程称为还原。
5.2 氧化还原反应中的电子转移可以通过半反应方程式来描述。
5.3 氧化剂是指能够接受电子的物质,还原剂是指能够提供电子的物质。
6. 化学平衡6.1 化学平衡是指在封闭系统中,反应物和生成物之间浓度或压力达到一定比例时,反应速率相等的状态。
6.2 平衡常数是描述化学平衡的指标,可以通过反应物和生成物浓度的比值来计算。
6.3 影响化学平衡的因素包括温度、压力和浓度,可以通过Le Chatelier原理来解释。
7. 动力学7.1 化学动力学研究反应速率与反应条件之间的关系。
高中化学竞赛辅导全套课件(绝对精品)(共255张PPT)

9、要学生做的事,教职员躬亲共做;要学生学的知识,教职员躬亲共学;要学生守的规则,教职员躬亲共守。2021/8/302021/8/30Monday, August 30, 2021 10、阅读一切好书如同和过去最杰出的人谈话。2021/8/302021/8/302021/8/308/30/2021 5:58:37 AM 11、只有让学生不把全部时间都用在学习上,而留下许多自由支配的时间,他才能顺利地学习……(这)是教育过程的逻辑。2021/8/302021/8/302021/8/30Aug-2130-Aug-21 12、要记住,你不仅是教课的教师,也是学生的教育者,生活的导师和道德的引路人。2021/8/302021/8/302021/8/30Monday, August 30, 2021
与金属反应
2Fe + 3(SCN) 2= 2Fe(SCN) 3 2Fe + 3Cl2=2FeCl3 与H2反应,但酸性很弱 H2+(CN)2 = 2HCN H2+ Cl2=2HCl
高中化学竞赛辅导无机化学20.2锕系元素知识点素材

§20-2 锕系元素The Actinides我们只介绍铀及其化合物的性质。
铀的重要化合物 UO 2(暗棕色) U 3O 8(墨绿色) UO 3(橙黄色) 一、铀的氧化物 1.UO 3(1) amphoteric oxide UO 3H +UO 2+2U 2O 27OH(2) decomposition 2UO 32UO 2 + O 2(3) preparation 2UO 2(NO 3)22UO 3 + 4NO 2 + O 22.U 3O 8preparation :3U(C 2O 4)2U 3O 8 + 8CO + 4CO 2或者:3U + 4O 2U 3O 8U 3O 8不溶于水,但溶于酸,生成+22UO 。
二、硝酸铀酰[UO 2(NO 3)2]1. Preparation UO 3 + 2HNO 3UO 2(NO 3)2 + H 2O2. Properties 水解生成+++53222222(OH))(UO (OH))UO ( (OH)UO 、、 加碱生成Na 2U 2O 7·6H 2O (黄色),加热脱水,生成无水Na 2U 2O 7,俗称铀黄。
3. Structure UO 2(NO 3)2·2H 2O (六角双锥) 三、UF 6(八面体)1. Preparation UO 3 + 3SF 4300℃UF 6 + 3SOF 2 2. Hydrolysis U F 6 + 2H 2O UO 2F 2 + 4HFSuperconductivityH. Kammerling Onnes (Nobel Prize for Physics, 1913) discoveredsuperconductivity in Leiden in 1911 when he cooled mercury to the temperature of liquid helium; Many other materials, mostly metals and alloys, were subsequently found to display supercond uctivity at very low temperatures.Two properties characterize a superconductor:1. It is perfectly conducting, i.e. it has z ero resistance.2. It is perfectly diamagnetic, i.e. it completely excludes applied magn etic fields. This is the Meissner effect and is the reason why a superconductor can levitate a magnet.Superconductivity exists within the boundaries of three limiting parameters which must not be exceeded :the critical temperat ure (T c), the critical magnetic field (H c) and the critical current density (J c).Until 1986 the highest recorded value of T c was ~23K for Nb 3Ge but in that yearO O O O OO H HH N OH N OUOOFig. 20.1 The structure of UO 2(NO 3)2·2H 2OBednorz and Muller, in pioneering work for which they received the 1987 Nobel Prize for Physics, reported T c=30K in an entirely new Ba-La-Cu-O ceramic system quickly identified as La2-x B a x CuO4.This prompted an examination of other Cu-O systems and the technologically important breakthrough in 1987 by the Houston and Alabama teams of C.W. Chu and M. K. Wu, of superconductivity at temperatures attainable in liquid nitrogen, T c=95K in a material subsequently shown to be YBa2Cu3O7, “YBCO". This , and other materials in which Y is replaced by a lanthanide, are referred to as "1,2,3" materials because of their stoichiometry. This produced a quite unprecedented explosion of activity amongst chemists, physicists and material scientists around the world. Though the highest T c has been pushed up to 135K (or 164 K under 350 kbar pressure) in HgBa2Ca2Cu3O8, YBCO is still the archetypal high temperature superconductor.In spite of its long history, it was not until 1957 that Bardeen, Cooper and Schrie ffer provided a satisfactory explanation of superconductivity.This "BSC: theory" suggests that pairs of electrons (Cooper pairs) move together through. the lattice, the first electron polarizing the lattice in such a way that the second one can more easily follow it. The stronger the interaction of the two electrons the higher T c, but it turns out as a consequence of this model that T c should have an upper limit ~35K. The advent of high-temperature superconductors therefore necessitated a new, or at least modified, explanation for the pairing, mechanism. Various suggestions have been made but non e has yet gained universal acceptance.。
化学竞赛知识点总结ppt

化学竞赛知识点总结ppt一、元素周期表1. 元素周期表的组成元素周期表由周期和族组成,周期表示元素的电子层次,族表示元素的化学性质。
2. 元素周期表的特点元素周期表中元素的周期数代表电子层次,族数代表元素的化学性质。
元素的周期数越大,原子半径越大,电负性越小。
元素的主族号越大,原子半径越大,电负性越小。
二、化学键1. 化学键的类型化学键包括离子键、共价键、金属键和氢键。
2. 化学键的性质离子键是由阳离子和阴离子相互吸引而形成的,共价键是由原子间的电子共享而形成的,金属键是由金属原子内的自由电子形成的,氢键是由氢原子和电负性较大的原子间的相互作用力形成的。
三、化学反应1. 化学反应的类型化学反应包括合成反应、分解反应、置换反应、双替反应、还原反应、氧化反应等。
2. 化学反应的平衡方程式化学反应的平衡方程式是表示反应物和生成物之间物质的量之间的关系的化学式。
四、化学物质1. 化学物质的分类化学物质可分为元素和化合物两类,元素是由同一类原子组成的物质,化合物是由不同种原子组成的物质。
2. 化学物质的性质化学物质的性质包括物理性质和化学性质,物理性质是指物质自身所固有的性质,如颜色、形状、密度等,化学性质是指物质在化学反应中所表现的性质,如与其他物质发生反应等。
五、酸碱中和反应1. 酸碱中和反应的原理酸碱中和反应是指酸和碱在一定条件下反应生成盐和水的化学反应。
2. 酸碱中和反应的应用酸碱中和反应在生活和工业中有广泛的应用,如制备食盐、制造肥料、调节土壤酸碱度等。
六、化学平衡1. 化学平衡的定义化学平衡是指在一定条件下,反应物和生成物浓度达到一定比例的状态。
2. 化学平衡的影响因素温度、压力、浓度和催化剂是影响化学平衡的因素。
七、化学实验1. 化学实验的安全性化学实验是一项需要谨慎对待的活动,实验者需要注意实验设备的安全性、实验操作的谨慎以及实验环境的卫生等。
2. 化学实验的操作技巧化学实验操作需要掌握一定的实验技巧,如搅拌、加热、滴加等操作。
高三化学竞赛知识点

高三化学竞赛知识点化学竞赛是对学生在化学知识掌握和应用能力上的一种考验。
高三化学竞赛知识点主要包括以下内容:元素周期表、离子反应、化学方程式、化学计算、有机化学等。
一、元素周期表元素周期表是化学的基础。
它是由一系列按照原子序数排列的化学元素组成的表格。
元素周期表的每一个水平行叫做一个周期,每一个垂直列叫做一个族。
元素周期表可以通过周期表上的化学符号、原子序数以及元素的性质进行学习和记忆。
掌握元素周期表可以帮助我们更好地理解元素之间的关系和化学反应。
二、离子反应离子反应是指在溶液中形成离子的反应。
在化学竞赛中,我们需要了解离子反应的基本规律和常见的反应类型。
常见的离子反应类型包括:酸碱反应、沉淀反应、氧化还原反应等。
我们需要掌握不同离子之间的配对关系和反应机理,以及如何进行离子方程式的书写和平衡。
三、化学方程式化学方程式是化学反应过程的符号表示。
在高三化学竞赛中,我们需要掌握如何根据反应物和生成物的配比关系来编写化学方程式。
化学方程式的编写需要遵循一定的规则,包括符号、配比以及反应条件等。
我们还需要了解不同类型的反应,如合成反应、分解反应、置换反应等,以便准确地进行方程式的书写。
四、化学计算化学计算是化学竞赛中的重要环节。
在化学计算中,我们需要根据已知条件,运用化学方程式和物质的质量、量、浓度等概念进行计算。
常见的化学计算包括:质量计算、浓度计算、化学反应计算等。
我们需要掌握如何利用化学方程式和化学计量关系来解决实际问题,提高计算的准确性和速度。
五、有机化学有机化学是研究有机物的化学性质和变化的学科。
在化学竞赛中,有机化学常常作为一个重要的考点。
有机化学涉及到有机物的命名、结构、性质和反应等方面的知识。
我们需要了解有机化合物的命名规则和命名方法,掌握它们的结构特点和反应规律。
结语高三化学竞赛知识点的掌握对于学生在竞赛中的表现至关重要。
通过学习和理解元素周期表、离子反应、化学方程式、化学计算和有机化学等内容,我们可以提高化学竞赛的实力,为取得好成绩奠定基础。
2017-2018高中化学竞赛辅导(试题、讲解及答案)--碘和碘的化合物

2.I4O9 也是离子化合物,用离子式表示;
3.I2O5 是最重要的碘的氧化物,用来定量测量 CO 的含量,写出反应方程式。
第二题(12 分)碘的制备与性质 化学发展史上, 有许多偶然事件引起科学发现的事例, 碘的发现也得益于 Courtoris 对意外 现象的注意。碘是人类发现的第二个生物必需微量元素,实验室中可以用淀粉检验碘的存在。 1.单质碘的制备方法之一是在酸性条件下通 Cl2 于 NaI 溶液中,指出运用该法时应注意的 问题?分析其原因,写出有关反应方程式。
元素化学 03:碘和碘的化合物
(时间:2.5 小时 满分:100 分) 第一题(7 分)碘的氧化物 2H2O、 1. (IO)2SO4 且在一定条件下能形成 I(ClO4)3· 已知最简式为 IO2 的物质是逆磁性的。 化合物。 (1)写出该化合物的可能组成式;
(2)写出它和热水反应的方程式;
(3)写出它和 NaOH 溶液反应的方程式;
2.写出 NaClO 与 I 反应离子方程式,判断此时碘元素主要存在的形式。
-
3.在实际操作中,为什么不能加入过量 NaClO 而使 I 完全氧化?
-
4.写出步骤④中交换反应方程式;
5.A 液中所含的离子有哪些;树脂上的离子有哪些?写出所发生反应的离子方程式;
6.B 溶液含有的离子有哪些;树脂上存在的离子有哪些;
+
6.室温下淀粉遇碘会变蓝,这个现象常 常用来鉴别碘或淀粉的存在,对此我们已经非 常熟悉。淀粉分为直链淀粉和支链淀粉,直链 淀粉是淀粉中使碘显蓝色的部分。 直链淀粉并 不是朝一个方向伸展的直线状结构,而是由分 子内的氢键使键卷曲成螺旋状的立体结构。螺 旋中有一定的空腔, 碘分子可钻入空腔, 蓝色就是淀粉的螺旋状空腔与碘分子相互作用产生的。 (右图:直链淀粉形成螺旋状结构,中间黑色代表包裹在螺旋状空腔中的碘分子) (1)向刚煮沸还未冷却的淀粉溶液中滴加数滴稀的 I2-KI 溶液,请猜测有什么现象?淀 粉溶液冷却后,又有什么现象?请分析原因。
关于高中化学竞赛知识点归纳

关于高中化学竞赛知识点归纳化学是自然科学的一种,主要在分子、原子层面,讨论物质的组成、性质、结构与变化规律,制造新物质(实质是自然界中原来不存在的分子)。
为了便利大家学习借鉴,下面我细心预备了高中化学竞赛学问点归纳内容,欢迎使用学习!高中化学竞赛学问点归纳一、硅元素:无机非金属材料中的主角,在地壳中含量26.3%,次于氧。
是一种亲氧元素,以熔点很高的氧化物及硅酸盐形式存在于岩石、沙子和土壤中,占地壳质量90%以上。
位于第3周期,第ⅣA族碳的下方。
Si对比C最外层有4个电子,主要形成四价的化合物。
二、二氧化硅(SiO2)自然存在的二氧化硅称为硅石,包括结晶形和无定形。
石英是常见的结晶形二氧化硅,其中无色透亮的就是水晶,具有彩色环带状或层状的是玛瑙。
二氧化硅晶体为立体网状结构,基本单元是[SiO4],因此有良好的物理和化学性质被广泛应用。
(玛瑙饰物,石英坩埚,光导纤维)物理:熔点高、硬度大、不溶于水、干净的SiO2无色透光性好。
化学:化学稳定性好、除HF外一般不与其他酸反应,可以与强碱(NaOH)反应,是酸性氧化物,在肯定的条件下能与碱性氧化物反应。
SiO2+4HF==SiF4↑+2H2OSiO2+CaO===(高温)CaSiO3SiO2+2NaOH==Na2SiO3+H2O不能用玻璃瓶装HF,装碱性溶液的试剂瓶应用木塞或胶塞。
三、硅酸(H2SiO3)酸性很弱(弱于碳酸)溶解度很小,由于SiO2不溶于水,硅酸应用可溶性硅酸盐和其他酸性比硅酸强的酸反应制得。
Na2SiO3+2HCl==H2SiO3↓+2NaCl硅胶多孔疏松,可作干燥剂,催化剂的载体。
高中化学竞赛必备化学方程式大全1. 氧化性:F2 + H2 === 2HF2F2 +2H2O===4HF+O2Cl2 +2FeCl2 ===2FeCl32Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I2Cl2+SO2 +2H2O===H2SO4 +2HCl2. 还原性S+6HNO3(浓)===H2SO4+6NO2↑+2H2O3S+4 HNO3(稀)===3SO2+4NO↑+2H2O(X2表示F2,Cl2,Br2) PX3+X2===PX5C+CO2===2CO (生成水煤气)(制得粗硅)Si+2NaOH+H2O===Na2SiO3+2H2↑3.(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O金属单质(Na,Mg,Al,Fe)的还原性4Na+O2===2Na2O2Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H2↑Mg+H2SO4===MgSO4+H2↑2Al+6HCl===2AlCl3+3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑2Al+6H2SO4(浓、热)===Al2(SO4)3+3SO2↑+6H2O(Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O2Al+2NaOH+2H2O===2NaAlO2+3 H2↑Fe+2HCl===FeCl2+H2↑Fe+CuCl2===FeCl2+Cu非金属氢化物(HF,HCl,H2O,H2S,NH3)1.还原性:16HCl+2KMnO4==2KCl+2MnCl2+5Cl2↑+8H2O(试验室常用)2H2S+SO2===3S↓+2H2O2NH3+3Cl2===N2+6HCl如何预备化学竞赛1.肯定要仔细对待前五年的真正问题,像正式考试一样,要完成并彻底讨论每一个问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(一)主族元素及其化合物一、氢和稀有气体(一)氢氢位于周期表的第一周期IA族,具有最简单的原子结构。
氢在化学反应中有以下几种成键情况:1、氢原子失去1个电子成为H+。
但是除了气态的质子外,H+总是与其它的原子或分子相结合。
2、氢原子得到1个电子形成H-离子,主要存在于氢和IA、IIA中(除Be外)的金属所形成的离子型氢化物的晶体中。
3、氢原子和其它电负性不大的非金属原子通过共用电子对结合,形成共价型氢化物。
此外,与电负性极强的元素相结合的氢原子易与电负性极强的其它原子形成氢键。
(二)稀有气体1、稀有气体的存在、性质和制备(1)存在:稀有气体的价电子结构称为饱和电子层结构,因此稀有气体不易失去电子、不易得到电子,不易形成化学键,以单质形式存在。
(2)物性:稀有气体均为单原子分子,He是所有单质中沸点最低的气体。
(3)制备:①空气的液化②稀有气体的分离2、稀有气体化合物(1)氟化物①制备:氙和氟在密闭的镍反应器中加热就可得到氙氟化物F2 + Xe(过量)→ XeF2F2 + Xe(少量)→ XeF4F2 + Xe(少量)→ XeF6②性质:(a)强氧化性:氧化能力按XeF2——XeF4——XeF6顺序递增。
二、s区元素(一)通性1、它们的价电子构型为ns1~2,内层为稀有气体稳定电子层结构。
价电子很易失去呈+1、+2氧化态。
都是活泼性很高的金属,只是碱土金属稍次于碱金属而己。
2、有较大的原子半径。
因为每一周期是从碱金属开始建立新的电子层。
原子半径变化的规律:同周期从IA到IIA减小,同族中从上到下增大。
3、电离势和电负性均较小,其变化规律为同周期从IA到IIA增大,同族中从上到下顺序减小。
(二)单质1、存在:由于它们的化学活泼性,决定它们只可能以化合物形式存在于自然界中。
如盐(X-、CO-23、SiO-23、SO-24等);氧化物(Li2O、BeO等)2、性质:(1)物性:单质具有金属光泽,有良好的导电性和延展性,除Be和Mg外,其它均较软。
它们在密度、熔点、沸点和硬度方面往往差别较大。
(2)化性:活泼。
①它们具有很高的化学活泼性,能直接或间接地与电负性较高的非金属元素形成相应的化合物。
如可与卤素、硫、氧、磷、氮和氢等元素相化合。
一般均形成离子化合物(除Li 、Be 及Mg 的卤化物外)。
②单质与水反应放出氢气。
其中Be 和Mg 由于表面形成致密的氧化膜因而对水稳定。
③标准电极电势均很负,是很强的还原剂。
它们的还原性在于态及有机反应中有广泛的应用。
如高温下Na 、Mg 、Ca 能把其它一些金属从氧化物或氯化物中还原出来。
3、制备:单质的制备多数采用电解它们的熔盐。
如电解NaCl 、BeCl 2、MgCl 2等。
注意:不能电解KCl ,因为会产生KO 2和K ,发生爆炸。
其他方法:①金属置换 KCl + Na → NaCl +K↑ (K 比Na 易挥发,离开体系; NaCl 晶格能大于KCl )BeF 2 + Mg → MgF 2 + Be ②热分解:4KCN = 4K + 4C + 2N 2 2MN 32M +3N 2 (M = Na 、K 、Rb 、Cs ) ③热还原K 2CO 3 + 2C 2K ↑+ 3CO 2KF + CaC 2 CaF 2 + 2K ↑+ 2C(三)氧化物和氢氧化物1、碱金属的氧化物比碱土金属的氧化物种类多。
它除有正常氧化物外,还有过氧化物、超氧化物及臭氧化物。
如碱金属在空气中燃烧时,只有Li 的主要产物是Li 2O (正常氧化物),而Na 、K 、Rb 、Cs 的主要产物分别是Na 2O 2(过氧化物)、KO 2(超氧化物)、RbO 2(超氧化物)和Cs 2O 2(过氧化物)。
2、氢氧化物除Be(OH)2呈两性外,其余均为中强碱或强碱。
(四)盐类1、碱金属的盐类:有MX (卤化物)、MNO 3、M 2SO 4、M 2CO 3、M 3PO 4等。
它们的共性如下: ①都是离子晶体(Li 盐除外);②都易溶解。
除Li 盐和极少数大阴离子组成的盐以外,例如LiF 、Li 2CO 3、Li 3PO 4、 Na[Sb(OH)6]、NaZn(UO 2)3(CH 3COO)9·6H 2O 等均难溶。
③热稳定性均很高,但Li 2CO 3和硝酸盐除外,它们加热会分解: ④易形成复盐。
光卤石类通式:M +Cl·MgCl 2·6H 2O (M + = K +,Rb +,Cs +)矾类通式: M 2SO 4·MgSO 4·6H 2O (M + = K +,Rb +,Cs +) 2、碱土金属盐类其溶解度与碱金属盐有些差别。
它们的碳酸盐、磷酸盐和草酸盐均难溶。
BaSO 4、BaCrO 4的溶解度亦很小。
它们的碳酸盐在常温下均较稳定(BeCO 3例外),但加热可分解。
热稳定性由Mg 到Ba 顺序增强。
**对角线规则:某些主族元素与其右下方的主族元素的有些性质是相似的。
Li —Mg ;Be —Al ;B —Si 。
(1)Li 与Mg 的相似性Li 与Na 虽属同一主族,但与Na 的性质相差较远,而它的化学性质更类似于Mg ,如①Li 和Mg 在氧气中燃烧,并不生成过氧化物,都生成氧化物;②Li 和Mg 都能直接与氮气反应生成氮化物Li 3N 和Mg 3N 2;③Li 和Mg 的氢氧化物在加热时,可分解为Li 2O 、MgO 及H 2O ;④Li 和Mg 的碳酸盐均不稳定,加热分解产生相应的氧化物Li 2O 、MgO 及CO 2;⑤Li 和Mg 的某些盐类如碳酸盐、磷酸盐等均难溶于水。
(2)Be 与Al 的相似性:①两者都是活泼金属,在空气中都易形成氧化物保护膜,与酸的作用都比较缓慢,且都能为浓硝酸所钝化;②两者都是两性元素,其金属单质、氧化物和氢氧化物既能溶于酸又能溶于碱。
(3)硼和硅的含氧酸盐都能形成玻璃,且互溶。
硼酸和硅酸都难溶于水。
三、p 区元素 (一)卤族元素 1、通性:(1)外层电子结构ns 2np 5,很容易得到一个电子呈八电子稳定结构,所以卤族元素显强氧化性。
(2)氧化能力 F 2>Cl 2>Br 2>I 2F 2、Cl 2可与所有金属作用,Br 2、I 2可与除贵金属外所有金属作用。
F 2是最强的氧化剂,能与稀有气体反应生成XeF 2、XeF 4、XeOF 4;与水猛烈反应放出O 2。
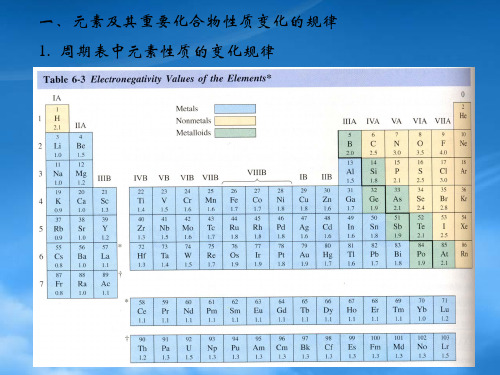
1273~1423K1473K真空**电负性数值的大小衡量元素在化合物里吸引电子的大小。
元素的电负性越大,表示该原子对键合电子的吸引能力越大,生成阴离子的倾向越大。
反之,吸引能力越小,生成阳离子的倾向越大。
电负性大小的标准:分别以氟、锂的电负性为标准。
F: 4.0 Li:1.0①同周期从左至右元素的电负性逐渐增大。
②同一主族中,从上到下,元素的电负性逐渐减小。
(3)化合价:由卤素电子层结构ns2np5决定,除了易获得一个电子显–1价外,氯、溴、碘的原子最外层电子结构中存在空的nd轨道,当这些元素与电负性更大的元素化合时,它们的nd轨道可以参加成键,原来成对的p电子拆开进入nd轨道中,因此这些元素可以表现更高的氧化态+1、+3、+5、+7。
这一类化合物主要是卤素含氧化合物和卤素互化物,主要形成共价键。
氟原子外层电子结构是2s22p5,价电子是在L层上,没有空d轨道,而且F的电负性最大,仅显+1价。
2、卤化氢制备:在实验室里由浓H2SO4与NaCl作用制得少量HCl。
而HBr、HI不能由浓H2SO4与NaBr、NaI作用制得,这是因为浓H2SO4对所生成的HBr及HI有氧化作用,使其中一部分被氧化成单质Br2及I2析出。
H2SO4(浓) + 2HBr = Br2 + SO2 + 2H2OH2SO4(浓) + 8HI = 4I2 + H2S + 4H2O可由H3PO4代替H2SO4制备HBr、HI,避免以上氧化作用。
性质:HF最稳定,高温下不分解,而HI在300℃即大量分解为I2与H2。
HF有强腐蚀性,并能腐蚀玻璃。
SiO2 + 4HF = SiF4 + 2H2O3、卤化物及多卤化物(1)氯化物AgCl、Hg2Cl2、PbCl2,CuCl难溶于水,其它易溶于水。
(2)由于氟的氧化性强,元素在氮化物中可呈高氧化态。
例如一般卤素银盐为AgX,但有AgF2存在。
由于碘离子还原性强,碘化物中元素呈低价氧化态,如FeI2较稳定。
(3)卤化物可和相同或不相同的卤素分子形成多卤化物,最常见的多卤化物是KI3,是由I2溶于KI中形成。
多卤化物所含的卤素可以是一种,也可以是两种或三种,如RbBrCl2、CsBrICl。
只有半径大,电荷少的金属离子适于形成多卤化物。
4、卤素的含氧酸卤素的含氧酸以氯的含氧酸最为重要。
因素含氧酸和含氧酸盐的许多重要性质,如酸性、氧化性、热稳定性、阴离子碱的强度等都随分子中氧原子数的改变而呈规律性的变化。
以氯的含氧酸和含氧酸盐为代表将这些规律总结在表中。
卤素含氧酸及其盐的稳定性与它们的氧化能力有相应的关系。
稳定性较差,氧化能力较强。
反之,稳定性高的氧化能力就弱。
向下增大向上增大卤素互化物1.卤素互化物不同卤素原子之间可通过共用电子对形成物质叫卤素互化物。
在卤素互化物中,原子半径较大、非金属性较弱的卤素(用X表示)显正价;原子半径较小、非金属性较强的卤素(用Y表示)显负价。
由于卤素有+1,+3,+5,+7等多种正价,而负价只有-1价,故卤素互化物通式为(XYn=1,3,5,7)。
如IBr,BrI3,BrF5,IF7等显不同价态的卤素互化物。
2.类卤化合物:由两个或两个以上电负性较大的元素的原子组成的原子团,而这些原子团在自由状态时与卤素单质性质相似,故称拟卤素。
它们的阴离子则与卤素阴离子性质也相似,故称拟卤离子。
目前已经分离出的拟卤素有氰(CN)2、氧氰(OCN)2、硫氰(SCN)和硒氰(SeCN)2。
常见的拟卤离子有氰根离子CN-、氰酸根离子OCN-、异氰酸根离子ONC-、硫氰根离子SCN-、硒氰根离子SeCN-、碲氰根离子TeCN-和叠氮酸根离子N3-等。
但N3-和TeCN-虽也有卤离子相似的性质,但它没有与单质卤素相应的母体。
3.拟卤素、拟卤化物与卤素、卤化物的相似性拟卤素、拟卤化物的性质与卤素、卤化物的性质相似的地方很多,主要有以下几点:(1)游离状态皆有挥发性(聚合体例外)并具有特殊的刺激性气味。
(2)氢化物的水溶液都是氢酸。
(3)形成和卤素形式类似的配离子。
如(4)形成多种互化物。
如CNCl、CN(SCN)、CN(SeCN)、SCN·Ci以及ClN3、BrN3、IN3等都已制得。
(5)许多化学性质相似。
①单质具有氧化性、阴离子具有还原性:拟卤素单质和卤素单质的氧化性以及拟卤离子和卤素离子的还原性的强弱次序如下:氧化性:F2>(OCN)2>Cl2>Br2>(CN)2>(SCN)2>I2>(SeCN)2还原性:F-<OCN-<Cl-<Br-<CN-<SCN-<I-<SeCN-②单质与碱作用:Cl2+2OH-=ClO-+Cl-+H2O (CN)2+2OH-=OCN-+CN-+H2O③单质和不饱和烃起加成反应:④CN-离子的Ag(Ⅰ)、Hg(Ⅰ)、Pb(Ⅱ)盐和氯、溴、碘的一样,都难溶于水。
