化学平衡图像专题
化学平衡图像专题

化学平衡图像题[专题解读]1.图像类型与解题策略(1)速率-时间图像(vt图像)[解题策略]分清正反应、逆反应及二者反应速率的相对大小,分清“突变”和“渐变”;正确判断化学平衡的移动方向;熟记浓度、压强、温度、催化剂等对化学平衡移动的影响规律。
Ⅰ.v′正突变,v′逆渐变,且v′正>v′逆,说明是增大了反应物的浓度,使v′正突变,且平衡正向移动。
Ⅱ.v′正、v′逆都突然减小,且v′正>v′逆,说明平衡正向移动,该反应的正反应可能是放热反应或气体体积增大的反应。
Ⅲ.v′正、v′逆都突然增大,且增大程度相同,说明该化学平衡没有发生移动,可能是使用了催化剂,也可能是对反应前后气体分子数不变的反应压缩体积(即增大压强)。
(2)百分含量(或转化率)-时间-温度(或压强)图像[解题策略]“先拐先平数值大”。
在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高(如图Ⅰ中T2>T1)、压强较大(如图Ⅱ中p2>p1)或使用了催化剂(如图Ⅲ中a使用了催化剂)。
Ⅰ.表示T2>T1,正反应是放热反应,升高温度,平衡逆向移动。
Ⅱ.表示p2>p1,反应物A的转化率减小,说明正反应是气体体积增大的反应,增大压强,平衡逆向移动。
Ⅲ.生成物C的百分含量不变,说明平衡不发生移动,但反应速率a>b,故a使用了催化剂;也可能该反应是反应前后气体体积不变的可逆反应,a增大了压强(压缩体积)。
(3)百分含量(或转化率)-温度(压强)图像[解题策略]“定一议二”。
在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个变量,分析方法是确定其中一个变量,讨论另外两个变量之间的关系。
如图Ⅰ中确定压强为105Pa或107Pa,则生成物C的百分含量随温度T的升高而逐渐减小,说明正反应是放热反应;再确定温度T不变,做横轴的垂线,与压强线出现两个交点,分析生成物C的百分含量随压强p的变化可以发现,增大压强,生成物C的百分含量增大,说明正反应是气体体积减小的反应。
化学平衡图像专题(超详细版)

一、浓度 - 时间图:
例:
c
0.9 0.6 0.3
可用于:
1)写出化学反应方程式:
C A B
t
A+2B 3C A的转化率=33.3% B的转化率=66.7%
2)求反应物的转化率:
200℃ 300℃
pC(g)+qD(g)
正反应吸热 m+n=p+q
P
判断m+n与p+q的关系?正反应是放热 还是吸热?
对于2A(g)+B(g) C(g)+3D(g)(正反应 吸热)有如下图所示的变化,图中Y轴可 能表示:
Y
A. B物质的转化率
B. 正反应的速率
300℃
200℃ C. 平衡体系中的A% 100℃ P D. 平衡体系中的C%
2、该反应正向是:啊
(吸、放)热反应。
啊气体物质的量(增大、减源自)的反应。三、某物质的转化率(或百分含量)时间-温度(或压强)图:
对于反应mA(g)+nB(g)
pC(g)+qD(g)
A
的 转
T1
化 率
T2
t
判断正反应是放热还是吸热?
正反应吸热
三、某物质的转化率(或百分含量)时间-温度(或压强)图:
c
练: 0.4
0.3
B
0.2
A
0.1
C
t
1) 写出化学反应方程式: 5A 3B+2C
2) 求反应物的转化率: A的转化率=62.5%
二、速度-时间图: 可用于:
化学平衡图像专题完整各类型图像

or personal use only in study and research; not for commercial use化学平衡图像专题解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作辅助线(等温线、等压线、平衡线),五看量的变化(如浓度变化、温度变化等),六想规律(外界条件对反应速率的影响规律和化学平衡移动规律)1. 速率-时间图1. 对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是()。
(A)Z,W为气体,X,Y中之一为气体(B)Z,W中之一为气体,X,Y为非气体(C)X,Y,Z皆为气体,W为非气体(D)X,Y为气体,Z,W中之一为气体2. 在一定条件下,反应A(g)+B(g)C(g)(正反应为放热反应)达到平衡后,根据下列图象判断A. B. C. D.E.(1)升温,达到新的平衡的是( )(2)降压,达到新的平衡的是( )(3)减少C的量,移向新平衡的是( )(4)增加A的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)-时间图3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率 D.t1时,N的是M浓度的2倍3. 含量-时间-温度(压强)图4. 可逆反应m A(s)+n B(g ) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()。
(A)达平衡后,加入催化剂则C%增大(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反应:M(g)+N(g )R(g)+2L此反应符合下面图像,下列叙述是正确的是()(A) 正反应吸热,L是气体(B) 正反应吸热,L是固体(C) 正反应放热,L是气体(D) 正反应放热,L是固体或液体6. 可逆反应m A(s) + n B(g) p C(g) + q D(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是()(A)到达平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升高温度,平衡则向逆反应方向移动(C)平衡后,增大A的量,有利于平衡向正反应方向移动(D)化学方程式中一定n>p+q7. 现有可逆反应A(气)+B(气)3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则__ _曲线是表示有催化剂时的情况。
专题6 化学平衡图像

专题 化学平衡图像一、化学平衡图像的类型与解题方法 1、速率—时间图像(v -t 图像)(1)解题方法:分清正反应、逆反应及二者的相对大小,分清“渐变”、“突变”和“平台”;正确判断化学平衡的移动方向;熟记浓度、压强、温度、催化剂等对化学平衡移动的影响规律 (2)常见的三种类型图像 ①“渐变”类v -t 图像图像分析结论t 1时v ′正突然增大,v ′逆逐渐增大;v ′正>v ′逆,平衡向正反应方向移动t 1时其他条件不变,t 1时v ′正突然减小,v ′逆逐渐减小;v ′逆>v ′正,平衡向逆反应方向移动t 1时其他条件不变,t 1时v ′逆突然增大,v ′正逐渐增大;v ′逆>v ′正,平衡向逆反应方向移动t 1时其他条件不变,t 1时v ′逆突然减小,v ′正逐渐减小;v ′正>v ′逆,平衡向正反应方向移动t 1时其他条件不变,②“断点”类v -t 图像:m A(g)+n B(g)p C(g)+q D(g) ΔH =Q kJ·mol -1 图像分析结论t 1时v ′正、v ′逆均突然增大,且v ′正>v ′逆;平衡向正反应方向进行 t 1时其他条件不变,增大反应体系的压强且m +n >p +q (正反应为体积减小的反应) t 1时其他条件不变,升高温度且Q >0(吸热反应)t 1时v ′正、v ′逆均突然增大,且v ′逆>v ′正;平衡向逆反应方向进行 t 1时其他条件不变,增大反应体系的压强且m +n <p +q (正反应为体积增大的反应) t 1时其他条件不变,升高温度且Q <0(放热反应)t 1时v ′正、v ′逆均突然减小,且v ′正>v ′逆;平衡向正反应方向进行 t 1时其他条件不变,减小反应体系的压强且m +n <p +q (正反应为体积增大的反应) t 1时其他条件不变,降低温度且Q <0(放热反应)t1时v′逆、v′正均突然减小,且v′逆>v′正;平衡向逆反应方向进行t1时其他条件不变,减小反应体系的压强且m+n>p+q(正反应为体积减小的反应)t1时其他条件不变,降低温度且Q>0(吸热反应)③“平台”类v-t图像图像分析结论t1时v′正、v′逆均突然增大且v′正=v′逆,平衡不移动t1时刻改变的条件可能是使用了催化剂或增大压强(仅适用于反应前后气体物质的量不变的反应)【对点训练1】1、对于H2(g)+I2(g)2HI(g),ΔH<0,根据下图,下列说法错误的是()A.t2时可能使用了催化剂 B.t 3时可能采取减小反应体系压强的措施C.t5时采取升温的措施 D.反应在t6时刻,HI体积分数最大2、对于反应2SO2(g)+O2(g)2SO3(g)ΔH<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)()3、如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。
化学平衡图像
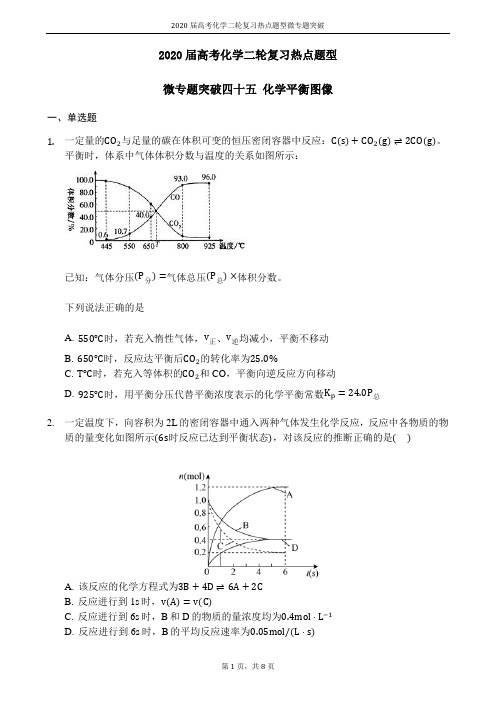
2020届高考化学二轮复习热点题型微专题突破2020届高考化学二轮复习热点题型微专题突破四十五化学平衡图像一、单选题1.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)⇌2CO(g)。
平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确的是A. 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动B. 650℃时,反应达平衡后CO2的转化率为25.0%C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K p=24.0P总2.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是()A. 该反应的化学方程式为3B+4D⇌6A+2CB. 反应进行到1s时,v(A)=v(C)C. 反应进行到6s时,B和D的物质的量浓度均为0.4mol⋅L−1D. 反应进行到6s时,B的平均反应速率为0.05mol/(L⋅s)3.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)()A. B.C. D.4.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A. B.C. D.5.下列叙述与图象对应符合的是()A. 对于达到平衡状态的N2(g)+3H2(g)⇌2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动B. 对于反应2A(g)+B(g)⇌C(g)+D(g)△H<0,p2>p1,T1>T2C. 该图象表示的化学方程式为:2A=B+3CD. 对于反应2X(g)+3Y(g)⇌2Z(g)△H<0,y可以表示Y的百分含量6.在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是()A. 可能是减小了反应物的浓度,反应物X2转化率一定减小B. 可能是加入了催化剂,反应物X2百分含量(X2%)将增大2020届高考化学二轮复习热点题型微专题突破C. 可能是缩小了容器的体积,但该反应的平衡常数保持不变D. 可能是升高了温度,该反应的平衡常数一定减小7.反应:2X (g)+Y(g)⇌2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示,下列判断正确的是()A. P1>P2T1>T2△H<0B. P1>P2T1<T2△H<0C. P1<P2T1>T2△H>0D. P1<P2T1<T2△H>08.在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)⇌xC(g)△H=?,符合图(a)所示的关系,其中w(C)为C的质量分数,由此推断关于图(b)的说法正确的是()A. P3>P4,y轴表示A的转化率B. P3<P4,y轴表示B的体积分数C. P3<P4,y轴表示混合气体的平均相对分子质量D. P3>P4,y轴表示混合气体的密度9.图中表示2NO(g)+O2(g)⇌2NO2(g)△H<0,能正确反映该可逆反应变化的图象是()A. B.C. D.10.某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g)⇌pC(g)的速率和平衡的影响图像如下,下列判断正确的是()A. 由图1可知,T1<T2,该反应正反应为吸热反应B. 由图2可知,该反应m+n<pC. 图3中,表示反应速率v(正)>v(逆)的是点3D. 图4中,若m+n=p,则a曲线一定使用了催化剂11.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH<0下列分析中正确的是()A. 图Ⅱ研究的只是t0时使用催化剂对反应速率的影响B. 图Ⅰ研究的是t0时缩小容器体积对反应速率的影响C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂12.某密闭容器中发生如下反应:2X(g)+Y(g)⇌Z(g);△H<0如图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是()A. t3时降低了压强B. t5时提高了温度C. t1−t2时该反应的平衡常数小于t6时反应的平衡常数D. t6时刻后反应物的转化率最低二、填空题13.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g)△H>0,已知该反应在240℃,平衡常数K=64×10−4.请回答:(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字2020届高考化学二轮复习热点题型微专题突破母序号).14.元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(2)CrO42−和Cr2O72−在溶液中可相互转化。
化学平衡图像专题

B% %
T2P2 T1P2 T1P1
pC(g)+qD(g)
t
•m+n<p+q •正反应吸热 正反应吸热
练习可逆反应mA(s)+nB(g) 可逆反应
pC(g)+qD(g)。反应中, 。反应中, 当其它条件不变时, 的质量分数与温度 的质量分数与温度( ) 当其它条件不变时 , C的质量分数与温度 ( T) 和压强 ( P)的关系如上图 , 根据图中曲线分析 , 判断下列叙 ) 的关系如上图,根据图中曲线分析, 述中正确的是( 述中正确的是( B )
“定一议二” 定一议二” 定一议二
某物质的转化率(或百分含量 或百分含量)-温度 四、某物质的转化率 或百分含量 温度 (或压强 图: 或压强)图 或压强
•对于反应 对于反应mA(g)+nB(g) 对于反应
A 的 转 化 率
pC(g)+qD(g)
A%
500℃ ℃ 200℃ ℃
1.01*107Pa 1.01*106Pa 1.01*105Pa
时间图: 可用于: 二、浓度 - 时间图: 可用于:
例: c
C A B
1)写出化学反应方程式: 写出化学反应方程式: 写出化学反应方程式 A+2B 3C 2)求反应物的转化率: 求反应物的转化率: 求反应物的转化率 A的转化率 的转化率=33.3% 的转化率 t B的转化率 的转化率=66.7% 的转化率 1)写出化学反应方程式: 写出化学反应方程式: 写出化学反应方程式 5A 3B+2C B 2)求反应物的转化率: 求反应物的转化率: 求反应物的转化率
200℃ ℃ 100℃ ℃
化学反应速率与化学平衡——图像专题(共52张)
v
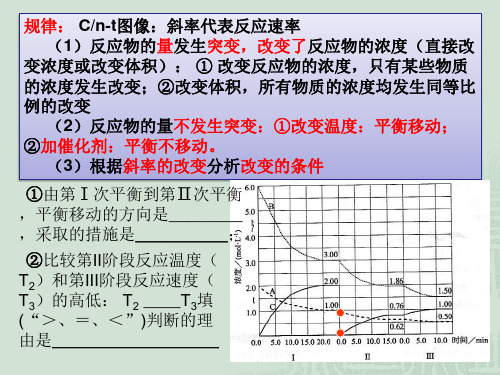
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
人教版化学选修四2.3化学平衡---化学平衡图像专题(16张)ppt

人教版化学选修四2.3化学平衡---化 学平衡 图像专 题(16张 )ppt
人教版化学选修四2.3化学平衡---化 学平衡 图像专 题(16张 )ppt
5、百分含量(转化率)--压强
--温度图
等压(温)线
可逆反应 mA(g) + nB(g) pC(g) +qD(g)
C%
C%
400°C
化学平衡图像专题
一 解题步骤
(1)看懂图象:
①看面(即看清纵坐标与横坐标) ②看线(即线的走向和变化趋势) ③看点(即起点、拐点、交点、终点) ④看量(图像中有关量的多少) ⑤看是否要作辅助线(如一等解温题步线骤、等压线)
(2)联想规律:
①外界条件对化学反应速率和化学平衡的影响 ②“先拐先平数值大” ③ “定一议二”原则
人教版化学选修四2.3化学平衡---化 学平衡 图像专 题(16张 )ppt
C
107 Pa
A
500应(放热、吸热)
m+n > p +q (> = < )
正反应是放热反应
P (放热、吸热)
m+n < p+q ( > = <)
“定一议二” 原则分析线的走向 会做辅助线
人教版化学选修四2.3化学平衡---化 学平衡 图像专 题(16张 )ppt
则a表示使用催化剂 (使用、不使用)
C %
t1 t2
B %
人教版化学选修四2.3化学平衡---化 学平衡 图像专 题(16张 )ppt
T1 T2
t
P1 P2
t
(2)含量 — 时间 — 温度
T1 < T2
正反应是
完整化学平衡移动图像专题

0
A
B
C
E
D
T
NO转化率
3 、图表示反应N2(g)+3H2(g) 2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( ) A t0~t1 B t2~t3 C t3~t4 D t5~t6
AB
练习:
D
下列图象中,不能表示反应A2(g)+3B2(g) 2AB3(g)(△H<0)平衡体系的是…( )
练习:
2、下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。
二、速度-时间图:
v逆
t1
t
v
v正
由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。
t
v
v正
增大
逆
<
•若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的 v – t 图。
t1 t2
t
v
v逆
v正
二、速度-时间图:
v逆
t1 t2
t
v
v正
•对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
2024年高考化学一轮复习一遍过专题27化学平衡图像专练含解析

专题27 化学平衡图像专练1.已知反应:CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)。
在肯定压强下,按向密闭容器中充入氯气与丙烯。
图甲表示平衡时,丙烯的体积分数(ϕ)与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。
则下列说法正确的是A.图甲中11ω>B.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将不变C.温度T1、2ω=, Cl2的转化率约为33.3%D.图乙中,线A表示正反应的平衡常数【答案】C【解析】A.ω增大,CH2=CHCH3的转化率增大,则φ减小,由上述分析可知:ω2>ω1,则ω1<1,故A错误;B.该反应在反应前后气体分子数不变,依据图甲上升温度丙烯的体积分数增大,即上升温度平衡逆向移动,正反应放热,在恒容绝热装置中进行题述反应,体系内温度上升,依据PV=nRT,达到平衡时,装置内的气体压强将增大,故B错误;C.由图乙可知,T1时平衡常数为1,设起始时CH2=CHCH3和Cl2的物质的量分别为amol和2amol,达到平衡时转化的Cl2的物质的量为xmol,依据三段式进行计算:CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)起始(mol) a 2a 0 0转化(mol) x x x x平衡(mol) a-x 2a-x x x则(xV)2÷(a xV-×2a xV-)=1,解得x=2/3a,则Cl2的转化率2/3a÷2a×100%=33.3%,故C正确;D.由图甲可知,ω肯定时,温度上升,φ增大,说明正反应是放热反应,故温度上升,正反应平衡常数减小,故图乙中,线A表示逆反应的平衡常数,故D错误。
2.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A.B.C.D.【答案】A【解析】A.该反应为放热反应,温度上升平衡向逆反应方向移动,C的质量分数减小,故A正确;B.依据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,故B错误;C.催化剂同等程度地变更正逆反应速率,平衡不发生移动,故C错误;D.该反应为放热反应,温度上升平衡向逆反应方向移动,A的转化率降低,依据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误。
整理版----化学平衡图像专题
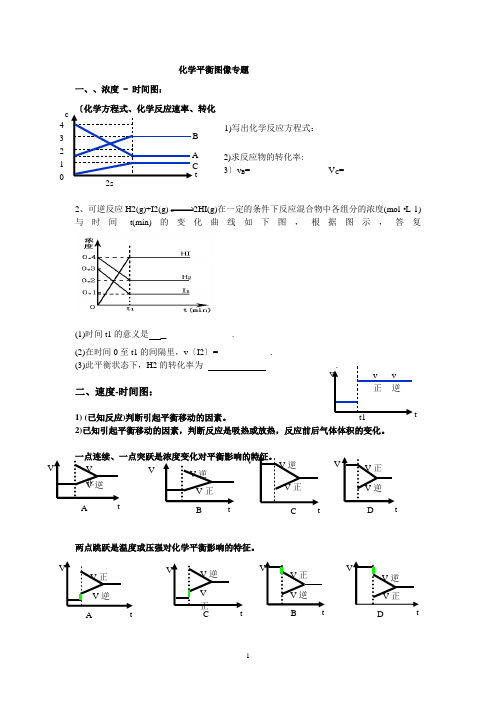
化学平衡图像专题一、、浓度 - 时间图:1)写出化学反应方程式:2)求反应物的转化率:3〕v B = V C =2、可逆反应H2(g)+I2(g)2HI(g)在一定的条件下反应混合物中各组分的浓度(mol ·L-1)与时间t(min)的变化曲线如下图,根据图示,答复(1)时间t1的意义是_ .(2)在时间0至t1的间隔里,v 〔I2〕= .(3)此平衡状态下,H2的转化率为 .二、速度-时间图:1) (已知反应)判断引起平衡移动的因素。
2)已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
一点连续、一点突跃是浓度变化对平衡影响的特征。
两点跳跃是温度或压强对化学平衡影响的特征。
A t 4 3 210A V 正 V 逆 VB V 逆V 正 V CV 正 V 逆 V D V 正 V 逆 V V 正 V 逆 A V V 逆 V 正 V V 正V 逆 CV V 逆V 正 D V v 逆t1 vv正例:右图表示在密闭容器中反应:2SO2+O22SO3+Q 到达平衡时 ,由于条件改变起反应速度和化学平衡的变化情况,ab 过程中改变的条件可能是 _;bc 过程中改变的条件可能是 _; 假设增大压强,反应速度变化情况画在c —d处.在密闭容器,一定条件下进行反应,mA(g)+nB(g)pC(g)+qD(g);假设增大压强或升高温度,重新到达平衡,变化过程均如下图,则对该反应表达正确的选项是〔 A .正反应是吸热反应B .逆反应是吸热反应C .m+n>p+qD .m+n<p+q三、某物质的转化率(或百分含量)-时间-温度/压强)图 解题思路:1、先从拐点向横轴作垂线:先拐先平,温度、压强均高。
2、再从拐点向纵轴作垂线: ①分析温度、压强升高时,转化率或含量的变化 ② 判断平衡移动的方向例:对于反应mA(g)+nB(g) pC(g)+qD(g)P1 P2; m+n p+qT1 T2;正反应 热v 逆t1t2 t v v 正 t A 的转化率 T1T2tT1 T2 t B% T2P2 T1P2T1P11、在密闭容器中进行以下反应:M(g)+ N(g) R(g)+2L此反应符合右图,以下表达正确的选项是( )A.正反应吸热,L是气体B.正反应吸热,L是固体C.正反应放热,L是气体D.正反应放热,L是固体或液体2、反应2X(g)+Y(g)2Z(g)(正反应为放热反应)在不同(T1和T2)温度及不同压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间t的关系如下图。
化学平衡图像专题(超详细版)ppt课件

1
速率与化学平衡中的常见图像类型
(一)速率图像
1、浓度-时间图 2、速率-时间图 3、速率-温度 (或压强)图
(二)常见化学平衡图像
1、某物质的转化率(或百分含量)-时间-温度 (或压强)图 2、某物质的转化率(或百分含量)-- 温度-压强图
2
解化学平衡图像题的技巧
Y
A. B物质的转化率
300℃ B. 正反应的速率
200℃ 100℃
C. 平衡体系中的A%
P D. 平衡体系中的C%
A、D
22
五、其它: 对于反应mA(g)+nB(g) pC(g)+qD(g)
v
v正
v逆
T1
T2
T
判断正反应是放热还是吸热?
正反应吸热
23
五、其它: 对于反应mA(g)+nB(g)
v
对于反应mA(g)+nB(g)
pC(g)+qD(g)
A%
500℃
200℃
正反应放热
m+n<p+q
P
判断m+n与p+q的关系?正反应是放热 还是吸热?
19
对于反应mA(g)+nB(g)
pC(g)+qD(g)
C%
1.01×106Pa 1.01×105Pa 1.01×104Pa
正反应吸热 T m+n>p+q
四、某物质的转化率(或百分含量)-
温度(或压强)图:
对于反应mA(g)+nB(g)
pC(g)+qD(g)
A
的
正反应放热
转 化
化学平衡图像专题ppt课件

为了规范事业单位聘用关系,建立和 完善适 应社会 主义市 场经济 体制的 事业单 位工作 人员聘 用制度 ,保障 用人单 位和职 工的合 法权益
一、速率—时间图像 1.计算平衡浓度
例:在容积固定为2L的密闭容器中,充入X、Y气体各2mol, 发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡, 以Y的浓度改变表示的反应速度与时间t的关系如图所示,
练 习
可逆反应mA(s)+nB(g) pC(g)+qD(g)。反应中,当其 它条件不变时,C的质量分数与温度(T)和压强(P) 的关系如上图,根据图中曲线分析,判断下列叙述中正
确的是( D )
(A)达到平衡后,若使用催化剂,C的质量分数增大 (B)化学方程式中一定有n>p+q (C)平衡后,增大A的量,有利于平衡正向移动 (D)平衡后,若升高温度,则平衡向逆反应方向移动
变式练习
• 下列反应符合下图T-v变化曲线的是
• A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 • B.N2O3(g) NO2(g)+NO(g);ΔH>0 • C.3NO2(g)+H2O(l) 2HNO3(aq)+NO(g);ΔH<0 • D.2CO(g) CO2(g)+C(s);ΔH<0
•正反应放热
T
P1
P
•m+n<p+q
为了规范事业单位聘用关系,建立和 完善适 应社会 主义市 场经济 体制的 事业单 位工作 人员聘 用制度 ,保障 用人单 位和职 工的合 法权益
百分含量(转化率或产率)——压强(温度)平衡图像
mA(s)+nB(g) qC(g);ΔH<0的可逆反应,在一定温 度下的密闭容器中进行,平衡时B的体积分数V(B)%与
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
②.看线(如:线的走向和变化趋势、斜率)
③.看点(如:起点、拐点、交点、终点)
④.做辅助线(如:等温线、等压线、平衡线等)
(3). 想规律: 联想外界条件的改变对化学反应速率和化 学平衡 的影响规律,得出图像中的隐含信息。
练习1:对于2A(g)+B(g) C(g)+3D(g)(正反应 吸热)有如下图所示的变化,图中Y轴可能 表示( AD )
1 放 2 T1 ;
3 不能 4 1
mA(s)+nB(g) qC(g);ΔH<0的可逆反应,在一定温 度下的密闭容器中进行,平衡时B的体积分数V(B)%与 压强(P)关系如下图所示,下列叙述正确的是( B、C )
A、m+n<q B、n>q C、X点时的状态,V正>V逆 D、X点比Y点混和物的正 反应速率慢
2NO(g)+O2 (g)
2NO2 (g) ΔH=Q (Q<0)
图中的曲线是表示其他条件一 定时,反应中NO的转化率与温度 的关系曲线,图中标有a、b、c、 d四点,其中表示未达到平衡状态, 且v(正)>v(逆)的是( C ) A. a点 B. b点 C. c点 D. d点
看图技巧:图像上的点为平衡点
解化学平衡图像题的技巧
(1).审题意:紧扣可逆反应的特征,搞清反应的吸、放 热情况,体积的变化,有无固体、纯液体物质参加 或生成等。 (2).看图象: ①.看面(如:纵坐标与横坐标的意义)
时间
B.
AB3%
100℃ 500℃
1×106Pa 时间 C.
压强
D.
练习3:
在密闭容器中进行下列反应:
M(g)+N(g) R(g)+2L(?),在不同条件下R的百 分含量R%的变化情况如下图,下列叙述正确的是( C ) A、正反应吸热,L是气体 B、正反应吸热,L是固体
C、正反应放热,L是气体
D、正反应放热,L是固体或液体
A.H2(g)+I2(g)
B.3NO2(g)+H2O(l) C.4NH3(g)+5O2(g)
2HI(g)
2HNO3(l)+NO(g) 4NO(g)+6H2O(g)
D.CO2(g)+C(s)
2CO(g)
V
看图技巧: 找平衡点(V正=V逆)
V(正) 平衡点 V(逆)
P
五、百分含量(转化率或产率)——压强(温度)平衡图像
(A)达到平衡后,若使用催化剂,C的质量分数增大 (B)化学方程式中一定有n>p+q (C)平衡后,增大A的量,有利于平衡正向移动 (D)平衡后,若升高温度,则平衡向逆反应方向移动
三.百分含量(转化率或产率)—压强—温度曲线
m A(g)+nB(g)
A 转
pC(g)+qD(g) ΔH=Q
ΔH< 0 m+n > p+q
相等物质的量的X气体和Y气体混合后,一定条件下发生 反应:Xg+Yg nZg。保持压强不变,经时间t, Z气体在反应混合物中的体积分数与温度T的关系如图Ⅰ所示。 1 此反应的正反应方向是填吸热或放热 反应。 2 此反应在时间t内达化学平衡时的温度是( ) 若保持T1不变此时间为t1,请在图Ⅱ上描绘出Z%与时间t 的关系曲线。 3 其他条件不变,在T<T1的某一温度时,该反应能否建立 平衡填能或不能 4 若在T2时增大压强,达新平衡时Z%将增大,则化学方程式 中n的取值为 。
t1
t2
t3
t
练习:某密闭容器中发生如下反应:X(g)+3Y(g)
2Z(g)(正反应放热)
v(逆) v v(正) v(逆) v(正) v( 逆) t1 v(正)
上图表示该反应的速率(v)随时间(t)变化的关系, t2、t3、t5时刻外界条件有所改变,但都没有改变各物 质的初始加入量。下列说法中正确的是 ( A ) A.t2时加入了催化剂 B.t3时降低了温度 C.t5时增大了压强 D.t4~t5时间内转化率最低
向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的B三种 气体.一定条件下发生反应,各物质浓度随时间变化如下图中甲图 所示[t0时c( B)未画出,t1时增大到0.05mol/L].乙图为 t2时刻 后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况.
(1)若t4时改变的条 件为减小压强,则B的 起始物质的量浓度 为( 0.02 )mol/L; c(B)c2(C) (2)若t5时改变的条 c3(A) 件是升温,此时 v(正)>v(逆),平衡常数K的值将( 增大 )选填“增大”、“减 小”或“变”). (3)若 t1=15s,则t0~t1阶段以C 浓度变化表示的平均反应速率 0.004)mol/L•s.t3 时改变的某一反应条件可能是( a b 为v(C)=( )(选填序号).a.使用催化剂 b.增大压强 c.增大反应物 浓度 d.降低产物浓度 (4)若A的物质的量减少0.02mol,容器与外界的热交换总量为 a kJ,写出反应热化学方程式(3A(g)⇌B(g)+2C(g)△H=+150akJ•mol-1
mA(g)+nB(g) A%
问题:
pC(g)+qD(g)
1、P1与P2的相对大小
2、 m+n 与 p+q 的大小
P2 P1 0 t1
答 案
P1 > P2 m+n > p+q
t2
时间
练 习
可逆反应mA(s)+nB(g) pC(g)+qD(g)。反应中,当其 它条件不变时,C的质量分数与温度(T)和压强(P) 的关系如上图,根据图中曲线分析,判断下列叙述中正 确的是( D)
化学平衡图像
盖州一高中范广新
一.速率和时间图像
例:根据下图回答下列问题: ⑴确定t1、t2、t3时刻的操作: A、浓度减小 B、加压 C、降温
⑵该反应正向是 放 (吸、放)热反应;
⑶气体物质的量 增大 (增大、减少)的反应。
V(逆) V(正) V(逆) V(正) V(正) V(逆)
V(正) V(逆)
1.01107Pa 1.01106Pa 1.01105Pa
化
率
0
T
看图技巧:图象中有三 温度 个量时,“定一议二”
mA(g)+nB(g)
A 转 化 率
pC(g)+qD(g) ΔH=Q
300C 200C 100C
m+n > p+q
ΔH > 0
0
P
压强
四. 由速率-压强(温度)图像
下列反应符合下图P-v变化曲线的是
t2
t3
t4
t5
t6
t
二、转化率(或产率、百分含量等)-时间图象
MA(g)+nB(g) C%
答 问 案 题
pC(g)+qD(g) ΔH=Q
1、 与 T2的高低 1T1 、 T1>T2 2、是放热反应还是吸热反应 2、放热反应
T2C T1C 看图技巧:
先拐先平数值大
0
t1
t2 时间
百分含量——时间图像
A.B物质的转化率 B.正反应的速率 C.平衡体系中的A% D.平衡体系中的C%
Y
300℃ 200℃ 100℃
P
练习2:
对于可逆反应 2AB3(g) A2(g) + 3B2(g) (正 反应吸热),下列图像正确的是( BD )
υ υ逆 υ正 AB3%
100℃ 500℃
温度
AB3% A. 1×105Pa
