煤热失重动力学的研究
福城煤的热解动力学研究

第 1期
薛 新 巧等 :福城 煤 的热 解动力 学 研究
81
2 结果与讨论
考察 不 同升 温速率对煤 热 解 的影 响 (图 1).由 图 1可 知 ,福 城 煤 (FC-Coa1)热 解 可 分 为 3个 阶 段 :第 一 阶段在 200℃ 以下 ,主要 是物 理 吸 附 H 0 及 气 体 的 脱附 ;第 二 阶 段 为 300~ 600 ℃,是 煤 的 主 要 热 解 阶 段 ,指煤 中有 机 质 的热 裂 解 过程 ;第 三 阶 段 为 620~ 720℃ ,主要归 属 于 煤 中矿物 质 的分 解 过程 .在 该 实 验 的升温速率 范 围内 , 对 煤 的质 量损 失 劬 没 有 显著影 响 ,850℃时 的 Aw 在 31%左 右 ;但 最 大 对 应温度受 的 影 响显 著 (图 lb).通 常 认 为 ,较 高 的 妒 会导致样 品 的传 热滞 后 ,使 样 品 颗粒 内外 温差 变 大 , 挥发分 释放速 度 降低 ,整个 曲线 向 高温 区移 动 ,而 且 在相 同温度下 ,较 高 对应样 品 的 Aw 明显 低 于较 低
燃料 外 ,还是用 于合成 其 他化 合 物 的原料 .煤 热解 动 为 ,并 用 Coats-Redfern法 进 行 热 解 动 力 学 特 性 研 究 ,
力学 常被广泛用 于煤 的热解特性 及反 应机理 研究 ,而 探讨 不同升温速率 对福城煤热解动 力学 的影 响.
且 热解动力学 研究 所获 得 参数 可 以为煤 的热 加 工利 用 提供参考l】j.热分 析法常用来研 究煤 的热解 特性和 反应动力学 ,其 中热重 法是 最常 用 的技 术之 一.煤热
气化 或者燃烧 ;焦油 除作 为液 体燃 料外 ,还 富含 BTX 大 时 指 前 因 子 也 增 大 ,二 者 呈 现 出 良 好 的 线 性 关 系 ,
煤自燃热失重特征规律及关键官能团研究

煤自燃热失重特征规律及关键官能团研究
李亚清;欧霖峰;李星;孙鑫鑫
【期刊名称】《中国安全生产科学技术》
【年(卷),期】2024(20)2
【摘要】为了研究煤自燃过程中对失重起重要作用的关键官能团,以3种不同变质程度煤样为研究对象,根据TG热重实验和傅里叶变换红外实验,研究煤自燃热失重过程的特征温度和官能团变化规律,基于频率比模型法和灰色关联度分析煤自燃失重量与官能团间的相关性,并探讨不同变质程度煤自燃热失重过程的关键官能团。
研究结果表明:随煤变质程度加深,热失重曲线后移,从褐煤到无烟煤,热失重特征温度分别增加22%,37%;随温度增加,官能团含量突变温度点与特征温度相近,羟基在150℃之前呈指数式下降后趋于稳定,脂肪烃、含氧官能团和芳香烃在燃点温度之后线性下降;影响不同变质程度煤自燃热失重的关键官能团不一致,C C是影响褐煤的热失重关键官能团,而甲基是影响烟煤、无烟煤的热失重关键官能团。
研究结果可为煤自燃热失重过程关键官能团的确定提供重要参考。
【总页数】7页(P118-124)
【作者】李亚清;欧霖峰;李星;孙鑫鑫
【作者单位】西安科技大学安全科学与工程学院;西安科技大学陕西煤炭火灾防治重点实验室
【正文语种】中文
【中图分类】X936
【相关文献】
1.粒度对煤自燃氧化性能影响规律的热重实验研究
2.煤的热解研究III.煤中官能团与热解生成物
3.二次氧化煤自燃过程关键官能团的转变规律
4.用XPS研究新西兰高硫煤热解过程中氮、硫官能团的转变规律
因版权原因,仅展示原文概要,查看原文内容请购买。
神华煤热解特性与非等温动力学研究

影 响。试验 采用 3 不同升温速率 ( , 1  ̄ m n 种 ) 即 0C/ i 、
2 ℃/ i 0 m n和 3 ℃/ i , 解 终 温 为 7 0 。 0 mn 热 5℃
大学 , 高级实 验师 , 从事 煤洁净 利用研 究 。
一
2一 8
煤 化 工
21 00年第 2 期
2 结果 与 讨 论
深 度 的增 加 而 降 低 。
关键词 神 华煤
热分解
非等温 动力学
文章编 号 :0 5 9 9 2 1 ) 0 — 07 0 中图分类 号 :O 3 文献标 识码 : 10 — 5 8(0 0 一 20 2 — 5 T50 A
煤 的热 解对煤 的气化 、 液化和焦 化有着 重要 的影 响。深入 了解这一 过程 , 有助于增进 对煤利 用方式 将 的理解, 尤其 是对低 阶煤资 源的有效 利用有着 重要 的 现实意义 [ 1 ] 。神华煤是一种煤化度相对较低 的长烟煤 , 具有较 高的反应活性 。 该煤 种低硫 、 灰 , 低 是我 国煤直 接 液化工业示范装 置的首选煤种 , 因而有 关神华 煤 的 液 化性能 已经 开展 了持 续而 广泛 的研究 [ ] 2 。煤 的直 - 4 接液化 即为煤的热解 和加 氢过程 。 液化转化率 和液 煤 化油 收率 主要取 决 于煤大 分子 结构 的适 度裂解 和 裂 解产物 ( 自由基 ) 的及 时加氢 , 因而研究煤 的热解过程
注 : 含量 由差减法得 到 。 氧
由结构相 似但 又不 完全 相 同的结 构单 元通 过桥 键联
结而成 。因此 , 于煤 热解机理 的研究 不能应用 纯物 对
12 热 重 分 析 .
神华 煤 的热 重 试验 采用 S IA Z G 6 差 热 分 H M DUT 一 0 析 仪 , 品质 量约 1m , 重分 析采用 的载气 是 流量 样 0g热 为 5m/i 0 Lm n的高纯氮气 ,主要 用来保 持炉 内 的惰 性 反应气 氛 , 同时及时将煤 热解产生 的挥发性 产物带 离
非定温热分析法在煤粉燃烧动力学研究中的应用

w hc l si l n r a es at h d of e ct ih wil lghty i c e s t e en r a i on; I i p i e o t at h l e ie o c m b to mec a s t s o ntd ut h t e pu v rz d c al o usi n h nim s o d e h ul b
a alz d t r ug ot he snge s a n y e h o h b h t i l c nni a e m e ho nd m uli l c nni a e ng r t t da tp e s a ng r t s met o h d.
Ke r s:pu v rz d c l ctv i n e er y wo d l e ie oa :a iato n gy;c m b to h r cers is; t r la a y i o us in c a a t itc he ma n l ss
热 重 分 析 (h r oga i tca a s ,T A) tem -rv mer nl i i ys G
o yp c h m a a y i e ho ft ialt er lan l ss m t d, s h a a s Re f r uc s Co t — d e n met od wih snge s an ng r e, FW O h t i l c ni at met o t u tpl s a h d wih m li e c nni ng r esa t rnk et d. Th p i at nd s a i m ho e ex erment r s t s w h t t e c al e uls ho t a h om b s i c i a i u ton a tv ton, e r y o a pes d r a e wih t ne g f s m l ec e s s t he
煤的热失重曲线

煤的热失重曲线分析煤,作为地球上最丰富的化石燃料之一,其热性能的研究对于能源利用、环境保护等具有重要意义。
其中,煤的热失重曲线是一种重要的研究手段,它能够反映煤在受热过程中的质量变化情况,从而揭示煤的热稳定性、燃烧特性以及气体生成特性等重要信息。
一、热失重曲线的基本概念热失重曲线,又称为TG曲线,是指样品在恒定升温条件下,随着温度的升高,样品的质量随时间或温度的变化关系曲线。
在煤的热解过程中,由于挥发分的逸出和有机质的分解,煤的质量会逐渐减少,这种质量的变化可以通过热失重曲线来表征。
二、煤的热失重曲线分析煤的热失重曲线通常可以分为几个阶段:预热阶段、挥发分析出阶段、半焦氧化阶段和矿物质分解阶段。
1. 预热阶段:在这个阶段,煤的温度较低,主要发生的是物理吸附和脱附作用,对煤的质量影响不大,因此TG曲线基本保持平直。
2. 挥发分析出阶段:当温度升高到一定程度时,煤中的挥发分会开始析出,导致煤的质量显著减少,TG曲线出现明显的下降趋势。
这个阶段的TG曲线斜率可以反映出煤的挥发分含量和热稳定性。
3. 半焦氧化阶段:随着温度的进一步升高,煤中的有机质开始分解,形成半焦。
在这个阶段,虽然煤的质量仍在减少,但由于半焦的生成,TG曲线的下降趋势会减缓。
4. 矿物质分解阶段:在更高的温度下,煤中的矿物质也会开始分解,释放出一些无机物,如二氧化硅、氧化铝等,这些无机物的质量损失会在TG曲线上表现为一个小的峰值。
三、煤的热失重曲线的应用煤的热失重曲线不仅可以用来研究煤的热解行为,还可以用于预测煤的燃烧性能、气化性能以及环保性能等。
例如,通过分析煤的热失重曲线,我们可以预测煤在燃烧过程中的热量释放情况,这对于锅炉的设计和运行具有重要的指导意义。
此外,煤的热失重曲线还可以提供关于煤中矿物质含量的信息,这对于评估煤的环保性能,如硫排放量、灰熔点等也是非常有用的。
四、总结总的来说,煤的热失重曲线是研究煤的热性能的重要工具,它可以为我们提供大量的有价值的信息。
煤热解特性及热解反应动力学研究

图1 不同粒径滕州烟煤的 T G、 D T G 曲线 ( 升温速率 : 30 ℃ / min)
2
] , 当 n ≠1 时 , 令 Y =
求解动力学参数主要有积分法和微分法 , 它们之 热力发电 ・ 2006 ( 04)
∼ λ
基础研究
ln [
) 1- n 1 - (1 - α ] , 则动力学方程可简化为 Y = a + 2 T ( 1 - n)
结果表明 , 当 n 等于 3 时 , 函数图像的线性关系最好 , 黑 龙江大头煤不同升温速率下的计算结果见表 5 。
2 . 2 动力学参数的计算
( 5) ( 6) ( 7)
对式 ( 8) 积分后两边取对数得 : ) 1- n 1 - (1 - α AR ( 2RT) E ln [ ] = ln [ 1 ] 2 βE E RT T ( 1 - n)
( n ≠1) ( 9)
或 ln [ -
) ln ( 1 - α T
2
] = ln [
βE
AR (
1-
2RT)
E
]-
E RT
式中 : E 为活化能 ; A 为频率因子 ; R 为气体常数 ; n 为 令 X =
T
( n = 1) ( 10)
1 α AR ( 2RT) E , = ln [ 1],b = ,当 n
βE
E
R
= 1 时 , 令 Y = ln [ -
) ln ( 1 - α T
煤炭加工中的热解反应动力学研究

热解反应动力 学在煤炭加工 中的应用
提高煤炭资源 利用率的方法 和途径
热解反应动力 学在提高煤炭 资源利用率中 的作用
热解反应动力 学在煤炭加工 中的应用实例 和效果分析
0
0
4
国内研究:主要关注热解反应动力学在煤炭加工中的应用,包括热解机理、 反应速率和反应条件等方面的研究。
国外研究:注重热解反应动力学在煤炭加工中的应用,特别是在热解反应机 理、反应速率和反应条件等方面的研究。
加强与其他领域的交叉学科研究, 推动热解反应动力学在煤炭加工 中的应用和发展
汇报人:
数值模拟的优点和局限性
数值模拟的未来发展趋势 和挑战
热解反应动力学原理 热解反应在煤炭加工中的应用 提高煤炭转化效率的方法 实际应用案例分析
热解反应动力学原理
热解反应动力学在煤炭加 工中的应用
优化煤炭加工工艺的方法 和步骤
优化后的煤炭加工工艺的 效果和优势
热解反应动力学在煤炭加工中的应用可以减少煤炭燃烧产生的有害气体排放 通过优化热解反应条件,可以降低煤炭燃烧产生的烟尘和颗粒物 热解反应动力学在煤炭加工中的应用可以减少煤炭燃烧产生的二氧化碳排放 通过热解反应动力学在煤炭加工中的应用,可以降低煤炭燃烧产生的硫氧化物和氮氧化物排放
研究进展:国内外学者在热解反应动力学在煤炭加工中的应用方面取得了一 定的进展,但仍然存在许多问题需要进一步研究。
发展趋势:随着科技的发展,热解反应动力学在煤炭加工中的应用将越来越 广泛,研究也将更加深入。
热解反应动力学模型的建立与验证 热解反应动力学在煤炭加工中的应用研究 热解反应动力学与煤炭加工工艺的优化 热解反应动力学在煤炭加工中的环境保护问题
理解煤炭热解反应机理,提高煤炭利用效率 预测煤炭热解反应产物,优化煤炭加工工艺 研究煤炭热解反应动力学,为煤炭清洁利用提供理论支持 探索煤炭热解反应动力学与环境保护的关系,为煤炭可持续发展提供科学依据
内蒙和印尼褐煤的热解特性及动力学分析

升 温速 率对热 失重过程略 有影 响 , 通过 动力 学分析 所得 的热 解动 力 学参数 能很 好 地反 映煤 的热 解
情 况. 关 键 词 褐 煤 , 解 , 重 分 析 , 力 学 热 热 动 中 图分 类 号 TQ5 0 2 3 .
0 引 言
褐煤 是煤化程 度较低 的一种 煤 , 水分高 , 其 热值 低 , 氢 含 量 低 , 储 量 大 , 占煤 炭 保 有 储 量 的 碳 但 约 1 .1 3 1 若直 接燃烧 , 烧 效 率低 , 且 排 放 大量 的 燃 而
图 1 煤样 的红 外 吸 收 曲 线
Fi FTI s c r sofc als m pls g.1 R pe t a o a e
M — — M o go i i n t ; — — I d n sa i n t n l l ie I a g n o e i n l ie g
1 1 原 料 .
本实 验选 用 内蒙褐煤 和 印 尼褐煤 为 实 验样 品 , 其工 业分析 和元 素数据见 表 1 .
表 1 煤 样 的工 业 分 析 和 元素 分 析 ( % )
T a l Pr i t nd uli be1 ox ma e a tmat na y i a pls e a l ssofs m e (
2 , 径 为 00 4mm, 0mg粒 .7 以流 量 为 10mL mi 0 / n的氮
气 作为 载气 , 采用 3种 不 同的升 温速 率 :0 ̄ mi, 1 C/ n
1 ቤተ መጻሕፍቲ ባይዱ/ n和 2 ℃/ n 恒 速 升 温 到 7 0℃ . 5 mi O mi, 0
有煤 焦 油 和 褐 煤 半 焦 , 焦 和 焦 油 用 途 都 较 为 广 半
热重法研究煤的燃烧行为及其动力学模型

热重法研究煤的燃烧行为及其动力学模型
1煤的燃烧行为及其动力学模型
煤是一种重要的能源,用于家庭和工业的发电。
因此,了解煤的燃烧行为和动力学模型非常重要,以提高燃烧的有效性。
热重分析(TGA)是理解煤燃烧行为的重要方法,而TGA实验过程包括加热和冷却等多阶段温度变化。
实验过程中可以测量到煤燃料的持续气体释放以及温度对物质几何重量变化趋势的影响。
通过TGA实验,可以获得描述燃烧行为的动力学模型的参量,如爆解温度、和燃烧速率常数等。
利用这些参量,可以研究煤燃料的相关动力学机制。
此外,TGA实验还可以研究煤燃料中不同组分的组成及其特性,以及如何影响燃烧行为。
例如,不同组分的水分会影响煤燃料的燃烧速率和过程温度。
另外,人们还可以利用TGA实验测量微观煤燃料空隙的尺寸、形状及其分布,从而推断煤在燃烧过程中的气体运动规律及其影响。
通过TGA实验,可以实现对煤的有效分析,深入洞察煤的燃烧行为和动力学模型,从而更好地提高燃烧的有效性和利用效率。
(精选)煤热解动力学研究

煤热解动力学研究引言热解是煤燃烧、气化和液化等热加工工业中的基本过程之一,也是成煤过程中的基本环节[1]。
因此,研究煤的热解不仅为煤的热加工过程提供科学依据,也能为加深煤化学研究提供重要信息。
在研究煤的热解动力学过程中,必然涉及反应速率与活化能和指前因子等动力学参数[2-4]。
本文着重探索几种热解模型和热解动力学模型,并针对在还原气氛下进行煤热解这一课题,进行动力学选择和分析。
1热解模型随着近十几年的现代仪器的发展,采用Py-FIMS、13C-NMR(碳核磁共振波谱法)、TG-FTIR(红外光谱仪)等手段对煤结构的研究,使得人们有可能有可能以煤的结构为基础研究煤的热解机理,并由此建立了比较成功的煤热解网络模型,如由用来描述气体逸出与焦油形成的降解一蒸发一交联的FG-DVC模型、FLASHCHAIN模型和化学渗透脱挥发分(CPD)模型。
这些模型都是用简化的煤化学和网络统计学描述焦油前驱体的生成,但在网络几何形状、断桥和交联化学、热解产物、传质假设和统计方法上各有不同[5]。
1.1 FG-DVC热解模型FG-DVC(Functional Group Depolymerization Vaporization Crosslinking)模型是由用来描述气体逸出的官能团模型与描述焦油形成的降解一蒸发一交联模型结合而成的。
FG模型是用来描述煤、半焦和焦油中气体的产生与释放机理;DVC模型是用来描述在桥键断裂和交联发生的影响下煤中大分子网络所发生的分解和缩聚行为,预测碎片的分子量分布情况[6]。
FG-DVC模型的基本概念:(1)煤中官能团分解产生小分子类热解气体;(2)大分子网络分解产生焦油和胶质体;(3)胶质体分子量的分布由网络配位数决定;(4)大分子网络的分解是由桥键的断裂来控制,而桥键的断裂是受活泼氢限制;(5)网络的固化是由交联控制的,交联的发生伴随着二氧化碳(桥键断裂前)和甲烷(桥键断裂后)的放出。
用热失重仪研究煤快速热解

用热失重仪研究煤快速热解
周静;何品晶;于遵宏
【期刊名称】《煤炭转化》
【年(卷),期】2004(027)002
【摘要】通过对原热失重仪气路进行改造,利用等温热重实验法研究快速加热条件下煤的热解,研究结果对认识气化炉内煤气化反应过程及设计、运行气化炉有重要意义.研究表明:煤从室温进到高温炉后,首先发生一个极快速裂解脱挥发分过程,它在8s内可脱除绝大部分挥发物,然后是慢速脱挥发分过程;热失重仪炉温越高,煤挥发分析出量越大,有些煤快速热解可析出比其工业分析更多量的挥发分;煤越年轻,煤粒越细小,煤量越少,其挥发分析出量越大;煤粒快速热解焦渣电镜照片显示,焦渣颗粒黏结在一起,大颗粒表面有很深裂纹生成;煤挥发分的脱除速度是慢速热解(升温速率<40C/min)与快速热解的最大差异.
【总页数】7页(P30-36)
【作者】周静;何品晶;于遵宏
【作者单位】污染控制与资源化研究国家重点实验室,同济大学,200092,上海;污染控制与资源化研究国家重点实验室,同济大学,200092,上海;华东理工大学洁净煤技术研究所,200237,上海
【正文语种】中文
【中图分类】TQ530.2
【相关文献】
1.煤化学工程——催化剂对混合煤在快速热解过程中的影响 [J], 许莹;孙小星;胡宾生
2.弱粘煤和不粘煤的快速热解及其团聚研究 [J], 李登新;Makino M;吕俊复;岳光溪;张建胜
3.煤热失重动力学的研究 [J], 朱学栋;朱子彬
4.煤低温实验研究(Ⅰ) 氮气中煤热失重及物理性质研究 [J], 周静;龚欣;郭小雷;于遵宏
5.热失重分析仪简介及热失重分析试验中影响因素的分析 [J], 郭恺;李岩;仇慧群因版权原因,仅展示原文概要,查看原文内容请购买。
生物质与煤热解特性及动力学研究

生物质与煤热解特性及动力学研究朱孔远;谌伦建;马爱玲;黄光许【摘要】利用热重分析技术对4种常见天然生物质(核桃壳、木屑、玉米秸秆、小麦秸秆)和两种烟煤在高纯N2条件下的热解过程进行了分析,研究不同粒度级和不同升温速率对热解过程的影响,并用Coats-Redfern积分法对热解过程进行了动力学分析.结果表明,生物质热解失重主要温度段为200~450℃,烟煤为300~600℃,反应符合一级反应动力学模型,生物质活化能为50~80kJ/mol,煤为30~115kJ/mol;升温速率对热解特性的影响较大,提高升温速率,TG及DTG曲线向高温方向移动.【期刊名称】《农机化研究》【年(卷),期】2010(032)003【总页数】5页(P202-206)【关键词】生物质;煤;热解特性;动力学【作者】朱孔远;谌伦建;马爱玲;黄光许【作者单位】河南理工大学,材料科学与工程学院,河南,焦作,454000;河南理工大学,材料科学与工程学院,河南,焦作,454000;河南理工大学,材料科学与工程学院,河南,焦作,454000;河南理工大学,材料科学与工程学院,河南,焦作,454000【正文语种】中文【中图分类】TK60 引言煤炭是主要的化石燃料,我国一次能源消费构成中煤炭比例超过2/3,在现有能源中占有重要的地位[1]。
随着经济的发展,煤炭的消耗量还在不断的增长。
另一方面,煤炭是不可再生的化石能源,煤炭燃烧可造成大气环境严重污染,因此研究洁净煤技术,开发利用生物质能等可再生能源意义重大,深受世界各国关注。
生物质是绿色植物经光合作用将太阳能转化为化学能储存于生物质内的能量,是仅次于煤、石油和天然气的第4大能源。
每年生物质能源产量约1 400~1 800亿t(干重),相当于目前总能耗的10倍[2]。
生物质的硫和氮含量低、燃烧过程中生成的SOX,NOX较少,且燃烧时生产的二氧化碳相当于它在生长时需要的二氧化碳量,使燃烧时二氧化碳近似于零排放[3-5]。
航空煤油热着火动力学特性及实验研究

卢 一d T / d t
式 中: w 为起 始质 量 ; W。为 T( £ ) 时 的质 量 ; W。 。 为 最 终 质 量; △ w 为 T( £ ) 时 失质 量 ; △w。 。 为 最 大失 质量 。
热重法 ( TG) 是 研 究 可 燃 物 热 分 解 特 性 广 泛 应 用 的
作 T G 曲线 的切 线 与 T G 开 始 曲线 的平 行 线 交 于 G点 , G 点 所 对 应 的 温度 就是 着 火 温 度 。有 多 个 峰 值 的 D T G曲 线 的着 火 点则 采 用 过 第 一 个 峰 作 垂 线 与 T G 曲线 的交 点
来 确定 。
文章编号 : 1 0 0 9 —0 0 2 9 ( 2 0 1 3 ) 1 0 —1 0 7 3 —0 3
一
种分析方法 , 是在程序控制升温速率 的条件下 , 通 过 热
根 据 质 量 作 用定 律 , 试样 反 应 速 率 如 式 ( 2 ) 所示 。
dx
—
天 平 测 量 可 燃 物 的 失 重 和加 热 温度 之 间 的 关 系 。热 重 法 分 为 两类 , 一是等温法 ( 静态法 ) , 在 恒 温 下 测 定 失 重 率 与 时 间 的关 系 , 此法对 航空 煤油 而言 , 产生 的误差 较大 , 因 为在试样 温度升至 实验指 定温 度之 前 , 会 由于 已 发 生 分
W。 一W
一
△w
方 式 固然 可 以获 得 较 好 的 动 力 学 数 据 , 但 不 能 对 实 际 火
W 一 W
灾 中 的复 杂 环 境 变化 进 行模 拟 。笔 者 采 用 S T A 4 4 9型 热
综 合 分 析 仪 对 RP 一 5型 航 空 煤 油 开 展 动 力 学 特 性 研 究 ,
煤矸石的热解生成机理与反应动力学分析

煤矸石的热解生成机理与反应动力学分析煤矸石作为煤矿采矿过程中产生的废弃物,对环境造成了严重的污染问题。
煤矸石的有效利用成为了当前的研究热点之一。
煤矸石的热解是一种重要的处理方式,通过高温热解过程,可以将煤矸石转化为有价值的产物,如焦炭、燃料气体、液体燃料等。
然而,煤矸石的热解过程涉及到复杂的化学反应机理和反应动力学,对于煤矸石的高效转化仍然有待深入研究。
煤矸石的热解生成机理主要与其化学成分和结构特征有关。
从化学成分上看,煤矸石主要由有机质和矿物质组成,其中有机质含量较高。
在高温下,煤矸石的热解可发生两个主要的反应路径:炭化和气化。
炭化是指有机质在缺氧条件下通过热解生成焦炭的过程;气化是指在氧气或水蒸气存在下,有机质通过热解生成可燃气体的过程。
炭化和气化反应过程中涉及了多个物理和化学的过程,如质量转移、热传导、化学反应等。
这些过程相互作用并影响了煤矸石热解的产物生成。
煤矸石的热解反应动力学研究对于优化热解工艺和提高产物收率具有重要意义。
反应动力学描述了反应速率随时间的变化规律。
煤矸石的热解反应动力学可以通过实验测定不同条件下的热解反应速率得到。
常用的方法包括热重失重实验、差示扫描量热法等。
通过实验数据的处理和拟合,可以得到煤矸石热解反应的速率常数、活化能等参数,从而探讨热解过程的热力学性质。
煤矸石的热解反应动力学研究发现,煤矸石热解过程中存在多个反应阶段。
一般情况下,煤矸石的热解过程可分为干馏、气化和煤炭灰渣生成三个阶段。
在干馏阶段,有机质中的挥发分开始释放并产生燃料气体和液体燃料。
而气化阶段是指有机质发生气化反应,生成可燃气体的过程。
煤矸石热解的最后阶段是煤炭灰渣生成,其中矿物质在高温下形成煤矸石灰渣。
煤矸石热解反应动力学的研究结果显示,煤矸石的热解速率常数和活化能取决于煤矸石的化学成分和结构特征。
煤矸石中的有机质主要由纤维素、半纤维素和木质素等组成,这些有机物在热解过程中会发生解聚和重排反应,形成焦炭和燃料气体。
生物质与煤热重分析及动力学研究.
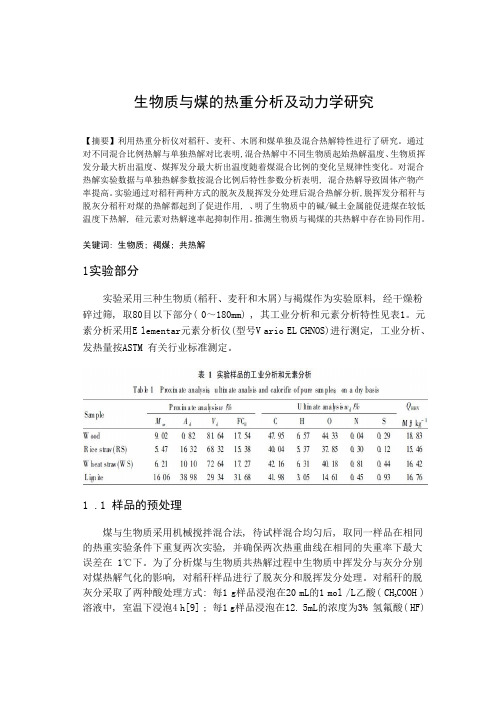
生物质与煤的热重分析及动力学研究【摘要】利用热重分析仪对稻秆、麦秆、木屑和煤单独及混合热解特性进行了研究。
通过对不同混合比例热解与单独热解对比表明,混合热解中不同生物质起始热解温度、生物质挥发分最大析出温度、煤挥发分最大析出温度随着煤混合比例的变化呈规律性变化。
对混合热解实验数据与单独热解参数按混合比例后特性参数分析表明, 混合热解导致固体产物产率提高。
实验通过对稻秆两种方式的脱灰及脱挥发分处理后混合热解分析,脱挥发分稻秆与脱灰分稻秆对煤的热解都起到了促进作用, 、明了生物质中的碱/碱土金属能促进煤在较低温度下热解, 硅元素对热解速率起抑制作用。
推测生物质与褐煤的共热解中存在协同作用。
关键词: 生物质; 褐煤; 共热解1实验部分实验采用三种生物质(稻秆、麦秆和木屑)与褐煤作为实验原料, 经干燥粉碎过筛, 取80目以下部分( 0~180mm) , 其工业分析和元素分析特性见表1。
元素分析采用E lementar元素分析仪(型号V ario EL CHNOS)进行测定, 工业分析、发热量按ASTM 有关行业标准测定。
1 .1样品的预处理煤与生物质采用机械搅拌混合法, 待试样混合均匀后, 取同一样品在相同的热重实验条件下重复两次实验, 并确保两次热重曲线在相同的失重率下最大误差在 1℃下。
为了分析煤与生物质共热解过程中生物质中挥发分与灰分分别对煤热解气化的影响, 对稻秆样品进行了脱灰分和脱挥发分处理。
对稻秆的脱COOH ) 灰分采取了两种酸处理方式: 每1 g样品浸泡在20 mL的1 mol /L乙酸( CH3溶液中, 室温下浸泡4 h[9] ; 每1 g样品浸泡在12. 5mL的浓度为3% 氢氟酸( HF)溶液中, 室温下浸泡1 h[10] 。
处理样品经去离子水洗至中性, 过滤去除滤液后置于105℃烘箱中24h得到干燥的脱灰稻秆,分别记为HA c-RS和HF-RS.在管式炉中对稻秆脱挥发分:把稻秆样品迅速放入预先升至900℃的管式炉中, 在氮气气氛中停留20 min, 氮气冷却至室温, 制得稻秆半焦。
煤的热天平燃烧反应动力学特性的研究

煤的热天平燃烧反应动力学特性的研究
肖三霞;方庆艳;傅培舫;周怀春
【期刊名称】《工程热物理学报》
【年(卷),期】2004(25)5
【摘要】采用热天平获得同一种煤在不同升温速率下的TG、DTG曲线,可求出燃烧速率、燃烧温度随燃烬度的变化曲线,根据两个不同升温速率下的数据,可计算出化学动力学参数活化能和指前因子随燃烬度的变化曲线。
根据实验数据计算得到四个煤种的反应动力学参数随燃烬度变化的曲线,并预测其中一种煤在第三个升温速率下的燃烧速率随燃烬度的变化曲线,计算结果与实验结果符合较好。
用此模型预测了在不同的恒定温度下试验煤种的煤粉燃烧速率随燃烬度的变化趋势。
【总页数】3页(P891-893)
【关键词】煤粉燃烧;反应动力学;燃烬度;热重分析
【作者】肖三霞;方庆艳;傅培舫;周怀春
【作者单位】华中科技大学煤燃烧国家重点实验室
【正文语种】中文
【中图分类】TK16
【相关文献】
1.超细煤粉热解特性及热解反应动力学研究 [J], 王琳俊;马阳;刘加勋;姜秀民
2.印尼煤掺混烟煤的热重燃烧反应动力学特性研究 [J], 王玲玲;卢志民;易新建;洪家嘉
3.煤-焦炉气共热解半焦燃烧动力学特性研究——燃烧模型的建立及其表观活化能动态描述 [J], 廖洪强;李保庆;孙成功
4.煤-焦炉气共热解特性研究Ⅱ.热解半焦燃烧反应性的研究 [J], 廖洪强;东成功;李保庆
5.在三个升温速率下用热天平研究煤的热解及其反应动力学 [J], 魏兴海;顾永达;沈平;徐永昌;荣光华
因版权原因,仅展示原文概要,查看原文内容请购买。
等温热重分析法对煤焦反应动力学特性研究

等温热重分析法对煤焦反应动力学特性研究摘要:本文讨论了等温热重分析法对煤焦反应动力学特性的研究。
通过建立煤焦的等温反应曲线,利用一阶模型、二阶模型和时间温度相关系数模型,从而评估了煤焦反应动力学特性。
其中,时间温度相关系数模型在研究热响应函数时表现出较好的准确性。
结果表明,等温热重分析法可以准确有效地研究煤焦反应动力学特性。
关键词:等温热重分析法;煤焦反应动力学;热重分析;一阶模型;二阶模型;时间温度相关系数正文:煤焦是一种复杂的可燃固体,在燃烧过程中产生大量的热能,从而带来巨大的潜在危险。
因此,研究煤焦反应动力学特性变得越来越重要。
等温热重分析法是一种分析和衡量反应动力学特性的方法,可以有效地研究煤焦的反应动力学特性。
在本文中,测得煤焦的化合物组成,并利用等温热重分析法建立煤焦的等温反应曲线,并分别用一阶和二阶反应模型,以及时间温度相关系数模型,来评估煤焦的反应动力学特性。
结果表明,一种煤焦的反应活性为47.2 kJ / mol,反应速率常数为1.62 × 10-3 (s-1),时间温度关联系数为1.56×10−3 K−1。
时间温度关联系数模型对煤焦反应动力学性能有较好的准确性。
总之,等温热重分析法可以准确有效地研究煤焦反应动力学特性,这些发现可以为煤焦燃烧及其相关安全性研究提供更多信息。
除了等温热重分析法,其他实验方法也可以用来研究煤焦反应动力学特性。
例如,能量谱和热重精密分析法可以确定固体的化学成分,从而估算煤焦反应的速率常数。
此外,还有一种称为微布鲁克计数法的实验方法,该方法可以测量活性气体的变化,以确定反应的反应活性。
另外,X射线衍射可以分析不同反应中溶剂的变化,从而估算煤焦反应的速率常数。
此外,基于理论计算,也可以使用密度泛函理论(DFT)、量子化学(QC)和分子动力学(MD)方法来研究煤焦反应动力学特性。
DFT和QC通过计算煤焦反应中各个步骤的能垒高度,来估算反应速率常数。
煤炭流变学和燃烧动力学研究

煤炭流变学和燃烧动力学研究煤炭是一种重要的能源资源,其在工业生产和生活中扮演着重要的角色。
煤炭的流变学和燃烧动力学研究是煤炭利用和燃烧过程中的关键问题,对于提高煤炭利用效率、减少环境污染具有重要意义。
本文将对煤炭流变学和燃烧动力学进行深入研究,探讨其在煤炭利用中的应用和意义。
一、煤炭的基本性质煤炭是一种含碳量较高的矿物质,其主要成分包括碳、氢、氧、氮等元素。
煤炭的性质受到其成分、结构和形态等因素的影响,具有一定的流变学特性和燃烧动力学特性。
二、煤炭的流变学特性煤炭在受力作用下会发生形变,其流变学特性是研究煤炭物理性质和力学性能的重要内容。
煤炭的流变学特性包括应力-应变关系、变形行为、变形速率等,通过研究这些特性可以了解煤炭在受力作用下的行为规律。
三、煤炭的燃烧动力学特性煤炭在燃烧过程中释放能量,其燃烧动力学特性是研究煤炭燃烧过程的关键。
煤炭的燃烧动力学特性包括燃烧速率、燃烧温度、燃烧产物等,通过研究这些特性可以了解煤炭燃烧的规律和机理。
四、煤炭流变学和燃烧动力学的研究方法煤炭流变学和燃烧动力学的研究方法包括实验研究和数值模拟两种。
实验研究通过对煤炭样品进行实验测试,获取其流变学和燃烧动力学特性的数据;数值模拟通过建立数学模型,模拟煤炭在受力和燃烧过程中的行为。
五、煤炭流变学和燃烧动力学在煤炭利用中的应用煤炭流变学和燃烧动力学的研究成果在煤炭利用中具有重要的应用价值。
通过对煤炭的流变学和燃烧动力学特性进行研究,可以优化煤炭的利用方式,提高燃烧效率,减少环境污染。
六、煤炭流变学和燃烧动力学的未来发展方向随着能源需求的增加和环境污染的加剧,煤炭流变学和燃烧动力学的研究将会变得更加重要。
未来的研究方向包括煤炭燃烧机理的深入研究、煤炭燃烧过程的优化控制等,为提高煤炭利用效率和减少环境污染提供更多的科学依据。
梳理一下本文的重点,我们可以发现,煤炭流变学和燃烧动力学的研究对于提高煤炭利用效率、减少环境污染具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
维普资讯
煤 热 失 重 动 力 学 的 研 究
25 2
值为 1 7 0 s,其余三个参数 、晶 和 口 由模型参数估值求取,为此也有利于研究结果的 . ×1 一 6 可
比较 。
为简化计算 ,式() 0 o 的无穷积分由 岛= 到 岛+ 代替,以计算值与实验值之间的残 3中 - o - l 4 差平方和最小为目标函数进行优化, 选用进退搜索和 P w l o e 法由计算机拟合模型.进行参数估值 。 l
Ta l P v l s i ei a a tr si tdfo DAE  ̄n fcm o e be2 y oy l kn tcp r mee se t s ma e m r e dl i
DaTo g n
2 .9 52
Se h nM u
m柏 m柏 m蚰唧m柏 m柏 m柏 m柏啪 岫帅
降,蜂的位置在 4 0 左右,总失重约为 7 %。进 3" C 0 入热解的第三 阶段,积分 曲线和微分 曲线都呈缓缓 下降趋势 .失重约为 2 %。 0
3 D E模型的建立 . 2 A
L ℃
图 I 大屯煤热解的 T -T G D G曲线
F g I 7 3 DTG L Y f t c a y o y i i - ( ・ GI eo Dat o l r l s I T m p  ̄
2 .9 85
Gu i wa 0 Ja n
2 .5 95
Dn T n “ 让 u
抛 瑚 马 l埘 珈 拼l 瑚 暑 抛mm Ⅲ mm 枷Ⅲ Ⅲ m 叭
虬儿 忸 住 ¨儿 ∞ 北 勰虬 g盯 船 阱 盯 =
2 .7 74
Sh n Ya g e n
3 B E模型的运用 . A 3
以大屯煤和小龙潭煤为例 ,其活化能分布如图 2 所示 。热解活化能呈 G usn分布,此平 asa i
均活化能与一般高分子化合物的热解活化能相近 .更证明煤是一个高分子的化合物[ 2 1 。图 3表示 了平均活化能与挥发分的关系,由图可知 .随煤的挥发分的增加 .煤热解的平均活化能下降,从
维普资讯
, 2马 一 ) 一
第 1掌 第 3 3 期
19 99年 6, E l
高 校
化
学 工 程
学 报
No3 Vo 1 . L3
Junlf h m cl g e igo C ic o rao C e ia _ 目 n f ha ̄Un c ic m i tt ̄ v sl
圈 5 模型 曲线掇台与实验值比较
F 5 P r l s sc r e ft o m ne o y o y i u v - rDa o a i f
八个煤样在不 同升温速率下的模型模 拟参数值列于表 2 由表 2中可知, 对同一煤样 . 选用 l 、 O 4 、10C. n 三种升 温速率下所得热解曲线的模型参数值 变化不大, 0 6 " mi - 。 平均活化能的值 相差在 5 %以内.对标准偏差 和最终热解挥发物产率也都小于 5 %。由此说明可用 同一模型参数表达不同 升温速率下煤的热解 过程。我国煤 的研究结果与 Mc o n 和 B rhm C wI un a 1 等人 的工作相一致 a
10 . i。,在 10 加热半小 时干燥 ,以充分除去水分,之后加热至终温 90 。以氮气为载 6 " mn) C 2" C 0" C 气,载气流率为 10 L m n 。对 比试验的失重曲线重现性好 。 0m . i ~
3 结果与讨论
31 煤的热解过程分析 .
煤样在不 同升温速率下的热解失重积分曲线与微分曲线见图 1 。图中纵 坐标 以煤样在 10 2" C
19 . .4 9 s 72 收到韧稿.19 .i 6收到謦改稿 . 0 95 - i2 鞋蕞^:来子彬. 第一作者;束掌拣,男. .博士生 . 讲 。
维普资讯
24 2
高 技
化
学 I 程
学 报
下于燥半小时之后 的试样重量为基准。
囊 l 样品的工 业分析与元素分析数据囊
变窄,正如图 2 所示 。
罾
_
括化能 . m r U- a‘
挥 发分.t 00 w %( a 图 3 堞 的挥 发分 与平 均 活化 扼 的关 系
F g Ov r l a  ̄rg el a i n ̄l 'y Y u o aiemB Ⅱ i 3 e al v a el t to f ̄g ∞ sv l t n v d l
煤
热解
’ - 一
热析 化布 重 能模 分 活分型
1 前
言
用热解模型来描述煤的热解过程是十分重要的,长期来为国r:学者所关注。传统的热解模 qb
型有单一反应模型 ,反应一般采用一级或 1 2 级来表示 .有限多平行反应模型认为煤的热解是g- t- ' l 化合物或几种化合物 的热分解 ,而 Ptj is tl 认为煤的热解过程有无限多平行反应同时发生 .可用无
阶段 。以升温速率 1" m n 0C. i- 的热解过程说明之 , 从 10 到 30 左右为第一阶段 ,此阶段失重量 2" C 2" C
大约占总失重的 1% 左右。第二阶段在 3o 0 2 ℃至大 约 60 之间 .发生强烈分解.积分曲线陡然下降, 2* C
相应微分 曲线则直线上升 ,达最大值后 ,又直线下
船船船”凹”船””¨”” 程 ,能适应多煤种和升温速率的变化 。
住 ∞∞ 拈 舛 嘶博 蛇; 宇 2:
州强
町蛇虬
; 2
= 兮∞
4 模 型比较
为了进一步验证 D I模型的合理性 ,现对国内研究者普遍采用和认同的用单一反应模型 , AS 以大屯煤为例进行考察和分析 。 41 一级反应的单一反应模型 . 假 定 煤 的 热 解 过 程 可 用 单 一 反 应 模 型 来 描 述 .且 反 应为 一 级 。 用微 商 法 .即用
图 5为大屯煤热解过程的模型计算值与实验值比较关系图,由图可知 .二者吻合 良好 ,仅
维普资讯
26 2
高 校 化
学 工
程
学 报
温度高于 8 02 0  ̄时,实验值和模型值之间稍有偏差 ,其他七种煤样与大屯煤相同。
衰 2 煤样热解散据的 DA E模型撤台参数
D E 模型认 为煤 的热分解 是煤分子 内键断裂的化学反应 ,由于不同化学键的强度存在明显 A
差异 ,因而假设煤的热解是无数个平行的一级化学反应的组台过程 ,且反应数 目足够 的大,以致
于可 以用 G us n as a 分布连续函数来表达反应 的活化能。 i
煤 中第 i 个反应物的挥发分释放速率可用式( 来描述 。 1 )
Ta l Pr xn emmlssa d  ̄tmmt b el o l mt y t n l emmlas0 s mpls y f a e
* y dl b Ⅱ ∞ c
煤是一复杂的高分子化合物,在惰性气氛下 , 加热至高温 .受热而发生一系列的物理变化和化学
反应。由图 1 知,其热解过程大致可以分为三个 可
田 2 典 型煤 样 的活 化能 分布 圈
F g 2 Th ci a i a甑 豇 d srbli ̄o o l i ea tv t o iti l o fc  ̄ s t
二
旧
氧含量. t ( a w % df )
图 4 氧音 量 与 括化能 标 准韫 差 的关 系
F g S a d r e ai n i c i t n∞ i 4 t n a dd vit n a t i o va o d srb t n f c iti u i hn 锄 Y u x g n c l c t o e so y e oa a t
Xi o L  ̄ t n a c a
4 2鲫
∞ ” 强 瓴 " 卯 拽 孙 ” 拽 傩 扼 盯 为进一步验证模 型的合理性与对煤种和升温速率 的适应性 ,用统计检验方法分别进行了模
型检验的方差分析 、相关性分析和 F检验。结果表明:F 检验显著性很好 ,残差平方和一般小于 1%.相关指数均在 0 9以上 采用无限多平行反应的活化能分布模型能完整描述煤热解全过 2 . 9
2 实
验
实验选用我国碳含量介于 6  ̄8 %的八种煤作煤样 ,其工业分析和元素分析见表 1 9 5 。 热解失重实验在上海天平仪器厂 的 WR .P型热天平上进行 .自动采样 ,由计算机绘 出失 T3
重积分曲线和微分曲线。 煤样用量约 1m , 0 g 粒度小于 015 m。实验采用三种升温速率(0 4 、 . r 2a 1、 0
3 .7 38
搬 珈 拼
Hu n a a g Xi n
¥ e ; h n Be
"
瑚 ∞
∞
m 阱
Ⅲ
3 5 3 6 59
5 9 2 2 3 7 9 6 7 9 6 5
1 8 0 3 8
1 3 3 8 0 4 7
J Ⅱ uc
1 9 99
煤亳 热
擅 升温速率变化有 宽广范 围的适应性
关薯词
● _ 一
究
帖温 解 投
( 华东理工大学化工工艺研究所, 上海 203) 027
要 以具有 { usn活化能分 布的平行反应模 型考察了我国煤 化程度 不同的^种煤的非等温热解 3 sa a i
过程 研究袁 明 :煤热解 的活化能呈 {a si 3us n正态分布 .其平均活化能介于 2 0 4 k ・ o a 1  ̄2 5. t l 1 o 之间 . 近似 于高分子化 合物 的热解活化能 模型能够描述 自低温到高温煤 的非等温热解 的全过 程,对煤种和
2 2 6 m l 逐渐降低到 2 1 6 m l。图 4为煤的氧含量与活化能标准偏差的关系.由图 4 . 1 o 6 0. - 1. 1 o。 1 0. I
