酸碱指示剂变色PH范围、配制方法
常用指示剂溶液的配制
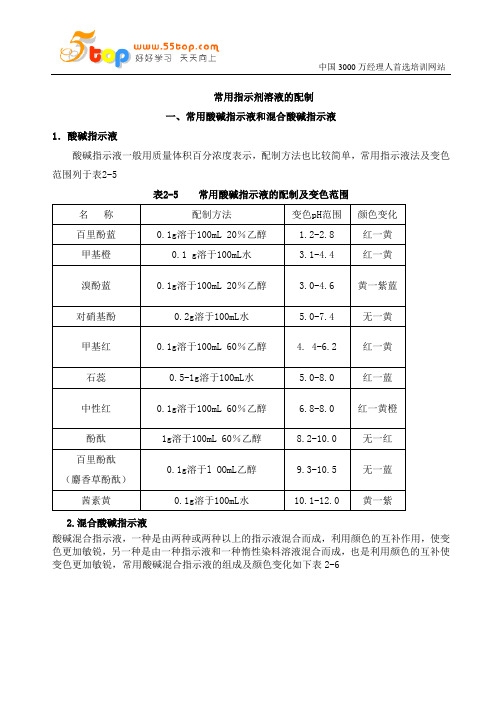
常用指示剂溶液的配制一、常用酸碱指示液和混合酸碱指示液1.酸碱指示液酸碱指示液一般用质量体积百分浓度表示,配制方法也比较简单,常用指示液法及变色范围列于表2-5表2-5 常用酸碱指示液的配制及变色范围2.混合酸碱指示液酸碱混合指示液,一种是由两种或两种以上的指示液混合而成,利用颜色的互补作用,使变色更加敏锐,另一种是由一种指示液和一种惰性染料溶液混合而成,也是利用颜色的互补使变色更加敏锐,常用酸碱混合指示液的组成及颜色变化如下表2-6德信诚精品培训课程(部分)内审员系列培训课程查看详情TS16949五大工具与QC/QA/QE品质管理类查看详情 JIT>>>德信诚深圳培训中心 E-mail:55top@ 报名表下载>>> 公开课计划表表2-6 常用酸碱混合指示液的组成及颜色变化二、氧化还原滴定指示液用于氧化还原滴定反应的指示液有以下几种。
1.氧化还原型指示液这种指示液本身就是氧化剂或还原剂,它的氧化型和还原型颜色不同,因此,在等量点附近发生氧化还原反应,从而引起颜色改变,指示终点的到达,常用以下几种:(1)二苯胺磺酸钠(5 g/L)要时过滤备用。
用时现配。
(2)邻苯氨基苯甲酸(2g/L)过滤,能保持几个月不分解。
(3)邻二氮菲亚铁(1g/L)可保存一年。
2.专属指示液专属指示剂是指在碘量法中使用的淀粉指示液。
淀粉中的直链淀粉(可溶性)可以和I 2生成蓝色配位化合物,而支链淀粉(不溶部分)与I2作用较弱,且生不易逆转的红紫色配合物。
所以,在配制指示液时,要用可溶性淀粉。
淀粉指示液的浓度为5g/L,可按下法配制:称取0.5g可溶性淀粉,于烧杯中,加10mL水调匀,徐徐倒人90mL沸水中,微沸2min,静置,取上层清液加1mlHgI2以抑制细菌作用,如果使用时现配现用,可不加HgI2三、金属指示剂溶液金属指示剂用于配位滴定中。
(1)铬黑T (5g/L) 它的水溶液不稳定,易聚合变质,常用配方有两种。
指示剂的名称,变色pH范围,颜色变化和配置方法
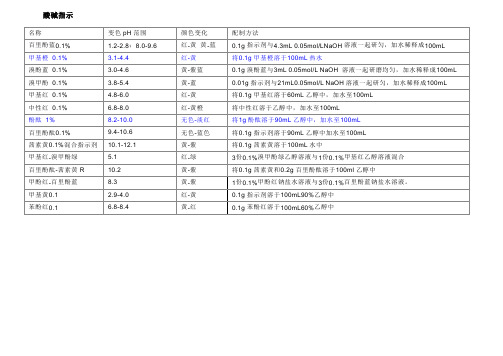
酸碱指示
名称变色pH范围颜色变化配制方法
百里酚蓝0.1% 1.2-2.8;8.0-9.6 红-黄黄-蓝0.1g指示剂与4.3mL 0.05mol/LNaOH溶液一起研匀,加水稀释成100mL
甲基橙0.1% 3.1-4.4 红-黄将0.1g甲基橙溶于100mL热水
溴酚蓝0.1% 3.0-4.6 黄-紫蓝0.1g溴酚蓝与3mL 0.05mol/L NaOH 溶液一起研磨均匀,加水稀释成100mL 溴甲酚0.1% 3.8-5.4 黄-蓝0.01g指示剂与21mL0.05mol/L NaOH溶液一起研匀,加水稀释成100mL
甲基红0.1% 4.8-6.0 红-黄将0.1g甲基红溶于60mL乙醇中,加水至100mL
中性红0.1% 6.8-8.0 红-黄橙将中性红溶于乙醇中,加水至100mL
酚酞1% 8.2-10.0 无色-淡红将1g酚酞溶于90mL乙醇中,加水至100mL
百里酚酞0.1% 9.4-10.6 无色-蓝色将0.1g指示剂溶于90mL乙醇中加水至100mL
茜素黄0.1%混合指示剂10.1-12.1 黄-紫将0.1g茜素黄溶于100mL水中
甲基红-溴甲酚绿 5.1 红-绿3份0.1%溴甲酚绿乙醇溶液与1份0.1%甲基红乙醇溶液混合
百里酚酞-茜素黄R 10.2 黄-紫将0.1g茜素黄和0.2g百里酚酞溶于100ml乙醇中
甲酚红-百里酚蓝8.3 黄-紫1份0.1%甲酚红钠盐水溶液与3份0.1%百里酚蓝钠盐水溶液。
甲基黄0.1 2.9-4.0 红-黄0.1g指示剂溶于100mL90%乙醇中
苯酚红0.1 6.8-8.4 黄-红0.1g苯酚红溶于100mL60%乙醇中。
酸碱指示剂的变色范围与选择

酸碱指示剂的变色范围与选择酸碱指示剂是一种具有变色特性的化学物质,广泛应用于化学实验、工业生产和日常生活中。
它们在水溶液中的颜色会随着pH值的变化而改变,从而可以作为检测酸碱性质的工具。
本文将探讨酸碱指示剂的变色范围与选择的相关知识。
一、酸碱指示剂的变色范围不同的酸碱指示剂具有不同的变色范围,这取决于它们的分子结构和酸碱指示范围。
下面是几种常用的酸碱指示剂及其变色范围:1. 酚酞(Phenolphthalein):酚酞是最常用的酸碱指示剂之一,它在酸性溶液中呈无色,在弱碱性溶液中呈粉红色。
它的变色范围在pH 8.2-10.0之间。
2. 甲基橙(Methyl Orange):甲基橙在酸性溶液中呈红色,在中性溶液中呈橙黄色,在碱性溶液中呈黄色。
它的变色范围在pH 3.1-4.4之间。
3. 酚红(Phenol Red):酚红在酸性溶液中呈黄色,在中性溶液中呈橙色,在碱性溶液中呈红色。
它的变色范围在pH 6.4-8.0之间。
4. 甲基紫(Methyl Violet):甲基紫在酸性溶液中呈红色,在碱性溶液中呈绿色。
它的变色范围在pH 0.0-2.0之间。
5. 甲基红(Methyl Red):甲基红在酸性溶液中呈红色,在中性溶液中呈橙色,在碱性溶液中呈黄色。
它的变色范围在pH 4.4-6.2之间。
以上是常见的几种酸碱指示剂及其变色范围,通过选择适当的酸碱指示剂,我们可以根据变色的颜色变化来推断溶液的酸碱性质。
二、酸碱指示剂的选择在选择酸碱指示剂时,我们应考虑以下几个因素:1. pH范围:根据需要检测的溶液的酸碱性质,选择适合的酸碱指示剂。
例如,如果需要检测中性溶液,可以选择酚红作为指示剂。
2. 变色剂的稳定性:酸碱指示剂在不同的环境中可能会发生分解或退色。
因此,我们应选择稳定性较好的指示剂,以确保准确的测试结果。
3. 可见光波长:酸碱指示剂的变色通常是由于吸收特定波长的光而引起的。
因此,我们需要选择颜色鲜明、易于观察或测量的指示剂。
酸碱指示剂的酸碱变色范围及选择

酸碱指示剂的酸碱变色范围及选择酸碱指示剂是一种化学试剂,能够在酸碱溶液中表现出特定的颜色,在实验和工业应用中起到重要的作用。
酸碱指示剂的酸碱变色范围及选择对于正确使用和准确判断酸碱性质至关重要。
本文将介绍酸碱指示剂的酸碱变色范围以及选择的注意事项。
一、酸碱指示剂的酸碱变色范围酸碱指示剂的酸碱变色范围取决于其分子结构和化学性质。
常见的酸碱指示剂包括酚酞、金鱼草红、溴酚蓝等。
以下是几种典型的酸碱指示剂及其酸碱变色范围的介绍:1. 酚酞酚酞是一种常用的酸碱指示剂,其酸性形式呈现红色,碱性形式呈现无色。
酚酞的酸碱变色范围为pH 6.8-8.2。
当溶液的pH值在这个范围内时,酚酞会从红色逐渐转变为无色。
2. 金鱼草红金鱼草红是一种常用的酸碱指示剂,其酸性形式呈现红色,碱性形式呈现黄色。
金鱼草红的酸碱变色范围为pH 4.8-6.0。
在这个范围内,金鱼草红会从红色逐渐转变为黄色。
3. 溴酚蓝溴酚蓝是一种常用的酸碱指示剂,其酸性形式呈现黄色,碱性形式呈现蓝色。
溴酚蓝的酸碱变色范围为pH 5.0-6.0。
在这个范围内,溴酚蓝会从黄色逐渐转变为蓝色。
以上只是部分常见的酸碱指示剂及其酸碱变色范围,不同的酸碱指示剂具有不同的变色范围,可以根据需要选择合适的指示剂。
二、酸碱指示剂的选择在选择酸碱指示剂时,需考虑以下几个因素:1. pH范围根据被检测溶液的pH范围,选择适合的酸碱指示剂。
确保酸碱指示剂的酸碱变色范围与被检测溶液的pH范围相匹配,以保证准确的酸碱性判断。
2. 可视性选择具有明确颜色变化的酸碱指示剂。
确保颜色变化明显,易于观察和判断。
这样可以提高实验操作的准确性和可靠性。
3. 化学稳定性酸碱指示剂应具有较好的化学稳定性,在不同环境条件下不易分解或变质。
这样可以保证酸碱指示剂的使用寿命,并减少误差的产生。
4. 相关性能要求根据实际需求,选择具有特定性能的酸碱指示剂。
例如,在生物学实验中,选择对生物体无毒的酸碱指示剂。
酸碱指示剂变色PH范围配制方法

酸碱指示剂变色PH范围配制方法一、酸碱指示剂的变色PH范围不同的酸碱指示剂有不同的变色PH范围。
下面列举一些常见的酸碱指示剂及其变色PH范围:1.酚酞:变色范围为pH7.2-8.8,红色到无色;2.溴蓝:变色范围为pH5.6-9.0,黄色到紫色;3.甲基橙:变色范围为pH3.1-4.4,红色到黄色;4.甲基红:变色范围为pH4.4-6.2,红色到黄色;5.酚红:变色范围为pH6.0-7.6,红色到黄色;6.酸性紫:变色范围为pH1.0-2.6,红色到紫色;7.碱性紫:变色范围为pH11.6-14.0,红色到紫色。
二、酸碱指示剂的配制方法1.酚酞:酚酞是一种酸碱指示剂,可通过以下方法配制:将少量酚酞溶于80%的乙醇中,配制的浓度通常为0.1%。
2.溴蓝:溴蓝是一种酸碱指示剂,可通过以下方法配制:将少量溴蓝溶解于水中,浓度通常为0.1%。
3.甲基橙:甲基橙是一种酸碱指示剂,可通过以下方法配制:将少量甲基橙溶解于水中,浓度通常为0.1%。
4.甲基红:甲基红是一种酸碱指示剂,可通过以下方法配制:将少量甲基红溶解于水中,浓度通常为0.1%。
5.酚红:酚红是一种酸碱指示剂,可通过以下方法配制:将少量酚红溶解于水中,浓度通常为0.1%。
6.酸性紫:酸性紫是一种酸碱指示剂,可通过以下方法配制:将少量酸性紫溶解于水中,浓度通常为0.1%。
7.碱性紫:碱性紫是一种酸碱指示剂,可通过以下方法配制:将少量碱性紫溶解于水中,浓度通常为0.1%。
以上是一些常见的酸碱指示剂的配制方法,但需要注意的是,不同溶液的pH值可能在不同的范围内存在变化,因此需要根据实际情况调整酸碱指示剂的浓度和使用方法。
同时,由于酸碱指示剂会因外部因素的干扰而发生变色,所以在实际应用中需要综合考虑其他因素的影响,以确定最准确的酸碱性质。
酸碱指示剂的颜色变化与pH计算方法

酸碱指示剂的颜色变化与pH计算方法酸碱指示剂是一种广泛应用于化学实验室和工业生产中的物质,用于确定溶液中的酸碱性质。
它们的颜色变化可以直观地反映出溶液的pH值。
本文将介绍酸碱指示剂的颜色变化与pH计算方法,并讨论其应用。
一、酸碱指示剂的基本原理酸碱指示剂根据溶液的酸碱性质,通过颜色变化来指示pH值。
其基本原理是根据指示剂分子的电离程度和酸碱性质的变化,使溶液呈现出不同的颜色。
在酸性溶液中,指示剂分子往往处于酸性形式,呈现一种颜色;而在碱性溶液中,指示剂分子往往处于碱性形式,呈现另一种颜色。
中性溶液时,指示剂通常处于中性形式,颜色变化较小。
二、常见酸碱指示剂及其颜色变化1. 酚酞酚酞是一种常用的酸碱指示剂,其在酸性溶液中呈现红色,而在碱性溶液中则呈现黄色。
在pH为8.2时,它会发生颜色转变。
2. 甲基橙甲基橙可以作为一种酸碱指示剂,其在酸性溶液中呈现红色,而在碱性溶液中呈现黄色。
在pH为3.1时,它会发生颜色转变。
3. 酚酞红酚酞红是一种常见的指示剂,其在酸性溶液中呈现红色,而在碱性溶液中呈现无色。
在pH为7.6时,它会发生颜色转变。
通过上述例子可以看出,不同的酸碱指示剂对应不同的颜色变化点,这些点可以用于pH值的计算。
三、pH计算方法通过酸碱指示剂的颜色变化可以定量地计算溶液的pH值。
这可以通过构建标准曲线或使用pH指示剂比色法来实现。
1. 标准曲线法标准曲线法是一种常用的pH计算方法。
首先,制备一系列已知pH值的标准溶液,然后使用酸碱指示剂在每个标准溶液中进行颜色测定。
根据颜色变化的结果,构建标准曲线。
当需要测量未知溶液的pH值时,测定其颜色变化,并利用标准曲线反推其对应的pH值。
2. pH指示剂比色法pH指示剂比色法是一种快速测定溶液pH值的方法。
选择适当的pH指示剂,并将其加入待测溶液中。
根据溶液的颜色变化来判断其酸碱性质。
将颜色与已知标准的颜色变化进行比较,从而确定溶液的pH 值。
四、酸碱指示剂的应用酸碱指示剂广泛应用于各个领域,包括实验室、工业生产和医学诊断等。
酸碱指示剂的酸碱度范围和pH测定的实验方法

结果总结:总结实验结果,包括酸碱指示剂的酸碱度范围、pH值的变化范围等,并提出可能的原因和解释。
结果计算:根据实验数据,计算酸碱指示剂的酸碱度范围
误差分析:分析实验误差的来源,如仪器误差、操作误差等
误差修正:根据误差分析结果,对实验数据进行修正
结果讨论:讨论实验结果与理论值的差异,分析可能的原因和解决方案
甲基橙:用于酸性溶液,颜色变化为黄色到红色
甲基红:用于酸性溶液,颜色变化为黄色到红色
变色规律:根据酸碱指示剂在不同酸碱度下的颜色变化,可以判断溶液的酸碱性
常见酸碱指示剂:酚酞、甲基橙、甲基红等
变色范围:酸碱指示剂在不同酸碱度下的颜色变化
酸碱指示剂:用于检测溶液酸碱性的化学物质
溴甲酚绿:pH范围3.8-5.4,颜色变化为黄色到蓝色
靛蓝二磺酸钠:pH范围1.0-2.8,颜色变化为黄色到蓝色
甲酚红:pH范围6.8-8.0,颜色变化为黄色到红色
甲基橙:pH范围1.0-4.6,颜色变化为黄色到红色
酚酞:pH范围8.2-10.0,颜色变化为无色到红色
甲基红:pH范围4.4-6.2,颜色变化为黄色到红色
pH测定实验方法
单击此处输入你的项正文,文字是您思想的提炼
注意事项: a. 保持溶液的稳定性 b. 避免电极污染 c. 准确读取电极电位变化 d. 正确计算pH值
原理:利用电位滴定法测定溶液的pH值
单击此处输入(你的)智能图形项正文,文字是您思想的提炼,请尽量言简意赅的阐述观点,请言简意赅的阐述观点
a. 试纸不能直接接触皮肤和眼睛b. 试纸应保存在干燥、避光的地方c. 试纸变色后应立即读取pH值,以免颜色变化过大影响准确性
a. 取一小片pH试纸,用蒸馏水湿润b. 将试纸浸入待测溶液中,等待颜色变化c. 与标准比色卡对比,读取pH值
酸碱指示剂的酸碱度范围与选择

酸碱指示剂的酸碱度范围与选择酸碱指示剂是化学实验中常用的一种试剂,它通过颜色的变化来指示溶液的酸碱度。
在实验中选择适当的酸碱指示剂具有重要的意义,因为它将直接影响实验结果的准确性。
本文将探讨酸碱指示剂的酸碱度范围以及选择的相关问题。
1. 酸碱指示剂的酸碱度范围酸碱指示剂是分子化合物,其分子结构中通常含有苯环、酮或醇基团等。
根据酸碱指示剂的化学性质,它们在酸性、中性和碱性环境下会表现出不同的颜色。
常见的酸碱指示剂有酚酞、溴甲蓝、甲基橙等。
酚酞是一种常用的酸碱指示剂,它在pH为0-3之间呈红色,pH为4-9之间呈红色到黄色的过渡区域,pH大于10时呈黄色。
溴甲蓝是一种广泛使用的指示剂,它在pH为3-4之间呈红色,pH为5-6之间呈蓝色,pH值大于7时呈黄色。
甲基橙在pH为2-4之间呈红色,pH为4-6之间呈橙色,pH大于7时呈黄色。
根据这些酸碱指示剂的特性,我们可以得出结论,不同的酸碱指示剂适用于不同的酸碱度范围。
在选择酸碱指示剂时,需要根据实验所需的pH范围来进行选择。
2. 酸碱指示剂的选择在实验室中,根据溶液的酸碱度,我们可以选择适当的酸碱指示剂。
一般来说,如果溶液的酸碱度在指示剂的酸碱度范围内,指示剂会发生颜色变化,从而提供了溶液酸碱度的信息。
例如,在酸性环境中,我们可以选择酚酞作为酸碱指示剂,它的酸碱度范围在pH 0-10之间。
当溶液的pH小于3时,酚酞呈红色;当pH 在4-9之间时,酚酞呈红色到黄色的过渡区域;当pH大于10时,酚酞呈黄色。
因此,通过观察酚酞的颜色变化,我们可以得知溶液的酸碱度。
同样地,溴甲蓝适用于pH 3-10范围内的溶液。
当溶液的pH在3-4之间时,溴甲蓝呈红色;当pH在5-6之间时,溴甲蓝呈蓝色;当pH大于7时,溴甲蓝呈黄色。
通过观察溴甲蓝的颜色变化,我们也可以判断溶液的酸碱度。
甲基橙适用于pH 2-7范围内的溶液。
当溶液的pH在2-4之间时,甲基橙呈红色;当pH在4-6之间时,甲基橙呈橙色;当pH大于7时,甲基橙呈黄色。
酸碱指示剂的酸碱度范围选择和溶液浓度

酸碱指示剂的酸碱度范围选择和溶液浓度酸碱指示剂是一种常用于酸碱滴定反应中的物质,它可以通过改变颜色来指示溶液的酸碱性质。
在进行滴定实验时,选择合适的酸碱指示剂是十分重要的,因为它能够准确地反映溶液的酸碱度范围和浓度。
本文将探讨酸碱指示剂的酸碱度范围选择和溶液浓度对实验结果的影响。
酸碱指示剂的酸碱度范围选择是根据其酸碱性质和PH范围来确定的。
常见的酸碱指示剂有苏丹红、溴酚蓝、甲基橙等,它们分别对应着酸性、中性和碱性溶液。
首先是苏丹红,它是一种酸性指示剂,可以将酸性溶液的颜色变为红色。
苏丹红的酸碱度范围为PH 0-3,因此适用于酸性溶液的滴定实验。
对于酸碱中性或碱性溶液,苏丹红的指示效果较差。
其次是溴酚蓝,它是一种中性指示剂,会使中性溶液的颜色变为蓝色。
溴酚蓝的酸碱度范围为PH 6.0-7.6,因此适用于中性溶液的滴定实验。
对于酸性或碱性溶液,溴酚蓝的指示效果较差。
最后是甲基橙,它是一种碱性指示剂,可以将碱性溶液的颜色变为橙色。
甲基橙的酸碱度范围为PH 3.1-4.4,因此适用于碱性溶液的滴定实验。
对于酸性或中性溶液,甲基橙的指示效果较差。
除了酸碱度范围的选择,溶液浓度也对酸碱指示剂的使用产生影响。
一般来说,指示剂在浓度较低的溶液中呈现出较明显的颜色变化,而在浓度较高的溶液中颜色变化较为模糊。
例如,在进行酸碱滴定实验时,如果溶液浓度过高,就会导致指示剂颜色变化不明显,难以准确判断等价点。
因此,在实验中应当尽可能使用相对较低浓度的溶液,以确保可观察到明显的颜色变化。
此外,酸碱指示剂的选择还应考虑其化学稳定性和溶解性。
指示剂应具有良好的稳定性,不易受到光、热或其他因素的影响而发生变化。
溶解性也是一个重要的考虑因素,以确保指示剂能够充分溶解在溶液中,不会出现沉淀现象。
综上所述,选择合适的酸碱指示剂对于酸碱滴定实验的准确性和可靠性至关重要。
在选择酸碱指示剂时,应根据需求确定所需的酸碱度范围,并考虑溶液的浓度、化学稳定性和溶解性等因素。
酸碱指示剂变色PH范围、配制方法

酸碱指示剂(291~298K)混合酸碱指示剂摘要纠错编辑摘要白花三叶草白花三叶草(Trifolium repens),又名白三叶草、白三叶、菽草、白花苜蓿或白车轴草,是一种产自欧洲、北非及西亚的三叶草。
它们广泛的引进世界各地,尤其是北美洲的草地甚为普遍。
一种白花三叶草(shamrock)是爱尔兰的国花.白花三叶草白花三叶草-基本情况白花三叶草16世纪后期荷兰首先栽培,现温带地区广泛分布。
多年生草本,着地生根。
茎细长而软,匍匐地面,植株高30~60厘米。
叶柄长,小叶倒卵形或近倒心形,叶缘有细锯齿。
头状花序,着花10~80朵,白或淡紫红色。
荚果倒卵状矩形,每荚有种子3~4粒。
种子近圆形,黄色,千粒重0.5~0.7克。
喜温暖湿润气候,适应性广,耐酸性强, pH4.5的土壤仍能生长,除盐碱土外,排水良好的各种土壤均可生长。
再生性好,耐践踏,属放牧型牧草。
开花前,鲜草含粗蛋白质5.1%,粗脂肪0.6%,粗纤维2.8%,无氮浸出物9.2%,灰分2.1%。
产量虽不如红三叶,但适口性好,营养价值也较高。
白花三叶草是草本及多年生植物。
它们矮生,有白色的花朵,很多时有些粉红色或奶白色。
花冠一般阔1.5-2厘米,末端有长7厘米的花梗。
叶子呈三小叶、平滑、呈椭圆形至蛋状、及有长柄。
茎有走茎的作用,匍匐生长,故白花三叶草很多时会形成草垫,茎子每年会生长18厘米,并会在结节长出根。
白花三叶草基部多分枝,匍匐茎实心,光滑细软,长30~50cm,茎节处着地生根。
掌状三出复叶,叶柄细长,自根茎或匍匐茎茎节部位长出。
小叶倒卵形,中部有倒“V”型淡色斑,三枚小叶的倒“V”型淡色斑连接,几乎形成一个等边三角形。
白花三叶草-科学分类界:植物界 Plantae门:被子植物门 Magnoliophyta纲:双子叶植物纲 Magnoliopsida目:豆目 Fabales科:豆科 Fabaceae亚科:蝶形花亚科 Faboideae属:三叶草属 Trifolium种:白三叶草 T. repens白花三叶草-自然形态主要有2种类型,即白花三叶草和红花三叶草。
实验室常用酸碱指示剂变色域附配制方法
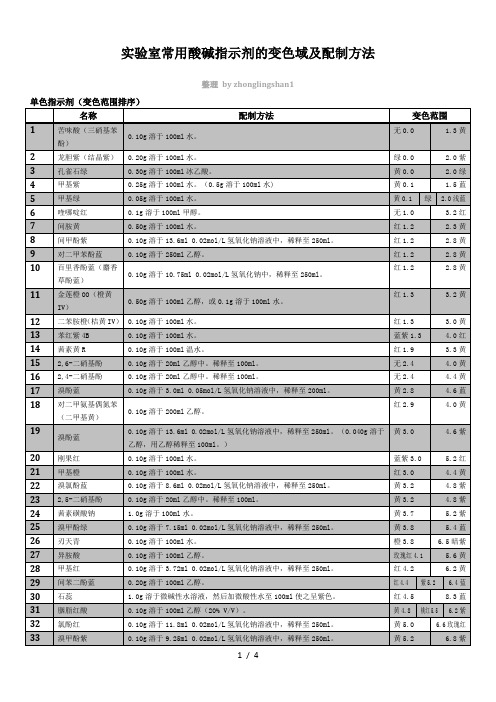
8.9粉红
53
百里香酚蓝(麝香草酚蓝)
0.10g溶于100ml乙醇。
黄8.0
9.6蓝
54
对二甲苯酚蓝
见8。
黄8.0
9.6蓝
55
酚酞
0.10g溶于60ml乙醇中,稀释至100ml。(GB603-881.0g溶于6100ml乙醇中)
无8.0
10.0红
56
邻甲酚酞
0.10g溶于250ml乙醇。
无8.2
8.0橙红
41
玫瑰酸
0.50g溶于50ml乙醇,稀释至100ml。
黄6.2
8.0红
42
中性红
0.10g溶于70ml乙醇中。稀释至100ml。
红6.8
8.0黄
43
苯酚红
0.10g溶于14.20ml 0.02mol/L氢氧化钠溶液中,稀释至250ml。
黄6.8
8.2红
44
树脂质酸(玫红酸)
1.0g溶于100ml乙醇(50% V/V)中。
1
黄
7.5
紫
1g/L酚红钠盐水溶液
1
31
1g/Lα-萘酚酞乙醇溶液
2
淡玫瑰
8.3
紫
1g/L甲酚红乙醇溶液
1
33
1g/Lα-萘酚酞乙醇溶液
1
淡玫瑰
8.9
紫
1g/L酚酞乙醇溶液
3
35*
1g/L酚酞乙醇溶液
1
绿
8.9
紫
1g/L甲基绿乙醇溶液
2
37
1g/L百里酚蓝50 %乙醇溶液
1
黄
9.0
紫
1g/L酚酞50%乙醇溶液
0.25g溶于100ml水。
无机化学 指示剂的变色范围

溴酚蓝 3.0~4.6 黄~蓝 0.1g指示剂溶于100mL20% 乙醇中
刚果红 3.0~5.2 蓝紫~红 1g?L-1水溶液
茜素红S
(第一变色范围) 3.7~5.2 黄~紫 1g?L-1水溶液
溴甲酚绿 3.8~5.4 黄~蓝 0.1g指示剂溶于100mL20%乙醇中
甲基绿 0.1~2.0 黄~绿~浅蓝 0.5g?L-1水溶液
孔雀绿
(第一变色范围) 0.13~2.0 黄~浅蓝~绿 1g?L-1水溶液
甲酚红
(第一变色范围) 0.2~1.8 红~黄 0.04g指示剂溶于100mL50%乙醇中
甲基紫
(第二变色范围) 1.0~1.5 绿~蓝 1g?L-1水溶液
酚酞 8.2~10.0 无色~紫红 (1)0.1g指示剂溶于100mL60%乙醇中 (2)1g酚酞溶于100mL90%乙醇中
百里酚酞 9.4~10.6 无色~蓝 0.1g指示剂溶于100mL90%乙醇中
茜素红S
(第二变色范围) 10.0~12.0 紫~淡黄 参看第一变色范围
茜素黄R
(第二变色范围) 10.1~12.1 黄~淡紫 1g?L-1水溶液
一份1g?L-1溴百里酚绿钠盐水溶液, 一份2g?L-1甲基橙水溶液 4.3 黄 蓝绿 pH3.5黄色 pH4.0黄绿色 pH4.3绿色
三份1g?L-1溴甲酚绿乙醇溶液 ,一份
2g?L-1甲基红乙醇溶液 5.1 酒红 绿
一份2g?L-1甲基红乙醇溶液 ,一份
1g?L-1次甲基蓝乙醇溶液 5.4 红紫 绿 pH5.2红紫 pH5.4暗蓝 pH5.6绿
1g?L-1次甲基蓝乙醇溶液 3.25 蓝紫 绿 pH3.2蓝紫色 pH3.4绿色
酸碱滴定法
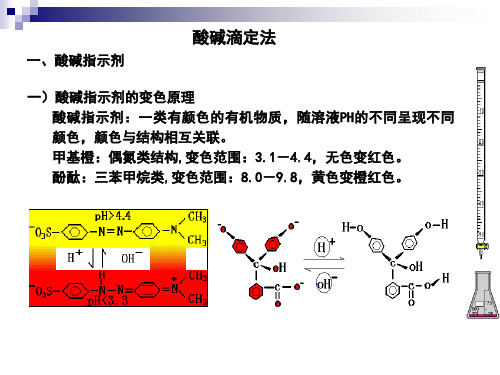
Na2CO3 的Kb1= 1.8×10-4 Kb2= 2.3×10-8
Cb •Kb1≥ 10-8 , 且Kb1 / Kb2 ≈ 104 。 因此,第一级能被准确、分步滴定(误差稍大)。 Cb/2 •Kb2≈10-9 如允许误差大,也可滴定 (2)化学计量点pH值的计算和指示剂的选择
第一级CO32-被完全滴定后,溶液组成NaHCO3两性物质
(pK a1 + pK a2 ) pH = = 8.34 2
当第二级HCO3-被完全滴定后,溶液组成H2CO3 饱和溶液,0.04mol/L
b. 滴定中 加入滴定剂体积为18.00mL时: [H+] = [(20.00-18.00)×10-3×0.1] /[(20.00+18.00)]×10-3 = 5.26×10-3 mol/L pH=2.28 加入滴定剂体积为19.98 mL时: [H+] = [(20.00-19.98)×10-3×0.1] /[(20.00+19.98)]×10-3 = 5.00×10-5 mol/L pH=4.30 c. 化学计量点 即加入滴定剂体积为 20.00mL [H+] = 1.0×10-7 mol/L pH=7.00 d. 化学计量点后 加入滴定剂体积为 20.02mL [OH-[= nNaOH / V= 5.0×10-5 mol / L pOH = 4.30 , pH= 9.70
化学计量点
b.指示剂变色点(滴定终点)
与化学计量点并不一定相同。 但相差不超过±0.02mL ,相对误
差不超过±0.1%。
(3) 影响滴定突跃的因素和指示剂的选择
不同浓度NaOH滴定不同浓度HCl时的滴定曲线。浓度越大突跃范围越大。
1.0 mol/L NaOH→1.0 mol/L HCL △pH=3.30~10.7 0
显色剂理论变色范围计算

显色剂理论变色范围计算
酸碱指示剂的理论变色范围的PH=PKa-1---PKa+1
理论变色点的PH=PKa
正式考试的时候题目应该会给你相关的信息,比如指示剂的Ka 指示剂变色的pH范围:
1、变色原理:以HIn表示指示剂
HIn
=H+
+In-
酸式型体
碱式型体
Ka为指示剂的解离常数
⑴、溶液的颜色是由[In-]/[HIn]的比值来决定的,随溶液的[H]的变化而变化。
⑵、当[In-]/[HIn]≤1/10
PH≤PKa-1
酸式色
当10>[In-]/[HIn]>1/10
PH在PKa±1之间
颜色逐渐变化的混合色
当[In-]/[HIn]≥10
PH≥PKa+1
碱式色
2、变色范围:当溶液的PH由PKa-1变化到PKa+1(或相反)时,才可以观察到指示剂由酸式色经混合色变化到碱性色,这一颜色变化的pH范围,即pH===pKa±1称为指示剂的变色范围。
3、理论变色点:当指示剂的酸式型体与碱式型体的浓度相等,即[In-]/[HIn]==1时,溶液的pH=pKa,称为指示剂的理论变色点。
酸碱指示剂的酸碱度范围和pH值的颜色变化描述

甲基橙指示剂
化学式:C14H11N2NaO3S
颜色变化:pH=3.1时黄色,pH=4.4时红色,pH=5.0时橙色
应用:广泛应用于酸碱滴定和pH值测量
特点:灵敏度高,颜色变化明显,易于观察
溴酚蓝指示剂
性质:是一种有机弱酸
酸碱度范围:pH=0-14
溴酚蓝指示剂的酸碱度范围
溴酚蓝指示剂是一种常见的酸碱指示剂,其酸碱度范围为pH 0-14。
在pH 0-6范围内,溴酚蓝指示剂呈现黄色。
在pH 6-7范围内,溴酚蓝指示剂呈现绿色。
在pH 7-14范围内,溴酚蓝指示剂呈现蓝色。
溴酚蓝指示剂的酸碱度范围广泛,可以应用于多种场合,如化学实验、环境监测等。
溴甲酚绿指示剂的酸碱度范围
在这个酸碱度范围内,溴甲酚绿指示剂的颜色会发生变化,具体表现为: - pH 4.0-5.0时,颜色为黄色。 - pH 5.0-6.0时,颜色为绿色。
- pH 4.0-5.0时,颜色为黄色。- pH 5.0-6.0时,颜色为绿色。
单击此处输入你的项正文文字是您思想的提炼,请尽量言简意赅的阐述观点
单击此处输入你的项正文文字是您思想的提炼,请尽量言简意赅的阐述观点
酸碱指示剂的pH值颜色变化描述
3
酚酞指示剂的pH值颜色变化描述
酚酞指示剂是一种常见的酸碱指示剂,其pH值颜色变化范围为8.2-10.0。
在pH值低于8.2时,酚酞指示剂呈现无色状态。
当pH值高于8.2时,酚酞指示剂开始呈现红色,随着pH值的升高,颜色逐渐加深,直至变为深红色。
溴酚蓝指示剂的pH值颜色变化描述
pH值范围:4.0-6.0
颜色变化:黄色到蓝色
实验室常用酸碱指示剂的变色域及配制方法

实验室常用酸碱指示剂的变色域及配制方法实验室中常用的酸碱指示剂有苏木精、酚酞、甲基红、溴蓝、品红、石蓝等。
这些指示剂在不同的pH值下会呈现不同的颜色,用于酸碱滴定等分析实验中。
下面将介绍这些酸碱指示剂的变色域及配制方法:
1.苏木精指示剂:
苏木精指示剂敏感区间为pH3.0-4.0,呈现黄色到红色。
苏木精指示剂的配制方法:将0.1克苏木精溶解于100毫升乙醇中。
2.酚酞指示剂:
酚酞指示剂敏感区间为pH6.8-8.2,呈现无色到红色。
酚酞指示剂的配制方法:将0.1克酚酞溶解在100毫升乙醇中。
3.甲基红指示剂:
甲基红指示剂敏感区间为pH4.2-6.3,呈现红色到黄色。
甲基红指示剂的配制方法:将0.1克甲基红溶解在100毫升乙醇中。
4.溴蓝指示剂:
溴蓝指示剂敏感区间为pH5.0-6.6,呈现黄色到蓝色。
溴蓝指示剂的配制方法:将0.1克溴蓝溶解在100毫升乙醇中。
5.品红指示剂:
品红指示剂敏感区间为pH5.0-5.8,呈现无色到紫红色。
品红指示剂的配制方法:将0.1克品红溶解在100毫升乙醇中。
6.石蓝指示剂:
石蓝指示剂敏感区间为pH10.0-12.5,呈现蓝色到蓝绿色。
石蓝指示剂的配制方法:将0.1克石蓝溶解在100毫升乙醇中。
以上所述的指示剂可以根据实验的需要进行配制和调配,在使用时可以按照实验要求配制合适浓度的酸碱指示剂溶液。
需要注意的是,配制和使用指示剂的过程中,要注意安全操作,避免接触指示剂溶液。
酸碱指示剂的酸碱变色范围及选择

酸碱指示剂的酸碱变色范围及选择酸碱指示剂的酸碱变色范围及选择酸碱指示剂是一种在酸碱溶液中,能够根据溶液的pH值发生颜色变化的化合物。
它在酸性、中性和碱性溶液中都有特定的变色范围。
正确选择酸碱指示剂对于准确检测溶液的酸碱性起着至关重要的作用。
本文将探讨酸碱指示剂的酸碱变色范围以及如何选择合适的酸碱指示剂。
一、酸碱指示剂的变色范围酸碱指示剂的变色范围取决于其分子结构中含有的酸碱性基团。
根据酸碱性基团的不同,酸碱指示剂可分为以下几类:1. 酚酞类指示剂:酚酞类指示剂在酸性溶液中呈无色,在碱性溶液中呈红色。
它的酸碱变色范围在pH值为8.2-10.0之间。
2. 酚红类指示剂:酚红类指示剂在酸性溶液中呈红色,在碱性溶液中呈黄色。
它的酸碱变色范围在pH值为6.0-8.0之间。
3. 甲基橙类指示剂:甲基橙类指示剂在酸性溶液中呈红色,在碱性溶液中呈黄色。
它的酸碱变色范围在pH值为3.1-4.4之间。
4. 甲基紫类指示剂:甲基紫类指示剂在酸性溶液中呈红色,在碱性溶液中呈蓝色。
它的酸碱变色范围在pH值为0.0-1.6之间。
5. 酸性紫蓝类指示剂:酸性紫蓝类指示剂在酸性溶液中呈红色,在碱性溶液中呈蓝色。
它的酸碱变色范围在pH值为4.5-6.2之间。
6. 酸性绿类指示剂:酸性绿类指示剂在酸性溶液中呈黄色,在碱性溶液中呈蓝色。
它的酸碱变色范围在pH值为1.0-3.8之间。
二、选择合适的酸碱指示剂选择合适的酸碱指示剂需要考虑以下几个因素:1. pH范围:根据被测溶液的pH范围选择适合的酸碱指示剂。
确保酸碱指示剂的酸碱变色范围覆盖被测溶液的pH值。
2. 变色幅度:不同的酸碱指示剂在变色时颜色的明暗程度不同,有些酸碱指示剂变色明显而有些变色相对较淡。
根据需要选择合适的变色幅度。
3. 可视性:选择一个颜色鲜明、易于观察的酸碱指示剂,以便准确判断溶液的酸碱性。
4. 相互干扰:一些酸碱指示剂在特定条件下可能会相互干扰,导致变色结果不准确。
常见指示剂

名称
离解平衡及颜色变化
配制方法
铬黑T(EBT)
H2In-(紫红)HIn(蓝)In(橙)
与NaCl 1:100
二甲酚橙(XO)
H3In-(黄)H2In(红)
0.5%乙醇或水溶液
K-B指示剂
H2In(红) HIn-(蓝) In2 (酒红)
0.2酸性铬蓝K和0.2萘酚绿B溶于水
钙指示剂
H2In-(酒红) HIn2(蓝) In-(酒红)
甲基红-溴甲酚绿
5.1
红-绿
3份0.1%溴甲酚绿乙醇溶液与1份0.1%甲基红乙醇溶液混合
二、氧化还原指示剂
名 称
变色pH范围
颜 色
配 制 方 法
氧化态
还原态
二苯胺1%
0.76
紫
无色
将1g二苯胺在搅拌下溶于100mL浓硫酸和100mL浓磷酸,储于棕色瓶中
二苯胺黄酸钠0.5%
0.85
紫
无色
将0.5g二苯胺黄酸钠溶于100mL水中,必要时过滤
5%乙醇溶液
吡啶偶氮萘酚(PAN)
H2In+(黄绿) HIn(黄) In-(淡红)
1%乙醇溶液
磺基水杨酸
H2In(红紫) HIn-(无色) In-(黄)
10%水溶液
酸性铬蓝K
红-蓝
0.1%乙醇溶液
PAR
红-黄
0.05%或0.2%水溶液
钙镁试剂
H2In-(红) HIn-(蓝) In-(红橙)
0.05%水溶液[2]
邻菲罗啉-Fe(Ⅱ)0.5%
1.06
淡蓝
红
将0.5gFeSO4·7H2O溶于100mL水中,加两滴硫酸,加0.5g邻菲罗啉
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
