锌锰电池PPT课件
合集下载
人教版高中化学选修四 化学电源 PPT课件

特点:比铅蓄电池耐用,可密封反复使用。
燃料电池汽车
四、燃料电池:
燃料电池是一种连续地将燃料和氧化剂的化学能 直接转换成电能的化学电池。(氢气、烃、肼、甲 醇、氨、煤气燃料电池……)
1、氢氧燃料电池
中性 负极: 2H2-4e-==4H+ 正极: O2+2H2O+4e-==4OH总反应: 2H2+O2==2H2O
负极 4Al-12e-=4Al3+ 正极 3O2+6H2O+12e-=12OH总反应式: 4Al+3O2+6H2O=4Al(OH)3
练习6: 碱性电池具有容量大、放电电流大的特点,因而 得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液, 电流总反应式为:
Zns+2MnO2s+H2Ol=ZnOH2s+Mn2O3s
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4
放电 充电
2PbSO4+2H2O
优点: 可重复使用、电压稳定、使用方便、安全可靠、 价格低廉 缺点: 比能量低、笨重、废弃电池污染环境
➢其它二次电池
镍镉电池、镍氢电池、银锌电池、锂离子电 池……
2、银锌蓄电池
正极壳填充Ag2O和石墨,负极盖填充锌汞 合金,电解质溶液KOH溶液。反应式为: 2Ag+Zn(OH充)放2 电电 Zn+Ag2O+H2O 写出放电时的电极反应式。
Zn + 2MnO2 + 2NH4+ = Zn2++Mn2O3 + 2NH3 + H2O
优点:制作简单、价格便宜。 缺点:放电时间短,电压下降快。
2、碱性锌-锰干电池
电池反应: Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2 负极:(Zn)
燃料电池汽车
四、燃料电池:
燃料电池是一种连续地将燃料和氧化剂的化学能 直接转换成电能的化学电池。(氢气、烃、肼、甲 醇、氨、煤气燃料电池……)
1、氢氧燃料电池
中性 负极: 2H2-4e-==4H+ 正极: O2+2H2O+4e-==4OH总反应: 2H2+O2==2H2O
负极 4Al-12e-=4Al3+ 正极 3O2+6H2O+12e-=12OH总反应式: 4Al+3O2+6H2O=4Al(OH)3
练习6: 碱性电池具有容量大、放电电流大的特点,因而 得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液, 电流总反应式为:
Zns+2MnO2s+H2Ol=ZnOH2s+Mn2O3s
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4
放电 充电
2PbSO4+2H2O
优点: 可重复使用、电压稳定、使用方便、安全可靠、 价格低廉 缺点: 比能量低、笨重、废弃电池污染环境
➢其它二次电池
镍镉电池、镍氢电池、银锌电池、锂离子电 池……
2、银锌蓄电池
正极壳填充Ag2O和石墨,负极盖填充锌汞 合金,电解质溶液KOH溶液。反应式为: 2Ag+Zn(OH充)放2 电电 Zn+Ag2O+H2O 写出放电时的电极反应式。
Zn + 2MnO2 + 2NH4+ = Zn2++Mn2O3 + 2NH3 + H2O
优点:制作简单、价格便宜。 缺点:放电时间短,电压下降快。
2、碱性锌-锰干电池
电池反应: Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2 负极:(Zn)
各种各样的电池PPT课件

• 如果一节一号电池在地里腐烂,它的有 毒物质能使一平方米的土地失去使用价 值;扔一粒纽扣电池进水里,它其中所 含的有毒物质会造成60万升水体的污染 相当于一个人一生的用水量 ;
当然有联系啦。 废电池中的主要成分是铅或其它的重金属。一个小小的五号电池, 报废后仍到地里,可以污染一个平方米的土地,通过土地,铅或 重金属可以进入食物链,人体吸收过多的铅会造成思维迟钝、反 应减慢等等一系列的后果。 在上世纪70~80年代以前,人们都知道在汽油中加入铅可以使汽 车更有力,因此当时的汽油全部都是含铅汽油。经过几十年使用 有铅汽油,通过汽车的尾气,有些国家就发现马路两边的土地中 的铅含量严重超标。有些小孩在公路边玩耍,通过接触泥土和吸 入尾气,造成智力发育的障碍。这就是为什么现在全球大部分地 区都不再允许使用有铅汽油的原因。 由此可见,废电池的危害主要是对环境的危害,最后是对人类的 危害。为了保护人类的生存环境和人类自身的安全,请不要随意 扔弃每一个废电池。
,其蒸气无色无味,比空气重七倍。汞及其化合物毒性都很大,特别是汞的有机化合物毒性更大。鱼在含汞量 0.01-0.02毫克/升的水中生活就会中毒;人若食用0.1克汞就会中毒致死。汞及其化合物可通过呼吸道、皮肤 或消化道等不同途径侵入人体。当汞进入人体后,即集聚于肝、肾、大脑、心脏和骨髓等部位,造成神经性中 毒和深部组织病变,引起疲倦,头晕、颤抖、牙龈出血、秃发、手脚麻痹、神经衰弱等症状,甚至会出现精神 混乱,进而疯狂痉挛致死。有机汞还能进入胎盘,使胎儿先天性汞中毒,或畸形,或痴呆。汞的毒性是积累性 的,往往要几年或十几年才能反应出来。食物链对汞有相当大的富集能力。如淡水鱼和浮游植物对汞的富集倍 数为一千,淡水无脊椎动物为十万,海洋植物为一百,海洋动物为二十万。食用被汞污染的水产品,产生甲基 汞中毒,关.头晕,四肢末梢麻木,记忆力减退,神经错乱,甚至死亡,还影响孕妇胎儿畸形。 家庭中常用 的水银体温计,就很危险!
第二讲 锌锰电池

(3)大电流连续放电其容量是酸性锌锰电池 的5倍左右;
(4)贮存寿命长。
碱性锌锰电池
表示。用于大电流放电和连续使用的用电器具,如放录机、BP机、 照相机、电动玩具等。根据电池中汞含量的高低,分为含汞电池、 低汞电池和无汞电池。 扣式电池采用电解二氧化锰与石墨混合压成片状正极,氢氧化 钾水溶液作电解液,锌粉压成片状作负极,正负极间用隔膜隔开。
锌离子的存在形式
pH值
电液导电能力
大,正极极化大
好
小电流间放
不好
大电流连放、防漏性能好
结论
中性锌锰电池:
一、将旧电池拆开,按物质初 类,并了解电池的构造。基本原理 中性锌锰电池结构 下:
)Zn NH4Cl ZnCl2 MnO2 , C(
铜帽 封蜡 锌筒 多孔纸 石墨电极
NH4Cl 和 MnO2
锌负极的自放电
○ 锌电极产生自放电的原因
氢离子的阴极还原所引起的锌的自放电
氧的阴极还原所引起的锌电极的自放电 电解液中的杂质所引起的锌电极的自放电
○ 引起锌电极自放电的主要原因是氢的阴极析出所引起
的锌的腐蚀,即析氢腐蚀
○ 影响锌电极自放电的因素
锌的纯度及表面均匀性的影响 溶液pH 值的影响 电液中NH4Cl、ZnCl2浓度对自放电的影响 温度的影响
水蒸气压/Pa 2933 2340
Zn2+离子状态 [Zn(H2O)]2+ [ZnCl4]2—
两电池比较
差异 氯化铵型 氯化锌型
好,不容易漏液
反应式不同
蒸气压 产物不同
无水生成和消耗 消耗大量的水,防漏性能
低
Zn(NH3)2Cl2, 致密而坚硬的沉淀 ,小电流间放 负离子,负极极化大 高,密封要求高 ZnCl2· 4 ZnO· 5 H2 O, 水泥效应,大电流连放 正离子,负极极化小 小,正极极化小
第章锌锰电池PPT课件
电极的总反应为: MnO2+4H++2e- Mn2++2H2O
2).水锰石在碱性溶液中的转移—固相质子扩散
• MnOOH只能靠固相中的质子扩散来转移。 “特殊”浓差极化或固相浓差极化。
3). 水锰石在中性溶液中的转移—混合方式
• 有 43 %的 MnOOH 是通过歧化反应来转移的, 有57%是通过固相扩散来转移的。
• • • • • 负极自放电(主要) 电液干涸 气胀 冒浆 铜冒生锈
2.6 糊式锌-锰电池
• • • • • • • 2.6.2 制造工艺及分析 一、生产流程 碳棒的制造 正极电芯的制造 负极锌筒的制造 电液及电糊的配制 装配
二、碳棒的制造
• 正极电芯的集流体,传导电流
三、正极的制造
拌粉、成型(打电芯)和包纸扎线等工序 • 1).拌粉
2. MnO2电极 阴极还原的次级过程
• MnOOH转移步骤即二次过程是整个MnO2阴极还原 的控制步骤
1). 水锰石在酸性溶液中的转移—歧化反应: 在酸性溶液中,MnO2放电的一次过程为: 2MnOOH 2MnO2+2H++2e-
歧化反应: 2MnOOH+2H+
MnO2+Mn2++2H2O
锌锰干电池
• 1868年 Leclanche发明 以NH4Cl为电解液 的Zn-MnO2电池 • 1888年Gassner 成功构成干电池 并商品化
氯化铵型电e dioxide)
电池组成 (-)Zn/KOH(aq) /MnO2(+) 额定电压:1.5V 可制成二次电池
2+ Zn+2e Zn + 2H +2e H2
《普通锌锰电池》课件

《普通锌锰电池》 PPT课件
contents
目录
• 锌锰电池简介 • 锌锰电池的工作原理 • 锌锰电池的制造工艺 • 锌锰电池的优缺点 • 锌锰电池的应用场景 • 未来展望与研究方向
01
锌锰电池简介
定义与特点
定义
锌锰电池是一种以二氧化锰为正 极,锌为负极的原电池。
特点
价格便宜、携带方便、使用广泛 ,是日常生活中最常见的电池之 一。
对环境不友好
锌锰电池对环境有一定的 影响,例如锌锰电池中的 重金属会对土壤和水源造 成污染。
性能比较
续航时间
安全性
与其他类型的电池相比,锌锰电池的 续航时间较短,不适合长时间使用的 设备。
相对于锂电池而言,锌锰电池的安全 性较高,不易发生燃烧或爆炸等危险 情况。
充电方式
锌锰电池只能通过直流电源进行充电 ,而不能像锂电池那样支持快速充电 。
内阻测试
通过测量电池的内阻,评估电 池的性能。
容量测试
通过放电实验,测量电池的实 际容量,了解电池的储能性能
。
循环寿命测试
通过模拟实际使用情况,对电 池进行充放电循环实验,评估
电池的循环寿命。
04
锌锰电池的优缺点
优点
01
02
03
可靠性高
锌锰电池结构稳定,不易 发生泄漏或变形,因此可 靠性较高。
电压稳定
03
锌锰电池的制造工艺
材料准备
锌粉
作为电池的负极材料, 需要确保纯度高、粒度 适中,以便具有良好的
电化学性能。
锰氧化物
作为电池的正极材料, 通常选用二氧化锰,具 有较高的电化学活性。
电解液
通常选用氯化铵和氯化 锌的水溶液,能够提供
contents
目录
• 锌锰电池简介 • 锌锰电池的工作原理 • 锌锰电池的制造工艺 • 锌锰电池的优缺点 • 锌锰电池的应用场景 • 未来展望与研究方向
01
锌锰电池简介
定义与特点
定义
锌锰电池是一种以二氧化锰为正 极,锌为负极的原电池。
特点
价格便宜、携带方便、使用广泛 ,是日常生活中最常见的电池之 一。
对环境不友好
锌锰电池对环境有一定的 影响,例如锌锰电池中的 重金属会对土壤和水源造 成污染。
性能比较
续航时间
安全性
与其他类型的电池相比,锌锰电池的 续航时间较短,不适合长时间使用的 设备。
相对于锂电池而言,锌锰电池的安全 性较高,不易发生燃烧或爆炸等危险 情况。
充电方式
锌锰电池只能通过直流电源进行充电 ,而不能像锂电池那样支持快速充电 。
内阻测试
通过测量电池的内阻,评估电 池的性能。
容量测试
通过放电实验,测量电池的实 际容量,了解电池的储能性能
。
循环寿命测试
通过模拟实际使用情况,对电 池进行充放电循环实验,评估
电池的循环寿命。
04
锌锰电池的优缺点
优点
01
02
03
可靠性高
锌锰电池结构稳定,不易 发生泄漏或变形,因此可 靠性较高。
电压稳定
03
锌锰电池的制造工艺
材料准备
锌粉
作为电池的负极材料, 需要确保纯度高、粒度 适中,以便具有良好的
电化学性能。
锰氧化物
作为电池的正极材料, 通常选用二氧化锰,具 有较高的电化学活性。
电解液
通常选用氯化铵和氯化 锌的水溶液,能够提供
第二章 锌锰电池

代汞缓蚀剂的要求
能有效地抑制锌的腐蚀
耐碱性电解液的腐蚀 对锌粉电极无不良影响
(Al? Ni?)
有害元素或杂质含量低 材料成本增加不明显
(Au?Pt?)
在锌电极中加入代汞金属元素 的方法(合金化)
直接在高纯锌中添加代汞元素,通
过共熔制造锌合金粉 把代汞金属(和化合物)添加在电解 质溶液中,通过置换反应使微量代 汞金属元素沉积在金属锌粉的表面, 从而改变锌电极的表面性能
三、有机缓蚀剂
有机缓蚀剂一般为非离子型表面活
性剂(共价型,C、H、N、O、S等, 一般不含金属。) 分子一端是极性基团,另一端为非 极性基团 连接两个基团的一般有-NH-,-S-, -COO-,-CON-,-SON-等
有机缓蚀剂的种类
聚乙二醇衍生物 芳烃衍生物
聚乙烯氧化物
胺类及肟类
亚乙基二醇类
碱性锌锰电池
按外形 分类
中性和 酸性锌 锰电池
碱性锌 锰电池
筒式 迭层式 薄层纸式 筒式
扣式
扁平式
2.1.1 勒克朗谢电池
( ) Zn NH 4 Cl, ZnCl 2 MnO 2 C( )
正极活性物质用天然MnO2(70~75%)
负极活性物质用Zn筒
隔膜为淀粉糨糊隔离层(糊状物)
锌电 极分 类
2.2.1 锌电极类型
锌筒
片状锌 锌合金粉
汞齐锌粉
无汞齐锌粉
无铅 锌粉
有铅 锌粉
几种电池中的锌电极 (1) 勒克朗谢电池中的锌电极
典型的电解液为4.96M
ZnCl2。 电池在放电和储存过程中,会发生析 氢反应,氢离子浓度降低,pH值不断 升高,在pH为5.1-5.8时,锌以离子进 入溶液,在5.8-7.9范围时,锌表面产 生不溶性ZnCl2.2NH3晶体,在大于7.9 时, ZnCl2.2NH3晶体会溶解产生 Zn(NH3)42+。
碱性锌锰电池全解PPT课件

第11页/共19页
3 锌负极
金属锌是电池的负极活性物质。
锌电极的阳极氧化过程
在以KOH溶液中(碱性电池) Zn + 2OH− − 2e− → Zn(OH)2 ⇌ ZnO + H2O
锌负极自放电(电池自放电的主要来源)
锌电极产生自放电的原因 ➢ 氢离子的阴极还原所引起的锌的自放电(主因) ➢ 氧的阴极还原所引起的锌电极的自放电 ➢ 电解液中的杂质所引起的锌电极的自放电
天然MnO2
电解MnO2车间 电解MnO2粉体
第8页/共19页
2 二氧化锰正极
二氧化锰电极反应
目前公认二氧化锰电极反应有两个:
MnO2 4H 2e Mn2 2H2O (2-1) MnO2 H2O e MnOOH OH (2-2)
通过对产物的分析,表明Mn2+是少量的,Mn3+化合物MnOOH 是主要的,所以(2-2)式是主要反应。
铵型电池
(pH=5.4) 中性电池
糊式电池(普通型) 纸板电池(高容量)
锌型电池 纸板电池(高功率) (pH=4.6)
一次碱性电池 碱性电池
二次碱性电池
第5页/共19页
1 锌锰电池概述
碱性锌锰电池
正极:电解MnO2粉 负极:锌粉 电解液:KOH水溶液 其放电时间大约是同类糊式电池的5~7倍。 电池符号: (-) Zn|KOH|MnO2 (+)
在民用领域有很强的竞争力,侧重于小 电流或间歇方式供电。
第3页/共19页
1 锌锰电池概述
锌锰电池是法国科学家Leclanche于1968年发明的。
锌棒
碳棒
MnO2粉 +碳粉
多孔 陶瓷管
玻璃瓶
Leclanche电池结构图
3 锌负极
金属锌是电池的负极活性物质。
锌电极的阳极氧化过程
在以KOH溶液中(碱性电池) Zn + 2OH− − 2e− → Zn(OH)2 ⇌ ZnO + H2O
锌负极自放电(电池自放电的主要来源)
锌电极产生自放电的原因 ➢ 氢离子的阴极还原所引起的锌的自放电(主因) ➢ 氧的阴极还原所引起的锌电极的自放电 ➢ 电解液中的杂质所引起的锌电极的自放电
天然MnO2
电解MnO2车间 电解MnO2粉体
第8页/共19页
2 二氧化锰正极
二氧化锰电极反应
目前公认二氧化锰电极反应有两个:
MnO2 4H 2e Mn2 2H2O (2-1) MnO2 H2O e MnOOH OH (2-2)
通过对产物的分析,表明Mn2+是少量的,Mn3+化合物MnOOH 是主要的,所以(2-2)式是主要反应。
铵型电池
(pH=5.4) 中性电池
糊式电池(普通型) 纸板电池(高容量)
锌型电池 纸板电池(高功率) (pH=4.6)
一次碱性电池 碱性电池
二次碱性电池
第5页/共19页
1 锌锰电池概述
碱性锌锰电池
正极:电解MnO2粉 负极:锌粉 电解液:KOH水溶液 其放电时间大约是同类糊式电池的5~7倍。 电池符号: (-) Zn|KOH|MnO2 (+)
在民用领域有很强的竞争力,侧重于小 电流或间歇方式供电。
第3页/共19页
1 锌锰电池概述
锌锰电池是法国科学家Leclanche于1968年发明的。
锌棒
碳棒
MnO2粉 +碳粉
多孔 陶瓷管
玻璃瓶
Leclanche电池结构图
普通锌锰电池

普通锌锰电池
碱性电池 镍 镉 电 池 锂离子电池
第二节 化学电源
小型高性能燃料电池 镍氢电池
锂电池
干电池
叠层电池
各类电池
纽扣电池
化学电源的分类: 化学电源的分类: 一次电池、二次电池和燃料电池等。 一次电池、二次电池和燃料电池等。 一次电池的活性物质消耗到一定程度就 一次电池的活性物质消耗到一定程度就 不能再用了,如普通锌锰干电池、碱性 不能再用了,如普通锌锰干电池、 锌锰干电池; 锌锰干电池; 二次电池又称充电电池或蓄电池,放电 二次电池又称充电电池或蓄电池, 又称充电电池或蓄电池 后再充电可以使活性物质再生,这类电 后再充电可以使活性物质再生, 池可多次重复使用。 池可多次重复使用。
二次电池
燃料电池
祝同学们学习进步 再见
熔融盐燃料电Leabharlann 具有高的发电效率, 熔融盐燃料电池具有高的发电效率,因而受到 重视,可用 重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解 为阳极燃气, 质,CO为阳极燃气,空气与 为阳极燃气 空气与CO2的混合气体为阴极 助燃气,制得在 助燃气,制得在650℃下工作的燃料电池,完成有关 ℃下工作的燃料电池, 的电池反应式: 的电池反应式:
银锌电池
1970-1975, 开发了先进的银锌、镍镉电池技术。 1975开发了先进的银锌、镍镉电池技术。 1983, 为美国海军生产潜水艇用银锌电池。 1979-1987,为 为美国海军生产潜水艇用银锌电池。 为 美国国家能源部发展电动车用的镍锌电池。 美国国家能源部发展电动车用的镍锌电池。 1998-1992, 为美国海军发展世界上最大的镍镉电池用于核潜水艇。 为美国海军发展世界上最大的镍镉电池用于核潜水艇。
教材106页 研究性课题(教材 页)
碱性电池 镍 镉 电 池 锂离子电池
第二节 化学电源
小型高性能燃料电池 镍氢电池
锂电池
干电池
叠层电池
各类电池
纽扣电池
化学电源的分类: 化学电源的分类: 一次电池、二次电池和燃料电池等。 一次电池、二次电池和燃料电池等。 一次电池的活性物质消耗到一定程度就 一次电池的活性物质消耗到一定程度就 不能再用了,如普通锌锰干电池、碱性 不能再用了,如普通锌锰干电池、 锌锰干电池; 锌锰干电池; 二次电池又称充电电池或蓄电池,放电 二次电池又称充电电池或蓄电池, 又称充电电池或蓄电池 后再充电可以使活性物质再生,这类电 后再充电可以使活性物质再生, 池可多次重复使用。 池可多次重复使用。
二次电池
燃料电池
祝同学们学习进步 再见
熔融盐燃料电Leabharlann 具有高的发电效率, 熔融盐燃料电池具有高的发电效率,因而受到 重视,可用 重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解 为阳极燃气, 质,CO为阳极燃气,空气与 为阳极燃气 空气与CO2的混合气体为阴极 助燃气,制得在 助燃气,制得在650℃下工作的燃料电池,完成有关 ℃下工作的燃料电池, 的电池反应式: 的电池反应式:
银锌电池
1970-1975, 开发了先进的银锌、镍镉电池技术。 1975开发了先进的银锌、镍镉电池技术。 1983, 为美国海军生产潜水艇用银锌电池。 1979-1987,为 为美国海军生产潜水艇用银锌电池。 为 美国国家能源部发展电动车用的镍锌电池。 美国国家能源部发展电动车用的镍锌电池。 1998-1992, 为美国海军发展世界上最大的镍镉电池用于核潜水艇。 为美国海军发展世界上最大的镍镉电池用于核潜水艇。
教材106页 研究性课题(教材 页)
锌锰电池.完美版PPT

我国生产的主要是低档次的酸性糊式 普通锌锰电池。2004年,总产量为150 亿只,约占世界总产量的1/3。
目前正在争取年生产碱性锌锰电池50 亿只,以达到世界总产量的1/3。
锌锰电池的优点
使用方便,安全。 原料来源丰富,价格低廉。(Zn、
MnO2) 可以以中等电流密度放电。 储存寿命较长。
2Mn2O 2H2e 2MnOOH
电池的总反应:
Z n 2 N4 C H 2 lM2 nZ O (N n3 )2 H C 2 l 2 Mn
如何提高干电池的性能:
采用MnO2含量为91~93%的电 解二氧化锰代替天然二氧化锰后, 放电容量和时间比干电池提高1.5~2 倍,称为高性能锌锰电池。
2型纸板电池
()Zn KOM Hn2O C()
负极采用汞齐化锌粉,可以抑制 锌的腐蚀(减轻自放电)
用KOH作电解质 电池性能较好,是同类糊式电池
的5~8倍
碱性锌锰电池的特点
负极
采用与普通锌锰电池相反的电极结构, 增大了正负极间的正相极对面积,采用高导 电性的碱性电解液,正负极采用高能电 极材料,所以,碱锰电池的容量和放电 时间是同等型号普通电池的5~8倍,低 温性能两者差距更大,碱锰电池更耐低 温,而且更适合于大电流放电和要求工 作电压比较稳定的用电场合。
此外,高电流密度下锌电极会发生钝化,
也会严重影响锌电极的反应性能。
一般,随着锌电极的阳极溶解,锌酸根
的浓度逐渐增大,并趋于饱和,电极表面开 始生成疏松的ZnO或Zn(OH)2,从而减小了 反应的有效表面积,使局部的极化增大,直 到出现钝化现象。
碱液很多,ZnO不饱和 碱液少,ZnO饱和了
防止锌电极外钝化的有效措施是
控制电流密度和改善物质的传递条件, 如采用多孔电极等。
目前正在争取年生产碱性锌锰电池50 亿只,以达到世界总产量的1/3。
锌锰电池的优点
使用方便,安全。 原料来源丰富,价格低廉。(Zn、
MnO2) 可以以中等电流密度放电。 储存寿命较长。
2Mn2O 2H2e 2MnOOH
电池的总反应:
Z n 2 N4 C H 2 lM2 nZ O (N n3 )2 H C 2 l 2 Mn
如何提高干电池的性能:
采用MnO2含量为91~93%的电 解二氧化锰代替天然二氧化锰后, 放电容量和时间比干电池提高1.5~2 倍,称为高性能锌锰电池。
2型纸板电池
()Zn KOM Hn2O C()
负极采用汞齐化锌粉,可以抑制 锌的腐蚀(减轻自放电)
用KOH作电解质 电池性能较好,是同类糊式电池
的5~8倍
碱性锌锰电池的特点
负极
采用与普通锌锰电池相反的电极结构, 增大了正负极间的正相极对面积,采用高导 电性的碱性电解液,正负极采用高能电 极材料,所以,碱锰电池的容量和放电 时间是同等型号普通电池的5~8倍,低 温性能两者差距更大,碱锰电池更耐低 温,而且更适合于大电流放电和要求工 作电压比较稳定的用电场合。
此外,高电流密度下锌电极会发生钝化,
也会严重影响锌电极的反应性能。
一般,随着锌电极的阳极溶解,锌酸根
的浓度逐渐增大,并趋于饱和,电极表面开 始生成疏松的ZnO或Zn(OH)2,从而减小了 反应的有效表面积,使局部的极化增大,直 到出现钝化现象。
碱液很多,ZnO不饱和 碱液少,ZnO饱和了
防止锌电极外钝化的有效措施是
控制电流密度和改善物质的传递条件, 如采用多孔电极等。
锌锰电池PPT课件

第1页/共32页
•
本章重点:
• 正极:二氧化锰的反应机理
• 负极:锌电极的自放电、引起自放电的原因和降低自放电的措施。
• 电池反应和性能:两类中性电池的比较、中性电池与碱性电池的比较
第2页/共32页
一、 概述
(-)Zn|
|MnO2(+)
• 锌锰电池的分类
中性锌锰电池 NH4Cl+ZnCl2的水溶液
铵型电池 Zn+2NH4Cl+2MnO2→Zn(NH3)2Cl2↓+2 MnOOH
锌型电池 4Zn+9H2O+ZnCl2+8MnO2 →8MnOOH+ZnCl2·4 ZnO·5 H2O
电液类型 电导率/S∙m-1
pH值 水蒸气压/Pa
Zn2+离子状态
氯化锌型
15
氯化铵型
43
4.6
2933
[Zn(H2O)]2+
+H2O
第18页/共32页
• Zn-MnO2电池的电性能 • 开路电压
不同情况下,Zn-MnO2电池的开路电压在1.5 -1.8V左右。 负极Zn的稳定电位大约在-0.8V左右。 正极稳定电位一般在0.7-1.0之间。
第19页/共32页
• 工作电压 1. 极化主要是来自于正极 2. 电压的恢复特性
电池内阻减小放电电流增大第26页共32页第27页共32页两种类型电池的比较铵型电池zn2nh2mnooh锌型电池4zn9h电液类型电导率sm1ph值水蒸气压pazn离子状态氯化锌型氯化铵型1543465429332340znh差异氯化铵型氯化锌型反应式不同无水生成和消耗消耗大量的水防漏性能好不容易漏液蒸气压密封要求高产物不同znnh致密而坚硬的沉淀zncl水泥效应小电流间放大电流连放锌离子的存在形式负离子正离子负极极化大负极极化小ph值正极极化大正极极化小电液导电能力不好结论小电流间放大电流连放防漏性能好第28页共32页放电性能好
•
本章重点:
• 正极:二氧化锰的反应机理
• 负极:锌电极的自放电、引起自放电的原因和降低自放电的措施。
• 电池反应和性能:两类中性电池的比较、中性电池与碱性电池的比较
第2页/共32页
一、 概述
(-)Zn|
|MnO2(+)
• 锌锰电池的分类
中性锌锰电池 NH4Cl+ZnCl2的水溶液
铵型电池 Zn+2NH4Cl+2MnO2→Zn(NH3)2Cl2↓+2 MnOOH
锌型电池 4Zn+9H2O+ZnCl2+8MnO2 →8MnOOH+ZnCl2·4 ZnO·5 H2O
电液类型 电导率/S∙m-1
pH值 水蒸气压/Pa
Zn2+离子状态
氯化锌型
15
氯化铵型
43
4.6
2933
[Zn(H2O)]2+
+H2O
第18页/共32页
• Zn-MnO2电池的电性能 • 开路电压
不同情况下,Zn-MnO2电池的开路电压在1.5 -1.8V左右。 负极Zn的稳定电位大约在-0.8V左右。 正极稳定电位一般在0.7-1.0之间。
第19页/共32页
• 工作电压 1. 极化主要是来自于正极 2. 电压的恢复特性
电池内阻减小放电电流增大第26页共32页第27页共32页两种类型电池的比较铵型电池zn2nh2mnooh锌型电池4zn9h电液类型电导率sm1ph值水蒸气压pazn离子状态氯化锌型氯化铵型1543465429332340znh差异氯化铵型氯化锌型反应式不同无水生成和消耗消耗大量的水防漏性能好不容易漏液蒸气压密封要求高产物不同znnh致密而坚硬的沉淀zncl水泥效应小电流间放大电流连放锌离子的存在形式负离子正离子负极极化大负极极化小ph值正极极化大正极极化小电液导电能力不好结论小电流间放大电流连放防漏性能好第28页共32页放电性能好
第2章1腐蚀的电化学基础电化学腐蚀热力学ppt课件

O2 + H2O + 4e → 4OH电子由阳极区提供,产生的OH-使pH值升高,酚酞显示出粉红色。 在浓差的推动下,Fe2+和OH—相互扩散,在水滴中部出现棕黄色的铁锈。
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
第二章 腐蚀的电化学基础电化学腐蚀热力学
§2.1 腐蚀原电池
蓝色、阳极
氧化反应; 正极(Anode): 电势高,电子流入,发生
还原反应。
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
例2. 原电池 锌锰干电池结构
NH4Cl, ZnCl2和MnO2 浆状物 正极:石墨 (带铜帽) 负极:锌(外壳)
棕色、铁锈
蓝色、阳极 红色、阴极
第二章 腐蚀的电化学基础电化学腐蚀热力学
§2.1 腐蚀原电池
使用的指示剂的浓度应尽可能低,否则会干扰上述的电极过程。
2Fe - 4e → Fe2+ 阴极过程:4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
例如,过多的K3[Fe(CN)6],可能发生Fe(CN)63-的还原,消耗 电子,提供阴极过程,而K3[Fe(CN)6]2的沉淀在阳极区,也可能使氧更 难于进入,加速阳极过程。因此K3[Fe(CN)6]的浓度应尽可能低,最好 只显示兰色而无沉淀。
溶解 氧化反应、阳极
氢气析出 还原反应、阴极
将Zn和Cu放入稀硫酸中并用导线相互连接,
就构成Zn-Cu原电池。于是在Zn电极上发生Zn
的溶解,而在Cu电极上析出氢气,两电极间有
电流流动。在电池作用中发生金属氧化反应的
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
第二章 腐蚀的电化学基础电化学腐蚀热力学
§2.1 腐蚀原电池
蓝色、阳极
氧化反应; 正极(Anode): 电势高,电子流入,发生
还原反应。
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
例2. 原电池 锌锰干电池结构
NH4Cl, ZnCl2和MnO2 浆状物 正极:石墨 (带铜帽) 负极:锌(外壳)
棕色、铁锈
蓝色、阳极 红色、阴极
第二章 腐蚀的电化学基础电化学腐蚀热力学
§2.1 腐蚀原电池
使用的指示剂的浓度应尽可能低,否则会干扰上述的电极过程。
2Fe - 4e → Fe2+ 阴极过程:4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
例如,过多的K3[Fe(CN)6],可能发生Fe(CN)63-的还原,消耗 电子,提供阴极过程,而K3[Fe(CN)6]2的沉淀在阳极区,也可能使氧更 难于进入,加速阳极过程。因此K3[Fe(CN)6]的浓度应尽可能低,最好 只显示兰色而无沉淀。
溶解 氧化反应、阳极
氢气析出 还原反应、阴极
将Zn和Cu放入稀硫酸中并用导线相互连接,
就构成Zn-Cu原电池。于是在Zn电极上发生Zn
的溶解,而在Cu电极上析出氢气,两电极间有
电流流动。在电池作用中发生金属氧化反应的
锌锰干电池的电极反应负极

02
它由锌筒、电解液、碳棒和二氧 化锰组成,其中锌是负极,碳棒 是正极。
锌锰干电池的结构
锌锰干电池的结构相对 简单,主要包括锌筒、 二氧化锰、碳棒和电解
质溶液。
01
二氧化锰是电池的正极 材料,通常与碳粉混合 制成糊状物质,涂在碳
棒上。
03
电解质溶液通常为氯化 铵和氯化锌的水溶液, 起着传递离子的作用。
通过优化电解质的浓度、组成和添加物等参数,可以进一步 提高电极的反应速率和稳定性。例如,在电解质中添加某些 添加剂可以改善电极表面的电化学行为,提高电极的循环寿 命和稳定性。
负极材料的改性
负极材料的改性可以通过物理或化学方法实现,以提高电极的反应活性和稳定性。常用的改性方法包 括表面涂覆、掺杂、合金化等。这些改性方法可以改变电极表面的形貌、组成和结构,提高电极的反 应活性、耐腐蚀性和稳定性。
负极材料的改性还可以通过调整材料的颗粒大小、孔隙率等参数来实现。这些参数对电极的电化学性 能和充放电过程中的反应动力学具有重要影响。通过优化这些参数,可以提高电极的反应速率和容量 ,同时改善电极的循环寿命和稳定性。
05 负极反应的影响因素
CHAPTER
温度的影响
温度升高,负极反应速率加快
随着温度的升高,电极表面的化学反应活化能增加,使得反应更容易进行,负极反应速 率相应加快。
开发回收技术
研究高效的电池回收技术, 将废旧电池中的有价金属 和材料进行分离和提纯, 实现资源的循环利用。
制定相关政策
制定相关政策鼓励电池回 收和再利用产业的发展, 提高环保意识和社会责任 感。
谢谢
THANKS
来源
锌主要来源于闪锌矿(ZnS)和菱锌矿(ZnCO₃)。
制备方法
它由锌筒、电解液、碳棒和二氧 化锰组成,其中锌是负极,碳棒 是正极。
锌锰干电池的结构
锌锰干电池的结构相对 简单,主要包括锌筒、 二氧化锰、碳棒和电解
质溶液。
01
二氧化锰是电池的正极 材料,通常与碳粉混合 制成糊状物质,涂在碳
棒上。
03
电解质溶液通常为氯化 铵和氯化锌的水溶液, 起着传递离子的作用。
通过优化电解质的浓度、组成和添加物等参数,可以进一步 提高电极的反应速率和稳定性。例如,在电解质中添加某些 添加剂可以改善电极表面的电化学行为,提高电极的循环寿 命和稳定性。
负极材料的改性
负极材料的改性可以通过物理或化学方法实现,以提高电极的反应活性和稳定性。常用的改性方法包 括表面涂覆、掺杂、合金化等。这些改性方法可以改变电极表面的形貌、组成和结构,提高电极的反 应活性、耐腐蚀性和稳定性。
负极材料的改性还可以通过调整材料的颗粒大小、孔隙率等参数来实现。这些参数对电极的电化学性 能和充放电过程中的反应动力学具有重要影响。通过优化这些参数,可以提高电极的反应速率和容量 ,同时改善电极的循环寿命和稳定性。
05 负极反应的影响因素
CHAPTER
温度的影响
温度升高,负极反应速率加快
随着温度的升高,电极表面的化学反应活化能增加,使得反应更容易进行,负极反应速 率相应加快。
开发回收技术
研究高效的电池回收技术, 将废旧电池中的有价金属 和材料进行分离和提纯, 实现资源的循环利用。
制定相关政策
制定相关政策鼓励电池回 收和再利用产业的发展, 提高环保意识和社会责任 感。
谢谢
THANKS
来源
锌主要来源于闪锌矿(ZnS)和菱锌矿(ZnCO₃)。
制备方法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 第二,MnO2与MnOOH两物质是在同一固相中;
• 第三,虽然MnOOH的生成是在固相中直接完成的,但 反应必须是在固/液界面上进行。必须保证有足够的 固/液界面。
• 第四,随着反应的进行就会使得电极附近的pH值升高
2. MnO2电极 阴极还原的次级过程
• MnOOH转移步骤即二次过程是整个MnO2阴极还原的控 制步骤
• 1. 提高氢过电势 • 2. 保证原材料的质量达到要求 高纯度 • 3. 对电解液进行净化 • 4. 降低储存电池的温度 • 5. 严格密封
2.4 锌锰电池材料 2.4.1 二氧化锰材料
自学
• 2.4.2 锌材料 • 2.4.3 电解质 • 2.4.4 隔膜 • 2.4.5 导电材料 • 2.4.6 导电凝胶剂
• R6P,LR6,3R14,6F22,4F100-4
电池符号和意义
符号 R
S
F
P
C
L
外形
圆筒 形
方柱 扁平 式式
高功 率
高容 量
碱性
电池的结构和电池反应
传统的勒克朗谢电池
(-)Zn | NH4Cl,ZnCl2 | MnO2,C(+)
• 正极是天然MnO2或电解MnO2, • 隔膜是淀粉加面粉浆糊隔离层, • 负极是锌筒。称“糊式锌-锰电
• 负极自放电(主要) • 电液干涸 • 气胀 • 冒浆 • 铜冒生锈
2.6 糊式锌-锰电池
• 2.6.2 制造工艺及分析 • 一、生产流程 • 碳棒的制造 • 正极电芯的制造 • 负极锌筒的制造 • 电液及电糊的配制 • 装配
二、碳棒的制造
• 正极电芯的集流体,传导电流 三、正极的制造
拌粉、成型(打电芯)和包纸扎线等工序 • 1).拌粉
2.3.2. 锌电极自放电
• 1). 氢离子的阴极还原所引起的锌的自放电 • 在中性溶液或酸性溶液中:
Zn+2e Zn2+
2H
+
+2e
H2
Zn+2H+ Zn2+ +H2
• 在碱性溶液中:
Zn 2e 2OH
2H2O
2e
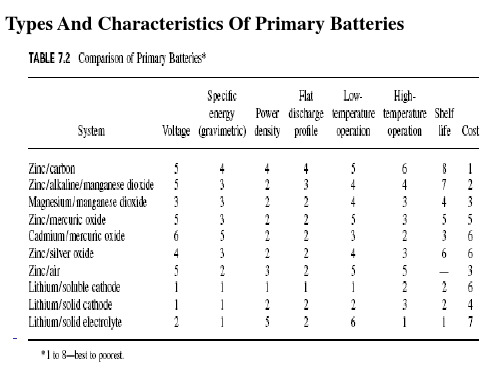
Types And Characteristics Of Primary Batteries
Primary batteries
第2章 锌锰电池
锌锰干电池
锌锰干电池
松下干电池工 厂
锌锰电池命名
2.1 Zn-MnO2电池的分类
分类
• 1 按电液分: • 中性和碱性
• 2 按外形: • 筒式、迭层式、薄形、扣式、扁平式
• MnOOH只能靠固相中的质子扩散来转移。 “特殊”浓差极化或固相浓差极化。
3). 水锰石在中性溶液中的转移—混合方式
• 有43%的MnOOH是通过歧化反应来转移的,有 57%是通过固相扩散来转移的。
MnO2电极在不同介质中的极化不同
2.3 锌电极
2.3.1.阳极过程
锌电极的电化学极化是比较小的,在放电过程 中锌电极的阳极极化主要来自于浓差极化。这 主要是放电产物离开电极表面受到一定的阻碍 所造成的
H2
ZnO 2OH
H
2O
Zn H2O ZnO H2
2). 氧的阴极还原所引起的锌电极的自放电
• 在中性溶液或酸性溶液中:
Zn 2e Zn2
1 2
O2
H
2e
2H2O
Zn
1 2
O2
2H
Zn 2
2H2O
SUCCESS
池”,
锌锰干电池
• 1868年 Leclanche发明 以NH4Cl为电解液 的Zn-MnO2电池
• 1888年Gassner 成功构成干电池 并商品化
氯化铵型电池
氯化锌型电池
碱性锌锰电池(Alkaline manganese dioxide)
电池组成 (-)Zn/KOH(aq) /MnO2(+)
2.5 锌锰电池的电性能
• 2.5.1 开路电压与工作电压
锌-锰系列电池不适于大电流放电。
具有电压恢复特性
2.5.2 电池的内阻
2.5.3 容量及其影响因素 (自学)
1. 放电制度 (表3-3, p66) 2. 锰粉质量 3. 锰粉颗粒度 4. 制造工艺各步工艺
2.5.4 储存性能 (自学)
THANK YOU
2019/7/2
可编辑
41
• 在碱性溶液中:
Zn
2e
2OH
ZnO
H2O
1 2
O2
2H2O
2e
4OH
1 2
O2
Zn
H2O
ZnO
2OH
3) .电解液中的杂质所引起的锌电极反 应
4) .锌电极表面不均匀性加速腐蚀
降低锌电极自放电的措施
命名
• 20世纪60年代建立了国际电工委员会(International Electrotechnical Commision,简称IEC),该组织实现 了电池型号、规格的标准化。
• 字母后面紧接着的数字代表单体电池的大小;在单体电 池前加上数字表示串联的组合电池中的单体电池数目。 单体电池之后加一并联电池数。
3).浆液的配制
• 打浆机中进行,在电液中加入一定 量的面粉和淀粉
额定电压:1.5V 可制成二次电池
碱性锌锰电池(Alkaline manganese dioxide)
2.2 MnO2电极
• 2.2.1 电化学行为
• 质子-电nO2 + H+ + e = MnOOH
• 第一,电子进入正极,质子进入MnO2晶格表面,这两 个过程是同时发生的;
1). 水锰石在酸性溶液中的转移—歧化反应: 在酸性溶液中,MnO2放电的一次过程为:
2MnO2+2H++2e- 2MnOOH
歧化反应:
2MnOOH+2H+
MnO2+Mn2++2H2O
电极的总反应为:
MnO2+4H++2e- Mn2++2H2O
2).水锰石在碱性溶液中的转移—固相质子扩散
2).打电芯(打芯)
• 目的:使粉料成型制成电芯,有专门的打芯机 完成
• 四、负极的制造 • 五、电液的配制、净化与浆液配制
1).电解液的组成及作用
• NH4Cl • ZnCl2
• 内电液用作拌粉时使用 外电液用作配浆液使用
2). 电液的配制和净化
• 电液的净化 • 吊锌角法 锌粉法 • 化学法:采用络合剂出杂质 • 电化学法 • 强制电液循环法
• 第三,虽然MnOOH的生成是在固相中直接完成的,但 反应必须是在固/液界面上进行。必须保证有足够的 固/液界面。
• 第四,随着反应的进行就会使得电极附近的pH值升高
2. MnO2电极 阴极还原的次级过程
• MnOOH转移步骤即二次过程是整个MnO2阴极还原的控 制步骤
• 1. 提高氢过电势 • 2. 保证原材料的质量达到要求 高纯度 • 3. 对电解液进行净化 • 4. 降低储存电池的温度 • 5. 严格密封
2.4 锌锰电池材料 2.4.1 二氧化锰材料
自学
• 2.4.2 锌材料 • 2.4.3 电解质 • 2.4.4 隔膜 • 2.4.5 导电材料 • 2.4.6 导电凝胶剂
• R6P,LR6,3R14,6F22,4F100-4
电池符号和意义
符号 R
S
F
P
C
L
外形
圆筒 形
方柱 扁平 式式
高功 率
高容 量
碱性
电池的结构和电池反应
传统的勒克朗谢电池
(-)Zn | NH4Cl,ZnCl2 | MnO2,C(+)
• 正极是天然MnO2或电解MnO2, • 隔膜是淀粉加面粉浆糊隔离层, • 负极是锌筒。称“糊式锌-锰电
• 负极自放电(主要) • 电液干涸 • 气胀 • 冒浆 • 铜冒生锈
2.6 糊式锌-锰电池
• 2.6.2 制造工艺及分析 • 一、生产流程 • 碳棒的制造 • 正极电芯的制造 • 负极锌筒的制造 • 电液及电糊的配制 • 装配
二、碳棒的制造
• 正极电芯的集流体,传导电流 三、正极的制造
拌粉、成型(打电芯)和包纸扎线等工序 • 1).拌粉
2.3.2. 锌电极自放电
• 1). 氢离子的阴极还原所引起的锌的自放电 • 在中性溶液或酸性溶液中:
Zn+2e Zn2+
2H
+
+2e
H2
Zn+2H+ Zn2+ +H2
• 在碱性溶液中:
Zn 2e 2OH
2H2O
2e
Types And Characteristics Of Primary Batteries
Primary batteries
第2章 锌锰电池
锌锰干电池
锌锰干电池
松下干电池工 厂
锌锰电池命名
2.1 Zn-MnO2电池的分类
分类
• 1 按电液分: • 中性和碱性
• 2 按外形: • 筒式、迭层式、薄形、扣式、扁平式
• MnOOH只能靠固相中的质子扩散来转移。 “特殊”浓差极化或固相浓差极化。
3). 水锰石在中性溶液中的转移—混合方式
• 有43%的MnOOH是通过歧化反应来转移的,有 57%是通过固相扩散来转移的。
MnO2电极在不同介质中的极化不同
2.3 锌电极
2.3.1.阳极过程
锌电极的电化学极化是比较小的,在放电过程 中锌电极的阳极极化主要来自于浓差极化。这 主要是放电产物离开电极表面受到一定的阻碍 所造成的
H2
ZnO 2OH
H
2O
Zn H2O ZnO H2
2). 氧的阴极还原所引起的锌电极的自放电
• 在中性溶液或酸性溶液中:
Zn 2e Zn2
1 2
O2
H
2e
2H2O
Zn
1 2
O2
2H
Zn 2
2H2O
SUCCESS
池”,
锌锰干电池
• 1868年 Leclanche发明 以NH4Cl为电解液 的Zn-MnO2电池
• 1888年Gassner 成功构成干电池 并商品化
氯化铵型电池
氯化锌型电池
碱性锌锰电池(Alkaline manganese dioxide)
电池组成 (-)Zn/KOH(aq) /MnO2(+)
2.5 锌锰电池的电性能
• 2.5.1 开路电压与工作电压
锌-锰系列电池不适于大电流放电。
具有电压恢复特性
2.5.2 电池的内阻
2.5.3 容量及其影响因素 (自学)
1. 放电制度 (表3-3, p66) 2. 锰粉质量 3. 锰粉颗粒度 4. 制造工艺各步工艺
2.5.4 储存性能 (自学)
THANK YOU
2019/7/2
可编辑
41
• 在碱性溶液中:
Zn
2e
2OH
ZnO
H2O
1 2
O2
2H2O
2e
4OH
1 2
O2
Zn
H2O
ZnO
2OH
3) .电解液中的杂质所引起的锌电极反 应
4) .锌电极表面不均匀性加速腐蚀
降低锌电极自放电的措施
命名
• 20世纪60年代建立了国际电工委员会(International Electrotechnical Commision,简称IEC),该组织实现 了电池型号、规格的标准化。
• 字母后面紧接着的数字代表单体电池的大小;在单体电 池前加上数字表示串联的组合电池中的单体电池数目。 单体电池之后加一并联电池数。
3).浆液的配制
• 打浆机中进行,在电液中加入一定 量的面粉和淀粉
额定电压:1.5V 可制成二次电池
碱性锌锰电池(Alkaline manganese dioxide)
2.2 MnO2电极
• 2.2.1 电化学行为
• 质子-电nO2 + H+ + e = MnOOH
• 第一,电子进入正极,质子进入MnO2晶格表面,这两 个过程是同时发生的;
1). 水锰石在酸性溶液中的转移—歧化反应: 在酸性溶液中,MnO2放电的一次过程为:
2MnO2+2H++2e- 2MnOOH
歧化反应:
2MnOOH+2H+
MnO2+Mn2++2H2O
电极的总反应为:
MnO2+4H++2e- Mn2++2H2O
2).水锰石在碱性溶液中的转移—固相质子扩散
2).打电芯(打芯)
• 目的:使粉料成型制成电芯,有专门的打芯机 完成
• 四、负极的制造 • 五、电液的配制、净化与浆液配制
1).电解液的组成及作用
• NH4Cl • ZnCl2
• 内电液用作拌粉时使用 外电液用作配浆液使用
2). 电液的配制和净化
• 电液的净化 • 吊锌角法 锌粉法 • 化学法:采用络合剂出杂质 • 电化学法 • 强制电液循环法
