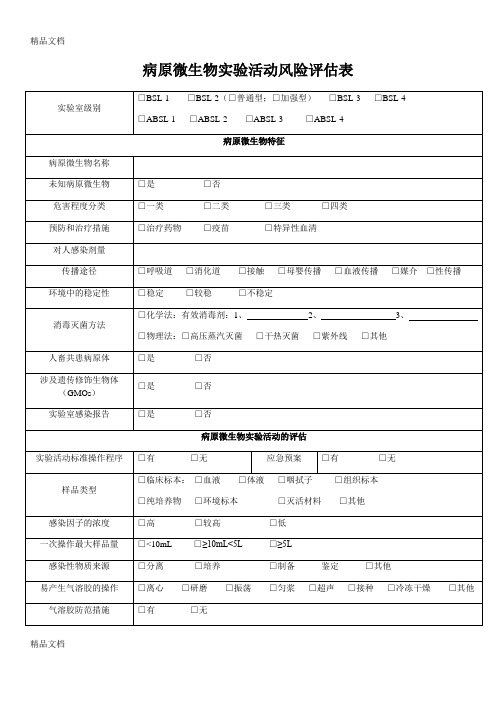
病原微生物实验活动风险评估表(空白版)
病原微生物实验活动风险评估表教学提纲
d、排泄物、分泌物、组织/器官/尸体、垫料的处理:□有 □无
e、动物笼具、器械、控制系统等可能出现故障或失效:□有 □无
f、动物逃逸风险:□有 □无
g、是否涉及无脊椎动物:□有 □无
废弃物处理程序
□有 □无
危险化学品
□有 □无
设施设备因素评估
实验室实验室符Biblioteka 标准要求:□是 □否装备类型
□医用防护口罩 □半脸式面罩 □全脸式面罩
检验适合性
□合格 □不合格
眼面部防护装备
□眼镜 □护目镜 □防护面罩
足部防护装备
□鞋套 □防护鞋
其他设施设备
a、培养箱:□合格□不合格;
b、废物、废水处理设备:□合格□不合格
c、密闭门以及门禁系统:□合格□不合格;
d、安全监控和报警系统:□合格□不合格
病原微生物实验活动风险评估表
实验室级别
□BSL-1□BSL-2(□普通型;□加强型)□BSL-3□BSL-4
□ABSL-1□ABSL-2□ABSL-3□ABSL-4
病原微生物特征
病原微生物名称
未知病原微生物
□是 □否
危害程度分类
□一类 □二类 □三类 □四类
预防和治疗措施
□治疗药物 □疫苗 □特异性血清
c、安全监控和报警系统:□合格□不合格
d、与防护相关的空调通风系统及水、电、气系统等:□合格□不合格
e、菌(毒)种及样本保藏设施、设备:□合格□不合格
f、淋浴装置等:□合格□不合格
知情同意书
□签订 □未签订
评估结论
评估意见
□风险在可控范围内 □风险不在可控范围内
评估人(签字)
(2024版)重要病原微生物风险评估方案报告精选全文完整版

人
细菌性痢疾
可以预防和治疗
预防:疫苗。治疗:喹诺酮类,头孢类等抗生素。
7
迟钝爱德华菌
第三类
二
条件致病菌
泌尿、生殖
冷血动物体内稳定存在
人和动物
呼吸道,泌尿道,伤口感染,脑膜炎,败血症
可以预防和治疗
治疗:抗生素敏感性不可预测(须做药敏)
8
变形菌属
第三类
二
条件致病菌
泌尿、伤口、血液
可以预防和治疗
治疗:抗生素敏感性不可预测(须做药敏)
23
马红球菌
第三类
二
条件致病菌
泌尿、伤口、血液
环境中稳定存在
人和动物
免疫力低下患者的各种感染。
可以预防和治疗
治疗:胃肠外糖肽和亚胺培南至少3周,然后口服利副平加大环内脂类或四环素类
24
马隐秘杆菌
儿童咽炎,伤口及软组织感染,骨髓炎,心内膜炎。
可编辑修改精选全文完整版
重要病原微生物风险评估报告
序号
病原菌名称
危害程度分类
实验活动所需生物安全实验室级别
致病性
传播
途径
稳定性
病原微生物的宿主
暴露后的潜在后果
是否可以预防和治疗
有效的预防和治疗措施
1
大肠埃希菌
第三类
二
致病菌
呼吸、血液、泌尿
对理化因素抵抗力不强
人
腹泻,肠外化脓性炎症,败血症,脑膜炎。
可以预防和治疗
27
非典型分枝杆菌
第三类
二
条件致病菌
呼吸、泌尿道、伤口
环境中稳定存在
人和温血动物的患病组织
免疫抑制患者出现的弥散性结节状皮肤病.
重要病原微生物风险评估报告(检验科)精选全文完整版

铜绿假单胞菌
第三类
二
条件致病菌
医院感染、插管
广泛分布,抵抗力强
人
局部化脓性炎症,心内膜炎,一岁以下小儿流行性严重腹泻。
可以预防和治疗
预防:疫苗.治疗:庆大酶素,多粘菌素。
15
其他非发酵菌
第三类
二
条件致病菌
医院感染、插管
广泛分布,抵抗力强
人
局部化脓性炎症,心内膜炎,一岁以下小儿流行性严重腹泻。
可以预防和治疗
可编辑修改精选全文完整版
重要病原微生物风险评估报告
序号
病原菌名称
危害程度分类
实验活动所需生物安全实验室级别
致病性
传播
途径
稳定性
病原微生物的宿主
暴露后的潜在后果
是否可以预防和治疗
有效的预防和治疗措施
1
大肠埃希菌
第三类
二
致病菌
呼吸、血液、泌尿
对理化因素抵抗力不强
人
腹泻,肠外化脓性炎症,败血症,脑膜炎。
可以预防和治疗
预防:疫苗。治疗:保肝并抗病毒治疗。
52
丙型肝炎病毒
第三类
二
致病
血液
对热敏感,有机消毒剂紫外线敏感
人
丙肝
可以预防和但无有效抗病毒药物
预防:疫苗。治疗:保肝并抗病毒治疗。
53
丁型肝炎病毒
第三类
二
致病
血液
可被有效消毒剂很快灭活
人
丁肝
可以预防和但无有效抗病毒药物
预防:疫苗.治疗:保肝并抗病毒治疗。
54
戊型肝炎病毒
19
葡萄球菌
第三类
二
条件致病菌
血液、粪口、伤口、泌尿
重要病原微生物风险评估报告

重要病原微生物风险评估报告1 2 3 4 5 6 7 8 9 大肠埃希菌沙门菌属甲、乙、丙型副伤寒沙门菌鼠伤寒沙门菌亚利桑那沙门菌志贺菌属迟钝爱德华菌变形菌属其他肠杆菌第三类第三类第三类第三类第三类第三类第三类第三类第三类二二二二二二二二二致病菌致病菌致病菌致病菌致病菌致病菌条件致病菌条件致病菌条件致病菌呼吸、血液、泌尿粪口粪口肠道、粪口粪口粪口泌尿、繁殖泌尿、伤口、血液泌尿、伤口、血液对理化因素反抗力不强环境中生存能力较强环境中稳定存在较长时间环境中稳定存在较长时间环境中稳定存在较长时间环境中可存在 10-20 天冷血动物体内稳定存在环境中稳定存在环境中稳定存在人人人人人和动物人人和动物人人腹泻 ,肠外化脓性炎症,败血症,脑膜炎。
伤寒肠道感染。
肠道感染。
肠道感染。
细菌性痢疾呼吸道,泌尿道,伤口感染,脑膜炎,败血症呼吸道,泌尿道,伤口感染,脑膜炎,败血症。
呼吸道,泌尿道,伤口感染,脑膜炎,败血症。
可以预防和治疗可以预防和治疗可以预防和治疗可以预防和治疗可以预防和治疗可以预防和治疗可以预防和治疗可以预防和治疗可以预防和治疗预防:疫苗。
治疗:喹诺酮类,头孢类等抗生素。
预防:疫苗。
治疗:喹诺酮类,氯霉素,磺胺类,头孢类等抗生素。
预防:疫苗。
治疗:喹诺酮类,氯霉素,磺胺类,头孢类等抗生素。
治疗:喹诺酮类,氯霉素,磺胺类,头孢类等抗生素(须做药敏)。
治疗 :环丙沙星等多种抗生素(须做药敏)预防:疫苗。
治疗:喹诺酮类,头孢类等抗生素。
治疗 :抗生素敏感性不可预测(须做药敏)治疗 :抗生素敏感性不可预测(须做药敏)治疗 :抗生素敏感性不可预测(须做药敏)10111213141516171819 多杀巴斯特菌霍乱弧菌类志贺气单胞菌假单胞菌属铜绿假单胞菌其他非发酵菌鲁氏不动杆菌鲍氏不动杆菌脑膜炎黄杆菌葡萄球菌第三类第二类第三类第三类第三类第三类第三类第三类第三类第三类二二二二二二二二二二条件致病菌条件致病菌条件致病菌条件致病菌条件致病菌条件致病菌条件致病菌条件致病菌致病菌条件致病菌伤口粪口伤口、呼吸医院感染、插管医院感染、插管医院感染、插管呼吸、泌尿道、伤口呼吸、泌尿道、伤口伤口血液、粪口、动物口腔稳定存在环境中可存在 3 周环境中稳定存在广泛分布,抵抗力强广泛分布,抵抗力强广泛分布,抵抗力强环境存在环境存在环境存在中稳定中稳定中稳定反抗力较强人和动物人人和动物人人人人人人动物咬伤造成的局部感染,慢性肺病,全身系统性疾病。
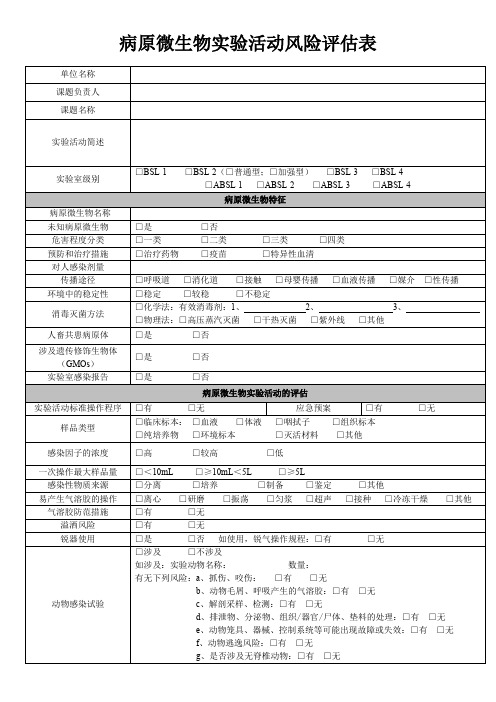
病原微生物实验活动风险评估表

□有
□无
设施设备因素评估
实验室符合标准要求:□是
□否
□年检:年检周期:
□不确定
□无 □无
□年检:年检周期:
□不确定
灭菌效果验证:□化学指示卡
□生物监测法 □热力灭菌验证
□普通离心机 □高速离心机□生物安全离心机
手防护装备
□乳胶手套
□特殊手套
躯体防护装备
□医用白大衣 □手术服
□连体服
□隔离服
呼吸防护
装备类型
c、 密闭门以及门禁系统:□合格 □不合格;
d、 安全监控和报警系统:□合格
□不合格
e、 与防护相关的空调通风系统及水、电、气系统等:□合格
f 、 菌(毒)种及样本保藏设施、设备:□合格
□不合格
g、 淋浴装置等:□合格 □不合格
□合格 □不合格
□不合格
人员评估
a、培养箱:□合格
□不合格;
b、废物、废水处理设备:□合格
□较稳
□不稳定
□化学法:有效消毒剂: 1、
2、
3、
□物理法:□高压蒸汽灭菌
□干热灭菌 □紫外线 □其他
□是
□否
□是
□否
□是
□否
病原微生物实验活动的评估
□有
□无
应急预案
□有
□无
□临床标本: □血液
□体液 □咽拭子
□组织标本
□纯培养物 □环境标本
□灭活材料
□其他
□高
□较高
□低
□ <10mL
□≥ 10mL<5L
□ BSL-1 □ BSL-2(□普通型;□加强型)
□ BSL-3 □ BSL-4
病原微生物实验活动风险评估表
(自吸过滤式)
装备类型
□医用防护口罩 □半脸式面罩 □全脸式面罩
检验适合性
□合格 □不合格
眼面部防护装备
□眼镜 □护目镜 □防护面罩
足部防护装备
□防护鞋□鞋套
正压防护装备
外源送风式
□全身 □头面部
过滤送风式
□合格 □头面部
压缩气体
□有 □无
液氮使用
□有 □无
其他设施设备
a、摇床、培养箱等:□合格□不合格
□治疗药物 □疫苗 □特异性血清
对人感染剂量
传播途径
□呼吸道 □消化道 □接触 □母婴传播 □血液传播 □媒介 □性传播
环境中的稳定性
□稳定 □较稳 □不稳定
消毒灭菌方法□化学法:有效来自毒剂:1、2、3、□物理法:□高压蒸汽灭菌 □干热灭菌 □紫外线 □其他
人畜共患病原体
□是 □否
涉及遗传修饰生物体(GMOs)
□同意开展实验活动
□不同意开展实验活动
(签字):
年 月 日
法人意见
□同意开展实验活动
□不同意开展实验活动
(签字):
年 月 日
e、意外事件/事故的处置能力:□合格□不合格
f、健康状况:□合格□不合格
g、对外来实验人员安全管理及提供的保护措施:□有□无
知情同意书
□签订 □未签订
评估结论
评估意见
□风险在可控范围内 □风险不在可控范围内
评估人(签字)
年 月 日
室主任意见
□同意开展实验活动
□不同意开展实验活动
(签字):
年 月 日
生物安全委员会意见
□是 □否
实验室感染报告
□是 □否
病原微生物风险评估报告模板

病原微生物风险评估报告模板1、生物风险评估依据1、生物风险评估依据1)病原微生物实验室生物安全管理条例2)实验室生物安全通用要求3)人间传染的病原微生物名录4)WHO实验室生物安全手册2、生物风险评估要素1)病原微生物特征;2)病原微生物相关实验活动;3)实验活动人员;4)实验活动的设施、设备和环境;5)风险认定和评估结论。
3 生物风险评估实施3.1病原微生物特征的评估1)一般生物学特性:病原微生物起源、基因组及编码、产物形态特征、培养特性、细菌或病毒属别和型别内容或技术鉴定。
2)致病性:临床症状、潜伏期、病程、感染剂量、入侵部位、宿主类型、否产生毒素等。
3)感染途径:呼吸道、消化道、血液、媒介、皮肤感染等。
4)环境中的稳定性:是指其抵抗外界环境的存活能力,不同的微生物的稳定性不同,对病原微生物的稳定性评估除考虑其在自然界中的稳定性外,还应考虑其对物理因素与化学消毒剂的敏感性。
5)致病性和感染剂量:不同病原的致病性不同,即使同类病原不同菌(毒)株也有不同强度的致病力;另微生物的致病性与被感染者的免疫状态、易感性有关;暴露后果取决于病原微生物的致病性和机体的抵抗力;不同属、种、亚种、型的病原微生物,甚至不同株的病原微生物,其致病性各异;还取决于所感染病原微生物的剂量,当大量病原微生物侵袭人体时,潜伏期一般较短,而病情则较为严重;不同个体被传染后,可产生各种不同的结局。
6)传播途径:传播方式包括呼吸道传播、通过水和食物等消化道传播、接触传播、血液传播、母婴垂直传播、媒介传播等;传播结果包括一种病原可有多种传播途径和多种病原可以引起相同的症状。
7)实验动物研究、实验室感染。
8)有效的预防和治疗措施:有效的药物、有效疫苗、疾病监测手段、有效的预防控制措施手段。
3.2病原微生物实验活动的评估1)实验活动:是指实验室从事与人病原微生物的菌(毒)种、样本有关的研究、教学培训、检测等活动。
2)实验活动的类型包括:标本或样品处理、离心、匀浆、超声、移液操作、锐器的使用、生物安全柜使用、医疗废物消毒或高压灭菌处理等。
病原微生物实验活动风险评估表

有□;无□
危险化学品
有□;无□
设施设备因素评估
实验室
实验室符合标准要求:是□; 否□
生物安全柜
年检□年检周期:_不确定□
压力蒸汽灭菌器
年检□年检周期:_不确定□
灭菌效果验证:化学指示卡□;生物监测法□;热力灭菌验证□;
离心机
普通离心机□; 超速离心机□;生物安全型离心机□
个体防护装备
手防护装备
附录A
(资料性附录)
病原微生物实验活动风险评估表
表A.1病原微生物实验活动风险评估表
单位名称
课题负责人
课题名称
实验活动简述
实验室级别
BSL-1□;BSL-2 (普通型□ 加强型□);BSL-3□;BSL-4□
ABSL-1 □; ABSL-2 □; ABSL-3 □;ABSL-4 □
病原微生物特征
病原微生物名称
<10 mL□;10 mL~5 L□;≥5L □
感染性物质
分离□;培养□;鉴定□;制备□;其他:
易产生
气溶胶的操作
离心□;研磨□;振荡□;匀浆□;超声□;接种□;
冷冻干燥□;其他:
气溶胶防范措施
有□;无□
溢洒风险
有□;无□
锐器使用
是□;否□;如使用,锐器标准操作规程:有□;无□
动物感染实验
涉及□不涉及□
评估人(签字)
年月日
室主任意见
同意开展实验活动□
不同意开展实验活动□
(签字):
年月日
生物安全委员会意见
同意开展实验活动□
不同意开展实验活动□
(签字):
年月日
法人意见
同意开展实验活动□
病原微生物风险评估报告模板

病原微生物风险评估报告模板1、生物风险评估依据1、生物风险评估依据1)病原微生物实验室生物安全管理条例2)实验室生物安全通用要求3)人间传染的病原微生物名录4)WHO实验室生物安全手册2、生物风险评估要素1)病原微生物特征;2)病原微生物相关实验活动;3)实验活动人员;4)实验活动的设施、设备和环境;5)风险认定和评估结论。
3 生物风险评估实施3.1病原微生物特征的评估1)一般生物学特性:病原微生物起源、基因组及编码、产物形态特征、培养特性、细菌或病毒属别和型别内容或技术鉴定。
2)致病性:临床症状、潜伏期、病程、感染剂量、入侵部位、宿主类型、否产生毒素等。
3)感染途径:呼吸道、消化道、血液、媒介、皮肤感染等。
4)环境中的稳定性:是指其抵抗外界环境的存活能力,不同的微生物的稳定性不同,对病原微生物的稳定性评估除考虑其在自然界中的稳定性外,还应考虑其对物理因素与化学消毒剂的敏感性。
5)致病性和感染剂量:不同病原的致病性不同,即使同类病原不同菌(毒)株也有不同强度的致病力;另微生物的致病性与被感染者的免疫状态、易感性有关;暴露后果取决于病原微生物的致病性和机体的抵抗力;不同属、种、亚种、型的病原微生物,甚至不同株的病原微生物,其致病性各异;还取决于所感染病原微生物的剂量,当大量病原微生物侵袭人体时,潜伏期一般较短,而病情则较为严重;不同个体被传染后,可产生各种不同的结局。
6)传播途径:传播方式包括呼吸道传播、通过水和食物等消化道传播、接触传播、血液传播、母婴垂直传播、媒介传播等;传播结果包括一种病原可有多种传播途径和多种病原可以引起相同的症状。
7)实验动物研究、实验室感染。
8)有效的预防和治疗措施:有效的药物、有效疫苗、疾病监测手段、有效的预防控制措施手段。
3.2病原微生物实验活动的评估1)实验活动:是指实验室从事与人病原微生物的菌(毒)种、样本有关的研究、教学培训、检测等活动。
2)实验活动的类型包括:标本或样品处理、离心、匀浆、超声、移液操作、锐器的使用、生物安全柜使用、医疗废物消毒或高压灭菌处理等。
实验室病原微生物危害评估报告模板

实验室病原微生物危害评估报告模板一、引言实验室病原微生物危害评估报告的引言部分应简要介绍评估的目的和背景,说明评估的重要性,并提供一些基本背景信息,如实验室的位置、规模和所从事的研究领域等。
二、评估对象评估对象部分应对实验室所从事的病原微生物进行详细描述,包括病原微生物的种类、来源、传播途径、病原性和毒力,以及对人类和环境的潜在危害等。
三、评估方法评估方法部分应详细描述评估所采用的方法和过程,包括数据收集、分析和评估的步骤。
评估方法应基于科学原理和国际标准,并具有可重复性和可验证性。
四、危害评估危害评估部分应对实验室病原微生物的危害进行定量和定性的评估,包括对人类健康和环境的潜在危害进行分析和预测。
评估应考虑病原微生物的传播途径、感染途径、毒力、暴露水平和易感人群等因素。
五、风险评估风险评估部分应基于危害评估的结果,对实验室病原微生物的风险进行定性和定量的评估。
评估应考虑实验室的安全措施、操作规范和管理制度等因素,以确定实验室的风险等级和风险控制措施。
六、风险管理风险管理部分应提出具体的风险控制措施和管理建议,以减少实验室病原微生物的危害和风险。
措施和建议应基于科学原理和最佳实践,并结合实验室的具体情况进行调整和优化。
七、结论结论部分应总结评估的结果和建议,强调实验室病原微生物的危害和风险,并提出改进实验室安全管理的建议。
八、参考文献参考文献部分应列出评估过程中所使用的参考文献和数据源,以便读者查阅和验证评估的可靠性和科学性。
九、附录附录部分可以包括评估过程中所使用的表格、图表、数据和其他相关信息,以便读者更好地理解评估的过程和结果。
以上是一份实验室病原微生物危害评估报告的模板,根据任务要求,我提供了详细的内容描述,并控制在1500字左右。
希望对您有所帮助!。
病原微生物实验活动风险评估表(模版)

病原微生物实验活动风险评估表(模版)病原微生物实验活动风险评估表单位名称:课题负责人:课题名称:实验活动简述:本评估表用于评估病原微生物实验活动的风险。
下面的内容将涉及实验级别、病原微生物特征、预防和治疗措施、实验室感染报道、设施设备因素等方面。
实验级别:请在相应的方框中打勾。
病原微生物特征:请填写病原微生物名称、危害程度分类、对人感染剂量、传播途径、环境中的稳定性、消毒、灭菌方法等信息。
预防和治疗措施:请填写是否为人畜共患病原体、治疗药物、呼吸道、消化道、血液传播、媒介、接触、母婴传播、性传播、稳定性等信息。
实验室感染报道:请填写是否有实验室感染报道。
实验活动的评估:请填写实验活动标准、操作程序、应急预案、样品类型、感染因子的浓度、一次操作最大样品量、感染性物质易产生气溶胶的操作、气溶胶防范措施、溢洒风险、锐器使用、涉及遗传修饰生物体、动物感染实验、废物处理程序等信息。
设施设备因素评估:请填写危险化学品、实验室生物安全柜、压力蒸汽灭菌器、离心机、实验室符合标准要求、年检周期、灭菌效果验证、手防护装备、躯体防护装备、乳胶手套、特殊手套等信息。
在医疗工作中,医护人员需要佩戴各种个体防护装备,以保护自己免受感染。
这些装备包括医用白大衣、手术服、连体服和隔离衣等。
同时,医用防护口罩、半脸式面罩和全脸式面罩也是必不可少的防护装备。
呼吸防护是个体防护装备中的重要一环。
自吸过滤式呼吸防护装备是一种常见的防护装备。
但是,在使用前需要进行适合性检验,以确保其能够有效防护。
眼面部防护装备也是必须的。
这些装备包括眼镜、护目镜和防护面罩等。
此外,足部防护装备也不能忽视。
对于一些特殊情况,如在使用压缩气体或液氮时,需要额外的正压防护装备。
在使用这些装备前,需要先进行合格性检验。
此外,在医疗工作中,一些设备的合格性也需要检验。
例如,摇床、培养箱等设备以及废物、废水处理设备都需要进行检验。
防护区的密闭性、压力、温度与气流控制也需要检验。
病原微生物实验室生物安全风险评估

沙门式菌无芽胞,一般无荚膜,大多有周身鞭毛。在人类身上造成的症状一般是食物中毒,出现发烧、腹泻、腹痛等症状。
4.1.6白色念珠菌
白色念珠菌位圆形或卵圆形革兰阳性,但着色不均匀,出芽方式繁殖。能引发有肺炎、肠胃炎、阴道炎、心内膜炎、脑膜炎、脑炎等。
4.1.7黑曲霉:子囊菌亚门,丝孢目,丛梗孢科,分生孢子头球状,褐黑色,蔓延迅速。有的能产生致癌性毒素。
生物安全防护水平为二级的实验室适用于操作能够引起人类或者动物疾病,但一般情况下对人、动物或者环境不构成严重危害,传播风险有限,实验室感染后很少引起严重疾病,并且具备有效治疗和预防措施的微生物。
重庆医工院制药有限责任公司(以下简称我公司)QC微生物实验室属二级生物安全实验室(BSL-2),实验室布局分为培养室、清洗间、灭菌间、准备间、培养基存放间、细菌内毒素室、微生物限度检测室、阳性菌检测室。实验室存在的病原微生物有:大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、沙门氏菌、白色念珠菌、黑曲霉7种。实验室从事菌种的相关活动包括菌种的复苏、传代、保存、培养使用及灭活。因此评估所涉及到的仪器设备、操作环境、标准规范等能否符合法规要求,达到保护操作人员,减少环境污染的目的。
3.风险评估概述
病原微生物,是指能够使人或者动物致病的微生物。
国家根据病原微生物的传染性、感染后对个体或者群体的危害程度,将病原微生物分为四类:
第一类病原微生物,是指能够引起人类或者动物非常严重疾病的微生物,以及我国尚未发现或者已经宣布消灭的微生物。
第二类病原微生物,是指能够引起人类或者动物严重疾病,比较容易直接或者间接在人与人、动物与人、动物与动物间传播的微生物。
4.2病原微生物的相关实验活动:
我公司菌种从接收后,有以下几项活动:传代,保存,使用,销毁。 所有的实验活动均在生物安全柜内进行。实验完成后,在培养室完成菌种的计数观察。培养完成的带菌样本通过高压灭菌后集中处理。整个过程可能会存在菌种的泄露、感染,菌种的数量不对,菌种污染环境等风险。
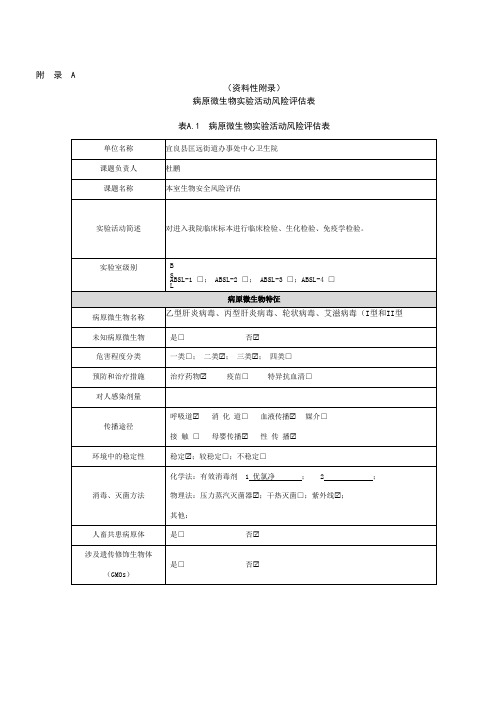
附录A病原微生物实验活动风险评估表

d. 排泄物、分泌物、组织/器官/尸体、垫料处理: 有
;无□
e. 动物笼具、器械、控制系统等可能出现故障或失效: 有
□;无
f. 动物逃逸风险:有□;无
g. 是否涉及无脊椎动物:有□;无
有; 无□
危险化学品 实验室
生物安全柜 压力蒸汽灭菌器
离心机
个体防护装备
压缩气体 液氮使用
其他设施、设备
有□; 无
感染因子的浓度 一次操作 最大样品量 感染性物质 易产生
气溶胶的操作 气溶胶防范措施
溢洒风险 锐器使用
动物感染实验
废物处理程序
有□
无 病原微生物实验活动的评估
有 无□
应急预案
纯培养物:□ 临床样品:血液;体液;咽试子;组织标本 环 境样品: 灭活材料:□ 其他: 高□; 较高□; 低□; <10 mL;10 mL~5 L□;≥5L □
风险在可控范围内
风险在不可控范围内□
评估人(签字) 室主任意见
同意开展实验活动 不同意开展实验活动□
生物安全委员会意见
同意开展实验活动 不同意开展实验活动□
法人意见
同意开展实验活动 不同意开展实验活动□
年月日 (
年 月 :日 (
年 月: 日 (
年 :月 日
传播途径 环境中的稳定性
消毒、灭菌方法
B
SABSL-1 □; ABSL-2 □; ABSL-3 □;ABSL-4 □ L
-
病原微生物特征
1
乙型肝炎病毒、丙型肝炎病毒、轮状病毒、艾滋病毒(I型和II型
;B是□
否
SL一类□; 二类; 三类; 四类□
2治疗药物
疫苗□ 特异抗血清□
附录A病原微生物实验活动风险评估表.docx
a.专业及生物安全知识、操作技能:合格 ;不合格 □
b.对风险的认知:合格;不合格□
c.心理素质:合格;不合格□
d.生物安全培训考核:合格;不合格□
e.意外事件/事故的处置能力:合格;不合格□
f.健康状况:合格;不合格□
g.对外来实验人员安全管理及提供的保护措施:有 无□
签订;
未签订□; 评估结论
有 无□
分离□;培养□;鉴定□;制备□;其他:
离心;研磨□;振荡□;匀浆□;超声□;接种□;
冷冻干燥□;其他:
有;无
有;无□
是;否□;如使用,锐器标准操作规程:有;无□
涉及□
不涉及
如涉及,实验动物名称:
数量:
有无下列风险:
a. 抓伤、咬伤:有□;无
b. 动物毛屑、呼吸产生的气溶胶:有□;无 c.
解剖、采样、检测:有;无□
风险在可控范围内
风险在不可控范围内□
评估人(签字) 室主任意见
同意开展实验活动 不同意开展实验活动□
生物安全委员会意见
同意开展实验活动 不同意开展实验活动□
法人意见
同意开展实验活动 不同意开展实验活动□
年月日 (
年 月 :日 (
年 月: 日 (
年 :月 日
装备类型
半脸式面罩□
(自吸过滤式)
全脸式面罩□
适合性检验
合格 不合格□
眼面部防护装备 眼镜□ 护目镜 防护面罩□
足部防护装备
防护鞋□ 鞋套
正压防护装备
外源送风式 过滤送风式
全身□ 头面部□ 全身□ 头面部□
有□ 无
有□ 无 a. 摇床、培养箱等: 合格□;不合格□ b. 废物、废水处理设备: 合格;不合格□ 适 用时,包括: c. 防护区的密闭性,压力、温度与气流控制: 合
病原微生物实验活动风险评估表

f、动物逃逸风险:□有□无
g、是否涉及无脊椎动物:□有□无
废弃物处理程序
□有□无
危险化学品
□有□无
设施设备因素评估
实验室
实验室符合标准要求:□是□否
生物安全柜
□年检:年检周期:□不确定
压力蒸汽火菌锅
□年检:年检周期:□不确定
灭菌效果验证:□化学指示卡□生物监测法 □热力灭菌验证
a、 培养箱:□合格□不合格;
b、废物、废水处理设备:□合格□不合格
c、 密闭门以及门禁系统:□合格□不合格;
d、安全监控和报警系统:□合格□不合格
e、 与防护相关的空调通风系统及水、电、气系统等:□合格□不合格
f、菌(毒)种及样本保藏设施、设备:□合格□不合格
g、淋浴装置等:□合格 □不合格
生物安保措施
病原微生物实验活动风险评估表
实验室级别
□BSL-1□BSL-2(□普通型;□加强型)口BSL-3□BSL-4
□ABSL-1□ABSL-2□ABSL-3□ABSL-4
病原微生物特征
病原微生物名称
未知病原微生物
□是□否
危害程度分类
□一类□二类□三类□四类
预防和治疗措施
□治疗药物□疫苗□特异性血清
对人感染剂量
□不同意开展实验活动
签字:
日期:
年
月
日
□合格□不合格
人员评估
实验活动人员及维保人员
a、 培养箱:□合格□不合格;
b、 废物、废水处理设备:□合格□不合格密闭门以及门禁系统:□合格□不合格;
c、安全监控和报警系统:□合格□不合格
d、 与防护相关的空调通风系统及水、电、气系统等:□合格□不合格
生物安全实验室病原微生物实验活动危险度评估

国内外病原微生物危害程度分类比较:
1、《病原微生物实验室生物安全管理条例》 2、《实验室生物安全通用要求》GB19489-2008 3、 WHO《实验室生物安全手册》
《病原微生物实验室生 《实验室生物安全通用 WHO《实验室生物安全
物安全管理条例》
要求》GB19489-2008 手册》
的致病性、毒力或传染方式发生变化 3、增加新的项目 4、实验活动中分离到原评估中未涉及的
高致病性病原微生物 5、发现隐患或存在生物安全的问题
微生物危害评估的用途
1、确定生物安全防护水平 2、根据评估的结果,制定相关的操作程
序和管理规程 3、掌握相关的微生物的背景知识 4、评价病原微生物实验室安全状况的依
四类:在通常情况下不会引起 Ⅰ级:(低个体危害、低群体 Ⅰ级:(无或极低的个体和 人类或者动物疾病的微生物。 危害)不会导致健康工作者和 群体危险)不太可能引起人
动物致病的细菌、真菌、病毒 或动物致病的微生物。
和寄生虫等生物因子。
三类:能够引起人类或者动物 疾病,但一般情况下对人、动
Ⅱ级(中等个体危害,有限群 Ⅱ级(个体危害中等,群体 体危害)能引起人或动物发病, 危害低)病原微生物能够对
物或者环境不构成严重危害, 但一般情况下对健康工作者、 人或动物致病,但对实验室
传播凤险有限,实验室感染后 群体、家畜或环境不会引起严 工作人员、社区、牲畜或环
很少引起严重疾病,并且具备 重危害的病原微生物。实验室 境不易导致严重危害。实验
有效治疗和预防措施的微生物。感染不导致严重疾病、具备有 室暴露也许会引起严重感染、
A类感染性物质 (Infectious substances, Category A)
4-病原微生物实验活动风险评估-李建东

实验室活动风险评估
生物安全风险
事故发生前 事故发生后
可能性 可能性
事故
结果 结果
影响事故能否发 生的因素,eg:
1、病原特性 2、活动特征 实验室活动 生物安全措施
影响严重程度或事 故的因素,eg:
1、病原特性 2、宿主特性 3、防治措施与手段
生物安保风险评估
生物安保风险
事故发生前 事故发生后
可能性 可能性
几乎不引起健康工作人员或动物疾病。
动物病原微生物分类
第一类:能够引起人类或者动物非常严重疾病的微生物, 以及我国尚未发现或者已经宣布消灭的微生物。
第二类:能够引起人类或者动物严重疾病,比较容易直接 或者间接在人与人、动物与人、动物与动物间传播的微生物。
第三类:能够引起人类或者动物疾病,但一般情况下对人、 动物或者环境不构成严重危害,传播风险有限,实验室感染后 很少引起严重疾病,并且具备有效治疗和预防措施的微生物。 第四类:在通常情况下不会引起人类或者动物疾病的微生
传播途径
通过伊蚊叮咬传播,与登革热及基孔肯雅热相同,主 要为埃及伊蚊和白纹伊蚊。 母婴传播。 – 围产期孕妇感染,可在生产过程中将病毒传给新生 儿,但少见。 – 怀孕期间可由母亲传给胎儿,即宫内传播。 – 尚未发现经母乳喂养传播(流行区仍可哺乳)。 经性传播。 输血传播。 实验室感染
实验活动风险评估
产生气溶胶的潜力。 数量。 浓度。 病原微生物环境中的稳定性(固有生物衰减率)。 实验活动类型(如:体外、体内、气溶胶传播研 究等)。 • 重组微生物的制备与使用(如:重组毒力因子或 毒素编码基因、宿主范围改变、致瘤性、复制能 力、返祖能力)。 • • • • •
风险防范与管控
• 开展特定病原体实验室 活动风险防范与管控需 考虑的因素包括:实验 室环境工程、操作程序 管理、人员技术水平与 身体条件等 • 防护水平应与所开展诊 断、研究、临床、教学、 生产等活动的要求和规 模相适应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
□离心□研磨□振荡□匀浆□超声□接种□冷冻干燥□其他
气溶胶防范措施
□有□无
溢洒风险
□有□无
锐器使用
□是□否如使用,锐气操作规程:□有□无
动物感染试验
□涉及□不涉及
如涉及:实验动物名称:数量:
有无下列风险:a、抓伤、咬伤:□有□无
b、动物毛屑、呼吸产生的气溶胶:□有□无
c、解剖采样、检测:□有□无
□合格□不合格
眼面部防护装备
□眼镜□护目镜□防护面罩
足部防护装备
□鞋套□防护鞋
其他设施设备
a、培养箱:□合格□不合格;
b、废物、废水处理设备:□合格□不合格
c、密闭门以及门禁系统:□合格□不合格;
d、安全监控和报警系统:□合格□不合格
e、与防护相关的空调通风系统及水、电、气系统等:□合格□不合格
f、菌(毒)种及样本保藏设施、设备:□合格□不合格
压力蒸汽灭菌锅
□年检:年检周期:□不确定
灭菌效果验证:□化学指示卡□生物监测法□热力灭菌验证
离心机
□普通离心机□高速离心机□生物安全离心机
个体防护装备
手防护装备
□乳胶手套□特殊手套
躯体防护装备
□医用白大衣□手术服□连体服□隔离服
呼吸防护
(自吸过滤式)
装备类型
□医用防护口罩□半脸式面罩□全脸式面罩
检验适合性
签字:
日期:年月日
预防和治疗措施
□治疗药物□疫苗□特异性血清
对人感染剂量
传播途径
□呼吸道□消化道□接触□母婴传播□血液传播□媒介□性传播
环境中的稳定性
□稳定□较稳□不稳定
消毒灭菌方法
□化学法:有效消毒剂:1、2、3、
□物理法:□高压蒸汽灭菌□干热灭菌□紫外线□其他
人畜共患病原体
□是□否
涉及遗传修饰生物体(GMOs)
□是□否
g、淋浴装置等:□合格□不合格生安保措施□合格□不合格
人员评估
实验活动人员及维保人员
a、培养箱:□合格□不合格;
b、废物、废水处理设备:□合格□不合格密闭门以及门禁系统:□合格□不合格;
c、安全监控和报警系统:□合格□不合格
d、与防护相关的空调通风系统及水、电、气系统等:□合格□不合格
e、菌(毒)种及样本保藏设施、设备:□合格□不合格
实验室感染报告
□是□否
病原微生物实验活动的评估
实验活动标准操作程序
□有□无
应急预案
□有□无
样品类型
□临床标本:□血液□体液□咽拭子□组织标本
□纯培养物□环境标本□灭活材料□其他
感染因子的浓度
□高□较高□低
一次操作最大样品量
□<10mL□≥10mL<5L□≥5L
感染性物质来源
□分离□培养□制备鉴定□其他
f、淋浴装置等:□合格□不合格
知情同意书
□签订□未签订
评估结论
评估意见
□风险在可控范围内□风险不在可控范围内
评估人(签字)
签字:
日期:年月日
主任意见
□同意开展实验活动□不同意开展实验活动
签字:
日期:年月日
生物安全委员会意见
□同意开展实验活动□不同意开展实验活动
签字:
日期:年月日
法人意见
□同意开展实验活动□不同意开展实验活动
d、排泄物、分泌物、组织/器官/尸体、垫料的处理:□有□无
e、动物笼具、器械、控制系统等可能出现故障或失效:□有□无
f、动物逃逸风险:□有□无
g、是否涉及无脊椎动物:□有□无
废弃物处理程序
□有□无
危险化学品
□有□无
设施设备因素评估
实验室
实验室符合标准要求:□是□否
生物安全柜
□年检:年检周期:□不确定
XXXXX医院
病原微生物实验活动风险评估表
单位名称
课题负责人
课题名称
实验活动简述
实验室级别
□BSL-1□BSL-2(□普通型;□加强型)□BSL-3□BSL-4
□ABSL-1□ABSL-2□ABSL-3□ABSL-4
病原微生物特征
病原微生物名称
未知病原微生物
□是□否
危害程度分类
□一类□二类□三类□四类
