高一化学《必修一》化学方程式(按章节归纳)
完整版高一化学必修一化学方程式大全

高一化学必修一化学方程式大全1、钠在空气中燃烧(黄色的火焰)2Na + O2==【点燃】 Na2O2钠块在空气中变暗4Na+O2 = 2Na2ONa2O 在空气中加热(变黄)2Na2O+ O2= 2Na2O22、钠与水反应(浮、熔、游、响、红)2Na + 2H2O=2H2O+H2↑2Na + 2H2O = 2Na+ + 2OH- + H2 ↑3、过氧化钠与水的反应(放热反应、Na2O2 是强氧化剂,用于漂白)2Na2O2 + 2H2O = 4NaOH + O2 ↑2Na2O2 + 2H2O = 4Na+ + 4OH - + O2↑碱性氧化物Na2O 与水的反应Na2O + H2O= 2NaOH4、过氧化钠可用在呼吸面具和潜水艇中作为氧气本源,原由是:2Na2O2 + 2CO2 = 2Na2CO3 + O25、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3 + 2HCl=2NaCl+H2O+CO2↑CO32- + 2H+= H2O + CO2↑②纯碱溶液中滴加盐酸,至过分Na2CO3 + HCl = NaHCO3 + NaClCO32- + H+ = HCO3-NaHCO3 + HCl = NaCl + H2O+ CO2↑HCO3- + H+ = H2O + CO2↑6、小苏打受热分解2NaHCO3== 【加热】 Na2CO3 + H2O + CO2 ↑7、固体氢氧化钠和碳酸氢钠混杂物在密闭容器中加热NaHCO3+NaOH==【加热】Na2CO3+H2OHCO3- + OH - = H2O + CO32-(假如溶液中反应有离子方程式)8、金属锂在空气中燃烧4Li+O2==【加热】2Li2O9、氯气的性质铜丝在氯气中激烈燃烧(棕色烟)Cu + Cl2== 【点燃】 CuCl2今后加水,可由绿色溶液(浓)获得蓝色溶液(稀)Cl2 + 2FeCl2 = 2FeCl32Cl2 + 2NaBr = 2NaCl + Br2Cl2 + 2NaI = 2NaCl + I2Cl2+ SO2 + 2H2O = H2SO4 + 2HCl2Na + Cl2 == 【点燃】 2NaCl10、铁在氯气中激烈燃烧2Fe + 3Cl2== 【点燃】 3FeCl311、氢气在氯气中燃烧(苍白色火焰)H2 + Cl2== 【点燃】 2HCl氟气与氢气反应(黑暗处即可爆炸)H2 + F2= 2HF12、氯气溶于水(新制氯水中含H +、 Cl- 、 ClO- 、 OH- 、 Cl2、HClO 、 H2O)Cl2 + H2O = HCl+HClOCl2 + H2O = H++ Cl- + HClO13、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂)2HClO== 【光照】 2HCl+O2↑14、工业制漂白粉的原理及漂白粉的无效2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O2Ca(OH)2+2Cl2=2Ca2++2ClO-+2Cl-+2H2OCa(ClO)2 +CO2+ H2O =CaCO3↓+ 2HClO2HClO== 【光照】2HCl+O2↑Ca2-+ 2ClO- + CO2 + H2O = CaCO3↓+2HClO15、氯气的实验室制法:(仪器:分液漏斗,圆底烧瓶) MnO2+ 4HCl( 浓)== 【加热】 MnCl2 + Cl2↑+ 2H2O MnO2 +4H ++ 2Cl -==【加热】 Mn2 ++ Cl2↑+ 2H2O16、新制氯水注入盛溴化钠溶液的试管中Cl2 + 2NaBr=Br2+2NaClCl2 + 2Br- = Br2 + 2Cl-17、铁与硫加热反应Fe + S==【加热】 FeS铁与氧气加热反应3Fe+2O2== 【加热】 Fe3O4铁在氯气中加热反应2Fe+ 3Cl2== 【加热】 2FeCl318、铜与浓硫酸反应:Cu+ 2H2SO4 ( 浓 ) == 【加热】 CuSO4 + 2H2O + SO2 ↑19、碳与浓硫酸反应:C+ 2H2SO4(浓) ==【加热】 2H2O +CO2↑+ 2SO2↑20、工业制单质硅(碳在高温下还原二氧化硅)SiO2 + 2C=( 高温 )Si + 2CO ↑21、二氧化硅与氢氧化钠反应SiO2 + 2NaOH = Na2SiO3 + H2OSiO2 + 2OH+=SiO32-+H2O22、氮气和氢气反应(工业合成氨)N2 + 3H2→【催化剂】2NH32NH3 →【高温高压】N2 + 3H223、氮气和氧气放电下反应(雷雨发庄稼)N2 + O2=( 放电 )2NO2NO + O2=2NO2二氧化氮溶于水3NO2+H2O =2HNO3+NO3NO2+H2O =2H++2NO3-+NO24、 HNO3 与 Fe 的反应Al 、 Fe 遇浓 HNO3 、浓硫酸钝化(常温)Fe 与浓 HNO3 加热Fe+ 6HNO3== 【加热】Fe(NO3)3+ 3NO2 ↑+ 3H2OFe 与稀 HNO3 反应Fe+ 4HNO3 = Fe(NO3)3 + NO↑+ 2H2O3Fe+ 8HNO3 = 3Fe(NO3)2 + 2NO ↑+ 4H2O25、 NO2 、 O2 的混杂气通入水中无节余气体4NO2 + O2 + 2H2O = 4 HNO326、 NO 、O2 的混杂气通入水中无节余气体4NO + 3O2 + 2H2O = 4 HNO327.氨的催化氧化4NH3+5O2 ==【催化剂、加热】4NO + 6H2O28.碳酸氢铵受热分解NH4HCO3== 【加热】NH3 ↑+H2O ↑+ CO2↑29.用浓盐酸检验氨气(白烟生成)HCl + NH3 = NH4Cl30.硫酸铵溶液与氢氧化钠溶液混杂加(NH4)2SO4 NH4+++ 2NaOH== 【加热】OH - ==【加热】 NH32NH3 ↑+ Na2SO2↑+ H2O+ 2H2O31.硝酸铵溶液与氢氧化钠溶液混杂(不加热)NH4NO3+NaOH=NH3· H2O+NaNO3NH4 ++ OH-= NH3 ·H2O32.铝箔在氧气中激烈燃烧4Al+3O2 ==2Al2O333.铝片与稀盐酸反应2Al+6HCl=2AlCl3+3H2↑2Al+6H+=2Al3++3H2↑34.铝与氢氧化钠溶液反应2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ 2Al+ 2OH -+2H2O = 2AlO2 -+ 3H2↑35.铝与三氧化二铁高温下反应(铝热反应)2Al+Fe2O3==【高温】2Fe + Al2O336.镁在二氧化碳中燃烧2Mg+CO2 ==【点燃】2MgO+C37.氧化铝溶于氢氧化钠溶液Al2O3+2NaOH =2NaAlO2+H2OAl2O3+2OH-=2AlO2-+H2O38.硫酸铝溶液中滴过分氨水Al2(SO4)3+6NH3· H2O=2Al(OH)3↓+(NH4)2SO4 Al3 ++ 3 NH3 ·H2O = Al(OH)3 ↓+3NH4 +39.①氢氧化铝溶液中加盐酸②A l(OH)3 与 NaOH 溶液反应Al(OH)3 + NaOH=NaAlO2+2 H2OAl(OH)3 + OH -= AlO2 -+ 2 H2O40.高温下铁与水反应3Fe + 4H2O(g)== 【高温】Fe3O4 + 4H241.铁与盐酸反应Fe + 2HCl=FeCl2+H2↑Fe + 2H+= Fe2++ H2↑42.氧化铁溶于盐酸中Fe2O3 + 6HCl=2FeCl3+3H2OFe2O3 + 6H+= 2Fe3++ 3H2O43.氯化铁中滴入氢氧化钠溶液(红褐色积淀)FeCl3 + 3NaOH = Fe(OH)3↓+3NaClFe3++ 3OH -= Fe(OH)3↓44.氢氧化亚铁在空气中被氧化(白色积淀变成红褐色积淀)4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)345.氯化亚铁溶液中通入氯气2FeCl2 + Cl2 = 2FeCl32 Fe2++ Cl2 = 2 Fe3++ 2Cl -46.氯化铁溶液中加入铁粉2FeCl3 + Fe = 3FeCl22Fe3++ Fe = 3Fe2+47.用 KSCN 检验的存在离子方程式Fe3+ +3SCN- = Fe(SCN)3。
高中必修一化学方程式汇总

1, 氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二,金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡 Fe+SnCl2==FeCl2+Sn)非金属氢化物(HF,HCl,H2O,H2S,NH3)1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O 14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O 2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2非金属氧化物1,低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H22,氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2金属氧化物1,低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2,氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al. 一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3,与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4,与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O含氧酸1,氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2,还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2,Br2,I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3,酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4,不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O碱1,低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)32,与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaClNaOH+Al(OH)3===NaAlO2+2H2O(AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OMg(OH)2+2NH4Cl===MgCl2+2NH3.H2OAl(OH)3+NH4Cl 不溶解3,不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O盐1,氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应) Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22,还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4,与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O22KMnO4===K2MnO4+MnO2+O22KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2Ca(HCO3)2===CaCO3+H2O+CO2CaCO3===CaO+CO2MgCO3===MgO+CO2。
高一必修一化学方程式总结(全)

...高一化学方程式总结〔1〕.Fe与O2:3Fe+2O2Fe3O4 一.钠:〔2〕.Al2O3电解:2Al2O34Al+3O2↑〔1〕.Na在空气中与O2:4Na+O2=2Na2O〔白色〕〔2〕.Na在O2中燃烧:2Na+O2Na2O2〔淡黄色〕〔3〕.Na与S:2Na+S=Na2S〔研磨即爆炸〕〔4〕.Na与Cl2:2Na+C2l2NaCl〔5〕.Na与H2O:2Na+2H2O=2NaOH+H2↑〔2Na+2H2O +-=2Na+2OH+H2↑〕+〔6〕.Na与HCl:2Na+2HCl=2NaCl+H2↑〔2Na+2H +=2Na+H2↑〕〔7〕.Na与CuSO4溶液:2Na+2H2O+CuSO4=Na2SO4+ Cu(OH)2↓+H2↑〔8〕.Na与FeC3l溶液:6Na+6H2O+2FeC3l=6NaCl+ 〔3〕.Fe与H2O〔g〕高温:3Fe+4H2O〔g〕Fe3O4+4H23+2+〕〔4〕.FeCl3+Fe:2FeCl3+Fe=3FeC2l〔2Fe+Fe=3Fe2+3+〔5〕.FeCl2+Cl2:2FeCl2+Cl2=2FeCl3〔2Fe+Cl2=2Fe -+2Cl〕〔6〕.FeCl3与Cu:2FeCl3+Cu=2FeC2l+CuC2l(用于雕刻3+2+2+〕铜线路板)〔2Fe+Cu=2Fe+Cu〔7〕.FeO与HCl:FeO+2HCl=FeC2l+H2O〔同H2SO4〕+2+〔FeO+2H=Fe+H2O〕〔8〕.Fe2O3与HCl:Fe2O3+6HCl=2FeC3l+3H2O〔同+=2Fe3++3H2O〕H2SO4〕〔Fe2O3+6H〔9〕.Fe3O4与HCl:Fe3O4+8HCl=2FeC3l+FeC2l+4H2O +2+3+〔同H2SO4〕〔Fe3O4+8H=Fe+2Fe+4H2O〕〔10〕.FeSO4与NaOH:FeSO4+2NaOH=Fe(OH)2↓+2Fe(OH)3↓+3H2↑〔9〕.Na2O与H2O:Na2O+H2O=2NaOH 〔10〕.Na2O与CO2:Na2O+CO2=Na2CO32+-=Fe(OH)2↓〕Na2SO4〔Fe+2OH〔11〕.FeCl3与NaOH:FeCl3+3NaOH=Fe(OH)3↓+3NaCl〔11〕.Na2O2与H2O:2Na2O2+2H2O=4NaOH+O2↑+-〔2Na2O2+2H2O=4Na+4OH+O2↑〕〔12〕.Na2O2与CO2:2Na2O2+2CO2=2Na2CO3+O2〔供氧〕〔13〕.Na2CO3与HCl:Na2CO3+2HCl=2NaCl+H2O+2-+CO2↑〔互滴鉴别〕〔CO3+2H=H2O+CO2↑〕〔14〕.NaHCO3与HCl:NaHCO3+HCl=NaCl+H2O+CO2 -+↑〔HCO3+H=H2O+CO2↑〕〔15〕.NaHCO3与NaOH:NaHCO3+NaOH=Na2CO3+H2O --2-〔HCO3+OH=CO3+H2O〕〔16〕.Na2CO3与H2O与CO2:Na2CO3+H2O+CO2=2--〕2NaHCO3〔鉴别、除杂〕〔CO3+H2O+CO2=2HCO33+-=Fe(OH)+3OH3↓〕+〔Fe(OH)3+3H3+=Fe〔Fe〔12〕.Fe(OH)2与H2O与O2:4Fe(OH)2+2H2O+O2=4Fe(OH)3〔白色沉淀→灰绿色沉淀→红褐色沉淀〕〔13〕.Fe(OH)2与HCl.Fe(OH)2+2HCl==FeC2l+2H2O+2+〔Fe(OH)2+2H=Fe+2H2O〕〔14〕.Fe(OH)3与HCl:Fe(OH)3+3HCl==FeC3l+3H2O+3H2O〕〔15〕.Fe(OH)3加热:2Fe(OH)3Fe2O3+3H2O 〔16〕.FeCl3与KSCN F:eCl3+3KSCN==Fe(SCN3+)3KCl 3+-3+〔Fe=Fe(SCN3)〕(红色溶液,用于鉴别Fe +3SCN)〔17〕.NaHCO3分解:2NaHCO3Na2CO3+H2O+CO2↑〔18〕.NaOH与CO2(少量):2NaOH+CO2(少量)=Na2CO3 -2-+H2O〔2OH+CO2(少量)=CO3 +H2O〕〔17〕.FeCl3与H2S(少量):2FeCl3+H2S(少量)=2FeC2l+2HCl+S↓〔18〕.FeCl3与KI:2FeCl3+2KI=2FeC2l+2KCl+2I↓〔19〕.FeCl3与H2O:FeCl3+3H2OFe(OH)3(胶体)+3HCl〔19〕.NaOH与CO2〔过量〕:NaOH+CO2〔过量〕=NaHCO3〔OH --〕+CO2〔过量〕=HCO3二.铝:〔20〕.C与H2O:C+H2OCO+H2(生成水煤气) 四.硅:〔1〕Si与NaOH与H2O:Si+2NaOH+H2O=Na2SiO3+-2-2H2↑〔Si+2OH+H2O=SiO3+2H2↑〕...〔1〕.Al与6HCl:2Al+6HCl=2AlC3l+3H2↑〔同H2SO4〕〔2Al+6H+=2Al3++3H2↑〕〔2〕Si与HF:Si+4HF=SiF4+2H2↑〔3〕Si与F2:Si+2F2=SiF4〔2〕.Al与NaOH与H2O:2Al+2NaOH+2H2O=2--NaAlO2+3H2↑〔2Al+2OH+2H2O=2AlO2+3H2↑〕〔3〕.Al2O3与HCl:Al2O3+6HCl=2AlC3l+3H2O+3+〔Al2O3+6H=2Al+3H2O〕〔4〕.Al2O3与NaOH:Al2O3+2NaOH=2NaAlO2+H2O--〔Al2O3+2OH=2AlO2+H2O〕〔5〕.Al(OH)3与HCl:Al(OH)3+3HCl=AlC3l+3H2O+3+〔Al(OH)3+3H=Al+3H2O〕〔6〕.Al(OH)3与NaOH:Al(OH)3+NaOH=NaAlO2+2H2O--〔Al(OH)3+OH=AlO2+2H2O〕〔7〕.2Al(OH)3Al2O3+3H2O〔8〕.AlCl3与NH3·H2O:AlCl3+3NH3·H2O=Al(OH)3↓+3++3NH4Cl〔Al+3NH3·H2O=Al(OH)3↓+3NH4〕〔9〕.NaAlO2与HCl与H2O:-+NaAlO2+HCl+H2O=NaCl+Al(OH)3↓〔AlO2+H+H2O=Al(OH)3↓〕〔4〕Si与O2:Si+O2SiO2〔研细的硅与纯氧〕〔5〕Si与C:Si+CSiC〔6〕C与SiO2:2C+SiO22CO↑+Si〔工业制粗硅〕〔7〕Cl2:与Si:2Cl2+Si=SiC4l〔8〕SiC4l与H2:SiCl4+2H2=Si+4HC〔l粗硅提纯〕〔9〕SiO2与NaOH:SiO2+2NaOH=Na2SiO3+H2O-2-〔SiO2+2OH=SiO3+H2O〕〔10〕CaO与SiO2::CaO+SiO2CaSiO3〔11〕SiO2与HF:SiO2+4HF=SiF4+2H2O〔12〕Na2SiO3与HCl:Na2SiO3+2HCl=2NaCl+H2SiO3↓〔13〕Na2SiO3与H2O与CO2:Na2SiO3+H2O+CO2=NaCO+HSiO↓〔强酸制弱酸〕2323〔14NaH〕SiOOCO()NaSiO+HO+2CO与23222322与过量:()=2NaHCO+HSiO过量↓323〔10〕.NaAlO2与CO2(少量)与H2O:2NaAlO2+CO2(少量)+3H2O=2Al(OH)3↓+Na2CO3-2-〕〔12〕.AlO2+CO2(少量)+3H2O=2Al(OH)3↓+CO3〔11〕.NaAlO2与CO2(过量)与2H2O:NaAlO2+CO2(过量)+2H2O=Al(OH)3↓+NaHCO3--〕〔AlO2+CO2(过量)+2H2O=Al(OH)3↓+HCO3〔12〕.Al与O2:4Al+3O2=2Al2O3〔15〕SiO2与Na2CO3:SiO2+Na2CO3Na2SiO3+CO2↑〔16〕SiO2与CaCO3:SiO2+CaCO3CaSiO3+CO2↑〔工业制玻璃〕〔17〕H2SiO3与NaOH:H2SiO3+2NaOH==Na2SiO3+ 2H2O〔18〕H2SiO3分解:H2SiO3SiO2+H2O五.氯:三.铁:〔1〕Cu与Cl2:Cu+Cl2CuCl2(棕黄色烟) CaSO3↓+H2O〔11〕Ca(OH)2与SO2(过量):Ca(OH)2+SO2(过量)〔2〕Cl2与Fe:3Cl2+2Fe2FeCl3(棕黄色烟)〔高价产物〕=Ca(HSO3)2〔12〕CaO与SO2:CaO+SO2=CaSO3〔13〕SO2与O2:2SO2+O22SO3〔3〕Na与Cl2:2Na+Cl22NaCl(白烟) 〔14〕Cl2与SO2:Cl2+SO2+2H2O=H2SO4+2HCl(同Br2、+2--I2)〔Cl2+SO2+2H2O=4H+SO4+2Cl)〔15〕H2S与SO2:2H2S+SO2=2H2O+3S↓〔4〕Cl2与H2:Cl2+H22HCl(燃烧苍白色火焰,光照〔16〕SO3与H2O:SO3+H2O=H2SO4〔17〕CaO与SO3:CaO+SO3=CaSO4会爆炸)〔5〕Cl2与P:3Cl2+2P2PCl3(液体) 〔18〕H2S与O2(少量):2H2S+O2(少量)2H2O+2S〔6〕Cl2与P:5Cl2+2P2PCl5(固体)〔白色烟雾〕〔7〕Cl2与H2O:Cl2+H2OHCl+HClO(新制氯水成分+,Cl-,ClO-,OH-)三分子H2O,C2l,HClO四离子H〔8〕Cl2与2NaOH:Cl2+2NaOH=NaCl+NaClO+H2O〔9〕Cl2与Ca(OH)2:2Cl2+2Ca(OH)2=CaC2l+Ca(ClO)2+2H2O 〔19〕H2S+O2(足量):2H2S+3O2(足量)2H2O+2SO2 〔20〕FeS与HCl:FeS+2HCl=H2S↑+FeC2l(同H2SO4,实验室制备H2S)〔21FeSO4FeS〕与:+11O2FeO+8SO2222232〔22SOH〕与O SO+HO=HSO〔工业制硫酸〕:323224〔工业制漂白粉〕〔10〕漂白粉的漂白原理Ca(ClO)2与H2O与CO2(少量):七.氮Ca(ClO)2+H2O+CO2(少量)=CaCO3↓+2HClO〔强酸制弱酸〕〔1〕N2与H2:N2+3H22NH3〔工业合成氨〕〔11〕漂白粉的失效原理Ca(ClO)2与H2O与CO2(少量):〔2〕N2与O2:N2+O22NOCa(ClO)+HO+CO()=CaCO+2HClO少量↓22232HClO2HCl+O2↑〔12〕FeCl2与Cl2:2FeCl2+C2l=2FeC3lN2与Mg:N2+3MgMg3N2〔3〕〔4〕NO与O2:2NO+O2=2NO2〔13〕NaBr与Cl2:2NaBr+Cl2==2NaCl+Br2〔2Br -+C2l〔5〕2NO2N2O4-==2Cl+Br2〕- 〔14〕KI+C2l:2KI+C2l==2KCl+2I〔2I -+Cl2==2Cl + 〔6〕NO2与H2O:3NO2+H2O=2HNO3+NO〔7〕NO与3O2与2H2O:NO+3O2+2H2O=4HNO3〔8〕NO2与O2与H2O:4NO2+O2+2H2O=4HNO3I2〕〔15〕实验室制备氯气MnO2与HCl(浓):MnO2+4HCl(浓)+-MnCl2+Cl2↑+2H2O〔MnO2+4H+2Cl 〔9〕Na2SO3与H2SO4:Na2SO3+H2SO4=Na2SO4+SO2+H2O〔实验室制备SO2〕〔10〕Na2SO3+O2:2Na2SO3+O2=2Na2SO4 〔11〕SO2(少量)与NH3与H2O:SO2(少量)+2NH3+H2O=2+Mn+Cl2↑+2H2O〕〔16〕NaX与AgNO3:NaX+AgNO3=AgX↓+NaNO3〔X=Cl,Br,I〕(沉淀不溶于HNO3,根据沉淀颜色鉴别卤离子) (NH4)2SO3++OH-〔12〕NH3+H2ONH3·H2ONH4〔13〕NH3与HCl:NH3+HCl=NH4Cl(白烟) 〔14〕NH3与HNO3:NH3+HNO3=NH4NO3(白烟)〔17〕NaCl与AgNO3:NaCl+AgNO3=AgCl↓+NaN3O 〔15〕NH3与H2SO4:2NH3+H2SO4=(NH4)2SO4(白色沉淀)〔18〕NaBr与AgNO3:NaBr+AgNO3=AgBr↓+NaN3O (浅黄色沉淀) 〔16〕NH3与O2:4NH3+5O24NO+6H2O〔17〕NO+O2:2NO+O2=2NO2〔18〕NO2+H2O:3NO2+H2O=2HNO3+NO〔工业制硝酸〕〔19〕KI与AgNO3:KI+AgNO3=AgI↓+KN3O(黄色沉淀)〔19〕NH4Cl受热分解:NH4ClNH3↑+HCl↑〔20〕NH4HCO3六.硫:受热分解:NH4HCO3NH3↑+H2O+CO2↑〔1〕Na与S加热:2Na+SNa2S〔2〕Fe与S:Fe+SFeS 〔21〕(NH4)2SO4与NaOH:(NH4)2SO4+2NaOH〔3〕Cu与S:2Cu+SCu2S〔低价产物〕+ Na2SO4+2NH3↑+2H2O(用于检验NH4)〔4〕H2与S:H2+SH2S 〔22〕NH4Cl与Ca(OH)2:2NH4Cl+Ca(OH2)CaCl2+2NH3↑+2H2O〔实验室制氨气〕〔5〕S与O2:S+O2SO2八.硫酸〔6〕S与NaOH:3S+6NaOH2Na2S+Na2SO3+ 〔1〕H2SO4(浓)与Cu:2H2SO4(浓)+CuCuSO4+-2-2-3H2O〔3S+6OH2S+SO3+3H2O〕〔7〕SO2:与H2O:SO2+H2OH2SO3〔注意“可逆反响〞的定义〕〔8〕NaOH与SO2(少量):2NaOH+SO2(少量)=Na2SO3+ 2H2O+SO2↑〔2〕HSO2↑2SO4(浓)与Zn:2H2SO4(浓)+Zn=ZnSO4+2H2O+〔3〕H2SO4(浓)与Fe〔少量〕:6H2SO4(浓)+2FeFe2(SO4)3+6H2O+3SO2↑(Fe少量)H2O 〔4〕H2SO4(浓)与C:2H2SO4(浓)+CCO2↑+2H2O〔9〕NaOH与SO2〔过量〕:NaOH+SO2〔过量〕=NaHSO3+2SO2↑〔10〕Ca(OH)2与SO2(少量):Ca(OH)2+SO2(少量)= 〔5〕H2SO4(浓)与S:2H2SO4(浓)+S2H2O+3SO2↑〔6〕H2S+H2SO4(浓):H2S+H2SO4(浓)=S↓+SO2↑+2+SO2↑+2H2O〔7〕HBr+H2SO4(浓):2HBr+H2SO4(浓)=Br2H2O〔8〕HNO3遇光分解:4HNO34NO2↑+O2↑+2H2O〔硝酸显黄色的原因〕〔9〕Cu与HNO3(浓)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O +-2+〔Cu+4H+2NO3=Cu+2NO2↑+2H2O〕(10)HNO3(稀)与Cu:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O+-2+〔3Cu+8H+2NO3=3Cu+2NO↑+4H2O〕〔11〕HNO3(浓)与Fe:6HNO3(浓)+FeFe(NO3)3+3H2O+3NO2↑〔12〕HNO3(稀)与Fe(足量):8HNO3(稀)+3Fe(足量)= 3Fe(NO3)2+2NO↑+4H2O〔13〕HNO3(稀)与Fe(少量):4HNO3(稀)+Fe(少量)= Fe(NO3)3+NO↑+2H2O〔14〕C与HNO3(浓):C+4HNO3(浓)CO2↑+4NO2↑+2H2O。
人教版高一化学必修1方程式归纳

人教版《化学必修1》化学方程式归纳一、铝及其化合物1.铝与氧气的反应:4Al + 3O2 2Al2O32。
铝与氧化铁反应(铝热反应):2Al + Fe2O3高温2Fe + Al2O33.铝和稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑离子方程式:2Al + 6H+ = 2Al3+ + 3H2↑4。
铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑5。
氧化铝和稀硫酸:Al2O3+3H2SO4=Al2(SO4)3+3H2O_离子方程式:Al2O3+6H+=2Al3++3H2O6.氧化铝和NaOH溶液:Al2O3+ 2NaOH = 2NaAlO2+H2O 离子方程式:Al2O3+ 2OH-=2AlO2-+H2O7.氢氧化铝和盐酸:Al(OH)3+3HCl = AlCl3+3H2O离子方程式:Al(OH)3+3H+ = Al3++3H2O8.氢氧化铝和NaOH溶液:Al(OH)3+NaOH = NaAlO2+2H2O离子方程式:Al(OH)3+OH-=AlO2-+2H2O9。
氢氧化铝受热分解:_2Al(OH)3Al2O3+3H2O_10.硫酸铝与氨水反应:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4离子方程式:_ Al3++3NH3·H2O=Al(OH)3↓+3NH4+_______11.AlCl3溶液中加入少量NaOH溶液:AlCl3+3NaOH=A l(O H)3↓+3NaClAlCl3溶液中加入过量NaOH溶液:AlCl3+ 4NaOH =NaAlO2+ 3NaCl+2H2O 12。
往偏铝酸钠溶液中通入少量CO2:2NaAlO2+3H2O+CO2=2A l(O H)3↓+Na2CO3往偏铝酸钠溶液中通入足量CO2:NaAlO2+2H2O+CO2=A l(O H)3↓+NaHCO313.电解氧化铝: 2Al2O34Al+3O2↑二、钠及其化合物1。
高中必修一化学方程式以及离子方程式(按章节)

高中必修一化学方程式以及离子方程式(按章节)化学方程式和离子方程式是化学反应的表达方式,通过它们可以清晰地描述反应物和生成物之间的关系。
下面是几个常见的化学反应及其方程式:1、硫酸根离子的检验:BaCl2 + Na2SO4 = BaSO4 ↓+ 2NaClSO4 2-+ Ba2+== BaSO4 ↓2、碳酸根离子的检验:CaCl2 + Na2CO3 = CaCO3 ↓ + 2NaClCO3 2-+ Ca2+== CaCO3 ↓3、碳酸钠与盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑CO3 2-+ 2H+== CO2 ↑+ H2O4、铝与硝酸铜溶液反应:2Al+3Cu(NO3)2 = 2Al(NO3)3 + 3Cu 2Al+3Cu2+= 2Al3++ 3Cu5、钠在空气中燃烧:2Na + O2 = 2Na2O钠块在空气中变暗:4Na + O2 = 2Na2ONa2O在空气中加热(变黄):2Na2O + O2 = 4NaOH6、钠与水反应:2Na + 2H2O = 2 NaOH + H2 ↑2Na + 2H2O = 2Na+ + 2OH- + H2 ↑7、过氧化钠与水的反应:2Na2O2 + 2H2O = 4NaOH + O2 ↑2Na2O2 + 2H2O = 4Na+ + 4OH- + O2 ↑碱性氧化物Na2O与水的反应:Na2O + H2O = 2NaOH8、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O29、XXX(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液:Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑CO3 2-+ 2H+== H2O + CO2 ↑②纯碱溶液中滴加盐酸,至过量:Na2CO3 + HCl = NaHCO3 + NaClCO3 2-+ H+== HCO3- + Na+NaHCO3 + HCl = NaCl + H2O + CO2 ↑HCO3-+ H+== H2O + CO2 ↑10、小苏打受热分解:2NaHCO3 △= Na2CO3 + H2O + CO2 ↑11、固体氢氧化钠和碳酸氢钠混合物在密闭中加热:NaHCO3 + NaOH △= Na2CO3 + H2OHCO3-+ OH-== CO3 2-+ H2O1.氮气和氧气在放电下会反应,产生二氧化氮。
(完整版)高一必修一化学方程式总结(全)

高一化学方程式总结一.钠:(1).Na在空气中与O2:4Na + O2 = 2Na2O(白色)(2).Na在O2中燃烧:2Na + O2Na2O2(淡黄色)(3).Na与S:2Na + S = Na2S(研磨即爆炸)(4).Na与Cl2:2Na + Cl22NaCl(5).Na与H2O:2Na + 2H2O = 2NaOH + H2↑ (2Na + 2H2O = 2Na+ + 2OH- + H2↑)(6).Na与HCl:2Na + 2HCl = 2NaCl + H2↑ (2Na + 2H+ =2Na+ + H2↑ )(7).Na与CuSO4溶液:2Na + 2H2O + CuSO4 = Na2SO4+ Cu(OH)2↓ + H2↑(8).Na与FeCl3溶液:6Na + 6H2O + 2FeCl3 = 6NaCl + 2Fe(OH)3↓ + 3H2↑(9).Na2O与H2O:Na2O + H2O = 2NaOH(10).Na2O与CO2:Na2O + CO2= Na2CO3(11).Na2O2与H2O:2Na2O2 + 2H2O = 4NaOH + O2↑(2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑)(12).Na2O2与CO2:2Na2O2 + 2CO2 = 2Na2CO3 + O2(供氧)(13).Na2CO3与HCl:Na2CO3 +2HCl = 2NaCl + H2O +CO2↑(互滴鉴别)(CO32- + 2H+ = H2O + CO2↑)(14).NaHCO3与HCl:NaHCO3 + HCl = NaCl + H2O + CO2↑(HCO3- + H+ = H2O + CO2↑)(15).NaHCO3与NaOH:NaHCO3 +NaOH=Na2CO3 + H2O (HCO3- + OH- = CO32- + H2O)(16).Na2CO3与H2O 与CO2 :Na2CO3 + H2O + CO2 =2NaHCO3(鉴别、除杂)(CO32- + H2O + CO2 = 2HCO3-)(17).NaHCO3 分解:2NaHCO3Na2CO3+H2O+ CO2↑(18).NaOH与CO2 (少量):2NaOH + CO2 (少量) = Na2CO3 + H2O (2OH-+ CO2 (少量) = CO32- + H2O)(19).NaOH 与CO2(过量):NaOH + CO2(过量)= NaHCO3(OH -+ CO2(过量)= HCO3-)二.铝:(1).Al与6HCl:2Al+6HCl=2AlCl3+3H2↑(同H2SO4)(2Al+6H+ =2Al3+ + 3H2↑ )(2).Al 与NaOH 与H2O:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑(2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑)(3).Al2O3与HCl:Al2O3 + 6HCl = 2AlCl3 + 3H2O(Al2O3 + 6H+ =2Al3+ + 3H2O)(4).Al2O3与NaOH:Al2O3+2NaOH=2NaAlO2+H2O(Al2O3 + 2OH- = 2AlO2- + H2O )(5).Al(OH)3与HCl:Al(OH)3 + 3HCl = AlCl3 + 3H2O(Al(OH)3 + 3H+ = Al3+ + 3H2O)(6).Al(OH)3与NaOH:Al(OH)3+NaOH=NaAlO2+2H2O (Al(OH)3 + OH- = AlO2- + 2H2O)(7).2Al(OH)3Al2O3 + 3H2O(8).AlCl3与NH3·H2O:AlCl3 + 3NH3·H2O = Al(OH)3↓ + 3NH4Cl (Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+)(9).NaAlO2与HCl与H2O:NaAlO2+HCl+H2O=NaCl+Al(OH)3↓ (AlO2- + H+ +H2O = Al(OH)3↓ )(10).NaAlO2 与CO2(少量)与H2O:2NaAlO2 + CO2(少量)+3H2O=2Al(OH)3↓+Na2CO3(12).AlO2- + CO2(少量)+ 3H2O = 2Al(OH)3↓ + CO32-)(11).NaAlO2与CO2(过量)与2H2O:NaAlO2+CO2(过量)+2H2O=Al(OH)3↓+NaHCO3(AlO2- + CO2(过量) + 2H2O = Al(OH)3↓ + HCO3-)(12).Al 与O2 :4Al + 3O2 = 2Al2O3三.铁:(1).Fe与O2:3Fe+2O2Fe3O4(2).Al2O3电解:2Al2O34Al+3O2↑(3).Fe与H2O(g)高温:3Fe+4H2O(g)Fe3O4+4H2(4).FeCl3 + Fe :2FeCl3 + Fe = 3FeCl2(2Fe3+ + Fe = 3Fe2+)(5).FeCl2+Cl2:2FeCl2+Cl2=2FeCl3(2Fe2+ + Cl2 = 2Fe3++2Cl-)(6).FeCl3与Cu:2FeCl3 + Cu = 2FeCl2 + CuCl2(用于雕刻铜线路板) (2Fe3+ + Cu = 2Fe2++ Cu2+)(7).FeO与HCl:FeO+ 2HCl = FeCl2 + H2O(同H2SO4)(FeO+2H+=Fe2+ +H2O )(8).Fe2O3 与HCl :Fe2O3 + 6HCl = 2FeCl3 + 3H2O(同H2SO4)(Fe2O3 + 6H+=2Fe3+ + 3H2O)(9).Fe3O4 与HCl:Fe3O4 + 8HCl = 2FeCl3 + FeCl2 +4H2O(同H2SO4)(Fe3O4 + 8H+=Fe2+ +2Fe3+ +4H2O)(10).FeSO4与NaOH:FeSO4 + 2NaOH=Fe(OH)2↓ +Na2SO4(Fe2+ + 2OH-=Fe(OH)2↓)(11).FeCl3与NaOH:FeCl3 + 3NaOH=Fe(OH)3 ↓+ 3NaCl (Fe3+ + 3OH-=Fe(OH)3 ↓)(12).Fe(OH)2 与H2O 与O2:4Fe(OH)2 + 2H2O + O2 =4Fe(OH)3 (白色沉淀→灰绿色沉淀→红褐色沉淀)(13).Fe(OH)2与HCl.Fe(OH)2+2HCl==FeCl2+2H2O(Fe(OH)2 + 2H+=Fe2+ + 2H2O)(14).Fe(OH)3与HCl:Fe(OH)3+3HCl==FeCl3+3H2O(Fe(OH)3 + 3H+ = Fe3+ + 3H2O)(15).Fe(OH)3加热:2Fe(OH)3Fe2O3 + 3H2O(16).FeCl3与KSCN:FeCl3+3KSCN==Fe(SCN)3+3KCl(Fe3++ 3SCN- = Fe(SCN)3)(红色溶液,用于鉴别Fe3+) (17).FeCl3与H2S(少量):2FeCl3 + H2S(少量) = 2FeCl2 + 2HCl + S↓ (18).FeCl3与KI:2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2↓(19).FeCl3与H2O:FeCl3+3H2O Fe(OH)3(胶体)+3HCl (20).C与H2O:C+H2O CO+H2 (生成水煤气)四.硅:(1)Si与NaOH与H2O:Si + 2NaOH + H2O = Na2SiO3 +2H2↑ (Si+2OH-+H2O= SiO32- + 2H2↑)(2)Si与HF:Si+ 4HF = SiF4 + 2H2↑(3)Si与F2:Si+ 2F2 = SiF4(4)Si与O2:Si+O2SiO2 (研细的硅与纯氧)(5)Si 与C:Si + C SiC(6)C与SiO2:2C+ SiO22CO↑+Si(工业制粗硅)(7)Cl2:与Si:2Cl2+Si= SiCl4(8)SiCl4 与H2:SiCl4 +2H2=Si+4HCl(粗硅提纯)(9)SiO2 与NaOH:SiO2 + 2NaOH = Na2SiO3 + H2O(SiO2 + 2OH- = SiO32-+ H2O )(10)CaO与SiO2::CaO+SiO2CaSiO3(11)SiO2 与HF:SiO2 + 4HF = SiF4 + 2H2O(12)Na2SiO3 与HCl:Na2SiO3 +2HCl=2NaCl+H2SiO3↓(13)Na2SiO3 与H2O与CO2:Na2SiO3 + H2O+CO2 =Na2CO3 + H2SiO3↓(强酸制弱酸)(14)Na2SiO3与H2O与CO2 (过量):Na2SiO3 + H2O+ 2CO2 (过量) = 2NaHCO3+H2SiO3↓(15)SiO2与Na2CO3:SiO2 + Na2CO3Na2SiO3+ CO2↑ (16)SiO2 与CaCO3:SiO2 + CaCO3CaSiO3+ CO2↑(工业制玻璃)(17)H2SiO3与NaOH:H2SiO3 + 2NaOH == Na2SiO3 +2H2O(18)H2SiO3分解:H2SiO3 SiO2 + H2O五.氯:(1)Cu与Cl2:Cu+Cl2CuCl2 (棕黄色烟)(2)Cl2与Fe:3Cl2+2Fe2FeCl3(棕黄色烟) (高价产物)(3)Na 与Cl2 :2Na + Cl2 2NaCl (白烟)(4)Cl2 与H2:Cl2 +H22HCl (燃烧苍白色火焰,光照会爆炸)(5)Cl2 与P:3Cl2 + 2P 2PCl3 (液体)(6)Cl2 与P:5Cl2 + 2P 2PCl5(固体) (白色烟雾)(7)Cl2与H2O:Cl2+H2O HCl+HClO (新制氯水成分三分子H2O,Cl2,HClO四离子H+,Cl-,ClO-,OH-)(8)Cl2 与2NaOH:Cl2 + 2NaOH = NaCl + NaClO + H2O(9)Cl2与Ca(OH)2:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O (工业制漂白粉)(10)漂白粉的漂白原理Ca(ClO)2与H2O与CO2(少量) :Ca(ClO)2+H2O+ CO2(少量) = CaCO3↓+2HClO (强酸制弱酸)(11)漂白粉的失效原理Ca(ClO)2与H2O与CO2(少量):Ca(ClO)2+H2O+CO2(少量) = CaCO3↓+ 2HClO2HClO2HCl+O2↑(12)FeCl2与Cl2:2FeCl2 + Cl2 = 2FeCl3(13)NaBr 与Cl2:2NaBr + Cl2 == 2NaCl + Br2(2Br - + Cl2 == 2Cl- + Br2)(14)KI + Cl2:2KI + Cl2 == 2KCl + I2(2I- + Cl2 == 2Cl- + I2)(15)实验室制备氯气MnO2与HCl(浓):MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O (MnO2+ 4H+ + 2Cl-Mn2+ + Cl2↑ + 2H2O)(16)NaX与AgNO3:NaX+AgNO3=AgX↓+NaNO3(X=Cl,Br,I)(沉淀不溶于HNO3,根据沉淀颜色鉴别卤离子)(17)NaCl 与AgNO3:NaCl + AgNO3 = AgCl↓ + NaNO3 (白色沉淀)(18)NaBr 与AgNO3:NaBr + AgNO3 = AgBr↓ + NaNO3 (浅黄色沉淀)(19)KI 与AgNO3:KI +AgNO3 = AgI↓ + KNO3 (黄色沉淀)六.硫:(1)Na 与S加热:2Na + S Na2S(2)Fe与S:Fe+S FeS(3)Cu与S:2Cu+S Cu2S (低价产物)(4)H2与S:H2 + S H2S(5)S 与O2:S + O2 SO2(6)S 与NaOH:3S + 6NaOH 2Na2S + Na2SO3 + 3H2O (3S + 6OH-2S2- + SO32- + 3H2O)(7)SO2:与H2O:SO2+H2O H2SO3(注意“可逆反应”的定义)(8)NaOH与SO2 (少量):2NaOH+ SO2 (少量) = Na2SO3 + H2O(9)NaOH与SO2(过量):NaOH+ SO2(过量)= NaHSO3(10)Ca(OH)2 与SO2 (少量) :Ca(OH)2 + SO2 (少量) =CaSO3↓+ H2O(11)Ca(OH)2 与SO2(过量):Ca(OH)2 + SO2(过量)=Ca(HSO3)2(12)CaO与SO2:CaO+ SO2 = CaSO3(13)SO2与O2:2SO2+O2 2SO3(14)Cl2与SO2:Cl2+SO2 +2H2O=H2SO4+2HCl (同Br2、I2) (Cl2+SO2 +2H2O= 4H+ + SO42- + 2Cl-)(15)H2S 与SO2:2H2S + SO2= 2H2O + 3S↓(16)SO3与H2O:SO3+H2O=H2SO4(17)CaO与SO3:CaO+ SO3 = CaSO4(18)H2S 与O2(少量):2H2S + O2(少量) 2H2O+2S (19)H2S + O2(足量):2H2S + 3O2(足量) 2H2O + 2SO2(20)FeS 与HCl:FeS + 2HCl = H2S↑ + FeCl2(同H2SO4,实验室制备H2S)(21)FeS2与O2:4FeS2+11O22Fe2O3 + 8SO2(22)SO3与H2O:SO3+H2O=H2SO4(工业制硫酸)七.氮(1)N2与H2:N2+3H22NH3(工业合成氨)(2)N2与O2:N2+O22NO(3)N2 与Mg:N2 + 3Mg Mg3N2(4)NO 与O2:2NO + O2 = 2NO2(5)2NO 2 N2O4(6)NO2与H2O:3NO2+H2O = 2HNO3+NO(7)NO与3O2与2H2O:NO+3O2+2H2O=4HNO3(8)NO2与O2与H2O:4NO2+O2+2H2O=4HNO3(9)Na2SO3与H2SO4:Na2SO3+H2SO4=Na2SO4+SO2 +H2O (实验室制备SO2)(10)Na2SO3 + O2:2Na2SO3 + O2 = 2Na2SO4(11)SO2(少量) 与NH3 与H2O: SO2(少量) + 2NH3 + H2O = (NH4)2SO3(12)NH3+H2O NH3·H2O NH4++OH-(13)NH3 与HCl :NH3 + HCl = NH4Cl(白烟)(14)NH3 与HNO3:NH3 + HNO3 = NH4NO3(白烟)(15)NH3 与H2SO4:2NH3 + H2SO4 = (NH4)2SO4(16)NH3与O2:4NH3+5O2 4NO+6H2O(17)NO + O2:2NO + O2 = 2NO2(18)NO2+H2O:3NO2+H2O=2HNO3+NO(工业制硝酸)(19)NH4Cl受热分解:NH4Cl NH3↑+HCl↑(20)NH4HCO3受热分解:NH4HCO3NH3↑+ H2O +CO2↑(21)(NH4)2SO4与NaOH:(NH4)2SO4 + 2NaOHNa2SO4 + 2NH3↑+ 2H2O (用于检验NH4+)(22)NH4Cl 与Ca(OH)2:2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑+2H2O(实验室制氨气)八.硫酸(1)H2SO4(浓) 与Cu:2H2SO4(浓) + Cu CuSO4 + 2H2O + SO2↑(2)H2SO4(浓) 与Zn:2H2SO4(浓) +Zn = ZnSO4 + 2H2O + SO2↑(3)H2SO4(浓) 与Fe(少量):6H2SO4(浓) + 2FeFe2(SO4)3 + 6H2O + 3SO2↑ (Fe少量)(4)H2SO4(浓) 与C:2H2SO4(浓) + C CO2↑ + 2H2O + 2SO2↑(5)H2SO4(浓) 与S:2H2SO4(浓) + S 2H2O + 3SO2↑(6)H2S + H2SO4(浓):H2S + H2SO4(浓)= S↓+ SO2↑+ 2H2O(7)HBr + H2SO4(浓):2HBr + H2SO4(浓)= Br2 + SO2↑+ 2H2O(8)HNO3遇光分解:4HNO3 4NO2↑+ O2↑+ 2H2O(硝酸显黄色的原因)(9)Cu与HNO3(浓)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑+ 2H2O)(10)HNO3(稀)与Cu:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑+ 4H2O)(11)HNO3(浓)与Fe:6HNO3(浓) + Fe Fe(NO3 )3+ 3H2O + 3NO2↑(12)HNO3(稀)与Fe(足量):8HNO3(稀) + 3Fe(足量)= 3Fe(NO3)2+2NO↑+4H2O(13)HNO3(稀)与Fe(少量):4HNO3(稀) + Fe(少量)= Fe(NO3)3 + NO↑ + 2H2O(14)C与HNO3(浓):C + 4HNO3(浓) CO2↑+ 4NO2↑+ 2H2O。
(完整版)人教版必修一化学方程式归纳齐全

人教版《化学必修1》化学方程式归纳、钠及其化合物1. 钠与氧气:常温:4Na+O= 2Na2O 点燃:2Na + O2 - Na zQ2. 钠与水反应:_2Na + 2H 2O = 2NaOH + H2 f _离子方程式:2Na + 2H2O = 2Na* + 20H + H 2 f3. 钠与硫酸反应:2Na +H2SQ = Na2SQ+Hd4. 氧化钠与水反应:NaaO+HO= 2NaOH5. 过氧化钠与二氧化碳反应:2Na2Q + 2CO 2 = 2Na 2CO +O2 f6. 过氧化钠与水反应:2N3Q+2H2O =4NaOH+O f 离子方程式:2Na2Q+2HO=4N扌+ 4OH+Q f7. NaOH溶液中通入少量CO: 2NaOH+CO Na z CO+HO 离子方程式:2OH+CO= CQ2「+HONaOH溶液中通入过量CO: NaOH+CO NaHCO 离子方程式:_ OH +CO= HCQ「_8. ①向碳酸钠溶液滴入少量稀盐酸:Na 2CO + HCI = NaHCO 3 + NaCI _______________向稀盐酸滴入少量碳酸钠溶液:Na 2CO + 2HCI = 2NaCI + H 2O + CO2 f ______________________②除去碳酸氢钠溶液中混有的碳酸钠:Na 2CO + H2O +CO =2NaHCO_________________③碳酸钠与氢氧化钙: ____ Na 2CO + Ca(OH) 2 = CaCOj + 2NaOH _______________④碳酸氢钠与盐酸:NaHCO 3+HCI= NaCI+HO+CO ____________________⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:NaHCQ+ Ca(OH)2 = CaCOj + NaOH+ H2O少量氢氧化钙溶液滴入碳酸氢钠溶液中:2NaHCQ+ Ca(OH)2 = CaCOj + Na 2CO + 2H 2O⑥除去碳酸钠溶液中的碳酸氢钠:NaHCO 3+ NaOH 二 W2CO + H 2O⑦除去碳酸钠固体中的碳酸氢钠:2NaHCQ Na z CO + H 2O +CQ f _________________⑧鉴别碳酸钠和碳酸氢钠溶液:Na 2CO + CaCI 2 = CaCOj + 2NaCI ______________、铝及其化合物1. 铝与氧气的反应:4AI + 3O 22AI 2Q高温2. 铝与氧化铁反应(铝热反应):2AI + Fe 2Q 2Fe + Al 2Q3. 铝和稀盐酸:2AI + 6HCI = 2AICI 3 + 3H 2 f 离子方程式:2AI + 6H + = 2AI 3+ + 3H 2 f4. 铝和NaOH溶液:2AI+2NaOH+2HO=2NaAIO+3H f 离子方程式: 2AI+2OH +2H2O=2AIQ_+3H f5. 氧化铝和稀硫酸:Al 2Q+3HSQ= Al 2(SO4)3+3HO 离子方程式: Al 2Q+6』=2AI 3*+3H2O6. 氧化铝和NaOH溶液:AI2Q + 2NaOH错误!未找到引用源。
高中化学必修1化学方程式总结
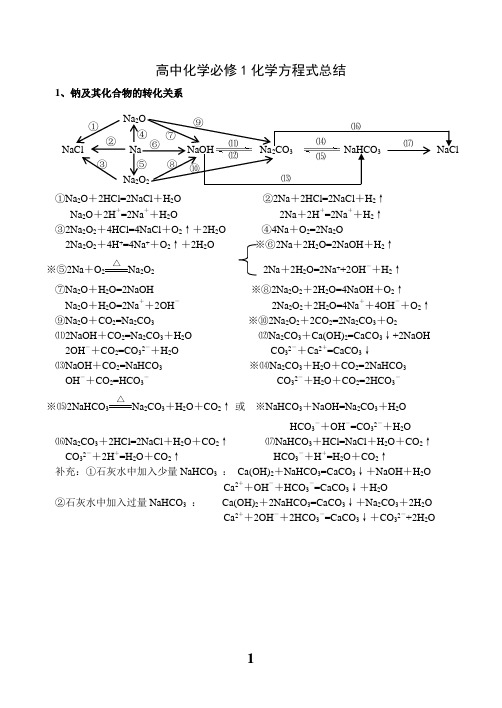
高中化学必修1化学方程式总结1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2ONaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④2、铝及其化合物的转化关系①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2OAl Al 2O 3 A l (O H )3 KAl(SO 4)2NaAlO 2AlCl 3 ① ② ③ ④ ⑤ ⑥⑦⑧ ⑨⑩⑾⑿①Fe 3O 4+4CO△3Fe +4CO 2 ※② 3Fe +4H 2O(g)高温Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀①Si +O 2△SiO 2②SiO 2+2C 高温 Si +2CO ↑※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO高温CaSiO 3※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+2OH -= SiO 32-+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑ SiO 32-+2H += H 2SiO 3↓※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △H 2O +SiO 2H 2SiO 3+2OH -= SiO 32-+2H 2O 5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △ Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClONa 2SiO 3 SiF 4 Si SiO 2 H 2SiO 3 CaSiO 3 ①②③ ④ ⑤⑥ ⑦ ⑧⑨ CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃或光照 光照光照①S +O 2 点燃SO 2②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系 ※①N 2+O 22NO※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
高一化学《必修一》化学方程式(按章节归纳)

高一化学《必修一》方程式(按章节归纳)第一、二章:1、硫酸根离子的检验: BaCl+ NaSO= BaSO↓+ 2NaCl2、碳酸根离子的检验: CaCl+ NaCO= CaCO↓ + 2NaCl3、银离子的检验: Cl+ Ag= AgCl ↓4、木炭还原氧化铜: 2CuO + C2Cu + CO↑5、铁片与硫酸铜溶液反应: Fe + CuSO= FeSO+ Cu6. 镁在二氧化碳中燃烧:2Mg + CO2MgO + C第三章:一、钠1、钠在空气中燃烧(黄色的火焰):2Na + O NaO2、钠块在空气中变暗:4Na+O=2NaO3、NaO在空气中加热(变黄):2NaO+O2NaO4、金属锂在空气中燃烧:4Li + O2LiO5、钠与水反应(浮、熔、游、响、红)2Na + 2HO = 2NaOH+ H↑2Na + 2HO = 2Na+ 2OH+ H↑二、NaO 、NaO的相关反应:1、碱性氧化物NaO与水的反应:NaO+HO=2NaOH2、过氧化钠与水的反应(放热反应、NaO是强氧化剂,可用于漂白)2NaO+ 2HO = 4NaOH + O↑2NaO+ 2HO = 4Na+4OH+O↑3、碱性氧化物NaO与CO的反应NaO + CO= NaCO4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是:2NaO+ 2CO = 2NaCO+ O5、NaO + SO= NaSONaO+ SO= NaSO6、NaO +2HCl = 2NaCl + HO7、2NaO+4 HCl = 4 NaCl + 2 HO + O↑三、NaHCO与NaCO1、小苏打受热分解: 2NaHCO NaCO+ HO +CO↑2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO+ NaOH NaCO+ HO3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO+ NaOH = NaCO+ HO HCO+ OH= HO + CO4、向NaOH溶液中通入少量CO:2NaOH + CO= NaCO+ HO5、继续通入过量CO:NaCO+ CO+ HO = 2 NaHCO总反应方程式:NaOH + CO= NaHCO6、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液NaCO+ 2HCl = 2NaCl + HO +CO↑ CO+ 2H= HO + CO↑②纯碱溶液中滴加盐酸,至过量NaCO+ HCl =NaHCO+ NaCl CO+ H= HCONaHCO+HCl=NaCl+HO+CO↑ HCO+H= HO +CO↑7、(1)NaCO溶液、NaHCO溶液与Ca(OH)反应:NaCO+Ca(OH)= CaCO↓+2 NaOHNaHCO+Ca(OH)(多)= CaCO↓+ NaOH +HO2NaHCO+Ca(OH)(少)= CaCO↓+ NaCO+2HO8、NaCO溶液、NaHCO溶液与CaCl反应: NaCO+CaCl= CaCO↓+2 Na ClNaHCO溶液与CaCl不反应;四、铝1、铝与氯气反应:2Al + 3Cl2AlCl2、铝片与稀盐酸反应2Al + 6HCl = 2AlCl+ 3H↑ 2Al + 6H= 2Al+3H↑3、铝与氢氧化钠溶液反应2Al+2NaOH +2HO = 2NaAlO+3H↑(只有HO作氧化剂)2Al + 2OH+2HO = 2AlO+ 3H↑4、4Al + 3O2Al O电解熔融的氧化铝:2AlO4Al + 3O↑5、铝与氧化铁高温下反应【铝热反应】:2Al + FeO2Fe + Al O6、不稳定性:2Al(OH)Al O+ 3HO7、硫酸铝溶液中滴过量氨水【实验室制备Al(OH)】Al(SO)+6NH·HO==2Al(OH)↓+3(NH)SOAl+ 3 NH·HO = Al(OH)↓+ 3NH8、向NaAlO溶液中通入CO2NaAlO+CO(少)+3HO = 2Al(OH)↓+ NaCO2AlO+CO(少)+3HO = 2Al(OH)↓+ CO NaAlO+CO(多)+2HO = Al(OH)↓+ NaHCOAlO+CO(多)+2HO = Al(OH)↓+ HCO 9、氧化铝溶于氢氧化钠溶液AlO+ 2NaOH == 2NaAlO+HO AlO+ 2OH= 2AlO+ HO10、氧化铝溶于盐酸:AlO+ 6HCl = 2AlCl+ 3 HO AlO+ 6H= 2Al+3 HO氢氧化铝的两性电离 H+ AlO+ HO Al(OH)Al+ 3OH11、Al(OH)溶液中加盐酸:Al(OH)+ 3HCl = AlCl+ 3HO Al(OH)+ 3H= Al+ 3HO12、Al(OH)与NaOH溶液反应:Al(OH)+ NaOH == NaAlO+2 HO Al(OH)+ OH= AlO+2 HO13、铝盐、偏铝酸盐反应生成Al(OH):3AlO+Al+ 6HO = 4 Al(OH)↓五、铁1、铁与硫加热反应: Fe + S FeS2、铁与氧气中燃烧: 3Fe+2O FeO3. 铁在氯气中燃烧: 2Fe+3Cl2FeCl4、高温下铁与水蒸气反应:3Fe + 4HO(g)FeO+ 4H5、铁与盐酸反应: Fe + 2HCl = FeCl+ H↑ Fe + 2H= Fe+ H↑6.铁的氧化物FeO 、FeO、FeO溶于盐酸中:1)FeO + 2HCl = FeCl+ HO FeO + 2H= Fe+ HO2)FeO+ 6HCl = 2FeCl+ 3HO FeO+ 6H= 2Fe+ 3HO3)FeO+ 8HCl = FeCl+2FeCl+4HO FeO+ 8H=Fe+2Fe+4 HO7.Fe(OH)、Fe(OH)的制备:1) FeSO+ 2NaOH = Fe(OH)↓+NaSOFe+ 2OH= Fe(OH)↓氯化铁中滴入氢氧化钠溶液(红褐色沉淀)2)FeCl+ 3NaOH = Fe(OH)↓+3NaCl Fe+ 3OH= Fe(OH)↓氢氧化亚铁在空气中被氧化(白色絮状沉淀迅速变成灰绿色,最后变为红褐色沉淀)3)4Fe (OH)+ O+ 2HO = 4Fe (OH)4)不稳定性:2Fe(OH)Fe O+ 3HO8.Fe、Fe之间的转化:1)氯化亚铁溶液中通入氯气(或者加氯水):2FeCl+ Cl= 2FeCl2 Fe+ Cl= 2 Fe+ 2Cl2)氯化铁溶液中加入铁粉:2FeCl+ Fe = 3FeCl2Fe+ Fe = 3Fe3)用KSCN检验Fe的存在:离子方程式:Fe+3SCNFe (SCN)(血红色)4)印刷电路板:2FeCl+ Cu = 2FeCl+CuCl第四章:一、硅(1)工业制单质硅(碳在高温下还原二氧化硅):SiO+ 2C Si + 2CO↑(硅单质的实验室制法,粗硅的制取)(2)硅单质与氢氟酸、Si +4HF = SiF↑+ 2H↑(3)硅单质与NaOH溶液反应: Si + 2NaOH + HO = NaSiO+2H↑Si及其化合物:二、二氧化硅(1)二氧化硅与氢氧化钠反应: SiO+ 2NaOH = NaSiO+ HO SiO+ 2OH= SiO+ HO(2)二氧化硅与氧化钙高温反应:SiO+ CaO CaSiO(3)二氧化硅与氢氟酸反应:SiO+ 4HF = SiF↑+ 2 HO三、硅酸(HSiO)(1)往硅酸钠溶液中通入二氧化碳:NaSiO+ CO+ HO = NaCO+ HSiO↓(2)硅酸钠与盐酸反应:NaSiO+ 2HCl = 2NaCl + HSiO↓(3)硅酸受热分解:HSiO SiO+ HO(4)工业制玻璃原理:SiO+ NaCO NaSiO+ CO↑SiO+ Ca CO Ca SiO+ CO↑四、氯气(1)氯气实验室制法:(仪器:分液漏斗,圆底烧瓶)MnO+4HCl(浓)MnCl+Cl↑+2HO MnO+4H+2Cl Mn+Cl↑+2HO(2)电解氯化钠溶液:2NaCl +2 HO 2NaOH + H↑+ Cl↑(氯碱工业)(3)电解熔融氯化钠: 2NaCl 2Na+ Cl↑2、氯气性质:A、金属和氯气的反应:(1)铜丝在氯气中剧烈燃烧(棕色烟):Cu + Cl CuCl之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)(2)氯气和金属钠反应:2Na + Cl2NaCl(3)铁在氯气中剧烈燃烧:2Fe + 3Cl3FeCl(4)氢气在氯气中燃烧(苍白色火焰):H+ Cl2HCl(5)氟气与氢气反应(黑暗处即可爆炸):H+F=2HFB、氯气与水反应(6)氯气溶于水(新制氯水中含H、Cl、ClO、OH、Cl、HClO、HO)Cl+ HO HCl + HClOCl+ HO = H+ Cl+ HClO新制氯水注入盛溴化钠溶液的试管中(7)Cl+ 2NaBr = Br+ 2NaCl Cl+ 2Br= Br+ 2Cl(8)Cl+ 2NaI = 2NaCl + ICl+2I=I+ 2Cl(9)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):2HClO 2HCl + O ↑C、氯气和碱的反应:(10)工业制漂白粉的原理:2Ca(OH)+ 2Cl=Ca(ClO)+ CaCl+ 2HO2Ca(OH)+2Cl=2Ca+2ClO+2Cl+2HO(11)漂白粉长期置露在空气中失效的原理:2Ca(OH)+ 2Cl===Ca(ClO)+ CaCl+ 2HOCa(ClO)+ CO+ HO =CaCO↓ + 2HClO2HClO 2HCl + O↑(12)制漂白液(或氯气尾气处理): Cl+2NaOH = NaCl + NaClO + HO五、硫和氮的化合物:(1)硫与非金属:S + O SOH+ S HS(2)硫与金属: Fe + S FeS 2Cu + S CuS(3)硫与氢氧化钠溶液反应:3S+6NaOH2NaS+NaSO+3HO(4)二氧化硫与水反应:SO+ HO HSO(5)二氧化硫与碱性氧化物反应:SO+ CaO = CaSO(6)二氧化硫与碱反应:SO+ 2NaOH = NaSO+ HO SO+ Ca(OH)= CaSO↓ + HO(7)二氧化硫与硫化氢气体反应:2HS +SO= 3S↓ + 2HO(8)二氧化硫通入氯水中:SO+ Cl+ 2HO = 2HCl + HSO(Cl可换作Br、I)(9)二氧化硫被O氧化:2SO+ O2SO(10)三氧化硫与水反应:SO+ HO = HSO(11)三氧化硫与碱反应:SO+ Ca(OH)= CaSO↓ + HO(12)硫化氢气体通入氯水: HS+Cl=== 2HCl + S↓(13)亚硫酸钠与浓硫酸反应制备二氧化硫: NaSO+HSO(浓)===NaSO+HO+SO↑(14)工业合成氨:N+ 3H2NH(15)氨的催化氧化:4NH+5O4NO + 6HO(16)NH在水中的反应:NH+ HO NH• HO NH+ OH(17)氨水受热分解:NH•HO NH↑ + HO(18)实验室制取氨气:2NHCl + Ca(OH)CaCl+ 2NH↑+ 2HO(19)碳酸氢铵受热分解:NHHCO NH↑+ HO↑+ CO↑(20)用浓盐酸检验氨气(白烟生成): HCl + NH= NHCl(21)氯化铵受热分解:NHCl NH↑ + HCl↑(22)硫酸铵溶液与氢氧化钠溶液混合加热(NH)SO+2NaOH2NH↑+NaSO+2HO NH+ OH NH↑+ HO(23)硝酸铵溶液与氢氧化钠溶液混合(不加热)(检验NH的方法)NHNO+ NaOH = NH↑+HO + NaNONH+ OH= NH↑+HO(24)氮气和氧气放电下反应(雷雨发庄稼)N+ O2NO 2NO + O= 2NO(25)二氧化氮溶于水:3NO+ HO = 2HNO+ NO3NO+ HO = 2H+ 2NO+NO(26)NO、O的混合气通入水中无剩余气体:4NO+ O+ 2HO = 4 HNO (27)NO 、O的混合气通入水中无剩余气体:4NO+ 3O+ 2HO = 4 HNO (28)NO、NO的回收:NO+NO+2NaOH===2NaNO+HO(29)NO与氢氧化钠反应:2NO+2NaOH===NaNO+NaNO+HO5、浓硫酸、HNO与Cu反应:Al、Fe遇浓HNO、浓硫酸钝化(常温)(30)Cu与浓HNO加热:Cu+4HNO(浓)= Cu(NO)+2NO↑+ 2HO (31)Cu与稀HNO反应:3Cu+8HNO(稀)= 3Cu(NO)+2NO↑+ 4HO(32)铜与浓硫酸反应:Cu+2HSO(浓)CuSO+2HO+SO↑(33)浓硫酸与木炭反应:C+2HSO(浓)2HO+CO↑+2SO↑(34)浓硝酸与木炭反应:C+4HNO(浓)2HO+CO↑+4NO↑。
高一化学必修一化学方程式大全(按章节)

⾼⼀化学必修⼀化学⽅程式⼤全(按章节)必修⼀化学⽅程式以及离⼦⽅程式1、硫酸根离⼦的检验:BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl SO42-+ Ba2+ == BaSO4↓2、碳酸根离⼦的检验:CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl CO32-+ Ca2+== CaCO3↓3、碳酸钠与盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32-+ 2H+== CO2↑+ H2O 4、铝与硝酸铜溶液反应:2Al+3Cu(NO3)2= 2Al(NO3)3+ 3Cu 2Al+3Cu2+= 2Al3++ 3Cu5、钠在空⽓中燃烧(黄⾊的⽕焰)2Na +O2Na2O2钠块在空⽓中变暗4Na+O2=2Na2ONa2O在空⽓中加热(变黄)2Na2O+O2△2Na2O26、钠与⽔反应(浮、熔、游、响、红)2Na +2H2O =2 NaOH +H2↑2Na +2H2O =2Na++2OH-+H2 ↑7、过氧化钠与⽔的反应(放热反应、Na2O2是强氧化剂,⽤于漂⽩)2Na2O2+2H2O =4NaOH +O2↑2Na2O2+2H2O =4Na++4OH-+O2↑碱性氧化物Na2O与⽔的反应Na2O+H2O=2NaOH8、过氧化钠可⽤在呼吸⾯具和潜⽔艇中作为氧⽓来源,原因是:2Na2O2+2CO2=2Na2CO3+O29、苏打(纯碱)与盐酸反应①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl+H2O+CO2↑CO32-+2H+=H2O +CO2↑②纯碱溶液中滴加盐酸,⾄过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=H2O +CO2↑10、⼩苏打受热分解2NaHCO3△Na2CO3+H2O +CO2 ↑11、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH △Na2CO3+H2OHCO3-+OH -=H2O +CO32-(若是溶液中反应有离⼦⽅程式)12、铝箔在氧⽓中剧烈燃烧4Al +3O2点燃2Al2O313、铝⽚与稀盐酸反应2Al +6HCl =2AlCl3+3H2↑2Al +6H+=2Al3++3H2↑14、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2-+3H2↑2Al +2OH -+2H2O =2AlO2-+3H2↑15、铝与三氧化⼆铁⾼温下反应(铝热反应)2Al +Fe2O3⾼温2Fe +Al2O316、氧化铝溶于氢氧化钠溶液Al2O3+2NaOH 2NaAlO2+H2OAl2O3+2OH -=2AlO2-+H2O17、硫酸铝溶液中滴过量氨⽔Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+18、①氢氧化铝溶液中加盐酸Al(OH)3+3HCl =AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O②Al(OH)3与NaOH溶液反应Al(OH)3+NaOH NaAlO2+2 H2OAl(OH)3+OH-=AlO2-+2 H2O19、⾼温下铁与⽔反应3Fe +4H2O(g) ⾼温Fe3O4+4H220、铁与盐酸反应Fe +2HCl =FeCl2+H2↑ Fe +2H+=Fe2++H2↑21、氧化铁溶于盐酸中Fe2O3+6HCl =2FeCl3+3H2OFe2O3+6H+=2Fe3++3H2O22、氯化铁中滴⼊氢氧化钠溶液(红褐⾊沉淀)FeCl3+3NaOH =Fe(OH)3↓+3NaClFe3++3OH -=Fe(OH)3↓23、氢氧化亚铁在空⽓中被氧化(⽩⾊沉淀变为红褐⾊沉淀)4Fe (OH)2+O2+2H2O =4Fe (OH)324、氯化亚铁溶液中通⼊氯⽓2FeCl2+Cl2=2FeCl3 2 Fe2++Cl2=2 Fe3++2Cl-25、氯化铁溶液中加⼊铁粉2FeCl3+Fe =3FeCl2 2Fe3++Fe =3Fe2+26、⽤KSCN检验Fe3+的存在离⼦⽅程式Fe3++3SCN-= Fe (SCN)3 (⾎红⾊)27、⼯业制单质硅(碳在⾼温下还原⼆氧化硅)SiO2+2C ⾼温Si +2CO↑28、⼆氧化硅与氢氧化钠反应SiO2+2NaOH =Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+2OH -=SiO32-+H2O29、硅与氧⽓反应Si(粉)+O2△SiO230、硅与氢氧化钠溶液反应Si+2NaOH+H2O=Na2SiO3+2H2↑Si + 2OH-+ H2O == SiO32-+ 2H2↑31、制玻璃SiO2+Na2CO3⾼温Na2SiO3+CO2 SiO2+CaCO3⾼温CaSiO3+CO232、氯⽓和⾮⾦属反应Cl2 +H22HCl (或光照)3Cl2 +2P2PCl3Cl2 +PCl3PCl533、氯⽓和⾦属反应3Cl2 +2Fe2FeCl3Cl2 +2Na2NaClCl2+Cu CuCl234、强氧化性:Cl2 +2FeCl2=2FeCl3Cl2 + 2Fe2+ == 2Fe3+ + 2Cl-Cl2+2NaBr =Br2+2NaCl Cl2+2Br-=Br2+2Cl-Cl2 + 2KI =2KCl + I2Cl2 + 2I-== 2Cl-+ I235、氯⽓溶于⽔ Cl 2+H 2O =HCl +HClO Cl 2+H 2O ==Cl -+H ++HClO2HClO 2HCl + O 2↑36、氯⽓和⼆氧化硫Cl 2+SO 2 +2H 2O =H 2SO 4 +2HCl 37、制漂⽩液:Cl 2+2NaOH =NaCl+NaClO+H 2O38、制漂粉精、漂⽩粉 2Cl 2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H 2O 39、漂⽩粉变质Ca(ClO)2+CO 2+H 2O =CaCO 3↓+2HClO 40、氮⽓和氢⽓反应(⼯业合成氨) N 2 + 3H 2催化剂⾼温⾼压2NH 341、氮⽓和氧⽓放电下反应(雷⾬发庄稼)N 2 + O 22NO 2NO + O 2 2NO 242、⼆氧化氮溶于⽔ 3NO 2 + H 2O 2HNO 3 + NO 3NO 2 + H 2O2H ++ 2NO 3-+NO43、 NH 3+HCl =NH 4Cl(⽩烟) 44、HNO 3与Fe 的反应Al 、Fe 遇冷浓HNO 3、浓硫酸钝化(常温) Fe 与浓HNO 3加热 Fe +6HNO 3△Fe(NO 3)3+3NO 2↑+3H 2O45、Fe 与稀HNO 3反应Fe +4HNO 3(过量)=Fe(NO 3)3+NO ↑+2H 2O 3Fe (过量)+8HNO 3=3Fe(NO 3)2+2NO ↑+4H 2O 46、氨⽓的实验室制法: 2NH 4Cl + Ca(OH)2 △CaCl 2 + NH 3↑ + H 2O47、 4HNO 34NO 2↑+O 2↑+2H 2O48、 4HNO 3(浓)+C△CO 2↑+4NO 2↑+2H 2O 49、 4HNO 3(浓)+Cu =Cu(NO 3)2+2NO 2↑+2H 2 4H ++ 2NO 3- + Cu == Cu 2+ + 2NO 2↑+ 2H 2O 8 HNO 3(稀)+3Cu =3Cu(NO 3)2+2NO↑+4H 2O 8H + +2NO 3- + 3Cu == 3Cu 2+ + 2NO↑+ 4H 2O 50、NO 2 、O 2 的混合⽓通⼊⽔中⽆剩余⽓体光照放电4NO2+O2+2H2O =4 HNO351、NO 、O2的混合⽓通⼊⽔中⽆剩余⽓体4NO+3O2+2H2O =4 HNO352、氨的催化氧化4NH3+5O24NO +6H2O53、碳酸氢铵受热分解NH4HCO3△NH3↑+H2O↑+CO2↑54、⽤浓盐酸检验氨⽓(⽩烟⽣成)HCl +NH3=NH4Cl55、硫酸铵溶液与氢氧化钠溶液混合加热(NH4)2SO4+2NaOH△3↑+Na2SO4+2H2ONH4++OH -△NH3↑+H2O56、硝酸铵溶液与氢氧化钠溶液混合(不加热)NH4NO3+NaOH =NH3·H2O +NaNO3NH4++OH-=NH3·H2O57、硫及其化合物的化学性质:S+H2△H2S S+Fe△FeSS+2Cu△Cu2S S+O2点燃SO23S+6NaOH△2S+Na2SO3+3H2O3S + 6OH-△2S2-+ SO32-+ 3H2OSO2 + 2H2S=3S+2H2O SO2+H2O=H2SO32NaOH+SO2(少量)=Na2SO3+H2O SO2 + 2OH-== SO32-+ H2O NaOH+SO2(⾜量)=NaHSO3SO2 + OH-== HSO3-2SO32SO2+O2催化剂加热2H2SO4(浓)+C△2↑+2SO2↑+2H2O2H2SO4(浓)+Cu△4+SO2↑+2H2ONa2SO3+H2SO4 = Na2SO4+ SO2↑+ H2O SO32-+ 2H+ == SO2↑+ H2O。
高一化学必修1重要方程式及离子方程式汇总(精选 背诵版)

3 4 5 6 7 8 9 10 11 12
+ HClO
-+ H O 2
Mn2++Cl2↑+2H2O
= Fe(OH)3 ↓
氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色 沉淀) 2 Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
2Fe3+ + Fe = 3Fe2+ 2Fe3++Cu= 2 Fe2++Cu2+
-
Na2CO3+2HCl = 2NaCl+ H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ 2NaHCO3
△
Na2CO3 + H2O +CO2↑
NaHCO3 + NaOH = Na2CO3 + H2O 2NaHCO3+ Ca( OH) 2= Ca CO3↓ + Na2CO3+ 2 H2O 向澄清石灰水中不断通入 CO2 至过量: (先浑浊):Ca(OH)2+CO2=Ca CO3↓+H2O ( 后 澄 清 ) : Ca CO3↓ + CO2+ H2O= Ca (HCO3)2
△
Fe+6H++3NO3-== Fe3+ + 3NO2↑+ 3H2O Fe+4H++NO3-== Fe3+ + NO↑+ 2H2O 4H++4NO3-+C
△
CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
34 35 36 37 38 39 40 41 42
4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2 O 8HNO3+3Cu=3Cu(NO3)2+2NO↑+4H2O S+Fe
人教版高一化学必修1方程式归纳

人教版高一化学必修1方程式归纳学习化学,记住方程式很重要。
下面本人为大家分享的是人教版高一化学必修1方程式归纳的详细内容,希望对你有帮助!一、钠及其化合物1.钠与氧气:常温:4Na+O2=2Na2O点燃:2Na +O2=(△)Na2O22.钠与水反应:2Na + 2H2O=2NaOH + H2↑_离子方程式:2Na + 2H2O=2Na++2OH-+ H2↑3.钠与硫酸反应:2Na +H2SO4= Na2SO4+H2↑4.氧化钠与水反应:Na2O+H2O=2NaOH5.过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 =2Na2CO3+O2↑6.过氧化钠与水反应:2Na2O2+2H2O =4NaOH+O2↑离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑7.NaOH溶液中通入少量CO2:2NaOH+CO2=Na2CO3+H2O 离子方程式:2OH-+CO2= CO32-+H2ONaOH溶液中通入过量CO2:NaOH+CO2= NaHCO3离子方程式:OH-+CO2= HCO3-8.①向碳酸钠溶液滴入少量稀盐酸: Na2CO3 + HCl = NaHCO3+ NaCl向稀盐酸滴入少量碳酸钠溶液: Na2CO3 + 2HCl =2NaCl +H2O + CO2↑②除去碳酸氢钠溶液中混有的碳酸钠: Na2CO3+ H2O +CO2 =2NaHCO3③碳酸钠与氢氧化钙:Na2CO3+ Ca(OH)2 =CaCO3↓+ 2NaOH④碳酸氢钠与盐酸: NaHCO3+HCl=NaCl+H2O+CO2↑⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中: NaHCO3+ Ca(OH)2=CaCO3↓+NaOH+ H2O少量氢氧化钙溶液滴入碳酸氢钠溶液中:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O⑥除去碳酸钠溶液中的碳酸氢钠:NaHCO3 + NaOH=(△) Na2CO3 + H2O⑦除去碳酸钠固体中的碳酸氢钠:2NaHCO3 =(△)Na2CO3 + H2O+CO2 ↑⑧鉴别碳酸钠和碳酸氢钠溶液:Na2CO3 + CaCl2=CaCO3↓ + 2NaCl二、镁的提取与应用1.与非金属O2、Cl2、S、N2等反应2Mg+O2 =(点燃) 2MgO Mg+Cl2=(点燃)MgCl2Mg+S=(△)MgS 3Mg+N2 =(点燃) Mg3N22.与热水反应:Mg+2H2O(热水)=(△)Mg(OH)2 + H2↑3.与稀硫酸反应:Mg+H2SO4=MgSO4+H2↑ 离子方程式:Mg+2H+=Mg2++H2↑4.与硫酸铜溶液反应:Mg+CuSO4=MgSO4+Cu 离子方程式:Mg+Cu2+=Mg2++Cu5.与CO2反应:2Mg+CO2=(点燃)C+2MgO6.向海水中加石灰乳使Mg2+沉淀:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2离子方程式Mg2++Ca(OH) 2=Mg(OH)2↓+Ca2+7.电解MgCl2:MgCl2(熔融) =(电解) Mg+Cl2↑三、铝及其化合物1.铝与氧气的反应:4Al + 3O2 =(点燃) 2Al2O32.铝与氧化铁反应(铝热反应):2Al + Fe2O3 =(高温) 2Fe + Al2O33.铝和稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑ 离子方程式:2Al + 6H+ = 2Al3+ + 3H2↑4.铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑5.氧化铝和稀硫酸:Al2O3+3H2SO4=Al2(SO4)3+3H2O_离子方程式:Al2O3+6H+=2Al3++3H2O6.氧化铝和NaOH溶液:Al2O3 + 2NaOH =2NaAlO2+H2O离子方程式:Al2O3 + 2OH-=2AlO2-+H2O7.氢氧化铝和盐酸:Al(OH)3+3HCl = AlCl3+3H2O离子方程式:Al(OH)3+3H+ = Al3++3H2O8.氢氧化铝和NaOH溶液:Al(OH)3 +NaOH =NaAlO2+2H2O离子方程式:Al(OH)3 +OH-=AlO2-+2H2O9.氢氧化铝受热分解:_2Al(OH)3 =(△) Al2O3+3H2O _10.硫酸铝与氨水反应:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+11.AlCl3溶液中加入少量NaOH溶液:AlCl3+3NaOH=Al(OH)3↓+3NaClAlCl3溶液中加入过量NaOH溶液:AlCl3 + 4NaOH = NaAlO2 + 3NaCl+2H2O12.往偏铝酸钠溶液中通入足量CO2:NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO313.电解氧化铝: 2Al2O3 =(电解) 4Al+3O2↑四、铁及其化合物1.铁与氧气反应:3Fe + 2O2 =(点燃)Fe3O4铁与硫反应:Fe + S =(△) FeS2.铁与盐酸反应:Fe + 2HCl = FeCl2 + H2↑离子方程式:Fe + 2H+ = Fe2+ + H2↑铁与CuSO4溶液:Fe+CuSO4=FeSO4+Cu离子方程式:Fe+Cu2+=Fe2++Cu3.铁和水蒸气:3Fe + 4H2O(g) =(高温) Fe3O4+4H2_4.氧化亚铁与盐酸反应:FeO+2HCl=FeCl2+H2O离子方程式:FeO+2H+=Fe2++H2O5.氧化铁与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O离子方程式:Fe2O3+6H+=2Fe3++3H2O6.CO还原氧化铁:Fe2O3+ 3CO=(高温)2Fe + 3CO27.氯化铁与氢氧化钠溶液:FeCl3+3NaOH =Fe(OH)3↓+3NaCl_离子方程式:Fe3++3OH-= Fe(OH)3↓8.硫酸亚铁与氢氧化钠溶液:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4离子方程式:Fe2++2OH-=Fe(OH)2↓9.氢氧化铁加热分解:2Fe(OH)3=(△)Fe2O3+3H2O10.氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + O2 + 2H2O =4Fe(OH)311.除去FeCl2中的FeCl3:2FeCl3 + Fe = 3FeCl2 _离子方程式:2Fe3+ + Fe = 3Fe2+12.FeCl2和Cl2反应:2FeCl2 + Cl2= 2FeCl3_离子方程式:_2Fe2+ + Cl2 = 2Fe3++2Cl-13.FeCl3和Cu反应:2FeCl3+Cu=2FeCl2+CuCl2_离子方程式:2Fe3++Cu=2Fe2++Cu2+14.氯化铁与硫氰化钾溶液反应: Fe3+ + 3SCN- = Fe(SCN)3五、硅及其化合物1.硅与氧气加热:Si+O2=(△)SiO2硅与氟气:Si+2F2=SiF42.硅单质与氢氟酸反应:Si+4HF=SiF4+2H23.硅与氢氧化钠溶液反应:Si+2NaOH+H2O=Na2SiO3+2H2↑4.二氧化硅与氢氟酸反应:4HF+SiO2=SiF4↑+2H2O5.二氧化硅与氧化钙高温反应:SiO2+CaO=(高温)CaSiO36.二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3+ H2O7.二氧化硅与碳反应:SiO2 + 2C =(高温) Si +2CO↑8.硅酸钠与盐酸反应:Na2SiO3+2HCl=H2SiO3↓+2 NaCl离子方程式: SiO32-+2H+=H2SiO3↓9.往硅酸钠溶液中通入二氧化碳: Na2SiO3+CO2+H2O == H2SiO3↓+ Na2CO310.二氧化硅与纯碱反应:SiO2+Na2CO3=(高温)Na2SiO3+CO2↑11.二氧化硅与石灰石反应:SiO2+CaCO3=(高温)CaSiO3+CO2↑12.加热硅酸:H2SiO3=(△)SiO2+H2O六、氯及其化合物1.实验室制氯气:MnO2+4HCl(浓) =(△)MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl-=(△)Mn2++Cl2↑+2H2O2.钠在氯气中燃烧: 2Na+Cl2 =(点燃)2NaCl铁在氯气中燃烧:2Fe+3Cl2 =(点燃) 2FeCl3铜在氯气中燃烧:Cu + Cl2 =(点燃) CuCl2氢气在氯气中燃烧:H2 + Cl2 =(点燃) 2HCl3.氯气和水反应:Cl2 + H2O = HCl+ HClO 离子方程式:Cl2 + H2O = H++Cl- + HClO4.次氯酸光照分解:2HClO=(△)2HCl + O2↑5.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl 离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-6.氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O 离子方程式:Cl2+2OH-=Cl-+ClO-+H2O7.工业生产漂白粉:2Ca(OH)2 + 2Cl2=Ca(ClO)2 + CaCl2+ 2H2O8.漂白粉漂白原理:Ca(ClO)2 + CO2+ H2O =CaCO3↓ + 2HClO9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 +2HCl=CaCl2 + 2HClO10.氯气通入溴化钾溶液:Cl2 + 2KBr = Br2+ 2KCl 离子方程式:Cl2 + 2Br- = Br2 + 2Cl-氯气通入碘化钾溶液:Cl2 + 2KI = I2+ 2KCl 离子方程式:Cl2 + 2I- = I2 + 2Cl-溴水和碘化钾溶液反应:Br2 +2KI = I2+2KBr 离子方程式:Br2 +2I- = I2+2Br-11.氯化钠和硝酸银溶液:AgNO3 + NaCl = AgCl↓ + NaNO3 离子方程式:Ag++Cl- = AgCl↓溴化钠和硝酸银溶液:AgNO3 + NaBr= AgBr↓ + NaNO3 离子方程式:Ag++Br- = AgBr↓_碘化钠和硝酸银溶液:AgNO3 + NaI = AgI↓ + NaNO3 离子方程式:Ag++I-=AgI↓七、硫及其化合物1.硫在空气中燃烧:S+O2=(点燃)SO2硫与氢气加热:S+H2=(△)H2S2.二氧化硫与水:SO2+H2O⇌H2SO3二氧化硫与氧化钙:SO2+CaO=CaSO3少量SO2与氢氧化钠:2NaOH+SO2=Na2SO3+H2O离子方程式:2OH-+SO2= SO32-+H2O过量SO2与氢氧化钠:NaOH+SO2=NaHSO3离子方程式:OH-+SO2= HSO3-3.SO2通入过量的澄清石灰水:Ca(OH)2+SO2=CaSO3↓+H2O过量的SO2通入澄清石灰水:Ca(OH)2+2SO2=Ca(HSO3)24.二氧化硫与硫化氢:SO2 + 2H2S=3S↓+2H2O5.SO2的催化氧化:2SO2 + O2 ⇌ (催化剂、△)2SO36.亚硫酸钠和硫酸反应:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O7.Na2SO3与氧气反应:2Na2SO3+O2=2Na2SO48.三氧化硫和水反应:SO3+H2O=H2SO49.三氧化硫与氧化钙:SO3+CaO= CaSO410.三氧化硫与氢氧化钙:Ca(OH)2+SO3=CaSO4↓+H2O11.铜与浓硫酸反应:Cu + 2H2SO4(浓)=(△)CuSO4 +2H2O+SO2 ↑12.碳与浓硫酸反应:C + 2H2SO4(浓)=(△)2H2O+CO2↑+2SO2↑八、氮及其化合物1.氮气和氧气反应:N2 + O2=(放电)2NO2.工业合成氨:N2 + 3H2 ⇌ (催化剂、高温高压) 2NH33.一氧化氮与氧气反应:2NO + O2= 2NO24.NO2溶于水:3NO2 + H2O= 2HNO3+ NO5.氨气溶于水: NH3 + H2O⇌NH3·H2O氨水显弱碱性(电离方程式):NH3·H2O⇌NH4+ + OH-6.浓氨水受热分解:NH3·H2O=(△)NH3↑+H2O7.氨气和氯化氢:HCl + NH3 = NH4Cl8.氨的催化氧化:4NH3 +5O2 =(催化剂、△) 4NO + 6H2O9.氯化铵受热分解:NH4Cl=(△)NH3+HCl10.碳酸氢铵受热分解:NH4HCO3 =(△)NH3 ↑+H2O↑+ CO2 ↑11.硝酸铵和NaOH:NH4NO3 + NaOH =(△) NaNO3 + NH3↑+H2O 离子方程式:NH4++ OH-=(△)NH3↑+H2O12.实验室制氨气:2NH4Cl+ Ca(OH)2=(△)CaCl2 + 2NH3↑ + 2H2O13.浓硝酸与铜反应:4HNO3(浓)+Cu =(△)Cu(NO3)2+2NO2↑+2H2O离子方程式:4H++2NO3-+Cu =(△)Cu2++2NO2↑+2H2O14.稀硝酸与铜反应:8HNO3(稀)+3Cu =(△)3Cu(NO3)2+2NO↑+4H2O离子方程式:8H++2NO3-+3Cu =(△)3Cu2++2NO↑+4H2O15.硝酸见光分解:4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)16.NH4+的检验离子方程式:NH4++ OH-=(△)NH3↑+H2O17.NO2、O2混合气通入水中无剩余气体:4NO2 +O2+ 2H2O = 4HNO318.NO、O2混合通入水中无剩余气体:4NO + 3O2+ 2H2O = 4HNO3看了人教版高一化学必修1方程式归纳还看:1.2019高一化学必修一方程式归纳大全2.高一必修1化学方程式汇总3.高一必修一化学方程式归纳4.2019高一化学必修一方程式归纳大全(2)5.高一必修一化学方程式总结及其现象;。
高一化学必修1化学方程式汇总

高一化学必修1化学方程式汇总1、 钠与氧气(常温):4Na + O 2 = 2Na 2O(加热)2Na + O 2 △ Na 2O 2钠与水反应:2Na + 2H 2O = 2NaOH + H 2↑ 离方:2、铁与水蒸气反应:3Fe + 4H 2O (g) △ F 3O 4 + 4H 23、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑ 离方:4、过氧化钠与水反应:2Na 2O 2 + 2H 2O = 4NaOH + O 2↑ 离方: 过氧化钠与二氧化碳反应:2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 25、Na 2CO 3溶液加入过量盐酸:Na 2CO 3+2HCl=2NaCl+CO 2↑+H 2O 离方: NaHCO 3和盐酸反应:NaHCO 3+HCl=NaCl+CO 2↑+H 2O 离方: NaHCO 3和NaOH 反应:NaHCO 3+ NaOH = Na 2CO 3+H 2O 离方: NaOH 溶液中通入少量CO 2:2NaOH + CO 2 = Na 2CO 3 + H 2O 离方:继续通入过量CO 2:Na 2CO 3+CO 2+H 2O =2NaHCO 3 离方:总: NaOH + CO 2 = NaHCO 3 离方:NaHCO 3固体受热分解:2NaHCO 3△Na 2CO 3+CO 2↑+H 2O6、氧化铝与盐酸反应:Al 2O 3 + 6HCl = 2AlCl 3 + 3H 2O 离方: 氧化铝与氢氧化钠溶液反应:Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O 离方:7、Al(OH)3的制备:Al 2(SO 4)3 + 6NH 3·H 2O = 2Al(OH)3↓ + 3(NH 3)2SO 4 离方: 氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl 3 + 3H 2O 离方: 氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO 2 + 2H 2O 离方: 氢氧化铝加热分解:2Al(OH)3 △ Al 2O 3 + 3H 2O8、氧化亚铁与盐酸反应:FeO + 2HCl = FeCl 2 + H 2O 离方: 氧化铁与盐酸反应:Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O 离方:9、Fe(OH)3的制备:FeCl 3 + 3NaOH = Fe(OH)3↓+ 3NaCl 离方: Fe(OH)2的制备:FeSO 4 + 2NaOH = Fe(OH)2↓+ Na 2SO 4 离方: Fe(OH)2被空气中的氧气氧化成Fe(OH)3: 4Fe(OH)2 + O 2+ 2H 2O = 4Fe(OH)3 (现象: )氢氧化铁加热分解:2Fe(OH)3 △ Fe 2O 3 + 3H 2O10、Fe 3+向Fe 2+转化(加铁粉):2FeCl 3 + Fe = 3FeCl 2 离方: Fe 2+向Fe 3+转化(加氯水):2FeCl 2 + Cl 2 = 2FeCl 3 离方:11、二氧化硅与氢氟酸反应:SiO 2 + 4HF = SiF 4↑+ 2H 2O 二氧化硅与氢氧化钠溶液反应:SiO 2 + 2NaOH = Na 2SiO 3 + H 2O 离方: 二氧化硅与氧化钙高温反应:SiO 2 + CaO 高温 CaSiO 3工业制玻璃原理:SiO 2 + Na 2CO 3 高温 Na 2SiO 3 + CO 2↑SiO 2 + CaCO 3 高温 CaSiO 3 + CO 2↑12、硅酸钠溶液中通入二氧化碳:Na 2SiO 3 + CO 2 + H 2O = Na 2CO 3 + H 2SiO 3↓离方: 硅酸钠与盐酸反应:Na 2SiO 3 + 2HCl = 2NaCl + H 2SiO 3↓ 离方: 硅酸受热分解:H 2SiO △ SiO 2 + H 2O13、粗硅的制取:SiO 2 + 2C 高温 Si + 2CO ↑ 14、硅单质与F 2、HF 、NaOH 溶液:Si + 2F 2 = SiF 4 Si + 4HF = SiF 4 + 2H 2↑Si + 2NaOH + H 2O = NaSiO 3↓ +2H 2↑15、氯气与金属反应:2Na + Cl 2 点燃 2NaCl 2Fe + 3Cl 2 点燃 2FeCl 3 Cu + Cl 2 点燃 CuCl 2氯气与非金属H 2反应:H 2 + Cl 2点燃 2HCl氯气与水反应:Cl 2 + H 2O = HCl + HClO 离方:HClO 光照下分解:2HClO 光照 2HCl + O 2↑制漂白液(或氯气尾气处理):Cl 2 + 2NaOH = NaCl + NaClO + H 2O 离方: 制漂白粉(或漂粉精):2Cl 2 + 2Ca(OH)2 = CaCl 2 + Ca(ClO)2 + 2H 2O 漂白粉长期置露在空气中失效:Ca(ClO)2 + CO 2 + H 2O = CaCO 3↓+ 2HClO ,2HClO 光 2HCl + O 2↑16、硫与非金属:S + O 2 点燃 SO 2 H 2+ S △ H 2S硫与金属: Fe + S △ FeS 2Cu + S △ Cu 2S17、二氧化硫与水反应:SO 2 + H 2O H 2SO 3二氧化硫与碱性氧化物反应:SO 2 + CaO = CaSO 3二氧化硫与碱反应:SO 2 + 2NaOH = Na 2SO 3 + H 2O 离方:二氧化硫与硫化氢气体反应:2H 2S +SO 2 = 3S↓ + 2H 2O 二氧化硫通入氯水中:SO 2 + Cl 2 + 2H 2O = 2HCl + H 2SO 4 (Cl 2可换作Br 2、I 2)离方:二氧化硫被O 2氧化:2SO 2 + O 2 2SO 3 18、三氧化硫:SO 3 + H 2O = H 2SO 4 SO 3 + Ca(OH)2 = CaSO 4↓ + H 2O 19、氮气与氧气在放电下反应:N 2 + O 2 放电或高温 2NO一氧化氮与氧气反应:2NO + O 2 = 2NO 2二氧化氮与水反应:3NO 2 + H 2O = 2HNO 3 + NO有关NO 、NO 2、O 2混合气体溶于水的计算:4NO 2 + O 2 +2H 2O = 4HNO 34NO + 3O 2 +2H 2O = 4HNO 320、NH 3在水中的反应:NH 3 + H 2O NH 3·H 2O NH 4++ OH — NH 3·H 2O 受热分解:NH 3·H 2O △ NH 3↑ + H 2O氨气与氯化氢反应:NH 3 + HCl = NH 4Cl21、氯化铵受热分解:NH 4Cl △ NH 3↑ + HCl↑碳酸氢氨受热分解:NH 4HCO 3 △ NH 3↑ + H 2O↑ + CO 2↑硝酸铵与氢氧化钠反应:NH 4NO 3 + NaOH △ NaNO 3 +NH 3↑ + H 2O (检验NH 4+的方法: 离方:22、实验室制取氨气:2NH 4Cl + Ca(OH)2 △ CaCl 2 + 2NH 3↑+ 2H 2O工业合成氨:N 2 + 3H 2 2NH 3 23、浓硫酸与铜反应:Cu + 2H 2SO 4(浓) △ CuSO 4 + SO 2↑+ 2H 2O浓硫酸与木炭反应:C + 2H 2SO 4(浓) △ CO 2 ↑+ 2SO 2↑+ 2H 2O△ 催化剂催化剂 高温高压解释“雷雨发庄稼”24、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2+ 2NO2↑+ 2H2O稀硝酸与铜反应:3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O离方:浓硝酸与木炭反应:C + 4HNO3(浓) = CO2↑+ 4NO2↑+ 2H2O。
高一必修一化学方程式分章节归纳汇总

高一化学《必修一》方程式(按章节归纳)第一、二章:1、硫酸根离子的检验:2、碳酸根离子的检验:3、银离子的检验:4、木炭还原氧化铜:5、铁片与硫酸铜溶液反应:6.镁在二氧化碳中燃烧:第三章:一、钠1、钠在空气中燃烧(黄色的火焰):2、钠块在空气中变暗:3、Na2O在空气中加热(变黄):4、金属锂在空气中燃烧:5、钠与水反应(浮、熔、游、响、红)化方离方二、Na2O、Na2O2的相关反应:1、碱性氧化物Na2O与水的反应:2、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,可用于漂白)化方离方3、碱性氧化物Na2O与CO2的反应4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是:5、Na2O+SO2=Na2O2+SO2=6、Na2O+2HCl=7、2Na2O2+4HCl=三、NaHCO3与Na2CO31、小苏打受热分解:2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:4、向NaOH溶液中通入少量CO2:5、继续通入过量CO2:总反应方程式:6、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液化方离方②纯碱溶液中滴加盐酸,至过量化方离方化方离方7、(1)Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3+Ca(OH)2=NaHCO3+Ca(OH)2(多)=2NaHCO3+Ca(OH)2(少)=8、Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na2CO3+CaCl2=NaHCO3溶液与CaCl2不反应;铝1、铝与氯气反应:2、铝片与稀盐酸反应化方离方3、铝与氢氧化钠溶液反应化方离方4、4Al+3O 22Al 2O 3电解熔融的氧化铝:2Al 2O 34Al +3O 2↑5、铝与氧化铁高温下反应【铝热反应】6、不稳定性:2Al(OH)3Al 2O 3+3H 2O7、硫酸铝溶液中滴过量氨水【实验室制备Al(OH)3】化方离方8、向NaAlO 2溶液中通入CO 2化方离方9、氧化铝溶于氢氧化钠溶液化方离方10、氧化铝溶于盐酸:化方离方11、Al(OH)3溶液中加盐酸:化方离方12、Al(OH)3与NaOH 溶液反应:化方离方13、铝盐、偏铝酸盐反应生成Al(OH)3:离方铁1、铁与硫加热反应:2、铁与氧气中燃烧:3.铁在氯气中燃烧:4、高温下铁与水蒸气反应:5、铁与盐酸反应:化方离方6.铁的氧化物FeO、Fe2O3、Fe3O4溶于盐酸中:化方离方化方离方化方离方7.Fe(OH)2、Fe(OH)3的制备:1)FeSO4+2NaOH=Fe(OH)2↓+Na2SO4Fe2++2OH-=Fe(OH)2↓氯化铁中滴入氢氧化钠溶液(红褐色沉淀)2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl Fe3++3OH-=Fe(OH)3↓氢氧化亚铁在空气中被氧化(白色絮状沉淀迅速变成灰绿色,最后变为红褐色沉淀)3)4)不稳定性:2Fe(OH)3Fe2O3+3H2O8.Fe2+、Fe3+之间的转化:1)氯化亚铁溶液中通入氯气(或者加氯水):化方离方2)氯化铁溶液中加入铁粉:化方离方3)用KSCN检验Fe3+的存在:离子方程式:Fe3++3SCN-=Fe(SCN)3(血红色)4)印刷电路板:第四章:一、硅(1)工业制单质硅(碳在高温下还原二氧化硅):(硅单质的实验室制法,粗硅的制取)(2)硅单质与氢氟酸(3)硅单质与NaOH溶液反应:Si及其化合物:二、二氧化硅(1)二氧化硅与氢氧化钠反应:化方离方(2)二氧化硅与氧化钙高温反应:(3)二氧化硅与氢氟酸反应:三、硅酸(H2SiO3)(1)往硅酸钠溶液中通入二氧化碳:(2)硅酸钠与盐酸反应:(3)硅酸受热分解:(4)工业制玻璃原理:四、氯气(1)氯气实验室制法:(仪器:分液漏斗,圆底烧瓶)化方离方2、氯气性质:A、金属和氯气的反应:(1)铜丝在氯气中剧烈燃烧(棕色烟):之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)(2)氯气和金属钠反应:(3)铁在氯气中剧烈燃烧:(4)氢气在氯气中燃烧(苍白色火焰):(5)氟气与氢气反应(黑暗处即可爆炸):B、氯气与水反应(6)氯气溶于水(新制氯水中含H+、Cl-、ClO-、OH-、Cl2、HClO、H2O)化方离方(7)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):C、氯气和碱的反应:(8)工业制漂白粉的原理:化方离方(9)漂白粉长期置露在空气中失效的原理:(10)制漂白液(或氯气尾气处理):五、硫和氮的化合物:(1)硫与非金属:(2)硫与金属:(3)硫与氢氧化钠溶液反应:(4)二氧化硫与水反应:(5)二氧化硫与碱性氧化物反应:(6)二氧化硫与碱反应:(7)二氧化硫与硫化氢气体反应:(8)二氧化硫通入氯水中:(9)二氧化硫被O2氧化:(10)三氧化硫与水反应(11)三氧化硫与碱反应:(12)硫化氢气体通入氯水:(13)亚硫酸钠与浓硫酸反应制备二氧化硫:(14)工业合成氨:(15)氨的催化氧化:(16)NH3在水中的反应:(17)氨水受热分解:(18)实验室制取氨气:(19)碳酸氢铵受热分解:(20)用浓盐酸检验氨气(白烟生成):(21)氯化铵受热分解:(22)硫酸铵溶液与氢氧化钠溶液混合加热化方离方(23)硝酸铵溶液与氢氧化钠溶液混合(不加热)(检验NH4+的方法)化方离方(24)氮气和氧气放电下反应(雷雨发庄稼)(25)二氧化氮溶于水:(26)NO2、O2的混合气通入水中无剩余气体:(27)NO、O2的混合气通入水中无剩余气体:5、浓硫酸、HNO3与Cu反应:Al、Fe遇浓HNO3、浓硫酸钝化(常温)(30)Cu与浓HNO3加热:(31)Cu与稀HNO3反应:(32)铜与浓硫酸反应:(33)浓硫酸与木炭反应:(34)浓硝酸与木炭反应:。
人教版高一化学必修1化学方程式(加粗必背)-自己总结的最全的方程式

高一化学必修1化学方程式汇总(加粗必背)1.钠与氧气常温反应:4Na +O2=2Na2O 金属钠切开后,银白色的切面很快变暗2.钠与氧气点燃反应:2Na +O2Na2O2 黄色火焰,生成淡黄色固体Na2O23.钠与水的反应:2Na +2H2O =2NaOH + H2↑(浮熔游响红)芙蓉又想红铁与高温水水蒸气反应:3Fe + 4H2O(g)Fe3O4 + 4H24.钠与硫酸铜溶液的反应(2步):2Na+2H2O =2NaOH+H2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO45. Na2O与水的反应:Na2O+H2O =2NaOH6.Na2O与CO2的反应:Na2O+CO2=Na2CO3Na2O与O2的反应:2Na2O+O22Na2O27. Na2O2与水的反应:2Na2O2+2H2O =4NaOH+O2↑ Na2O2既是氧化剂又是还原剂8.Na2O2与CO2的反应:2Na2O2+2CO2=2Na2CO3+O2Na2O2发生歧化反应,配平配29.氢气在氯气中燃烧:H2+Cl22HCl 安静燃烧、苍白色火焰,瓶口有白雾氢气和氯气光照:H2+Cl22HCl 会发生爆炸10.铁在氯气中燃烧:2Fe+3Cl22FeCl3黄褐色烟11.铜在氯气中燃烧:Cu+Cl2CuCl2 棕黄色的烟铝在氯气中燃烧:2Al +3Cl22AlCl3 白烟或黄烟(氯化铝是无色透明晶体或浅黄色的结晶性粉末)钠在氯气中燃烧:2Na +Cl22NaCl黄色火焰,氯气颜色褪去,白烟12.氯气与水的反应:Cl2+H2O = HCl+HClO 可逆反应,也可以写洁厕灵和84消毒液反应:NaClO+2HCl=NaCl+Cl2↑+H2O Cl- + ClO- + 2H+ = Cl2↑ + H2O13.次氯酸的不稳定性:2HClO 2HCl+O2↑14.氯气与氢氧化钠溶液反应(制漂白液/84消毒液):Cl2+2NaOH = NaCl+NaClO+H2O15.制漂白粉:2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O漂白粉具有漂白性:Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO生成的HClO越多,漂白性越好(生成HClO具有漂白性,但HClO不稳定,见光易分解,所以漂白粉就慢慢失效了)溴与NaOH溶液反应:Br2+2NaOH = NaBr+NaBrO+H2O (可用NaOH吸收氯气或溴单质)16.铁与稀硫酸反应的离子方程式:Fe + 2H+= Fe2++ H2↑FeO和稀硫酸反应:FeO + 2H+ = Fe2++ H2OFe3O4和稀H2SO4反应:Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O制备Fe(OH)2:FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4制备Fe(OH)3:FeCl3 + 3NaOH = Fe(OH)3↓ +3 NaClFe(OH)2不稳定易被空气中氧气氧化:4Fe(OH)2+O2+2H2O = 4Fe(OH)3白→灰绿→红褐色Fe(OH)3加热分解:2Fe(OH)3Fe2O3+3H2O 2Al(OH)3Al2O3+3H2O17.FeCl3溶液与Fe反应的离子方程式:2Fe3++Fe =3Fe2+18. FeCl3溶液与Cu反应的离子方程式:2Fe3++Cu =2Fe2++Cu2+19.FeCl2溶液与Cl2或氯水反应的离子方程式:2Fe2++ Cl2=2Fe3++ 2Cl-用KSCN检验Fe3+:Fe3+ + 3SCN-Fe(SCN)3血红色溶液制备Fe(OH)3胶体:Fe3+ + 3H2O Fe(OH)3 + 3H+(利用Fe3+水解原理)明矾﹝KAl(SO4)2∙12H2O﹞净水:Al3+ + 3H2O Al(OH)3 + 3H+胶体具有吸附性能净水20、向Na2CO3溶液中滴加少量稀盐酸的离子方程式CO32- + H+=HCO3-不产生CO2气体向Na2CO3溶液中加入过量稀HCl的离子方程式CO32 -+ 2H+=CO2 + H2O 产生CO221、向NaHCO3溶液中加稀HCl的离子方程式HCO3- + H+=H2O+CO2↑22、向NaHCO3溶液中加NaOH溶液的离子方程式HCO3-+ OH-=H2O + CO32-向NaHSO3溶液中加NaOH溶液的离子方程式HSO3-+ OH-=H2O + SO32-向NaHS溶液中加NaOH溶液的离子方程式HS-+ OH-=H2O + S2-23、向Na2CO3溶液中通入CO2气体的离子方程式CO32-+ H2O + CO2=2HCO3-24、NaHCO 3受热分解 2NaHCO 3 Na 2CO 3 + H 2O + CO 2↑侯氏制碱法 NaCl + NH 3 + H 2O + CO 2 = NH 4Cl + NaHCO 3↓25、溶洞形成的两反应 CaCO 3+CO 2+H 2O =Ca(HCO 3)2 Ca(HCO 3)2=CaCO 3↓+CO 2↑+H 2O26.N 2与O 2 N 2 + O 2 2NO27.N 2与H 2(工业合成氨/制氨气) N 2+3H 2 2NH 328.NO 与O 2 2NO + O 2 = 2NO 2 (无色气体NO 变红棕色气体NO 2)29.NO 2与H 2O 3NO 2 + H 2O = 2HNO 3 + NO30.NH 3与H 2O NH 3 + H 2O NH 3•H 2O31.NH 3与HCl NH 3 + HCl = NH 4Cl 有白烟生成(NH 4Cl 固体小颗粒)NH 3与Cl 2 8NH 3 + 3Cl 2 = 6NH 4Cl + N 2 有白烟生成 2NH 3+3Cl 2 = 6HCl + N 232.氨的催化氧化4NH 3 + 5O 2 4NO + 6H 2O33.NH 4Cl 受热分解 NH 4Cl NH 3↑ + HCl ↑ 不可用于制取氨气,生成的NH 3会和HCl 直接反应 34.NH 4HCO 3受热分解 NH 4HCO 3NH 3↑+H 2O+CO 2↑ 铵盐受热都易分解,铵盐易溶于水且吸热 35.实验室制氨气 2NH 4Cl + Ca(OH)2 CaCl 2 + 2NH 3↑ + 2H 2O 加热时试管口略向下倾斜36.氯化铵与稀氢氧化钠溶液反应的离子方程式NH 4+ + OH - = NH 3•H 2O氯化铵与浓氢氧化钠溶液反应(或加热)的离子方程式(可用于检验铵根离子)NH 4+ + OH - NH 3•H 2O NH 3↑ + H 2O (所以也可以用浓氨水直接加热,快速制取氨气)37.硝酸见光或受热分解 4HNO 3 4NO 2↑ + O 2↑ + 2H 2O 浓硝酸要放棕色试剂瓶中避光保存38.铜与稀硝酸 3Cu + 8HNO 3(稀) = 3Cu(NO 3)2 + 2NO ↑ + 4H 2O39.铜与浓硝酸 Cu + 4HNO 3(浓) = Cu(NO 3)2 + 2NO 2↑ + 2H 2O40.碳与浓硝酸 C + 4HNO 3(浓) CO 2↑ + 4NO 2↑ + 2H 2O少量铁与稀硝酸 Fe + 4HNO 3(稀) = Fe(NO 3)3 + NO ↑ + 2H 2O过量铁与稀硝酸 3Fe + 8HNO 3(稀) = 3Fe(NO 3)2 + 2NO ↑ + 4H 2O41.硫和铁 Fe+S FeS FeS 可溶于硫酸/盐酸/硝酸 FeS+H 2SO 4=FeSO 4+H 2S ↑42.硫和铜 2Cu+S Cu 2S (S 的氧化能力不足以将Cu 氧化成CuS ,只能得到Cu 2S ) 铁和氯气 2Fe +3Cl 2 = 2FeCl 3 Cu +Cl 2 = CuCl 2 Cl 2有强氧化性,把金属单质氧化到最高价硫化铜和硝酸反应 CuS + 10HNO 3(浓) = Cu(NO 3)2 + H 2SO 4 + 8NO 2↑ + 4H 2O3CuS + 8HNO 3(稀) = 3Cu(NO 3)2 + 3S + 2NO↑ + 4H 2O硫化铜和硝酸反应 Cu 2S + 12HNO 3(浓) = CuSO 4+Cu(NO 3)2 + 10NO 2↑ + 6H 2O3Cu 2S + 16HNO 3(稀) = 6Cu(NO 3)2 + 3S + 4NO ↑ + 8H 2OCuS 不溶于硫酸/盐酸,能溶于硝酸 Cu 2S 溶于硫酸/盐酸/硝酸硫化亚铜和浓硫酸反应 Cu 2S + 4H 2SO 4 = 2CuSO 4 + S + 2SO 2↑ + 4H 2O 浓硫酸的氧化性 硫化亚铜和稀硫酸反应 Cu 2S + H 2SO 4 = Cu + CuSO 4 + H 2S ↑ 亚铜的歧化反应硫和氢气 H 2 + S H 2S (臭鸡蛋气味气体,溶于水形成氢硫酸-弱酸)硫化氢和浓硫酸反应 H 2S + H 2SO 4 = S ↓ + SO 2 + 2H 2O 不可用浓硫酸干燥硫化氢等还原性气体43.硫在足量的氧气中燃烧 S +O 2 SO 2 (注意:氧气再多也不能生成SO 3)二氧化硫和氧气反应 2SO 2+O 2 2SO 3 (需要催化剂,空气中的灰尘可充当催化剂)44.SO 2溶于水 SO 2+H 2O H 2SO 3弱酸H 2SO 3分步电离 H 2SO 3 H + + HSO 3- HSO 3- H + + SO 32-NaOH 溶液吸收少量SO 2: SO 2 + 2NaOH = Na 2SO 3 + 2H 2ONaOH 溶液吸收过量SO 2: SO 2 + NaOH = NaHSO 3SO 2通入澄清石灰水: SO 2 + Ca(OH)2 = CaSO 3↓+ H 2O 出现浑浊,不可以用于检验SO 2SO 3和NaOH 溶液反应: SO 3 + 2NaOH = Na 2SO 4 + H 2O燃煤时加入石灰石吸收SO 2:2CaCO 3 + 2SO 2 + O 2 2CaSO 4 + 2CO 2CaO + SO 2 = CaSO 3 Ca(OH)2 + SO 2 = CaSO 3 +H 2O CaCO 3 + SO 2 CaSO 3 + CO 2催化剂 △CaSO 3CaO + SO 2↑ 2CaO + 2SO 2 + O 2 = 2CaSO 4 2Ca(OH)2 + 2SO 2 + O 2 = 2CaSO 4 + 2H 2O45.SO 2通入氢硫酸中 2H 2S + SO 2 = 3S ↓ + 2H 2O 归中反应,体现了SO 2的氧化性46.H 2SO 3被O 2氧化 2H 2SO 3 + O 2 = 2H 2SO 447.SO 2通入氯水中 SO 2 + Cl 2+ 2H 2O = 2HCl + H 2SO 4SO 2通入溴水中 SO 2 + Br 2 + 2H 2O = 2HBr + H 2SO 4SO 2通入碘水中 SO 2 + I 2 + 2H 2O = 2HI + H 2SO 448.铜和浓硫酸共热 Cu + 2H 2SO 4(浓) CuSO 4+SO 2↑+2H 2O 实验室制取SO 2浓硫酸和亚硫酸钠固体制取SO 2 Na 2SO 3 + H 2SO 4 = Na 2SO 4 + H 2O + SO 2↑ 也可用于实验室制SO 249.碳和浓硫酸共热 C + 2H 2SO 4(浓) CO 2↑ + 2SO 2↑ + 2H 2O 蔗糖被浓硫酸脱水碳化后会继续和浓硫酸反应50.以硫磺为原料工业制硫酸(共3步, S 和O 2a 点燃只能生成SO 2)S +O 2 SO 2 2SO 2+O 2 2SO 3 SO 3+H 2O=H 2SO 4硫酸酸雨的生成步骤 S+O 2SO 2 SO 2+H 2O=H 2SO 3 2H 2SO 3+O 2=2H 2SO 451.以N 2等为原料工业制硝酸:(共4步) N 2 + 3H 2 2NH 3 4NH 3 + 5O 2 4NO + 6H 2O2NO + O 2 = 2NO 2 3NO 2 + H 2O = 2HNO 3 + NO52.电解熔融MgCl 2 MgCl 2(熔融) Mg+Cl 2↑ 2NaCl (熔融) 2Na+Cl 2↑53.Mg 在CO 2中燃烧: 2Mg+CO 2 C+2MgO 2Al 2O 3(熔融) 4Al+3O 2↑54.设计实验验证氧化性Cl 2>Br 2>I 2: 2NaBr + Cl 2 = 2NaCl + Br 2 2KI + Br 2 = 2KBr + I 255.向NaBr 溶液中滴加硝酸银溶液反应的离子方程式Ag + + Br - = AgBr ↓ 淡黄色沉淀56.向KI 溶液中滴加硝酸银溶液反应的离子方程式 Ag + + I - = AgI ↓ 黄色沉淀57、硅与氧气共热 Si + O 2 SiO 258、硅的工业制法 SiO 2 + 2C Si + 2CO ↑59、SiO 2与NaOH 溶液 SiO 2 + 2NaOH = Na 2SiO 3 + H 2OSiO 2与碱性氧化物反应 SiO 2 + CaO CaSiO 360、SiO 2与氢氟酸 SiO 2 + 4HF = SiF 4↑+ 2H 2O61、工业制玻璃(2个)SiO 2 + CaCO 3 CaSiO 3 + CO 2↑SiO 2 + Na 2CO 3 Na 2SiO 3 + CO 2↑62、Na 2SiO 3溶液与稀盐酸 Na 2SiO 3 + 2HCl = 2NaCl + H 2SiO 3↓ 硅酸盐和酸反应制取硅酸Na 2SiO 3溶液中通入CO 2 Na 2SiO 3 + CO 2 + H 2O = Na 2CO 3 + H 2SiO 3↓ 出现硅酸胶体,变浑浊 硅酸不稳定加热分解 H 2SiO 3 SiO 2 + H 2O63、Al 与稀硫酸的离子方程式 2Al + 6H + = 2Al 3+ + 2H 2↑64、Al 与NaOH 溶液反应 2Al + 2NaOH + 2H 2O =2NaAlO 2 + 3H 2↑此反应分为两步反应:2Al + 6H 2O = 2Al(OH)3 + 3H 2↑ Al(OH)3 +NaOH = NaAlO 2 + 2H 2O65、Al 与Fe 2O 3的铝热反应 2Al + Fe 2O 3 Al 2O 3 + 2Fe66、Al 2O 3与稀硫酸的离子方程式 Al 2O 3 + 6H + = 2Al 3+ + 3H 2O67、Al 2O 3与NaOH 溶液反应 Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2OAl(OH)3的电离 AlO 2- + H + + H 2O Al(OH)3Al 3+ + 3OH -酸式电离 碱式电离68、Al(OH)3与稀硫酸的离子方程式 Al(OH)3 + 3H + = Al 3+ + 3H 2O69. Al(OH)3与NaOH 溶液的离子方程式 Al(OH)3 + OH - = AlO 2- + 2H 2O70、AlCl 3与足量氨水的离子方程式 Al 3+ + 3NH 3•H 2O = Al(OH)3↓+ 3NH 4+ 用于制备Al(OH)371.Cu 在潮湿的空气中生锈 2Cu + O 2 + CO 2 + H 2O = Cu 2(OH)2CO 3 (碱式碳酸铜/铜锈,绿色)72、AlCl 3与少量NaOH 反应的离子方程式 Al 3+ + 3OH - = Al(OH)3↓73、AlCl 3与足量NaOH 反应的离子方程式 Al 3+ + 4OH - = AlO 2- + 2H 2O催化剂△74、偏铝酸钠溶液加如稀盐酸: 少量HCl :NaAlO 2 + HCl + H 2O = Al(OH)3↓ + NaCl 过量HCl :NaAlO 2 + 4HCl = AlCl 3 + NaCl + 2H 2O75、偏铝酸钠溶液中通入二氧化碳: 少量CO2:2NaAlO 2 + CO 2 + 3H 2O = 2 Al(OH)3↓ + Na 2CO 3 过量CO2:NaAlO 2 + CO 2 + 2H 2O = Al(OH)3↓ + NaHCO 376、碳酸钠溶液中通入二氧化硫:碳酸钠吸收少量二氧化硫:2Na 2CO 3 + SO 2 + H 2O = 2NaHCO 3 + Na 2SO 3 碳酸钠吸收等物质的量二氧化硫:Na 2CO 3 + SO 2 + H 2O = H 2O + CO 2↑+ Na 2SO 3 碳酸钠吸收过量二氧化硫:Na 2CO 3 + 2SO 2 + H 2O = CO 2↑+ 2NaHSO 377、碳酸氢钠溶液中通入二氧化硫:7879、高锰酸钾和草酸反应2KMnO 4+5H 2C 2O 4+3H 2SO 4 = 2MnSO 4+K 2SO 4+10CO 2↑+8H 2O2MnO 4-+5H 2C 2O 4+6H + = 2Mn 2+ +10CO 2↑+8H 2OMnO 4- + MnO 4- + KClO 3 + HCl (浓) ═ KCl + ClO 2↑ + Cl 2↑ + H 2O。
高一化学必修一方程式总结

高一化学必修一方程式总结高一化学必修一(一)课堂导学1一、氨1.氨气的物理性质是无色气体,有刺激性气味,密度比空气小,极易溶于水(易液化)。
2.氨气易溶于水——喷泉实验操作及现象:(1)打开止水夹,并挤压滴管的胶头(2)烧杯中的溶液由玻璃管进入烧瓶,形成喷泉,瓶内液体呈红色结论:氨易溶于水,水溶液呈碱性3.将分别蘸有浓氨水、浓盐酸的两支玻璃棒渐渐靠近,观察到的现象是有大量白烟产生,这是因为浓氨水挥发产生的氨气与浓盐酸挥发产生的HCl气体在空气中相遇迅速反应生成氯化铵晶体小颗粒,反应的化学方程式是NH3+HCl===NH4Cl。
4.NH3分子中氮元素的化合价为-3价,在化学反应中氮元素化合价可能的变化是只能升高,不能降低,因此氨具有还原性。
请写出氨气与氧气在催化剂作用下生成NO的化学方程式:4NH3+5O2催化剂4NO+6H2O。
归纳总结11.氨气的化学性质(1)氨与水反应生成一水合氨:NH3+H2O?NH3·H2O。
(2)氨与酸反应生成铵盐:NH3+H+===NH4+。
(3)氨的催化氧化反应:4NH3+5O2催化剂4NO+6H2O。
2.氨水的性质(1)氨溶于水,大部分和水反应生成NH3·H2O。
NH3·H2O很不稳定,受热易分解为氨气和水,反应的化学方程式是NH3·H2O△=====NH3↑+H2O。
(2)氨水具有弱碱性,电离方程式是NH3·H2O?NH4++OH-,能使酚酞试液变红色(或使湿润的红色石蕊试纸变蓝色),能与氯化铝溶液反应,离子方程式是Al3++3NH3·H2O===Al(OH)3↓+3NH4+。
课堂导学2二、铵盐及氨气的制取1.农业上常用的铵态氮肥,如NH4HCO3、(NH4)2SO4、NH4NO3等都属于铵盐,它们都易溶于水。
其化学性质是(1)铵盐受热易分解NH4Cl受热分解的化学方程式:NH4Cl△=====NH3↑+HCl↑。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学《必修一》方程式(按章节归纳)第一、二章:1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl3、银离子的检验:Cl -+ Ag += AgCl ↓4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu6. 镁在二氧化碳中燃烧:2Mg +CO2点燃2MgO +C第三章:一、钠1、钠在空气中燃烧(黄色的火焰):2Na +O2Na2O22、钠块在空气中变暗:4Na+O2=2Na2O3、Na2O在空气中加热(变黄):2Na2O+O2△2Na2O24、金属锂在空气中燃烧:4Li +O2△2Li2O5、钠与水反应(浮、熔、游、响、红)2Na +2H2O =2NaOH+H2↑2Na +2H2O =2Na++2OH -+H2 ↑二、Na2O 、Na2O2的相关反应:1、碱性氧化物Na2O与水的反应:Na2O+H2O=2NaOH2、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,可用于漂白)2Na2O2+2H2O =4NaOH +O2↑2Na2O2+2H2O =4Na++4OH -+O2↑3、碱性氧化物Na2O与CO2的反应Na2O +CO2=Na2CO34、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是:2Na2O2+2CO2=2Na2CO3+O25、Na2O +SO2=Na2SO3Na2O2+SO2=Na2SO46、Na2O +2HCl =2NaCl +H2O7、2Na2O2+4 HCl =4 NaCl +2 H2O +O2↑三、NaHCO3与Na2CO31、小苏打受热分解:2NaHCO3△Na2CO3+H2O +CO2 ↑2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3+NaOH △Na2CO3+H2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO3+NaOH =Na2CO3+H2O HCO3-+OH -=H2O +CO32-4、向NaOH溶液中通入少量CO2 :2NaOH + CO2 = Na2CO3 + H2O5、继续通入过量CO2 :Na2CO3 + CO2 + H2O = 2 NaHCO3总反应方程式:NaOH + CO2 = NaHCO36、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O +CO2↑ CO32-+2H+=H2O +CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=H2O +CO2↑7、(1)Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3+Ca(OH)2 =CaCO3↓+2 NaOHNaHCO3+Ca(OH)2(多)=CaCO3↓+NaOH +H2O2NaHCO3+Ca(OH)2(少)=CaCO3↓+Na2CO3+2H2O8、Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na2CO3+CaCl2 =CaCO3↓+2 Na ClNaHCO3溶液与CaCl2 不反应;四、铝1、铝与氯气反应:2Al +3Cl2点燃2AlCl32、铝片与稀盐酸反应2Al +6HCl =2AlCl3+3H2↑ 2Al +6H+=2Al3++3H2↑3、铝与氢氧化钠溶液反应2Al+2NaOH +2H2O =2NaAlO2+3H2↑(只有H2O作氧化剂)2Al +2OH -+2H2O =2AlO2-+3H2↑4、4Al +3O2△2Al2O3 电解熔融的氧化铝:2Al2O3 4Al +3O2↑5、铝与氧化铁高温下反应【铝热反应】:2Al +Fe2O3高温2Fe +Al2O36、不稳定性:2Al(OH)3 △Al2O3 +3H2O7、硫酸铝溶液中滴过量氨水【实验室制备Al(OH)3】Al2(SO4)3+6NH3·H2O==错误!未找到引用源。
2Al(OH)3↓+3(NH4)2SO4Al3++3 NH3·H2O =Al(OH)3↓+3NH4+8、向NaAlO2 溶液中通入CO22NaAlO2 +CO2(少)+3H2O =2Al(OH)3↓+Na2CO32AlO2-+CO2(少)+3H2O =2Al(OH)3↓+CO32-NaAlO2 +CO2(多)+2H2O =Al(OH)3↓+NaHCO3AlO2-+CO2(多)+2H2O =Al(OH)3↓+H CO3-9、氧化铝溶于氢氧化钠溶液Al2O3+2NaOH == 2NaAlO2+H2O Al2O3+2OH -=2AlO2-+H2O10、氧化铝溶于盐酸:Al2O3+6HCl =2AlCl3+3 H2O Al2O3+6H+=2Al3++3 H2O氢氧化铝的两性电离H+ + AlO2-+ H2O Al(OH)3Al3+ + 3OH-11、Al(OH)3溶液中加盐酸:Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O12、Al(OH)3与NaOH溶液反应:Al(OH)3+NaOH == NaAlO2+2 H2O Al(OH)3+OH-=AlO2-+2 H2O13、铝盐、偏铝酸盐反应生成Al(OH)3 :3AlO2-+Al3++6H2O =4 Al(OH)3↓五、铁1、铁与硫加热反应:Fe +S FeS2、铁与氧气中燃烧:3Fe+2O2点燃Fe3O43. 铁在氯气中燃烧:2Fe+3Cl2点燃2FeCl34、高温下铁与水蒸气反应:3Fe +4H2O(g)高温Fe3O4+4H25、铁与盐酸反应:Fe +2HCl =FeCl2+H2↑ Fe +2H+=Fe2++H2↑6.铁的氧化物FeO 、Fe2O3、Fe3O4溶于盐酸中:1)FeO +2HCl =FeCl2+H2O FeO +2H+=Fe2++H2O2)Fe2O3+6HCl =2FeCl3+3H2O Fe2O3+6H+=2Fe3++3H2O3) Fe3O4+8HCl =FeCl2+2FeCl3+4H2O Fe3O4+8H+=Fe2++2Fe3++4 H2O7.Fe(OH)2、Fe(OH)3的制备:1) FeSO4+2NaOH =Fe(OH)2↓+Na2SO4 Fe2++2OH -=Fe(OH)2↓氯化铁中滴入氢氧化钠溶液(红褐色沉淀)2)FeCl3+3NaOH =Fe(OH)3↓+3NaCl Fe3++3OH -=Fe(OH)3↓氢氧化亚铁在空气中被氧化(白色絮状沉淀迅速变成灰绿色,最后变为红褐色沉淀.......................)3)4Fe (OH).......2.+.O.2.+.2H..2.O .=.4Fe (OH).......3.4)不稳定性:2Fe(OH)3 △Fe2O3 +3H2O8.Fe2+、Fe3+之间的转化:1)氯化亚铁溶液中通入氯气(或者加氯水):2FeCl2+Cl2=2FeCl3 2 Fe2++Cl2=2 Fe3++2Cl-2)氯化铁溶液中加入铁粉:2FeCl3+Fe =3FeCl2 2Fe3++Fe =3Fe2+3)用KSCN检验Fe3+的存在:离子方程式:Fe3++3SCN-Fe (SCN)3 (血红色)4)印刷电路板:2FeCl3+Cu =2FeCl2 +CuCl2第四章:一、硅(1)工业制单质硅(碳在高温下还原二氧化硅):SiO 2 + 2C高温Si + 2CO ↑(硅单质的实验室制法,粗硅的制取)(2)硅单质与氢氟酸、Si +4HF = SiF 4 ↑+ 2H 2↑(3)硅单质与NaOH 溶液反应: Si + 2NaOH + H 2O = Na 2SiO 3 +2H 2↑ Si 及其化合物: 二、二氧化硅(1)二氧化硅与氢氧化钠反应: SiO 2 + 2NaOH = Na 2SiO 3 + H 2O SiO 2 + 2OH -= SiO 32-+ H 2O (2)二氧化硅与氧化钙高温反应:SiO 2 + CaO高温CaSiO 3(3)二氧化硅与氢氟酸反应:SiO 2 + 4HF = SiF 4↑+ 2 H 2O 三、硅酸(H 2SiO 3)(1)往硅酸钠溶液中通入二氧化碳:Na 2SiO 3 + CO 2 + H 2O = Na 2CO 3 + H 2SiO 3↓ (2)硅酸钠与盐酸反应:Na 2SiO 3 + 2HCl = 2NaCl + H 2SiO 3↓ (3)硅酸受热分解:H 2SiO 3△SiO 2 + H 2O(4)工业制玻璃原理:SiO 2 + Na 2CO 3高温Na 2SiO 3 + CO 2↑SiO 2 + Ca CO 3 高温Ca SiO 3 + CO 2↑四、氯气(1)氯气实验室制法:(仪器:分液漏斗,圆底烧瓶) MnO 2 +4HCl(浓)MnCl 2+Cl 2↑+2H 2O MnO 2 +4H ++2Cl-Mn 2++Cl 2↑+2H 2O(2)电解氯化钠溶液 : 2NaCl +2 H 2O 2NaOH + H 2↑ + Cl 2↑(氯碱工业) (3)电解熔融氯化钠: 2NaCl 2Na + Cl 2↑ 2、氯气性质:A 、金属和氯气的反应:(1)铜丝在氯气中剧烈燃烧(棕色烟):Cu + Cl 2点燃CuCl 2之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)(2)氯气和金属钠反应:2Na + Cl 2点燃2NaCl (3)铁在氯气中剧烈燃烧 :2Fe + 3Cl 2点燃3FeCl 3(4)氢气在氯气中燃烧(苍白色火焰):H 2 + Cl 2点燃2HCl(5)氟气与氢气反应(黑暗处即可爆炸):H 2+F 2=2HF B 、氯气与水反应(6)氯气溶于水(新制氯水中含H +、Cl -、ClO -、OH -、Cl 2、HClO 、H 2O ) Cl 2 + H 2O HCl + HClO Cl 2 + H 2O = H ++ Cl -+ HClO新制氯水注入盛溴化钠溶液的试管中通电 通电(7)Cl2+2NaBr =Br2+2NaCl Cl2+2Br-=Br2+2Cl-(8)Cl2+2NaI =2NaCl +I2Cl2+2I-=I2 +2Cl-(9)次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂):2HClO 2HCl +O2↑C、氯气和碱的反应:(10)工业制漂白粉的原理:2Ca(OH)2 +2Cl2=Ca(ClO)2+CaCl2+2H2O2Ca(OH)2 +2Cl2=2Ca2++2ClO-+2Cl -+2H2O(11)漂白粉长期置露在空气中失效的原理:2Ca(OH)2 + 2Cl2 ===Ca(ClO)2 + CaCl2 + 2H2OCa(ClO)2 + CO2 + H2O =CaCO3↓+ 2HClO2HClO 2HCl + O2↑(12)制漂白液(或氯气尾气处理):Cl2 +2NaOH = NaCl + NaClO + H2O五、硫和氮的化合物:(1)硫与非金属:S + O2点燃SO2H2+ S △H2S(2)硫与金属:Fe + S △FeS 2Cu + S△Cu2S(3)硫与氢氧化钠溶液反应:3S+6NaOH △2Na2S+Na2SO3+3H2O(4)二氧化硫与水反应:SO2 + H2O H2SO3(5)二氧化硫与碱性氧化物反应:SO2 + CaO = CaSO3(6)二氧化硫与碱反应:SO2 + 2NaOH = Na2SO3 + H2O SO2 + Ca(OH)2 = CaSO3↓ + H2O (7)二氧化硫与硫化氢气体反应:2H2S +SO2= 3S↓ + 2H2O(8)二氧化硫通入氯水中:SO2 + Cl2 + 2H2O = 2HCl + H2SO4(Cl2可换作Br2、I2)(9)二氧化硫被O2氧化:2SO2 + O22SO3(10)三氧化硫与水反应:SO3 + H2O = H2SO4(11)三氧化硫与碱反应:SO3 + Ca(OH)2 = CaSO4↓ + H2O(12)硫化氢气体通入氯水:H2S+Cl2=== 2HCl + S↓(13)亚硫酸钠与浓硫酸反应制备二氧化硫:Na2SO3 +H2SO4 (浓)===Na2SO4+H2O+SO2 ↑(14)工业合成氨:N2+3H2催化剂高温高压2NH3(15)氨的催化氧化:4NH3+5O24NO +6H2O(16)NH3在水中的反应:NH3 + H2O NH3• H2O NH4++ OH-(17)氨水受热分解:NH3•H2O △NH3↑ + H2O(18)实验室制取氨气:2NH4Cl + Ca(OH)2△CaCl2 + 2NH3↑+ 2H2O催化剂光照△光照(19)碳酸氢铵受热分解:NH4HCO3△NH3↑+H2O↑ +CO2↑(20)用浓盐酸检验氨气(白烟生成):HCl +NH3=NH4Cl(21)氯化铵受热分解:NH4Cl △NH3↑ + HCl↑(22)硫酸铵溶液与氢氧化钠溶液混合加热(NH4)2SO4+2NaOH △2NH3↑+Na2SO4+2H2O NH4++OH -△NH3↑+H2O(23)硝酸铵溶液与氢氧化钠溶液混合(不加热)(检验NH4+的方法)NH4NO3+NaOH =NH3↑+H2O +NaNO3 NH4++OH-=NH3↑+H2O (24)氮气和氧气放电下反应(雷雨发庄稼)N2+O2 2NO 2NO +O2=2NO2(25)二氧化氮溶于水:3NO2+H2O =2HNO3+NO3NO2+H2O =2H++2NO3-+NO(26)NO2、O2的混合气通入水中无剩余气体:4NO2+O2+2H2O =4 HNO3(27)NO 、O2的混合气通入水中无剩余气体:4NO+3O2+2H2O =4 HNO3(28)NO2、NO的回收:NO2+NO+2NaOH===2NaNO2+H2O(29)NO2与氢氧化钠反应:2NO2+2NaOH===NaNO3+NaNO2+H2O5、浓硫酸、HNO3与Cu反应:Al、Fe遇浓HNO3、浓硫酸钝化(常温)(30)Cu与浓HNO3加热:Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O (31)Cu与稀HNO3反应:3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O (32)铜与浓硫酸反应:Cu+2H2SO4 (浓)CuSO4 +2H2O+SO2 ↑(33)浓硫酸与木炭反应:C+2H2SO4(浓)2H2O+CO2↑+2SO2↑(34)浓硝酸与木炭反应:C+4HNO3(浓)2H2O+CO2↑+4NO2↑放电。
