蔗糖标准溶液配制
实验八 甘蔗汁中总糖及蔗糖含量的测定

实验八甘蔗汁中总糖及蔗糖含量的测定(费林法)一、原理蔗糖的测定常以还原糖的测定为基础,样品经前处理后,加入稀盐酸,在加热条件下使蔗糖水解转化为还原糖,再以斐林试剂法测定试样水解后的总还原糖量(即食品中的总糖)及水解前的还原糖量(食品原有的还原糖),两者之差再乘以校正系数0.95即为蔗糖量。
二、操作步骤:1、样品处理准确吸取10.00mL甘蔗汁移入100m L容量瓶中。
缓慢加入5mL乙酸锌溶液及5mL10.6%亚铁氰化钾溶液,加水至刻度,混匀,静置后过滤,弃去初滤液,收集滤液,即样品处理液。
2、标定碱性酒石酸铜溶液(费林试剂):(1)准确吸取5.00mL碱性酒石酸铜甲液及5.00mL乙液,置于150mL锥形瓶中。
(2)加水10mL,加入玻璃珠数粒。
(3)从滴定管滴加约9mL葡萄糖(转化糖)标准溶液,2min内加热至沸,趁沸以每两秒1滴的速度继续滴加葡萄糖标准溶液,直至溶液蓝色刚好褪去,记录消耗葡萄糖标准溶的总体积。
(4)同时平行操作三份,取其平均值。
3、水解前样品中还原糖含量的测定:取样品处理液,按还原糖法测定水解前的还原糖含量。
(同实验七)4、样品总糖量的测定:(1)吸取10.00mL样品处理液置于100mL容量瓶中。
(2)加入6mol/L 盐酸5mL,在68~70℃水浴加热15min。
(3)迅速冷却后加2滴指示剂,用20% NaOH中和(甲基红指示剂:溶液颜色由红变黄;酚酞指示剂:由无色变浅粉红色),加水至刻度,混匀,按还原糖法测定水解后的总还原糖含量。
(同实验七)三、实验记录及处理:碱性酒石酸铜溶液的标定10ml碱性酒石酸铜溶液相当于葡萄糖(转化糖)的质量mg。
葡萄糖标准溶液蔗糖标准溶液(转化糖)标准溶液浓度ρ,mg/ml标定所耗标液的体积V,ml1 2 3 平均 1 2 3 平均10mL碱性酒石酸铜相当于葡萄糖(转化糖)的质量F,mg公式:F1= ρ1× V1公式:F2 = ρ2× V2/0.95食品中还原糖含量测定水解前(试样原有还原糖)水解后(总糖)试样量,ml稀释过程试样定容总体积V,ml样液预测总消耗量V0,ml样液正式滴定总消耗量V1 ,ml1 2 3 平均值 1 2 3 平均值测得还原糖含量,%公式:样品中还原糖含量R1,%总糖含量R2,%(以转化糖计)蔗糖的含量,%公式:蔗糖% = (R2-R1)×0.951001000VVmF%计)还原糖(以葡萄糖1⨯⨯⨯=或转化糖四、说明及注意事项1.严格控水解条件以确保结果的准确性及重现性。
(完整版)蔗糖标准操作规程(2015版药典)
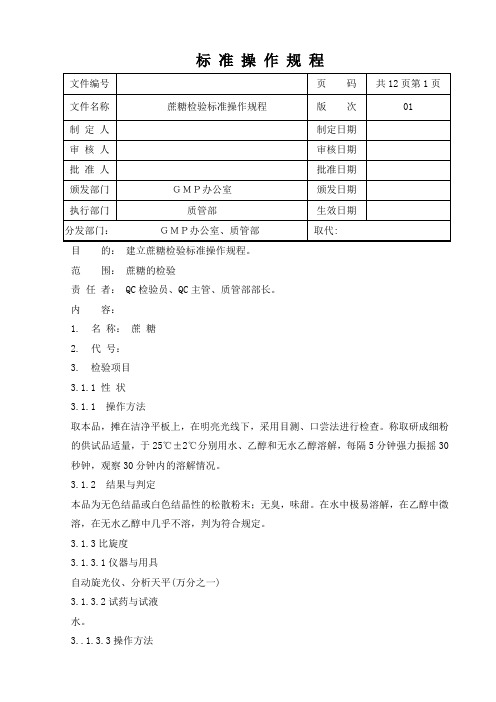
目的:建立蔗糖检验标准操作规程。
范围:蔗糖的检验责任者: QC检验员、QC主管、质管部部长。
内容:1. 名称:蔗糖2.代号:3. 检验项目3.1.1 性状3.1.1 操作方法取本品,摊在洁净平板上,在明亮光线下,采用目测、口尝法进行检查。
称取研成细粉的供试品适量,于25℃±2℃分别用水、乙醇和无水乙醇溶解,每隔5分钟强力振摇30秒钟,观察30分钟内的溶解情况。
3.1.2 结果与判定本品为无色结晶或白色结晶性的松散粉末;无臭,味甜。
在水中极易溶解,在乙醇中微溶,在无水乙醇中几乎不溶,判为符合规定。
3.1.3比旋度3.1.3.1仪器与用具自动旋光仪、分析天平(万分之一)3.1.3.2试药与试液水。
3..1.3.3操作方法取本品,精密称定,加水溶解并定量稀释成每1ml中约含0.1g的溶液,立即依法测定(中国药典2015年版四部通则0621)比旋度。
3.1.3.4结果与判定比旋度为+66.3°至+67.0°,判为符合规定。
3.2 鉴别3.2.1 显色反应3.2.1.1仪器与用具酒精灯、试管。
3.2.1.2 试药与试液0.05mol/L硫酸溶液、0.1mol/L氢氧化钠溶液、碱性酒石酸铜试液。
3.2.1.3 操作方法取本品,0.05mol/L加硫酸溶液,煮沸后,用0.1mol/L氢氧化钠溶液中和,再加碱性酒石酸铜试液,加热,观察发生的现象。
3.2.1.4 结果与判定加热即生成氧化亚铜的红色沉淀,判为符合规定。
3.2.2 红外鉴别3.2.2.1仪器与用具红外分光光度计、玛瑙研钵、压片机、烘箱、电子分析天平(十万分之一)、压片模具。
3.2.2.2试剂溴化钾(光谱纯)、蔗糖对照品。
3.2.2.3空白片的制备取干燥的溴化钾细粉适量,移置于直径为13mm的压模中,使铺布均匀,加压至20Mpa,保持2~5min,除去真空,取出制成的供试片,目视检查应均匀透明,无明显颗粒。
3.2.2.4供试片的制备取供试品3mg,置玛瑙研钵中,加入干燥的溴化钾细粉约0.6g,充分研磨,移置于直径为13mm的压模中,使铺布均匀,加压至20Mpa,保持2~5min,除去真空,取出制成的供试片,目视检查应均匀透明,无明显颗粒。
蔗糖的测定方法

蔗糖的测定方法-CAL-FENGHAI.-(YICAI)-Company One1蔗糖的测定方法1.原理样品经除去蛋白质后,蔗糖经盐酸水解转化为还原糖,再按还原糖测定。
水解前后还原糖的差值为蔗糖含量。
2.适用范围。
本方法适合于所有食物样品蔗糖的检测。
3.仪器(1)滴定管(2) 25ml古式坩埚或G4垂融坩埚(3)真空泵(4)水浴锅4.试剂除特殊说明外,实验用水为蒸馏水,试剂为分析纯。
6 mol/L盐酸:量取50ml盐酸加水稀释至100 ml。
甲基红指示剂:称取10mg甲基红,用100ml乙醇溶解。
5 mol/L氢氧化钠溶液:称取20g氢氧化钠加水溶解并稀释至100ml。
碱性酒石酸铜甲液:称取硫酸铜(CuSO4·5H2O),加适量水溶解,加硫酸,再加水稀释至500ml,用精制石棉过滤。
碱性酒石酸铜乙液:称取173g酒石酸钾钠与50g氢氧化钠,加适量水溶解,并稀释至500ml,用精制石棉过滤,贮存于橡胶塞玻璃瓶中。
精制石棉:取石棉先用3mol/L盐酸浸泡2~3天,用水洗净,再加L氢氧化钠溶液浸泡2~3天,倾去溶液,再用热碱性酒石酸铜已液浸泡数小时,用水洗净。
再以3 mol/L 盐酸浸泡数小时,以水洗至不呈酸性。
然后加水振摇,使成微细的浆状软县委,用水浸泡并贮存于玻璃瓶中,即可用做填充古式坩埚用。
L高锰酸钾标准溶液。
1mol/L氢氧化钠溶液:称取4g 氢氧化钠,加水溶解并稀释至100ml。
硫酸铁溶液:称取50g硫酸铁,加入200ml水溶解后,慢慢加入100ml硫酸,冷却后加水稀释至1L。
3mol/L盐酸:量取30ml盐酸,加水稀释至120ml。
5.操作方法样品处理:5.1.1乳类、乳制品及含蛋白质的食品:称取约~2 g固体样品(吸取2~10 ml 液体样品),置于250 ml容量瓶中,加50 ml水,摇匀。
加入10 ml碱性酒石酸铜甲液及4 ml1mol/L氢氧化钠溶液,加水至刻度,混匀。
静置30min,用干燥滤纸过滤,弃去初滤液,滤液备用。
蔗糖及葡萄糖标准溶液

蔗糖及葡萄糖标准溶液的制备
蔗糖和葡萄糖都是常见的糖类物质,它们在生物化学实验中经常被用作标准溶液。
标准溶液是一种已知浓度的溶液,可以用于测量其他溶液的浓度。
以下是蔗糖和葡萄糖标准溶液的制备方法:
1. 蔗糖标准溶液:制备蔗糖标准溶液,首先需要将蔗糖干燥并精确称量。
然后,将蔗糖溶解在足够的水中,通常使其浓度达到10%、20%或更高。
为了确保溶液的准确性,可以使用搅拌器充分搅拌,直到蔗糖完全溶解。
要制备10%的蔗糖标准溶液,可以按照以下步骤进行:- 称取10克蔗糖。
- 将蔗糖放入100毫升水中。
- 搅拌至蔗糖完全溶解。
制备更高浓度的蔗糖标准溶液,只需按照相同的比例增加蔗糖的量即可。
2. 葡萄糖标准溶液:葡萄糖标准溶液的制备方法与蔗糖类似。
首先,需要精确称取一定量的葡萄糖,然后将其溶解在足够的水中。
为了确保溶液的准确性,可以使用搅拌器充分搅拌,直到葡萄糖完全溶解。
要制备一定浓度的葡萄糖标准溶液,可以按照以下步骤进行:- 称取所需的葡萄糖量(例如,1克)。
- 将葡萄糖放入一定体积的水中(例如,100毫升)。
- 搅拌至葡萄糖完全溶解。
在实验过程中,可以根据需要将蔗糖或葡萄糖溶液稀释到不同浓度。
注意,在制备和储存标准溶液时,要确保溶液的稳定性,避免光照、温度变化和微生物污染。
在生物化学实验中,蔗糖和葡萄糖标准溶液可以用于测量其他糖类物质的浓度,也可以用于研究糖的代谢和生物活性。
使用标准溶液可以确保实验结果的准确性和可重复性。
蔗糖标准溶液配制

蔗糖标准溶液配制必需设备:1.蔗糖2.A级移液管(分辨率至少为0.1ml)3.分析天平(±0.1mg)4.A级容量瓶(5000 ml)或等效容量瓶5. (4) A级瓶(用于移液)6.Alconox 清洁器或通用实验室玻璃器皿清洁器清洗所有玻璃器皿1.将玻璃器皿充水至1/2处并摇动冲洗。
2.将玻璃器皿充水至1/2处并倒入洗涤液。
3.用力摇动并冲洗3次。
4.倒置存放5000 ml容量瓶和(4)个瓶子以排放所有液体。
5.带盖存放所有其他玻璃器皿。
6.用试剂水冲洗3次移液管。
7. (3)A级量瓶(1000 ml)配制蔗糖标准溶液7.将清洁的称盘放在天平上。
8.将天平调到零点。
9. 重量=0.12g蔗糖。
10. 记录在表1的第1行上。
11. 将蔗糖倒入清洁的1000 ml容量瓶中。
12. 称量空盘并记录在表1的第2行上。
13. 给1000 ml容量瓶充入试剂水至1/2处以溶解蔗糖。
14. 给1000 ml容量瓶充入试剂水至1000 ml标记处(低于弯月面)。
15. 用421,069乘第3行(表1)并将结果填入表1的第4行上。
16. 给容量瓶贴上标签注明“xx.xxxppb C 蔗糖”:配制者的姓名及日期。
17.缓慢地搅拌蔗糖储备液以使溶液均匀化。
18.使用下列公式确定需要吸移多少储备液(将移液量记录在表1的第5行上)移液量(mL )= 10004500⨯⎪⎭⎫⎝⎛行第19.用移液管两次抽满蔗糖储备液并倒掉(最大限度地减少管尖浸入溶液中)。
20.按表1的第5行上的计算结果抽出确切量的蔗糖储备液。
21.全倒入清洁的1000ml 容量瓶中。
22.给容量瓶充入试剂水至1/2处并搅拌以使溶液均匀化。
23.给容量瓶充入试剂至1000 ml 标记处并缓慢搅拌以使全部溶液均匀化。
24.将容量瓶内的溶液转移到一个清洁干燥的5000ml 容量瓶中。
25.有力地搅拌(摇晃)5分钟。
26.将溶液转移到1000ml 容量瓶中或清洁干燥的可移瓶中。
蔗糖(欧洲药典方法)-整理稿

SUCROSESaccharurnDEFINITIONβ-D-Fructofuranosyl α-D-glucopyranoside. It contains no additives.CHARACTERSAppearance: white or almost white, crystalline powder, or shiny, colourless or white or almost white crystalsSolubility: very soluble in water, slightly soluble in alcohol, practically insoluble in ethanol IDENTIFICATIONFirst identification : A.Second identification : B, C.A. Infrared absorption spectrophotometry(2.2.24).Comparison : sucrose CRS.B. Thin-layer chromatography (2.2.27).Test solution. Dissolve 10 mg of the substance to be examined in a mixture of 2 volumes of water R and 3 volumes of methanol R and dilute to 20 ml with the same mixture of solvents.Reference solution (a). Dissolve 10 mg of sucrose CRS in a mixture of 2 volumes of water R and 3 volumes of methanol R and dilute to 20 ml with the same mixture of solvents。
蒽酮法测定可溶性糖方法[仅供参考]
![蒽酮法测定可溶性糖方法[仅供参考]](https://img.taocdn.com/s3/m/d594d35c7375a417876f8f16.png)
蒽酮法测定可溶性糖方法(一) 实验原理糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量。
糖类与蒽酮反应生成的有色物质在可见光区吸收峰为630 nm,故在此波长下进行比色。
(二)材料、仪器设备及设计1 材料12种源砂生槐叶片,2种处理,4个重复,共96个样。
2 仪器设备分光光度计,恒温水浴锅,20 ml刻度试管,5 ml和1 ml刻度吸管,5 ml和1 ml的移液枪,记号笔,吸水纸适量。
3 试剂(1)蒽酮乙酸乙酯试剂:取分析纯蒽酮1 g,溶于50 ml乙酸乙酯中,贮于棕色瓶中,在黑暗中可保存数周,如有结晶析出,可微热溶解。
(2)100 ug/L蔗糖溶液:1%蔗糖标准液:精确称取蔗糖1.000 g,加入少量水溶解,移入100 ml容量瓶,加0.5 ml 浓硫酸,定容至刻度线。
100 ug/L蔗糖溶液的配制:用移液枪精确吸取1%蔗糖标准液1 ml,加入到100 ml容量瓶,加蒸馏水定容。
(3)浓硫酸(比重1.84)(三)实验步骤1.标准曲线的制作:按表1加入标准的蔗糖溶液,然后按顺序向试管中加入0.5 ml蒽酮乙酸乙酯试剂和5 ml 浓硫酸,充分振荡,立即将试管放入沸水浴中,逐管准确保温1 min取出后自然冷却至室温,以空白作参比,在630 nm波长下测其光密度,以光密度为纵坐标,以糖含量为横坐标,绘制标准曲线,并求出标准线性方程。
管号试剂0 1,2 3,4 5,6 7,8 9,10100µg.1-1蔗糖0 0.2 0.4 0.6 0.8 1/ml水/ml 2 1.8 1.6 1.4 1.2 1 蔗糖量/µg 0 20 40 60 80 1002.取样取不同种源砂生槐幼苗,用蒸馏水冲洗干净,随后用吸水纸吸干水分。
将叶片切下,用锡箔纸包住,放入液氮中冷冻。
取完后将样品放入-80℃冰箱中保存。
无花果可溶性糖含量测定

无花果可溶性糖含量测定作者:苏云婷潘世会来源:《食品安全导刊》2024年第05期摘要:為了建立一个可靠且高效的测定方法,专门用于测量不同成熟度无花果中的可溶性糖含量,深入探索并精确改进蒽酮-硫酸比色法。
根据研究目的,针对性优化了显色时间、蔗糖标准液浓度与冷却比色时间,建立了可用于无花果果实可溶性糖含量测定的蒽酮-硫酸比色法。
实验结果显示,最佳显色时间为10 min,最佳蔗糖标准溶液浓度为100 μg·mL-1,最佳冷却比色时间为20 min。
回归方程y=0.005x+0.153 4(R2=0.998 2)。
通过检测不同成熟度的无花果,发现糖度变化趋势与可溶性糖含量变化趋势一致,可溶性糖含量可作为无花果产品质量控制指标。
关键词:无花果;可溶性糖;蒽酮-硫酸比色法Method for Determination of Soluble Sugar Content in FigSU Yunting1, PAN Shihui2*(1. Weihai Vocational College, Weihai 264200, China; 2. Shandong University, Weihai 264209, China)Abstract: In order to establish a reliable and efficient assay specifically for measuring the soluble sugar content in figs of different ripenesses, the anthone-sulfate colorimetric method was explored in depth and precisely improved. According to the purpose of the study, the color development time, the concentration of sucrose standard solution and the cooling colorimetric time were optimized, and an anthone-sulfate colorimetric method was established for the determination of soluble sugar content in fig fruit. The experimental results showed that the optimal color development time was 10 min, the optimal concentration of sucrose standard solution was 100μg·mL-1, and the optimal cooling colorimetric time was 20 min. The regression equationy=0.005x+0.153 4 (R2=0.998 2). By detecting figs with different ripeness, it was found that the change trend of sugar content was consistent with the change trend of soluble sugar content, and the soluble sugar content could be used as a quality control index for fig products.Keywords: fig; soluble sugar; anthrone-sulfuric acid colorimetry可溶性糖在水果和蔬菜中的重要性是显而易见的,主要由单糖和寡糖组成。
乳制品中乳糖和蔗糖的测定

乳制品中乳糖和蔗糖的测定糖类测定方法概述1、提取液制备(1)常用提取剂——水、乙醇(2)提取液中含糖量控制O.5~3.5mg∕mL(3)含脂肪食品先脱脂,然后用水提取(4)含淀粉及糊精食品(乙醇沉淀淀粉等)用70-75%乙醇溶液提取。
用高浓度乙醇的目的,降低酶的作用,避免糖被酶水解,还可以使淀粉和糊精沉淀。
(5)含乙醇及C02液态食品,蒸发至1∕3~1∕4原体积,以除去C2H5OH及C02o(6)酸性食品应先中和防止低聚糖部分水解。
(7)提取固体样品有时需要加热,以提高提取效果。
一般在40~50°C,防止多糖溶出。
(8)乙醇作提取剂加热时应安装回流装置2、提取液的澄清(1)影响测定的杂质色素、蛋白质、果胶、可溶性淀粉、有机酸、氨基酸、单宁,可影响颜色、浑浊、过滤困难。
(2)澄清剂①醋酸铅(中性)Pb(CH3C00)2∙3H20,形成沉淀,吸附杂质,可除去蛋白质、果胶、有机酸、单宁等。
②乙酸锌和亚铁氟化钾二者生成氟亚铁酸锌I吸附蛋白质等干扰物。
③硫酸铜和氢氧化钠Cu离子使蛋白质沉淀。
(3)澄清剂用量用量适宜,以无新沉淀为准,如2mL饱和醋酸铅(30%)。
(4)除铅剂由于铅影响还原糖的测定,生成铅糖化合物。
常用除铅剂有草酸钠、硫酸钠、磷酸氢二钠。
测定方法GB5009.8-2016食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定GB5413.5-2010婴幼儿食品和乳品中乳糖、蔗糖的测定两个标准中都是有两种方法:高效液相色谱法和莱茵一一埃农氏法适用范围GB5009.8-2016食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定第一法“高效液相色谱法”,本法适用于谷物类、乳制品、果蔬制品、蜂蜜、糖浆、饮料等食品中果糖、葡萄糖、蔗糖、麦芽糖和乳糖的测定。
第二法“酸水解-莱因-埃农氏法”,本法适用于食品中蔗糖的测定。
GB5413.5-2010婴幼儿食品和乳品中乳糖、蔗糖的测定适用于婴幼儿食品和乳品中乳糖、蔗糖的测定。
饮料中糖含量的测定

饮料中糖含量的测定测定总糖通常以还原糖的测定方法为基础,将食品中的非还原性双糖,经酸水解成还原性单糖,再按还原糖的测定法测定,测出以转化糖的总糖量。
若需要单纯测定食品中的蔗糖量,可分别测定样品水解前的还原糖量及水接后的还原糖量,两者的差再乘以校正系数0.95就是蔗糖量,即1g转化糖量相当于0.95g蔗糖量。
1.原理样品除去蛋白质后,加入稀盐酸,在加热条件下使蔗糖水解转化为还原糖,再以直接滴定法或高锰酸钾法测定。
还原糖测定原理是根据还原糖可以还原碱性酒石酸铜,生成氧化亚铜这一特性来决定的。
碱性酒石酸铜溶液时有甲乙液混合而成。
试剂甲为硫酸铜溶液,试剂乙为氢氧化钠与酒石酸钾钠的混合液。
甲乙两中溶液的混合液与还原糖作用,在加热滴定时产生红色氧化亚铜,滴定终点可以借助次甲基兰做指示剂。
次甲基兰在碱性溶液中(加热至沸腾)可被还原成无色。
2.仪器!)恒温水浴箱2)其他仪器同还原糖的测定3试剂1)6mol/L盐酸溶液2)甲基红指示剂:称取0.1g甲基红溶于100Ml60%(体积分数)乙醇中。
3)200g/L氢氧化钠溶液4)水解后的蔗糖标准溶液配制:(A)称取105度烘干至恒重的纯蔗糖1.0000g,用蒸馏水溶解,转移入500毫升容量瓶中,稀释至刻度,摇匀。
此标准液1毫升相当于纯蔗糖2mg.(B)吸取蔗糖标准液50毫升置于100毫升容量瓶中,加6mol/L5毫升在68---70度水浴中加热15min,冷去后加2滴甲基红指示剂,用200g/L的氢氧化钠中和至中性,加水至刻度,摇匀,此标准液1毫升相当于蔗糖1mg.5)碱性酒石酸铜甲液:称取15g硫酸铜及0.05g次甲基蓝,溶于水中并稀释至1000毫升6)碱性酒石酸铜乙液:称取50g酒石酸钾钠及75g氢氧化钠,溶于水中,再加入4g亚铁氰化钾,完全溶解后,用水稀释至1000毫升,贮存于橡胶塞玻璃瓶中。
7)乙酸锌溶液:称取乙酸锌结晶21.9g,加3毫升冰醋酸,加水溶解至100毫升8)106g/L亚铁氰化钾溶液4测定方法(1)样品处理(对于无蛋白质的饮料此处理步骤可以省略)吸取果汁饮料样品10毫升于250毫升容量瓶中,加少量水摇匀,摇匀后加入5毫升乙酸锌溶液,混匀后放置2min,再加入5毫升亚铁氰化钾溶液,震摇,加水定容并摇匀后静置30min,用干滤纸过滤,弃去初滤液,过滤液备用.(2)标定碱性酒石酸铜溶液:取经过水解的蔗糖标准液,按直接滴定法标定酒石酸铜溶液,具体步骤如下:吸取5.00毫升碱性酒石酸铜甲液及5.00毫升碱性酒石酸铜乙液,置于250毫升锥形瓶中。
【精品】食品中蔗糖测定方法

【关键字】精品食品中蔗糖的测定方法酶-比色法食品中蔗糖的测定方法,一般采用盐酸水解法。
由于盐酸水解蔗糖过程中,还有其他糖类被水解为还原糖,导致测定结果偏高。
本标准采用的酶-比色法是在检索了近20年148 篇国外文献的基础上,经过反复实验、验证而制定的。
由于酶法具有高度的专一性(β-果糖苷酶只能催化蔗糖转化为葡萄糖和果糖),灵敏度高,操作简便,因此测定结果准确。
蔗糖酶解后的产物-葡萄糖的测定方法,与GB/T 16285-96保持一致。
食品中蔗糖的测定方法GB/T 16286-96酶-比色法1 范围本标准规定了用酶-比色法测定食品中蔗糖的方法,适用于各类食品中蔗糖的测定。
本标准最低检出限量为0.04μg(蔗糖)/mL(试液)。
2 原理在β-果糖苷酶(β-FS)催化下,蔗糖被酶解为葡萄糖和果糖。
葡萄糖氧化酶(GOD)在有氧条件下,催化β-D-葡萄糖(葡萄糖水溶液状态)氧化,生成D -葡萄糖酸-δ-内酯和过氧化氢。
受过氧化物酶(POD)催化,过氧化氢与4 -氨基安替比林和苯酚生成红色醌亚胺。
在波长505nm处测定醌亚胺的吸光度,计算食品中蔗糖的含量。
β-FSC12H22O11 +H2O ────> C6H12O6(G) +C6H12O6(F)GODC6H12O6(G) +O2 ────> C6H10O6 +H2O2PODH2O2 +C6H5OH +C11H13N3O ────> C6H5NO +H2O3 试剂3.1 组合试剂盒1号瓶:内含β-果糖苷酶(fructosidase)400U(活力单位)、柠檬酸、柠檬酸三钠;2号瓶:内含0.2mol/L 磷酸盐缓冲液(pH=7.6) 200mL,其中含4 -氨基安替比林0. 00154mol/L;3号瓶:内含0.022mol/L苯酚溶液200mL;4号瓶:内含葡萄糖氧化酶(glucose oxidase)800U(活力单位)、过氧化物酶(辣根,peroxidase)2000U(活力单位)。
蔗糖的测定

0.1
0.2
0.4
0.6
0.8
0.9
蒸馏水(ml)
0.9
0.8
0.7
0.5
0.3
0.1
0
2N氢氧化钠(ml)
0.1
0.1
0.1
0.1
0.1
0.1
0.1
混合后100℃沸水浴中10min,冷却。再加入间苯二酚,Hcl。
间苯二酚(ml)
1
1
1
1
1
1
1
10N盐酸(ml)
3
3
3
3
3
3
3
蔗糖量
0
40
80
160
蔗糖含量(%)=(C×V/a×n)/(W×106)
式中C---标准方程求的蔗糖量(微克)。
a---吸取样品液体积(ml)
V---提取液(ml)
n---稀释倍数(ml)
W---重量(g)
240
320
360
混合后100℃沸水浴中10min,冷却。500nm下测定光密度。绘制标准曲线。
2样品的测定取0.9ml的样品,加入0.1ml 2N的氢氧化钠,混合后100℃沸水浴中10min,冷却。再加入1ml间苯二酚,3ml 10NHcl,混合后100℃沸水浴中10min,冷却。500nm下测定光密度。
蔗糖的测定
实验试剂:
1.间苯二酚:0.1g的间苯二酚用6N的盐酸溶解后定容到100ml.
2.10N的盐酸
3.2N的氢氧化钠
4.蔗糖标准溶液:0.1g溶解定容到100ml。
实验步骤:
1.标准曲线的制定:1mg/ml的蔗糖溶液稀释成0.4mg/ml蔗糖溶液。
试管号
甜度检测方法

甜度检测方法以蔗糖甜度作为标准,蔗糖的甜度为1(100%)。
一、比蔗糖甜的物质的甜度测定二、1、试剂和容器:三、蔗糖四、甜味剂样品五、蒸馏水六、 100ml容量瓶七、 10ml刻度移液管八、2、操作步骤:九、①对照样,10%蔗糖溶液十、配制方法:称取10g蔗糖,加蒸馏水稀释至100ml。
十一、②系列浓度实验样品的配制十二、配制方法:先称取样品1.0g加蒸馏水稀释至100ml即成1.0%的样品溶液。
分别量取1.0%样品溶液20ml、12.5ml、10.0ml、5ml、4ml、3.3ml、2.5ml到100ml容量瓶中,稀释至100 ml,其溶液浓度分别是0.2%、0.125%、0.1%、0.05%、0.04%、0.033%、0.025%。
十三、3、样品品尝比较:由至少5个人组成评定小组对样品进行品尝,判断系列浓度样品中哪一个与10%蔗糖溶液的甜度相同或相近,从而计算出样品的甜度。
公式如下:十四、十五、4、计算甜度=10%/样品浓度十六、十七、4、附:样品的甜度与浓度的关系:十八、吸取1%样品溶液量稀释后溶液浓度相当于蔗糖的甜度十九、 20ml 0.2% 50二十、 12.5 0.125% 80二十一、 10 0.1% 100二十二、 5 0.05% 200二十三、 4 0.04% 250二十四、 3.3 0.033% 300二十五、 2.5 0.025% 400二十六、无蔗糖甜的物质的甜度测定参照菊糖苷GB8270-1999中甜度的测定制定本方法。
1、称取蔗糖2g,加水100ml,制成2%的蔗糖溶液。
另称取被测物质,同样加100ml水溶解。
根据被测物质的情况,配制成不同浓度的溶液。
2、对比品尝两种溶液,当两种溶液甜度相当时就计算被测物质的甜度。
3、计算:n=2/W其中:W为被测物质的质量(g),n为被测物质的甜度。
标准糖溶液的配制

标准糖溶液的配制
配制标准糖溶液通常是指配制出特定浓度的蔗糖溶液,常用于实验中的比色法、折射法、极化仪校准等。
以下是一个常见的标准糖溶液配制方法:
1. 准备所需材料:蔗糖纯品、蒸馏水、电子天平、容量瓶、移液枪或滴管等。
2. 根据所需浓度,计算所需蔗糖的质量(以克为单位)。
例如,要配制20%蔗糖溶液,假设所需溶液总量为100毫升,则计算公式为:20/100 × 100 = 20 克。
3. 使用电子天平准确称取所需蔗糖的质量。
4. 取出一个干净的容量瓶,使用蒸馏水冲洗干净,并用蒸馏水漂洗一次标定,保持容量瓶的干净和干燥。
5. 使用移液枪或滴管将称取好的蔗糖放入容量瓶中。
6. 加入足够的蒸馏水,使液面接近容量瓶口。
7. 用塞子盖好容量瓶,轻轻摇晃瓶子使蔗糖充分溶解。
8. 最后,加入足够的蒸馏水,使液面恰好达到标定线。
9. 使用标准糖溶液前需要将其保存在避光、干燥和密封的容器中,避免糖溶液浓度变化。
需要注意的是,配制标准糖溶液时要特别注意蔗糖和蒸馏水的净化,以避免杂质的影响。
同时,准确称取蔗糖质量和保持容量瓶的干净、干燥也是配制成功的关键。
蔗糖的测定

3
3
3
3
3
3
蔗糖量
0
40
80
160
240
320
360
混合后100℃沸水浴中10min,冷却。500nm下测定光密度。绘制标准曲线。
2样品的测定取0.9ml的样品,加入0.1ml 2N的氢氧化钠,混合后100℃沸水浴中10min,冷却。再加入1ml间苯二酚,3ml 10NHcl,混合后100℃沸水浴中10min,冷却。500nm下测定光密度。
试管号
0
1
2
3
4
5
6
0.4mg/ml蔗糖溶液(ml)
0
0.1
0.2
0.4
0.6
0.8
0.9
蒸馏水(ml)
0.9
0.8
0.7
0.5
0.3
0.1
0
2N氢氧化钠(ml)
0.1
0.1
0.1
0.1
0.1
0.1
0.1
混合后100℃沸水浴中10min,冷却。再加入间苯二酚,Hcl。
间苯二酚(ml)
1
1
1
1
1
1
1
10N盐酸(ml)
样品的测定取09ml的样品加入01ml2n的氢氧化钠混合后100沸水浴中10min冷却
蔗糖的测定
实验试剂:
1.间苯二酚:0.1g的间苯二酚用6N的盐酸溶解后定容到100ml.
2.10N的盐酸
3.2N的氢氧化钠
4.蔗糖标准溶液:0.1g溶解定容到100ml。
实验步骤:
1.标准曲线的制定:1mg/ml的蔗糖溶液稀释成0.4mg/ml蔗糖溶液。
蔗糖含量(%)=(C×V/a×n)/(W×106)
蔗糖水解反应速度常数的测定

蔗糖水解反应速度常数的测定一、实验目的1、了解旋光仪的基本原理、掌握其正确的操作技术。
2、根据物质的光学性质研究蔗糖水解反应,测定其反应速率常数和半衰期。
二、基本原理1. 蔗糖的转化可看作一级反应蔗糖在H + 催化作用下水解为葡萄糖和果糖,反应方程式为:C 12H 22O 11 + H 2O −−→−+H C 6H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖此反应的反应速率与蔗糖的浓度、水的浓度以及催化剂H +的浓度有关。
但在反应过程中,由于水是大量的,可以认为水的浓度基本不变,且H + 是催化剂,其浓度也保持不变,故反应速率只与蔗糖的浓度有关,而反应速率与反应物浓度的一次方成正比的反应称为一级反应,所以蔗糖的转化反应视为一级反应。
(1) 反应速率公式和半衰期 r kc = (1)k —反应速率常数,为单位浓度时的反应速率, r —反应速率。
r 也可以写为r dc kc dt-== (2) t 反应时间,c 为时间 t 时蔗糖的浓度。
不定积分:ln c kt C =-+ (3)C 积分常数,当0=t 时,0ln C c =0c 蔗糖的起始浓度,代入上式可得定积分式cc t k 0ln 1= (4) 当反应进行一半所用的时间称为半衰期,用t 1/2表示,则2/1002/lnkt c c = (5) 解得 k k t 6932.02ln 2/1==(6)(2)一级反应有三个特点:① k 的数值与浓度无关,量纲:时间-1,常用单位1-s ,1min -等。
② 半衰期与反应物起始浓度无关。
③ 以c ln 对 t 作图应得一直线,斜率为k -,截距为C 。
由此可用作图法求得直线斜率,计算反应速度常数-=k 斜率。
2. 反应物质的旋光性蔗糖及其水解产物葡萄糖,果糖都含有不对称碳原子,它们都具有旋光性,即都能使透过他们的偏振光的振动面旋转一定的角度,此角度称为旋光度,以α表示。
蔗糖,葡萄糖能使偏振光的振动面按顺时针方向旋转,为右旋物质,旋光度为正值。
实验二植物组织水势的测定(小液流法)

② 如果小液滴在各对照溶液中全部下降,说明蔗糖溶液配制得浓度过低,应重新 配制。
3、如果某一支试管内多加入或少加入一个圆片,对结果有无影响?为什么?
对结果无影响。因为本实验想要获得的是与溶液渗透势与植物组织水势相等时
的溶液浓度,进而计算出植物组织水势。如果植物组织的水势低于外液的水势,组
织吸水、重量增大而使外液浓度变大,液滴下降;反之,则组织失水、重量降低而
五、注意事项
1、试管、移液管和毛细管等要洗净烘干,移液管与毛细移液管应从低浓度到高浓 度依次吸取溶液。
2、蔗糖溶液用前一定要摇匀,时间放久了的蔗糖溶液会分层,影响结果。
3、取材以及打取圆片的过程操作要迅速,以免植物材料失水
4、甲烯蓝不宜加得过多(溶液呈稍深的蓝色即可),否则将使实验组各管中溶液
的比重均加大。 5、释放蓝色液滴时要缓慢,防止过急挤压冲力影响液滴移动。
↓
↓
↓
↓
↑
↑
↑
↑
错误结果
溶液浓度 液滴移动 方向 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8
↓
↓
↓
↑
↓
↑
↑
↑
四、植物组织水势的计算
ψ 植物 =ψ S=﹣iCRT
式中 —ψ S溶液的渗透势,以MPa为单位;
R=0.008314MPa·L·mol﹣1·K﹣1 T—绝对温度,即273+t℃; C—溶液的摩尔浓度,以mol·kg-1 为单位 i-溶液的等渗系数,蔗糖=1。
据公式计算出溶液的渗透势,即为植物组织的水势。
二、实验步骤
1、配置蔗糖标准液
M 母液(ml) 0.1 1 0.2 2 0.3 3 0.4 4 0.5 5 0.6 6 0.7 7 0.8 8
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
15. 用421069乘第3行表1并将结果填入表1的第4行上。
16. 给容量瓶贴上标签注明“xx.xxxppb C 蔗糖”配制者的姓名及日期。 蔗糖的原始重量 g 2 无蔗糖时的盘重 g 3 蔗糖的重量第1行-第2行 g 4 蔗糖储备液中的TOC浓度 第3行×421069 μg/L 5 要转移的储备液的体积 mL 6 标准蔗糖溶液中的TOC浓度 μg/L 配制500ppb 标准蔗糖溶液
17缓慢地搅拌蔗糖储备液以使溶液均匀化。
18使用下列公式确定需要吸移多少储备液将移液量记录在表1的第5行上 移液量mL 10004500行第
19用移液管两次抽满蔗糖储备液并倒掉最大限度地减少管尖浸入溶液中。
20按表1的第5行上的计算结果抽出确切量的蔗糖储备液。
21全倒入清洁的1000ml容量瓶中。 22给容量瓶充入试剂水至1/2处并搅拌以使溶液均匀化。
23给容量瓶充入试剂至1000 ml标记处并缓慢搅拌以使全部溶液均匀化。
24将容量瓶内的溶液转移到一个清洁干燥的5000ml容量瓶中。 25有力地搅拌摇晃5分钟。
26将溶液转移到1000ml容量瓶中或清洁干燥的可移瓶中。 27用下列公式计算浓度将浓度记录在表1的第6行上。 TOCppb第4行结果 X 第5行 / 1000 28给溶液贴上标签注明“500ppb C或等当量蔗糖、批号、配制者的姓名和日期”。
9. 重量0.12g蔗糖。
10. 记录在表1的第1行上。
11. 将蔗糖倒入清洁的1000 ml容量瓶中。
12. 称量空盘并记录在表1的第2行上。
13. 给1000 ml容量瓶充入试剂水至1/2处以溶解蔗糖。
14. 给1000 ml容量瓶充入试剂水至1000 ml标记处低于弯月面。
2. 将玻璃器皿充水至1/2处并倒入洗涤液。
3. 用力摇动并冲洗以排放所有液体。
5. 带盖存放所有其他玻璃器皿。
6. 用试剂水冲洗3次移液管。
7. 3A级量瓶1000 ml 配制蔗糖标准溶液
7. 将清洁的称盘放在天平上。
8. 将天平调到零点。
蔗糖标准溶液配制
必需设备 1. 蔗糖 2. A级移液管分辨率至少为0.1ml 3. 分析天平±0.1mg 4. A级容量瓶5000 ml或等效容量瓶 5. 4 A级瓶用于移液 6. Alconox
清洁器或通用实验室玻璃器皿清洁器 清洗所有玻璃器皿
1. 将玻璃器皿充水至1/2处并摇动冲洗。
