CAR-T治疗恶性血液病至今临床数据解读
CAR-T细胞治疗难治或复发B细胞急性淋巴细胞白血病I期临床试验数据管理计划

数据管理计划Data Management Plan一项评估 **** CAR-T 治疗难治或复发B 细胞急性淋巴细胞白血病患者的 I期临床试验缩略语简表英文缩写英文全称中文含义AE Adverse EventCRA Clinical Research Associate临床监查员CRC Clinical Research Coordinator临床协调员CRF Case Report Form病例报告表DPL Data Project Leader数据经理DVP Data Validation Plan数据核查计划DMP Data Manager Plan数据管理计划DM Data Manager数据管理员EDC Electronic Data Capture 电子化数据采集系统GCP Good Clinical Practice药物临床试验质量管理规范PI Principal Investigator主要研究者PM Project Manager项目经理QC Quality Control质量控制SAE Serious Adverse Event严重不良事件SAP Statistical Analysis Plan统计分析计划SDV Source Data Verification原始数据核对SOP Standard Operation Procedure标准操作流程SAS Statistics Analysis System统计分析系统TBD To Be Determined时间不确定UAT User Acceptance Test用户验收测试URL Uniform Resource Locator统一资源定位符概述为使临床试验的数据管理过程有章可循、有据可依,从而能保证数据管理工作的正确性和及时性,在承接数据管理项目后,DPL首先会根据GCP相关原则和临床试验相关内容(包括研究方案、CRF、需要使用的资源、研究的时间表,同时还需考虑xx公司的一些特殊要求,如数据库结构、变量名称与格式)制定一份全面而详细的DMP。
恶性血管肿瘤的诊断及治疗

恶性血管肿瘤的诊断及治疗
张静菊;杨华
【期刊名称】《吉林大学学报(医学版)》
【年(卷),期】1999(025)006
【摘要】目的:探讨恶性血管肿瘤的诊断及治疗.方法:统计分析我院病理诊断比较少见和属多学科的恶性血管肿瘤59例.结果:其中血管外皮(肉)瘤20例,血管平滑肌肉瘤27例和血管肉瘤及其它肉瘤12例.发生肢体21例,头颈和躯干体表16例,口鼻、腹腔和泌尿系统等23例.所有病例均被误诊,有15例误诊为其它恶性肿瘤.复发1~4次者19例.除1例仅作活检外,其余病例均手术治疗.结论:恶性血管肿瘤主要靠病理诊断;手术是主要治疗手段;放射治疗对预防复发有重要作用,并可做为切除不彻底或切除后复发的首选治疗.
【总页数】2页(P744-745)
【作者】张静菊;杨华
【作者单位】第三临床学院,血管外科,长春,130031;第三临床学院,病理科,长春,130031
【正文语种】中文
【中图分类】R73
【相关文献】
1.恶性肿瘤抗凝治疗后肝素诱导血小板减少症的诊断与治疗进展 [J], 马军
2.恶性肿瘤相关物质联合检测在恶性肿瘤诊断和治疗中的应用 [J], 加尔肯古丽;沙
吾来提
3.恶性血液病患者接受CAR-T细胞治疗后相关并发症的诊断及治疗研究进展 [J], 陈丹
4.恶性肿瘤相关物质联合检测在恶性肿瘤诊断和治疗的价值 [J], 伍尤华
5.胸腔镜治疗恶性胸腔积液诊断治疗体会 [J], 苗国强;王宏伟;李学锋;纽乐
因版权原因,仅展示原文概要,查看原文内容请购买。
cart细胞疗法

cart细胞疗法标题:探索细胞疗法在疾病治疗中的应用——以CAR-T细胞疗法为例引言:细胞疗法作为一种新兴的治疗方法,已经在医学领域引起了极大的关注。
其中,CAR-T细胞疗法是一种基于改良的T细胞疗法,通过改造患者自身的T细胞,使其具备更强的抗肿瘤能力。
本文将重点探讨CAR-T 细胞疗法的原理、治疗效果以及其在疾病治疗中的前景。
一、CAR-T细胞疗法的原理及流程(500字)CAR-T细胞疗法全名为嵌合抗原受体T细胞疗法(Chimaeric Antigen Receptor-T cell),主要通过工程改造T细胞,使其能够更好地与肿瘤细胞产生特异性的抗原识别,进而杀伤肿瘤细胞。
该疗法的核心技术是将人工构建的CAR基因导入到T细胞中,经过扩增和激活后再输回患者体内。
具体来说,CAR基因通常由以下三个部分构成:抗原识别区、共刺激分子和激活区域。
抗原识别区通常由单链抗体(scFv)构成,能够特异性识别肿瘤细胞表面的抗原。
共刺激分子通常是CD28或CD137,能够增强T细胞的活性和持久性。
激活区域通常是CD3ζ,能够能够激活T细胞并引发细胞毒性效应。
通过这种方式,CAR-T细胞能够识别并杀伤带有特定抗原的肿瘤细胞。
CAR-T细胞疗法的治疗流程包括以下几个主要步骤:首先,从患者体内提取T细胞,并通过采血或者淋巴细胞分离技术获取目标细胞。
其次,在实验室中将CAR基因导入T细胞中,并进行基因转导和扩增,以形成大量的改良T细胞。
最后,将改良后的T细胞再次输回患者体内,使其能够识别和攻击肿瘤细胞。
二、CAR-T细胞疗法的治疗效果(600字)CAR-T细胞疗法作为一种激进的治疗方法,具有很大的潜力。
截至目前,CAR-T细胞疗法已经在多种恶性肿瘤治疗上取得了较好的疗效。
以急性淋巴细胞白血病(ALL)为例,CAR-T细胞疗法被证明对患者具有显著的治疗效果。
一项在美国进行的临床试验显示,使用一种名为CD19 CAR-T的治疗方法,可以使80%的儿童ALL患者达到完全缓解状态。
CAR-T治疗
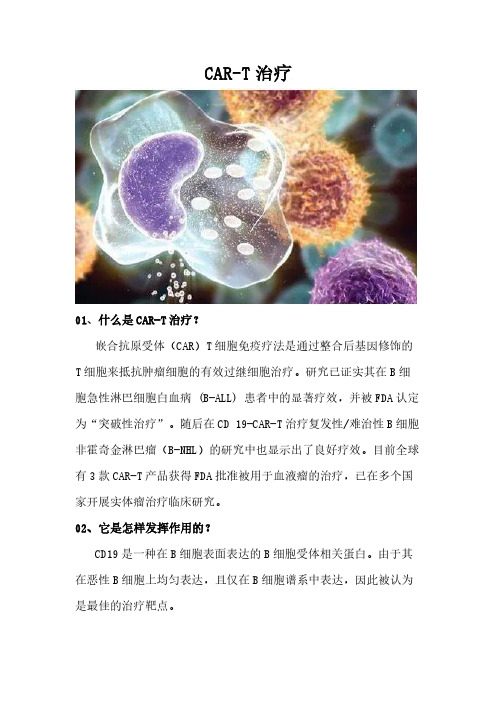
CAR-T治疗01、什么是CAR-T治疗?嵌合抗原受体(CAR)T细胞免疫疗法是通过整合后基因修饰的T细胞来抵抗肿瘤细胞的有效过继细胞治疗。
研究已证实其在B细胞急性淋巴细胞白血病 (B-ALL) 患者中的显著疗效,并被FDA认定为“突破性治疗”。
随后在CD 19-CAR-T治疗复发性/难治性B细胞非霍奇金淋巴瘤(B-NHL)的研究中也显示出了良好疗效。
目前全球有3款CAR-T产品获得FDA批准被用于血液瘤的治疗,已在多个国家开展实体瘤治疗临床研究。
02、它是怎样发挥作用的?CD19是一种在B细胞表面表达的B细胞受体相关蛋白。
由于其在恶性B细胞上均匀表达,且仅在B细胞谱系中表达,因此被认为是最佳的治疗靶点。
抗CD19CAR是一种重组分子,由三部分组成:源自抗CD19单克隆抗体的单链可变区(scFv)、跨膜区、T细胞受体(TCR)的信号转导区(CD3ζ)。
为了改善CAR-T细胞扩增能力,进一步增强杀伤力和精准度,CAR的结构也在逐渐完善中,目前进展到第四代CAR的探索阶段。
正常T细胞与抗原呈递细胞(APC)(如树突状细胞)相互作用,通过T细胞受体(TCR)和其他共刺激结构域被激活(a)。
TCR 介导的抗原识别依赖于主要组织相容性复合体(MHC)分子上的多肽。
然而,CAR-T可以通过抗原识别结构域识别靶抗原,并且不依赖于MHC(b)。
当CAR-T识别特异性抗原时,细胞通过细胞内信号转导结构域被激活,发挥靶细胞毒性。
(i) 通过白细胞单采采集患者的单核细胞(ii) T细胞被分离、激活和扩增(iii) 使用逆转录病毒或慢病毒载体将CAR基因转染至T细胞中(iv)细胞克隆扩增(v) 将新创的CAR-T细胞产品输注到已接受淋巴细胞耗竭化疗的患者体内03CAR-T治疗会带来哪些风险?一旦T细胞被激活,他们的细胞毒性可能会导致副作用:(i) 靶向肿瘤毒性:即使在CAR-T细胞通过其在肿瘤组织上表达的靶点特异性激活的最佳情况下也会导致毒性。
CAR-T治疗恶性血液病至今临床数据解读

迄今为止靶向CD19的CAR-T治疗恶性血液病临床试验结果解读摘要靶向CD19的嵌合抗原受体(CAR)T细胞在治疗B细胞恶性肿瘤患者取得令人瞩目的成果。
尽管这CAR修饰的T细胞靶向相同的抗原,其CAR分子设计不同,并且临床研究的关键环节已被研究。
目前还不清楚这些差异是否会对临床结果和治疗相关毒性产生影响。
在此,我们根据CAR分子设计和制备的不同,回顾了靶向CD19的CAR-T细胞在治疗B细胞恶性肿瘤患者的临床研究结果,比较这些研究之间的内在局限性并进行概述。
引言嵌合抗体受体修饰的自体T细胞在治疗难治性B细胞恶性肿瘤获得了较高的缓解率。
CAR是由胞外单链可变区(scFv)抗体衍生物构成的重组受体,与胞内T细胞受体信号域连接,使T细胞独立于HLA 对肿瘤具有特异性。
幼稚T细胞的增殖与分化,需要两种特异性抗原肽的相互作用:MHC与T细胞受体结合(第1信号)以及T细胞表面共刺激受体与靶细胞或特定的抗原呈递细胞相应配体相互作用的共刺激信号。
已经有数代CAR被开发并进行了临床试验研究。
第一代CAR为连接在T细胞受体/CD3复合体的CD3ζ内切域的靶向特异性scFv。
第一代CAR-T细胞表现出有限的扩增性和持久性,以及有限的抗肿瘤效应,第二代CAR加入了共刺激分子(如CD28、4-1BB)以提供第二信号,第三代CAR则是串联多个共刺激域。
不同机构构建的靶向CD19的CAR-T细胞在治疗儿童和成人复发B细胞急性淋巴细胞白血病(B-ALL),慢性淋巴细胞白血病(CLL),和B细胞非霍奇金淋巴瘤(B-NHL)表现出稳定高效的抗肿瘤效力。
各机构产品在CAR的设计、T细胞活化与转导方法以及细胞剂量上有所不同(表1)。
此外,异质患者群体CAR-T细胞注射剂量,淋巴细胞删除性化疗方案。
在本综述中,我们侧重于一些CD19-CAR-T治疗恶性血液疾病成熟和初步的临床研究,注重临床结果,相关毒性和体内T细胞的持久性,并根据治疗方案的差异对观察到的结果进行分析。
临床应用中的血液病治疗新方向

临床应用中的血液病治疗新方向血液病治疗在临床应用中面临着不断的挑战和变革。
近年来,随着医学科技的不断发展和突破,一些新的治疗方向和方法逐渐应用于血液病的治疗中,为患者带来了新的希望和机会。
本文将探讨血液病治疗中的新方向,并介绍相应的治疗方法和研究进展。
一、免疫治疗免疫治疗作为一种新的治疗血液病的方法,受到了广泛的关注。
其中,CAR-T细胞疗法是最为常见和有效的一种免疫治疗方法。
该疗法通过采集患者自身的T细胞,经过基因改造后,使其具有能够识别和攻击肿瘤细胞的能力,然后再将这些改造后的T细胞重新注入患者体内,从而达到治疗血液病的目的。
CAR-T细胞疗法已在某些特定类型的血液病治疗中取得了显著的疗效,为一些疑难病例提供了新的治疗选择。
二、基因治疗基因治疗是一种通过改变患者基因表达或基因功能来治疗血液病的方法。
近年来,基因编辑技术的突破,如CRISPR-Cas9系统,使得基因治疗成为可能。
通过这种技术,可以直接干预患者的基因序列,修复或替换有缺陷的基因,在基因水平上达到治疗血液病的目的。
基因治疗在某些遗传性血液病或基因突变相关的血液病治疗中显示出了潜在的治疗效果,为患者提供了新的治疗希望。
三、靶向治疗靶向治疗是指通过抑制或干扰血液病细胞中特定的信号通路或靶点,从而抑制肿瘤细胞生长和扩散的治疗方法。
近年来,针对血液病细胞特定的突变或异常表达的靶向药物已经得到开发并应用于临床。
例如,一些酪氨酸激酶抑制剂可以有效治疗一些特定类型的白血病,靶向治疗进一步提高了血液病治疗的精准性和个体化水平,为个体患者提供了更加有效的治疗方案。
四、免疫检查点抑制剂免疫检查点抑制剂是一类通过抑制免疫抑制信号通路,增强机体对于肿瘤细胞的免疫应答能力的药物。
血液病中的某些类型,如霍奇金淋巴瘤和黑色素瘤等,对免疫检查点抑制剂具有较好的治疗响应。
这一新的治疗方向为这些类型的血液病患者带来了新的治疗机会,延长了患者的生存时间。
综上所述,血液病治疗新方向的不断涌现为患者带来了新的希望和机遇。
CAR-T疗法介绍、发展历程及细胞免疫治疗中存在的问题与挑战

CRA_T129万元治疗案例

CRA_T129万元治疗案例
说到CAR-T细胞疗法的疗效,就不得不提到一个案例,那就是全球首个接受CAR-T疗法的Emily Whitehead。
xx年,年仅5岁的Emily被诊断出患有B细胞急性淋巴性白血病,由于病情复发且
十分凶险,便接受了CAR-T细胞免疫疗法。
令人惊喜的是,CAR-T 疗法起了作用。
就在今年,Emily迎来了她无癌生存九年的纪念日,她也成为这一史诗级疗法的代言人而被载入史册。
而在国内,xx注射液上市后,也为众多患者带来了福音。
今年,一名57岁患有弥漫大B淋巴瘤的患者在xx附属第一医院接受了靶向CD19自体CAR-T产品治疗,成为中国首例使用这一产品的获益患者,并在治疗后顺利出院。
xxx医院也传出了一则好消息,罹患弥漫性B大细胞淋巴瘤多年的xx,成为了CAR-T药品获批后,全国首位接受CAR-T药品回输治疗后被评估症状完全缓解的患者。
在遭遇复发且多种治疗方式已经不适用于她的情况下,她选择了CAR-T细胞治疗法。
结果振奋人心,接受了治疗的xx在检查后,发现体内暂时没有癌细胞,症状完全得到了缓解,并于8月26日出院回家。
xx 的痊愈出院,为其他即将接受治疗或是还在观望期的患者增强了信心。
CAR-T细胞功能精确识别或优化未来癌症治疗(等2则)

7快乐养生 2019.12治疗胃酸竟有可能造成过敏CAR-T细胞功能精确识别或优化未来癌症治疗国际医学期刊The Journal of Experimental Medicine官网近日发表关于“首次直观观察到细胞抵御血液癌症的过程”的文章,称来自巴斯德研究所等机构的科学家们通过研究鉴别出了嵌合抗原受体T细胞(CAR-T细胞)的精确功能,或能优化未来癌症的治疗手段。
CAR-T细胞是B细胞恶性肿瘤的潜在治疗策略,基于对患者自身的T淋巴细胞进行修饰来使其能够识别肿瘤细胞所表达的CD19靶点分子,从而有效清除癌细胞。
临床试验证实该方法非常有效,因此这种疗法常常用来治疗成年和儿童血液癌症患者;但其中有些患者的癌症会复发。
该项研究中,研究人员阐明了CAR-T细胞的精细化工作机制,以改善疗法的有效性。
该项研究利用活体成像技术,追踪了抗CD19 CAR-T细胞与B细胞淋巴瘤小鼠之间的相互作用。
循环靶细胞被困在肺部的CAR-T细胞中,减少了它们对淋巴器官的接触。
在骨髓中,CAR-T细胞在25分钟内参与、杀死肿瘤细胞并脱离靶细胞。
值得注意的是,并不是所有的CAR-T细胞接触都能在与肿瘤相互作用时杀伤肿瘤细胞,从而揭示了功能异质性的广泛存在。
研究结果表明,CAR-T细胞在体内相互作用的结果中存在着一种以前未被认识到的多样性水平,具有重要的临床意义。
通过识别能够发挥作用的CAR-T细胞的优缺点,或许能帮助开发新型策略以利用CAR-T细胞的活性有效治疗癌症患者。
很多人都经历过胃酸、胃胀,通常大家会吃点胃药应付过去。
但你可曾想过,随便吃下的胃药有可能带来其他风险。
最新的一项研究表明,胃药虽然可以靶向治疗胃部不适,但这些药物可能诱发严重的副作用,例如过敏。
研究人员通过分析奥地利800万人的健康保险数据发现,很多人在服用质子泵抑制剂与H 2阻滞剂后,抗过敏药物处方药的服用量激增。
质子泵抑制剂是一种重要的抑制胃酸分泌药物。
而H 2阻滞剂主要用于治疗胃溃疡与十二指肠溃疡。
【深度好文】天价car-t疗法,预示着癌症有望被彻底攻克

【深度好文】天价CAR-T疗法,预示着癌症有望被彻底攻克?提醒:今日胖熊推送一篇深度好文,内容有点长,有点烧脑,但干货满满,居家旅行、闲来无事必看良品!↓↓↓手术、放疗、化疗是目前肿瘤治疗的三大常规方法,它们都对肿瘤治疗做出了巨大的贡献,而且目前也取得了很大的进步,但不可否认的是它们都会对人体正常组织造成一定的损伤,而术后并发症和放化疗副反应也是广大肿瘤患者不得不面对的现实问题。
肿瘤免疫治疗是近年来医学领域最具前景的研究方向之一,不同于传统的肿瘤治疗,免疫疗法的作用对象是免疫细胞,主要靠激发人体免疫系统,动员免疫细胞发挥抗肿瘤作用,因此它在靶向肿瘤细胞的同时极少损伤正常组织,在恶性肿瘤治疗方面取得了一系列突破性成果而得到了广泛的关注。
2013年,全球顶尖的《科学》杂志评出肿瘤治疗方面的十大科技突破,其中免疫治疗高居榜首,而CAR-T细胞治疗作为目前过继性细胞免疫治疗的杰出代表在血液系统等恶性肿瘤的治疗中取得了令人振奋的临床疗效,更是成为目前肿瘤免疫治疗的研究热点。
2017年,被称为“CAR-T代言人”的美国宾夕法尼亚大学的Carl June教授获授也因此荣获了本年度美国临床肿瘤学会(ASCO)最重要的Karnofsky大奖。
杨涛,医学博士,重庆市肿瘤医院/重庆大学附属肿瘤医院血液肿瘤中心副主任医师。
华西医科大学博士毕业,师从于国内外著名的肿瘤免疫治疗专家,国家973计划首席科学家,中国科学院魏于全院士。
从事肿瘤内科临床工作近20年,曾受国家卫生部选派为肿瘤学专家执行援外医疗任务两年,擅长淋巴瘤、骨髓瘤、肺癌、结直肠癌等血液系统肿瘤及常见实体瘤的化疗、细胞免疫治疗及分子靶向治疗等。
主持和参研国家自科、重庆市科委、重庆市卫计委等国家级及省厅级科研课题多项。
主编医学专著3部,在SCI、CSCD及国家核心期刊上发表医学论文20余篇。
T细胞是人体抗肿瘤免疫的主力军CAR-T,全称Chimeric Antigen ReceptorT-Cell Immunotherapy,即嵌合抗原受体的T细胞免疫治疗。
CAR-T细胞的作用机制及其在B淋巴细胞肿瘤治疗中的研究进展

CAR-T细胞的作用机制及其在B淋巴细胞肿瘤治疗中的研究进展李晓清;杜新;刘焕勋;陈伟红;古庆利;胡春宏【期刊名称】《标记免疫分析与临床》【年(卷),期】2018(025)006【摘要】嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)用于恶性肿瘤靶向治疗,在近几年已得到了飞速发展.经过基因改造的CAR-T细胞兼具CD19抗体基因和T细胞受体基因,可以特异性识别血液恶性肿瘤中B细胞所表达的特异性抗原CD19.将其回输给患者用以进行恶性肿瘤的治疗时,在CD19抗原刺激下,CAR-T细胞能够持续增殖活化,起到杀伤肿瘤细胞的作用,但此种治疗方式也有引起多种不良反应的风险.本文就上述问题及其在B淋巴细胞肿瘤的临床治疗作用进行初步综述.【总页数】3页(P918-920)【作者】李晓清;杜新;刘焕勋;陈伟红;古庆利;胡春宏【作者单位】深圳市第二人民医院肿瘤内科,广东深圳518000;深圳市第二人民医院肿瘤内科,广东深圳518000;深圳市第二人民医院肿瘤内科,广东深圳518000;深圳市第二人民医院肿瘤内科,广东深圳518000;深圳市第二人民医院肿瘤内科,广东深圳518000;中南大学附属湘雅二医院肿瘤内科,湖南长沙410000【正文语种】中文【相关文献】1.CAR-T细胞的作用机制及其在B淋巴细胞血液恶性肿瘤治疗中的研究进展 [J], 张天生;郑小丽;祝芳;姬新颖2.CAR-T细胞治疗在血液肿瘤中的研究进展与问题 [J], 何爱丽;王夏曼3.DEAD-box RNA解旋酶41在髓系肿瘤中的作用机制的研究进展——骨髓增生异常综合征/急性髓系淋巴细胞白血病 [J], 马俊霞4.肿瘤过继性细胞免疫治疗中CAR-T及TCR-T疗法研究进展 [J], 张青青;许莲蓉5.B淋巴细胞瘤-xL蛋白及其在肿瘤耐药中作用机制的研究进展 [J], 杨伟锋;李晓宁;李军岐;许书君;王菁婧;张晨静因版权原因,仅展示原文概要,查看原文内容请购买。
急性髓系白血病CAR-T治疗的靶点选择

急性髓系白血病CAR-T治疗的靶点选择
邵若男;辛红蕾;施小凤
【期刊名称】《中国实验血液学杂志》
【年(卷),期】2024(32)3
【摘要】嵌合抗原受体(CAR)T细胞疗法将抗原抗体的靶向识别与T细胞的杀伤作用相结合,已成为最有应用前景的肿瘤治疗方法之一。
在淋巴系肿瘤中,CAR-T显示出了强大的治疗效果,并已陆续在临床中得到应用。
然而,在急性髓系白血病的治疗中尚未发现如淋巴系肿瘤中CD19一样有效且特异的靶点,因此,尝试多种靶点,并且使用优化策略,以增强疗效、减轻毒性,是目前主要的研究方向。
本文介绍了近年来CAR-T治疗急性髓系白血病靶点的最新研究进展,分析了目前亟待解决的相关问题,并总结了研究中提到的优化构建策略,希望能为相关研究的进行以及产品的临床应用提供参考。
【总页数】5页(P965-969)
【作者】邵若男;辛红蕾;施小凤
【作者单位】南京医科大学第二附属医院血液科
【正文语种】中文
【中图分类】R733.71
【相关文献】
1.CAR-T细胞治疗在急性髓系白血病中的研究和应用进展
2.《中国肿瘤临床》文章推荐:CAR-T细胞治疗在急性髓系白血病中的研究和应用进展
3.CAR-T治疗急性
髓系白血病的研究进展4.《中国肿瘤临床》文章推荐:CAR-T细胞治疗在急性髓系白血病中的研究和应用进展5.CAR-T疗法治疗急性髓系白血病的相关靶点研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
CAR-T细胞的研究进展

CAR-T细胞的研究进展[摘要]嵌合抗原受体T(CAR-T)细胞治疗被认为是治疗复发或难治性肿瘤,特别是血液系统恶性肿瘤的有效方法。
尽管最初批准的抗CD19 CAR-T疗法取得了令人印象深刻的结果,但也经历了高复发率和耐药性等挫折,促使人们需要发现更有效的工程CAR-T细胞用于治疗。
CAR-T细胞在结构和制造方面的创新导致了疗效和持久性的显著改善,特别是随着第四代CAR-T细胞的发展。
与免疫调节剂配对,第四代和下一代CAR-T细胞的使用将不会因为细胞毒效应而受到限制,将成为克服肿瘤微环境的有效工具。
本文综述了CAR-T细胞结构在胞外区、跨膜区和胞内区的最新变化,结合创新的制造技术和改进的细胞来源,展望了CAR-T细胞治疗的未来发展前景。
[关键词]CAR-T细胞疗法;恶性血液病;免疫治疗随着临床试验的扩大,检查点抑制疗法已经显示出在短期内逆转复发患者CAR-T细胞耗竭的能力,并通过诱导释放转基因免疫修饰物来塑造肿瘤环境。
基于这些原理的CAR-T细胞疗法被称为第四代CAR-T细胞疗法[1]。
此外,除了免疫调节剂外,T细胞结合体和一些膜受体也与第二代CAR-T细胞转导,通常被称为下一代CAR-T细胞。
这些CAR-T细胞不受T细胞毒性的限制,是输注后重建免疫系统的强大工具。
作为到目前为止最受期待的进展,第四代和下一代CAR-T细胞被分为两类,利用分泌分子的细胞和利用膜受体的细胞。
到目前为止,修饰细胞内域的创新方法一直是几代人CAR-T细胞革命性变化的主要驱动力。
仅含有CD3 ITAM片段的第一代CAR-T细胞因缺乏持久性和增殖能力而过时。
第二代抗CD19 CAR-T细胞在B细胞ALL和NHL患者中显示出强大的抗肿瘤效果,并被配方为含有一个刺激表位的内域,如CD28或4-1BB[2]。
探索共刺激结构域潜力的研究正在进行中,新的共刺激结构域,如ICOS和CD27,已经在临床前实验中显示出在消除肿瘤细胞方面的有效性[3]。
CAR—T的免疫治疗最新研究进展及前景展望

CAR—T的免疫治疗最新研究进展及前景展望作者:崔馨予来源:《中国科技纵横》2017年第23期摘要:免疫治疗一直以来是人们研究的热点。
随着基因重组技术的不断发展以及人们对肿瘤发病机制的深入认识,嵌合抗原受体T细胞(CAR-T)免疫疗法得以在临床试验研究中开展。
理论上,CAR-T免疫疗法可以特异性、靶向性地杀伤肿瘤细胞,同时为个体化肿瘤免疫治疗提供无限可能,前景乐观。
目前此疗法已经可以有效治疗急性髓系白血病,急性淋巴细胞白血病及黑色素瘤等一系列高发病症,但同时也伴随着发生细胞因子风暴等风险。
尽管CAR-T细胞治疗过程中会出现多种不良反应,但它仍被认为是肿瘤治疗中最有前景的技术之一,同时也被认为有更广阔的应用前景和令人振奋的临床疗效。
关键词:CAR-T;免疫治疗;白血病;黑色素瘤;细胞因子释放综合征中图分类号:R730.5 文献标识码:A 文章编号:1671-2064(2017)23-0180-021 CAR-T介绍众所周知,癌症三大传统治疗方法——手术、放疗、化疗,近半世纪来已有大幅进步,但令人遗憾的是这些治疗方法并不令人非常满意,近年来的死亡率并无明显下降,所以癌症的免疫治疗又再次引起人们的重视。
这种新被人们开发的CAR-T技术,即嵌合抗原受体T细胞免疫疗法。
这种免疫疗法是通过将外源性人工设计的CAR基因导入T细胞内进行基因修饰改造后得到表达有CAR的T细胞,然后将这些细胞在体外规模化扩增后再回输给患者进行治疗的方法。
[1]2 CAR-T技术免疫治疗应用范围急性髓系白血病:急性髓系白血病(AML)是一种血液系统的恶性肿瘤,以克隆性增殖异常分化的恶性细胞浸润骨髓、血液及其他组织为特点[2,3]。
髓系白血病中存在一群具有自我更新分化能力的白血病细胞LSCs,其以CD123为特点[4]。
CD123是一种糖蛋白,可以与CD131组成高亲和力的IL-13受体,一旦其与IL-13结合,便可促进细胞的增殖及存活。
深度完整版:CAR-T的现状和未来讲解
深度完整版:CAR-T的现状和未来作者:CytoCares/刘海燕来源:CytoCares/刘海燕2015-5-25 9:31:24下载生物谷资讯App关键词:CAR-T癌症免疫细胞治疗CAR-T(T细胞嵌合抗原受体)作为一种免疫细胞治疗方案,在全球范围内吸引了包括学者、医生、患者、投资人的大量关注。
然而CAR-T具体是什么,它的背后有什么样的故事、目前的研究状况如何,未来又将走向何方呢?CAR-T带来的新曙光自古以来,人们不断地与癌症进行斗争。
科学家们考古发现的木乃伊是死于癌症,敬爱的周总理死于癌症,报纸杂志中风光无限的水果总裁死于癌症,电视剧中美丽的女主角患上了癌症,或许你也听闻某位长辈过世的原因是罹患了癌症,甚至被告知前几天春晚上那个活泼可爱的小男孩还那么小竟然也患有癌症。
于是惊讶和慌乱一起袭来,我们拼劲全力想要进行反击,一轮轮的手术、放疗、化疗却仍然抵挡不住它一波又一波的猛烈攻势,无奈的发现终究道高一尺魔高一丈~当艾米丽?怀特黑德(Emily Whitehead)还活着的消息传来,人们看到了这场战争的曙光。
这个小姑娘5岁就被诊断出癌症,6岁接受了免疫治疗,自7岁生日当天醒来。
之后的两年仍然身体健康,可以跟家里的小狗滚作一团,可以上学,可以学钢琴,可以像其他孩子一样体验生命的美好。
小艾米丽接受的是一种疯狂的、之前从未用于儿童身上的试验性疗法:抽取6岁的小艾米丽的血液,在其中提取她的白细胞,利用改良的艾滋病毒对这些白细胞进行改造,教会它们识别肿瘤细胞并进行杀伤。
改造后的白细胞又重新输回小姑娘的体内。
经历了噩梦般的连续高烧后,小艾米丽挣脱了死神的束缚重新醒了过来,医生和科学家们的疯狂试验成功了。
CAR的出现使人们在对抗癌症这一隐性又无处不在的恶魔的战争中,找到了扭转战局的契机。
将嵌合抗原受体(CAR)导入T细胞中从而产生肿瘤特异的T细胞。
一旦T细胞表达这种受体,便可用单个融合分子与抗原进行特异性结合并激活T细胞。
car-t 案例

car-t 案例
CAR-T细胞疗法作为一种革命性的肿瘤治疗方法,近年来在全球范围内备受关注。
它的出现为癌症患者带来了新的生机,尤其在一些血液肿瘤方面取得了显著的疗效。
CAR-T细胞疗法的治疗原理是通过提取患者自身的T细胞,在体外对其进行基因改造,使其能够识别和攻击癌细胞。
改造后的T细胞具有更强的增殖和杀伤能力,回输患者体内后,可以有效地消灭癌细胞,达到治疗目的。
在CAR-T细胞疗法的应用案例中,最为著名的当属美国女孩艾米莉。
她曾患有复发难治性急性淋巴细胞白血病,在多次化疗失败后,接受了CAR-T细胞疗法。
令人惊喜的是,治疗后她的病情得到了显著改善,成为全球第一个通过CAR-T细胞疗法治愈白血病的患者。
CAR-T细胞疗法的发展前景非常广阔,未来有望成为癌症治疗的主流方向。
目前,全球已有多个国家开展CAR-T细胞疗法的研究,并在多种癌症类型上取得了积极的疗效。
我国在CAR-T细胞疗法的研究也取得了举世瞩目的成果,多个自主研发的CAR-T细胞疗法已经进入临床试验阶段,有望在不久的将来为国内患者带来更好的治疗选择。
总之,CAR-T细胞疗法为癌症患者带来了希望,但仍然面临一定的局限性和挑战,如治疗费用高、副作用较大等。
car-t研发药效学评估指标

car-t研发药效学评估指标CAR-T细胞疗法是一种革命性的癌症治疗方法,它利用改造的T细胞来攻击癌细胞。
然而,为了确保CAR-T疗法的疗效和安全性,研发者需要准确评估CAR-T细胞治疗的药效学指标。
本文将为您介绍CAR-T研发中常用的药效学评估指标。
一、CAR-T细胞的表达和持续时间CAR-T细胞疗法通过将CAR(嵌合抗原受体)基因导入T细胞,使其产生特异性抗肿瘤效应。
因此,评估CAR-T细胞的表达水平和在体内的寿命对药效学至关重要。
研究人员常常使用流式细胞术等技术来检测CAR-T细胞的表达情况,并通过动物实验和临床试验来评估CAR-T细胞的寿命。
二、肿瘤细胞减少和消退时间CAR-T疗法的主要目标是通过攻击肿瘤细胞来实现肿瘤的减少和消退。
因此,评估CAR-T细胞疗法在消退肿瘤方面的药效学指标是必要的。
常用的方法包括肿瘤体积的测量、活检样本的分析以及影像学技术(如MRI和CT扫描)的应用。
这些指标可以帮助研究人员了解CAR-T细胞在不同时间点对肿瘤的影响。
三、生存期延长除了消退肿瘤之外,CAR-T细胞疗法还被用作肿瘤治疗的长期方案。
因此,评估CAR-T细胞疗法对患者生存期的延长也是非常重要的药效学指标。
在临床试验中,研究人员通常会记录患者的生存率和无进展生存期。
这些数据有助于评估CAR-T细胞疗法是否能够显著提高患者的生存期。
四、副作用的发生和管理虽然CAR-T细胞疗法具有巨大的潜力,但同样也伴随着一系列的副作用。
因此,准确评估和管理CAR-T细胞治疗过程中的副作用也是很重要的。
其中,常见的副作用包括细胞因子释放综合征(CRS)和神经毒性。
研究人员需要评估这些副作用的严重程度和持续时间,并寻找合适的管理措施,以确保患者的安全。
结论CAR-T研发药效学评估指标的准确性和全面性对于推动CAR-T细胞疗法的发展非常重要。
通过评估CAR-T细胞的表达和持续时间、肿瘤细胞减少和消退时间、生存期延长以及副作用的发生和管理,研究人员可以更好地了解CAR-T细胞疗法的疗效和安全性。
肿瘤免疫治疗的新方法CAR-T 细胞治疗
肿瘤免疫治疗的新方法CAR-T 细胞治疗秦皇岛市第四医院病理科康文喜康瑶满迪随着肿瘤免疫学理论和技术的开展,肿瘤免疫治疗近年来取得了长足的进步。
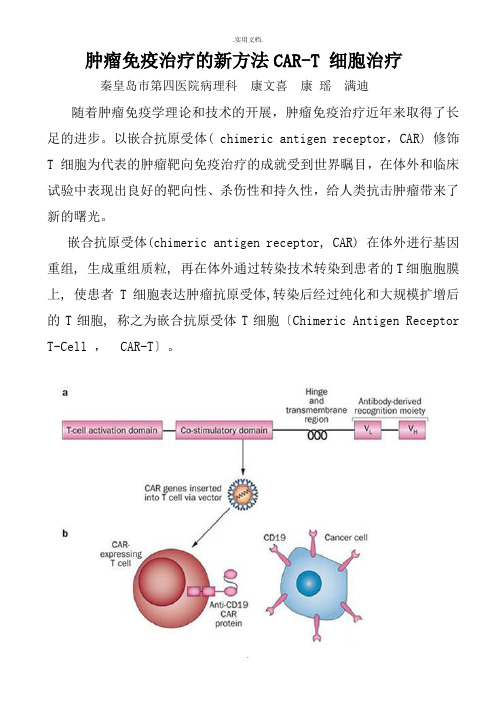
以嵌合抗原受体( chimeric antigen receptor,CAR) 修饰T 细胞为代表的肿瘤靶向免疫治疗的成就受到世界瞩目,在体外和临床试验中表现出良好的靶向性、杀伤性和持久性,给人类抗击肿瘤带来了新的曙光。
嵌合抗原受体(chimeric antigen receptor, CAR) 在体外进行基因重组, 生成重组质粒, 再在体外通过转染技术转染到患者的T细胞胞膜上, 使患者T细胞表达肿瘤抗原受体,转染后经过纯化和大规模扩增后的T细胞, 称之为嵌合抗原受体T细胞〔Chimeric Antigen Receptor T-Cell , CAR-T〕。
1989年Grooss等首次提出CAR-T细胞这一概念,多年来科学家经过不断的深入研究,CAR-T细胞技术已经研制出三代。
第一代CAR 由识别肿瘤外表抗原的单链抗体和免疫受体酪氨酸活化基序〔ITAM〕组成。
然而,ITAM 发出的激活信号只能引起 T 细胞短暂的分裂和较低水平的细胞因子分泌,不能提供长时间的多克隆扩增和持续的体内抗肿瘤效应。
给患者输注第一代 CAR-T细胞2天后, CAR-T细胞在体内可大量繁殖, 但1个月后迅速下降至难以检测的水平, 也没有观察到对肿瘤的免疫应答反响。
虽然对第一代CAR-T细胞的研究较多, 但是大多数试验在细胞扩增、体内存活时间、细胞因子分泌等方面还存在很多问题, 没有到达预期的临床效果。
研究说明, T细胞的完全活化有赖于双信号和细胞因子的作用。
其中第一信号为特异性信号, 由 TCR识别抗原递呈细胞外表的抗原肽-MHC 复合物所启动;第二信号为协同刺激信号, 通过CD28/B7等重要的共刺激分子, 促进IL-2合成, 并使T细胞充分活化及免于凋亡。
对于初始型T细胞(未与抗原接触的T细胞), 如果只有信号1而没有信号2, T 细胞就不能发挥正常作用;即使T细胞与抗原接触, 假设没有协同刺激信号, 细胞也不能发挥正常功能。
2018年CAR-T细胞免疫疗法分析报告

2018年CAR-T细胞免疫疗法分析报告2018年5月目录一、CAR-T细胞免疫疗法简介 (6)1、治疗原理及特点 (6)2、较传统疗法优势显著 (7)3、两个产品上市开创新纪元 (8)4、市场空间测算 (12)(1)儿童急性淋巴细胞白血病 (12)(2)漫性大B细胞淋巴瘤 (13)(3)其他血液肿瘤 (13)(4)实体瘤 (14)(5)医保支付 (14)二、国内外研发动态 (14)1、CAR-T国际三巨头 (14)(1)诺华和Kite Pharma首屈一指 (15)(2)Juno牵手Celgene重整旗鼓 (15)2、未来的发展方向:新靶点、新适应症 (16)3、国内发展逐渐步入正轨 (17)(1)第一阶段-全面放开、秩序混乱(2016年以前) (17)(2)第二阶段-紧急叫停、举步维艰(2016年) (18)(3)第三阶段-有序放开、步入正轨(2017年至今) (18)4、中国位列第一梯队,热门靶点竞争激烈 (19)5、多个产品临床申请获得受理,3个纳入优先审评 (21)三、上市公司研究进展 (23)1、南京传奇生物/金斯瑞:避开热门靶点,率先获批临床 (23)2、北京马力喏/银河生物:首个申请获得受理、唯一纳入优先审评的CD19CAR-T (25)3、科济生物/佐力药业:主攻实体瘤,GPC3-CAR-T获优先审评 (26)4、博生吉安科/安科生物:临床数据优异,专注工艺和产业化 (28)5、复星凯特/复星医药:技术和资本强强联合,助Yescarta早日登陆中国 . 30CAR-T是目前肿瘤治疗领域最具颠覆潜力的新兴技术之一,在需求、技术、资金、政策的推动下有望加速商业化进程,面对上百家从事CAR-T研发的企业,建议从进度、靶点和适应症以及产业化程度三个方面来选择优秀的公司。
首先是进度领先的公司,最早上市的产品可占有抢占市场的先发优势。
做产品引进的企业复星凯特(复星医药),致力于Yescarta 在中国的技术落地和商业化生产,预计Yescarta 将成为国内第一个上市的细胞治疗产品;以及获得临床批件的南京传奇生物(金斯瑞),和已获得优先审评的北京马力喏(银河生物)、科济生物(佐力药业)。
car-t研发药效学评估指标 -回复

car-t研发药效学评估指标-回复"Cart研发药效学评估指标" 是关于基于CAR-T细胞治疗技术研发的药效学评估指标的主题。
CAR-T细胞疗法是一种新兴的免疫疗法,已被证明在某些癌症治疗中具有显著的疗效。
本文将逐步回答有关CAR-T细胞疗法药效学评估指标的问题。
第1步:介绍CAR-T细胞疗法首先,我们需要了解CAR-T细胞疗法的基本原理和工作机制。
CAR-T细胞疗法是通过基因工程将T细胞改造成能够靶向攻击癌细胞的人工受体CAR(chimeric antigen receptor),从而增强患者自身免疫系统对癌症的应对能力。
在CAR-T细胞疗法中,患者的T细胞被提取出来,并经过基因改造后重新注入患者体内,从而产生能够识别并消灭癌细胞的CAR-T 细胞。
第2步:药效学评估的重要性药效学评估是新药研发中至关重要的一环。
在CAR-T细胞疗法中,药效学评估的主要目标是判断治疗效果和安全性。
对于CAR-T细胞疗法而言,治疗效果的评估主要关注肿瘤负荷的减少或完全缓解,以及患者生存期的延长。
此外,药效学评估还需要确定治疗期间的患者体内CAR-T细胞活性的持续时间,以及对非靶向细胞的毒性。
第3步:CAR-T细胞疗法的评估指标在CAR-T细胞疗法的药效学评估中,有一些重要的指标和参数需要被考虑。
这些指标包括但不限于:1. 免疫细胞活力:衡量CAR-T细胞的活性和功能,可以通过测定细胞增殖、产生细胞因子、杀伤肿瘤细胞等参数来评估。
2. 细胞存留时间:衡量CAR-T细胞在患者体内的存在时间,通常通过采用标记技术和分析方法来确定。
3. 肿瘤负荷减少程度:通过影像学检查和生物学标志物测定,例如肿瘤大小、代谢水平等来评估。
4. 患者生存期:通过对患者的生存期进行统计和分析,了解CAR-T细胞疗法对患者生存的影响。
5. 不良反应和毒性:主要关注治疗过程中可能出现的不良反应和严重毒性,例如细胞因子释放综合征、神经毒性等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
迄今为止靶向CD19的CAR-T治疗恶性血液病临床试验结果解读摘要靶向CD19的嵌合抗原受体(CAR)T细胞在治疗B细胞恶性肿瘤患者取得令人瞩目的成果。
尽管这CAR修饰的T细胞靶向相同的抗原,其CAR分子设计不同,并且临床研究的关键环节已被研究。
目前还不清楚这些差异是否会对临床结果和治疗相关毒性产生影响。
在此,我们根据CAR分子设计和制备的不同,回顾了靶向CD19的CAR-T细胞在治疗B 细胞恶性肿瘤患者的临床研究结果,比较这些研究之间的内在局限性并进行概述。
引言嵌合抗体受体修饰的自体T细胞在治疗难治性B细胞恶性肿瘤获得了较高的缓解率。
CAR是由胞外单链可变区(scFv)抗体衍生物构成的重组受体,与胞内T细胞受体信号域连接,使T细胞独立于HLA对肿瘤具有特异性。
幼稚T细胞的增殖与分化,需要两种特异性抗原肽的相互作用:MHC与T细胞受体结合(第1信号)以及T细胞表面共刺激受体与靶细胞或特定的抗原呈递细胞相应配体相互作用的共刺激信号。
已经有数代CAR被开发并进行了临床试验研究。
第一代CAR为连接在T细胞受体/CD3复合体的CD3ζ内切域的靶向特异性scFv。
第一代CAR-T细胞表现出有限的扩增性和持久性,以及有限的抗肿瘤效应,第二代CAR加入了共刺激分子(如CD28、4-1BB)以提供第二信号,第三代CAR则是串联多个共刺激域。
不同机构构建的靶向CD19的CAR-T细胞在治疗儿童和成人复发B细胞急性淋巴细胞白血病(B-ALL),慢性淋巴细胞白血病(CLL),和B细胞非霍奇金淋巴瘤(B-NHL)表现出稳定高效的抗肿瘤效力。
各机构产品在CAR的设计、T细胞活化与转导方法以及细胞剂量上有所不同(表1)。
此外,异质患者群体CAR-T细胞注射剂量,淋巴细胞删除性化疗方案。
在本综述中,我们侧重于一些CD19-CAR-T治疗恶性血液疾病成熟和初步的临床研究,注重临床结果,相关毒性和体内T细胞的持久性,并根据治疗方案的差异对观察到的结果进行分析。
CD19-CAR-T在治疗B细胞恶性血液肿瘤中临床疗效CD19-CAR-T产品特点,淋巴细胞删除性化疗以及相关的临床结果总结与表1.靶向CD19 CAR-T细胞治疗成人B-ALL纪念斯隆-凯特琳癌症中心(MSKCC)和费雷德记癌症研究中心(FHCRC)公布的CD19-CAR-T治疗成人复发性B-ALL研究数据最多。
MSKCC团队在美国血液学会(ASH)公布了他们利用CD28共刺激域(19-28ζ)CAR治疗46例成人患者阶段性成果。
患者高风险特点包括≥3次的一线治疗(n=26),接受过异基因造血干细胞移植(alloHSCT,n=18)以及费城染色体阳性(n=14)。
T细胞输注前,25例患者具有形态学的疾病负荷(骨髓原始细胞≥5%或髓外浸润),21例患者有微小残留(骨髓原始细胞<5%),45例可评估患者中有37例达到或维持形态学完全缓解(CR),36例可评估患者中有30例经流式细胞检测微小残留为阴性(MRD-)。
完全缓解率没有对年龄、疾病负荷、一线治疗次数以及异基因造血干细胞移植等因素进行分类。
37例CR患者中13例曾接受异基因造血干细胞移植,但接受异基因造血干细胞移植和没有接受造血干细胞移植的患者6个月总生存期(OS)没有差异(分别为79%和80%)。
6个月OS患者保持MRD-占80%。
18例患者在随访期内复发,其中3例患者检测不到CD19的表达。
在ASH会议上FHCRC的研究人员公布了CD19-CAR-T治疗29例成人患者I期临床试验的最新研究结果。
与MSKCC的主要差异在4-1BB共刺激域(vs CD28)以及CD4+与CD8+细胞单独单独培养并按1:1的比例进行输注。
这个小组近期公布的前期临床研究表明,定义了T细胞组成的CD19-CAR-T产品,最有效的经转导的T细胞亚群(即CD4+细胞分泌的细胞因子更多,尤其幼稚CD4+ CAR-T细胞可极强促进具有中央记忆表型的CD8+CAR-T 细胞的抗肿瘤效应),总剂量更低单个患者间剂量更均一,并且可能产生增效作用。
10例患者曾接受过异基因造血干细胞移植,CAR-T输注前骨髓原始细胞比例中位数为17%(范围:0~97%)。
可评估的12例患者接受环磷酰胺(Cy)淋巴细胞删除性化疗有10例患者获得骨髓缓解,10例患者中7例复发(中位复发时间66天)。
5例患者经CAR-T细胞再处理无应答。
研究人员推测更强的淋巴细胞删除性化疗可增强T细胞的持久性,后续的患者采用氟达拉滨(Flu)25mg/m2 x3天和环磷酰胺60mg/kg的方案。
所有接受Cy/Flu的患者都获得骨髓CR,并且接受Cy/Flu方案的患者无疾病生存期比接受Cy单药方案的患者长。
输注后获得/维持CR的患者MRD状态尚未确定。
CD19-CAR-T治疗儿童B-ALL费城儿童医院(CHOP)/宾夕法尼亚大学(UPenn)研究者对含4-1BB共刺激分子靶向CD19的CAR-T(CTL019)治疗25例儿童复发B-ALL进行详细的报道。
12%患者为第一次复发,88%患者复发次数≥2次,72%患者曾接受过异基因造血干细胞移植。
白细胞采集术后,患者接受主治医师的临时治疗。
最新结果显示在CTL019输注前62%患者具有形态学疾病负荷,38%患者有微小残留。
6例初次复发的患者中有3例通过流式细胞术检测不到CD19的表达,CTL019细胞持续存在。
2015年ASH年会上研究人员对CTL019治疗53例儿童/青壮年复发难治B-ALL患者最新结果进行报告(表1)。
41例可检测的B-ALL,12例患者MRD-。
53例患者有50例获得/维持形态学CR,50例可评估患者通过流式细胞术检测有45例患者MRD-。
20例输注CTL019复发的患者中,13例原始细胞CD19阴性。
根据西雅图儿童医院的初步报告,使用含4-1BB共刺激域(JCAR017)有利于提高复发难治性B-ALL的完全缓解率,尽管成熟的研究数据尚未被报道(NCT02028455)。
美国国立癌症研究所(NCI)的研究者进行了20例CD19-CAR-T治疗儿童复发性B-ALL 的安全性和有效性进行了研究。
与CHOP相反,65%患者之前没有进行异基因造血干细胞移植。
20例患者中有14例获得/维持CR,14例中12例MSD-。
这12例患者中有10例随后进行了异基因造血干细胞移植,除了这10个人其他都未进行造血干细胞移植。
CD19-CAR-T 输注后不足6个月有4例患者复发,2例在输注后获得MRD+的完全缓解,2例在输注后获得MRD-的完全缓解,但未接受异基因造血干细胞移植。
研究者对复发患者再次进行CAR-T 输注(第一次输注后2-2.5个月),没有出现客观应答。
CD19 CAR-T治疗CLL和B-NHL尽管首次探讨CD9-CAR-T治疗CLL和B-NHL患者,并且缺乏成熟数据报告。
Upenn 的研究者使用CTL019治疗40例复发难治性CLL患者。
他们以摘要的形式报告了II期临床剂量优化研究,26例复发难治性CLL患者在淋巴细胞删除性化疗后随机接受5x107 (n=13) vs. 5x108 (n=13) CTL019。
高风险包括P53/17p染色体异常(n=10)以及依鲁替尼耐药(n=2)。
23例患者中有9例获得客观应答,包括5例获得CR,在这些CR患者中MRD状态未报道,剂量与应答关系并不明显。
3例患者在获得响应后疾病进展,表现出CD19阴性侵袭性淋巴瘤(n=2)或CTL019丢失(n=1)。
最近,研究人员发表了一份详细的CTL019探索性治疗14例成人复发性CLL的后续报告。
患者前期治疗次数中位数为5,6例患者有染色体缺失。
14例患者有8例出现明显的客观反映,4例患者在CTL019输注后获得CR,获得CR的患者在3个月后进行免疫球蛋白重链深度测序分析得出MRD为阴性。
所有获得PR患者在治疗后5-13个月出现复发,获得CR的患者未出现复发,中位数为40个月(范围:21~53个月)。
NCI的研究中使用CD19-CAR-T治疗8例患有复发性CLL和B-NHL的患者。
除了淋巴细胞删除性化疗,患者在细胞输注后接受IL-2治疗直至毒性消除。
响应持续了7-18个月,1例获得CR的CLL患者发生B细胞再生障碍。
该小组随后使用低剂量CAR-T细胞对15例化疗难治性DLBCL和其他惰性B-NHL进行治疗,并且不使用IL-2。
7例可评估的难治性DLBCL患者有4例获得CR,其中3例获得持久应答(9-22+个月),3例CLL患者通过流式细胞术对骨髓进行检测,评价为获得持久性CR(14~23+个月)在2015ASH年会上,UPenn和FHCRC的研究者展示了CD19-CAR-T细胞治疗成人复发难治性B-NHL的初步成果。
UPenn报告了38例成人复发难治性B-NHL患者在淋巴细胞删除性化疗后使用CTL019。
24例患者接受了CTL019方案的规定使用剂量,22例可评估患者中有15例产生了客观应答,包括7/13的DLBCL和7/7的滤泡性淋巴瘤(FL),获得CR 的比例尚不清楚。
在FHCRC的试验中,CD4+和CD8+细胞以1:1的比例扩增与输注,这与他们在B-ALL中的研究相似。
FHCRC报告中28例B-NHL患者中有16例曾接受造血干细胞移植(自体13例,异体3例)。
12例基于环磷酰胺淋巴细胞删除性化疗的患者大部分CAR-T 细胞持续性短,与FHCRC在成人ALL中的研究经验相似,观察到了鼠源CAR转导的毒性T淋巴细胞介导的应答反应。
12例患者中有6例观察到客观应答反应(CR 1例[DLBCL],PR 5例),5例患者再次治疗未出现进一步的临床反应。
同样,在随后的16例患者中淋巴细胞删除性化疗增加使用氟达拉滨,观察到客观反映率为67%,(CR 42%),8例DLBCL有6例产生客观应答(CR 3例),3例FL有2例获得CR。
额外6例复发难治性CLL患者,在输注4周后通过流式细胞术检测有5例患者外周血和骨髓的原始细胞得到完全清除。
MSKCC的研究者还报道了复发难治性PET阳性和/或骨髓浸润B-NHL患者,在进行大剂量化疗和自体造血干细胞移植后接受5x106-1x107 19-28z CAR-T细胞/kg剂量的CAR-T挽救性治疗。
截至2015年ASCO年会,11例入组患者有6例获得CR,其中4例仍在持续CR (13~21+个月)CD19-CAR-T细胞毒性所有的CD19-CAR-T试验都报道了治疗相关性毒性反应,特别是CRS,神经毒性和B 细胞发育不全,虽然观察到的毒性严重程度不相同。
CRS是在CAR-T输注后数小时到数天内发生的全身炎症反应综合征,其特征为促炎性细胞因子的增高和T细胞的活化与扩增,临床症状包括发烧,肌痛,乏力,在严重情况下,出现与毛细血管渗漏综合征相关的缺氧,低血压,偶发的肾功能不全以及凝血功能障碍。
