烯烃的结构 PPT
合集下载
有机化学课件-6烯烃
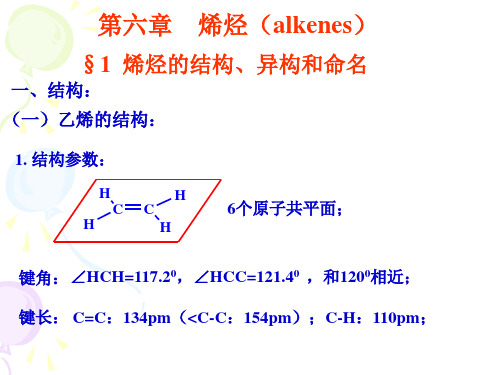
三、烯烃的命名(CCS系统命名法): (一)命名原则:
1. 主链选择:含碳碳双键(官能团)在内的最长碳链作为主链;
如:CH3CH2CH2CH2C=CH2 (√) CH2CH2CH(3 没有把碳碳双键都包含在内)
2-丙基-1-己烯 或2-丙基己烯(官能团处于1位时可省略去位次)
2. 主链编号:使碳碳双键处于尽量小的编号;
2×7 +2 - 8
,C7H8 ,Ω=
=4; 三个C=C和一个环
2
CH3CH2OH ,C2H6O ,Ω=
O
CH3C NH2,C2H5ON ,Ω=
2×2 +2 - 6
=0
2 2×2 +2 - 5 +1
=1
2
二、烯烃的同分异构: (一)构造异构:
如分子式为 C4H8 的烯烃的构造异构体有: CH3 CH3CH2CH=CH2 ,CH3CH=CHCH3 ,CH3C=CH2
CH3 CH
CH3
CH2CH3
C H
(E)-2,3-二甲基-3-己烯
和顺反命名法相比较,顺式的可能是Z构型的,也可能是E构型;
§2 烯烃的相对稳定性
一、燃烧热:
燃烧热kJ/mol
稳定性
例: CH3CH2CH=CH2
2718
H3C
CH3
CC
2711
HH
H3C
H
CC
2708
H
CH3
高
烯烃中碳碳双键上的烷基越多,稳定性越高;
6 CH3 如:CH3CH2CH=CHCH2CHCHCH3
1 2 3 4 5 CH37 8
6,7-二甲基-3-辛烯
3. 标明双键的位次;只写双键两个碳原子中位次较小的一个,放
《烯烃炔烃》课件

详细描述
炔烃可以被酸性高锰酸钾 溶液、重铬酸钾溶液等氧 化剂氧化,生成酮、羧酸 或二氧化碳等物质。
举例
乙炔在酸性高锰酸钾溶液 中氧化得到二氧化碳和锰 离子。
炔烃的聚合反应
总结词
炔烃可以发生聚合反应, 生成高分子化合物。
详细描述
在催化剂的作用下,炔烃 可以发生聚合反应,生成 高分子链,如合成橡胶、 合成纤维等。
总结词
烯烃的氧化反应是指烯烃在一定条件下被氧化生成更复杂的有机物。
详细描述
烯烃的氧化反应可以通过多种方式进行,如空气氧化、臭氧氧化、过氧化氢氧 化等。在氧化过程中,烯烃的碳碳双键被氧化成羧基或酮基等含氧官能团,生 成相应的醛、酮、酸等化合物。
烯烃的聚合反应
总结词
烯烃的聚合反应是指多个烯烃分子相互结合形成高分 子化合物的过程。
《烯烃炔烃》ppt课件
目 录
• 烯烃炔烃的简介 • 烯烃的性质 • 炔烃的性质 • 烯烃与炔烃的鉴别 • 烯烃炔烃的应用 • 烯烃炔烃的未来发展
01
烯烃炔烃的简介
烯烃的定义与结构
烯烃的定义
烯烃是一种不饱和烃,其分子中 含有碳碳双键。
烯烃的结构
烯烃的分子结构由一个碳碳双键 和两个碳氢单键组成。
炔烃的定义与结构
炔烃的应用前景展望
炔烃作为一种重要的有机化合物,在合成高 分子材料、药物、农药等领域具有广泛的应 用前景。未来,炔烃有望在生物医用材料、 环保型农药等领域发挥重要作用,为解决人 类社会面临的资源、能源和环境问题提供新 的解决方案。
THANKS
感谢观看
烯烃炔烃在许多化学反应中用作反应剂和催 化剂,如烷基化反应、聚合反应等。
在生物医学领域中作为药 物和生物活性分子
烯烃、炔烃(烯烃的结构分类及加成反应)(课堂PPT)

2-丙醇
41
烯烃与水的加成也遵守马氏规律,因此 由丙烯水合只能得到异丙醇,而不能制备 正丙醇。 应用:由石油裂化气中的低级烯烃丙烯制 备2-丙醇。
42
方法:烯烃的水合,由于化工厂硫酸腐蚀性 强,一般用磷酸催化,烯烃纯度大于95%。
⑤与硫酸加成 烯烃能和硫酸加成,生成 可以溶于硫酸的烷基硫酸氢酯。
45
应用:注意实际生产中,不是先制备次氯 酸,而是将烯烃和氯气同时通入水中。
⑦硼氢化反应
C C +1/2B2H6
CC
H BH2 与不对称的烯烃反应时,硼原子加到含氢较多的碳原子上。
CH3 CH3 CH2 +H BH2
C H 3 C H 2 C 2 B H H 2
46
小结:
1.烯烃的命名 2.烯烃的加成反应
33
烯烃与氯、溴等很容易加成,例如, 将乙烯或丙烯通入溴的四氯化碳溶液中, 由于生成无色的二溴代烷而使溴的红棕色 退去。
C H 3 C H C H 2 +B r 2 C H 3C H C H 2 B r B r
应用:溴水或是溴的四氯化碳溶液都是鉴别 不饱和键常用的试剂。
34
③与卤化氢HX加成(亲电加成) H+首先加到碳—碳双键中的一个碳原
18
例:给下列各化合物命名
3-丙基-2-庚烯
19
2)顺–反命名法 由于双键不能自由旋转,且双键两端
碳原子连接的四个原子处于同一平面上, 因此,当双键的两个碳原子各连接不同的 原子或基团时,就有可能生成两种不同的 异构体。(相同的基团在同侧的为“顺”)
H3C CH2
CH3
CC
顺-2-戊烯
H
H
相同的两个基团
1个C-Cπ键
41
烯烃与水的加成也遵守马氏规律,因此 由丙烯水合只能得到异丙醇,而不能制备 正丙醇。 应用:由石油裂化气中的低级烯烃丙烯制 备2-丙醇。
42
方法:烯烃的水合,由于化工厂硫酸腐蚀性 强,一般用磷酸催化,烯烃纯度大于95%。
⑤与硫酸加成 烯烃能和硫酸加成,生成 可以溶于硫酸的烷基硫酸氢酯。
45
应用:注意实际生产中,不是先制备次氯 酸,而是将烯烃和氯气同时通入水中。
⑦硼氢化反应
C C +1/2B2H6
CC
H BH2 与不对称的烯烃反应时,硼原子加到含氢较多的碳原子上。
CH3 CH3 CH2 +H BH2
C H 3 C H 2 C 2 B H H 2
46
小结:
1.烯烃的命名 2.烯烃的加成反应
33
烯烃与氯、溴等很容易加成,例如, 将乙烯或丙烯通入溴的四氯化碳溶液中, 由于生成无色的二溴代烷而使溴的红棕色 退去。
C H 3 C H C H 2 +B r 2 C H 3C H C H 2 B r B r
应用:溴水或是溴的四氯化碳溶液都是鉴别 不饱和键常用的试剂。
34
③与卤化氢HX加成(亲电加成) H+首先加到碳—碳双键中的一个碳原
18
例:给下列各化合物命名
3-丙基-2-庚烯
19
2)顺–反命名法 由于双键不能自由旋转,且双键两端
碳原子连接的四个原子处于同一平面上, 因此,当双键的两个碳原子各连接不同的 原子或基团时,就有可能生成两种不同的 异构体。(相同的基团在同侧的为“顺”)
H3C CH2
CH3
CC
顺-2-戊烯
H
H
相同的两个基团
1个C-Cπ键
烯烃的结构与性质及命名++课件++2024-2025学年高二化学人教版(2019)选择性必修3

第二章《烃》
第二节 烯 烃、炔 烃
第一课时 烯 烃的结构、性质及命名
学习目标: 1.结合代表物,认识烯烃的组成和结构特点。 2.了解烯烃物理性质的变化规律,掌握烯烃的化学性质及应用。 3.了解烯烃的结构特征和顺反异构
自然界里存在许多烯烃,如番茄中的番茄红 素、鲨鱼油中的角鲨烯都是烯烃。
乙烯是常见的烯烃
因烯烃中C%(85.7%)较大,燃烧时火焰明亮且伴有黑烟C。H4
C2H4
烯烃能使酸性高锰酸钾溶液 褪色 。
可利用酸性KMnO4溶液鉴别乙烯与甲烷等饱和气态烷烃 但不可用于除去CH4中的C2H4
拓展1:烯烃被酸性高锰酸钾溶液氧化的产物规律
烯烃中双键被
CH2=
RCH=
氧化的部分 (双键C上2个H) (双键C上1个H)
-6.3 30 63.3 93.6
相对密度 0.566 0.5193 0.5951 0.6405 0.6731 0.6970
2、烯烃的性质
(1)烯烃的物理性质 :随着分子中碳原子数的递增,呈现规律性的变化。 颜色:__无__色____ 所有的烃都难溶与水且密度比水小! 溶解性:均难溶于水,易溶于有机溶剂
两个双键连在同一个碳上
共轭二烯烃 C=C-C=C-C 稳 定
两个双键被一个单键隔开
孤立二烯烃 C=C-C-C=C 性质同单烯烃
两个双键被两个或 两个以上单键隔开
c) 1,3-丁二烯与溴发生加成反应
请类比乙烯/丙烯加成反应书写下列物质的加成反应方程式
➢ CH2=CH-CH=CH2与足量溴水的加成反应
物理性质
密度:随C数目的增加而增大;但相对密度都小于1 熔沸点:一般随碳数增加而升高;同碳数时,支链越
多熔沸点越低 (主要由分子间作用力决定!)
第二节 烯 烃、炔 烃
第一课时 烯 烃的结构、性质及命名
学习目标: 1.结合代表物,认识烯烃的组成和结构特点。 2.了解烯烃物理性质的变化规律,掌握烯烃的化学性质及应用。 3.了解烯烃的结构特征和顺反异构
自然界里存在许多烯烃,如番茄中的番茄红 素、鲨鱼油中的角鲨烯都是烯烃。
乙烯是常见的烯烃
因烯烃中C%(85.7%)较大,燃烧时火焰明亮且伴有黑烟C。H4
C2H4
烯烃能使酸性高锰酸钾溶液 褪色 。
可利用酸性KMnO4溶液鉴别乙烯与甲烷等饱和气态烷烃 但不可用于除去CH4中的C2H4
拓展1:烯烃被酸性高锰酸钾溶液氧化的产物规律
烯烃中双键被
CH2=
RCH=
氧化的部分 (双键C上2个H) (双键C上1个H)
-6.3 30 63.3 93.6
相对密度 0.566 0.5193 0.5951 0.6405 0.6731 0.6970
2、烯烃的性质
(1)烯烃的物理性质 :随着分子中碳原子数的递增,呈现规律性的变化。 颜色:__无__色____ 所有的烃都难溶与水且密度比水小! 溶解性:均难溶于水,易溶于有机溶剂
两个双键连在同一个碳上
共轭二烯烃 C=C-C=C-C 稳 定
两个双键被一个单键隔开
孤立二烯烃 C=C-C-C=C 性质同单烯烃
两个双键被两个或 两个以上单键隔开
c) 1,3-丁二烯与溴发生加成反应
请类比乙烯/丙烯加成反应书写下列物质的加成反应方程式
➢ CH2=CH-CH=CH2与足量溴水的加成反应
物理性质
密度:随C数目的增加而增大;但相对密度都小于1 熔沸点:一般随碳数增加而升高;同碳数时,支链越
多熔沸点越低 (主要由分子间作用力决定!)
有机化学课件(李景宁主编)第3章-单烯烃
总目录
第二节 烯烃的同分异构和命名
一、烯烃的同分异构现象
1. 构造异构(constitutional isomerism)
构造异构——分子式相同,原子或基团在分子 中连接次序不同。
碳干异构:
位置异构:(官能团变位)
CH3 CH2 CH CH2
CH3 CH2 CH CH2
CH3 C CH2 CH3
CH3 CH CH CH3
a > b;c > d
a > b,c > d
优先基团同侧-(Z) 优先基团异侧-(E)
总目录
Cl >H,Br >CH3 (E)-
I >CH3,Br >H (Z)-
(E)
(Z)
总目录
(E)-2,2,4-三甲基-3-己烯 (E)-2,2,4-trimethyl-3-hexene
(E)-3,4-二甲基-2-戊烯 顺-3,4-二甲基-2-戊烯 (E)-3,4-dimethyl-2-pentene
因为内能:烯烃 > 烷烃,所以氢化反应放热
总目录
烯烃
氢化热 kJ.mol-1
137.2 125.1 126.8 119.7
115.1
总目录
烯烃
氢化热 kJ.mol-1
126.8
119.2
112.5
111.3
总目录
(1)稳定性:反式 > 顺式 (2)C=C连接的烷基越多越稳定 • 稳定性:
• R2C=CR2 > R2C=CHR > RCH=CHR ≈ R2C=CH2 > RCH=CH2 > CH2=CH2
总目录
注意:
• 顺、反与Z、E是两种不同的表示烯烃几 何构型的方法,在大多数情况下,不存 在对应关系。即顺式不一定是Z构型,而 反式不一定是E构型。例如:
烯 烃ppt课件

(Z)构型 (E)构型
顺-2-戊烯
CH3
Cl
反-2-氯-2-戊烯
优先基团在双键的同侧
优先基团在双键的异侧
Z来源于德语的“zusammen”,意为“在一起”,与cis相当; E来源于德语的“entgegen”,意为“相反”,与trans相当。
Z-E标记法----次序规则:
(1)首先由和双键碳原子直接相连原子的原子序数决定, 大的在前:
C C
(3)
CH3 H H
CH3 H CH3 H
顺式 (两个相 (4) 同基团处于 双键同侧3
C
构造异构
顺反异构
碳架异构 (官能团)位置异构
同基团处于 双键异侧)
由于双键不能自由旋转,当双键的两个碳原子 各连接不同的原子或基团时,可能产生不同的 异构体. 产生顺反异构的条件: ① 分子中存在着限制碳原子自由旋转的因素, 如双键或环; ② 不能自由旋转的原子上连接2个不相同的原子 或基团。
117 ° 121.7 ° 121.5 °124.3 °CH
H H
C
C
0.108nm
H H
C
C H
0.150nm 0.109nm
3
H
0.133nm
0.109nm
sp2杂化
2p
激发
2s
2
2s
1
2p
杂化
sp
2
sp
2
sp
2
2p
三个sp2轨道的对称轴分 布在同一平面上,以碳 原子为中心指向三角形 的顶点,夹角120°。未 杂化的2p轨道保持原来 形状,垂直于三个sp2轨 道所在的平面。
I>Br>Cl>S>P>F>O>N>C>D>H (2)若双键碳原子直接相连第一原子相同时,则比较以 后的原子序数
顺-2-戊烯
CH3
Cl
反-2-氯-2-戊烯
优先基团在双键的同侧
优先基团在双键的异侧
Z来源于德语的“zusammen”,意为“在一起”,与cis相当; E来源于德语的“entgegen”,意为“相反”,与trans相当。
Z-E标记法----次序规则:
(1)首先由和双键碳原子直接相连原子的原子序数决定, 大的在前:
C C
(3)
CH3 H H
CH3 H CH3 H
顺式 (两个相 (4) 同基团处于 双键同侧3
C
构造异构
顺反异构
碳架异构 (官能团)位置异构
同基团处于 双键异侧)
由于双键不能自由旋转,当双键的两个碳原子 各连接不同的原子或基团时,可能产生不同的 异构体. 产生顺反异构的条件: ① 分子中存在着限制碳原子自由旋转的因素, 如双键或环; ② 不能自由旋转的原子上连接2个不相同的原子 或基团。
117 ° 121.7 ° 121.5 °124.3 °CH
H H
C
C
0.108nm
H H
C
C H
0.150nm 0.109nm
3
H
0.133nm
0.109nm
sp2杂化
2p
激发
2s
2
2s
1
2p
杂化
sp
2
sp
2
sp
2
2p
三个sp2轨道的对称轴分 布在同一平面上,以碳 原子为中心指向三角形 的顶点,夹角120°。未 杂化的2p轨道保持原来 形状,垂直于三个sp2轨 道所在的平面。
I>Br>Cl>S>P>F>O>N>C>D>H (2)若双键碳原子直接相连第一原子相同时,则比较以 后的原子序数
烯烃的结构和性质 PPT

互为顺反异构的物质化学性质基本相同,物理性质有一定
的差异。
工具
12
第二章 烃和卤代烃
栏目导引
3.下列有机物分子中,可形成顺反异构的是( D ) A.CH2=CHCH3 B.CH2=CHCH2CH3 C.CH3CH=C(CH3)2 D.CH3CH=CHCl
4.分子式为C5H10的烯烃共有同分异构体为(要考虑顺反异构
3-甲基-6-乙基-4-辛烯
C H3
CH CH3
C C H2 3-甲基-2-乙基-1-丁烯
CH2 CH3
注意:双键在1位时,要标出其位置,不 要忘记。▲
烯烃的命名
命名步骤: 1.选主链:选择含有碳碳双键的最长碳链作为 主链,按主链上所含碳原子数称 “某烯”。
2.编号:从最近双键的一端将主链碳原子依次编 号,双键的位次,以双键上编号较小的 数字表示,写在烯烃名称之前,并用短 线隔开。
一般用溴水或溴的四氯化碳溶液
8、制取卤代烃一般用加成的方法而不用取代方法 一卤代烃和HX加成,二卤代烃用X2加成,
X表示(Cl、 Br、I)
1.某烃的通式为CnH2n,关于该烃的下列说法正确的是( D ) A.一定是烯烃 B.能使溴水或酸性高锰酸钾溶液褪色 C.一定是不饱和烃 D.燃烧1mol此烃,生成等物质的量的CO2和H2O
在常温、常压下,碳原子数小于等于4的烯烃为气态。 (2)熔沸点、密度:
随着分子里碳原子数的增加,熔沸点逐渐升高,密度逐渐 增大,但密度均小于水。 (3)溶解性:
烯烃均难溶于水,易溶于有机溶剂。
工具
25
第二章 烃和卤代烃
栏目导引
5.化学性质:
(1)氧化反应 ①烯烃能使高锰酸钾酸性溶液褪色。
②可燃性:
烯 烃ppt课件

碳碳单键和双键电子云分布的比较
C-C s键
电子云不易与外界接近
C-C 键
电子云暴露在外.易接近亲电试剂
a:s键电子云集中在两核之间,不易与外界试剂接近 b:双键是由四个电子组成,相对单键来说,电子云密 度更大;且构成键的电子云暴露在乙烯分子所在的平 面的上方和下方,易受亲电试剂(s+)攻击,所以双键有 亲核性 (s-).
r- B r + B C H H 2 C 2
第一步
C C
CH2Br CH2Br _
+ + B r- B r
C Br: + Br C
Br
::
C
C
Br + Br-
::
溴鎓离子
第二步
C
Br- C
Br
C C Br
反式加成
加成反应首先是亲电子试剂(缺电子的溴正离子)的 进攻引起的,称为亲电加成反应。如果双键的电子云 密度越大,反应越容易进行,反之亦然。
5.顺反异构体命名
a.双键两个碳原子上连接的两相同的基团在同 侧为顺式,在异侧为反式。名称前附以顺或反, 用短线连接。
CH3 H C C CH2CH3 H H C C CH3
b.双键两个碳原子所连接的4个基团不相同时, 采用Z、E命名法。Z:“同一侧”,E:“相 a d 反”。 a c 基团优先次序: C C C C b a>b, c>d c b d
第一节 烯烃的结构
不饱和:即有机物分子中与碳原子数相等的开 链烷烃相比较,氢原子的数目少于开链烷烃的 氢原子数。
实验表明乙烯的结构为: ① 所有原子在同一平面,每个碳原子只和三个原子相连, 键角120°。 ② 键能:C = C 610 kJ/mol(C—C 345.6 kJ/mol),双键的 键能≠两个单键键能之和:345.6 * 2 = 691.2 kJ/mol ③ 键长: C = C 0.133nm(C—C 0.153nm),不是单键的1/2。 H
第三章烯烃PPT课件

4-乙基环己烯
环戊烯
1-甲基环己烯
.
3-氯环庚烯
16
顺反异构体的命名
顺反命名法: 系统名称前加一“顺(或cis)”或“反(trans)”字。
顺-2-戊烯 cis-2-pentene
反-2-戊烯 trans-2-pentene
顺反命名法有局限性,即在两个双键碳上所连接的两个基团彼此 应有一个是相同的,彼此无相同基团时,则无法命名其顺反。
这是两种不同的命名法。顺、反异构体 的命名指的是相同原子或基团在双键平面同一 侧时为"顺",在异侧时为"反"。Z、E构型指 的是原子序数大的原子或基团在双键平面同一 侧时为"Z",在异侧时为"E"。
.
19
Cl
H
Br
Cl
反- 1,2-二氯-1-溴乙烯
Trans- 1-bromo-1,2-dichloroethene
几何异构体之间在物理性质和化学性质上都可以 有较大的差别,因而容易分离。
满足条件:每个双键碳上都. 连有不同原子或原子团 9
a
C
b
a
C
b
a
C
b
a
C
d
a
C
b
c
C
d
a
C
a
c
C
d
.
10
己烯雌酚
反式(有生理活性)
顺式 (无)
治疗卵巢功能不全或
垂体功能异常引起的
各种妇科疾病
.
11
三.烯烃的命名
(1)普通命名法
➢补充:苄基和烯丙基碳正离子的相对稳定性:
PhCH2 > 3°> 2°> 1°
烯烃、二烯烃的性质与结构-高中化学同步课件(苏教版2019选择性必修3)

CH3CH2OH(乙醇)
烯烃能使酸性高锰酸钾和溴水褪色
烯烃的不对称加成反应
【提问】试写出CH2=CH-CH3与HBr的反应。
CH2=CH-CH3 + HBr
CH2-CH-CH3
|
|
Br
H
CH2-CH-CH3
|
|
主要产物
H
Br
当不对称烯烃与含氢化合物(HBr、H2O等)加成时,H原子主要
加到连有较多H原子的C原子上(马氏规则)
CH3
[ CH2
CH3
C]
n
CH3
二、加聚反应的类型
②共轭烯烃型加聚反应 双键要打开,单键变双键
n CH2=CH—CH=CH2 催化剂
[ CH2—CH=CH—CH2 ]n
【练一练】试右侧物质的加聚反应?
不变 ,氢原子质量分数 不变 。
数
环烷烃:CnH2n (n≥3)
单烯烃与同碳原子数的环烷烃是同分异构体
3.烯烃的结构:
含有碳碳双键,乙烯所有原子 能 共平面,键角约为 120° 。
3和sp2
sp
烯烃中含有键和 键,碳原子的杂化方式为
。碳原子
数不同的单烯烃之间关系是 同系物
。
二、烯烃的立体异构
1.顺反异构产生的原因:由于与双键相连接的两个碳原子不能旋转,导致原子
现象:若发生取代反应则生成HBr,则有淡黄色沉淀或加石蕊会变红;
若发生加成反应,则无此现象。
四、烯烃的化学性质
3.氧化反应:
①在氧气中燃烧
现象:在空气中燃烧,火焰明亮且伴有黑烟
反应方程式:
四、烯烃的化学性质
3.氧化反应:
②与酸性高锰酸钾溶液反应
现象:酸性高锰酸钾溶液褪色
烯烃能使酸性高锰酸钾和溴水褪色
烯烃的不对称加成反应
【提问】试写出CH2=CH-CH3与HBr的反应。
CH2=CH-CH3 + HBr
CH2-CH-CH3
|
|
Br
H
CH2-CH-CH3
|
|
主要产物
H
Br
当不对称烯烃与含氢化合物(HBr、H2O等)加成时,H原子主要
加到连有较多H原子的C原子上(马氏规则)
CH3
[ CH2
CH3
C]
n
CH3
二、加聚反应的类型
②共轭烯烃型加聚反应 双键要打开,单键变双键
n CH2=CH—CH=CH2 催化剂
[ CH2—CH=CH—CH2 ]n
【练一练】试右侧物质的加聚反应?
不变 ,氢原子质量分数 不变 。
数
环烷烃:CnH2n (n≥3)
单烯烃与同碳原子数的环烷烃是同分异构体
3.烯烃的结构:
含有碳碳双键,乙烯所有原子 能 共平面,键角约为 120° 。
3和sp2
sp
烯烃中含有键和 键,碳原子的杂化方式为
。碳原子
数不同的单烯烃之间关系是 同系物
。
二、烯烃的立体异构
1.顺反异构产生的原因:由于与双键相连接的两个碳原子不能旋转,导致原子
现象:若发生取代反应则生成HBr,则有淡黄色沉淀或加石蕊会变红;
若发生加成反应,则无此现象。
四、烯烃的化学性质
3.氧化反应:
①在氧气中燃烧
现象:在空气中燃烧,火焰明亮且伴有黑烟
反应方程式:
四、烯烃的化学性质
3.氧化反应:
②与酸性高锰酸钾溶液反应
现象:酸性高锰酸钾溶液褪色
有机化学课件烯烃的结构及命名

区域选择性——马氏规则
RCH=CH2 + HBr 马氏经验规律:
R C H C H 3 + RCH2CH2Br
Br 主
H加在含氢较多的双键碳原子上,X加在含氢原 子较少的双键碳原子上。
实质:由碳正离子的稳定性决定。
碳正离子的稳定性:R3C+
>
+ R2CH
++ >RCH2>CH3
正碳离子(carbon cation)
条件——不能自由旋转的碳原子所连接的原子或原子团不同
1)双键的存在
A
D
B
E
环或双键 的存在
A≠B并且D≠E时,存 在顺反异构
2)环的存在
• 烯烃的命名
双键视为烯烃的官能团
“三步曲”: ①选主链——最长(最多) ①主链应含双键(官能团)
②编号——最近
②主官能团的位次尽可能小
③命名——“取代基位次 (最低系列)
R C+
> R C+ > H C+
R
H
H
H
R3C·> R2CH·> RCH2·> CH3·
过氧化物下加氢溴酸
l 特例——反马氏规则 即氢加在氢少的碳原子上
– 条件:过氧化物存在 – 机理:自由基加成反应
R2
R3
R2
H Br
C
R3 H
R2 H
R3
H RO OOO RH
Br
Br
R1
R4
R1
R4
R1
R4
1,6-二甲基环己烯 •编号先官能团(双键),
后取代基
例3
9'
化学课件烯烃优秀ppt苏教版

94.对一个适度工作的人而言,快乐来自于工作,有如花朵结果前拥有彩色的花瓣。――[约翰·拉斯金] 95.没有比时间更容易浪费的,同时没有比时间更珍贵的了,因为没有时间我们几乎无法做任何事。――[威廉·班] 96.人生真正的欢欣,就是在于你自认正在为一个伟大目标运用自己;而不是源于独自发光.自私渺小的忧烦躯壳,只知抱怨世界无法带给你快乐。――[萧伯纳]
97.有三个人是我的朋友爱我的人.恨我的人.以及对我冷漠的人。 爱我的人教我温柔;恨我的人教我谨慎;对我冷漠的人教我自立。――[J·E·丁格] 98.过去的事已经一去不复返。聪明的人是考虑现在和未来,根本无暇去想过去的事。――[英国哲学家培根] 99.真正的发现之旅不只是为了寻找全新的景色,也为了拥有全新的眼光。――[马塞尔·普劳斯特] 100.这个世界总是充满美好的事物,然而能看到这些美好事物的人,事实上是少之又少。――[罗丹] 101.称赞不但对人的感情,而且对人的理智也发生巨大的作用,在这种令人愉快的影响之下,我觉得更加聪明了,各种想法,以异常的速度接连涌入我的脑际。――[托尔斯泰] 102.人生过程的景观一直在变化,向前跨进,就看到与初始不同的景观,再上前去,又是另一番新的气候――。[叔本华] 103.为何我们如此汲汲于名利,如果一个人和他的同伴保持不一样的速度,或许他耳中听到的是不同的旋律,让他随他所听到的旋律走,无论快慢或远近。――[梭罗] 104.我们最容易不吝惜的是时间,而我们应该最担心的也是时间;因为没有时间的话,我们在世界上什么也不能做。――[威廉·彭] 105.人类的悲剧,就是想延长自己的寿命。我们往往只憧憬地平线那端的神奇【违禁词,被屏蔽】,而忘了去欣赏今天窗外正在盛开的玫瑰花。――[戴尔·卡内基] 106.休息并非无所事事,夏日炎炎时躺在树底下的草地,听着潺潺的水声,看着飘过的白云,亦非浪费时间。――[约翰·罗伯克] 107.没有人会只因年龄而衰老,我们是因放弃我们的理想而衰老。年龄会使皮肤老化,而放弃热情却会使灵魂老化。――[撒母耳·厄尔曼] 108.快乐和智能的区别在于:自认最快乐的人实际上就是最快乐的,但自认为最明智的人一般而言却是最愚蠢的。――[卡雷贝·C·科尔顿] 109.每个人皆有连自己都不清楚的潜在能力。无论是谁,在千钧一发之际,往往能轻易解决从前认为极不可能解决的事。――[戴尔·卡内基] 110.每天安静地坐十五分钟·倾听你的气息,感觉它,感觉你自己,并且试着什么都不想。――[艾瑞克·佛洛姆] 111.你知道何谓沮丧---就是你用一辈子工夫,在公司或任何领域里往上攀爬,却在抵达最高处的同时,发现自己爬错了墙头。--[坎伯] 112.「伟大」这个名词未必非出现在规模很大的事情不可;生活中微小之处,照样可以伟大。――[布鲁克斯] 113.人生的目的有二:先是获得你想要的;然后是享受你所获得的。只有最明智的人类做到第二点。――[罗根·皮沙尔·史密斯] 114.要经常听.时常想.时时学习,才是真正的生活方式。对任何事既不抱希望,也不肯学习的人,没有生存的资格。
97.有三个人是我的朋友爱我的人.恨我的人.以及对我冷漠的人。 爱我的人教我温柔;恨我的人教我谨慎;对我冷漠的人教我自立。――[J·E·丁格] 98.过去的事已经一去不复返。聪明的人是考虑现在和未来,根本无暇去想过去的事。――[英国哲学家培根] 99.真正的发现之旅不只是为了寻找全新的景色,也为了拥有全新的眼光。――[马塞尔·普劳斯特] 100.这个世界总是充满美好的事物,然而能看到这些美好事物的人,事实上是少之又少。――[罗丹] 101.称赞不但对人的感情,而且对人的理智也发生巨大的作用,在这种令人愉快的影响之下,我觉得更加聪明了,各种想法,以异常的速度接连涌入我的脑际。――[托尔斯泰] 102.人生过程的景观一直在变化,向前跨进,就看到与初始不同的景观,再上前去,又是另一番新的气候――。[叔本华] 103.为何我们如此汲汲于名利,如果一个人和他的同伴保持不一样的速度,或许他耳中听到的是不同的旋律,让他随他所听到的旋律走,无论快慢或远近。――[梭罗] 104.我们最容易不吝惜的是时间,而我们应该最担心的也是时间;因为没有时间的话,我们在世界上什么也不能做。――[威廉·彭] 105.人类的悲剧,就是想延长自己的寿命。我们往往只憧憬地平线那端的神奇【违禁词,被屏蔽】,而忘了去欣赏今天窗外正在盛开的玫瑰花。――[戴尔·卡内基] 106.休息并非无所事事,夏日炎炎时躺在树底下的草地,听着潺潺的水声,看着飘过的白云,亦非浪费时间。――[约翰·罗伯克] 107.没有人会只因年龄而衰老,我们是因放弃我们的理想而衰老。年龄会使皮肤老化,而放弃热情却会使灵魂老化。――[撒母耳·厄尔曼] 108.快乐和智能的区别在于:自认最快乐的人实际上就是最快乐的,但自认为最明智的人一般而言却是最愚蠢的。――[卡雷贝·C·科尔顿] 109.每个人皆有连自己都不清楚的潜在能力。无论是谁,在千钧一发之际,往往能轻易解决从前认为极不可能解决的事。――[戴尔·卡内基] 110.每天安静地坐十五分钟·倾听你的气息,感觉它,感觉你自己,并且试着什么都不想。――[艾瑞克·佛洛姆] 111.你知道何谓沮丧---就是你用一辈子工夫,在公司或任何领域里往上攀爬,却在抵达最高处的同时,发现自己爬错了墙头。--[坎伯] 112.「伟大」这个名词未必非出现在规模很大的事情不可;生活中微小之处,照样可以伟大。――[布鲁克斯] 113.人生的目的有二:先是获得你想要的;然后是享受你所获得的。只有最明智的人类做到第二点。――[罗根·皮沙尔·史密斯] 114.要经常听.时常想.时时学习,才是真正的生活方式。对任何事既不抱希望,也不肯学习的人,没有生存的资格。
烯烃(0002)ppt课件

第五章
烯烃
本章提纲
▪ 第一节 烯烃的结构特征 ▪ 第二节 烯烃的命名 ▪ 第三节 烯烃的物理性质 ▪ 第四节 烯烃的化学性质 ▪ 第五节 烯烃的制备
第一节 烯烃的结构特征
▪ 双键碳是sp2杂化。 ▪ π键是由p轨道侧面重叠形成 ▪ 由于室温下双键不能自由旋转,所以有Z,E
异构体
C=C 1.346Å
= =
==
O
O
制
CH3COH
30% H2O2, H+ CH3COOH
OO
=
备
C6H5COOCC6H5 + CH3ONa CHCl3,、-5o-0oC
O
O
=
=
C6H5COCH3 + C6H5COONa
H+
O C6H5COOH
实验室常用过氧化 物来制备过酸。
过氧化物易分解爆炸,使 用时要注意温度和浓度。
1-甲基环己烯的加溴反应
Br2 Br2
Br
+
-Br -Br
+
Br
Br
Br Br Br
2. 加成时,溴取两个直立键,遵循构象最小改变原 理
构象最小改变原理:当加成反应发生时,要使碳 架的构象改变最小 3. 双键旁有取代基时,要考虑碳正离子的稳定性。
(S)-3-甲基环己烯的加溴反应
*
H3C
*
Br2 H3C
CH3
C2H5
CH3COOH
CH3 C2H5
CC C2H5
H
30% H2O2
O
CH3COO CH3 C2H5
C2H5 H
OH
H2O, H+ or -OH
HO CH3 C2H5
烯烃
本章提纲
▪ 第一节 烯烃的结构特征 ▪ 第二节 烯烃的命名 ▪ 第三节 烯烃的物理性质 ▪ 第四节 烯烃的化学性质 ▪ 第五节 烯烃的制备
第一节 烯烃的结构特征
▪ 双键碳是sp2杂化。 ▪ π键是由p轨道侧面重叠形成 ▪ 由于室温下双键不能自由旋转,所以有Z,E
异构体
C=C 1.346Å
= =
==
O
O
制
CH3COH
30% H2O2, H+ CH3COOH
OO
=
备
C6H5COOCC6H5 + CH3ONa CHCl3,、-5o-0oC
O
O
=
=
C6H5COCH3 + C6H5COONa
H+
O C6H5COOH
实验室常用过氧化 物来制备过酸。
过氧化物易分解爆炸,使 用时要注意温度和浓度。
1-甲基环己烯的加溴反应
Br2 Br2
Br
+
-Br -Br
+
Br
Br
Br Br Br
2. 加成时,溴取两个直立键,遵循构象最小改变原 理
构象最小改变原理:当加成反应发生时,要使碳 架的构象改变最小 3. 双键旁有取代基时,要考虑碳正离子的稳定性。
(S)-3-甲基环己烯的加溴反应
*
H3C
*
Br2 H3C
CH3
C2H5
CH3COOH
CH3 C2H5
CC C2H5
H
30% H2O2
O
CH3COO CH3 C2H5
C2H5 H
OH
H2O, H+ or -OH
HO CH3 C2H5
烯烃课件

C=C
+ H- X
慢
X C- C H
+
X- 快
C=C H
按正碳离子所连的烃基的数目,正碳离子可分为伯、仲、叔和 甲基正碳离子。与正碳离子相连的烃基具有斥电子诱导效应,可 以分散正碳离子上的正电荷。叔正碳离子的正电荷分散到三个烃 基,上仲正碳离子的正电荷分散到两个烃基上,伯正碳离子的正 电荷仅能分散到一个烃基上,而甲基正碳离子的正电荷不能得到 分散,因此正碳离子稳定性次序为:
烯 烃
第一节 烯烃的官能团结构
乙烯分子的结构示意图(电子云图)
1.π键的特点:
⑴ π键重叠程度比σ键小,不如σ键稳定,比较容易破裂。C=C 的平均键能是610kJ/mol。[610(C=C键能)-346(C-C键能)] 是 C-C单键的键能346kJ/mol的1.76倍左右。 ⑵ π键具有较大的流动性,容易受外界电场的影响,电子云比较 容易极化,容易给出电子,发生反应。 由于π键的电子云不象σ 键电子云那样集中在两原子核连线上,而是分散成上下两方,故 原子核对π电子的束缚力就较小。
二、与卤化氢的加成
1870年,俄国化学家马尔可夫尼可夫总结了不对称烯烃加卤化氢的 规律(马氏规律):HX与不对的碳原子上,带负电的X-加到双键中含氢较少的碳原 子上。 烯烃与卤化氢加成的活性顺序为:HI>HBr>HCl>HF
以丙烯和卤化氢的加成为例:
反应式如下:
CH3
+
δ+ δδ+ δ- 慢 CH=CH2+H-X 快
[CH3CHCH3 ] [CH3CHCH3 ] X
+
[CH3CHCH3 ] +X-
此反应是分步进行的。首先,是卤化氢中带正电荷的质子作为亲电试 剂进攻碳碳双键的π电子,使π键打开,形成碳正离子中间体,然后卤 素负离子与碳正离子中间体很快结合生成加成产物。反应中涉及π键 的第一步较慢,是决定整个反应速率的关键步骤。
高中化学课件:烯烃

CH3—CH2—OSO3H
CH3CH==CH2+H2SO4
CH3—CH—CH3
—
OSO3H
加成产物硫酸氢酯与水加热,可水解成醇和硫酸,此法可用于制备醇。
2.加聚反应 在适当的温度、压强和催化剂存在的条件下,烯烃分子中碳碳双键中的一个键 断裂,分子间通过碳原子相互结合形成很长的碳链,生成相对分子质量很大的 聚合物。
CH3—CH—CH2
—
主要产物90% 占10%
—
—
H Cl 马氏规则:不对称烯烃与极性试剂卤化氢发生加成时,酸中的氢原子加在含氢
较多的双键碳原子上。 马氏规则实质上是电性规律
与HBr在过氧化物作用下发生加成反应:
CH3CH==CH2+HBr
过氧化物 光照
— —
CH3—CH —CH2 H Br
只能得到反马氏规则产物
5CH2==CH2+12KMnO4+18H2SO4→10CO2+28H2O+6K2SO4+12MnSO4
【思考】 1.如何鉴别甲烷与乙烯? ①分别通入酸性高锰酸钾溶液 ②燃烧法:观察燃烧时的火焰颜色
2.除去甲烷中的乙烯能否用酸性KMnO4溶液?为什么? 不能用酸性KMnO4溶液,因为酸性KMnO4将乙烯最终氧化为CO2, 引入新杂质CO2。
3.下列物质不存在顺反立体异构的是( B )
A.CH3CH==CHCH3
B.CH2==C(CH3)2
C.
D.BrCH==CHBr
4.有关苯乙烯
的说法,正确的是( C )
A.用溴水可以除去苯中的苯乙烯
B.苯乙烯有顺反(立体)异构
C.苯乙烯的所有原子可以共平面
D.1 mol苯乙烯最多可以与1 mol H2发生加成反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• CH2=C-
•
CH3
1-丙烯基 2-丁烯基 2-丙烯基(烯丙基) 1-甲基乙烯基
(异丙烯基)
(3)Z/E命名法
• ⅠIUPAC命名法,Z指同一侧的意思,E 指相反的意思。用“顺序规则”来决定Z, E的构型。
• Ⅱ “顺序规则”主要内容: • 一是将双键碳原子所连接的原子或基团
按原子序数大小排列,把大的排在前面, 小的排在后面,同位素按原子量大小次 序排列。
5, π键和σ键的对比
π键 • 没有对称轴 • 不能自由旋转 • 侧面重叠,重叠程度
较小,容易破裂. • 分散成上下两方,流
动性较大,易反应. • 键长较短,0.134nm • 键能264.4kJ/mol
•σ键 •有对称轴 •成键原子间能自由旋转 •重叠程度较大,键能高, 比较稳定.
电子云集中,不易反应 键长较长0.154nm •键能345.6kJ/mol
4,产生顺反异构的条件
• 必须在构成双键的任何一个碳原子上所 连接的两个原子或基团要不相同。也就 是说,当双键的任何一个碳原子所连接 的两个原子或基团相同时就没有顺反异 构现象。
下列化合物没有顺反异构体:
a
aa
d
C=C
C=C
a
bb
d
∵ a=a
∵ d=d
∴无顺反异构
∴无顺反异构
二,烯烃的命名
• (1) 烯 烃的系统命名法:与烷 烃相似, 其要点是:
• π轨道:每个碳原子还剩下一个2py轨道, 它们的对称轴垂直于这五个σ键所在的平 面,且互相平行,电子的自旋方向相反, 沿着轴平行地重叠,便组成新的轨道, 称为π轨道。
(3)乙烯 分子中的σ键和π键
H C
H
H C
H
乙烯分子中的σ键和π键
* MO
C-C
C=C
* MO 键能/kJmol-1 346
6,碳碳双键的组成
• 烯烃的双键: • 由一个σ键和一个π键组成的.π键的直剖面
垂直于σ键所在的平面. • 烯 烃的构造式,用两条短线来表示双键.一
条短线代表σ键,另一条是代表π键.
第二节 烯烃的同分异构和命名
烯烃的同分异构现象 烯烃的命名
一,烯烃的同分异构现象
• 1,由于烯 烃含有双键,因此烯 烃的同 分异构有:
的双键 碳原子上,这称为马尔科夫尼科
夫(Markovnikov)规则。
乙酸
• CH3CH2CH=CH2 + HBr
•
CH3CH2CHBrCH2
•
80%
D 区位专一性和区位选择性
=0 ( bp 0.9oC )
比较烯烃几何异构体的稳定性试。
Hf /kJ•mol-1 -7.9
-12.5
双键碳上烷基越多的烯烃越稳定
R2C=CR2 > R2C=CHR > R2C=CH2 > RCH=CHR > RCH=CH2 > CH2=CH2
第四节 烯烃的化学性质
催化氢化 亲电加成 氧化反应 聚合反应
课件10
第三章 单 烯 烃
烯烃的结构 烯烃的同分异构和命 名 烯烃的物理性质 化学性质 烯
烃的制备 反应历程 马氏规则
单烯烃的概念和功能团
• 单烯烃是指分子中含有一个碳 碳双键 (C==C)的不饱和开链烃,简称烯烃。烯 表示分子中含量氢较少的意思。
• 单烯烃的通式是CnH 2n。 • 碳碳双键叫做烯键,是烯烃的官能团。
几种原子的顺序为:
I,Br,Cl,S,P,O,N,C,D,H
当与C1所连接的两个原子或基团中原子序数 大的与C2所连接原子序数大的原子或基团处 在平面同一侧的为(Z)构型,命名时在
名称的前面附以(Z)字。反之,若不在同
一侧的则为(E)构型,命名时在名称前面
附以(E)字,均用一短线连接。
a
c
a
d
C==C
CH 3 C=CH2 CH3
异丁烯
(1),(2)和(3)是碳干异构体
(3)
(2) 2-丁烯又有两个顺反异构体:
H3C
CH3
C=C
H
H
顺-2-丁烯 (4)
H3C
H
C=C
H
CH3
反-2-丁烯
(5)
3,顺反异构现象
• 由于组成双键的两个碳原子不能相对自 由旋转,使得这两个碳原子上所连接的 原子或基团在空间的配置不同,以致形 成的几何构型不同,这一现象称为顺反 异构现象。
引起,故此反应称亲电加成反应。
1,与酸的加成
• 强酸即H+是最简单的亲电试剂,能与烯 烃起加成反应。
• C==C +HX C C X=Cl,Br,I
•
HX
• C==C +H2SO4 •
CC H OSO3H
与弱酸的加成
• 弱的有机酸(如乙酸),醇,水等只有 在强酸催化下才能发生加成反应。
• C=C + H2O H+
• 丙烯分子的分子结构:
•
H
CH3
•
C====C
sp2
B CC
B
•
H
H
A
A
2,杂化轨道 理论解释
• (1)杂化:乙烯碳原子成键时,碳原子 以一个s轨道和两个p轨道进行杂化,组 成三个等同的sp2轨道,sp2轨道 对称轴在 同一平面上,彼此成120º角,这种杂化方 式叫sp2杂化。
• 每个碳原子余下一个未参加杂化的2p轨 道,仍保持原来的形状,其对称轴垂直 于在三个sp2轨道的对称轴所在的平面。
课件11
第三节 烯烃的物理性质
烯烃的物理性质与烷烃相似
烯烃的物理性质递增变规律
• 状态:常温下,2∽4个碳原子的为气体,5∽ 18的为液体,19以上的为固体.
• 沸点,熔点和相对密度都随相对分子质量 的增加而上升.
• 无色,不溶于水,易溶于有机溶液剂.
CH3
CH3
CC
H
H
H
CH3
CC
CH3
H
=0.33D ( bp 3.7oC )
B 不对称烯烃和卤化氢的加成
• 丙烯是不对称分子,它和卤化氢反应时, 可以生成两种加成产物。
•
CH3 CH==CH2
•
HX
(2)
(1) HX
• CH3 CH2 CH2 X • •
CH3 CH CH3 X
主要产物
C,马尔科夫尼科夫规则
• 凡是不对称结构的烯烃和酸(HX)加成
时,酸的负基X-主要加到含氢原子较少
烯烃的官能团
• 双键是反映烯烃化学性质的官能团。 • 烯烃很活泼,可以和很多试剂作用。 • 能起加成,氧化,聚合等反应。 • 加成反应是烯烃的典型 反应。在反应中π
键断开, 双键上的两碳原子和其他原子或 原子团结合,形成两个σ键,这种反应称为 加成反应。
一,催化氢化和氢化热
• 1,催化氢化:在催化剂存在下,有机化 合物和分子氢所起的反应称为催化氢化。
CH3
CH2CH3
CC
H
H
顺-2-戊烯
H
CH2CH3
CC
CH3
H
反-2-戊烯
Z式:双键碳原子上两个较优基团或原子处于双键同侧。 E式:双键碳原子上两个较优基团或原子处于双键异侧。
(优)CH3 C
H
CH2CH3(优) C
CH3 C
CH3
(优)CH3CH2
CH(CH3)2(优) C
CH2CH2CH3
(Z)- 3-甲基-2-戊烯 (E)- 3-甲基-4-异丙基-3-庚烯
CC
•
H OH
• C==C +CH3COOH H+
CC
•
H OCCH3
(1) 与卤化氢的加成
• A 卤化氢气体或发烟氢卤酸溶液和烯烃 加成时,可得一卤代烷 。
• H2C==CH2 + HX
CH3CH2X
• 浓氢碘酸,浓氢溴酸也能和烯烃加成。
浓盐酸一般不起反应,要用催化剂
(AlCl3)才行。
• 卤化氢的活泼性次序:HI>HBr>HCl
• 几个烃基的顺序为: • (CH3)3C-> (CH3)2CH->CH3CH2->CH3-
例子:
• H3C
CH3
• C===C
•H
C2H5
• H3C->H
CH3->-C2H5
•
(E)构型
• (E)-3-甲基-2-戊烯
2. 顺反异构体的命名和 Z、E标记法
顺式:双键碳原子上两个相同的 原子或基团处于双键同侧。 反式:双键碳原子上两个相同 的原子或基团处于双键反侧。
• 最长碳链为主链(母体烯 烃) • 以最小的编号给双键 • 双键的位次,只写出双键两个碳原子中位
次较小的一个,放在烯烃名称的前面. • 其他同烷烃的命名原则.
(2) 烯 基
• 烯 基:当烯烃从形式上去掉一个氢原子后 剩下的一价基团叫做烯 基。
• CH3CH=CH-
• CH3CH=CHCH2-
• CH2=CHCH2-
(2)反应:氢原子与烯烃双键的碳原子 结合生成了烷 烃。
(3)解吸:烷 烃一旦生成,就立即从 催化剂表面解吸出来。这是因为催化 剂表面对烷 烃的吸附能力小于烯烃。
H
H
H
H
C======C
H2
HH
C==C
ቤተ መጻሕፍቲ ባይዱ
H
H
H HH
H
H CH2 -CH2 H
顺式加成,定量完成;从位阻小的一面进行。
4,催化反应的应用
610
E
键长/nm
0.154 0.134
