(完整版)第1章热力学基本概念
合集下载
高等工程热力学第1章
附: 华氏温标和摄氏温标
t
( C) =5 t(F ) 32 9
° °
33
☻ 压力
绝对压力 p;
表压力 pe(pg); 真空度 pv;
p=
F A
p = pb + pe ( p > pb )
p = pb - pv ( p < pb )
动压力、静压力、滞止压力和绝对压力 ?
☻ 热力学能
Uch
G = G( p, T , n1 , n2 , , nr )
热力平衡系统
其中
是驱使第i 种组分变化的势,即化学势:
12
用A表示的化学势
改变约束条件,化学势还可有其它的表达式、但是 无论如何表示,其实质都相同:
据化学势概念,定温、定容和定压、定温系统的 平衡判据:
13
四. 稳定平衡判据
力学中平衡的稳定性
+
+
1
b2
1
C)状态参数分类: 广延量 强度量 (广延量的比性质,具有强度量特性)32
► 系统两个状态相同的充要条件: 所有状参一一对应相等 简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
► 基本状态参数
☻ 温度
测温的基础—热力学零定律 热力学温标和国际摄氏温标
{t } C = {T }K 273.15
δ AT ,V = 0
1
δ AT , V > 0
2
定温定压系统,平衡与稳定的条件
δ GT , p = 0
1
δ GT , p > 0
2
16
过程
不同形式能量之间的转换必须通过工质的状态变化过程才 能完成。 一切过程都是平衡被破坏的结果,工质和外界有了热的、力的 或化学的不平衡才促使工质向新的状态变化,故实际过程都是不 平衡的。
t
( C) =5 t(F ) 32 9
° °
33
☻ 压力
绝对压力 p;
表压力 pe(pg); 真空度 pv;
p=
F A
p = pb + pe ( p > pb )
p = pb - pv ( p < pb )
动压力、静压力、滞止压力和绝对压力 ?
☻ 热力学能
Uch
G = G( p, T , n1 , n2 , , nr )
热力平衡系统
其中
是驱使第i 种组分变化的势,即化学势:
12
用A表示的化学势
改变约束条件,化学势还可有其它的表达式、但是 无论如何表示,其实质都相同:
据化学势概念,定温、定容和定压、定温系统的 平衡判据:
13
四. 稳定平衡判据
力学中平衡的稳定性
+
+
1
b2
1
C)状态参数分类: 广延量 强度量 (广延量的比性质,具有强度量特性)32
► 系统两个状态相同的充要条件: 所有状参一一对应相等 简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
► 基本状态参数
☻ 温度
测温的基础—热力学零定律 热力学温标和国际摄氏温标
{t } C = {T }K 273.15
δ AT ,V = 0
1
δ AT , V > 0
2
定温定压系统,平衡与稳定的条件
δ GT , p = 0
1
δ GT , p > 0
2
16
过程
不同形式能量之间的转换必须通过工质的状态变化过程才 能完成。 一切过程都是平衡被破坏的结果,工质和外界有了热的、力的 或化学的不平衡才促使工质向新的状态变化,故实际过程都是不 平衡的。
工程热力学-01 基本概念及定义

平衡状态1
p1 v1
p
p2
2
压容图 p-v图
平衡状态2
p1
1
p2 v2
O
v2
v1
v
12
1-4 状态方程式
在平衡状态下,由气态物质组成的系统,只要知道两个独立的 状态参数,系统的状态就完全确定,即所有的状态参数的数值随之 确定。这说明状态参数间存在某种确定的函数关系,状态参数之间 存在着确定的函数关系,这种函数关系就称为热力学函数。
(2)当系统处于热力学平衡状态时,只要没有外界的影响, 系统的状态就不会发生变化。
(3)整个系统可用一组具有确定数值的温度、压力及其他参
? 数来描述其状态。
10
经验表明,确定热力学系统所处平衡状态所需的独立状 态参数的数目,就等于系统和外界间进行能量传递方式的数 目。对于工程上常见的气态物质组成的系统,系统和外界间传递 的能量只限于热量和系统容积变化所作的功两种形式,因此只需 要两个独立的状态参数即可描述一个平衡状态。
3、平衡状态、稳定状态、均匀状态
(1)关于稳定状态与平衡状态
稳定状态时,状态参数虽不随时间改 变,但它是依靠外界影响来维持的。而平 衡状态是不受外界影响时,参数不随时间 变化的状态。
85℃ 20℃
90℃
15℃
铜棒
平衡必稳定,稳定未必平衡。
(2)关于均匀状态与平衡 水
质统称为外界。 通常选取工质作为热力学系统,把高温热源、低温热源
等其他物体取作外界。
3、边界 ——热力学系统和外界之间的分界面称为边界。
边界可以是固定的,也可以是移动的; 边界可以是实际的,也可以是假想的。
3
二、热力学系统的分类 依据——有无物质或能量的交换
第1章 热力学第一定律

Extensive properties can be made intensive by normalizing.
5.热力学平衡态
系统在一定环境条件下,经足够长的时间,其各 部分可观测到的宏观性质都不随时间而变,此时系统 所处的状态叫热力学平衡态。 热力学系统,必须同时实现以下几个方面的平衡, 才能建立热力学平衡态: (i) 热平衡—系统各部分的温度T相等;若系统不是绝 热的,则系统与环境的温度也要相等。 (ii) 力平衡—系统各部分的压力p相等;系统与环境的 边界不发生相对位移。 (iii)质平衡—体系和环境所含有的质量不随时间而变。 (iv)化学平衡—若系统各物质间可以发生化学反应,则 达到平衡后,系统的组成不随时间改变。
此公式适合于恒外压过程。 (2)
式中p为系统压力,n为气体的物质的量。此公式适 合于理想气体恒压变温过程。
(3)
式中Wr为可逆功,p为系统的压力。只要知道p、V之 间的函数关系就可以对上式进行积分。此公式适合 于封闭体系可逆过程体积功的计算。
(4)Wr (5) (6)
Wr pdV
V1
V2
并且有
2 A 2 A xy yx
即二阶导数与求导次序无关
对一无限小的增量dA
dA=L(x,y)dx+M(x,y)dy
其中,L和M是独立变量x和y的函数,此时并不能马上断 定 A A dA是否是全微分,即不能断定是否存在一个函数(或性质) x y y x A(x,y),因为L(x,y),无需是 或M(x, y)无须是 。 L L dA为全微分的充要条件: y x x y 若α L/ αy≠ α M/ αx,则dA并非为全微分;若α L/ α y =α M/ α x, 则dA为全微分,且A是体系的一个性质, 它在状态1,2之间的差值为,dA=A2一A1,与路径无关。 断定体系性质是否为状态函数依据:1.自变量是否可 知;2. 体系表征数据的精度是否可靠。
工程热力学第一章

(3)好处:用系统的参数来计算;可以作 好处:用系统的参数来计算; 为实际过程中能量转换效果比较的标准和极 限;可把实际过程当作可逆过程进行分析计 然后再用经验系数加以修正。 算,然后再用经验系数加以修正。 (4)热量和功量 热量和功量都是过程量, 热量和功量都是过程量,它们的大小不仅与 过程的初终状态有关, 过程的初终状态有关,而且与过程的性质有 关。 可逆过程的功量: 可逆过程的功量: w = ∫ pdv 可逆过程的热量: 可逆过程的热量: q = ∫ Tds
C B A
课后题1 课后题1-5;1-6;1-9
(c)系统内部状态参数不随时间而变化 (d)系统内部状态不发生改变 2.均质等截面杆的两端的温度由分别维持 2.均质等截面杆的两端的温度由分别维持 t1 t2的两热源保持 t1 t2 不变,取此杆为系统, 不变,取此杆为系统, 则系统处于( 则系统处于(B)。 平衡状态, (a)平衡状态,因其各截面温度不随时间改 变 非平衡状态, (b)非平衡状态,因其各截面温度不等 平衡状态, (c)平衡状态,因其各截面温度不随时间改 变,且流入系统的热量等于流出系统的热量 非平衡状态, (d)非平衡状态,因其处于重力场
4.基本状态参数:温度、压力、 4.基本状态参数:温度、压力、比体积 基本状态参数 温度: (1)温度:是热平衡的惟一判据
t = T − 273.15
(2)压力Βιβλιοθήκη p = B + pg
p = B−H
(3)比体积 二、平衡状态、状态公理及状态方程 平衡状态、 1.定义 是指在没有外界作用的情况下, 定义: 1.定义:是指在没有外界作用的情况下, 系统的宏观性质不随时间变化的状态。 系统的宏观性质不随时间变化的状态。 2.实现平衡的条件: 2.实现平衡的条件:系统内部及系统与外界 实现平衡的条件 之间各种不平衡势差消失
热力学 第一章

(3)状态参量:描述热力学系统平 衡状态的宏观性质的物理量。
描述系统状态的宏观参量一般可以 直接测量。
广延量和强度量
3、均匀系与非均匀系
(1)均匀系:一个系统各部分的性质完全
一致,称为一个均匀系。(也称为一个相 —单相系) (2)非均匀系:复相系
§1.2 热平衡定律和温度
一、热平衡定律(热力学第零定律) 实验
2 3 3 6 1
如果保持温度不变,将1mol的水从1 1000 pn ,求:外界所做的功。
pn
加压到
§1.5 热力学第一定律
一、热量:系统与外界仅由于温度差,通过边界 所传递的能量。(通过分子间的碰撞来实现)
Q 过程量 热量是能量传递的另一种方式 Q 0 系统从外界吸收热量
Q 0 系统向外界放出热量
3 6 2 3
1
§1.6 热容量和焓
一、热容量
1、引入:桶的装水量(水容量)
M 水容: C h
Q 电容: C U
2、热容量:一个系统在某一过程中温度升 高1K所吸收的热量。
Q C lim T T dQ C dT
单位:焦耳/开尔文 J / K
3、系统的质量对热容量的影响:
an2 ( p 2 )(V nb) nRT V
1mol : a ( p 2 )( v b) RT v
3、简单固体和液体:
V (T , p) V0 (T0 ,0)1 (T T0 ) KT p
例1、一个简单可压缩系统,已知
nR 1 a ; KT pV p V
作业:1、1mol理想气体,在27℃的恒温下 发生膨胀,其压强由 20Pn 准静态地降到 1Pn ,求:气体所做的功和所吸取的热量。 2、在27℃,压强在0至 1000pn 之间,测得 水的体积为V (18.066 0.71510 p 0.04610 p )cm mol 如果保持温度不变,将1mol的水从1 pn 加压至 1000pn ,求:外界所做的功。
工程热力学 第一章基本概念

简单可压缩系统
压缩功 膨胀功
简单可压缩系统的独立变量数
只交换热量和一种准静态的容积变化功
简单可压缩系统:N = n + 1 = 2
The state of a simple compressible system is completely specified by two independent properties
强度参数:与物质的量无关的参数
如压力 p、温度T
强度参数与广延参数
广延参数:与物质的量有关的参数可加性
如 质量m、容积 V、内能 U、焓 H、熵S
比参数:
V v m 比容
U u m 比内能
H h m 比焓
S s m 比熵
单位:/kg /kmol 具有强度参数的性质
强度参数变化量与路径无关,只与 初终态有关。 数学上:
2 2 2
点函数、态函数
1
point function
a b
2
dz dz dz z2 z1
1 1, a 1,b
dz 0
例:温度变化 山高度变化
状态参数的微分特征 dz是全微分 设 z =z (x , y)
O
5 t[ C ] (t[ F ] 32) 9
O
t[ F ] t[ R] 459.67
Temperature Measurement Devices
日常:水银温度计,酒精温度计, thermometer
工业:热电偶 Thermocouple 热电阻 Resistance temperature detector 辐射温度计Radiation thermometer
1、定义:
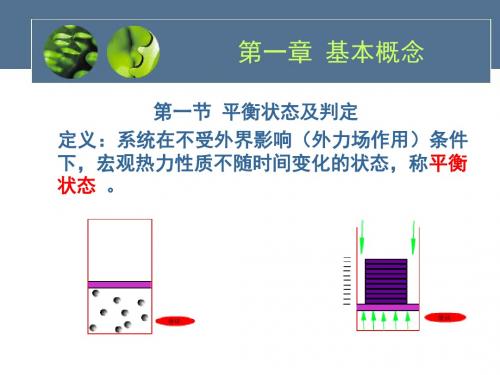
在不受外界影响的条件下(重力场除 外),如果系统的状态参数不随时间变化, 则该系统处于平衡状态。
《工程热力学》第一章 基本概念

9
1.3.1、基本术语-状态、状态参数
1、状态:工质在热力变化过程中某一瞬间所呈现的宏观 物理状况称状态
2、状态参数:表示状态特征的物理量称为状态参数
状态与状态参数是一一对应的
3、状态参数特点
数学特征为点函数: 微元变化的微增量具全微分性质
4、热力学基本状态参数为三个:比容、压力、 温度
10
1.3.2、基本状态参数--比容及密度
C 1 2 B B A
16
1-4
平衡状态、状态方程式、坐标图
1.4.1 平衡状态与非平衡态 平衡状态:系统在不受外界影响的条件下, 如果宏观热力性质不随时间而变化,系统 内、外同时建立了热平衡、力平衡(及 化学平衡),此时系统所处状态为平衡态 非平衡态: 系统与外界,系统内部各部分间 存在能量传递及相对位移,状态将随时间 变化,称系统处于非平衡态
受逐渐变化的压力作用下的活塞的移动过程 发生系统状态变化 (力作用)(NEXT)
受变化的恒温热源缓慢加热的活塞系统发生 系统状态变化(热的作用) (NEXT)
26
P3 P2
P1
工质 工 质
工质
受逐渐变化压力作用下的活塞移动过程发生系 统状态变化(P、V、T变化) (力作用)
27
工质
工质
工质
热源T
31
1-6
过程功与热量
1.6.1 功的定义: 1、功的力学定义: 将物体间通过力的作用而传递的能量称为功并 定义:功等于力F与物体在力作用方向上的位移X 的乘积(点积) dW = F ·dX 2、功的热力学定义: 热力学系统和外界通过边界而传递的能量, 其效果可表现为举起重物
区别:功与系统动能、重力位能等“储存能”变化传递 的机械能的本质区别
工程热力学---第1章 基本概念

pv RgT
实际气体(real gas; imperfect gas)的状态方程
范德瓦尔方程
R—K方程
a p 2 v b v
RgT
a p 0.5 v b T v(v b)
RgT
(a,b为物性常数)
27
三、状态参数坐标图
一简单可压缩系只有两个独立参数,所以 可用平面坐标上一点确定其状态,反之任一状 态可在平面坐标上找到对应点,如:p-v、T-s。
a)刚性的或可变形的或有弹性的 b)固定的或可移动的 c)实际的或假想的
边界示意图
10
汽缸-活塞装置(闭口系例)
11
汽车发动机(开口系示例)
12
热力系分类
按照组元和相数分 单元系 多元系 按系统与外界能质交换分 单相系 复相系
闭口系—closed system 控制质量CM) —没有质量越过边界 开口系—open system (控制体积CV) —通过边界与外界有质量交换
所有状参一一对应相等
简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
状态法则:系统独立状态参数的数目N等于系统对外所 作广义功的数目n加1,即N=n+1.
20
基本状态参数
温度
热力学第零定律(R.W. Fowler in 1931) 如果两个系统分别与第三个系统处于 热平衡,则两个系统彼此必然处于热平衡。
dx 0
ห้องสมุดไป่ตู้
2、分类 #可逆循环与不可逆循环,状态参数坐标图上表示。 正向循环:输出功,热能 目的 机械能 Q 高温热源
逆向循环:消耗功,低温热源
二、正向循环(动力循环)
wnet t 1 q1
6 6 6
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.1 热力学系统
1.1.1 热力学系统的定义
系 统 (System): 作为热力学研究对象的物质或空 间被称为热力学系统,简称热力系。
边 界 (Boundary):将系统从其周围环境中分离出来 的,真实的或是假想的表面称为边界。
环境 (Surrounding):又称为外界,热力系边界以外 的任何物质与空间均称为环境。
热力系的边界可以是真实的也可以是假想的;可以是固定的也 可以是可变的
1.1.2 热力系的分类
封闭热力系 (Closed system ) :
与外界仅有能量交换而无物质交换的热力系,也称 为闭口系。 ( 因热力系内部质量不变又被称为控制 质量 Control Mass )
开口热力系(Opened system ):
Hale Waihona Puke SI:摄氏温标(Celesuis scale)
English: 华氏温标(Fahrenheit scale)
named after the German instrument maker G.Fahrenheit (1686-1736)
热力学温标:
SI:
开氏温标(Kelvin scale)
English: 朗肯温标(Rankine scale)
工业:热电偶 Thermocouple 热电阻 Resistance temperature detector 辐射温度计Radiation thermometer
计量:铂电阻温度计 Platinum
1.4.3 比容( specific volume )
vV m
m3/kg
1.5 状态公理
热力系的状态是由状态参数描述的。 但是需要已知多少这个里状的态“参纯数”就,可主以要确定一个 状态呢?需要穷举指法相么态?纯,并非指单
温标间关系:
T (K) T (。C) 273 .15 T (R) T (。F) 459 .67
T (。F) 1.8T (。C) 32
T (R) 1.8T (K)
约定:
今后用摄氏温标表示的温度用字母 t 指代,用开氏温 标表示的温度用 T 指代。
1.4.2.4 常用温度测量仪表
日常:水银温度计,酒精温度计, thermometer
比参数具有强度参数的性质
1.4 基本状态参数
压力、温度、比容——易于测量
1.4.1 压力(Pressure)
1.4.1.1 压力的定义
物理中压强
单位:
P F A
SI:
Pa--------N/m2
English: psi------bf/in2
常用压力单位有:MPa,bar,kgf/cm2 1bar=105 Pa = 0.1 MPa ≈1 kgf/cm2 1atm=101,325 Pa
绝对压力?表压力? 真空度? woooooooo!
哪一个是状态参数?
1.4.2 温度(Temperature)
什么是温 度?
我认为应该是 指物体冷热的 程度。
对么?
首先由 R. H. Fowler 于1931年提出
1.4.2.1 热力学第零定律
如果两个热力系分别与第三个热力系处于热平衡, 那么这两个热力系之间必然互相处于热平衡。
非平衡态:
1.2.3 平衡的条件
•热平衡 •力平衡 •化学平衡 •相平衡
1.3 系统的状态参数
1.3.1 定义
从某一角度描述系统热力学状态的宏观特性量称为 状态参数
1.3.2 状态参数的特征
只与状态一一对应,而与状态变化时所经历的中间 过程无关
用数学描述,即为:
∮dx = 0
1.3.3 状态参数的分类
质 状态公理
对于可压缩纯物质体系,只要“两个” 独立的强度 参数就可以确定其状态
1 . 6 热力学状态参数图
由于两个独立状态参数决定一个状态,那么用二维的坐 标图显示状态就顺理成章
p
平衡态 非平衡态
v
常用的状态参数坐标图有: p-v 图, T-s 图, h-s 图
古典热力学只 研究平衡态,
既然平衡还怎 1 . 7 过程与循环
1.4.2.2 温度的热力学定义
温度是确定一个系统是否与其它系统处于热平衡的物理量
1.4.2.3 温标 温标——温度的标度 温标的三要素 : • 0点 • 两个基准点 ( 易于重现 ) • 标度
历史上的温标
Formerly called the centigrade scale, in 1948 it was renamed after the Swedish astronomer A.Celsuis (1701-1744)
≈1 bar
=14.696 psi
“实际”二字指由公式
1.4.2 表压力和真空度P=F/A计算所得值
绝对压力: 某一给定点的实际压力
压力表
表压力:绝对压力高于大气压(Pb)的部分,以 Pg 表达
Pg P Pb
真空度:绝对压力低于大气压的部分,以 Pv表示
Pv Pb P
pg
p
pv
pb p
强度参数: 与热力系的质量或尺度无关且不可相加的参数,如:
温度(T)、压力(强)(P)等
广延参数: 与热力系的质量或尺度相关且可以相加的参数,如:
质量(m)、体积(V)、焓(H)、熵(S)等
比参数: 单位化(质量或摩尔)的广延参数,如: 比容(v=V/m)、比焓(h=H/m)、比熵(s=S/m)等
If two bodies are in thermal equilibrium with a third body, they are also in thermal equilibrium with each other.
处于同一热平衡状态的各个热力系,必定有某一宏观 特征彼此相同,用于描述此宏观特征的物理量 温度。
么变化呢?
1.7.1过程
热力系从一个平衡态变化到另一个平衡态所经历所有状 态的集合
准静态过程:
如果一个热力过程进行得无限缓慢使得过程进行时 热力系内部随时都无限逼近于平衡态,则此过程为 准静态过程
和外界既有能量交换又有物质交换的热力系 (也称为 控制体积control volume )
孤立热力系 : 与外界既无能量交换也无物质交换的热力系
宇宙
1.2 状态与平衡
1.2.1 状态
某一时刻热力系所有宏观特性量的集合叫做状态
1.2.2 状态的分类:
平衡态: 系统中任何一部份的特性完全相同。 系统中任何一部份的特性不随时间变化。
1.1.1 热力学系统的定义
系 统 (System): 作为热力学研究对象的物质或空 间被称为热力学系统,简称热力系。
边 界 (Boundary):将系统从其周围环境中分离出来 的,真实的或是假想的表面称为边界。
环境 (Surrounding):又称为外界,热力系边界以外 的任何物质与空间均称为环境。
热力系的边界可以是真实的也可以是假想的;可以是固定的也 可以是可变的
1.1.2 热力系的分类
封闭热力系 (Closed system ) :
与外界仅有能量交换而无物质交换的热力系,也称 为闭口系。 ( 因热力系内部质量不变又被称为控制 质量 Control Mass )
开口热力系(Opened system ):
Hale Waihona Puke SI:摄氏温标(Celesuis scale)
English: 华氏温标(Fahrenheit scale)
named after the German instrument maker G.Fahrenheit (1686-1736)
热力学温标:
SI:
开氏温标(Kelvin scale)
English: 朗肯温标(Rankine scale)
工业:热电偶 Thermocouple 热电阻 Resistance temperature detector 辐射温度计Radiation thermometer
计量:铂电阻温度计 Platinum
1.4.3 比容( specific volume )
vV m
m3/kg
1.5 状态公理
热力系的状态是由状态参数描述的。 但是需要已知多少这个里状的态“参纯数”就,可主以要确定一个 状态呢?需要穷举指法相么态?纯,并非指单
温标间关系:
T (K) T (。C) 273 .15 T (R) T (。F) 459 .67
T (。F) 1.8T (。C) 32
T (R) 1.8T (K)
约定:
今后用摄氏温标表示的温度用字母 t 指代,用开氏温 标表示的温度用 T 指代。
1.4.2.4 常用温度测量仪表
日常:水银温度计,酒精温度计, thermometer
比参数具有强度参数的性质
1.4 基本状态参数
压力、温度、比容——易于测量
1.4.1 压力(Pressure)
1.4.1.1 压力的定义
物理中压强
单位:
P F A
SI:
Pa--------N/m2
English: psi------bf/in2
常用压力单位有:MPa,bar,kgf/cm2 1bar=105 Pa = 0.1 MPa ≈1 kgf/cm2 1atm=101,325 Pa
绝对压力?表压力? 真空度? woooooooo!
哪一个是状态参数?
1.4.2 温度(Temperature)
什么是温 度?
我认为应该是 指物体冷热的 程度。
对么?
首先由 R. H. Fowler 于1931年提出
1.4.2.1 热力学第零定律
如果两个热力系分别与第三个热力系处于热平衡, 那么这两个热力系之间必然互相处于热平衡。
非平衡态:
1.2.3 平衡的条件
•热平衡 •力平衡 •化学平衡 •相平衡
1.3 系统的状态参数
1.3.1 定义
从某一角度描述系统热力学状态的宏观特性量称为 状态参数
1.3.2 状态参数的特征
只与状态一一对应,而与状态变化时所经历的中间 过程无关
用数学描述,即为:
∮dx = 0
1.3.3 状态参数的分类
质 状态公理
对于可压缩纯物质体系,只要“两个” 独立的强度 参数就可以确定其状态
1 . 6 热力学状态参数图
由于两个独立状态参数决定一个状态,那么用二维的坐 标图显示状态就顺理成章
p
平衡态 非平衡态
v
常用的状态参数坐标图有: p-v 图, T-s 图, h-s 图
古典热力学只 研究平衡态,
既然平衡还怎 1 . 7 过程与循环
1.4.2.2 温度的热力学定义
温度是确定一个系统是否与其它系统处于热平衡的物理量
1.4.2.3 温标 温标——温度的标度 温标的三要素 : • 0点 • 两个基准点 ( 易于重现 ) • 标度
历史上的温标
Formerly called the centigrade scale, in 1948 it was renamed after the Swedish astronomer A.Celsuis (1701-1744)
≈1 bar
=14.696 psi
“实际”二字指由公式
1.4.2 表压力和真空度P=F/A计算所得值
绝对压力: 某一给定点的实际压力
压力表
表压力:绝对压力高于大气压(Pb)的部分,以 Pg 表达
Pg P Pb
真空度:绝对压力低于大气压的部分,以 Pv表示
Pv Pb P
pg
p
pv
pb p
强度参数: 与热力系的质量或尺度无关且不可相加的参数,如:
温度(T)、压力(强)(P)等
广延参数: 与热力系的质量或尺度相关且可以相加的参数,如:
质量(m)、体积(V)、焓(H)、熵(S)等
比参数: 单位化(质量或摩尔)的广延参数,如: 比容(v=V/m)、比焓(h=H/m)、比熵(s=S/m)等
If two bodies are in thermal equilibrium with a third body, they are also in thermal equilibrium with each other.
处于同一热平衡状态的各个热力系,必定有某一宏观 特征彼此相同,用于描述此宏观特征的物理量 温度。
么变化呢?
1.7.1过程
热力系从一个平衡态变化到另一个平衡态所经历所有状 态的集合
准静态过程:
如果一个热力过程进行得无限缓慢使得过程进行时 热力系内部随时都无限逼近于平衡态,则此过程为 准静态过程
和外界既有能量交换又有物质交换的热力系 (也称为 控制体积control volume )
孤立热力系 : 与外界既无能量交换也无物质交换的热力系
宇宙
1.2 状态与平衡
1.2.1 状态
某一时刻热力系所有宏观特性量的集合叫做状态
1.2.2 状态的分类:
平衡态: 系统中任何一部份的特性完全相同。 系统中任何一部份的特性不随时间变化。
