现代分析化学作业
现代分析化学 红外 拉曼光谱作业

3.分子的每一种振动自由度是否都能产生一个红外吸收峰并说明原因。
答:不是分子的振动必须伴随偶极矩的变化,即分子振动过程中能引起偶极矩的变化,只有红外活性振动才能产生红外光谱。有些分子可能具有对称伸缩振动(不具有红外活性)而不出现红外吸收峰。
824是苯环上两个氢相邻的面外变形振动 证明苯环是对位二取代
综上所述可以确定其结构为:
8.化合物C6H12,根据如下IR谱图确定结构,并说明依据。
答:该化合物分子式为C6H12,计算其不饱和度为U=1-12/2+6=1;
3079为不饱和碳氢伸缩振动 说明结构中有C=C-H
2960为饱和碳氢伸缩振动 说明结么影响?选择溶剂时应考虑哪些因素?
答: 极性溶剂致使n→π*跃迁发生兰位移。溶剂的极性越大这种兰位移的幅度也就越大。 极性溶剂致使π→π*跃迁K带发生红移。选择溶剂时应考虑溶剂本身的透明范围、溶剂对溶质的惰性、溶剂对溶质要有良好的溶解性。
5.紫外分光光度计主要由哪几部分所组成?
综上可以判断分子结构为:
12.指出下列异构体所对映的紫外光谱数据:
λmax:235 εmax:12000(A); >220nm无强吸收(B)
13.从本质上阐述红外吸收光谱法比紫外吸收光谱法更有利于有机化合物的定性分析的原因.
答:与紫外-可见吸收光谱不同,产生红外光谱的红外光的波长要长得多,因此光子能量低。物质分子吸收红外光后,只能引起振动和转动能级跃迁,不会引起电子能级跃迁。在有机物中存在大量的相似结构,用紫外定性分析,难度很大,而红外分析更容易确定有机物结构和官能团类型。
13现代分析化学试题及答案 上师大研究生

1.21世纪现代分析化学的发展方向和目标是什么?答:2.原子光谱主要包括哪几方面的技术?并简述ICP-AES和ICP-TOFMS技术的特点?答:原子光谱主要包括原子发射光谱(AES)、原子吸收(AA)、原子荧光光谱(AFS)、和原子质谱(AMS)四个方面的技术;ICP-AES技术,即电感耦合等离子体原子发射光谱技术,仪器特点:检出限低,检出灵敏度高。
(可检出ng/ml级含量)分析精密度高。
(例:被分析元素的浓度为其检出限的100倍时,精密度可达1%)分析动态范围小。
(工作曲线的直线范围可达4-5个数量级)基体效应小。
多元素同时分析,分析速度快。
操作简单,使用安全。
应用范围:主要用于微量元素的分析,可分析的元素为大多数的金属和硅、磷、硫等少量的非金属,共72种。
广泛地应用于质量控制的元素分析,超微量元素的检测,尤其是在环保领域的水质监测。
还可以对常量元素进行检测,例如组分的测量中,主要成分的元素测定。
ICP-TOFMS技术,即电感耦合等离子体飞行时间质谱仪技术,3.什么是光谱电化学联用技术?与电化学方法连用的光谱技术主要有哪些?答:光谱电化学联用技术就是将电化学分析方法与光谱分析方法相结合的联用技术。
按其光谱检测手段的不同,具体可分为紫外-可见光谱电化学、红外光谱电化学、激光拉曼光谱电化学、电子自旋共振波谱电化学、核磁共振电化学等4.什么是超分子化学?请举三类基于超分子化学的分析方法?答:5.简述毛细管电泳的基本原理和特点。
答:6.生物传感器的探头有哪两个主要部分?在探头上固定生物功能物质的方法有哪些?通常考察传感器性能的指标有哪些?答:7.什么是流动注射分析(Flow Injection Analyze)?FIA有哪些方面的应用?答:8.谈谈你所了解的芯片(Lab on Chip)分析技术。
答:9.什么是表面等离子体共振技术?有哪些优点?请简述SPR应用。
答:10.请简述你对今后研究方向的设想和计划。
分析化学Z1-6作业

A型题:1. 分析化学是化学学科中的一个重要分支,分析化学的主要任务不包括C.明确物质的合成方法2。
已知某混合试样A、B、C三组分在硅胶薄层色谱上的Rf值的大小顺序为A>B>C,问三组分的极性大小顺序为:B.C>B>A3。
红外光谱法对制样的要求错误的是:B.样品可以含大量水4。
以下对于测定紫外吸收光谱时溶剂的选择,叙述错误的是:D.在所测定的波长范围内,溶剂本身有吸收5。
分离度R的计算式为:B。
6. 沉淀的类型与聚集速度有关,影响聚集速度的主要因素是:E。
相对过饱和度7。
下列不是增大沉淀物溶解度的因素是:C.同离子效应8. 一组分析数据标准偏差的计算式应为:B. 必须采用间接法配制标准溶液的物质9. 气相色谱法中“死时间"的准确含义是:E.完全不与固定相作用组分流经色谱柱的时间10。
HPLC与GC比较,可以忽略纵向扩散,主要原因是:D.流动相粘度大11. 当共轭体系由顺式变为反式时,其UV光谱的λmax将如何变化B.红移12. HAc 的pKa=4。
76,苯甲酸C6H5COOH 的Ka=4。
19,HCOOH的pKa=3.75,HCN 的pKa=9。
21,据此,不能用标准碱溶液直接滴定0。
1 mol/L 的酸应是:E。
HCN13. 草酸钠溶液与0。
04000mol/ L KMnO4溶液反应,反应完成时两种溶液消耗的体积相等,两者反应的物质的量之比为:2KMnO4~5Na2C2O4, 则草酸钠的浓度B。
0。
1000mol/L14. 提高配位滴定选择性,消除共存金属离子干扰的最彻底方法是C.沉淀掩蔽法15。
当单色光通过一吸光介质后:A。
透光率一般小于116. 必须采用间接法配制标准溶液的物质E.NaOH17. 根据条件电位定义式,以下选项错误的是:E。
式中α≤118. 对氧化还原滴定,以下叙述错误的是:B。
只要氧化还原反应的≥0.4V,就一定可以用于氧化还原滴定19. 在下面各种振动模式中不产生红外吸收带的是:D.二氧化碳分子中O=C=O对称伸缩振动20。
现代分析化学作业

现代分析化学作业大连理工大学研究生院
1.请解释生物化学中常用的荧光探针的工作原理
答:大多数PET荧光分子探针的设计是基于受体与客体结合,使光诱导电子转移作用受到抑制,荧光团发射出强烈荧光的原理,但是当与过渡金属作用时,结果有时会发生变化。
由于过渡金属3d电子的氧化还原行为,可以发生从荧光团到键合过渡金属的电子转移,或者从过渡金属到荧光团的电子转移,因此可以通过无辐射能量转移导致荧光淬灭。
化合物4受体冠醚为硫杂冠醚,众所周知,硫杂冠醚与Cu2+有强的亲和能力,该分子设计也是基于PET过程,但不同的是,与Cu2+键合后产生了从荧光团到金属离子的PET过程,导致荧光淬灭。
2.A和B化合物的结构如下. 试比较两者产生荧光的能力, 并说明其原因。
后者产生能力大
3.荧光分析法中最常见的光谱干扰来自于___波长____和_振动弛豫_______。
这也是光谱探针开发中要求stoke位移尽可能大以避开干扰的一个原因。
4.由电解着的溶液所产生的光发射称为____荧光光谱发射______。
最常见的电化学发光反应物质是___[Ru(bpy)3]2+___________。
5.为什么在LC-MS中的离子化较适于在常压下进行而不是在减压下进行?哪些接口可在常压下离子化?
答:常压。
传送带接口(MB)
粒子束接口(PB)
直接导入接口(DLI)
连续流动快原子轰击(CFFAB)
热喷雾接口(TSP)
大气压离子化接口(API)
6.什么参数会影响LC-NMR流通池体积和直径的选择?
答:预期的样品量和LC峰的体积,同时还有场强以及利用直接或反相实验所检测的原子核。
现代波谱分析化学第一次作业

1.一般来讲,分子光谱远比原子光谱复杂,原子光谱通常为 线状 光谱,而分子光谱为 带状 光谱。
2.简述影响分子离子峰丰度的主要因素有哪些?①化合物分子的稳定性;②所选用的电离源。
3.饱和脂肪烃化合物裂解的特点是(1)生成一系列 C n H 2n+1+ 质量峰,m/z ,_29__,_43__,_57___;(2)m/z=__43__ 和m/z=_57____峰最强;(3)裂解优先发生在支链处,优先失去较大的烷基。
4.根据下列谱图解析未知化合物的结构,并说明依据。
解:由氮规则知:该化合物分子离子峰为m/z 73,故含有奇数个氮;其可能的分子式为:C 4H 11N ;C 3H 7ON ;①当该化合物分子为C 4H 11N 时,不饱和度U=4–(11–1)/2+1=0;MS 73584430 M +· [M-CH 3·]+ [M-CH 3CH 2·]+ CH 2NH 2+②当化合物分子式为C 3H 7ON 时,不饱和度U=3-(7-1)/2+1=1,不饱和化合物且含有氧、氮,故可能为酰胺;MS解析:m/z 离子主要断裂反应73 M+·58 [M-CH3·]+44 [M-HCO·]+30 CH2NH2+由谱图分析知:该化合物分子离子峰可见(m/z 73),且峰的强度较大,仅次于基峰,故排除结构CH3CH2NHCH2CH3;该化合物可能结构为:5.某化合物C4 H10O,试根据如下谱图推断其结构,并说明依据。
解:不饱和度:U=4-(10-0)/2+1=0,饱和化合物,含氧可能为醚;分子离子峰m/z为74,因此该化合物相对分子质量为74;MS解析:m/z 离子主要断裂反应74 45M+·[M-CH3·]+推测该化合物可能结构为:CH3OCH2CH2CH36.试计算下列化合物的(M+2)/M 和(M+4)/M 峰之强度比:①C7H6Br2;(M+2)/M=2:1;(M+4)/M=1:1②CH2Cl2;(M+2)/M=6:9;(M+4)/M=1:9③C2H4BrCl(忽略13C、2H的影响)。
大学分析化学作业及单元习题

1、某分析天平的称量绝对误差为±0.1mg ,如用减量法称取试样重0.0500g ,相对误 差是多少?如果称取试样1.0000g ,相对误差是多少?从二者的比照中说明什么?()()样的质量小误差,可适当增加试以上结果说明:为了减样样%02.0%1000000.10002.0%1002%4.0%1000500.00002.0%1001r r ±=⨯±=⨯=±=⨯±=⨯=m E E m E E a a2、某试样中氯离子含量经6次测定得:x =35.2 (μg .ml -1), s=0.7(μg .ml -1),计算置信度为90%时平均值的置信区间。
〔n =6,P=90℅时,t =2.02〕mL g n ts /6.02.3567.002.22.35x μμ±=⨯±=±=3、分析石灰石中CaO 质量分数,测定结果为0.5595、 0.5600、 0.5604、 0.5608、0.5623。
用Q 检验法检验可疑数据是否舍去(P=90℅)。
〔n =5,P=90℅时,Q 表=0.64〕,故可疑值不用舍去可疑值为表计邻近可疑计Q Q R Q 〈===54.05595.0-5623.05608.0-5623.0x -x 5623.01、欲使滴定时消耗0.2mol·L -1的HCl 溶液的体积控制在20~30ml ,应称取分析纯Na 2CO 3(M=105.99)约多少克?gg CO Na g CO Na CO Na CO Na m olHC CO Na CO Na HC g CO Na CO Na CO Na m olHC CO Na CO Na HC HC CO Na CO O H NaCl HCl NaHCO NaCl NaHCO HCl CO Na 3.0~2.03.099.105103)M()n()m(10310300.221l)n(21)21n(21)n(30l 2.099.105102)M()n()m(10210200.221l)n(21)21n(21)n(20l l21323-3232323-3-32323-3232323-3-323232223332故应取分析纯的毫升时,溶液的体积为当毫升时,溶液的体积为当,基本单元为=⨯⨯=⋅=⨯=⨯⨯⨯====⨯⨯=⋅=⨯=⨯⨯⨯===++=++=+2、计算以下溶液的滴定度T(X/S)。
华南理工大学 分析化学作业及答案

班级___________________姓名_______________作业编号__________教师评定___________ 2-1 为了探讨某江河地段底泥中工业污染物的聚集情况,某研究单位在该江河的不同地段采集了足够多的原始试样,混匀后随机取出部分试样送到分析室,由分析人员根据国家标准采用适当的方法测定其中有害化学组分的含量。
以上过程中是否存在不合理的步骤?若有应该如何改进?(简答)2-2现有粗碎后试样40 kg,最大颗粒的粒径约为6 mm。
(1)该试样可进行几次缩分?(2)缩分后,再破碎至试样全部通过10号筛(d=2 mm),又可缩分几次?(设K值为0.2)。
2-3测定牛奶、鱼肉等有机样品中重金属含量时通常采用干法或湿法消解处理样品,简单比较一下这两种前处理方法的优劣。
(简答)3-1分析过程中出现下列情况会造成哪种误差或过失?若是系统误差应如何消除?a. 分析试剂中含有微量待测组分b. 移液管转移溶液后尖嘴处残留量稍有不同c. 称量过程中天平零点略有变动d. 基准物质保存不当,结晶水部分风化e. 用NaOH 标准溶液测定某食醋试液总酸度时,碱式滴定管未用NaOH 标准溶液润洗f. 同(e ),锥形瓶未用待测食醋试液润洗g. 沉淀重量法测定某组分含量,过滤时发生穿滤现象,但及时没有发现e. 沉淀重量法测定试样中某组分含量时,共存成分亦产生沉淀3-2 平行6次测定某试样中氮含量的结果如下:20.44%、20.55%、20.59%、20.58%、20.53%和20.50%。
(1)计算该组数据的平均值、平均偏差、相对平均偏差、标准偏差和变异系数;(2)若已知该样品中氮含量的标准值为20.45%,计算以上测定结果的绝对误差和相对误差。
(注意有效数字)3-3 用加热驱除水分法测定O H 21SO Ca 24⋅(纯品)中结晶水的含量。
现称取试样0.2000 g ,所用分析天平称量精度为±0.1 mg ,试问分析结果应保留几位有效数字?简述原因。
分析化学作业及答案

分析化学作业第一章 概述一、选择题1.根据置信度为 95% 对某项分析结果计算后,写出的合理分析结果表达式应为(B )。
a. ( 25.48 ± 0.1) % b. ( 25.48 ± 0.13 ) %c. ( 25.48 ± 0.135 )%d. ( 25.48 ± 0.1348 ) %2.分析测定中的偶然误差,就统计规律来讲,(d )。
a. 数值固定不变b. 数值随机可变c. 无法确定d. 正负误差出现的几率相等3. 某小于1的数精确到万分之一位,此有效数字的位数是( d )。
a.1b.2c.4d.无法确定4. 消除或减小试剂中微量杂质引起的误差常用的方法是( A )。
A.空白实验B.对照实验C.平行实验D.校准仪器5.可用于减小测定过程中偶然误差的方法是( D )。
A .对照实验 B. 空白实验 C .校正仪器 D. 增加平行测定次数6.对某试样进行平行三次测定,得 CaO 平均含量为 30.60% ,而真实含量为 30.30% ,则 30.60%-30.30% = 0.30% 为( B )。
A. 相对误差B. 绝对误差C. 相对偏差D. 绝对偏差二、判断正误1.在分析测定中,测定的精密度越高,则分析结果的准确度越高(x )。
2.有效数字是指所用仪器可以显示的数字( x )。
3.分析结果的置信度要求越高 , 置信区间越小(x )。
4.对某项测定来说,它的系统误差大小是不可测量的(x )。
第二章 滴定分析概论一、选择题1.欲配制 1000ml 0.1mol/L HCl 溶液,应取浓盐酸(B )。
a. 0.84mlb. 8.4mlc. 1.2m ld. 12ml2. .用NaC 2O 4( A )标定KMnO 4( B )时,其反应系数之间的关系为(a )。
a. n A =5/2n B b. n A =2/5n Bc. n A =1/2 n Bd. n A =1/5n B3. .已知1mLKMnO 4相当于0.005682g Fe 2+,则下列表示正确的是( b )。
分析化学网上作业1、2、3——(中南大学)

分析化学网上作业1、2、3(一) 单选题1.下列措施可以减小随机误差的是()。
(C)增加平行测定次数2.化学分析是()。
(A)分析化学是化学学科的一个重要分支,是研究物质的化学组成、含量、结构及其分析方法的学科3.定量分析中,精密度与准确度之间的关系是()。
(C)高精密度是保证准确度的前提4.下列数据中包含三位有效数字的是()。
(A)5.4*1055.在滴定分析测定中,属偶然误差的是()。
(D)滴定管最后一位估读不准确6.n次测定结果平均值的标准偏差与单次测量结果的标准偏差s之间的关系是()。
(C)7.试样用量为0.1~10mg的分析称为()。
(C)微量分析8.测定试样中CaO的质量分数,称取试样0.9080g,滴定耗去EDTA标准溶液20.50毫升,以下结果表示正确的是()。
(C)10.08%9.下列有关随机误差的叙述中不正确的是()。
B)随机误差具有单向性10.下列表述中,最能说明随机误差小的是()。
(A)高精密度1.用Ca2+为沉淀剂,测定四草酸氢钾,最后灼烧烧成CaO,求CaO对KHC2O4?H2C2O4?2H2O的换算因数()。
(D)2.2662.用0.1mol/L的HCl溶液滴定同浓度的时,适宜的指示剂为()。
(C)甲基红(pkHIn=5.0)3.标定HCl可用的基准物质是()。
(B)Na2CO34.已知H3PO4的pKa1=2.12,pKa2=7.20,pKa3=12.36,今有一磷酸盐溶液,测得其pH=7.0,则其主要存在形式是()。
(B)H2PO4-+HPO42-5.下图滴定曲线的第一化学计量点适用的指示剂为()(B)甲基橙(pH变色范围为3.1~4.4)6.共轭酸碱对的Ka与Kb的关系是()。
(B)KaKb=Kw7.用25mL常量滴定管进行滴定分析时,耗用标准溶液的体积应控制在(单位:mL)()。
(C)20~258.在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。
现代分析化学平时练习题

1.用于有机结构分析常用的有机波谱方法有哪些?
分子荧光光谱法、分子磷光光谱法、红外光谱法、紫外光谱法、核磁共振谱、顺磁共振谱
2.现代分析化学的发展概况及其发展趋势。
现代分析化学已远远超出化学学科的领域,它正把化学与数学,物理学,计算机科学,生物学结合在一起,已经发展成一门多学科为基础的综合性科学。
现代分析化学的发展方向是高灵敏度(达原子级、分子级)、高选择性(复杂体系分析)、智能化(专家系统)、自动化(计算机技术)、联用化(不同分析方法的联用)、并向实时、在线的动态分析方向纵深发展。
3. Franck-condon原理从理论上解释了光波谱的_谱峰形状_和_强度_分布等问题的实质。
4.解释硬离子化方法(如电子轰击离子化)和软离子化方法之间的差别
硬离子化方法会产生大量的碎片离子,而软离子化方法往往是形成准分子离子。
5.如何判断分子离子峰?当分子离子峰不出现时,怎么办?
1、分子离子峰一定是质谱中质荷比数最大的峰。
2、分子离子峰应具有合理的中性丢失。
3、分子离子峰质量数符合N规则。
此外还可以根据化合物的性质进行判断。
如果分子离子峰不出现可以:1、制备挥发衍生物。
2、降低电离能量,增加进样量。
3、采取软电离方式。
6.某未知物的质谱所示,试给出其分子结构及峰归属。
7.分子式C8H10O的未知物质谱如图所示,写出结构式。
8.除同位素离子峰外,如果存在分子离子峰,则其一定是m/z___最大__的峰,它是分子失去一个电子生成的,故其m/z是该化合物的__分子量___它的相对强度与分子的结构及__稳定性_有关。
现代分析化学试题及答案

现代分析化学试题及答案一、选择题(每题2分,共20分)1. 以下哪种仪器不属于色谱分析仪器?A. 气相色谱仪B. 液相色谱仪C. 质谱仪D. 原子吸收光谱仪答案:D2. 原子吸收光谱法中,样品的原子化方式不包括以下哪种?A. 火焰原子化B. 石墨炉原子化C. 电感耦合等离子体原子化D. 化学发光原子化答案:D3. 质谱分析中,以下哪种离子源不适合分析生物大分子?A. 电子轰击源B. 快原子轰击源C. 基质辅助激光解吸离子源D. 热喷雾离子源答案:A4. 在电化学分析中,以下哪种电极不是基于氧化还原反应的?A. 玻璃电极B. 铂电极C. 银/氯化银电极D. 汞电极答案:A5. 以下哪种物质不能用于酸碱滴定?A. 盐酸B. 氢氧化钠C. 硫酸D. 蔗糖答案:D6. 红外光谱中,以下哪种官能团不会产生吸收峰?A. 羰基B. 羟基C. 炔基D. 烷基答案:D7. 核磁共振氢谱中,以下哪种化合物的氢原子化学位移最大?A. 甲烷B. 乙醇C. 乙酸D. 苯答案:C8. 以下哪种方法不属于色谱分离技术?A. 纸色谱B. 薄层色谱C. 毛细管电泳D. 离心分离答案:D9. 以下哪种仪器不适用于元素分析?A. 元素分析仪B. 红外光谱仪C. 质谱仪D. 原子吸收光谱仪答案:B10. 在紫外-可见光谱分析中,以下哪种物质不会产生吸收?A. 芳香族化合物B. 金属络合物C. 蛋白质D. 糖类答案:D二、填空题(每题2分,共20分)1. 色谱分析中的固定相可以是__________或__________。
答案:固体/液体2. 质谱分析中,__________离子源适用于分析大分子化合物。
答案:基质辅助激光解吸3. 原子吸收光谱法中,火焰原子化的温度通常在__________左右。
答案:2000-3000K4. 电化学分析中,__________电极是一种常用的pH敏感电极。
答案:玻璃5. 酸碱滴定中,滴定终点的确定可以通过__________或__________来实现。
现代分析化学技术习题课(2005)

5)核磁共振碳谱 C13NMR 分子中有9个碳, C13NMR中只有7个峰,分子有对称性。
δ
偏共振多重性
12
q
60
t
115~142
d
s
s
165 2020/6/14
s
归属
CH3
CH2 CH C C C
推断
CH3-CH2
-CH2-CH3 苯环上没取代的碳 苯环上取代的碳 苯环上取代的碳
C=O碳
5)推断结构
应 m/z=63
m/z=50
m/z=43
H3C O
O C CH3
O C CH3
m/z=43
m/z=150
O
H3C O
C
m/z=135
H3C O
O
2020/6/14
m/z=108
m/z=92
H3C O
m/z=107
m/z=77
2020/6/14
30.根据如下MS和IR谱图确定化合物(M=78)结构,并说明依据。 50
850
1638 1510 1610 1680 1280
1)紫外光谱UV
218nm,289nm K带红移表明苯环供电基和共轭基团取代。
2)红外光谱IR
❖ ~3330 cm-1,3420cm-1,双峰,N-H伸缩振动,伯胺NH2 ❖ 3030cm-1,芳环C-H伸缩振动 ❖ 1610cm-1, 1510cm-1 芳环骨架振动 ❖ 1580cm-1, 1450cm-1 芳环骨架振动 ❖ 1680cm-1,强峰,C=O 伸缩振动(共轭) ❖ 850cm-1, 苯环对位取代 ❖ 1280 cm-1, C-O-C伸缩振动(酯(ester)吸收带)
三重峰
现代波谱分析化学第三次作业
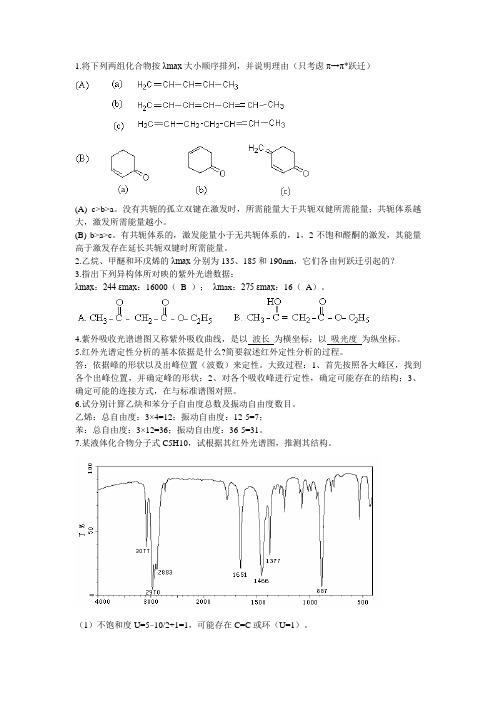
1.将下列两组化合物按λmax大小顺序排列,并说明理由(只考虑π→π*跃迁)(A) c>b>a。
没有共轭的孤立双键在激发时,所需能量大于共轭双健所需能量;共轭体系越大,激发所需能量越小。
(B) b>a>c。
有共轭体系的,激发能量小于无共轭体系的,1,2-不饱和醛酮的激发,其能量高于激发存在延长共轭双键时所需能量。
2.乙烷、甲醚和环戊烯的λmax分别为135、185和190nm,它们各由何跃迁引起的?3.指出下列异构体所对映的紫外光谱数据:λmax:244 εmax:16000(B );λm ax:275 εmax:16(A)。
4.紫外吸收光谱谱图又称紫外吸收曲线,是以波长为横坐标;以吸光度为纵坐标。
5.红外光谱定性分析的基本依据是什么?简要叙述红外定性分析的过程。
答:依据峰的形状以及出峰位置(波数)来定性。
大致过程:1、首先按照各大峰区,找到各个出峰位置,并确定峰的形状;2、对各个吸收峰进行定性,确定可能存在的结构;3、确定可能的连接方式,在与标准谱图对照。
6.试分别计算乙炔和苯分子自由度总数及振动自由度数目。
乙烯:总自由度:3×4=12;振动自由度:12-5=7;苯:总自由度:3×12=36;振动自由度:36-5=31。
7.某液体化合物分子式C5H10,试根据其红外光谱图,推测其结构。
(1)不饱和度U=5-10/2+1=1,可能存在C=C或环(U=1)。
(2)谱峰归属1 3077cm-1双键=C-H伸缩振动,可能是烯烃2 2970 cm-1~2883 cm-1CH3或CH2的C-H伸缩振动3 1651 cm-1C=C伸缩振动4 1466 cm-1CH3的C-H不对称伸缩振动或CH2的剪式振动5 1377 cm-1CH3的C-H对称变形缩振动6 887 cm-1末端烯烃,同碳二取代C-H变形振动特征吸收峰(3)可能结构8.化合物C6H12,根据如下IR谱图确定结构,并说明依据。
兰大《分析化学》22春平时作业一

《分析化学》22春平时作业1-000011.使用铬黑T指示剂合适的pH范围是()选项A: 5~7选项B: 1~5选项C: 7~10选项D: 10~12参考答案:C2.用铁铵矾指示剂法测定Cl-时,若不加硝基苯等保护沉淀,分析结果会( )选项A:偏高选项B:偏低选项C:准确选项D:不影响参考答案:B3.在薄层色谱中,以硅胶为固定相,有机溶剂为流动相,移动速度快的组分是()选项A:极性大的选项B:极性小的选项C:挥发性大的选项D:挥发性小的参考答案:B4.下列各量中,描述测量值精密度的量是( )选项A:相对误差选项B:绝对误差选项C:标准偏差选项D:真值参考答案:C5.配位滴定终点所呈现的颜色是()。
选项A:游离的金属离子的颜色选项B: EDTA与待测离子形成的配合物的颜色选项C:游离的金属指示剂的颜色选项D:金属指示剂与待测离子形成的配合物的颜色参考答案:C6.配制Na2S2O3时,加入少量Na2CO3的目的是( )选项A:作抗氧剂选项B:增强Na2S2O3的还原性选项C:中和Na2S2O3溶液的酸性选项D:防止嗜硫细菌生长和Na2S2O3分解参考答案:D7.选择酸碱指示剂时,下列那种因素不需考虑()。
选项A:化学计量点的pH选项B:指示剂变色范围选项C:指示剂的物质的量选项D:滴定方向参考答案:C8.用KMnO4溶液滴定C2O42-时,滴定速度控制正确的是( )选项A:慢快慢选项B:快慢慢选项C:始终缓慢滴定选项D:始终较快滴定参考答案:A9.下列关于滴定度的叙述,正确的是:()选项A: 1g标准溶液相当被测物的体积(mL)选项B: 1ml标准溶液相当被测物的质量(g)选项C: 1g标准溶液相当被测物的质量(mg)选项D: 1mL标准溶液相当被测物的体积(mL)参考答案:B10.用EDTA滴定M2+时,下列情况能够增大滴定突跃的是:()选项A:固定CM使K/MY减小选项B:使K/MY固定减小CM选项C:增大CM和K/MY选项D:减小CM和K/MY参考答案:C11.一般情况下,下列哪种措施可提高反应速度( )选项A:降低温度选项B:降低反应物浓度选项C:升高温度选项D:增加反应物浓度选项E:加入正催化剂参考答案:C,D,E12.用两次测量法测定溶液的pH值得目的是( )选项A:消除玻璃电极的酸差选项B:消除玻璃电极的碱差选项C:消除公式中的常数K选项D:稳定pH值选项E:消除玻璃电极的不对称电位参考答案:C,E13.某弱酸的H2A的分布系数与( )有关选项A:Ka1选项B:Ka2选项C:溶液的pH值选项D:酸总浓度c选项E:溶液的活度系数参考答案:A,B,C14.单纯开裂电子分配通常有( )选项A:均裂选项B:异裂选项C:半异裂选项D:重排开裂选项E:Mclafferty参考答案:A,B,C15.下列关于沉淀溶解度叙述正确的是( )选项A:一般来讲,物质的溶解度随温度升高而增加选项B:同一沉淀物,其小颗粒的溶解度小于大颗粒的溶解度选项C:同一沉淀物,其表面积愈大则溶解度愈大选项D:沉淀反应中的陈化作用,对一样大小的沉淀颗粒不起作用参考答案:A,C,D16.以下标准溶液可以用直接法配制的是( )选项A:KMnO4选项B:NaOH选项C:K2Cr2O7选项D:Na2C2O选项E:C6H5COOH参考答案:C,D,E17.EDTA与被测离子的反应,如下情况时,可采用返滴定法( )选项A:反应速度快缺乏变色敏锐的指示剂选项B:反应可趋于完全,反应速度慢选项C:生成的配合物不稳定选项D:符合滴定分析的要求,且有合适的指示剂选项E:某种指示剂对被测离子有封闭现象。
现代分析化学作业

文章标题:红外光谱、拉曼和紫外作业发文时间:2012-12-03 10:14:04要求于12月10日前提交。
--------------------------------------------1.化合物能发生n-σ*跃迁,为227nm(ε为900)。
试问:若在酸中测量时,该吸收峰会怎样变化?为什么?2.某化合物根据红外光谱及核磁共振谱推定其结构可能为(A)或(B),而测其紫外光谱为为284nm(ε9700),试问结构何种?3.某化合物C8H9NO2,试根据如下谱图推断其结构,并说明依据。
4.某酮类化合物的溶剂由非极性溶剂改为极性溶剂时,对n→π*、π→π*跃迁有何影响?用能级图说明。
5.根据如下红外光谱图回答问题。
(1)指出该化合物的类型;(2)归属各谱峰;并说明各谱峰反映的结构特征。
6.某化合物C8H10O ,根据下列谱图解析此化合物的结构,并说明依据。
7.试说明共振拉曼效应。
8.化合物C6H15N,根据如下Raman光谱图回答问题。
a) 指出该化合物的类型;b) 3368 cm-1和3310 cm-1谱峰对应化合物中什么基团的何种振动形式;c) 2937 cm-1和2855 cm-1谱峰对应化合物中什么基团的何种振动形式;d) 1443 cm-1谱峰对应化合物中什么基团的何种振动形式;e) 782 cm-1谱峰对应何种振动形式;9.某化合物分子式为C6H15N,根据如下IR和1H NMR谱图推断其结构.10.化合物CH3-(C=O )-CH=C(CH3)2 在正丁烷与水中均能出现两个吸收带,一对是230nm1和329nm,这是在______为溶液中测定。
另一对是243nm和305nm,这是在____为溶液中测定。
11.计算下列化合物UV光谱的最大吸收波长:12.试分别计算乙炔和苯分子自由度总数及振动自由度数目。
13.分别预测下列化合物在红外光谱中那一区段有吸收,各因什么振动类型引起?文章标题:绪论和质谱作业发文时间:2012-10-10 11:22:44要求于10月21日前提交。
分析化学课后作业及详解

第一章不定量分析化学概论1.指出下列情况各引起什么误差,若是系统误差,应如何消除?(1)称量时试样吸收了空气中的水分(2)所用砝码被腐蚀(3)天平零点稍有变动(4)试样未经充分混匀(5)读取滴定管读数时,最后一位数字估计不准(6)蒸馏水或试剂中,含有微量被测定的离子(7)滴定时,操作者不小心从锥形瓶中溅失少量试剂2.某铁矿石中含铁39.16%,若甲分析结果为39.12%,39.15%,39.18%;乙分析结果为39.19%,39.24%,39.28%。
试比较甲、乙两人分析结果的准确度和精密度。
3.如果要求分析结果达到0.2%或1%的准确度,问至少应用分析天平称取多少克试样?滴定时所用溶液体积至少要多少毫升?4.甲、乙二人同时分析一样品中的蛋白质含量,每次称取2.6g,进行两次平行测定,分析结果分别报告为甲:5.654%5.646%乙:5.7%5.6%试问哪一份报告合理?为什么?5.下列物质中哪些可以用直接法配制成标准溶液?哪些只能用间接法配制成标准溶液?FeSO4H2C2O4·2H2OKOHKMnO4K2Cr2O7KBrO3Na2S2O3·5H2OSnCl26.有一NaOH溶液,其浓度为0.5450mol·L-1,取该溶液100.0ml,需加水多少毫升才能配制成0.5000mol·L-1的溶液?7.计算0.2015mol·L-1HCl溶液对Ca(OH)2和NaOH的滴定度。
8.称取基准物质草酸(H2C2O4·2H2O)0.5987溶解后,转入100ml容量瓶中定容,移取25.00ml标定NaOH标准溶液,用去NaOH溶液21.10ml。
计算NaOH溶液的量浓度。
9.标定0.20mol·L-1HCl溶液,试计算需要Na2CO3基准物质的质量范围。
10.分析不纯CaCO3(其中不含干扰物质)。
称取试样0.3000g,加入浓度为0.2500mol·L-1HCl溶液25.00ml,煮沸除去CO2,用浓度为0.2012mol·L-1的NaOH溶液返滴定过量的酸,消耗5.84ml,试计算试样中CaCO3的质量分数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
文章标题:红外光谱、拉曼和紫外作业
发文时间:2012-12-03 10:14:04
要求于12月10日前提交。
--------------------------------------------
1.化合物能发生n-σ*跃迁,为227nm(ε为900)。
试问:若在酸中测量时,该吸收峰会怎样变化?为什么?
2.某化合物根据红外光谱及核磁共振谱推定其结构可能为(A)或(B),而测其紫外光谱为
为284nm(ε9700),试问结构何种?
3.某化合物C8H9NO2,试根据如下谱图推断其结构,并说明依据。
4.某酮类化合物的溶剂由非极性溶剂改为极性溶剂时,对n→π*、π→π*跃迁有何影响?用能级图说明。
5.根据如下红外光谱图回答问题。
(1)指出该化合物的类型;
(2)归属各谱峰;并说明各谱峰反映的结构特征。
6.某化合物C8H10O ,根据下列谱图解析此化合物的结构,并说明依据。
7.试说明共振拉曼效应。
8.化合物C6H15N,根据如下Raman光谱图回答问题。
a) 指出该化合物的类型;
b) 3368 cm-1和3310 cm-1谱峰对应化合物中什么基团的何种振动形式;
c) 2937 cm-1和2855 cm-1谱峰对应化合物中什么基团的何种振动形式;
d) 1443 cm-1谱峰对应化合物中什么基团的何种振动形式;
e) 782 cm-1谱峰对应何种振动形式;
9.某化合物分子式为C6H15N,根据如下IR和1H NMR谱图推断其结构.
10.化合物CH3-(C=O )-CH=C(CH3)2 在正丁烷与水中均能出现两个吸收带,一对是230nm1和329nm,这是在______为溶液中测定。
另一对是243nm和305nm,这是在____为溶液中测定。
11.计算下列化合物UV光谱的最大吸收波长:
12.试分别计算乙炔和苯分子自由度总数及振动自由度数目。
13.分别预测下列化合物在红外光谱中那一区段有吸收,各因什么振动类型引起?
文章标题:绪论和质谱作业
发文时间:2012-10-10 11:22:44
要求于10月21日前提交。
--------------------------------------------
1.什么叫准分子离子峰?哪些离子源容易得到准分子离子?
2.38. 某有机化合物,用质谱法测得的数据如下:
试确定该化合物的分子式。
3.除同位素离子峰外,如果存在分子离子峰,则其一定是m/z_________的峰,它是分子失去_________生成的,故其m/z是该化合物的_____________它的相对强度与分子的结构及___________有关。
4.根据如下MS谱图确定两个化合物的分子量和分子式,并说明依据。
5.某化合物为C8H8O的质谱图如下,试推断其结构,并写出主要碎片离子的断裂过程.
6.X射线荧光光谱是如何产生的?
7.简述电子衍射的特点。
8.扫描电子显微镜常用的信号是__________和____________。
文章标题:核磁作业
发文时间:2012-10-31 09:37:48
要求于11月12日前提交。
--------------------------------------------
1.在下列化合物中,比较Ha和Hb,哪个具有较大的δ值?为什么?
2.一个分子的部分1HNMR谱图如下,试根据峰位置及裂分峰数,推断产生这种吸收峰的氢核的相邻部分的结构及电负性。
3.某化合物C8H9 N O2 ,根据如下MS和1H NMR谱图推断其结构,并说明依据。
4.化合物C10H12O2,根据如下NMR谱图确定结构,并说明依据。
5.为了解决固体样品的NMR谱带增宽问题,通常采用什么技术?
6.化合物C5H12O,根据如下13C NMR谱图确定结构,并说明依据。
7.化合物C4H7O2Br根据如下 13C NMR和1H NMR谱图确定结构,并说明依据。
8.某化合物C8H9NO,试根据如下13C NMR和1H NMR谱图推断其结构,并说明依据。
9.预测乙烷分子(CH3CH3)在HNMR谱上信号数目为_______个,苯在HNMR谱上信号数目有______个。
10.化合物C7H16O3,1HNMR谱图有如下数据:有三种类型质子
(a) ? =1.1,三重峰,9 个质子 (b)? =3.7,四重峰,6个质子 (c) ? =5.3,单峰,1个质子
其中,a为_______________基团, b为_______________基团,c为_______________基团, 它的结构式为_____________________________________________。
11.化合物C4H6O,根据如下13C NMR谱图确定结构,并说明依据。
12.根据1HNMR推测下列化合物的结构。
1、C8H10:δ:1.2 (3H,三重峰); δ:2.6(2H,四重峰);δ:7.1(5H,单峰)
2、C10H14: δ:1.1(6H,三重峰); δ:2.5 (4H,四重峰); δ:7.0 (4H,单峰)
文章标题:综合解析作业
发文时间:2012-12-17 12:29:41
要求12月24日前提交。
--------------------------------------------
1.Molecular Formula: C3H7NO2 Molecular Weight: 89.1
2.Molecular Formula: C4H9NO Molecular Weight: 87.1
3.Molecular Formula: C6H15NO Molecular Weight: 117.2
文章标题:分子发光与联用技术
发文时间:2012-12-25 10:04:04
要求于1月5日前提交。
--------------------------------------------
1.为什么分子发射光谱分析法一般要比吸收光谱分析法的灵敏度高?
2.什么是重原子效应、外部重原子效应,内部重原子效应?
3.分子由激发态回到基态, 同时发射一个光子的过程称为辐射跃迁, 包括____和____.
4.________、__________、_________和荧光寿命都是描述荧光性质的重要物理量。
5.利用GC-MS和GC-FTIR可获得什么样的互补信息?
6.对于GC-FTIR,冷阱接口的优点和局限性是什么?。
