新版GMP认证申报模板
GMP认证申请报告(范本)

GMP认证申请报告(范本)XXXXXXX(原料药)车间GMP认证申报材料XXXX制药有限公司二○○五年十月目录1. 药品GMP认证申请书2. 《药品生产许可证》和营业执照复印件3. 药品生产管理和质量管理自查情况4. 企业组织机构图5. 人员状况6. 企业生产范围及申请认证范围剂型和品种表7. 平面布置图(厂区、仓储、质检等)8. 生产车间概况及设备安装平面布置图9. 工艺流程图10. 验证情况11. 检验仪器、仪表、量具、衡器校验情况12. 文件目录13. 企业符合消防和环保要求的证明文件申报资料№.1药品GMP认证申请书(注:本号资料用电子版本填写,并附软盘)申报资料№.2《药品生产许可证》和营业执照复印件申报资料№.3药品生产管理和质量管理自查情况药品生产管理和质量管理自查情况一、企业概况及历史沿革情况:XXXX制药有限公司原为XXXX制药厂,始建于一九八九年。
厂址座落在XXXXX号,东靠XX公路,西去是济南国际机场,北靠胶济铁路、南临XX公路,交通极为便利,周围环境清洁,无污染,并能提供符合生产要求的水、电、汽。
厂区占地面积40970m2,其中预留9090m2,实用部份占地面积31880m2,绿化面积10200m2,约占总面积的32%,建筑占地面积16000m2。
建筑物由办公楼、仓库、精烘包车间、片剂车间、质检中心等组成。
其中认证的精烘包车间建筑面积520m2,片剂车间1220m2,中心化验室240m2,仓库1290m2。
周边环境图、总平面布置图、仓储平面图、质监科平面图见资料(五)。
公司是以XXXX生产XXX原料药为主的制药企业;一九九二年由山东省医药工业设计院设计,建成面积1224m2的片剂车间。
2002年,我公司投资920万元人民币,由山东省医药工业设计院设计,对原料药生产的精烘包车间、片剂车间及配套设施进行了GMP改造,并顺利通过认证。
营业执照、生产许可证见资料(二)。
为适应市场发展的需要,公司近年来加大了新产品的研制开发力度,并向国家食品药品监督管理局提出注册申请,其中XXXXX(原料药)已取得国家药品生产批准文号。
GMP申报资料相关模板及表格
批准文号
标准依据
备注
1
2
3
4
5
6
7
8
9
规格
批准文号
标准依据
备注
1
2
3
4
5
6
7
8
9
注:常年生产品种用“*”标注。
6、检验仪器、仪表、量具、衡器校验情况登记表示例:
序号
名称
型号
生产厂家
使用部门
计量校
验单位
检定时间
有效期限
1
2
3
4
5
6
7
8
9
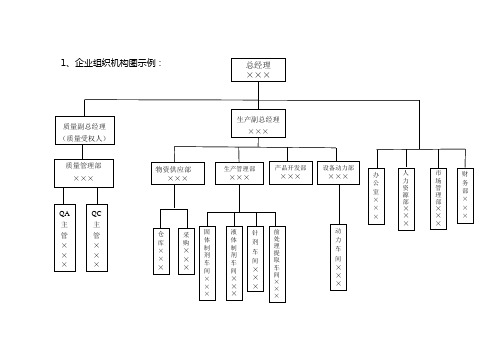
1、企业组织机构图示例 :
2、企业负责人、部门负责人履历表示例:
姓名
性别
出生日期
籍贯
民族
联系电话
职务
职称
部门
最高学历
毕业时间
毕业院校
学历
专业
本人简历
起止年月
工作单位和部门
职务
备注
3、各类技术人员登记表示例:
姓名
性别
年龄
学历
专业
毕业院校
毕业时间
所在岗位
备注
4、企业全部剂型和品种表示例:
序号
药品名称
剂型
gmp认证申请书事例

gmp认证申请书事例英文回答:GMP Certification Application Template.Introduction.The purpose of this application is to provide the necessary information to the GMP Certification Body (CB) to assess the applicant's compliance with the GMP requirements.Section 1: Applicant Information.Applicant Name:Address:Phone Number:Email Address:Website:Section 2: Product Information.Product Name(s):Description of Product(s):Intended Use(s) of Product(s):Manufacturing Process:Section 3: Quality Management System.3.1 Quality Policy.Statement of the company's quality policy and its commitment to GMP compliance.3.2 Organizational Structure.Organizational chart showing the roles and responsibilities of personnel involved in GMP activities.3.3 Training.Description of the training program for personnel involved in GMP activities, including the frequency and content of training.3.4 Documentation Control.Description of the system for controlling and maintaining GMP-related documentation, including SOPs, records, and reports.3.5 Change Control.Description of the system for managing changes to GMP-related documentation, materials, and processes.3.6 Internal Audits.Description of the program for conducting internal audits of GMP compliance, including the frequency and scope of audits.3.7 Corrective and Preventive Actions.Description of the system for addressing and resolving GMP non-compliances, including the process for identifying, investigating, and implementing corrective and preventive actions.3.8 Product Recall.Description of the system for managing product recalls, including the process for notifying customers and authorities.Section 4: Manufacturing Facility.4.1 Location and Description.Physical address and description of the manufacturingfacility, including the size and layout.4.2 Equipment and Utilities.List of equipment and utilities used in GMP operations, including their calibration and maintenance schedules.4.3 Environmental Monitoring.Description of the environmental monitoring program, including the parameters monitored, the frequency of monitoring, and the action limits.4.4 Sanitation and Pest Control.Description of the sanitation and pest control program, including the frequency and methods of cleaning and pest control.Section 5: Personnel.5.1 Hygiene and Personal Protective Equipment.Description of the requirements for hygiene and personal protective equipment (PPE) for personnel involved in GMP operations.5.2 Health Qualifications.Description of the health qualifications required for personnel involved in GMP operations.Section 6: Testing and Quality Control.6.1 Raw Material Testing.Description of the testing methods and acceptance criteria for raw materials used in GMP operations.6.2 In-Process Testing.Description of the testing methods and acceptance criteria for in-process materials.6.3 Finished Product Testing.Description of the testing methods and acceptance criteria for finished products.6.4 Stability Testing.Description of the stability testing program for finished products.Section 7: Distribution.7.1 Storage and Transportation.Description of the storage and transportation conditions for finished products.7.2 Distribution Records.Description of the system for maintaining records of distribution, including the dates of distribution, quantities, and customer information.Section 8: Complaints and Adverse Events.Description of the system for handling customer complaints and adverse events, including the process for investigating and responding to complaints.Section 9: Declarations.Declaration by the applicant that the information provided in the application is true and accurate.Declaration by the applicant that the applicant is committed to maintaining compliance with GMP requirements.中文回答:GMP认证申请书示例。
1-药品GMP认证申请书(一式四份)

填写细节要求:a、企业名称、注册地址、生产地址应与《药品生产许可证》一致;b、企业法人、企业负责人应与《药品生产许可证》一致;注意:企业填报的联系人应熟悉企业生产、质量管理情况,联系方式应有效、快捷。
c、企业申请认证范围应在《药品生产许可证》生产许可范围;d、企业申请认证剂型应与该品种的注册批件剂型一致;e、中药丸剂申请认证时应展开,如:丸剂(蜜丸、水蜜丸、水丸、浓缩丸、微丸、糊丸、蜡丸);注意:相近剂型的确认-----喷雾剂和气雾剂、合剂和口服液、口服液和口服溶液剂等等f、认证品种中有青霉素类、头孢菌素类、激素类、抗肿瘤药、避孕药、放射性药品应注明;g、原料药认证应注明原料药名称;h、既有口服也有外用的制剂,外用的应在制剂后注明外用。
i、医用氧企业认证申请范围应注明气态、液态;j、中药饮片企业认证申请范围应明确饮片的炮制方法,如:中药饮片〔净制,切制,炮炙(炒、烫、煅、制炭、蒸、煮、炖、燀、酒制、醋制、盐制、姜汁炙、蜜炙、油炙、水飞、煨),粉碎(不包括直接口服饮片),包括毒性饮片的净制、切制、炒制与蒸煮制〕;k、企业申请认证范围有中药前处理及提取车间的应予以注明;m、企业申请认证范围有动物脏器、组织的洗涤、提取车间的应予以注明。
注意:企业中药前处理及提取委托生产的应在安监处办理相关委托手续。
受理编号:吉I0376药品GMP认证申请书申请单位:****制药有限公司(公章)所在地:新疆省、自治区、直辖市填报日期:200* 年**月**日受理日期:200* 年**月**日国家食品药品监督管理局制填报说明1、组织机构代码按《中华人民共和国组织机构代码证》上的代码填写。
2、企业类型:按《企业法人营业执照》上企业类型填写。
三资企业请注明投资外方的国别或港、澳、台地区。
3、生产类别:填写化学药、中成药、化学药及中成药,并同时在括弧内注明(原料药、中药提取、制剂),生物制品,体外诊断试剂,放射性药品,其它类(中药饮片、药用辅料、空心胶囊、医用氧)。
GMP认证申报材料(综合版)

二、浙江******药业有限公司生产管理和质量管理自查情况:企业GMP自查情况1.企业概况浙江省******药业有限公司成立于2005年10月(前身为浙江省******医药化工有限公司,成立于1998年),占地面积2.1万平方米,建筑面积1.3万平方米。
公司注册地址*******城关丰泽路22号,东临浙江省*******药业有限公司,西临金盘路,南临人民东路,北临丰泽路,交通方便。
公司创办以来,坚持“以人为本,科技领先”的企业理念,积极引进国内外先进技术及产品,目前已形成抗艾滋病类、抗癌类、激素类三大系列产品;公司持续不断地进行科技投入,以技术创新与技术进步,保证产品质量,保持竞争优势。
公司现已申报五个产品国家专利,二个产品国际专利。
为此公司被列为市“128”工程国家重点项目承担单位和浙江省高新技术企业。
本次申请认证的产品为****,****产品生产的二车间厂房建成于2005年10月份,车间一般生产区建筑面积132平方米。
经2008年初的改造,建筑面积达到287平方米,车间的人流通道及物流通道是分开设立的,避免了可能的交叉污染。
****产品生产所使用的洁净厂房建筑面积165平方米,洁净区按十万级洁净度要求进行控制。
****的生产设备为该产品专用,年生产能力1000Kg。
2.企业负责人、生产、质量管理人员及其他技术人员情况浙江省******药业有限公司有员工170人,其中技术人员77人,占全厂职工人数45.29 %,公司主要领导情况:质量管理部门主要技术人员:质量部QA人员8名,质检中心人员18人,共占全厂职工人数15.29%:技术人员在各主要部门分布情况:3.人员培训情况公司人力资源部每年度均制订年度培训计划,每年均进行一次系统地GMP培训,内容包括国家药品生产的相关法规、质量管理程序、EHS制度程序、技能培训等,工艺技术技能的培训根据生产计划在生产前进行,培训均严格按以下培训要求进行:●新员工经面试、体检合格后,需经过公司管理制度、GMP知识、EHS知识等知识培训,并经考核合格后,才允许分配至各部门。
新版GMP认证申报模板

新版GMP认证申请模板第一部分企业总体情况1.1 企业信息:企业名称:内蒙古商贸有限公司注册地址:内蒙古呼和浩特商贸职业学院企业生产地址:内蒙古呼和浩特商贸职业学院邮政编码:010000联系人:白雪建传真:xxxxxx联系电话:1584933595*应急联系人:靳亮亮应急联系电话:1760488256*1.2 企业历史沿革:我公司始建于2017年,位于内蒙古商贸职业学院,占地面积XXXXX平方米。
企业现有职工XXXXXX人,各类专业技术人员XXXXXX人,XXX 于XXXX年XX月通过复认证。
1.3 企业药品生产情况:我公司XXXX食品,上述食品均已获得《食品生产质量管理规范》1998版认证,GMP证书已到期,上述食品的所有生产活动均符合《食品生产质量管理规范》1998版要求。
本公司没有进口分包装、出口以及获得国外许可的事项。
我公司获得批准文号的所有品种及近三年产量见附件。
1.4 本次《食品GMP证书》认证的范围:1.4.1本次申请食品GMP认证的生产线,生产食品、品种、并附相关产品的注册批准文件的复印件。
生产品种、注册批准文件的复印件见附件。
1.4.2 最近一次(食品)药品监督管理部门对该生产线的检查情况:最近一次(食品)药品监督管理部门对该生产线的检查是XXXX食品药品监督管理局药品GMP认证跟踪检查组于XXXX年XX月XX日~0X月XX日,对我公司XXXX剂型进行了跟踪检查,该次检查共发现一般缺陷XX项,其中该生产线存在一般缺陷XX项,无严重缺陷。
发现该生产线缺陷内容包括:XXXX 以上缺陷我公司已于XXXX年XX月XX日前全部整改完毕,并将整改报告送至XXXXX食品药品监督管理局。
该生产线没有经过境外的食品GMP检查。
1.5 上次食品GMP认证以来的主要变更情况:该条生产线上次认证检查后关键人员、设备设施、品种的变换情况自上次认证后,因生产管理负责王菲工作调动,其不再担任我公司生产管理负责人。
省局药品GMP认证申请书 2

受理编号:药品GMP认证申请书申请单位:(公章)所在地:填报日期:年月日受理日期:年月日山东省食品药品监督管理局制填报说明1、组织机构代码按《中华人民共和国组织机构代码证》上的代码填写。
2、企业类型:按《企业法人营业执照》上企业类型填写。
三资企业请注明投资外方的国别或港、澳、台地区。
3、生产类别:填写化学药、化学原料药、中成药、中药提取、生物制品、体外诊断试剂、放射性药品、其它类(中药饮片、药用辅料、空心胶囊、医用氧)。
中成药含中药提取的,应在括弧内注明。
4、认证范围:按制剂剂型类别,填写注射剂、口服固体制剂、口服液体制剂、其它制剂、原料药,生物制品,体外诊断试剂,放射性药品,其它类(中药饮片、药用辅料、空心胶囊、医用氧)。
青霉素类、头孢菌素类、激素类、抗肿瘤药、避孕药、中药提取车间在括弧内注明;原料药应在括弧内注明品种名称;放射性药品、生物制品应在括弧内注明品种名称和相应剂型。
5、固定资产和投资额计算单位:万元。
生产能力计算单位:万瓶、万支、万片、万粒、万袋、吨等。
6、联系电话号码前标明所在地区长途电话区号。
7、受理编号及受理日期由受理单位填写。
受理编号为:省、自治区、直辖市简称 + 年号 + 四位数字顺序号。
8、申请书填写内容应准确完整,并按照《药品GMP认证申请资料要求》报送申请认证资料,要求用A4纸打印,左侧装订。
9、报送申请书、申请认证资料一式2份。
企业全部生产线情况企业全部品种情况本次申请认证生产线情况本次申请认证品种注:大型精密检验仪器指:高效液相色谱仪、气相色谱仪、紫外分光光度仪、薄层扫描仪、原子吸收分光光度仪、高效液相色谱-质谱联用仪、蒸发光散射检测器、荧光检测器、柱后衍生装置、凝胶电泳检测仪、生物显微镜、二氧化硫检测装置等。
药品GMP认证申请资料要求1 企业的总体情况1.1 企业信息◆企业名称、注册地址;◆企业生产地址、邮政编码;◆联系人、传真、联系电话(包括出现严重药害事件或召回事件的24小时的联系人、联系电话)。
GMP申报资料模板

word格式-可编辑-感谢下载支持药品GMP认证申请资料1 企业的总体情况1.1 企业信息企业名称:XXXXXX注册地址:XXX企业生产地址:邮政编码:130012联系人: XXX联系电话:XXX传真:XXXXXX1.2 企业的药品生产情况◆本公司获得食品药品监督管理部门批准的生产活动情况:我公司为疫苗生产企业;生产范围为XXX和XXX,二者均为注射用冻干制剂。
常年生产的品种为XXX,该疫苗每年出口韩国和印度。
现XXX、XXX生产车间已于2009年12月13日通过GMP认证现场检查;2010年2月9日获国家食品监督管理局药品GMP证书;本次我公司按《药品生产质量管理规范》(2010年修订)申报XXX和XXXGMP认证。
无进口分包装药品。
◆《药品生产许可证》和《企业法人营业执照》复印件见附件1◆截止2012年9月,我公司已获得批准文号的所有品种见下表:word格式-可编辑-感谢下载支持本公司已获得批准文号的所有品种◆ 本公司无生产高毒性、性激素类药物等高活性、高致敏性物料的操作。
1.3 本次药品GMP 认证申请的范围◆ 本次申请药品GMP 认证的生产线,生产剂型、品种见下表:注册批件的复印件见附件2。
◆ 最近一次(食品)药品监督管理部门对该生产线的检查情况:本次申请认证为XXX 和XXX 的第二次认证,上次认证时间为2009年12月11日-13日。
2009年12月11日至2009年12月13日,国家食品药品监督管理局组织相关专家对我公司进行全面检查,检查结果为无严重缺陷项,一般缺陷项6项,顺利通过GMP 认证现场检查。
针对GMP 现场检查的缺陷项目,公司及时组织相关部门进行整改,在2009年12月18日向国家食品药品监督管理局提交整改报告,整改报告如下:1.4 上次药品GMP认证以来的主要变更情况本公司于2010年2月取得XXX、XXX认证GMP证书,药品GMP认证以来的主要变更情况见下表:(1)关键人员变更情况(2)品种变化情况自上次认证后生产品种无变化(3)设备设施变更情况以上变更均已上报吉林省食品药品监督管理局备案。
药品GMP认证申报资料模板

目录申报材料之一 (3)申报材料之二 (4)1、企业信息 (5)2、企业的药品生产情况 (5)3、本次药品GMP认证申请的范围 (8)3.1 本次申请基本情况 (8)3.2 最近一次药品监督管理部门对该生产线的检查情况 (8)4、上次药品GMP认证以来的主要变更情况 (8)申报材料之三 (9)1、企业质量管理体系的描述 (10)1.1 质量管理体系的相关管理责任 (10)1.2 质量管理体系要素 (10)2、成品放行程序 (10)2.1 放行程序描述 (10)2.2 负责放行人员基本情况 (10)3、供应商管理及委托生产、委托检验的情况 (10)3.1 供应商管理要求 (10)3.2 委托生产的情况 (10)3.3 委托检验的情况 (10)4、企业的质量风险管理措施 (10)4.1 质量风险管理方针 (10)4.2 质量风险管理获得的范围和重点 (10)5、年度产品质量回顾分析 (10)申报材料之四 (11)1、组织机构图 (12)1.1 企业组织机构图 (12)1.2 相关部门组织机构图 (12)2、主要技术人员的资历 (12)3、各部门员工数 (12)申报材料之五 (13)1、厂房 (14)1.1 建筑物情况 (14)1.2 厂区总平面布局图、生产区域的平面布局图和流向图 (14)1.3 生产线的布局情况 (14)1.4 仓储情况 (14)1.5 空调净化系统 (14)1.6 水系统 (14)1.7 其他公用设施 (14)2、设备 (15)2.1 生产和检验用主要仪器、设备 (15)2.2 清洗和消毒方法及验证 (15)2.3与药品生产质量相关的关键计算机化系统 (15)申报材料之六 (16)1、企业的文件系统 (17)申报材料之七 (18)1、生产的产品情况 (19)1.1 所生产的产品情况综述 (19)1.2 本次申请认证剂型及品种的工艺流程图 (19)2、工艺验证 (19)2.1 工艺验证的原则及总体情况 (19)2.2 返工、重新加工的原则 (19)3、物料管理和仓储 (19)3.1 物料、中间产品和成品的处理 (20)3.2 不合格物料和产品的处理 (20)申报材料之八 (21)1、质量控制情况 (22)申报材料之九 (23)1、发运 (24)1.1 产品在运输过程中的控制 (24)1.2 确保产品可追踪性的方法 (24)2、投诉和召回 (24)申报材料之十 (25)1、自检 (26)申报材料之十一 (27)申报材料之十二 (28)申报材料之一《药品GMP认证申请书》申报材料之二企业的总体情况1、企业信息企业名称:xxxx制药有限公司注册地址:企业生产地址:邮政编码:联系人:传真:联系电话:2、企业的药品生产情况本公司2009年取得xxxxGMP认证证书以来,公司各部门在GMP 工作小组的领导下,严格按照《药品生产质量管理规范》推行各项GMP工作,公司现按2010版GMP要求正常运行生产。
药品GMP认证申请书实例

受理编号:吉I0376 药品GMP认证申请书申请单位:****制药有限公司(公章)所在地:新疆省、自治区、直辖市填报日期:200* 年**月**日受理日期:200* 年 **月 **日国家食品药品监督管理局制填报说明1、组织机构代码按《中华人民共和国组织机构代码证》上的代码填写。
2、企业类型:按《企业法人营业执照》上企业类型填写。
三资企业请注明投资外方的国别或港、澳、台地区。
3、生产类别:填写化学药、中成药、化学药及中成药,并同时在括弧内注明(原料药、中药提取、制剂),生物制品,体外诊断试剂,放射性药品,其它类(中药饮片、药用辅料、空心胶囊、医用氧)。
4、认证范围:填写制剂剂型,其中青霉素类、头孢菌素类、激素类、抗肿瘤药、避孕药在括弧内注明(中药提取车间在括弧内注明);填写原料药同时在括弧内注明品种名称;填写放射性药品并在括弧内注明相应剂型;生物制品填写品种名称,并在括弧内注明相应剂型。
5、认证剂型类别:填写注射剂、口服固体制剂、口服液体剂、其它制剂、原料药,生物制品,体外诊断试剂,放射性药品,其它类(中药饮片、药用辅料、空心胶囊、医用氧)。
6、建设性质:填写新建(指新开办的药品生产企业和新增生产范围)、改扩建、迁建。
7、固定资产和投资额计算单位:万元。
生产能力计算单位:万瓶、万支、万片、万粒、万袋、吨等。
8、联系电话号码前标明所在地区长途电话区号。
9、受理编号及受理日期由受理单位填写。
受理编号为:省、自治区、直辖市简称+ 年号+ 四位数字顺序号。
10、本申请书填写应内容准确完整,字迹清晰。
《药品GMP认证管理办法》规定的申报资料应有目录,用A4幅面纸打印(左边距不小于3cm,页码标在右下角)。
11、报送申请书一式2份(并附申请认证生产剂型和品种表,原料药、生物制品、放射性药品药品注册批件的复印件,药品生产许可证副本的复印件),申请认证资料1份,药品GMP认证初审意见表一式2份。
(如制剂剂型等内容填写空间不够,可另加附页)生产剂型和品种表。
gmp认证申请书

gmp认证申请书申请书尊敬的评审委员会:您好!我代表XXXX公司,向贵委员会提交申请,希望能够获得GMP(Good Manufacturing Practices,良好生产规范)认证。
本申请书将详细介绍我们公司的背景、产品品质管理体系以及申请GMP认证的目的和意义。
希望贵委员会能够审阅并批准我们的申请。
一、公司背景XXXX公司成立于XXXX年,总部位于XXXX地区。
多年来,我们致力于生产和销售优质的药品和医疗设备。
我们拥有一支专业的团队,具备先进的生产设施和先进的技术,以确保我们产品的质量和安全。
二、产品品质管理体系本章将详细介绍我们公司的产品品质管理体系,以证明我们具备符合GMP认证的条件。
1. 资源管理我们重视人才的培养和管理,并通过完善的人力资源体系,确保员工的素质和技能与GMP要求相符。
此外,我们还注重设备和设施的维护与更新,以保障生产过程的稳定和可靠。
2. 原料管理我们严格管理原料的采购、接收、储存和使用。
只有符合GMP标准的原料才能进入我们的生产过程,并通过严格的质检程序进行检测和验收。
3. 生产管理我们严格按照GMP规范进行生产过程控制,确保每个环节都符合相关要求。
我们的生产设备经过定期的维护和校准,以确保其正常运行和产品质量的稳定。
4. 品质控制我们建立了完善的品质控制体系,包括原料和成品的检验、检测和质量追溯等环节。
我们的质量控制实验室配备先进的仪器设备和一流的技术人员,以保证产品的质量。
5. 记录与文档管理我们要求生产过程中的各个环节都进行详细的记录,包括生产计划、操作记录、检验记录等。
同时,我们还建立了完善的文档管理体系,确保相关文件的保存和更新。
三、申请GMP认证的目的和意义我们申请GMP认证的目的是为了进一步提升公司的品质管理水平,为消费者提供更安全、更可靠的产品。
通过获得GMP认证,我们能够在产品市场上具备更大的竞争力,为公司的长期发展奠定坚实的基础。
同时,GMP认证也是国际市场贸易的通行证。
2022版GMP认证申报材料

2022版GMP认证申报材料某某某某药业有限公司GMP认证申请资料某某某某药业有限公司目录一、公司总体情况31、公司信息(各证照复印件)42、公司药品生产情况53、本次GMP 认证申请范围114、上次GMP认证检查关键人员、设备设施、品种的变更20二、公司质量管理体系211、质量管理体系描述222、成品放行程序263、供应商管理及委托生产、委托检验的情况314、公司质量风险管理措施345、年度产品质量回顾分析35三、人员与机构371、质量保证、生产和质量控制组织机构图382、关键人员及从事质量保证、生产、质量控制技术人员资历413、质量保证、生产、质量控制、贮存和发运等各部门的员工数44四、厂房、设施和设备451、厂房462、设备59五、文件651、公司GMP文件系统662、文件的起草、修订、批准、发放、控制和存档系统66GMP认证申请资料某某某某药业有限公司六、生产671、生产的产品情况682、工艺验证723、物料管理和仓储74七、质量控制77八、发运、投诉和召回831、发运842、投诉和召回84九、自检851、自检工作程序862、自检选择标准863、自检的实施874、整改措施90十、消防验收及环保验收证明材料911、消防验收证明材料922、环保验收证明材料93十一、其他证明材料971、授权委托书982、真实性保证说明99附页(所有品种再注册批件)1382GMP认证申请资料某某某某药业有限公司一、公司总体情况目录1、公司信息(各证照复印件)42、公司药品生产情况53、本次GMP 认证申请范围114、上次GMP认证检查关键人员、设备设施、品种的变更203GMP认证申请资料某某某某药业有限公司一、公司总体情况1、公司信息:某某某某药业有限公司是由原某某某某中药厂经2000年、2002年、2022年三次改制的股份制企业。
现公司注册资本4000万元,其中某某某某占46%,某某某占34%,某某某某16%,自然人占4%近几年来,企业得到了长远发展,各项经济技术指标快速增长,被省、市人民政府评为“重合同、守信用”企业,“省级优秀企业”,“银行信用A级企业”,产品销售全国30多个省市。
药品gmp认证申请书范文

药品gmp认证申请书范文英文回答:GMP Certification Application for Pharmaceutical Products.1. Introduction.The Good Manufacturing Practices (GMP) certification is a critical requirement for pharmaceutical companies to ensure the quality, safety, and efficacy of their products. To obtain GMP certification, pharmaceutical companies must demonstrate compliance with strict regulatory standards and guidelines.2. Application Process.The application process for GMP certification typically involves the following steps:Submission of Application Form: The pharmaceutical company submits an application form to the regulatory authority, providing information about the company, its products, and manufacturing facilities.Site Inspection: The regulatory authority conducts an on-site inspection of the pharmaceutical company's manufacturing facilities to verify compliance with GMP standards.Review of Application: The regulatory authority reviews the application form and inspection report to assess the company's compliance.Issuance of Certificate: If the company meets the GMP requirements, the regulatory authority issues a GMP certification.3. Documentation Requirements.The GMP certification application requires extensive documentation, including:Quality Manual: Outlines the company's GMP policies and procedures.Standard Operating Procedures (SOPs): Detailed instructions for all manufacturing processes.Equipment Validation: Proof that critical equipment is functioning as intended.Raw Material Specifications: Defines thespecifications for all incoming raw materials.Finished Product Specifications: Defines the specifications for all finished products.Quality Control and Testing Procedures: Describes the quality control measures and testing methods used to ensure product quality.4. Benefits of GMP Certification.GMP certification provides numerous benefits to pharmaceutical companies, including:Enhanced Product Quality and Safety: Ensures that products are manufactured in accordance with industry best practices, minimizing the risk of adverse events.Regulatory Compliance: Demonstrates compliance with regulatory requirements, reducing the risk of legal penalties or enforcement actions.Increased Customer Confidence: Builds trust and confidence among customers by ensuring the quality and safety of products.International Recognition: Facilitates the export of products to countries that recognize GMP certification.5. Conclusion.GMP certification is essential for pharmaceutical companies seeking to produce high-quality, safe, andeffective products. By following the application process and meeting the documentation requirements, pharmaceutical companies can obtain GMP certification and reap the numerous benefits it offers.中文回答:药品GMP认证申请书范文。
药品GMP认证申报资料范本

GMP 认证申报资料XXX药业有限公司二○XX年八月目录一、有关证照(复印件)。
二、药品生产管理和质量管理自查情况三、公司组织机构图四、公司人员情况五、生产剂型和品种表六、公司环境条件、仓储、质检及公司总平面布置图七、固体制剂车间概况及工艺布局平面图八、工艺流程图及主要质量控制点九、固体制剂车间的关键工序、主要设备、设施验证情况;检验仪器、仪表、衡器校验情况十、公司生产管理、质量管理文件目录GMP认证申报资料(一)有关证照(复印件)潜江永安药业股份有限公司内容1、《药品生产许可证》复印件2、《企业法人营业执照》复印件3、省药监局《关于※※※药业有限公司GMP改造的批复》复印件GMP认证申报资料(二)药品生产管理和质量管理自查情况潜江永安药业股份有限公司内容1、企业概况2、药品生产管理和质量管理自查情况××××药业有限责任公司药品生产管理和质量管理自查报告1.公司简介××××药业有限责任公司是一家以口服固体制剂生产和中药提取为主的现代化制药企业。
公司注册资本5000万元,经济性质为有限责任公司。
经××省药品监督管理局批准(*药监安函[2010]007号),建设了年产片剂2亿片,胶囊剂3亿粒,颗粒剂30吨的中药口服固体制剂车间,并建设有年处理中药材20000吨的中药提取车间,公用工程和辅助设施。
截止2004年5月,已经完成了口服固体制剂车间、中药提取车间和公用工程的改造,进行了从药人员GMP培训,建立了药品生产质量管理制度,使企业达到了设施齐全,设备先进,管理到位,产品工艺合理,产品质量稳定的要求。
现将我公司在生产管理和质量管理方面的自查情况予以报告。
2.机构与人员2.1 组织机构××××药业有限责任公司设立了六个部门,分别为生产技术部、工程设备部、质量管理部、销售部、财务部和办公室。
药品GMP认证申请书

药品GMP认证申请书申请单位:(公章)所在地:填报日期:年月日受理日期:年月日宁夏回族自治区食品药品监督管理局制填报说明1、组织机构代码按《中华人民共和国组织机构代码证》上的代码填写。
2、企业类型:按《企业法人营业执照》上企业类型填写。
三资企业请注明投资外方的国别或港、澳、台地区。
3、生产类别:填写化学药、化学原料药、中成药、中药提取、生物制品、体外诊断试剂、放射性药品、其它类(中药饮片、药用辅料、空心胶囊、医用氧)。
中成药含中药提取的,应在括弧内注明。
4、认证范围:按制剂剂型类别,填写注射剂、口服固体制剂、口服液体制剂、其它制剂、原料药,生物制品,体外诊断试剂,放射性药品,其它类(中药饮片、药用辅料、空心胶囊、医用氧)。
青霉素类、头孢菌素类、激素类、抗肿瘤药、避孕药、中药提取车间在括弧内注明;原料药应在括弧内注明品种名称;放射性药品、生物制品应在括弧内注明品种名称和相应剂型。
5、固定资产和投资额计算单位:万元。
生产能力计算单位:万瓶、万支、万片、万粒、万袋、吨等。
6、联系电话号码前标明所在地区长途电话区号。
7、受理编号及受理日期由受理单位填写。
受理编号为:省、自治区、直辖市简称+年号+四位数字顺序号。
8、申请书填写内容应准确完整,并按照《药品GMP认证申请资料要求》报送申请认证资料,要求用A4纸打印,左侧装订。
9、报送申请书、申请认证资料一式2份。
企业全部生产线情况企业全部品种情况本次申请认证生产线情况本次申请认证品种注:大型精密检验仪器指:高效液相色谱仪、气相色谱仪、紫外分光光度仪、薄层扫描仪、原子吸收分光光度仪、高效液相色谱-质谱联用仪、蒸发光散射检测器、荧光检测器、柱后衍生装置、凝胶电泳检测仪、生物显微镜、二氧化硫检测装置等。
药品GMP认证申报资料

药品认证申报资料药品生产质量管理规范认证申报资料申报人:××××制药有限公司申报人地址:×××市×××区××路××号联系人:×××联系人电话:××××制药有限公司药品生产质量管理规范认证申报资料目录、《药品认证申请书》(一式两份)、企业的总体情况、企业的质量管理体系情况、企业人员情况、企业厂房、设施和设备情况、企业文件管理情况、企业生产管理情况、企业质量控制情况、企业发运、投诉和召回情况、企业自检情况、企业申请材料真实性的自我保证声明、法定代表人授权委托书及代理人身份证复印件药品认证申报资料之一:药品认证申请书××××制药有限公司受理编号:药品认证申请书申请单位:××××制药有限公司(公章)所在地:新疆省、自治区、直辖市填报日期:* 年**月**日受理日期:* 年**月**日国家食品药品监督管理局制填报说明、组织机构代码按《中华人民共和国组织机构代码证》上的代码填写。
、企业类型:按《企业法人营业执照》上企业类型填写。
三资企业请注明投资外方的国别或港、澳、台地区。
、生产类别:填写化学药、化学原料药、中成药、中药提取、生物制品、体外诊断试剂、放射性药品、其它类(中药饮片、药用辅料、空心胶囊、医用氧)。
中成药含中药提取的,应在括弧内注明。
、认证范围:按制剂剂型类别,填写注射剂、口服固体制剂、口服液体制剂、其它制剂、原料药,生物制品,体外诊断试剂,放射性药品,其它类(中药饮片、药用辅料、空心胶囊、医用氧)。
青霉素类、头孢菌素类、激素类、抗肿瘤药、避孕药、中药提取车间在括弧内注明;原料药应在括弧内注明品种名称;放射性药品、生物制品应在括弧内注明品种名称和相应剂型。
药品GMP认证申请书

受理编号:药品GMP认证申请书申请单位:(公章) 所在地:省、自治区、直辖市填报日期:受理日期:国家食品药品监督管理局制填报说明1、组织机构代码按《中华人民共和国组织机构代码证》上的代码填写。
2、生产类别:填写化学药、中成药、化学药及中成药,并同时在括弧内注明(原料药、中药提取、制剂),生物制品,体外诊断试剂,放射性药品,其它类(中药饮片、药用辅料、空心胶囊、医用氧)。
3、企业类型:按《企业法人营业执照》上企业类型填写。
三资企业请注明投资外方的国别或港、澳、台地区。
4、认证范围:填写制剂剂型,其中青霉素类、头孢菌素类、激素类、抗肿瘤药、避孕药在括弧内注明(中药提取车间在括弧内注明);填写原料药同时在括弧内注明品种名称;填写放射性药品并在括弧内注明相应剂型;生物制品填写品种名称,并在括弧内注明相应剂型。
5、认证剂型类别:填写注射剂、口服固体制剂、口服液体剂、其它制剂、原料药,生物制品,体外诊断试剂,放射性药品,其它类(中药饮片、药用辅料、空心胶囊、医用氧)。
6、建设性质:填写新建(指新开办的药品生产企业和新增生产范围)改扩建、迁建。
7、固定资产和投资额计算单位:万元。
生产能力计算单位:万瓶、万支、万片、万粒、万袋、吨等。
8、联系电话号码前标明所在地区长途电话区号。
9、受理编号及受理日期由受理单位填写。
受理编号为:省、自治区、直辖市简称+年号+四位数字顺序号。
10、本申请书填写应内容准确完整,字迹清晰。
《药品GMP认证管理办法》规定的申报资料应有目录,用A4幅面纸打印(左边距不小于3cm,页码标在右下角)。
11、报送申请书一式2份(并附申请认证生产剂型和品种表,原料药、生物制品、放射性药品注册批件的复印件,药品生产许可证副本的复印件),申请认证资料1份,药品GMP认证初审意见表一式2份。
(如制剂剂型等内容填写空间不够,可另加附页)。
【实用】GMP申报资料:GMP认证申请报告

【实用】ΓM∏申报认证资料
药海无涯 学无止境 专注药学领域
)010号
关于《GMP 》认证的申请报告
国家食品药品监督管理局:
我公司为大容量注射剂生产企业,2005年8月25日第二次通过了国家《GMP 》专家组的现场检查,《GMP 》证书的签发时间为2005年9月26日,证书编号G 。
在《GMP 》认证后的五年时间内,公司严格按照《GMP 》标准要求组织生产,不断完善或维护生产基础设施设备,不断完善生产质量管理体系,企业主要生产、管理人员稳定,定期组织学习与培训,深化《GMP 》管理准则的执行力度。
在公司近五年的生产过程中,没有出现制假制劣情形、产品在市场没有发生过内在质量问题,企业管理严格履行了《GMP 》的原则规定。
根据国家《GMP 》认证管理办法,企业在认证证书有效期到达前6个月,再次提出认证申请。
我公司现将再认证申请资料报送贵局,请贵局审查。
抄报:
二O 一O 年三月二十二日。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新版GMP认证申请模板第一部分企业总体情况1.1企业信息:企业名称:内蒙古商贸有限公司注册地址:内蒙古呼和浩特商贸职业学院企业生产地址:内蒙古呼和浩特商贸职业学院邮政编码:010000联系人:白雪建传真:xxxxxx联系电话:1584933595*应急联系人:靳亮亮应急联系电话:1760488256*1.2企业历史沿革:我公司始建于2017年,位于内蒙古商贸职业学院,占地面积XXXXX平方米。
企业现有职工XXXXXX人,各类专业技术人员XXXXXX人,XXX 于XXXX年XX月通过复认证。
1.3企业药品生产情况:我公司XXXX食品,上述食品均已获得《食品生产质量管理规范》1998版认证,GMP证书已到期,上述食品的所有生产活动均符合《食品生产质量管理规范》1998版要求。
本公司没有进口分包装、出口以及获得国外许可的事项。
我公司获得批准文号的所有品种及近三年产量见附件。
1.4本次《食品GMP证书》认证的范围:1.4.1本次申请食品GMP认证的生产线,生产食品、品种、并附相关产品的注册批准文件的复印件。
生产品种、注册批准文件的复印件见附件。
1.4.2最近一次(食品)药品监督管理部门对该生产线的检查情况:最近一次(食品)药品监督管理部门对该生产线的检查是XXXX食品药品监督管理局药品GMP认证跟踪检查组于XXXX年XX月XX日~0X月XX日,对我公司XXXX剂型进行了跟踪检查,该次检查共发现一般缺陷XX项,其中该生产线存在一般缺陷XX项,无严重缺陷。
发现该生产线缺陷内容包括:XXXX 以上缺陷我公司已于XXXX年XX月XX日前全部整改完毕,并将整改报告送至XXXXX食品药品监督管理局。
该生产线没有经过境外的食品GMP检查。
1.5上次食品GMP认证以来的主要变更情况:该条生产线上次认证检查后关键人员、设备设施、品种的变换情况自上次认证后,因生产管理负责王菲工作调动,其不再担任我公司生产管理负责人。
生产管理负责人一职由罗大佑担任,并于XXXX食品药品监督管理局备案。
其他如设备设施、生产品种等均未发生变化。
第二部分企业的质量管理体系1、质量管理体系:我公司组建由公司总经理、质量受权人、生产管理负责人、质量管理负责人组成的质量管理体系。
1.1总经理职责:(1)制定并维护公司质量方针;(2)制定质量目标并推动其贯彻实施;(3)为质量管理体系提供支持;(4)建立组织机构;(5)职责授权;(6)资源配备的讨论和决定;(7)质量管理部门的实施;(8)管理评审和系统持续改进。
1.2生产管理负责人职责:(1)确保食品按照批准的工艺规程生产、贮存,以保证食品质量;(2)确保严格执行与生产操作相关的各种操作规程;(3)确保批生产记录和批包装记录经过指定人员审核并送交质量管理部门;(4)确保厂房和设备的维护保养,以保持其良好的运行状态;(5)确保完成各种必要的验证工作;(6)确保生产相关人员经过必要的上岗前培训和继续培训,并根据实际需要调整培训内容;(7)审核和批准产品的工艺规程、操作规程等文件;(8)监督厂区卫生状况;(9)确保关键设备经过确认;(10)确保完成生产工艺验证;(11)确保企业所有相关人员都已经过必要的上岗前培训和继续培训,并根据实际需要调整培训内容;(12)批准并监督委托生产;(13)确定和监控物料和产品的贮存条件;(14)保存记录;(15)监督《食品生产质量管理规范》的执行状况;(16)监控影响产品质量的因素。
1.3质量管理负责人职责:(1)确保原辅料、包装材料、中间产品、待包装产品和成品符合经注册批准的要求和质量标准;(2)确保在产品放行前完成对批记录的审核;(3)确保完成所有必要的检验;(4)批准质量标准、取样方法、检验方法和其他质量管理的操作规程;(5)审核和批准所有与质量有关的变更;(6)确保所有重大偏差和检验结果超标已经过调查并得到及时处理;(7)批准并监督委托检验;(8)监督厂房和设备的维护,以保持其良好的运行状态;(9)确保完成各种必要的确认或验证工作,审核和批准确认或验证方案和报告;(10)确保完成自检;(11)评估和批准物料供应商;(12)确保所有与产品质量有关的投诉已经过调查,并得到及时、正确的处理;(13)确保完成产品的持续稳定性考察计划,提供稳定性考察的数据;(14)确保完成产品质量回顾分析;(15)确保质量控制和质量保证人员都已经过必要的上岗前培训和继续培训,并根据实际需要调整培训内容;(16)审核和批准产品的工艺规程、操作规程等文件;(17)监督厂区卫生状况;(18)确保关键设备经过确认;(19)确保完成生产工艺验证;(20)确保企业所有相关人员都已经过必要的上岗前培训和继续培训,并根据实际需要调整培训内容;(21)批准并监督委托生产;(22)确定和监控物料和产品的贮存条件;(23)保存记录;(24)监督《食品生产质量管理规范》的执行状况;(25)监控影响产品质量的因素。
1.4质量受权人职责:(1)参与企业质量体系建立、内部自检、外部质量审计、验证以及食品不良反应报告、产品召回等质量管理活动;(2)承担产品放行的职责,确保每批已放行产品的生产、检验均符合相关法规、食品注册要求和质量标准;(3)在产品放行前,质量受权人必须按照上述第2项的要求出具产品放行审核记录,并纳入批记录。
简要描述质量管理体系的要素,如组织机构、主要程序、过程等。
我公司质量管理体系的要素包括:质量保证部、质量控制实验室、工程部、生产部、行政部、物资部、经营部、生产车间等。
生产活动程序:物料采购→检验入库→仓库贮存→生产→过程方行→检验入库;质量保证程序:供应商审计→物料贮存控制→生产过程控制→(验证、偏差、变更)→检验控制→销售发运→信息反馈;质量管理程序:建立产品质量标准→建立质量控制、质量检验、生产操作标准→建立其他职能部门标准;持续改进程序:质量参数统计→质量趋势分析→质量风险评估→改进和预防措施。
2、成品放行程序:放行程序的总体描述以及负责放行人员的基本情况(资历)。
成品是指按照批准的生产工艺、在符合GMP要求的条件下生产的经检验符合相应质量标准,预定用途和注册要求的药品。
成品在放行后、由销售部统一管理。
成品的放行需符合以下要求:在批准放行前,应当对每批药品进行质量评价,保证药品及其生产应当符合注册和《药品生产质量管理规范》要求,并确认以下各项内容:(1)审核批生产记录、批包装记录,保证执行的主要生产工艺经过验证,保证所有必需的生产和质量控制均已完成并经相关主管人员签名,生产符合GMP和注册文件要求;(2)审核批检验记录,保证主要检验方法经过验证,保证成品已完成所有必需的检查、检验,检验符合操作规程,成品符合质量标准;(3)审核变更和偏差,确认变更、偏差已按照相关规程处理完毕,对变更或偏差已完成所有必要的取样、检查、检验和审核,所有与该批产品有关的偏差均已有明确的解释或说明,或者已经过彻底调查和适当处理,涉及其他批次产品偏差,并处理完毕;(4)成品质量评价;(5)质量授权人签名批准放行。
放行人员的基本情况:质量受权人:靳亮亮,男,毕业于XXXXXXX食品工程系,工程师,从事食品生产XX年。
3、供应商管理及委托生产、委托检验的情况:3.1供应商管理的要求,以及评估考核的方法公司建立物料供应商管理规程,由质量保证部会同供应部对主要供应商进行管理,并对供应商质量体系评估、考核。
(1)供应商的选择:选择供应商→对供应商进行现场评估考核→形成评估报告→质量管理部门批准→建立供应商档案→与主要供应商签订质量协议→确定供应商。
(2)供应商的评估和考核内容包括:供应商加盖红章的资质证明材料,如生产许可证、营业执照、产品注册证、GMP认证证书、包装材料许可证、物料的批准证明文件、质量标准、检验依据、检验结论;供应商的质量管理体系;供应商的人员机构、生产过程或经营过程的厂房实设施、设备、检验仪器、生产工艺流程和生产管理、物料管理、质量控制、文件系统等。
(3)供应商的评估考核办法:公司建立由质量保证部与供应部组成的供应商评估考核小组统筹评估考察供应商,对候选的物料逐个进行考评。
(4)对评估考核合格的供应商,填写物料供应商评估考核报告,对供应商进行综合评定,确定主要供应商名单报质量管理部门批准,交供应部执行采购,由质量保证部监督执行。
(5)物料供应商已经确定、应保持相对稳定,每年对供应商进行质量回顾,对出现问题的供应商采取纠正和预防措施。
(6)对需要变更的供应商应进行重新评估。
3.2委托生产、委托检验情况:接受委托生产情况,已向国家食品药品监督管理局备案。
4、企业的质量风险管理措施:4.1我公司企业的质量风险管理方针保证药品质量符合法定标准和预定用途。
4.2公司质量风险管理活动的范围和重点,以及在质量风险管理体系下进行风险识别、评价、控制、沟通和审核的过程。
(1)我公司风险管理活动的范围涵盖我公司生产的所有药品;(2)质量风险活动的重点为我公司所有药品品种生产的质量监控点;(3)风险活动的监控点及控制参数由生产部、生产车间、质量保证部、质量控制部、设备动力部、储运部、人事部、工程部依据《药品生产质量管理规范》、工艺规程、操作规程综合分析后制定,报由质量管理部门批准后执行,任何人无权擅自更改;(4)风险活动的监控点按剂型分品种制定;(5)风险活动的监控点的日常监控由车间QA执行,定期汇总上报质量保证部;(6)质量保证部对监控结果进行风险分析,并提出处理建议;(7)质量保证部通过风险分析,发现不良趋势或偏差应及时向生产管理部门反映,采取纠偏措施;(8)质量保证部门发现风险活动的监控点与监控标准发生较大偏差,严重危及药品质量时,有权要求生产部门停产,经生产管理部门、质量管理部门采取纠偏措施并对偏差进行风险分析确认无潜在的风险后方可重新开始生产;(9)质量控制部门在风险活动中监控到的不良趋势或偏差应及时向质量保证部门、生产车间通报,以便采取纠偏措施。
5、年度产品质量回顾分析:我公司每年12月份对上年度生:产情况进行年度质量回顾分析,对发现的不良趋势及偏差采取预防和纠偏措施;年度质量分析考察的重点是:重点考察含量、PH值、可见异物合格率、无菌、热源或细菌内毒素,工艺用水重点考察PH值、微生物。
第三部分人员1、公司质量保证、生产和质量控制的组织机构图(包括高层管理者),以及质量保证、生产和质量控制部门各自的组织机构图见附件组织机构图;2、公司企业关键人员及从事质量保证、生产、质量控制主要技术人员的数量及资历;高层管理者总经理:王盈,大学专科学历,高级经济师,从事食品生产XX年。
质量管理负责人:于小慧,大学专科学历,工程师,从事食品生产XXX年。
生产管理负责人:刘丽娜,大学专科学历,工程师,从事食品生产XX年。
