化工热力学课件
合集下载
第五章化工热力学课件

2、稳态流动
①连续 ②质量流率相等(无积累)③热力学性质不随时间变化
1 2 1 2 m(H1 u1 gz1 ) m(H 2 u2 gz2 ) WS Q 0 2 2 u 2 H gz Q Ws 积分、单位质量 2
微分流动过程
dH udu gdz Q Ws
H C p dT
373
813
27.89 4.27110 T dT
3
13386kJ / kmol Cp R S dT dP T P 373 27.89 1.013 3 4.27110 dT 8.314 ln 813 4.052 T 12.083kJ / kmol K
压缩机可以提高流体 的压力,但是要消耗功
枣庄学院 化学化工系
化工热力学
透平机和压缩机
2
H
u
2
gz Q Ws
是!
通常可以忽略
Ws H
是否存在轴功?
是否和环境交换热量? 位能是否变化? 动能是否变化?
不变化或者可以忽略 通常可以忽略
枣庄学院 化学化工系
化工热力学
节流阀 Throttling Valve
无流动功 单位流体
通常势能和动能无变化
d (mU) W Q dU W Q
枣庄学院 化学化工系
化工热力学
5.1 能量平衡方程
能量平衡方程的应用
1 2 1 2 d (mE) m1 (H1 u1 gz1 ) m2 (H 2 u2 gz2 ) WS Q 2 2
g为重力加速度。
1 2 E1 U1 u1 gz1 2
1 2 E2 U 2 u2 gz2 2
①连续 ②质量流率相等(无积累)③热力学性质不随时间变化
1 2 1 2 m(H1 u1 gz1 ) m(H 2 u2 gz2 ) WS Q 0 2 2 u 2 H gz Q Ws 积分、单位质量 2
微分流动过程
dH udu gdz Q Ws
H C p dT
373
813
27.89 4.27110 T dT
3
13386kJ / kmol Cp R S dT dP T P 373 27.89 1.013 3 4.27110 dT 8.314 ln 813 4.052 T 12.083kJ / kmol K
压缩机可以提高流体 的压力,但是要消耗功
枣庄学院 化学化工系
化工热力学
透平机和压缩机
2
H
u
2
gz Q Ws
是!
通常可以忽略
Ws H
是否存在轴功?
是否和环境交换热量? 位能是否变化? 动能是否变化?
不变化或者可以忽略 通常可以忽略
枣庄学院 化学化工系
化工热力学
节流阀 Throttling Valve
无流动功 单位流体
通常势能和动能无变化
d (mU) W Q dU W Q
枣庄学院 化学化工系
化工热力学
5.1 能量平衡方程
能量平衡方程的应用
1 2 1 2 d (mE) m1 (H1 u1 gz1 ) m2 (H 2 u2 gz2 ) WS Q 2 2
g为重力加速度。
1 2 E1 U1 u1 gz1 2
1 2 E2 U 2 u2 gz2 2
化工热力学课件化工专业本科阶段-(8)

解 W idHT0S
W L W s W idT 0S Q
T产生功
Ws Wid
Ws 0.85 WR
HQWs
可逆绝热过程 S1 S2
HWR
25
查过热水表汽表可知,初始状态1.57MPa, 484℃ 时的蒸汽焓、熵值为H1=3437.5kJ/kg, S1=7.5035kJ/(kg·K)
若蒸汽按绝热可逆膨胀,则是等熵过程,当膨胀 至0.0687MPa时,熵为 S´2=S1=7.5035kJ/(kg·K) 查过热水 蒸汽表
交换,例如传热过程也是可逆的
3
流动过程理想功的计算式
对于稳流过程,热一律表达式为:
H12C2gZQWS
忽略动,势能变化
HQWS
若可逆
QT0S
W id HT 0 S (7-41)
稳流过程理想功
4
注意点:
➢不忽略进出口的动能,势能的变化。完整的表达式为:
W id HT 0 S1 2 C 2g Z
➢体系经历一个稳流过程,状态发生变化,即可计算其 理想功,理想功的值决定于体系的始、终态与环境温度, 而与实际变化途径无关。
11
解:100kPa压力下水的沸点约为100℃,有水蒸气
表查得
H1=2676.1kJ/kg, S1=7.3549kJ/(kg·K) 在环境温度(T0=t0+273.15=293.15K)下, 100kPa压力下水的焓和熵为
H0=83.96kJ/kg, 所以加给水的热量为
S0=0.2966 kJ/(kg·K)
➢要区别可逆轴功与理想功这两个概念.WidWSRWc
对绝热过程
WC 0
Wid WSR
对不做轴功的过程 WSR 0
Wid Wc
化工热力学精ppt课件

基于临界性质的估算方法
利用纯物质在临界点附近的特殊性质,通过一 些经验公式或图表,估算其在其他条件下的热 物理性质。
混合物热物理性质预测方法
基于组分的加权方法
根据混合物中各组分的摩尔分数或质量分数,采用加权平均的方法 预测混合物的热物理性质。
基于活度的预测方法
引入活度系数来描述混合物中组分间的相互作用,通过活度系数与 纯物质性质的关联,预测混合物的热物理性质。
01
夹点技术
通过优化换热网络,降低能源消耗。
热泵技术
利用外部能源,提高低温热源的品 位,实现能量的升级利用。
03
02
热集成
将多个操作单元集成在一起,提 高能源利用效率。
04
节能技术与措施
改进工艺和设备
采用先进的生产工艺和设备,降低能源消耗。
设计优化方法
通过选择合适的萃取剂、优化萃取塔结构、改进操作条件 等方式,提高萃取过程的分离效率,降低能耗和投资成本。
案例分析
结合具体萃取案例,分析热力学原理在萃取过程设计中的 应用,以及优化方法对提高萃取效率的作用。
其他分离过程热力学原理简介
01
02
结晶过程热力学原理
利用物质在溶液中的溶解度随温度、压 力等条件的变化而变化的性质,实现物 质的分离和提纯。结晶过程涉及相平衡、 传热等热力学基本原理。
封闭系统
与外界有能量交换但没有物质交换的系统。
开放系统
与外界既有能量交换又有物质交换的系统。
热力学基本定律
热力学第零定律
如果两个系统分别与第三个系统处于热平衡状态,那么这两个系统也必定处于热平衡状态。
热力学第一定律
热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
利用纯物质在临界点附近的特殊性质,通过一 些经验公式或图表,估算其在其他条件下的热 物理性质。
混合物热物理性质预测方法
基于组分的加权方法
根据混合物中各组分的摩尔分数或质量分数,采用加权平均的方法 预测混合物的热物理性质。
基于活度的预测方法
引入活度系数来描述混合物中组分间的相互作用,通过活度系数与 纯物质性质的关联,预测混合物的热物理性质。
01
夹点技术
通过优化换热网络,降低能源消耗。
热泵技术
利用外部能源,提高低温热源的品 位,实现能量的升级利用。
03
02
热集成
将多个操作单元集成在一起,提 高能源利用效率。
04
节能技术与措施
改进工艺和设备
采用先进的生产工艺和设备,降低能源消耗。
设计优化方法
通过选择合适的萃取剂、优化萃取塔结构、改进操作条件 等方式,提高萃取过程的分离效率,降低能耗和投资成本。
案例分析
结合具体萃取案例,分析热力学原理在萃取过程设计中的 应用,以及优化方法对提高萃取效率的作用。
其他分离过程热力学原理简介
01
02
结晶过程热力学原理
利用物质在溶液中的溶解度随温度、压 力等条件的变化而变化的性质,实现物 质的分离和提纯。结晶过程涉及相平衡、 传热等热力学基本原理。
封闭系统
与外界有能量交换但没有物质交换的系统。
开放系统
与外界既有能量交换又有物质交换的系统。
热力学基本定律
热力学第零定律
如果两个系统分别与第三个系统处于热平衡状态,那么这两个系统也必定处于热平衡状态。
热力学第一定律
热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
化工热力学第三版课件
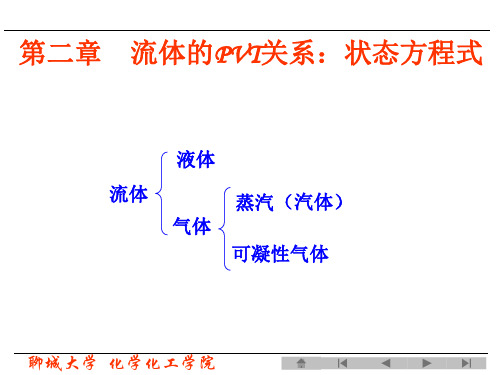
第二章
流体的热力学性质力 两相平衡线上: F=1 1
固
2
温度 图 2-1 纯物质的P-T图 (2)
聊城大学 化学化工学院
化工热力学
第二章
流体的热力学性质
第一节
压缩流体区 3 Super Critical Fluid (SCF) A Pc 临界温度下气体液化所需的最小压力 C 液相区 固相区
聊城大学 化学化工学院
化工热力学
第二章
流体的热力学性质
第一节
超临界流体的应用:
超临界流体萃取 超临界水氧化技术
超临界流体干燥
超临界流体色谱
超临界流体化学反应
常用的物质及临界点:
二氧化碳:304.3K 7.39MPa 水:647K 22MPa 甲醇:512K 8.1MPa 乙醇:516K 6.38MPa
第一节
超临界流体应用原理:
物质在超临界流体中的溶解度受压力和温度的影 响较大。可以利用升温、降压手段(或两者兼用) 将超临界流体中所溶解的物质分离析出,达到分离 提纯的目的。如:
高压条件下,使超临界流体与物料接触,物料中的有 效成分溶于超临界流体中(如萃取);分离后对溶有溶 质的超临界流体降压,溶质析出。 如果有效成分不止一种,可以采取逐级降压,使多种 溶质分步析出。 分离过程中没有相变,过程能耗低。
仍是一种气体,但又不同于一般气体,是一种稠密气态。 密度比一般气体要大两个数量级,与液体相近。 粘度比液体小,但扩散速度比液体快两个数量级,有 较好的流动性和传递性。 很强的溶解能力。 介电常数大,有利于溶解一些极性高的物质。
聊城大学 化学化工学院
化工热力学
第二章
流体的热力学性质
化工热力学38页PPT文档

热力学第零定律为建立温度的概念提供了实验基础。根 据第零定律,处于同一热平衡状态的所有体系必定有一宏观 特性是彼此相同的,描述此宏观特性的参数称为温度。可见, 温度是描述体系特性的一个状态函数。
南阳理工学院 生化学院
化工热力学
热力学的分支
第一章 绪 论
⑴工程热力学:十九世纪蒸汽机的发明和相应的科学形成了工程热力学,工 程热力学主要研究功热转换,以及能量利用率的高低。 ⑵化学热力学:化学热力学是应用热力学原理研究有关化学的各类平衡问题, 这在物理化学中是一个很重要的组成部分。离开了热力学原理,许多化学现 象就无法深入探讨下去。化学热力学主要侧重于热力学函数的计算,主要是 H、S、U、F 和G 的计算。 ⑶化工热力学:研究在化学工程中的热力学问题,化工热力学具有化学热力 学和工程热力学的双重特点。它既要解决能量的利用问题,又要研究解决相 际之间质量传递与化学反应方向与限度等问题。
南阳理工学院 生化学院
化工热力学
第一章 绪 论
化工热力学与其他化学工程分支学科的关系
原料
反应
分离提纯
产品
从这一过程可以提出这样几个问题:
反应工程
分离工程
⑴制造原料的获得。 ⑵选择反应工艺条件,设计反应器。
⑶确定分离、提纯方法,设计分离设备。
化工动力学 催化剂工程
化工热力学
针对这几个问题,就要考虑解决它的 办法,原则上为这样的解决途径,我们可
南阳理工学院 生化学院
化工热力学
第一章 绪 论
未来发 展:
热力学作为科技发展和社会进步的基石从来没有动摇过, 并已逐渐深入到材料、生命、能源、信息、环境等前沿领 域。热力学所处理的对象不单单是一般的无机、有机分子, 还包含有链状大分子、蛋白质分子、双亲分子、电解质分 子和离子等,其状态也不局限于常见的汽(气)、液、固三态, 还涉及高温高压、临界和超临界、微孔中的吸附态、液晶 态、微多相态等,这一切都对化工热力学提出了新的要求, 并向着连续热力学,带反应的热力学,高压与临界现象, 界面现象,电解质溶液,膜过程,高分子系统,生物大分 子,不可逆过程热力学,分子热力学,分子模拟等复杂系 统发展。
南阳理工学院 生化学院
化工热力学
热力学的分支
第一章 绪 论
⑴工程热力学:十九世纪蒸汽机的发明和相应的科学形成了工程热力学,工 程热力学主要研究功热转换,以及能量利用率的高低。 ⑵化学热力学:化学热力学是应用热力学原理研究有关化学的各类平衡问题, 这在物理化学中是一个很重要的组成部分。离开了热力学原理,许多化学现 象就无法深入探讨下去。化学热力学主要侧重于热力学函数的计算,主要是 H、S、U、F 和G 的计算。 ⑶化工热力学:研究在化学工程中的热力学问题,化工热力学具有化学热力 学和工程热力学的双重特点。它既要解决能量的利用问题,又要研究解决相 际之间质量传递与化学反应方向与限度等问题。
南阳理工学院 生化学院
化工热力学
第一章 绪 论
化工热力学与其他化学工程分支学科的关系
原料
反应
分离提纯
产品
从这一过程可以提出这样几个问题:
反应工程
分离工程
⑴制造原料的获得。 ⑵选择反应工艺条件,设计反应器。
⑶确定分离、提纯方法,设计分离设备。
化工动力学 催化剂工程
化工热力学
针对这几个问题,就要考虑解决它的 办法,原则上为这样的解决途径,我们可
南阳理工学院 生化学院
化工热力学
第一章 绪 论
未来发 展:
热力学作为科技发展和社会进步的基石从来没有动摇过, 并已逐渐深入到材料、生命、能源、信息、环境等前沿领 域。热力学所处理的对象不单单是一般的无机、有机分子, 还包含有链状大分子、蛋白质分子、双亲分子、电解质分 子和离子等,其状态也不局限于常见的汽(气)、液、固三态, 还涉及高温高压、临界和超临界、微孔中的吸附态、液晶 态、微多相态等,这一切都对化工热力学提出了新的要求, 并向着连续热力学,带反应的热力学,高压与临界现象, 界面现象,电解质溶液,膜过程,高分子系统,生物大分 子,不可逆过程热力学,分子热力学,分子模拟等复杂系 统发展。
《化工热力学》课件

提高产品质量和产量
通过改进热力学过程,可以提高产品的质量和产量,提升企业竞争力。
03
02
01
历史回顾
化工热力学起源于工业革命时期,随着科技的发展和工业的进步,逐渐形成一门独立的学科。
发展趋势
随着环保意识的提高和能源需求的增加,化工热力学将更加注重节能减排、资源循环利用和可再生能源的开发利用。
未来展望
总结词:熵增加
详细描述:热力学第二定律指出,在封闭系统中,自发过程总是向着熵增加的方向进行,即系统总是向着更加混乱无序的状态发展。这个定律对于化工过程具有重要的指导意义,因为它揭示了能量转换和利用的限制,以及不可逆过程的本质。
绝对熵的概念
总结词
热力学第三定律涉及到绝对熵的概念,它指出在绝对零度时,完美晶体的熵为零。这个定律对于化工过程的影响在于,它提供了计算物质在绝对零度时的熵值的方法,这对于分析化学反应的方向和限度具有重要的意义。同时,它也揭示了熵的物理意义,即熵是系统无序度的量度。
总结词
化工过程的能量效率是衡量化工生产经济效益的重要指标,通过提高能量效率,可以降低生产成本并减少环境污染。
能量效率是评价化工过程经济性和环境影响的重要参数。它反映了化工过程中能量转化和利用的效率。提高能量效率意味着减少能源的浪费,降低生产成本,同时减少对环境的负面影响。为了提高能量效率,需要采用先进的工艺技术和设备,加强能源管理,优化操作条件。
《化工热力学》PPT课件
xx年xx月xx日
目 录
CATALOGUE
化工热力学概述热力学基本定律化工过程的能量分析化工过程的热力学分析化工热力学的应用实例
01
化工热力学概述
提高能源利用效率
通过优化化工过程的热力学参数,可以降低能耗,提高能源利用效率。
通过改进热力学过程,可以提高产品的质量和产量,提升企业竞争力。
03
02
01
历史回顾
化工热力学起源于工业革命时期,随着科技的发展和工业的进步,逐渐形成一门独立的学科。
发展趋势
随着环保意识的提高和能源需求的增加,化工热力学将更加注重节能减排、资源循环利用和可再生能源的开发利用。
未来展望
总结词:熵增加
详细描述:热力学第二定律指出,在封闭系统中,自发过程总是向着熵增加的方向进行,即系统总是向着更加混乱无序的状态发展。这个定律对于化工过程具有重要的指导意义,因为它揭示了能量转换和利用的限制,以及不可逆过程的本质。
绝对熵的概念
总结词
热力学第三定律涉及到绝对熵的概念,它指出在绝对零度时,完美晶体的熵为零。这个定律对于化工过程的影响在于,它提供了计算物质在绝对零度时的熵值的方法,这对于分析化学反应的方向和限度具有重要的意义。同时,它也揭示了熵的物理意义,即熵是系统无序度的量度。
总结词
化工过程的能量效率是衡量化工生产经济效益的重要指标,通过提高能量效率,可以降低生产成本并减少环境污染。
能量效率是评价化工过程经济性和环境影响的重要参数。它反映了化工过程中能量转化和利用的效率。提高能量效率意味着减少能源的浪费,降低生产成本,同时减少对环境的负面影响。为了提高能量效率,需要采用先进的工艺技术和设备,加强能源管理,优化操作条件。
《化工热力学》PPT课件
xx年xx月xx日
目 录
CATALOGUE
化工热力学概述热力学基本定律化工过程的能量分析化工过程的热力学分析化工热力学的应用实例
01
化工热力学概述
提高能源利用效率
通过优化化工过程的热力学参数,可以降低能耗,提高能源利用效率。
化工热力学课件

1 kij
kij称为二元交互作用参数。
(2)Prausnitz等人建议用下式计算交叉项aij
aij
a
R
T2 2.5 cij
pcij
为了提高计算精度,也可以改变参数的混合规则,
如:
aM
yi y jaij
ij
aij (aia j )0.5 1 kij
bM
yi y jbij
1
bij 2 bii bjj 1 lij
主要内容
流体pVT关系发展概况 流体的非理想性 混合物的pVT行为 维里方程 立方型状态方程 总结
流体的p –V –T关系的发展概况
一、理想气体
1662年 Boyle定律
pV 常数
1834年 理想气体状态方程
pV RT
二、维里方程
Z
1
Bp
C p 2
1
B V
C V2
Onnes:1901年以一种经验的关系式开发出了维 里方程;
(2)适用于 1 Tci 2, 1 pci 2
2 Tcj
2 pcj
(3)对于组分差别很大的混合物,尤其对于具有
极性组元的系统以及可以缔合为二聚物的系统均
不适用。
(4)常应用于三参数压缩因子图等。
Prausnitz对计算各临界参数提出如下的混合规则:
Tcij (1 kij ) TciTcj
➢氯仿和二异丁基甲酮也形成氢键,但由于存在空间障碍, 络合的趋势小得多。
Cl Cl C H
Cl
CH3C
O CH3
C
O
C
C C C CC C C
比较同分异构体C2H6O的某些热力学性质,便可 以很好地说明氢键对于物化性质的强烈影响。
化工热力学的教学课件

第四章 溶液的热力学性质
本章要求: 1、掌握化学位、偏摩尔性质、逸度/逸度系数、
活度/活度系数、混合性质变化、超额性质等的 定义和计算 2、掌握溶液的性质及其规律 3、理想溶液与非理想溶液 4、Gibbs-Duhem方程 5、活度系数与超额自由焓的关系式
第四章 溶液的热力学性质 ——变组成体系热力学性质间关系式
第四章 溶液的热力学性质 ——偏摩尔性质
第四章 溶液的热力学性质 ——偏摩尔性质
第四章 溶液的热力学性质 ——偏摩尔性质
第四章 溶液的热力学性质 ——偏摩尔性质
第四章 溶液的热力学性质 ——偏摩尔性质
第四章 溶液的热力学性质 ——偏摩尔性质
第四章 溶液的热力学性质 ——偏摩尔性质
第四章 溶液的热力学性质 ——偏摩尔性质
第四章 溶液的热力学性质 ——变组成体系热力学性质间关系式
第四章 溶液的热力学性质 ——变组成体系热力学性质间关系式
第四章 溶液的热力学性质 ——变组成体系热力学性质间关系式
第四章 溶液的热力学性质 ——变组成体系热力学性质间关系式
第四章 溶液的热力学性质 ——变组成体系热力学性质间关系式
第四章 溶液的热力学性质 ——变组成体系热力学性质间关系式
第四章 溶液的热力学性质 ——变组成体系热力学性质间关系式
第四章 溶液的热力学性质 ——变组成体系热力学性质间关系式
第四章 溶液的热力学性质 ——变组成体系热力学性质间关系式
第四章 溶液的热力学性质 ——偏摩尔性质
第四章 溶液的热力学性质 ——偏摩尔性质
第四章 溶液的热力学性质 ——超额性质
第四章 溶液的热力学性质 ——活度系数与组成的关系
第四章 溶液的热力学性质 ——活度系数与组成的关系
化工热力学经典PPT课件

j
1 2
K j 1
K k 1
z jk 2kT
jk
12 高分子系统的分子热力学
多元系旋节线
A11
Dsp
A21
AK 1,1
A1,K 1
A2,K 1
0
AK 1,K 1
多元系临界点
Dsp 0
D1 A21 Dcri
AK 1,1
DK 1
A2,K 1
0
AK 1,K 1
Aij
2 A~V
● 再填充N1个组分1分子
只要将上式作一变换即可,即:
N2 N1 r2 r1 Nr N1r1
N1r1 0
所有N1个组分1分子的填充方式数为
1
z N1 (z 1) N1 (r1 2) N1N1r1 r1N1r1 NrN1 (r1 1) N1!e N1r1
12 高分子系统的分子热力学
混合物总的填充方式数为
12 高分子系统的分子热力学
胞腔模型
键长1,键角90和180 邻座数6
高分子溶液由立方格子堆 积而成,高分子由r个链节组 成,每个格子可以被高分子的 一个链节或一个溶剂分子占
据,但每个格子并非被高分子 链节或溶剂分子填满,而是留 有一定的空隙。格子的大小是 可以变化的,系统压力愈高, 格子愈小,填充后留下的空隙 也愈小。为可压缩液体,在此 基础上建立的模型能反映压力 变化对系统热力学性质的影响。 可以得到状态方程。
i
12 高分子系统的分子热力学
为简单起见,采用完全随机分布的近似处理:
N11 N1r1z1 / 2 N22 N2r2z2 / 2 N12 N1r1z2 N2r2z1
代入式(1)得
U z N1r1z111 / 2 N2r2z222 / 2 N1r1z212
《化工热力学》课件

Van der Waals方程
探讨Van der Waals方程对非理想气体的描述和应 用。
二元混合物
混合物的组成
解释二元混合物的组成及其对热力学性质的 影响。
离子交换
研究离子交换对二元混合物中的离子平衡的 影响。
相平衡曲线
介绍二元混合物相平衡曲线在化工热力学中 的重要性。
活度系数
讲解混合物中的活度系数及其在化工热力学 计算中的应用。
相边界
1
液-气相边界
探索液-气相边界及其在化工过程中
固-气相边界
2
的应用。
了解固-气相边界对于固体反应和蒸
馏过程的重要性。
3
液-固相边界
研究液-固相边界对于溶解过程和晶 体生长的影响。
气体相似性定律
波伊尔斯定律
讨论波伊尔斯定律及其在气 体流动和压缩过程中的应用。
查理定律
探索查理定律对气体热膨胀 和压力变化的影响。
熵和焓
1 熵的概念
2 焓的定义
解释熵作为热力学状态函数的概念和性质。
介绍焓的定义及其在化工热力学中的应用。
3 能量转换
4 热力过程。
说明热力学第一法则与焓的关系和在化工 过程中的应用。
状态方程及其应用
状态方程的定义
理想气体状态方程
介绍状态方程在化工热力学中的基本定义和应用。 研究理想气体状态方程及其在化工过程中的应用。
《化工热力学》PPT课件
通过本课件,您将深入了解化工热力学的基本概念和应用。从熵和焓到热力 学计算和催化反应,准备好探索化学工程的热能世界吧!
化工热力学概述
1 基本原理
2 重要性
3 实际应用
介绍化工热力学的基本 原理和主要研究领域。
化工热力学的教学课件5

第五章 化工过程的能量分析 ——功热间的转化
第五章 化工过程的能量分析 ——功热间的转化
第五章 化工过程的能量分析 ——功热间的转化
第五章 化工过程的能量分析 ——功热间的转化
第五章 化工过程的能量分析 ——功热间的转化
第五章 化工过程的能量分析 ——功热间的转化
第五章 化工过程的能量分析 ——理想功、损耗功及热力学效率
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——能量平衡方程
第五章 化工过程的能量分析 ——能量平衡方程
第五章 化工过程的能量分析 ——能量平衡方程
第五章 化工过程的能量分析 ——能量平衡方程
第五章 化工过程的能量分析 ——能量平衡方程
第五章 化工过程的能量分析 ——功热间的转化
第五章 化工过程的能量分析 ——功热间的转化
第五章 化工过程的能量分析 ——化工过程与系统分析
第五章 化工过程的能量分析 ——理想功、损耗功及热力学效率
化工热力学培训课件(ppt 35页)

log P2s 7.9392 1650.4 /(t 226.27) V2 22.888 3.642 102 T 0.685 104 T 2
P i (mmHg )
Vi (cm / mol )
3
t (C)
T (K )
解:由于低压气相理想气体,液相为非理想溶液,
汽液平衡关系为
T 38.45 42.00 46.00 50.00 54.00 58.00 62.33
x 1.00 0.7863 0.5810 0.405 0.254 0.127 0.000
y 1.00 0.9014 0.7728 0.623 0.450 0.249 0.000
65 60 55 50 45
P=53.3kPa
P kPa
s
p1 x1 p2 x2
s s s s
50 40 30 20 10 0 0.0 0.2 0.4 0.6 0.8 1.0
p1 x1 p2 (1 x1 ) ( p1 p2 ) x1 p2
s S
x(y)
(2) 求P=53.3 KPa时的T-x-y数据
(若指定x,则因为T未知,而T与Pis的关系为非线形 关系,求温度时要试差)
γ
汽-液平衡计算回顾:
根据独立变量的指定方案不同可以将汽-液平衡计算分 成以下两大类,即泡、露点计算和平衡闪蒸计算。
泡、露点计算的特点是已知温度、压力、汽相组成、 液相组成四者中的两个,去求另两个。
泡点压力计算: 指定液相组成x和温度T,求汽相组成y和压力P;
泡点温度计算: 指定液相组成x和压力P,求汽相组成y和温度T;
i
变化?
再次计算ΦiV,Ki 和
K x
7.3.3.2 活度系数法计算泡、露点
P i (mmHg )
Vi (cm / mol )
3
t (C)
T (K )
解:由于低压气相理想气体,液相为非理想溶液,
汽液平衡关系为
T 38.45 42.00 46.00 50.00 54.00 58.00 62.33
x 1.00 0.7863 0.5810 0.405 0.254 0.127 0.000
y 1.00 0.9014 0.7728 0.623 0.450 0.249 0.000
65 60 55 50 45
P=53.3kPa
P kPa
s
p1 x1 p2 x2
s s s s
50 40 30 20 10 0 0.0 0.2 0.4 0.6 0.8 1.0
p1 x1 p2 (1 x1 ) ( p1 p2 ) x1 p2
s S
x(y)
(2) 求P=53.3 KPa时的T-x-y数据
(若指定x,则因为T未知,而T与Pis的关系为非线形 关系,求温度时要试差)
γ
汽-液平衡计算回顾:
根据独立变量的指定方案不同可以将汽-液平衡计算分 成以下两大类,即泡、露点计算和平衡闪蒸计算。
泡、露点计算的特点是已知温度、压力、汽相组成、 液相组成四者中的两个,去求另两个。
泡点压力计算: 指定液相组成x和温度T,求汽相组成y和压力P;
泡点温度计算: 指定液相组成x和压力P,求汽相组成y和温度T;
i
变化?
再次计算ΦiV,Ki 和
K x
7.3.3.2 活度系数法计算泡、露点
《化工热力学》PPT课件

化工热力学
Chemical Engineering thermodynamic s
第四章 流体混合物的热力学性质
本章的学习目的: 通过本章的学习,掌握敞开体系
均相混合物的基本热力学关系及计算
枣庄学院 化学化工系
第四章 流体混合物的热力学性质
本章的知识点与重点
1、掌握变组成体系热力学性质间的关系 2、理解化学位、偏摩尔量、混合物的逸度及逸度系数
• 溶液的摩尔性质
M,如 U、H、S、G、V
• 偏摩尔性质 M i
• 纯组分的摩尔性质
,如 Ui、Hi、Si、Gi、Vi
Mi,如 Ui、Hi、Si、Gi、Vi
4.2 化学位和偏摩尔性质
(3)偏摩尔性质的计算 ⅰ解析法(截距法)
将
Mi
nM ni
T ,P ,n j
展开
Mi
M
n ni
T ,P,n
M ni
T
,P,n
M xk
T ,P,x
xk ni
n
j
j
j
(4-14)
4.2 化学位和偏摩尔性质
xk
nk n
x k n i
n j
n
n k n i
=0
nj
n
k
n n i
n2
=1 n j
xk ni
n
nk xk
n2
n
j
逐次代入 代入4-14 代入4-13
4.2 化学位和偏摩尔性质
M i
M
k i
xk
M xk
T ,P ,x ji ,k
二元体系
dM M1 M x2 dx2 或
M1
M
x2
Chemical Engineering thermodynamic s
第四章 流体混合物的热力学性质
本章的学习目的: 通过本章的学习,掌握敞开体系
均相混合物的基本热力学关系及计算
枣庄学院 化学化工系
第四章 流体混合物的热力学性质
本章的知识点与重点
1、掌握变组成体系热力学性质间的关系 2、理解化学位、偏摩尔量、混合物的逸度及逸度系数
• 溶液的摩尔性质
M,如 U、H、S、G、V
• 偏摩尔性质 M i
• 纯组分的摩尔性质
,如 Ui、Hi、Si、Gi、Vi
Mi,如 Ui、Hi、Si、Gi、Vi
4.2 化学位和偏摩尔性质
(3)偏摩尔性质的计算 ⅰ解析法(截距法)
将
Mi
nM ni
T ,P ,n j
展开
Mi
M
n ni
T ,P,n
M ni
T
,P,n
M xk
T ,P,x
xk ni
n
j
j
j
(4-14)
4.2 化学位和偏摩尔性质
xk
nk n
x k n i
n j
n
n k n i
=0
nj
n
k
n n i
n2
=1 n j
xk ni
n
nk xk
n2
n
j
逐次代入 代入4-14 代入4-13
4.2 化学位和偏摩尔性质
M i
M
k i
xk
M xk
T ,P ,x ji ,k
二元体系
dM M1 M x2 dx2 或
M1
M
x2
绪论化工热力学-PPT

活了全世界 10、生物医学工程
4
化工热力学和其她化学工程分支学科间得关系
全流程的 最佳化设 计和控制
吸收 系统 模拟
反应 系统 模拟
精馏 系统 模拟
吸收 塔计 算
反应 器计 算
换热 器计 算
精馏 塔计 算
反应 速度 计算
传质 计算
传热 计算
流体 力学 计算
相平 衡计 算
反应 平衡 计算
物料 平衡 计算
3)注意单位换算 能量:J,Cal,cm3、atm,cm3、bar 压力:kg/m2(工程压力),atm,mmHg,bar, Pa,MPa 温度:K,℃ ,oF,
4)循序渐进
29
四、为何学和如何学好化工热力学
3、教材与习题:
❖ 教材:董新法编,化工热力学,化学工业出版社,2008 ❖ 习题: 陈钟秀,顾飞燕编,化工热力学例题与习题,化学工业出版
15
经典热力学
❖ 无论就是工程热力学还就是化学热力学还 就是化工热力学,她们均就是经典热力学,遵 循经典热力学得三大定律(热力学第一、第 二、第三定律),不同之处就是由于热力学 应用得具体对象不同,决定了各种热力学解 决问题得方法有各自得特点。
16
一、 化工热力学得定义和用途
2、化工热力学得用途
2
化学工程能做什么?
❖ 早期化学工程得主要目标就就是使化学家实验室做出来得化 学反应商品化!
❖ 化学工程就是以化学、物理、生物、数学得基本原理作为基 础,研究化学工业和相关工业中得物质转化、物质形态和物质 组成得一门工程科学
10项顶尖成果 (1983年, AIChE )
1、合成橡胶:1983年,220亿磅/年。二战期间,及时解救了天然 橡胶匮乏得困境
4
化工热力学和其她化学工程分支学科间得关系
全流程的 最佳化设 计和控制
吸收 系统 模拟
反应 系统 模拟
精馏 系统 模拟
吸收 塔计 算
反应 器计 算
换热 器计 算
精馏 塔计 算
反应 速度 计算
传质 计算
传热 计算
流体 力学 计算
相平 衡计 算
反应 平衡 计算
物料 平衡 计算
3)注意单位换算 能量:J,Cal,cm3、atm,cm3、bar 压力:kg/m2(工程压力),atm,mmHg,bar, Pa,MPa 温度:K,℃ ,oF,
4)循序渐进
29
四、为何学和如何学好化工热力学
3、教材与习题:
❖ 教材:董新法编,化工热力学,化学工业出版社,2008 ❖ 习题: 陈钟秀,顾飞燕编,化工热力学例题与习题,化学工业出版
15
经典热力学
❖ 无论就是工程热力学还就是化学热力学还 就是化工热力学,她们均就是经典热力学,遵 循经典热力学得三大定律(热力学第一、第 二、第三定律),不同之处就是由于热力学 应用得具体对象不同,决定了各种热力学解 决问题得方法有各自得特点。
16
一、 化工热力学得定义和用途
2、化工热力学得用途
2
化学工程能做什么?
❖ 早期化学工程得主要目标就就是使化学家实验室做出来得化 学反应商品化!
❖ 化学工程就是以化学、物理、生物、数学得基本原理作为基 础,研究化学工业和相关工业中得物质转化、物质形态和物质 组成得一门工程科学
10项顶尖成果 (1983年, AIChE )
1、合成橡胶:1983年,220亿磅/年。二战期间,及时解救了天然 橡胶匮乏得困境
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
优点 体积小,功率大,结构紧凑,运行平稳
缺点 材料要求高 压气机消耗功率大
8.4 制冷循环原理与蒸汽压缩制冷过程分析
汽轮机中工质对外作功量(过程1→2) WS(R) H H2 H1 (kJ kg-1)
冷凝器中工质对外放热量
QL H H3 H2 (kJ kg-1)
水泵消耗的压缩功量
Wpump H H4 H3 V3 p4 p3 (kJ kg-1)
工质从锅炉中吸收的热量
QH H H1 H4 (kJ kg-1)
内燃机是一个敞开系统
每一个循环都要从外界吸入工质,循环结束时将废气
排于外界 适合使用汽油
与蒸汽动力循环 不同
8.2.2 定压加热循环 Diesel循环
p2
3
p2
3
T
4
0
1
V
排气阀
2
4
1
1
进气阀
V
(a) 实际工作原理图
(b) p-V 图 图 8-9 图 图 图 图 图 图
依靠压缩后的高温空气使燃料着火燃烧,使 用柴油 现代高速柴油机既有定压加热又有定容加热 混合加热循环
过热器
1'汽轮机
再热器 1
T
5
锅炉
发电机
4
6
2’
1 1’ 56
冷凝器
给水泵 3
冷却水
(a) 工作原理图
3
(b) T-S图
2 2’
x2x2’
S
图 8-7 再热循环图
目前超高压(蒸汽初压为13MPa和24MPa或更高)的大型电 厂几乎毫无例外地采用再热循环
8.2 内燃机热力过程分析
内燃机 使用气体或液体燃料,在汽缸中以燃烧时生成 的燃气作为工质驱动循环的机械装置
8.1.2.1 回热循环
1
过热器
汽轮机
发电机
T
1
锅炉
α1
7
水泵 3
6 9
水泵 2
α2 8
2 1-α1-α2
冷却水
3 冷凝器
水泵 1
4 α1
5
7 α2
9
1-α1-α2
3
一号回热器
二号回热器
(a) 工作原理图
图 8-5
(b) T-S 图
图图图图图图图图图图图图图图
1-α1
6 8 2
S
8.1.2.2 再热循环
点燃式内燃机(汽油机) 定容加热循环 混合加热循环
压燃式内燃机(柴油机) 定压加热循环
Jetta柴油车
8.2.1 定容加热循环 Otto循环
p
3
3
3
p
T
2
4
0
大气压力
1
2
V
2
4
4
排气阀 进气阀
(a)实际工作原理图
1
(b) p-V 图 V
1 S
(c) T-S 图
图 8-8 图 图 图 图 图 图 图 图 图 图 图 图 图
本章重点内容
1) Rankine循环的热力学分析方法,热效率、气耗率的 概念与计算,以及Rankine的改进方法。
2)了解Otto循环和Diesel循环燃气循环和燃气轮机过程 分析;
3) 逆Carnot循环与蒸汽压缩制冷循环的基本组成,制冷 系数和单位工质循环量的计算;
4) 热泵的基本概念和在工业生产中的应用; 5)了解深冷循环,掌握空气液化及其计算方法。
3
冷凝器(等压)
QL
T
c
TH
4
1
透平
WS
2
特征:透平机与水泵处于 两相区操作,均易产生“ 浸湿”、“气蚀”而损坏 1 设备。
TL
3
2
T-S图表达
S
8.1 蒸汽动力循环-Rankine循环过程分析
8.1.1 Rankine循环
1
组成
循环过程
过热器
汽轮机
锅炉
T
1
2
冷
凝
4
器
4
3
水
3
泵
(a) 工作原理图
(b) T-S图
降低冷凝器温度 提高锅炉温度
平均吸热温度
T 10 5
Tm
1
6 9
T
1' 1
cБайду номын сангаас
4'
5'
p1
4
p1
5
4
3
2
x2
8
7S
图 8-3 图 图 图 图 图 图
等效Carnot循环的平均吸热温度 Tm
3
p2
2' 2
x2 x2
S 图 8-4 图 图 图 图 图 T-S 图
1与1'点的压力高低 ?
8.1.2 Rankine循环的改进
第8章 蒸汽动力循环与制冷循环
第8章 蒸汽动力循环与制冷循环
内容概要
将热能变为机械能必须通过循环才能完成,而组成 循环的热力过程主要是在热力原动机中进行的。根据所 采用工质的不同,热力原动机循环分为两类:以蒸汽为 工质的称为蒸汽动力循环,而以气体为工质的则称为气 体循环。其中以蒸汽动力循环最为主要,其研究对象不 是原动机的结构与构件,而是工质所经历的状态及其变 化过程。
图8-1 Rankine蒸汽动力循环装置
2’
2
S
1→2 过热水蒸汽在汽轮机内等熵膨胀,变成湿蒸汽,同 时对外作输出轴功
2→3 湿蒸汽在冷凝器内等压、等温冷凝,变成饱和液体水 3→4 冷凝水在水泵中等熵压缩,进回至锅炉 4→1 水在锅炉中吸收热量,完成预热、汽化、过热阶 段过程,变成过热水蒸汽
热力学分析
热机 将热能转化为机械能等动力的装置
工厂、 交通工具、 居民、办公用电
热力循环过程 热机的工作循环 蒸汽动力循环 燃气动力循环 制冷 获得并保持低于环境温度的操作
制冷循环 输入外功实现从低温环境吸热排向高 温环境的循环
蒸汽动力循环
蒸汽压缩制冷循环
Carnot循环过程描述
QH
4 WC 水泵
锅炉(等压)
3 4
S (c) T-S 图
柴油机 压燃式内 燃机
8.3 燃气轮机过程分析
以空气及燃气为工质的旋转式热力发动机
油泵2
燃烧室
3
p23
燃气轮机
1 叶轮式压气机
空气
(a)实际工作原理图
4 发电机 废气
1 (b) p-V图
T
4 V
3
2
4
1
S (c) T-S图
图8-10燃气轮机装置循环 燃气轮机装置循环的热效率仅与增压比β有关/β愈大,热效率愈高
制冷循环是一种逆向循环。逆向循环的目的在于把 低温物体(热源)的热量转移到高温物体(热源)去。
根据Clausius对热力学第二定律的描述,要使热量从 低温物体传到高温物体,必须提供机械能或热能作为 代价。
如果循环的目的是从低温物体(如冷藏室、冷库等) 不断地取走热量,以维持物体的低温,称之为制冷循 环;如果循环的目的是给高温物体(如供暖的房间)不 断地提供热量,以保证高温物体的温度,称之为热泵 循环。习惯上,制冷温度在-100℃以上者,称为普冷, 低于-100℃者称为深冷。制冷广泛应用于化工生产中 的低温反应、结晶分离、气体液化以及生活中的冰箱、 空调、冷库等各方面。
热效率
T
WN QH
WS(R) Wpump QH
H2 H1 H4 H3
H1 H4
T
WS(R) QH
H1 H2 H1 H4
汽耗率 蒸汽动力装置中每输出1的净功所消耗的蒸汽量
SSC 3600 kg kWh-1
WN
提高Rankine循环热效率的途径
carnot
1 TL TH
