徐州细胞生物学膜片钳电生理技术原理及步骤
膜片钳技术的基本原理

膜片钳技术的基本原理膜片钳技术的基本原理膜片钳技术运用微玻管电极(膜片电极或膜片吸管)接触细胞膜,以千兆欧姆[gigaohm seal,1010欧姆(GΩ)]以上的阻抗使之对接,使与电极尖开口处相接的细胞膜小片区域(膜片)与其周围在电学上分隔,在此基础上固定电位,对此膜片上的离子通道的离子电流(pA 级)进行检测记录。
膜片钳技术的原理及应用(综述)Intro:细胞是构成生物体的基本单位。
细胞内和细胞之间的信号传导的重要途径是通过镶嵌在细胞膜上的离子通道蛋白进行的。
1976年,德国的两位细胞生物学家埃尔温. 内尔(Erwin Neher)和贝尔特. 萨克曼(Bert Sakmann)建立了一种以记录通过离子通道的离子电流来反映细胞膜上单一或多数离子通道分子活动的技术,成为膜片钳技术(Patch Clamp)。
这一技术使对细胞电活动的研究精度提高到1pA 的电流分辨率,1μm的空间分辨率和10μs的时间分辨率水平,是细胞和分子水平的生理学研究领域的一次革命性突破。
它与基因克隆技术(Gene Cloning)并驾齐驱,推动了生命科学研究的迅速发展。
为此,1991年的诺贝尔医学与生理学奖授予了这两位学者,以表彰他们的突出贡献。
这一能精确描述细胞通道特征的实验方法在问世后的短短十几年时间里,已经在生物学研究领域显示出了非常重要的意义和广阔的应用前景。
一. 膜片钳技术的基本原理膜片钳技术运用微玻管电极(膜片电极或膜片吸管)接触细胞膜,以千兆欧姆[gigaohm seal,1010欧姆(GΩ)]以上的阻抗使之对接,使与电极尖开口处相接的细胞膜小片区域(膜片)与其周围在电学上分隔,在此基础上固定电位,对此膜片上的离子通道的离子电流(pA 级)进行检测记录。
(如图1)图1 膜片钳技术原理图Rs是与膜片阻扰相串联的局部串联电阻(或称入路阻扰),Rseal 是封接阻抗。
Rs通常为1-5MΩ,若Rseal高达10GΩ以上时成为Ip/I=Rseal/(Rs+Rseal)-1,此Ip可作为在I-V转换器(点线)内的高阻扰反馈电阻(Rf)的电压下降而被检出。
膜片钳使用规则

膜片钳使用规则一、工作原理:1.膜片钳是一种可以直接观察单一的离子通道蛋白质分子对相应离子通透难易程度等特性的一种实验技术。
其基本原理是用一个尖端光洁,直径约为0.5~3um 的玻璃微电极同神经或肌细胞的膜接触而不刺入,然后在微电极另一端开口处施加适当的负压,将与电极尖端接触的那一小片膜轻度吸入电极尖端的纤细开口,这样在这一小片膜周边与微电极开口处的玻璃边沿之间,会形成紧密的封接,其电阻可达数个或数十个千兆欧,这实际上把吸附在微电极尖端开口处的那一片膜同其余部分的膜在化学上完全隔离出来,由微电极记录到的电流变化只同该膜片中通道分子的功能状态有关。
如果在这一小片膜中只包含了一个或少数几个通道蛋白分子,那么通过微电极测量出的电流,就是某种带电离子经由开放的单一通道蛋白质分子进行跨膜移动的结果。
二、操作步骤:1.打开总电源。
2.依次打开电脑、显微镜、监视器、微操、放大器。
3.打开PULSE软件,在E盘建立自己的文件夹。
4.灌注玻璃电极并排空气体。
5.装上玻璃电极,浸入液面并调至视野范围。
6.点击set-up,将增益调为0.5,点Auto,记录电极电阻。
7.封接细胞,若上G,提起或吸破细胞。
8.依次点击on-cell,whole-cell补偿。
9.选定In-out或whole-cell模式进行实验。
10.用毕请关闭仪器,并切断总电源。
三、注意事项:1.每天做实验前请用清水拖地,以防尘埃、静电伤害机器。
2.拉制仪使用前需预热15-30min。
3.银丝电极及地线发白时,请先用砂纸轻微打磨,再浸入新鲜的次氯酸钠溶液镀氯化银,如果银丝电极30min未变黑,则考虑更换次氯酸钠。
4.先开放大器,后开软件;先关软件,后关放大器。
5.非必须用到汞灯时请不要打开汞灯电源,打开后至少需1个小时才可关闭。
6.在放大器打开时绝对不能用手、金属物品或其它导电的物品接触电极丝(包括地线),在取放细胞片时请关闭放大器。
7.向玻璃微电极灌注内液时切勿灌太多(1cm左右为适),以防液体进入银丝底部增加噪声。
细胞生物学膜片钳电生理技术方案

探密神经元:细胞生物学膜片钳电生理技术想要深入了解神经元的内部世界,细胞生物学膜片钳电生理技术是必不可少的工具。
本文将为您详细介绍这一技术的流程和应用。
一、细胞生物学膜片钳电生理技术的流程
1. 细胞分离:使用一定的方法,将某特定细胞(比如神经元)从组织中分离出来。
2. 制备膜片钳:将玻璃毛细管拉制成1-2微米孔径,然后加热拉扯形成一个特定形状的膜片钳。
这个过程需要高超的技术和经验。
3. 吸管过程:将制备好的膜片钳接在一根吸管上,启动吸管的吸气功能,使得膜片钳固定上细胞表面。
4. 测量:通过膜片钳的电学特性测量细胞膜上的电流、电势变化等信息,以了解神经元在不同环境下的生理活动情况。
二、细胞生物学膜片钳电生理技术的应用
1. 突触传递:了解神经元之间信号传递的机制,通过刺激突触区域,测量膜片钳电生理信号,可以得知该突触区域对应神经递质的释放和再吸收等生理和病理过程。
2. 离子通道:如钾、钠、钙等离子通过通道进出神经元,参与神经元兴奋、抑制等生理过程。
细胞生物学膜片钳电生理技术则可以揭示这些离子通道的运转方式和动力学特点。
三、细胞生物学膜片钳电生理技术的注意事项
1. 技术难度较大:这种技术需要较高的专业性和技术能力,并且需要功能完备的设备。
2. 实验操作需谨慎:对细胞的操作需要精确细致,防止对细胞产生不必要的损伤。
同时操作过程中注意安全,防止伤害自己和他人。
细胞生物学膜片钳电生理技术是目前神经元研究最重要的技术手段之一。
实践证明,通过这一技术手段,可以更好地探究神经元内部的运作机制和行为特点,以及有针对性地进行药物筛选等工作。
细胞生物学膜片钳成像研究方案

细胞生物学膜片钳成像研究方案细胞膜是细胞最外层的一层膜,它扮演着维持细胞内外环境稳定的关键角色。
细胞膜的形态、运动和功能对细胞的生长发育及代谢活动起着至关重要的影响。
为了研究细胞膜的结构和功能,科学家们发明了一种专门用于研究细胞膜的工具——膜片钳。
这篇文章将详细介绍膜片钳成像研究方案。
一、膜片钳原理膜片钳原理是通过将一根精细的玻璃针端粘附在细胞膜上,控制针的移动,形成一个小型膜片,进而观察膜片表面和内部的结构和功能。
二、膜片钳制备制备膜片钳的关键是制备尖端的玻璃微针。
一般使用拉伸法制备微针,首先是将一段粗玻璃毛细管加热,使其柔软,然后拉伸成一根细长的玻璃针,最后将末端研磨成尖端。
在制备过程中需要注意保持微针的平衡和尖端的光滑度。
三、膜片钳成像膜片钳成像技术可以通过光学显微镜进行观察。
对于表面结构的观察,采用反射式显微镜对针尖下的细胞膜进行观察;对于内部结构的观察,采用荧光染色或融合表达荧光蛋白技术对膜片内部进行标记和观察。
四、膜片钳应用1. 研究细胞膜的电极性通过模拟离子流动并研究细胞膜电势变化,可以为准确理解细胞生物电现象提供必要的信息。
2. 研究膜蛋白的结构和功能通过观察膜片上的蛋白结构和对蛋白功能的研究,可以深入解析细胞膜功能的化学机制。
3. 研究膜增厚现象通过控制膜片的厚度,可以观察细胞膜增厚的过程和机制,为深入研究细胞膜生物学提供有价值的信息。
五、膜片钳的优缺点膜片钳成像技术可以实现对细胞膜表面和内部结构的高清晰度成像,是观察细胞膜的一个重要手段。
但是,膜片钳技术需要精细制备和操作,需要一定的技术力和时间耗费,同时也存在损伤细胞的风险。
六、结语随着细胞生物学研究的深入,膜片钳成像技术的应用范围也在不断扩大。
通过对细胞膜的结构和功能进行深入研究,我们可以更好地理解细胞生命的本质,为生命科学的发展提供强大的支持。
膜片钳技术及其应用

膜片钳技术可以用于研究细胞信号转导过程中离子通道和受体的变 化,了解信号转导的机制。
细胞功能调控的研究
膜片钳技术可以用于研究细胞功能调控的机制,例如细胞兴奋性的 调节和细胞内离子浓度的变化。
04 膜片钳技术的优势与局限 性
膜片钳技术的优势
高灵敏度
细胞无损
膜片钳技术具有高灵敏度,能够检测单 个离子通道的活动,从而提供关于细胞 膜电位和离子通道功能的重要信息。
膜片钳技术可以在保持细胞完整性的 情况下进行实验,不会对细胞造成严 重损伤或干扰细胞的正常功能。
实时监测
膜片钳技术可以对细胞膜电位进行实时 监测,从而了解离子通道的动态变化, 有助于深入理解细胞生理和病理过程。
膜片钳技术的局限性
1 2 3
实验条件要求高
膜片钳技术需要高精度的实验设备和条件,包括 低温、低噪声和低阻抗等,这增加了实验的难度 和成本。
03
04
05
膜片钳放大器
微操纵器
细胞培养皿或显 微镜载玻片
电极溶液
细胞内和细胞外 灌流液
用于放大细胞膜电信号, 提高信号的检测灵敏度。
用于精确控制电极的移动 ,以便在细胞膜上定位和 进行膜片钳实验。
用于培养和固定细胞,以 便进行膜片钳实验。
用于填充电极,以保持电 极的湿润和导电性。
用于维持细胞内外环境的 稳定,并排除干扰实验的 物质。
03
在单细胞水平上研究细胞信号转导和离子通道功能,深入了 解细胞生理和病理过程。
膜片钳技术与其他技术的联合应用
结合光学成像技术,利用膜片钳技术对神经元电生理特性进行同时监测和成像,实现多参数的同时测 量。
与基因编辑技术结合,利用膜片钳技术对特定基因表达的离子通道进行功能研究,深入了解基因与离子 通道的关系。
膜片钳技术原理

膜片钳技术原理膜片钳技术是一种常见的实验技术,广泛应用于生物学、药理学、细胞生物学等领域。
它是利用一种特殊的仪器,通过对细胞膜的控制和操作,实现对细胞内外环境的调控和研究。
膜片钳技术的原理主要涉及到膜片形成、膜片钳的构造和工作原理等方面,下面将对这些内容进行详细介绍。
首先,膜片的形成是膜片钳技术的基础。
膜片是由玻璃或石英毛细管制成的,其内外涂有一层导电性金属。
在形成膜片的过程中,需要将毛细管和细胞膜接触,利用毛细管的吸附作用将细胞膜抽附到毛细管上,形成一个微小的膜片。
这一步骤的关键是要保持膜片的完整性和稳定性,以确保后续实验的准确性和可靠性。
其次,膜片钳的构造是实现膜片钳技术的重要工具。
膜片钳通常由微操作系统、压力控制系统、电压控制系统等组成。
微操作系统用于控制膜片的形成和定位,压力控制系统用于控制膜片与细胞膜的接触压力,电压控制系统用于记录和调节膜片与细胞膜之间的电压变化。
这些系统的协同工作,使得膜片钳能够对细胞膜进行高度精准的操作和控制。
最后,膜片钳技术的工作原理是通过对膜片与细胞膜之间的接触和电学特性的测量,实现对细胞内外环境的调控和研究。
在实验中,可以通过改变膜片与细胞膜的接触压力和电压,观察细胞膜的电学特性和通透性的变化,从而研究细胞的离子通道、受体通道等功能。
同时,也可以利用膜片钳技术对细胞内外环境的离子浓度、pH值等进行精准调控,以研究细胞的生理和病理过程。
总之,膜片钳技术是一种重要的细胞生物学实验技术,其原理涉及膜片的形成、膜片钳的构造和工作原理等方面。
通过对这些原理的深入理解和掌握,可以更好地应用膜片钳技术进行细胞内外环境的调控和研究,为生物学、药理学等领域的研究工作提供重要的技术支持。
膜片钳技术
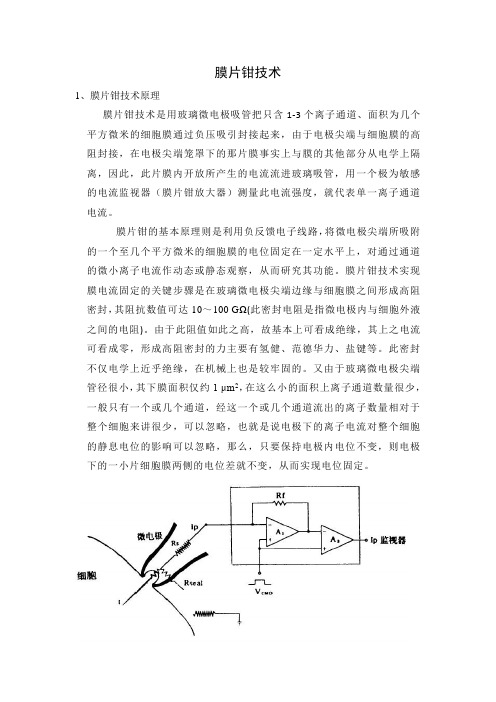
膜片钳技术1、膜片钳技术原理膜片钳技术是用玻璃微电极吸管把只含1-3个离子通道、面积为几个平方微米的细胞膜通过负压吸引封接起来,由于电极尖端与细胞膜的高阻封接,在电极尖端笼罩下的那片膜事实上与膜的其他部分从电学上隔离,因此,此片膜内开放所产生的电流流进玻璃吸管,用一个极为敏感的电流监视器(膜片钳放大器)测量此电流强度,就代表单一离子通道电流。
膜片钳的基本原理则是利用负反馈电子线路,将微电极尖端所吸附的一个至几个平方微米的细胞膜的电位固定在一定水平上,对通过通道的微小离子电流作动态或静态观察,从而研究其功能。
膜片钳技术实现膜电流固定的关键步骤是在玻璃微电极尖端边缘与细胞膜之间形成高阻密封,其阻抗数值可达10~100 GΩ(此密封电阻是指微电极内与细胞外液之间的电阻)。
由于此阻值如此之高,故基本上可看成绝缘,其上之电流可看成零,形成高阻密封的力主要有氢健、范德华力、盐键等。
此密封不仅电学上近乎绝缘,在机械上也是较牢固的。
又由于玻璃微电极尖端管径很小,其下膜面积仅约1 μm2,在这么小的面积上离子通道数量很少,一般只有一个或几个通道,经这一个或几个通道流出的离子数量相对于整个细胞来讲很少,可以忽略,也就是说电极下的离子电流对整个细胞的静息电位的影响可以忽略,那么,只要保持电极内电位不变,则电极下的一小片细胞膜两侧的电位差就不变,从而实现电位固定。
膜片钳技术的原理图[51]Rs是与膜片抗阻串联的局部串联电阻(或称入路阻抗),Rseal是封接阻抗。
RS通常为1~5MΩ,如果Rseal高达10GΩ以上是成为Ip/I=Rseal/(Rs+Rseal)-1。
此Ip可作为I~V转换器(点线)内的高阻抗负反馈电阻(Rf)的电压下降而被检测出。
实际上这是场效应管运算放大器(A1)的输出中包括着膜电阻成分,这部分将在通过第二级场效应管运算放大器(A2)时被减掉。
本实验采用的是全细胞记录模式。
全细胞记录构型(whole-cell recording)高阻封接形成后,继续以负压抽吸使电极管内细胞膜破裂,电极胞内液直接相通,而与浴槽液绝缘,这种形式称为“全细胞”记录。
膜片钳PPT课件

(二) 受体:细胞膜或细胞内能与某些化学物质(递质、调质、激素) 特
异性结合并产生生物效应的特殊分子。细胞膜上涉及到离子通道的主要受体:
Glu能离子型受体
激动剂
拮抗剂
AMPA
GluR1 Glu
CNQX
GluR2 AMPA
GluR3
GluR4
Kainate
GluR5 Glu
CNQX
GluR6 KA
• 配制切片液及灌流液ACSF,冻存切片液至冰水混合态 • 二元气饱和ACSF • 动物麻醉、断头、取脑、切片 • ACSF中孵育脑片至少30min • 拉制玻璃电极 • 脑片入记录槽,持续ACSF灌流1-3ml/min • 低倍镜定位,IR-DIC镜选择靶细胞
2021
23
• 玻璃微电极充灌电极内液(预配),并固定于电极夹持器 • 维持电极正压,入液,补偿液接电位 • 操纵电极尖端至靶细胞上方,压之有凹痕(快) • 撤正压,予负压,予半量钳制电压,GΩ(1min 内)封接
1. 结构研究:生化确定蛋白质氨基酸序列+X线衍 射确定结构+……
2.功能研究:电生理技术(膜片钳) +……
3.结构和功能相结合:电生理技术(膜片钳) +转 基因技术+……
2021
3
电流钳----测电压
向细胞内注入恒定或变化的电流,记录相应膜电位变化
电压钳----测电流
为负反馈系统。注入电流,同时钳制电压于固定的某值,此时注入电流恰 好与离子通道开放产生的离子流大小相等,方向相反,以此得知该离子流大 小及方向。
后予全量钳制电压
• 补偿C-fast,破膜 • 补偿C-slow,稳定10-15min
细胞电生理学基本原理与膜片钳技术

细胞电生理学基本原理与膜片钳技术细胞电生理学是研究细胞内外电流、电压变化以及与生物学功能的关系的学科。
而膜片钳技术则是细胞电生理学中最重要的实验技术之一,用于测量细胞膜上离子通道的电流。
细胞电生理学的基本原理是通过测量细胞膜上的电位变化来研究细胞内外离子的分布和运动。
细胞膜是由脂质双层组成的,其中包含了各种离子通道和离子泵,这些离子通道和泵的开闭状态会导致细胞内外离子浓度的变化,从而产生电位的变化。
膜片钳技术是一种高精度的电生理记录技术,通过将玻璃微电极与细胞膜紧密接触,形成一个微小的隔离空间,从而可以测量细胞膜上的电位变化。
膜片钳技术主要包括两种形式:全细胞膜片钳和单通道膜片钳。
全细胞膜片钳技术是将玻璃微电极与细胞膜上的一个小区域接触,通过控制微电极与细胞膜的紧密接触程度,形成一个微小的隔离空间,从而可以记录到整个细胞膜上的电位变化。
全细胞膜片钳技术可以用来研究细胞内外离子浓度的变化、离子通道的活性以及细胞内外离子的转运等。
单通道膜片钳技术是将玻璃微电极与细胞膜上的某一个离子通道接触,通过控制微电极与细胞膜的紧密接触程度,形成一个微小的隔离空间,从而可以记录到单个离子通道的电流变化。
单通道膜片钳技术可以用来研究离子通道的电导率、选择性以及开闭状态等。
膜片钳技术的关键是保持微电极与细胞膜的紧密接触,这需要一定的技术和经验。
在进行膜片钳实验时,需要注意控制微电极与细胞膜的距离、微电极的阻抗以及细胞膜的稳定性等因素,以确保记录到准确的电位变化或电流变化。
膜片钳技术的应用非常广泛。
它可以用来研究离子通道的结构和功能,揭示离子通道与各种生物学功能的关系。
比如,通过记录钠通道的电流变化,可以研究神经细胞的兴奋性和抑制性传递过程;通过记录钾通道的电流变化,可以研究细胞的稳定性和兴奋性调节等。
膜片钳技术还可以用于药物筛选和药理学研究。
通过记录离子通道的电流变化,可以评估不同药物对离子通道的影响,从而筛选出具有特定药理作用的药物。
细胞生物学膜片钳成像原理及步骤

细胞生物学膜片钳成像原理及步骤细胞生物学膜片钳成像原理及步骤一、原理膜片成像(Scanning Microscopy,SEM)是一种用于显微检查固体样品的技术,使用一种叫做钳成像的方法,利用电子观察技术,能够非常精确地检查出样品表面的细节。
膜片成像是一种无损的分析技术,在不改变样品的基本结构的情况下,能够提供样品表面的细节信息。
它可以用来分析各种类型的样品,如生物样品,体外器官分析,单分子活性等。
膜片成像的基本原理是向观察样品表面施加一个电子束,使样品表面上结构被激发产生电子。
这些电子被检测器收集,然后通过计算机技术构建出电子图像,以显示样品的结构和尺寸等相关信息。
二、步骤1、准备工作:样品的放置在膜片成像的过程中,需要先将样品放置到检测器上,一般采用分子偶合的方式将样品固定在检测器上。
然后,需要使用原子力显微镜将样品放置到指定的位置,以确保样品结构在检测器中的正确放置。
2、检测:电子束施加及电子探测经过样品放置后,接下来就要进行检测了。
此时,需要将电子束施加到检测样品表面上,使得样哮表面的结构被激发产生电子。
这些电子被检测器收集,并通过计算机技术构建出电子图像,以显示样品的结构和尺寸等相关信息。
3、分析:数据处理经过电子探测后,需要对检测的数据进行合理的处理,来进行深入的分析。
检测后的电子图像可以用于分析样品表面的特征。
此外,还可以通过梯度图像确定样品表面的几何特征,以及一些其他特征,以确定样品的结构。
4、报告:分析结果报告接下来就是针对样品检测后的数据进行分析,分析得出的结论最终会写成报告,提供给客户或者相关的研究机构。
这样客户就可以根据报告中的数据,对样品的结构、特征和性能等进行深入的分析,从而给出优化方案。
膜片钳技术原理及相关基本知识

膜片钳技术可以用于研究内分泌系统的电生理特性,了解激素分泌的 调节机制。
其他领域的应用
肿瘤学研究
膜片钳技术可以用于研究肿瘤细胞的 电生理特性,了解肿瘤的发生和发展 机制。
免疫学研究
膜片钳技术可以用于研究免疫细胞的 电生理特性,了解免疫反应的调节机 制。
THANKS
感谢观看
膜片钳技术可以用于药物筛选, 快速筛选出具有潜在治疗作用的 药物。
膜片钳技术可以用于研究药物对 离子通道的影响,了解药物的副 作用和不良反应。
生理学领域的应用
心血管系统研究
膜片钳技术可以用于研究心血管系统的电生理特性,了解心脏和血 管的电活动和功能。
呼吸系统研究
膜片钳技术可以用于研究呼吸系统的电生理特性,了解呼吸肌的电 活动和功能。
膜片钳技术的应用领域
生理学研究
研究细胞膜离子通道的电生理 特征和功能,揭示生理状态下
细胞膜电活动的规律。
药理学研究
研究药物对离子通道的作用机 制和效果,为新药研发提供实 验依据。
神经科学研究
研究神经元和神经网络的电活 动和信息传递机制,揭示神经 系统的工作原理。
疾病机制研究
研究疾病状态下细胞膜离子通 道的异常变化,为疾病诊断和
数据采集
使用膜片钳系统记录细胞膜 电位变化,通过放大器和记 录器获取数据。
数据筛选
排除异常或噪声数据,确保 数据质量。
数据转换
将原始数据转换为适合分析 的格式,如电压值或电流值 。
数据分析方法
统计分析
对数据进行统计分析,如平均值、标准差、相 关性等。
频谱分析
对数据进行频谱分析,以了解信号的频率成分。
膜片钳技术适用于多种细胞 类型,包括神经元、肌肉细 胞、上皮细胞等,具有广泛 的应用范围。
细胞电生理学与膜片钳技术ppt课件

CCD Camera
Vibration Isolation Table
Micro-Manipulators Remote Controller
Electrophysiology-Apparatus
DAD-VC system
MicroManipulators
CCD Camera
Electrophysiology-Apparatus
钠通道 钙通道 钾通道
神经类钠通道 骨骼肌类钠通道 心肌类钠通道(持久、瞬时)
L-型(心肌窦房结、房室结);T-型(心脏传 导组织);N-型(中枢神经系统神经元和突 触部位);P-型(大脑);Q-型(小脑、海 马、脊髓);R-型(神经细胞)
瞬时外向钾通道 (Ito) 延迟整流钾通f)
失活 状态
Inactive
state
复活
recovery 静息 状态
resting state
二、门控特性(Gating):
失活状态不仅是通道处于关闭状态, 而且只有在经过一个额外刺激使通道从 失活关闭状态进入静息关闭状态后,通 道才能再度接受外界刺激而激活开放。
失活
inactivation
开放 状态
心血管系统主要有: 1.乙酰胆碱激活钾通道(KACh):参与迷走调控。 2. ATP敏感钾通道(KATP):心肌缺血、缺氧开放。 3.钙激活钾通道(KCa):参与血管张力调控。
配体门控离子通道
KACh
KCa
ACh作用于M受体 去极化、[Ca2+]i↑
KATP
细胞内 ATP/ADP↓
增加舒张电位 复极化或超极化 缩短动作电位时程
细胞上,当钙通道尚未激活时,钠通道已经失活。 ➢ 对离子的选择性较低:在细胞外Ca2+浓度([Ca2+]o)下降
膜片钳技术及应用

膜片钳技术的应用领域
神经科学
研究神经元离子通道与动作电 位的产生和传播,以及药物对
神经元功能影响。
心血管
研究心脏离子通道与心律失常 的关系,以及抗心律失常药物 的作用机制。
药理学
研究药物对离子通道的作用机 制和效果,以及新药的开发和 筛选。
其他领域
膜片钳技术还可应用于内分泌 、免疫等领域,研究相关细胞
利用膜片钳技术,可以研究神经元在长期和短期内的电生理变化,了 解学习、记忆等认知过程的神经机制。
药物筛选与开发中的应用
药物作用机制的研究
膜片钳技术可以用于研究药物对离子通道或受体电流的影响,从 而揭示药物的作用机制。
药物筛选
通过膜片钳技术,可以在细胞或组织水平上快速筛选出具有特定 药理作用的药物候选物。
物或其他因素对细胞膜功能的影响。
03 膜片钳技术的应用实例
神经科学研究中的应用
神经元电活动的记录
膜片钳技术可以用来记录单个神经元在静息状态和刺激下的膜电位 变化,从而研究神经元的兴奋性和电生理特性。
突触传递的研究
通过膜片钳技术,可以记录突触后电位,研究神经递质释放、受体 激活和信号转导等过程。
神经可塑性的研究
在医学诊断与治疗中的应用
疾病诊断
膜片钳技术可用于检测细胞膜离子通道的异常变化,从而对某些 疾病进行早期诊断,如癌症、神经退行性疾病等。
药物研发
通过膜片钳技术可以研究药物对离子通道的作用机制,为新药研发 提供有力支持。
个体化治疗
根据患者的离子通道基因变异情况,膜片钳技术可以为个体化治疗 提供精准的用药建议。
高通量与高灵敏度
通过改进膜片钳技术的设计和材料,有望实现高通量和高灵敏度的检测, 从而能够同时记录多个细胞或同一细胞的不同活动,提高实验的效率和 精度。
膜片钳技术原理与基本操作

膜片钳技术原理与基本操作1976 年Neher 和Sakmann 建立了膜片钳技术(Patch clamp technique),这是一种以记录通过离子通道的离子电流来反映细胞膜上单一的或多数的离子通道分子活动的技术。
1981 年Hamill, Neher 等人又对膜片钳实验方法和电子线路进行了改进,形成了当今广泛应用的膜片钳实验技术。
该技术可应用于许多细胞系的研究,也是目前唯一可记录一个蛋白分子电活动的方法,膜片钳技术和克隆技术并驾齐驱给生命科学研究带来了巨大的前进动力,这一伟大的贡献,使Neher 和Sakmann 获得1991 年诺贝尔医学与生理学奖。
一、膜片钳技术的基本原理用一个尖端直径在1.5~3.0μm 的玻璃微电极接触细胞膜表面,通过负压吸引使电极尖端与细胞膜之间形成千兆欧姆以上的阻抗封接,此时电极尖端下的细胞膜小区域(膜片,patch)与其周围在电学上分隔,在此基础上固定(钳制,Clamp)电位,对此膜片上的离子通道的离子电流进行监测及记录。
基本的仪器设备有膜片钳放大器、计算机、倒置显微镜、示波器、双步电极拉制器、三轴液压显微操纵器、屏蔽防震实验台、恒温标本灌流槽、玻璃微电极研磨器。
膜片钳放大器是离子单通道测定和全细胞记录的关键设备,具有高灵敏度、高增益、低噪音及高输入阻抗。
膜片钳放大器是通过单根电极对细胞或膜片进行钳制的同时记录离子流经通道所产生的电流。
膜片钳放大器的核心部分是以运算放大器和反馈电阻构成的电流-电压(I-V)转换器,运算放大器作为电压控制器自动控制,使钳制电位稳定在一定的水平上。
二、操作步骤1.膜片钳微电极制作(1) 玻璃毛细管的选择:有二种玻璃类型,一是软质的苏打玻璃,另一是硬质的硼硅酸盐玻璃。
软质玻璃在拉制和抛光成弹头形尖端时锥度陡直,可降低电极的串联电阻,对膜片钳的全细胞记录模式很有利;硬质玻璃的噪声低,在单通道记录时多选用。
玻璃毛细管的直径应符合电极支架的规格,一般外部直径在1.1~1.2mm。
膜片钳技术流程

膜片钳技术流程嘿,朋友们!今天咱来唠唠膜片钳技术流程这超酷的事儿。
你就把它想象成一场精心策划的冒险之旅吧,每一步都充满了惊喜和挑战呢。
首先,准备工作就像是冒险前的装备整理。
得挑选合适的细胞或者组织,这就好比要挑选合适的队友一起踏上征程,可重要啦!细胞得状态良好,就像充满活力的小伙伴,准备好迎接接下来的挑战。
然后就是各种仪器设备的调试,显微镜啦、电极啦等等,这些家伙就像是我们冒险的得力工具,得确保它们都处于最佳状态,不然可就会影响整个旅程哦。
接下来,到了关键的封接阶段。
这就像是在搭建一座通往细胞内部神秘世界的桥梁。
把微电极轻轻地靠近细胞,小心翼翼地操作,就好像在摆弄一件珍贵的艺术品。
当电极和细胞膜形成紧密的封接时,那种感觉,哇哦,就像是找到了打开宝藏大门的钥匙孔一样,超级兴奋!这时候,电阻会发生变化,我们得时刻关注着,就像盯着指南针在茫茫大海中寻找方向一样。
如果封接成功,那简直太棒了,意味着我们离探索细胞的奥秘又近了一步。
然后是记录阶段啦。
这就像是打开了一本神秘的日记,开始记录细胞内部的点点滴滴。
通过膜片钳技术,我们可以测量到细胞的各种电生理参数,比如电流啦、电压啦。
这些数据就像是细胞的“悄悄话”,告诉我们它在干什么,它的状态如何。
我们要仔细地记录下来,每一个数据都可能是解开细胞奥秘的重要线索哦。
想象一下,我们就像是细胞的侦探,通过这些线索去了解细胞的“小秘密”,是不是很有趣呢?在整个过程中,实验人员的耐心和细心可是至关重要的哦。
就像一个耐心的渔夫,等待着鱼儿上钩一样,不能急躁。
稍微一点疏忽,可能就会让整个实验前功尽弃呢。
而且,每一个步骤都需要精确操作,就像在走钢丝一样,要保持平衡和稳定。
膜片钳技术流程虽然看起来有点复杂,但它真的是一个超级厉害的工具。
它让我们能够深入了解细胞的电生理特性,就像打开了一扇通往微观世界的窗户。
通过它,我们可以发现很多关于细胞功能和疾病机制的奥秘。
这对于医学研究、药物研发等等领域来说,简直就是宝藏啊!所以呀,膜片钳技术流程就像是一场精彩的冒险,充满了挑战和惊喜。
心脏电生理技术基础(膜片钳)

膜片钳实验操作技巧
准备工作
细胞处理
操作步骤
准备好玻璃微电极、电极填充
获取目标细胞,如心肌细胞或
将玻璃微电极进入细胞膜,形
液和录音设备。
神经元,进行培养和处理。
成一个密封,调整电极位置,
记录和分析电流。
结论和展望
膜片钳是研究心脏电活动和细胞膜离子通道的重要工具。随着技术的进步,
膜片钳的应用范围将进一步扩大,为心脏病、神经科学和药物研发等领域提
供更多的研究突破。
膜片钳的分类
全细胞膜片钳
内外膜片钳
通过破坏细胞膜,将膜片与细胞内外连接,可
只破坏细胞膜的一侧,可以选择性地记录细胞
以记录到细胞内外的完整电活动。
内或细胞外的电活动。
斜膜片钳
差分膜片钳
将膜片与细胞膜倾斜连接,可以记录到细胞内
通过使用两个膜片钳同时记录细胞内外的离子
部的离子通道电流。
通道电流,可以获得更精确的记录。
心脏细胞的电活动和离子通道功能。
变化,帮助研究神经传递机制。
药物筛选和研发
基因工程研究
膜片钳可以用来评估潜在药物对离子通道的作用,
通过记录细胞膜上的电活动,可以研究基因工程对
帮助药物筛选和研发。
细胞功能的影响。膜片钳的优源自点1优点 高分辨率记录细胞膜上的离子电流;可以精确地控制实验条件。
2
缺点
膜片钳的工作原理
膜片钳使用一根玻璃微电极将电极进入细胞膜,形成一个密封。通过施加负压,使电极与细胞膜贴合,形成一
个高阻抗的接触。然后,通过改变电极与细胞膜之间的电位差,可以测量细胞膜上的离子电流。
研究应用举例
心脏细胞的离子通道研究
膜片钳实验技术入门---基本原理与操作

膜片钳实验技术入门------基本原理与操作关兵才 李国华 刘理望按:本文乃于2003年根据较旧型号的仪器写成,后被《机能实验科学》 (郑先科主编,北大医学版,2006)收入。
因新旧仪器基本原理和操作步骤大同小异,现对原文略作修改和标注,供同学们参考。
【实验目的】1. 了解膜片钳技术的基本原理和操作。
2. 初步学习电压依赖性离子通道电流的基本记录方法。
【实验原理】一、膜片钳技术原理简介膜片钳(patch clamp)是一种主要用于检测细胞膜离子通道活动的电生理技术,按工作方式可区分为电压钳(voltage clamp)和电流钳是最基本的工作方式,即对细胞膜电位进行人为控制,如将膜电位钳制于某一固定水平,或在此基础上再施以阶跃(step)式或斜坡式(ramp)电压刺激,同时记录跨膜电流,从而分析细胞膜通道的活动。
电流钳即人为控制经微电极对细胞进行注射的电流(等于离子通道电流与细胞膜电容电流之和),同时记录膜电位及其变化。
若注射电流为零即常用的零位钳流,用于测量细胞膜静息电位,若注射方波脉冲刺激电流,用于诱发、观测动作电位。
另外,膜片钳技术还常用于观测细胞膜电容, 从而推测分泌细胞的活动情况。
下面主要介绍其电压钳工作方式的基本原理。
(注:在电生理资料中,因通常将细胞外液和记录系统的“地”点相连作为参考点即零电位点,所以电位和电压两个概念经常混用。
)根据膜片钳实验中受检细胞膜的型式(configuration)不同,又可将膜片钳分为全细胞式(whole-cell)、细胞贴附式(cell-attached 或on-cell)、内面朝外式(inside-out)、外面朝外式(outside-out)等四种模式。
(一)全细胞式1.电压钳制和电流记录的实现图9-9为全细胞式膜片钳工作原理示意图。
图9-9 全细胞膜片钳实验原理示意图A1:运算放大器;A2:单倍增益差动放大器;R f:反馈电阻;V p:电极电位(A1反向输入端电位);V c:A1同向输入端电位;C in:输入端杂散电容;C p:电极电容;Rs:串联电阻;C m:细胞膜电容;R m:细胞膜电阻;E m:细胞膜内在电位(指钳压时的细胞膜诸通道状态决定的内在Goldman-Hodgkin-Katz平衡电位);V o:A2输出端电位;V-offset:偏移电位补偿电位;C c:用于电容补偿的电容;V c(app):表观钳制电压即欲施加于受试膜片的电压;图中⊕和表示求和电路将充有电解质溶液的玻璃微电极(glass microelectrode或 recording pipette)利用负压紧密吸附于细胞表面,形成吉欧即千兆欧(109Ω)级高阻封接,进一步对微电极内施加负压、将放大器(以下简称运放)A1在深度负反馈工作状态下的“虚短路(virtual short circuit)”原理实现,即只要A1工作于线性范围内,其反向输入端的电位V p总是等于同向输入端的电位V c,这两个输入端之间虽非短路却类似于短路。
徐州细胞生物学膜片钳电生理技术原理及步骤

徐州细胞生物学膜片钳电生理技术原理及步骤
徐州细胞生物学膜片钳电生理技术是一种研究细胞膜离子通道的有效方法,其原理基于细胞膜上存在离子通道,可以使用微型电极记录离子通道的开放和关闭过程。
该技术以下列步骤进行:
1.制备微型电极:将细的玻璃管拉制成具有微小开口的电极,称为玻璃微针电极。
2.制备膜片:从细胞培养皿中取出细胞,并在适当的缓冲液中制成膜片,通常使用人工贴附法或机械剪切法制备薄膜。
3.在膜片上形成电极:将玻璃微针电极与膜片接触,通过微小的吸引力将玻璃微针电极吸附在膜片上。
4.形成紧密接触:通过微小的压力和真空吸附使玻璃微针电极与膜片紧密连接。
5.记录电流:使用电极记录器测量微小电流变化,记录离子通道的活动。
通过这些步骤,可以实现对单个离子通道的记录和分析,从而研究离子通道的特性和功能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
徐州细胞生物学膜片钳电生理技术原理及
步骤
徐州细胞生物学膜片钳电生理技术是一种用于研究细胞膜离子通道的高精度技术。
该技术可以通过测量细胞膜上的离子通道电流来研究离子通道的特性和功能。
下面将介绍该技术的原理和步骤。
原理:
徐州细胞生物学膜片钳电生理技术是一种利用微细玻璃管制作的膜片钳,将其与细胞膜贴合,形成一个微小的密闭空间,然后通过电极记录细胞膜上的离子通道电流的技术。
该技术可以测量离子通道的电流和电压,从而研究离子通道的特性和功能。
步骤:
1. 制备膜片钳:将微细玻璃管拉制成细管,然后用火烧制成膜片钳。
制备好的膜片钳需要在显微镜下进行检查,确保其质量符合要求。
2. 细胞培养:将需要研究的细胞培养在培养皿中,待细胞生长到一定程度后,用胰酶等酶类将细胞从培养皿中剥离出来。
3. 细胞贴附:将剥离出来的细胞放在培养皿中,待其贴附在培养皿底部后,用吸管将细胞吸到膜片钳上。
4. 形成膜片:将膜片钳与细胞膜贴合,形成一个微小的密闭空间。
然后用吸管将细胞内的液体抽出,形成一个膜片。
5. 记录电流:将电极插入膜片钳中,然后将电极连接到电压放大器上。
通过电压放大器可以放大细胞膜上的离子通道电流,从而记录下离子通道的电流和电压。
徐州细胞生物学膜片钳电生理技术是一种高精度的技术,可以用于研究细胞膜上的离子通道。
该技术需要制备膜片钳、培养细胞、贴附细胞、形成膜片和记录电流等步骤。
通过该技术可以深入了解离子通道的特性和功能,为研究细胞生物学提供了重要的工具。
