(整理)冻干甲型肝炎减毒活疫苗
十一种疫苗说明书

卡介苗的使用说明书【药物别名【分子式成分】本品是由Leon Calmette和Camile Guerin首创,今是用卡介菌种在综合培养液中培养后,收集菌膜,混悬于适宜的灭菌的保护液内,经冷冻干燥制成。
所得到的活菌制剂,具有产生抗体、增强免疫力、诱导γ-干扰素产生的作用。
冻干菌苗活菌数每毫克应在100万以上,皮内注射用稀释后,每1mL含0.5-1mg。
【制剂规格】粉针剂:0.5mg~0.75mg菌体。
本品冻干粉针剂为乳白色疏松固体或粉末,加入1mL注射用水应于2分钟内完全溶解为均匀混悬液,残余水分不应超过3%。
冻干卡介苗注射剂10人份/支。
贮法:保存在2-8℃暗处。
效期:1年。
卡介苗口服混悬液10mg:1mL。
口服用卡介苗1mL:50mg。
划痕用卡介苗(1)0.5mL:37.5mg (2)1mL:75mg。
皮内注射用卡介苗(1)1mL:0.5mg (2)1mL:0.75mg (3)2mL:1.5mg。
本品注射液为乳白色混悬液,pH值6.8-7.6,放置后菌体下沉,经轻摇能均匀分散。
【药理毒理】结核菌是细胞内寄生菌,因此人体抗结核的特异性免疫主要是细胞免疫。
接种卡介苗是用无毒卡介菌(结核菌)人工接种进行初次感染,经过巨噬细胞的加工处理,将其抗原信息传递给免疫活性细胞,使T细胞分化增殖,形成致敏淋巴细胞,当机体再遇到结核菌感染时,巨噬细胞和致敏淋巴细胞迅速被激活,执行免疫功能,引起特异性免疫反应。
释放淋巴因子是致敏淋巴细胞免疫功能之一,其中趋化因子(MCF)能吸引巨噬细胞及中性多核白细胞,使其趋向抗原物质与致敏淋巴细胞相互作用的部位移动,巨噬细胞抑制因子(MIF)能抑制进入炎症区的巨噬细胞和中性多核白细胞的移动,使它们停留在炎症或病原体聚集的部位,利于发挥作用。
MIF可使巨噬细胞发生粘着,并使吞噬反应显着增加。
巨噬细胞激活因子(MAF)主要作用是增加巨噬细胞的吞噬与消化能力,并加强巨噬细胞对抗原进行处理的能力,从而提高抗原的免疫原性作用。
哪些疫苗是减毒活疫苗

哪些疫苗是减毒活疫苗现在临床上有部分疫苗是减毒的活疫苗的,这个是只会引起我们人体的免疫反应的,不会引起人体生病的,种类还是很多的,因为这种疫苗的见效是很快的,就是通过生物方法将病毒的致病性降低的,下面就给各位讲解有关减毒活疫苗的健康知识的。
一、哪些疫苗是减毒活疫苗目前已经在临床使用的减毒活疫苗有:麻疹减毒活疫苗、甲型肝炎减毒活疫苗、冻干甲肝减毒活疫苗、冻干水痘减毒活疫苗、乙型脑炎减毒活疫苗、风疹减毒活疫苗、腮腺炎减毒活疫苗、口服脊髓灰质炎减毒活疫苗、口服狂犬病减毒活疫苗等。
减毒活疫苗是指病原体经过甲醛处理后,A亚单位(毒性亚单位)的结构改变,毒性减弱,但B亚单位(结合亚单位)的活性保持不变,即保持了抗原性的一类疫苗。
二、减毒活疫苗的优点1、诱导体液免疫和细胞免疫两种免疫反应,有的制品:通过自然感染途径接种,还可以诱导出黏膜免疫,使机体获得较广泛的免疫保护。
2、使用的是活的微生物,可在机体内长时间起作用、而诱导较强的免疫反应。
3、活的微生物有再增殖的特性,理论上只需接种一次,即可以达到满意的免疫效果。
4、可能引起水平传播,扩大免疫效果,增强群体免疫屏障。
5、无需添加佐剂;生产工艺一般不需要浓缩纯化;价格低廉。
三、减毒活疫苗的缺点1、一般减毒活疫苗均保留一定残余毒力,对一些个体(如免疫缺陷者)可能诱发严重疾病。
2、由于种种原因(如基因修饰等),减毒活疫苗有可能出现毒力返祖现象。
3、是活微生物制剂,可能造成环境污染、而引发交叉感染等。
4、缺损颗粒可能干扰疫苗的免疫效果。
5、产品的分析评估较为困难。
6、保存、运输等条件要求较高,如需冷链等。
以上就是关于减毒活疫苗的健康知识的,宝宝在接种疫苗的时候要注意时间的,千万不要超过期限的,否则就是没用的,还有感冒发烧的是不可以的,有时候由于免疫力的问题,极个别情况也会引起生病的,一般是家长也可以自己选择的。
一苗一训(各疫苗说明、禁忌、要求)

一、皮内注射用卡介苗说明书严禁皮下或肌内注射1、《药品名称》:通用名称:皮内注射用卡介苗2、《成份与性状》本品系用卡介苗菌经培养后收集菌体,加入稳定剂冻干制成。
为白色疏松或粉末,复溶后为均匀悬液。
本品主要成份为卡介菌,辅料包括明胶、蔗糖、氯化钾、味精。
接种对象:出生3个月以内的婴儿或用5IUPPD试验阴性的儿童(PPD 试验后48-72小时局部硬结在5mm以下者为阴性)。
3、《作用与用途》接种本疫苗后,可使机体产生细胞免疫应答,用于预防结核病。
4、《规格》每支5次人用剂量含卡介菌0.25mg.每1mg卡介菌数应不低于1.0*106cfuSSSS5、《免疫程序和剂量》(1)5次人用剂量卡介菌加入0.5ml所附稀释剂,放置约1分钟,摇动使之溶解后必须在半小时内用完。
(2用灭菌的1ml蓝心注射器(25-26号针头)吸取摇匀的疫苗,在上臂外侧三角肌中部略下处皮内注射0.1ml。
6、《不良反应》接种后2周左右,局部可出现红肿浸润,若随后化脓,形成小溃疡,可用1%龙胆紫涂抹,以防感染。
一般8-12周后结痂,如遇局部淋巴结软化形成脓疱,应及时诊治。
7、《禁忌》(1)患结核病、急性传染病、肾炎、心脏病者。
(2)患湿疹或其他皮肤病者。
(3)患免疫缺陷症者8、〈注意事项〉(1)严禁皮下或肌内注射(2)使用前请检查包装容器、标签、外观、效期是否符合要求。
疫苗瓶有裂纹者不得使用。
(3)本品重溶时间应不超过3分钟。
(4)接种对象改须详细登记姓名、性别、年龄、住址、疫苗批号及亚批号、制造单位和接种日期。
(5)接种卡介苗的注射器应专用、不得用作其他注射,以及产生化脓反应。
(6)使用时应注意避光。
9、〈贮藏〉于2-8℃避光保存和运输。
10、〈包装〉棕色安瓿,10支/盒〈有效期〉24个月二、脊髓灰质炎减毒活疫苗糖丸(人二倍体细胞)1、〈药品名称〉通用名称:脊髓灰质炎减毒少疫苗糖丸(人二倍体细胞)2、〈成份和性状〉本品系用脊髓灰质炎病毒一、二三型减毒株分别接种于人二倍体细胞,经培养、收获病毒液后制成。
常用疫苗组成分
乳糖
核酸
灭菌、无热原PBS
A群C群脑膜炎球菌多糖疫苗
A群和C群脑膜炎球菌荚膜多糖
乳糖
苯酚
灭菌、无热原PBS
水痘减毒活疫苗
水痘减毒活病毒
明胶、蔗糖、人血白蛋白、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水
冻干人用狂犬病疫苗
(Vero细胞)
灭活的狂犬病固定病毒
明胶、蔗糖、
人血白蛋白
Vero细胞DNA残余、宿主细胞蛋白残留、牛血清白蛋白、抗生素
白砂糖、葡萄糖、奶粉、奶油
抗生素
脊髓灰质炎减毒活疫苗糖丸(猴肾细胞)
Ⅰ、Ⅱ、Ⅲ型脊髓灰质炎减毒活病毒
白砂糖、葡萄糖、奶粉、奶油
抗生素
口服脊髓灰质炎减毒活疫苗(猴肾细胞)
Ⅰ、Ⅱ、Ⅲ型脊髓灰质炎减毒活病毒
酚红、氯化镁
抗生素
口服轮状病毒活疫苗
轮状病毒减毒活病毒
蔗糖、乳糖
抗生素
卡介菌活菌体
蔗糖、明胶、谷氨酸钠
——
灭菌注射用水
乙型脑炎减毒活疫苗
乙脑减毒活病毒
明胶、蔗糖、人血白蛋白、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水或灭菌PBS
冻干乙型脑炎灭活疫苗(Vero细胞)
灭活的乙型脑炎病毒P3株
明胶、蔗糖、人血白蛋白、谷氨酸钠
牛血清白蛋白、抗生素、甲醛
灭菌注射用水
冻干甲型肝炎减毒活疫苗
灭菌注射用水
人用狂犬病疫苗
(Vero细胞)
灭活的狂犬病病毒固定毒
蔗糖、硫柳汞、明胶
Vero细胞DNA残余、宿主细胞蛋白残留、牛血清白蛋白、抗生素
灭菌注射用水
人用狂犬病疫苗
(地鼠肾细胞)
冻干甲型肝炎减毒活疫苗成品检定方法的优化

冻干甲型肝炎减毒活疫苗成品检定方法的优化钱汶;陈军;金巧军;张轶侠;陈悦青;夏华良;庄昉成;邵健忠【期刊名称】《中国公共卫生》【年(卷),期】2006(22)11【摘要】目的对冻干甲肝减毒活疫苗成品检定中关键性项目的检定方法进行优化。
方法(1)感染性滴度检测:建立微量免疫荧光法,并与常规组织培养ELISA法比较;(2)牛血清白蛋白残留量检测:比较反向间接血凝法、酶联免疫法的重复性、精确性;(3)水分含量测定:建立助溶剂加入法,并比较助溶剂加入前后冻干疫苗水分含量检测结果。
结果(1)微量免疫荧光法灵敏度与常规组织培养ELISA法相仿(P>0.05),重复性佳,可提前1周左右出结果;可用Leica Qwin荧光定量分析系统标定化判断结果。
(2)反向间接血凝法测定结果不稳定,2批疫苗5次测定结果的变异系数(CV)为39.12%,34.23%;酶联免疫法的重复性,精确性均较佳(CV)为2.12%,2.82%,回收率为101.73%。
(3)助溶剂加入前后2批疫苗5次测定结果的CV分别由8.32%,9.03%降为1.85%,1.82%。
结论微量免疫荧光法有望代替常规组织培养ELISA法用于疫苗滴度检测;牛血清白蛋白残留量测定中酶联免疫法优于反向间接血凝法;加入助溶剂有利于提高疫苗水分含量检测的重复性。
【总页数】3页(P1359-1361)【关键词】冻干甲肝减毒活疫苗;感染性滴度;水分含量;牛血清白蛋白残留量【作者】钱汶;陈军;金巧军;张轶侠;陈悦青;夏华良;庄昉成;邵健忠【作者单位】浙江大学生命科学学院生物技术系;浙江省医学科学院病毒所【正文语种】中文【中图分类】R383.3【相关文献】1.注射用丹参(冻干)调配技术正交优化及其成品输液质量稳定性 [J], 吴凤芝;唐祺;吴妍;邓晓媚;刘圣2.冻干甲型肝炎减毒活疫苗灌装设备的清洁验证对保证产品质量的重要性 [J], 王华;周延彬;张德利;魏鹏;肖想3.动态浊度法检测冻干甲型肝炎减毒活疫苗细菌内毒素含量的研究 [J], 曾艳;孙阳;蓝燕;崔越;董历子;杨红育4.冻干甲型肝炎减毒活疫苗与免疫规划疫苗同时接种疑似预防接种异常反应监测数据分析 [J], 蒋蕊鞠;殷琼洲;徐明珏;赵志梅;邓燕;宁若彤;车艳春5.注射用双黄连(冻干)调配方法优化及其成品输液稳定性研究 [J], 怀斌;郑学燕;陈智;杜洁因版权原因,仅展示原文概要,查看原文内容请购买。
一二类疫苗及价格
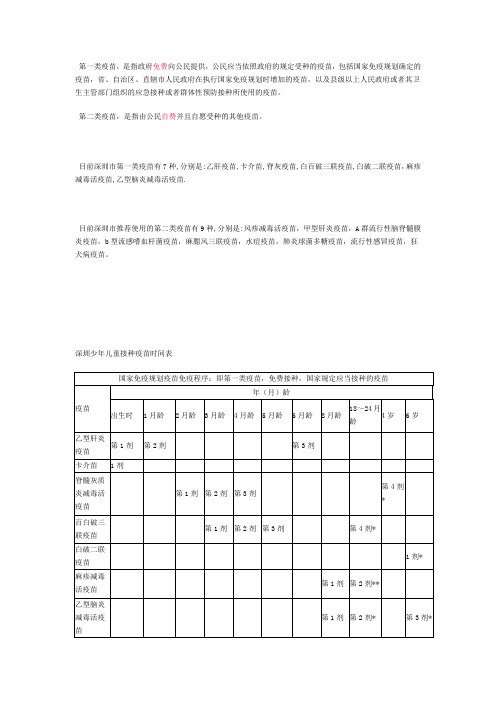
第一类疫苗,是指政府免费向公民提供,公民应当依照政府的规定受种的疫苗,包括国家免疫规划确定的疫苗,省、自治区、直辖市人民政府在执行国家免疫规划时增加的疫苗,以及县级以上人民政府或者其卫生主管部门组织的应急接种或者群体性预防接种所使用的疫苗。
第二类疫苗,是指由公民自费并且自愿受种的其他疫苗。
目前深圳市第一类疫苗有7种,分别是:乙肝疫苗,卡介苗,脊灰疫苗,白百破三联疫苗,白破二联疫苗,麻疹减毒活疫苗,乙型脑炎减毒活疫苗.
目前深圳市推荐使用的第二类疫苗有9种,分别是:风疹减毒活疫苗,甲型肝炎疫苗,A群流行性脑脊髓膜炎疫苗,b型流感嗜血杆菌疫苗,麻腮风三联疫苗,水痘疫苗,肺炎球菌多糖疫苗,流行性感冒疫苗,狂犬病疫苗。
深圳少年儿童接种疫苗时间表
来源:深圳市疾病控制中心,本地宝编辑整理。
冻干甲型肝炎减毒活疫苗 中科院

冻干甲型肝炎减毒活疫苗【药品名称】通用名称:冻干甲型肝炎减毒活疫苗商品名称:维赛瑞吉【规格】本品复溶后每瓶1.0ml。
每1次人用剂量1.0ml,含甲型肝炎活病毒应不低于6.50lgCCID50。
【剂型】冻干粉针剂【成分和性状】本品系将甲型肝炎病毒H2减毒株接种于人二倍体细胞KMB17株,经培养、收获病毒液、提取病毒,加稳定剂冻干制成。
本品为乳白色疏松体,复溶后为澄明液体。
有效成分:甲型肝炎减毒活病毒。
辅料:明胶、海藻糖、甘氨酸和右旋糖苷。
疫苗稀释剂:灭菌注射用水。
【接种对象】1岁半以上的甲型肝炎易感者。
【作用与用途】接种本品后,可刺激机体产生抗甲型肝炎病毒免疫力。
用于预防甲型肝炎。
接种前应排除以下禁忌(1)已知对该疫苗中的任何组分,包括辅料及硫酸卡那霉素过敏者;(2)妊娠期妇女禁用;(3)患急性疾病、严重慢性疾病、慢性疾病的急性发作期、发热者;(4)免疫缺陷、免疫功能低下或正在接受免疫抑制剂治疗者;(5)患未控制的癫痫和其他进行性神经系统疾病者。
详情请参考说明书。
接种时应注意:(1)疫苗瓶有裂纹、标签不清或过有效期者、疫苗复溶后出现浑浊等外观异常者均不得使用。
(2)应备有肾上腺素等药物,以供偶有发生严重过敏反应时急救用,接受注射者在注射后应在现场观察至少30分钟。
(3)接种本品与注射人免疫球蛋白应至少间隔3个月以上,以免影响免疫效果。
(4)使用其他减毒活疫苗与接种本疫苗应至少间隔1个月以上,以免影响免疫效果。
(5)本品为减毒活疫苗,一般不推荐在该病流行期使用。
(6)应仔细阅读产品说明书内描述的其他事项。
推荐使用人群:1岁半以上的甲型肝炎易感者。
疫苗安全性:维赛瑞吉®自2006年上市以来为全国提供4000多万人份疫苗,未监测到一例与疫苗相关的严重不良反应。
常见不良反应:(1)一般接种疫苗后24小时内,注射部位可能出现疼痛和触痛,多数情况下于2~3天内自行消失。
(2)一般接种疫苗后1~2周内,可能出现一过性发热反应。
疫苗知情同意书

冻干甲型肝炎减毒活疫苗接种知情同意书甲型肝炎简称甲肝,是由甲型肝炎病毒引起的一种以肝脏损害为主的急性消化道传染病,以疲乏、食欲减退、厌油、肝功能异常为主,部分病例可出现黄疸。
通过粪口途径传播。
甲肝是我国最常见急性传染病之一,在病毒性肝炎中发病率仅次于乙肝位居第二。
接种甲肝疫苗是预防甲肝的有效手段。
【接种对象和免疫程序】1岁半以上的人群。
国家免疫程序规定在18月龄时接种,于上臂外侧三角肌附着处皮下注射1ml。
【禁忌症】⑴已知对该疫苗所含的任何成分过敏者。
⑵妊娠期妇女。
⑶患急性疾病、严重慢性疾病、慢性疾病的急性发作期、发热者。
⑷免疫缺陷、免疫功能低下或正在接受免疫抑制剂治疗者。
⑸患未控制的癫痫和其他进行性神经系统疾病者。
【注意事项】⑴有以下情况者慎用:家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、哺乳期妇女。
⑵对适龄儿童免费接种。
⑶注射人免疫球蛋白者应至少间隔3个月以上接种本疫苗,以免影响免疫效果。
⑷育龄期妇女注射本疫苗后,应至少3个月内避免怀孕。
⑸接种后应在接种单位的留观区域观察30分钟,无不良反应方可离开。
⑹任何疫苗的保护效果还不能达到100%。
少数人接种后未产生保护力,或者仍然发病,与疫苗本身特性和受种者个人体质有关。
⑺家长(监护人)应如实提供儿童健康状况、有无过敏史、患病史和家族病史等。
【不良反应】少数人在接种疫苗后24小时内,可出现注射部位疼痛和触痛,多数情况下于2~3天内自行消失。
在接种疫苗后1~2周内,也可能出现一过性发热反应。
其中大多数为轻度发热反应,一般持续1~2天后可自行缓解,不需处理,必要时适当休息,多喝开水,注意保暖,防止继发感染;对于中度发热反应或发热时间一般超过48小时者,可采用物理方法或药物对症处理。
偶有皮疹出现,不需特殊处理,必要时可对症治疗。
如出现其它严重不良反应,应及时诊治并与接种单位联系。
儿童姓名:家长姓名:年月日冻干甲型肝炎减毒活疫苗接种知情同意书甲型肝炎简称甲肝,是由甲型肝炎病毒引起的一种以肝脏损害为主的急性消化道传染病,以疲乏、食欲减退、厌油、肝功能异常为主,部分病例可出现黄疸。
冻干甲型肝炎减毒活疫苗(长春所)

关爱生命
呵护健康
五、甲肝的免疫预防
未经甲肝病毒感染,体内未形成抗体的属于易感人群,保 护易感者是防止甲肝暴发流行的重要手段。当群体中抗-
HAV阳性率不足40%时,有导致甲肝流行的危险,而当抗
体阳性率达到80%时(例如通过免疫预防),即使有传染 源和传播因素存在,亦不致暴发流行或流行可被中止。
1、养成良好的卫生习惯
关爱生命
呵护健康
关爱生命
呵护健康
关爱生命
呵护健康
关爱生命
呵护健康
三、甲肝减毒活疫苗生产工艺流程
检定
•细胞鉴别试验 •无菌检查 •支原体检查
工作库细胞
工作病毒种子批
病毒接种
换液
检定
•细胞内外源病毒因子检查
•致瘤性检查
•鉴别试验 •无菌检查 •支原体检查 •病毒滴定
•病毒外源因子检查
洗换 收获病毒 纯化处理
关爱生命
呵护健康
(一)、安全性结果
562名观察对象接种后无局部反应发生;全身反应以发热为主,且均为轻度 发热。
接种前 观察人数 562 体温均值 36.50±0.33 轻度发热 人 数 0 接种后30min 接种后24h 562 562 36.49±0.26 36.45±0.27 23(4.09%) 接种后48h 562 36.47±0.23 接种后72h 562 36.45±0.21 2(0.4%)
1、主要检测指标
自2006年实行批签发制度至今,疫苗批签发合格率100%。 主要项目检测结果如下: ①病毒滴度:每剂病毒滴度7.00 LgCCID50/ml(国家标准为不低于 6.50LgCCID50/ml)。 ②热稳定性试验:疫苗出厂前进行热稳定性试验,即于37℃放置72小时,病毒 滴度≥6.67 LgCCID50/ml(国家标准为不低于6.50LgCCID50/ml),病毒滴 度下降≤0.33 LgCCID50/ml(国家标准为不高于0.50 LgCCID50/ml)。 ③三氯甲烷残留量为0~0.0009%(国家标准为不高于0.006%)。 ④牛血清白蛋白残留量不高于2ng/剂-7ng/剂(国家标准为不高于50ng/剂)。 2007年12月实行病毒滴度双通过检定
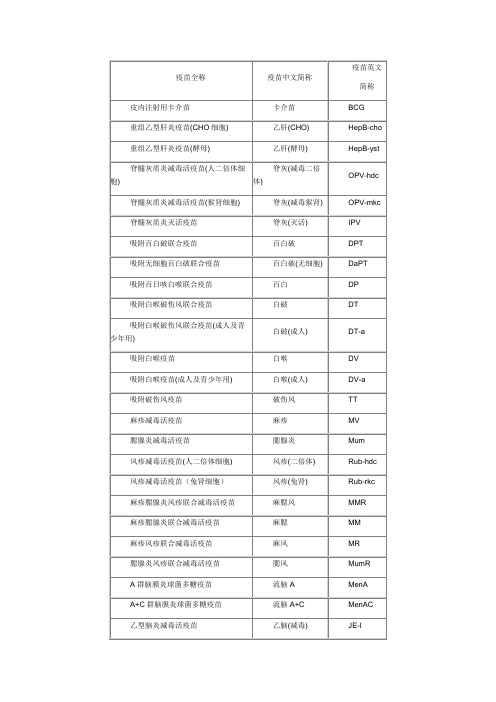
(整理)疫苗名称及英文缩写

疫苗名称表冻干皮内卡介苗','卡介苗','BCG','吸附百白破混合制剂','百白破','DPT''流行性乙型脑炎疫苗','乙脑','JE',是否冻干麻疹活疫苗','麻疹','MV',乙型肝炎疫苗','乙肝','HepB','B型流感嗜血杆菌疫苗','HIB','Hib',破伤风免疫球','破伤风免疫球','TIG',麻风二联疫苗','麻风','MR','伤寒','伤寒','Typh','甲型肝炎疫苗','甲肝','HepA-i','流行性感冒裂解疫苗','流感裂解','Flu_sp','1' 白喉破伤风二联类毒素','白破二联','DT',肺炎球菌疫苗','肺炎','Pneu','本轮强化糖丸','本轮强化糖','NOPV',体检','体检','PE',兰菌净','兰菌净','Lan',驱虫糖','驱虫糖','Quc',流脑A+C','流脑A+C','MenAC','结核菌素试验','结素','PPD','转移因子','转移因子','Zhy'重组乙型肝炎疫苗(CHO细胞)','乙肝(CHO)','HepB-cho','狂犬病人免疫球蛋白','狂犬病球蛋白','RIG碘丸','碘丸','Dw乙脑减毒','乙脑减毒','VereJE'狂犬病疫苗','狂犬疫苗','Rab','流脑多糖疫苗','流脑','MenA'口服轮状病毒活疫苗','轮状病毒','Rot流行性腮腺炎疫苗','腮腺炎','Mum冻干风疹减毒活疫苗','风疹','RV麻疹腮腺炎风疹三联疫苗','麻腮风','MMR水痘减毒活疫苗','水痘','Var历史强化糖丸','强化糖丸','HOPV痢疾','痢疾','Dys','流行性感冒全病毒灭活疫苗','流感全病毒','Flu_wv甲型肝炎减毒疫苗','甲肝减毒','HepA-l霍乱疫苗','霍乱','Chol时费)values('|','乙肝球蛋白','乙肝球蛋白','HepBIG 吸附破伤风疫苗','破伤风','TT气管炎疫苗','气管炎','Tra无细胞百白破','无细胞百白破','DaPT'口服脊髓灰质炎活疫苗','糖丸','OPV麻疹腮腺炎二联疫苗','麻腮二联','MM。
甲肝疫苗减毒和灭活区别【专业知识文档】

甲肝疫苗减毒和灭活区别【专业知识文档】本文内容极具参考价值,如若有用,请打赏支持!谢谢!文章导读宝宝从出生以后,每个月都要接种一些疫苗,这对于宝宝的健康是非常重要的,在接种甲肝疫苗的时候,主要分为甲肝灭活疫苗和减毒活疫苗,这两种疫苗有什么区别呢?应该说这两种疫苗各有优点,各有缺点,可以在专业的人士指导下,根据孩子的情况来选择注射疫苗的种类。
市场上的甲肝疫苗主要有甲肝灭活疫苗,和减毒活疫苗两大类。
由于制备原理的不同,在有效性和安全性上存在差异。
相对于减毒活疫苗,灭活疫苗具有更好的稳定性,而甲肝减毒活疫苗的价格相对便宜。
那么,甲肝疫苗减毒和灭活的区别在哪里呢?【甲肝减毒疫苗】用人工定向变异方法,或从自然界筛选出毒力减弱或基本无毒的活微生物制成活疫苗或减毒活疫苗。
通俗一点讲,即疫苗是活的,但一般选用的是“无毒或毒力很低但免疫性很高的病毒或支原体种株”培养繁殖后制成。
既可产生保护性抗体,又可增强细胞免疫的活化、识别、吞噬等能力。
常用活疫苗有卡介苗(BCG,结核病)、麻疹疫苗、脊髓灰质炎疫苗(小儿麻痹症)等。
接种后在体内有生长繁殖能力,接近于自然感染,可激发机体对病原的持久免疫力。
活疫苗用量较小,免疫持续时间较长。
活疫苗的免疫效果优于死疫苗。
比如:水痘疫苗是减毒活疫苗,麻风、腮腺炎疫苗都是属于活疫苗。
【甲肝减毒活疫苗优点】1、所需接种次数比较少,有的减毒活疫苗只需接种1次,类似自然感染的过程;2、在人体内停留一个时期,可增殖产生大量抗原,从而产生良好的免疫应答效果;3、免疫效果比较牢固,不仅可以促使全身免疫形成,而且可以产生局部免疫;4、可以采取自然感染的途径进行接种,免疫效果会更好,如口服脊髓灰质炎减毒活疫苗;【甲肝减毒活疫苗缺点】1、在人体内有毒力返祖的潜在危险性;可能形成潜在感染或传播;2、疫苗中有可能污染对人体不利的因子;3、减毒活疫苗不稳定,不易于保存和运输;病毒可能干扰免疫。
【甲肝灭活疫苗】选用免疫原性好的细菌、病毒、立克次体、螺次体等,经人工培养,再用物理或化学方法将其杀灭制成。
甲肝疫苗

冻干甲型肝炎减毒活疫苗接种告知【疫苗品种】冻干甲型肝炎减毒活疫苗【作用】预防甲型肝炎【接种对象】:18月龄以上的甲型肝炎易感者【价格】免费【用法剂量】上臂三角肌附着处皮下注射1.0ml【不良反应】接种后可能出现局部痛疼、红肿、一般72小时内自行缓解。
偶有皮疹。
必要时对症处理。
【接种禁忌】1、有发热腋温大于37.5度者;2、急性传染病或其他严重疾病者;3、免疫缺陷症和接受免疫抑制治疗者;4、孕妇或过敏体质者。
为了保证您的孩子能够安全有效地接种,请向医生提供孩子目前的身体状况。
【接种后注意事项】。
接种后请在接种地点观察15到30分钟;注射当天不要洗澡,防止注射部位的感染;宜多饮白开水,注射后发生任何不适均可与接种医生咨询电话0745-870299以上内容已告知儿童家属,儿童家属对此表示理解,确认无以上禁忌症,自愿接种甲型肝炎减毒活疫苗,并表示愿意承担接种疫苗可能出现的反应所产生的风险。
预约接种日期同意接种本疫苗□不同意接种本疫苗□接种儿童姓名家长及监护人签名:接种日期:接种医生接种部位广坪中心卫生院冻干甲型肝炎减毒活疫苗接种告知【疫苗品种】冻干甲型肝炎减毒活疫苗【作用】预防甲型肝炎【接种对象】:18月龄以上的甲型肝炎易感者【价格】免费【用法剂量】上臂三角肌附着处皮下注射1.0ml【不良反应】接种后可能出现局部痛疼、红肿、一般72小时内自行缓解。
偶有皮疹。
必要时对症处理。
【接种禁忌】1、有发热腋温大于37.5度者;2、急性传染病或其他严重疾病者;4、免疫缺陷症和接受免疫抑制治疗者;4、孕妇或过敏体质者。
为了保证您的孩子能够安全有效地接种,请向医生提供孩子目前的身体状况。
【接种后注意事项】接种后请在接种地点观察15到30分钟;注射当天不要洗澡,防止注射部位的感染;宜多饮白开水,注射后发生任何不适均可与接种医生咨询电话0745-870299以上内容已告知儿童家属,儿童家属对此表示理解,确认无以上禁忌症,自愿接种甲型肝炎减毒活疫苗,并表示愿意承担接种疫苗可能出现的反应所产生的风险。
甲型肝炎疫苗(甲肝疫苗)

甲型肝炎疫苗(甲肝疫苗)【预防的疾病】甲肝疫苗可以预防甲型病毒性肝炎。
【种类】甲肝疫苗有甲肝减毒活疫苗和甲肝灭活疫苗2种。
【接种对象】主要为≥18月龄儿童。
【免疫程序】儿童在18月龄接种1剂甲肝减毒活疫苗;或在18月龄及24月龄各接种1剂甲肝灭活疫苗,两剂间隔≥6个月。
【禁忌】甲肝减毒活疫苗:(1)已知对该疫苗所含任何成分,包括辅料以及抗生素过敏者;(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期、发热者;(3)免疫缺陷、免疫功能低下或正在接受免疫抑制剂治疗者;(4)患未控制的癫痫和其他进行性神经系统疾病者。
甲肝灭活疫苗:(1)已知对该疫苗所含任何成分,包括辅料、甲醛以及抗生素过敏者;(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期、发热者;(3)患未控制的癫痫和其他进行性神经系统疾病者。
【注意事项】甲肝减毒活疫苗:(1)接种疫苗之前,应如实向预防接种医生告知儿童身体健康状况。
若有感冒、发热等症状,待恢复健康后进行补种;(2)接种疫苗后,须在预防接种单位留观至少30分钟。
若儿童出现轻度发热等一般反应,通常不需任何处理。
若高烧不退或伴有其他并发症者,应及时到医院就诊;(3)接种人免疫球蛋白者应间隔≥3个月接种本疫苗,以免影响免疫效果。
甲肝灭活疫苗:(1)接种疫苗之前,应如实向预防接种医生告知儿童身体健康状况。
若有感冒、发热等症状,待恢复健康后进行补种;(2)接种疫苗后,须在预防接种单位留观至少30分钟。
若儿童出现轻度发热等一般反应,通常不需任何处理。
若高烧不退或伴有其他并发症者,应及时到医院就诊。
1. 疾病概况甲肝是由甲肝病毒引起的消化道传染病。
传染源主要是甲肝病人和隐性感染者(无肝炎症状和体征,但甲肝病毒IgM抗体呈阳性者)。
粪-口途径是甲肝传播的主要途径。
人群对甲肝病毒普遍易感。
2. 主要症状甲肝常见临床症状有乏力、食欲减退、精神不振、呕吐、恶心、腹痛、部分病人出现黄疸,如巩膜、皮肤和尿发黄。
PPD试剂说明书

结核菌素纯蛋白衍生物(p p d):适用范围:胸片检查异常的患者;涂阳肺结核病人密切接触者;涂阴病人和需与其他疾病鉴别诊断的病人皮内注射法1.注射部位和注射方法:选择在左侧前臂掌侧中上部1/3处,一般常用0.1ml含5个结核菌素单位的纯蛋白衍生物(ppd)皮内注射,使之形成直径6-10mm的皮丘;若患者结核变态反应强烈如患疱疹性结膜炎,结节性红斑或一过性多发性结核过敏性关节炎等,宜用1个结核菌素单位的ppd试验,以防局部的过度反应及可能的病灶反应。
(注意:在注射前应询问患者以前曾否做过该试验,如做过应问清时间、部位,以免引起促进反应。
)2.注射量和皮丘的关系准确地向皮内注射0.1毫升液体,形成的丘疹直径在6-10mm左右,这个大小程度在儿童较成人小(平均7mm左右),成人女子也略小于男子(9mm与8mm之比)。
3.注射的深度同样注射在皮内,观察其各种深度变化所出现反应的差别,结核菌素反应直径不因深度出现差异。
然而深的注射与浅的注射相比,深的注射反应的分散度大。
如果过深达皮下程度,结核菌素迅速被吸收出现的反应就小。
因此应当十分注意必须做浅层皮内注射4.结果观察于试验后48—72小时观察和记录结果,测量时以硬结(横径+纵径/2)大小为主,不以红晕大小作为判断标准。
因为硬结为特异性变态反应,而红晕为非特异性反应。
但一般情况下硬结和红晕大小一致。
注意:在见到双重同心圆状红润(双圈)时,测外层的红润直径。
不要将因注射造成的内出血误认为结核菌素反应。
结核菌素反应的红润指压暂时褪色,出血的红润指压不褪色。
结果判定硬结直径≤5mm为阴性5~9mm为阳性(+)(提示分支杆菌感染,也包括非典型分支杆菌感染)10~19mm为中度阳性(++)≥20mm为强阳性(+++)局部有硬结外,还有水泡、破溃、淋巴管炎及双圈反应等为强阳性反应(++++)结核菌素使用时注意事项1、注射器及针头应当专用,不可作其它注射之用。
2、安瓿开启后在半小时内使用。
(整理)儿童疫苗接种.

1. 出生24小时之内,我们应当接种卡介苗和乙肝疫苗。
2. 一个月龄的时候,要满30天以上,我们要接种第二针乙肝疫苗。
3. 满两个月龄的时候,我们要吃第一粒脊灰疫苗。
4. 在三个月龄的时候,我们要吃第二联脊灰疫苗,接种白百破三联疫苗的第一针。
5. 四个月龄的时候,我们要吃脊灰疫苗的第三联,接种白百破三联疫苗的第二针。
6. 五个月龄的时候,我们要接种白百破三联疫苗的第三针。
7. 满六个月龄时,我们要接种乙肝疫苗的第三针,从这里我们可以看出,乙肝疫苗的免疫程序,它是零、一、六个月接种程序,六月龄的时候,我们还要进行流脑疫苗的接种第一针。
8. 八个月龄时,我们要进行麻疹疫苗第一针的接种。
9. 九个月龄的时候,我们要进行流脑疫苗第二针的接种。
10. 当孩子满一岁的时候,我们要进行乙脑疫苗的接种。
11. 一岁半的时候,我们要进行百白破三联疫苗的加强注射,麻风三疫苗的加强注射。
12. 两岁时,我们要接种乙脑疫苗第二针。
13. 三岁时我们要进行流脑A+C疫苗的接种。
14. 四岁时,我们要加服一颗脊灰糖丸疫苗。
15. 六岁时,就是入学的年龄,我们要进行白百破二联加强注射,麻风塞加强注射,乙脑疫苗加强注射。
16. 在小学四年级的时候,我们要进行流脑A+C疫苗的加强注射。
17. 初中三年级进行白百破二联疫苗的加强注射。
18. 对于大一年级进京的新生,我们要进行白破二联的注射和麻疹疫苗的注射。
从表中我们可以看到,免疫程序随年龄的变化:1. B型流感、嗜血杆菌结合疫苗,它的适中人群为三个年龄段,第一个六月龄以下,儿童注射三针,间隔一到两个月,一年后加强一次。
第二个六到12个月儿童注射两针,间隔一个月,于出生后,第二年加强接种一次。
第三个一到5岁儿童注射一针。
2. 水痘疫苗,分两个年龄段,第一个一到12岁儿童接种一针,13岁以上接种两针,间隔6到10周。
3. 肺炎疫苗,它用于两岁以上,体弱多病的儿童,65岁以上老年人,慢性疾患或免疫功能减弱的人群,注射一针,高危人群五年后加强一次,健康人不需加强,一些容易患呼吸道疾病的儿童和癌症患者,都可以进行肺炎疫苗的接种。
常用疫苗组成成分

海藻糖、谷氨酸钠、精氨酸、抗坏血酸、低分子右旋糖苷、山梨醇、甘露醇
牛血清白蛋白、三氯甲烷、抗生素
灭菌注射用水
甲型肝炎灭活疫苗(人二倍体细胞)
灭活的甲型肝炎病毒
氢氧化铝、注射用氨基酸、磷酸二氢钾、聚山梨醇酯20、氯化钾、氯化钠
牛血清白蛋白、抗生素、甲醛
灭菌注射用水
A群脑膜炎球菌多糖疫苗
风疹减毒活疫苗(人二倍体细胞)
风疹减毒活病毒
明胶、蔗糖、人血白蛋白
牛血清白蛋白、抗生素
灭菌注射用水
风疹减毒活疫苗(兔肾细胞)
风疹减毒活病毒
明胶、蔗糖、人血白蛋白
牛血清白蛋白、抗生素
灭菌注射用水
麻疹腮腺炎联合减毒活疫苗
麻疹减毒活病毒和腮腺炎减毒活病毒
明胶、蔗糖、人血白蛋白、精氨酸、尿素、谷氨酸钠
牛血清白蛋白、抗生素
常用疫苗组成成分
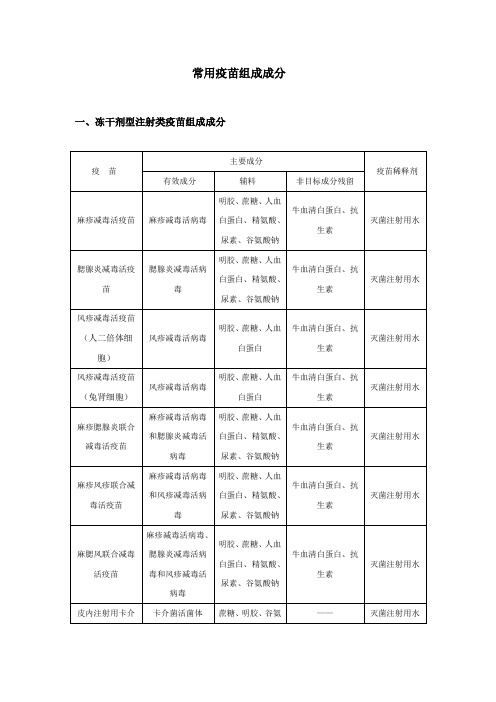
一、冻干剂型注射类疫苗组成成分
疫苗
主要成分
疫苗稀释剂
有效成分
辅料
非目标成分残留
麻疹减毒活疫苗
麻疹减毒活病毒
明胶、蔗糖、人血白蛋白、精氨酸、尿素、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水
腮腺炎减毒活疫苗
腮腺炎减毒活病毒
明胶、蔗糖、人血白蛋白、精氨酸、尿素、谷氨酸钠
牛血清白蛋白、抗生素
灭菌注射用水
灭活的I型和II型肾综合征出血热病毒源自氢氧化铝、硫柳汞、人白蛋白甲醛
双价肾综合征出血热灭活疫苗(沙鼠肾细胞)
灭活的I型和II型肾综合征出血热病毒
氢氧化铝、硫柳汞、人白蛋白
β-丙内酯
三、口服疫苗组成成分
疫苗
主要成分
有效成分
辅料
疫苗全称
Lep
皮肤划痕用鼠疫活疫苗
鼠疫
Plag
皮肤划痕人用炭疽活疫苗
炭疽
Anth
皮肤划痕人用布氏菌活疫苗
布病
Bruc
霍乱疫苗
霍乱
Chol
乙型肝炎人免疫球蛋白
乙肝球蛋白
HepBIG
冻干乙型肝炎人免疫球蛋白
乙肝球蛋白(冻干)
HepBIG-fd
白喉抗毒素
白抗
DAT
冻干白喉抗毒素
白抗(冻干)
DAT-fd
破伤风抗毒素
HFⅠ
Ⅱ价肾综合征出血热灭活疫苗
出血热(Ⅱ价)
HFⅡ
双价肾综合征出血热灭活疫苗
出血热(双价)
HFⅠ+Ⅱ
伤寒疫苗
伤寒
Typh
伤寒Vi多糖疫苗
伤寒Vi
Typh-Vi
伤寒副伤寒甲联合疫苗
伤寒副伤寒甲
T-pTA
伤寒副伤寒甲乙联合疫苗
伤寒副伤寒甲乙
T-pTAB
口服福氏宋内痢疾双价活疫苗
痢疾
Dys
钩端螺旋体疫苗
Pneu23
气管炎疫苗
气管炎
Tra
兰菌净细菌溶解物
兰菌净
Lan
人用狂犬病疫苗(Vero细胞)
狂犬病(Vero)
Rab-Vero
冻干人用狂犬病疫苗(Vero细胞)
狂犬病(Vero冻干)
Rab-Vero-fd
人用狂犬病疫苗(地鼠肾细胞)
狂犬病(地鼠肾)
Rab-hkc
Ⅰ价肾综合征出血热灭活疫苗
出血热(Ⅰ价)
脊髓灰质炎灭活疫苗
脊灰(灭活)
IPV
吸附百白破联合疫苗
百白破
DPT
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
冻干甲型肝炎减毒活疫苗
Donggan Jianxing Ganyan Jiandu Huoyimiao
Hepatitis A Vaccine(Live),Freeze-dried
本品系用甲型肝炎 (简称甲肝) 病毒减毒株接种人二倍体细胞,经培养、收获、提纯病毒、加入适宜稳定剂后冻干制成,用于预防甲型肝炎。
1基本要求
生产和检定用设施、原材料及辅料、水、器具、动物、等应符合“凡例”有关要求。
2制造
2. 1 生产用细胞
株或其他批准的细胞株)。
生产用细胞为人二倍体细胞(2BS 株、 KMB
17
2. 1. 1 细胞库管理及检定
应符合“生物制品生产和检定用动物细胞基质制备及检定规程”规定。
取自同批工作细胞库的1支或多支细胞管, 经复苏扩增后的细胞仅用于一批疫苗的生产。
2BS株原始细胞库细胞代次应不超过第14代,主细胞库细胞代次应不超过第31代,工作细胞库细胞代次应不超过第44代。
KMB
株原始细胞库细胞代次
17
应不超过第 6代,主细胞库细胞代次应不超过第15代,工作细胞库细胞代次应不超过第45代;
2. 1. 2 细胞制备
取工作细胞库中的1支或多支细胞管,复苏后混合培养,成单层后,用适宜浓度的胰蛋白酶消化,置37±0.5℃静置或旋转培养。
2. 2 毒种
2. 2. 1 名称及来源
或L-A-1减毒株。
生产用毒种为甲型肝炎病毒H
2
2. 2. 2 种子批的建立
应符合“生物制品生产和检定用菌毒种管理规程”规定。
减毒株原始种子批传代应不超过第7代,主种子批应不超过第8代,工作H
2
种子批应不超过第14代,生产的疫苗病毒代次应不超过第15代;L-A-1株原始种子批传代应不超过第17代,主种子批应不超过第18代,工作种子批应不超过第26代,生产的疫苗病毒代次应不超过第27代。
2. 2. 3 种子批检定
主种子批应进行以下全面检定,工作种子批应至少进行 2.2.3.1-2.2.3.4项检定。
2. 2.
3. 1 鉴别试验
/ml甲型肝炎病毒用甲型肝炎病毒特异高效价免疫血清与500~1000CCID
50
等量混合,置37℃水浴60分钟,接种人二倍体细胞,置35℃培养至病毒增殖高峰期,提取甲型肝炎病毒后用酶联免疫法测定,经中和的培养物检测结果应为阴
性(证明甲型肝炎病毒应完全中和),未经中和的病毒液检测结果应为阳性(应证明为甲型肝炎病毒)。
2. 2.
3. 2 病毒滴定
将毒种作10倍系列稀释,取至少3个稀释度,分别接种人二倍体细胞,置35℃培养至病毒增殖高峰期,收获后提取甲型肝炎病毒,用酶联免疫法进行病毒滴定,病毒滴度应不低于6.50 LgCCID
/ml。
50
2. 2.
3.3 无菌检查
依法检查(附录XⅡ A),应符合规定。
2.2.3.4 支原体检查
依法检查(附录XⅡ B),应符合规定。
2. 2.
3. 5 病毒外源因子检查
依法检查(附录XⅡ C),应符合规定。
供试品可不经甲型肝炎病毒抗特异性免疫血清中和,直接接种小鼠观察。
2. 2.
3. 6 免疫原性检查
用主种子批制备原疫苗,按常规接种甲型肝炎易感者至少40名,分别于免疫前及免疫后6~8周采血,血清抗体阳转率应不低于90%。
2. 2.
3. 7 猴体安全及免疫原性试验
用主种子批制备的疫苗做猴体试验。
取甲型肝炎病毒抗体阴性、丙氨酸氨基转移酶指标正常、体重为1.5-4.5 kg的健康恒河猴或红面猴5只,于下肢静脉注射疫苗1.0ml,滴度应不低于6.50 LgCCID
/ml。
试验猴于第0、4、8周肝穿
50
刺做组织病理检查。
于第0周、第2周、第3周、第4周、第6周、第8周采血测定丙氨酸氨基转移酶及甲型肝炎病毒抗体。
应设2只猴为阴性对照。
试验组符合下列情况者判定合格:
(1)至少4只猴抗体阳转;
(2)血清丙氨酸氨基转移酶有一过性(1周次)升高者不超过2只猴;
(3)肝组织无与接种供试品有关的病理改变。
有下列情况之一者可重试:
(1)接种猴抗体阳转率低于4/5;
(2)抗体阳转前后两周内血清丙氨酸氨基转移酶异常升高超过2次;
(3)试验猴不能排除其他原因所致的肝组织病理改变。
重试后仍出现上述情况之一者,判为不合格。
2. 2. 4 毒种保存
毒种应置-60℃以下保存。
2. 3 原液
2. 3. 1 细胞制备
同2.1.2项。
2. 3. 2 培养液
培养液为含适量灭能新生小牛血清的MEM或其他适宜培养液。
新生牛血清的
质量应符合规定(附录XIII D),且甲肝抗体检测应为阴性。
2. 3. 3 对照细胞外源因子检查
依法检查(附录XⅡ C ),应符合规定。
2. 3. 4 病毒接种和培养
取工作种子批毒种按适宜MOI接种于人二倍体细胞(同一工作种子批应按同一MOI接种),于35±0.5℃培养,培养期间,根据细胞生长情况,可用不少于原倍培养液量的洗液充分洗涤细胞表面以去除牛血清,并换加维持液或其他适宜的液体继续培养。
2.3.5 病毒收获物
于病毒增殖高峰期,采用适宜浓度的胰蛋白酶或其他适宜方法消化含甲肝病毒的细胞,并经离心或其他适宜的方法收集含甲肝病毒的细胞为病毒收获物。
2.3.6 病毒收获物检定
按3.1项进行。
2.3.7 病毒收获物保存
于-20℃以下保存,保存时间按批准的执行。
2.3.7 病毒提取
检定合格的病毒收获物经冻融和(或)超声波处理,并采用适宜浓度的三氯甲烷抽提以提纯病毒。
2. 3. 8 合并
同一细胞批生产的病毒收获物经提取病毒后合并为一批原液。
2. 3.9原液检定
按3.2项进行。
2.3.10 原液保存
于2~8℃保存,保存时间按批准的执行。
2. 4 半成品
2.4.1 配制
用疫苗稀释液将原液按同一病毒滴度进行配制,并加入适量稳定剂,即为半成品。
2. 4.2 半成品检定
按3.3项进行。
2. 5 成品
2. 5. 1 分批
应符合“生物制品分批规程”规定。
2. 5.2 分装及冻干
应符合“生物制品分装和冻干规程”规定。
2.5. 3 规格
复溶后每瓶0.5ml或1.0ml。
每1次人用剂量为0.5ml或1.0ml,含甲型肝。
炎活病毒应不低于6.50 LgCCID
50
2. 5. 4 包装
应符合“生物制品包装规程”规定。
3 检定
3. 1 病毒收获物检定
3. 1. 1 病毒滴定
/ml。
按2.2.3.2项进行,病毒滴度应不低于7.00 LgCCID
50
3. 1. 2 无菌检查
依法检查(附录XⅡA),应符合规定。
3.1.3 支原体检查
依法检查(附录XⅡ B),应符合规定。
3.2 原液检定
3. 2. 1 病毒滴定
按2.2.3.2项进行,病毒滴度应不低于7.00 LgCCID
/ml。
50
3. 2. 2 无菌检查
依法检查(附录XⅡA),应符合规定。
3.2.3 支原体检查
依法检查(附录XⅡ B),应符合规定。
3. 3 半成品检定
无菌检查
依法检查(附录XⅡ A),应符合规定。
3.4 成品检定
除水分测定外,应按标示量加入灭菌注射用水,复溶后进行以下各项检定。
3.4.1 鉴别试验
采用酶联免疫法进行测定,应证明含有甲型肝炎病毒抗原。
3. 4. 2 外观
应为乳酪色疏松体,复溶后为澄明液体,无异物。
3. 4.3 水分
应不高于3.0 %(附录VⅡD)。
3.4.4 三氯甲烷残留量
应不高于0.006 %,(附录 VI V )
3.4.5 抗生素残留量检查
生产过程中加入抗生素的应进行该项检查。
采用酶联免疫法检测,应不超过10ng/ml。
3. 4. 6 病毒滴定
取疫苗3-5瓶供试品混合滴定,按 2.2.3.2项进行,病毒滴度应不低于6.50LgCCID
/ml。
50
3.4.7 热稳定性试验
疫苗出厂前应进行热稳定性试验,应与病毒滴定同时进行。
于37℃放置72小时后,按2.2.3.2项进行,病毒滴度应不滴于6.50 LgCCID
/ml,病毒滴
50
度下降应不高于0.50 Lg。
3. 4. 8 无菌检查
依法检查(附录XⅡ A),应符合规定。
3. 4. 9 异常毒性检查
依法检查(附录XⅡ F),应符合规定。
3. 4. 10 牛血清白蛋白残留量
应不高于50 ng/剂(附录 VIII F)。
4保存、运输及有效期
于2~8℃避光保存和运输,自生产之日起,有效期为18个月。
5 疫苗稀释剂
疫苗稀释剂为灭菌注射用水,应符合对疫苗稀释剂有关要求。
5.1疫苗稀释剂装量
5.2 疫苗稀释剂包装
5.3 疫苗稀释稀释剂有效期
5.4 疫苗稀释剂批准文号
5.5 疫苗稀释剂生产企业
6 说明书。
