化工原理第五章(吸收过程的传质速率)
化工原理第五章吸收过程的传质速率

2019/12/1
一些物质在水中的扩散系数(20℃,稀溶液)
注:DCO2=1.50×10-9(m2/s)
2019/12/1
(3)气体扩散系数的估算
①在简化条件下,经分子运动论的理论推导与实验
修正,Fuller(富勒)等人提出了如下半经验公式 :
1.00107T1.75( 1 1 )
2019/12/1
气相
pA1
pA2
pB1
pB2
液相
p1=pA1+pB1
A
p2=pA2+pB2
p1>p2
A,B
总体流动
(3)单向扩散的质量传递特点
【说明】(1)整体流动将 B组分使得气液相界面附近 B组分分压增大,故B组分 将向主体扩散; (2)整体流动将A组分带 到了气液相界面,故气相 中A组分的传质量比单纯的 分子扩散过程多。
式中 JA——组分A在扩散方向z上的扩散通量,kmol/ m2·s dcA/dz——组分A在扩散方向z上的浓度梯度,kmol/m4; DAB——组分A在组分B中的扩散系数,m2/s。
【说明】负号表示扩散方向与浓度梯度方向相反, 扩散沿着浓度降低的方向进行。
2019/12/1
4、等摩尔(分子)逆(反)向扩散
2019/12/1
(2)单向扩散的特点——整(总、主)体流动
【说明】当A、B双组分气体 混合物与液体溶剂接触时, 气相主体中的组分A扩散到界 面,然后通过界面进入液相 ,造成在界面左侧附近总压 降低,使气相主体与界面产 生一小压差,促使A、B混合 气体由气相主体向界面处流 动,此流动称为总体流动。
D7.4108 (MS)0.5T v 0.6
化工原理王志魁第五版-吸收5-5(郑州大学授课讲义)

5.吸收
鞍形填料
弧鞍填料
矩鞍填料
环矩鞍填料 (金属)
改进矩鞍填料
3/4/2019 10
5.吸收
球形填料、花环填料
3/4/2019
11
5.吸收
整装填料
格栅填料
木格栅填料 适用于低压降、大负荷及防堵场合
3/4/2019
12
5.吸收
波纹填料
板波纹填料
3/4/2019
丝网波纹填料
结构紧凑,比表面积大,传质效率高
3/4/2019 25
5.吸收
液体分布器
作用:使液体形成均匀的初始分布 要求:喷淋点足够多、各喷淋点喷淋液量相等
注意不同类型分布器适用的塔径范围。塔径越大,要求越高
3/4/2019
26
5.吸收
液体再分布器
作用:收集液体、重新分布,克服壁流问题 要求: 1. 具有收集液体功能(向中央归拢) 2. 本身也是液体分布器 3. 填料层分段,每隔一定高度设置
ε越大,压降越小,适应负荷越大
3/4/2019
15
5.吸收
5.5.3 填料塔的流体力学性能与操作特性
填料层的持液量
持液量——单位体积填料层中滞留的液体体积 静持液量——与气液负荷无关 总持液量 动持液量——与气液负荷有关 持液量↗ ⇒ 填料层压降↗
3/4/2019 16
5.吸收
填料层的压降
u 代表空塔气速
3/4/2019 22
5.吸收
填料塔操作中返混的原因
• 气液分布不均,各处传质效率差别很大 初始分布不均;壁流;填料层内的沟流
• 气流对液膜有影响,雾沫夹带不可避免 • 湍动剧烈时,轴向混合不可避免 流体力学性能随规模变化明显,直接影响三传一反的效果,
化工原理第五章第三节

吸收推动力 吸收阻力
kG
当气相的组成以摩尔分数表示时
N A k y (y yi )
k y —以 y 表示的气膜吸收系数,knoll/(m2.s)。
当气相组成以摩尔比浓度表示时
N A kY (Y Yi )
kY —以 Y 表示推动力的气膜吸收系数,kmol/(m2.s)。
2020/4/4
2、液膜吸收速率方程式
一、分子扩散与费克定律
第五章 吸收
二、稳态分子扩散 三、单相内的对流传质
第三节 吸收过程的传质速率
四、两相间传质机理—双
膜理论
五、传质速率方程式
2020/4/4
2020/4/4
吸收过程涉及两相间的物质传递,包括 三个步骤: •溶质由气相主体扩散至两相界面气相 侧,即气相内的传质; •溶质在相界面上的溶解,由气相转入 液相,即界面上发生的溶解过程(平衡) •溶质由相界面液相侧扩散至液相主体 20,20/4/4即液相内的传质。
c)气相总吸收系数与液相总吸收系数的关系
KG HK L , mKy Kx , mKY K X
2020/4/4
3)各种分系数间的关系
k y PkG
kx CmkL
6、传质速率方程的分析
1)溶解度很大时的易溶气体
1 1 kG HkL
1 1 1 KG kG Hk L
1 1 KG kG
即KG kG ——气膜控制
Y * —与液相主体摩尔比X成平衡的气相摩尔比。
2020/4/4
b)以(y-y*)为推动力的总传质速率方程
NA Ky (y y*)
K y —以(y-y*)为推动力的气相总传质系数,kmol/(m2·s)。 y * —与液相主体摩尔分数x成平衡的气相摩尔分数。
化工原理 第五章 气体吸收

Y
*
mX 1 (1 m) X
当溶液浓度很低时,上式右端分母约等于1,于是上式可简化为:
Y*=mX
20
三、 相平衡关系在吸收中的应用
(一)判断过程进行的方向
* pA pA * pA pA * pA pA
A由气相向液相传质,吸收过程 平衡状态
A由液相向气相传质,解吸过程
*或x* >x或 c * y
dc A —组分A在扩散方向z上的浓度梯度(kmol/m3)/m; dz
DAB——组分A在B组分中的扩散系数,m2/s。
负号:表示扩散方向与浓度梯度方向相反,扩散沿 着浓度降低的方向进行
28
理想气体:
pA cA RT
dc A 1 dp A = dz RT dz
DAB dpA JA RT dz
25
吸收过程: (1)A由气相主体到相界面,气相内传递; (2)A在相界面上溶解,溶解过程; (3)A自相界面到液相主体,液相内传递。
单相内传递方式:分子扩散;对流扩散 。
26
一、 分子扩散与菲克定律
分子扩散:在静止或滞流流体内部,若某一组分存 在浓度差,则因分子无规则的热运动使
该组分由浓度较高处传递至浓度较低处,
物系一定, E T 2)E大的,溶解度小,难溶气体 E小的,溶解度大,易溶气体
3)E的来源:实验测得;查手册
对于理想溶液,亨利常数即为纯溶质的饱和蒸汽压。亨利常数E值较大表示溶解度 较小。一般E值随温度的升高而增大,常压下压力对E值影响不大。
16
(二)亨利定律其它形式
cA 1)p H
体主体浓度线相交于一点E,则厚度zG为E到相界
面的垂直距离。
(二)气相传质速率方程
化工原理王志魁第五版-吸收最新版本

5. 吸收
扩散系数的讨论
(3)温度、压力的影响。 气体、液体和固体的扩散系数一般都随温度升高而增大。 气体扩散系数随压力的增加而减少。 液体的扩散系数与压力无关。
气 体 : DT1.5p1
(4)浓度影响。对理想气体和稀溶液,浓度影响不大;而 非理想气体和一般溶液的D则是浓度的函数。
1/17/2020
1/17/2020
7
5. 吸收
分子扩散
分子扩散基本定律——费克定律
JA
D
dcA dz
jA
D
dA
dz
分子扩散可在单相中进行(如红墨水在水中的扩 散),也可以在气、液、固相间进行(如香水扩 散,气-液相间;活性炭吸异味,气-固间)。
1/17/2020
8
5. 吸收
扩散系数的讨论
(1) D的物理意义:浓度梯度数值为1时的扩散通 量。单位:m2/s。其大小表明物质的扩散能力大小 。
Dp( yB2 yB1 ) RTZ yB2 yB1
ln( yB2 / yB1 )
Dp RTZ
1 yBm(yA1
yA2) ↖
传质推动力
即:NARD TpZy1Bm(yA1yA2) ——单项扩散传质速率方程
其中:yBm
yB2 yB1 ln(yB2 / yB1)
(对数平均)
1/17/2020
NM
15
5. 吸收
(3)单项扩散的传质速率方程
1 NA 1 yA JA
JA
D
dcA dz
NARTD pyAddyzA
D p dyA RT dz
分离变量: N A dzR D T pd yy A AR D T pd( yy A A )
化工原理--2-8气体吸收
④吸收操作的物料衡算
⑤填料层高度的计算方法
⑥解吸过程计算
⑦传质设备,填料吸收塔
.
6
重点内容: a.物理吸收过程 b.低浓度吸收过程设计计算
本章难点: a.吸收过程的传质机理 b.相平衡关系不同表达式间的换算
.
7
物质的量浓度(摩尔浓度)CA = nA / V 物质的量分数(摩尔分数)xA = nA / n 摩尔比 XA = nA / nB
1+(1-m )XA
XA —— 液相摩尔比
或 YA* = m XA
*5 E、H、m之间关系 H =E xA/ CA ≈ E MS /ρS
m = E / P总压
E — 亨利系数,N/m2。
.
13
三、相平衡与吸收过程的关系
1、判别传质过程的方向
P
P
PA
A
PB*
PA*
PB
B
xA xA* x
xB* xB
x
上式也可写成:
DC
NA = —— ——(CA1 - CA2 ) Z CBm
式中:CBm—组分B浓度的对数平均值,kmol/m3。
C —混合物的总浓度,kmol/m3,(C =CA + CB )
**该式同样适用于液相。 .
28
4、分子扩散系数 D, m2/s
物性参数之一,表示物质在介质中的扩散能力。 影响因素:物质的种类
①气、液两相流经吸收设备的能量消耗;
②溶剂的挥发损失和变质损失;
③溶剂再生(解吸)费用,即解吸操作费用。
*以上三项费用中第③项所占比例最大。
.
5
本章基本内容:
本章基本内容:介绍物理吸收过程机理、传质速率方 程及吸收过程的设计计算和操作分析。
化工原理第四版课件(第五章吸收)

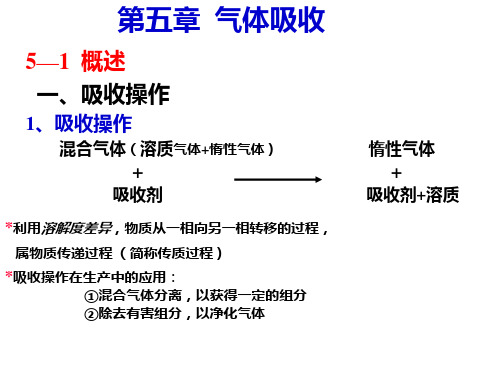
第五章:吸收 概述气液相平衡吸收过程的传质速率吸收塔的计算填料塔第一节:概述一、吸收吸收的定义:吸收是利用气态均相混合物中各组分在吸收剂中溶解度的差异来实现分离的单元操作。
吸收的目的:I.回收或捕获气体混合物中的有用物质,以制取产品II.除去工艺气体中的有害成分,使气体净化,以便进一步加工处理III.除去工业放空尾气中的有害气体,以免环境污染。
二、工业吸收了解工业生产中吸收及解吸过程、所需条件和典型设备例子工业上从合成氨原料混合气体中回收CO2乙醇胺脱硫法•需要解决的问题1.选择合适的溶剂2.提供适当的传质设备3.溶剂的再生三、溶剂的选择1.对溶质较大的溶解度;2.良好的选择性;3.温度变化的敏感性;4.蒸汽压要低;5.良好的化学稳定性;6.较低的黏度且不易生泡;7.廉价、无毒、易得、不易燃烧等经济和安全条件。
四、吸收的分类按有无化学反应:物理吸收和化学吸收按溶质气体的浓度:低浓度和高浓度吸收按溶质气体组分的数目:单组分和多组分吸收按有无热效应:等温和非等温吸收本章只讨论低浓度、单组分、等温的物理吸收过程。
五、吸收操作的经济性(费用)气液两相流经设备的能量损耗;溶剂的挥发及变质损失;溶剂的再生费用。
√六、吸收设备第二节:气液相平衡一、平衡溶解度恒温、恒压下,相互接触的气液两相的浓度不变时,气液两相之间的浓度关系。
气液两相组成的浓度分别用物质的摩尔分数来表示,即y= n i /Σn y 、x= n i /Σn x:气液两相中惰性组分的量不变,溶质与惰性组分摩尔比。
yy Y −=1xx X −=11.气体的溶解度气体在溶液中的溶解平衡是一个动态平衡,该平衡的存在是有条件的;平衡时气相中溶质的分压——平衡分压(或饱和分压),液相中溶质的浓度——平衡浓度(或饱和浓度),也即是气体在溶液中的溶解度;气体的溶解度是一定条件下吸收进行的极限程度;温度和压力对吸收操作有重要的影响;加压和降温对吸收有利;升温和降压对解吸有利。
化工原理第五章吸收课后习题及答案

第五章 吸收相组成的换算【5-1】 空气和CO 2的混合气体中,CO 2的体积分数为20%,求其摩尔分数y 和摩尔比Y 各为多少? 解 因摩尔分数=体积分数,.02y =摩尔分数 摩尔比 ..020251102y Y y ===--. 【5-2】 20℃的l00g 水中溶解lgNH 3, NH 3在溶液中的组成用摩尔分数x 、浓度c 及摩尔比X 表示时,各为多少?解 摩尔分数//117=0.010*******/18x =+浓度c 的计算20℃,溶液的密度用水的密度./39982s kg m ρ=代替。
溶液中NH 3的量为 /311017n kmol -=⨯ 溶液的体积 /.33101109982 V m -=⨯溶液中NH 3的浓度//.33311017==0.581/101109982n c kmol m V --⨯=⨯ 或 . 3998200105058218s sc x kmol m M ρ==⨯=../ NH 3与水的摩尔比的计算 或 ..00105001061100105x X x ===--. 【5-3】进入吸收器的混合气体中,NH 3的体积分数为10%,吸收率为90%,求离开吸收器时NH 3的组成,以摩尔比Y 和摩尔分数y 表示。
吸收率的定义为解 原料气中NH 3的摩尔分数0.1y = 摩尔比 (11101)01111101y Y y ===-- 吸收器出口混合气中NH 3的摩尔比为 摩尔分数 (22200111)=0010981100111Y y Y ==++ 气液相平衡【5-4】 l00g 水中溶解lg 3 NH ,查得20℃时溶液上方3NH 的平衡分压为798Pa 。
此稀溶液的气液相平衡关系服从亨利定律,试求亨利系数E(单位为kPa )、溶解度系数H[单位为/()3kmol m kPa ⋅]和相平衡常数m 。
总压为100kPa 。
解 液相中3NH 的摩尔分数/.//1170010511710018x ==+气相中3NH 的平衡分压 *.0798 P kPa =亨利系数 *./.0798*******E p x ===/液相中3NH 的浓度 /./.333110170581 101109982n c kmol m V --⨯===⨯/ 溶解度系数 /*./../()3058107980728H c p kmol m kPa ===⋅ 液相中3NH 的摩尔分数 //1170010511710018x ==+./气相的平衡摩尔分数 **.0798100y p p ==// 相平衡常数 * (079807610000105)y m x ===⨯ 或 //.76100076m E p ===【5-5】空气中氧的体积分数为21%,试求总压为.101325kPa ,温度为10℃时,31m 水中最大可能溶解多少克氧?已知10℃时氧在水中的溶解度表达式为*.6331310p x =⨯,式中*p 为氧在气相中的平衡分压,单位为kPa x ;为溶液中氧的摩尔分数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
仅为分子扩散,组分A的传质速率等于其扩散速率即
:
dc A N A J A D dz
2013-9-19
边界条件:z=0,cA=cA1;z=Z,cA=cA2;
J A J B
将以上关系式代入菲克定律式,得到:
组分A在组 分B中的扩 散系数
DAB=DBA=D
组分B在组 分A中的扩 散系数
【结论】在双组分混合物中,组分A在组分B中的扩
散系数等于组分B在组分A中的扩散系数。
2013-9-19
(4)等分子反向扩散的传质速率
【传质速率】在任一固定的空间位置上,单位时间
流体的湍动程度有关,也与流体质点的位置有关,
既不能使用公式计算,也难于用试验的方法测定。
(2)NA的表达式形式好看但不好用,并不能将NA的
表达式积分求出对流传质速率NA。
2013-9-19
4、有效层流膜模型 (1)对流传质的传质阻力全部集中在一层虚拟的层 流膜层内,膜层内的传质形式仅为分子扩散。 (2)层流膜外流体高度湍流,无浓度差(没有推动 力),故没有质量传递过程。 (3)层流膜的厚度ZL 层流内层分压梯度线延长线 与液相主体浓度线cA相交于一点L,L到相界面的垂
2013-9-19
整体流动
(5)单向扩散的传质速率方程 ①单向扩散的传质速率方程基本计算式
cA NA JA NA c
式中
JA——分子扩散(扩散流)所传递的量;
NAcA/c——主体流动所传递的量。
2013-9-19
②单向扩散传质速率方程的积分式 对于气相可推得:
D p NA ( p A1 p A2 ) RTZ p Bm
2013-9-19
5、单向扩散及速率方程 (1)什么是单向扩散
【特点】一种组分扩散,另外一种组分“静止”。
【例如】在气体吸收中,A为被吸收组分,B为惰性 组分,液相不存在组分B,不可能向界面提供组分B 。因此,吸收过程所发生的是组分A通过“静止” 组分B的单方向扩散,而不是等分子反向扩散。
2013-9-19
分 子 扩 散 现 象
2013-9-19
2013-9-19
3、分子扩散的基本规律——费克定律 费克(A. Fick)在1855年在实验的基础上提出了 菲克第一定律,指出:“由两组分A和B组成的混合 物中,在恒定温度、总压条件下,若组分A只沿z方 向扩散,浓度梯度为dcA/dz,则任一点处组分A的扩 散通量与该处A的浓度梯度成正比”,即:
pA1 Z pA2
NA
2013-9-19
【等摩尔(分子)逆向扩散的特点】
(1)系统中各处的总浓度c(总压力p)相等;
(2)JA=-JB(两组分反方向的扩散速率相等);
(3)浓度(压力)梯度为常数;
(4)DAB=DBA=D;
(5)传质速率方程式为:
D D NA JA ( p A1 p A2 ) (c A1 c A2 ) RTZ Z
扩散流
物流的宏观运动,它同时
携带组分A与B流向界面。
2013-9-19
整体流动
(5)“静止”组分B 若整体流动中B组分的传递速率为NBM,扩散流中 B组分的传递速率为JB,则:
J B N BM
cB N c
扩散流
即JB与NBM两者数值相 等,方向相反。由于B组 分的浓度维持不变,表观 上B组分是“静止”的。
式中 JA——组分A在扩散方向z上的扩散通量,kmol/ m2· s
dcA/dz——组分A在扩散方向z上的浓度梯度,kmol/m4; DAB——组分A在组分B中的扩散系数,m2/s。
【说明】负号表示扩散方向与浓度梯度方向相反,
扩散沿着浓度降低的方向进行。
2013-9-19
4、等摩尔(分子)逆(反)向扩散
1.00 10 7 T 1.75 ( D
1 3
1 1 ) MA MB
1 3 2
P [( v A ) ( v B ) ]
②当知道某一温度和压力下的扩散系数时,可由下
式求算另一温度和压力下的扩散系数:
P1 T2 D 2 D1 P2 T1
2013-9-19
单相扩散传质速率
(1)因ppBm或ccBm,故p/pBm1或c/cBm 1。 (2)漂流因子反映了总体流动对传质速率的影响程 度,溶质的浓度愈大,其影响愈大。 (3)漂流因子的大小为总体流动使传质速率较单纯
分子扩散速率增大的倍数。
2013-9-19
【问题】顺水行舟为何快?
千里江陵一日还
2013-9-19
【有关说明】
(1)涡流扩散系数与分子扩散系数不同,DE不是物
性常数。影响DE的因数众多,其值与流体流动状态
及所处的位置有关,DE的数值很难通过实验准确测
定;
(2)由于涡流扩散是借助于流动质点的位移进行的
质量传递,故其扩散速率远大于分子扩散速率;
(3)物系内各处的浓度比较均匀。
2013-9-19
3、对流传质速率 (1)过程分析
2013-9-19
总体流动
(3)单向扩散的质量传递特点
【说明】(1)整体流动将 B组分使得气液相界面附近 B组分分压增大,故B组分 将向主体扩散;
(2)整体流动将A组分带
到了气液相界面,故气相 中A组分的传质量比单纯的 分子扩散过程多。
2013-9-19
(4)整体流动与扩散流的区别 【扩散流】(分子扩散引 起的物料流)是分子微观 运动的宏观结果,所传递 的是纯组分A或纯组分B。 【整体(主体)流动】是
1.75
(4)液体中的扩散系数的估算 对于很稀的非电解质溶液(溶质A+溶剂B), 其扩散系数常用惠尔凯(Wilke-Chang)公式估算:
D 7.4 10 8
(M S ) 0.5 T
v A
0.6
对给定的系统,可由温度 T1下的D1扩散系数推算 T2下的D2,如:
T2 1 D2 D1 ( ) T12
过程,称为涡流扩散。
2013-9-19
2、涡流扩散速率
【表达式】因质点运动无规则,所以涡流扩散速率
很难从理论上确定,通常采用描述分子扩散的菲克
定律形式表示,即:
dcA J A DE dz
式中 JA——涡流扩散速率,kmol/(m2· s);
DE——涡流扩散系数,m2/s。
2013-9-19
2013-9-19
二、单相对流传质过程
【定义】流动着的流体与 某一界面(如气液相界面 )之间或两个有限互溶的 流动流体之间发生的传质 ,称为对流传质。
【特点】同时存在分子扩
散与涡流扩散。
2013-9-19
1、什么是涡流扩散(湍流扩散)
【定义】依靠流体质点 的位移,使组分从浓度
高处向浓度低处移动的
【说明】以上两式称为某组分单向扩散时的传质速
率方程式,适用于某一组分在扩散时,另一组分是 “静止”的,或处于滞流的状态。
2013-9-19
【漂流因子几点说明 】
D NA ( p A1 p A2 ) RTZ
单纯分子扩散传质速率
D p NA ( p A1 p A2 ) RTZ p Bm
T
α
p cA1 cB1 T
β
p cA2 cB2
c=cA+cB
②浓度梯度为常数
1
2
cA
cB1 cA1
0
C
cB2
dc A const dz
2013-9-19
cB
cA2
z
扩散距离 z 图 5-8 等分子反向扩散
(3)等分子反向扩散的扩散系数 由于 则
c=cA+cB=常数
dc A dcB dz dz
直距离。
2013-9-19
【模型要点】
cAi
气相 液相 相界面 L
(1)膜的厚度为ZL ;
(2)膜内为分子扩散; (3)膜外无浓度差,因 此不存在传质过程。
cA
【模型的作用】将复杂的对 流扩散过程处理成了一个简 单的分子扩散过程。
ZL
2013-9-19
有效层流模模型示意图
5、气(膜)相传质速率方程式 按照有效层流膜模型,结合单向扩散速率方程,可 以得到气相对流传质速率方程式:
层流内层—— 分子扩散
气相 液相
过渡区——分子 扩散、涡流扩散
湍流主体—— 涡流扩散 相界面
2013-9-19
(2)对流传质速率的计算式 一般情况下,对流传质速率可写成:
dcA NA JA + (流) ( D DE ) (分子) J A dz
【说明】(1)由于DE不像D那样是物性参数,它与
dc A JA dz
2013-9-19
【扩散通量】 【定义】单位时间内通过垂直于扩散方向的单位截
面积扩散的物质量,称为扩散通量(扩散速率),
以符号J表示,单位为kmol/(m2· s)。 【作用】扩散通量可以用来表征扩散进行的快慢程
度。
2013-9-19
【费克定律的数学表达式】
dc A J A DAB dz
(2)单向扩散的特点——整(总、主)体流动
【说明】当A、B双组分气体 混合物与液体溶剂接触时, pA1 pB1 p1=pA1+pB1 p2=pA2+pB2 p1>p2
A,B
气相 pA2 pB2
A
液相
气相主体中的组分A扩散到界
面,然后通过界面进入液相
,造成在界面左侧附近总压
降低,使气相主体与界面产 生一小压差,促使A、B混合 气体由气相主体向界面处流 动,此流动称为总体流动。
