第七章还原反应(精)教程
合集下载
药物合成反应_第七章_还原反应

肼NH2-NH2或二酰亚胺NH=NH,可选择性还原非极性重键(如C=C、碳碳叁键、N=N), 而不影响极性重键(如C=N、腈基、硝基等)。
Ph
C
C
Ph
NH2 NH2 Cu2 + 空气
Ph CH2CH2 Ph
(80%)
烯 ︑ 炔 烃 的 还 原
C7H7SO2NHNH2 CH2 CH CH2 S S CH2 CH CH2 △ C3H7SSC3H7
硝基可被还原为氨基,常用的条件为铁粉+酸、锌或锡+酸、硫化物(如Na2S,Na2S2等)。
O2N
C C C H H O COOEt Fe/HOAc EtOH+H2O NO2
NH2 COOEt
Fe/NH4Cl
H2N
C C C H H O NH2 Na2S
NH2
NO2
硝 基 的 还 原
NO2 NH2
NO2
NaBH4-AlCl3不影响硝基;
HOOO (CH2)4 COOEt
B2H6 / THF -18 C, 10h
0
HOCH2 (CH2)4 COOEt
(88%)
硼烷或乙硼烷与羧基反应最快,如果控制低温和用量,可选择性优先还原羧基而不影响硝
基、卤素、酰卤、氰基、酯基、醛、酮等,选择性非常优秀。
4
硝基的还原 肟和亚甲胺的还原 偶氮、叠氮的还原
OH
NO2
饱 和 醛 酮 的 活 性 大 于 α,β-不 饱 和 醛 酮
2
醇铝为还原剂(Meerwein-Ponndorf-Verley反应)
在异丙醇铝中,醛、酮被还原为醇,取而代之的是异丙醇被氧化为丙酮;此反应可看做是 Oppenauer氧化的逆反应。
无机化学简明教程第7章 氧化还原反应可编辑全文

H+浓度为1mol·L-1的酸溶液中。不断地通入压力为101.3
kPa的氢气流,使铂黑电极上吸附的氢气达到饱和。这时,
H2与溶液中H+可达到以下平衡:
电极反应: 2H (aq) 2e = H2 g
电电对对::H/H2
E
H /H2
= 0.000V
无机化学
33
表示为: H+ H2(g) Pt
H2←
即: Cr(OH)3 (s) + 5OH- = CrO42- + 4H2O + 3e-
②
①×3+②×2得
2Cr(OH)3 (s) + 3Br2 (l) + 10OH- = 2CrO42- + 6Br- + 8H2O
2Cr(OH)3 (s) + 3Br2 (l) + 10KOH= 2K2CrO4 + 6KBr + 8H2O
() Pt Fe2 1.0mol L1 , Fe3 0.1mol L1 ‖ Cl 2.0mol L1 Cl2101325Pa Pt ()
无机化学
21
例2:将反应: SnCl2 +FeCl3 SnCl4 +FeCl2 组成一个原电池,写出其电池组成及正负极的电极反应。
解: <–> Sn2+ – 2e
S4O62S4O62 S的氧S的化氧数化为数 为2.5 2.5 CCHH33CCOOOOHH CC的的氧氧化化数数为为00
无机化学
7
4、氧化还原电对
对氧化还原反应 Cu2+ + Zn = Zn2+ + Cu O1 R1 O2 R2
Cu2+ /Cu , Zn2+ /Zn 称为氧化还原电对 氧化态和还原态成共轭关系:
第七章 还原反应

7.1 催化氢化
催化氢化:分子氢在催化剂作用下,将不饱和 键或基团转化为饱和键与基团的还原反应。
优点:反应定向进行,副反应少、产品质量好、
产率高。生产能力大,对解决环境污染问 题有明显的优越性。 缺点:对生产装置和工业控制的要求较高, 需要优良的催化剂和氢气来源。
机理:首先,在催化剂作用下氢气分解为氢原子、 并吸附在催化剂上。其次,氢原子进攻烯烃双键 碳,使烯烃双键打开,氢原子与其中一个碳原子 成键,另一个吸附在催化剂上的氢原子也与另一
酯族化合物。
N Na EtOH N PhCOCl NaOH N COPh 77-81%
COOH OH
Na , -C5H11OH
COOH COOH 43-50%
OH Li-NH3-EtOH
OH
苯环上有推电子基团,如烃基、烷氧基、胺
基等时,使苯环钝化(苯甲醚除外),致使质子
化发生在2,5位,得3,6-二氢化物。
+ 2CH 3CH 2ONa
2CH 3CH2OH H
H
苯甲醚用金属钠在液氨中还原得到3,6-二氢苯甲醚,
在酸性溶液中水解,经酸催化异构化可得环己烯-3-酮。 典型还原反应可用于(±)硫辛酸的合成。
OCH3 (1)BuLi (2) CH2 CH2 O OCH3 CH2CH2OH Na , NH3 EtOH OCH3 CH2CH2OH
还原。
在精细有机合成中,以化学还原法为主。有
机分子中的氢化反应是所有合成中发展水
平最高的反应。其选择性方面的知识也是
遥遥领先。
还原剂:氢气。低价金属盐,如TiCl3, TiCl2等。
还原性的金属:Li,Na,Mg,Ca,Zn
金属或金属配位催化剂:Ni,Pd,Pt,Ru, Rh, LiAlH4,NaBH4,B2H6 低价态化合物:(N2H4, N2H2,Ph3P,MeS, Na2S2O4,HO-CH2-SO3Na即SFS)。 催化剂活性:Pt>Rh>Ni>Ru, 反应速率跟压力、温度及溶剂有关。
第七章 还原反应( 精)ppt课件

• (4)硫化物或含氧硫化物对含氮化合物的 还原 前者为电子供体 • (5)活泼金属作用下的氢解反应 • 2. 自由基取代还原 R3SnH作用,使碳卤键断裂,氢原子取代 卤原子
三 非均相催化氢化反应
1 基本原理
非均相催化氢化的五个连续步骤 ①:作用物分子向催化剂界面扩散; ②:作用物分子向催化剂表面吸附(物理和化学); ③:作用物分子向催化剂表面发生化学反应; ④:产物分子在催化剂表面解吸; ⑤:产物分子由催化剂界面向介质扩展。
• (1)硼烷对烯烃的还原 • 顺式加成,四中心过渡态,硼原子加到取 代较少的碳上。
• (2)硼烷对羰基化合物及含氮化合物的还 原
二 自由基反应机理 1.电子转移还原 • 氢化还原机理
• 氢解还原机理
• (1)碱金属对芳香族化合物的还原 即Birch还原 • (2)活泼金属对羰基化何物的还原 Clemmensen还原、Blanc还原、偶姻缩 合、Pinacol偶联 • (3)活泼金属对含氮化合物的还原 硝基化合物、肟、偶氮化合物等
• (3)烷氧基铝对羰基化何物的还原 即Meerwein-Ponndorf-Verley Reduction • (4)甲酸及其衍生物对羰基化合物的还原 胺化 经过Shiff碱后还原 • (5)水合肼对醛、酮的还原 即Wolff-Kishner Reduction
• 2. 亲电加成 硼烷
• THF optimally provides uncomplexed, monomeric BH3 available for reduction (or other reactions).In ether (B2H6), or in the presence of amines (BH3•NR3), less reactive borane-complexes are formed
第七章 还原反应

第七章 还原反应
• 一、概述 • 1.定义: 在化学反应中,使有机物分子中碳原子总的氧
化态降低的反应称还原反应。 • 在还原剂的作用下,使有机物分子得到电子或使参加反
应的碳原子上的电子云密度增加的反应称还原反应。 • 有机分子增加氢或减少氧的反应。
3.应用
意义: NO2
O
NH2
C
OH
C
CC
H
CH CH OH
10036,U.S.A
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
多相氢化因素:
a 催化剂:活性高 稳定性 不易中毒,再生 用量 Ni 10%~15%被催化物质质量 Pd/C 1%~5%被催化物质质量 Pt 0.5%~1%被催化物质质量
载体:为增大催化剂的表面在催化剂制备中加入的多孔物质
氯霉素
Ph
C H
C H
CHO Al(OEt)3 Ph EtOH
C H
C H
CH2OH
还原有选择性
第四节 羧酸及其衍生物的还原二酯及酰胺的还原1 酯还原成醇
1 酯还原成醇
①金属复氢化合物为还原剂
(a)LiAiH4 O
R C OR' + LiAiH4
R
OAlH3 C OR'
-AlH3(OR')
H
酯:LiAiH4=1:0.5
Al-Ni+NaOH H2O Na2AlO4+Ni+H2↑
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
亚当斯1889年生于美国波士顿,1908年毕业于哈佛大学,曾 在柏林E·费歇尔实验室从事博士后研究工作。这一年的国外学习为 他以后一生的事业奠定了基础,使他成长为美国化学界最有代表性的 人物之一
• 一、概述 • 1.定义: 在化学反应中,使有机物分子中碳原子总的氧
化态降低的反应称还原反应。 • 在还原剂的作用下,使有机物分子得到电子或使参加反
应的碳原子上的电子云密度增加的反应称还原反应。 • 有机分子增加氢或减少氧的反应。
3.应用
意义: NO2
O
NH2
C
OH
C
CC
H
CH CH OH
10036,U.S.A
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
多相氢化因素:
a 催化剂:活性高 稳定性 不易中毒,再生 用量 Ni 10%~15%被催化物质质量 Pd/C 1%~5%被催化物质质量 Pt 0.5%~1%被催化物质质量
载体:为增大催化剂的表面在催化剂制备中加入的多孔物质
氯霉素
Ph
C H
C H
CHO Al(OEt)3 Ph EtOH
C H
C H
CH2OH
还原有选择性
第四节 羧酸及其衍生物的还原二酯及酰胺的还原1 酯还原成醇
1 酯还原成醇
①金属复氢化合物为还原剂
(a)LiAiH4 O
R C OR' + LiAiH4
R
OAlH3 C OR'
-AlH3(OR')
H
酯:LiAiH4=1:0.5
Al-Ni+NaOH H2O Na2AlO4+Ni+H2↑
第二节不饱和烃的还原 一 炔、烯烃的还原1多相催化氢化
亚当斯1889年生于美国波士顿,1908年毕业于哈佛大学,曾 在柏林E·费歇尔实验室从事博士后研究工作。这一年的国外学习为 他以后一生的事业奠定了基础,使他成长为美国化学界最有代表性的 人物之一
颜范勇-第七章还原反应-全

美国化学协会(American Chemical Society) 通信地址:1155 Sixteenth St., N.W., Wsshington,D.C. 10036,U.S.A
24
• (2) 多相催化氢化影响因素: ①作用物的结构 ②作用物的纯度 ③催化剂的种类和用量 ④溶剂和介质的酸碱度 ⑤温度 ⑥压力 ⑦接触时间 ⑧搅拌
9
底物的化学吸附形式:
• (a) 氢的吸附:解离吸附。氢分子在催化剂表面
时,解离成氢原子(* 代表催化剂的活性中心)
H2 + 2
*
2H
*
10
• (b) 烯的二σ吸附:π 键打开重新形成σ键
RaCH=CHRb+ 2 * RaCH * CH Rb *
烯的π 吸附:形成π 化合物
R CH=CHR + *
H2C CH2
COOH COOH 80%
NH2NH2/Cu2+/Oc CuSO4 100%
36
• (5) 炔烃的氢化
• 炔键易被氢化,首先氢与炔进行顺式加成, 生成烯烃;然后进一步氢化,生成烷烃。 • 炔烃还原所用的催化剂通常为Raney Ni 、钯、 铂等,在常温常压下能迅速反应。控制适当 条件可优先还原炔键,分子中的其它基团 (芳硝基和酰卤除外)往往能保留下来 ,当 分子中有多个炔键时,末端的炔键优先被还 原,位阻小的炔键比位阻大的优先还原。
• 优点:
• • • • 较高的选择性; 不对称还原; 对毒剂不敏感,不易中毒; 不伴随发生异构化、氢解等副反应。
43
末端双键易氧化
单取代>双取代>三取代>四取代
OH
H2/TTC
OH
PhH RT
易氢化末端双键 90%
还原反应-2016

氢解还原的历程
• 当A=B接受一个电子形成“负离子自由基”后,一般不易 再接受第二个电子,而是分裂成为负离子B-和自由基A·, A·可接受第二个电子形成负离子A-或二聚为A-A;负离子 A-、B-和供质子剂相遇,形成氢解还原产物AH和BH。
• 常用的活性金属为:碱金属锂、钠、钾;碱土金属钙、镁、 锌;第三族的铝;第四族的锡;第八族的铁等。亦常采用 相应金属的汞齐或碱金属的液氨溶液,以增强反应活性。
电子供给体
质子供给体
活泼金属
水(联想铁粉和烯酸水溶液)
(4)硫化物或含氧硫化物对含氮化合 物的还原
• 反应底物:含氮化合物包括硝基或偶氮化合物。 • 还原过程:电子和质子转移的来龙去脉分析:
电子得失转移过程
电子供给体
质子供给体
硫化物
水或醇
(5)活泼金属作用下的氢解反应
• 在活泼金属(如锂、钠等)作用下脱卤或脱硫 氢解的反应历程包括:
第一节 还原反应机理
非均相 催化氢化
机理-分类1
均相催 化氢化
负氢离子 转移还原
机理-分类2
电子转 移还原
电子反应机理
自由基 反应机理
非均相催化 氢化机理
亲核反应
亲电反应
电子转移
自由基取代
表面催化
1. 亲核反应——亲核加成
金属复氢化物
羰基化合物 及其衍生物
含氮化合物
醛、酮、 酰氯、酯
酰胺、腈、 羧酸、酸酐
第七章 还原反应
Chapter 7 Reduction Reaction
Tel: 15877657967 QQ: 1361764205 E-mail: mengge@ :8080/web/mengge 2016,04,27~5,09
第七章 还原反应(Reduction reaction)

+
CH2OH
+
+
+
+
(ro内酯)
CH2OH
+
ROH
+
+
1
+
HNR2
+ + + + + + + +
15
RCH2OH RCHO CH2NH2 or CHO CH=NH
反应的功能基(底物)生成的功能基(产物) LiAlH4 C R NOH NO2 R C HNH2 NH2 CH3
+
LiBH4
+
NaBH4 KBH4
10
在金属原子上有件大的负电荷,如果在中央金属周围存在给电子 的配位体,如Hө、Clө等则有利于Mn+1…H2ө的形成。通常,若配 合物中央金属原子存在空轨道和处于低氧化态时,更有利于氢的 活化。 H-H键的断裂可以通过异裂或均裂两种方式。由异裂产生的 H-能取代配合物中的负离子(通常是卤素离子),而本身结合到 配合物中去。例如:
+ + +
Mn-2
+
RH2
+
(c) RH2 (d) (e) (f)
Mn(RH) RH Mn(RH)
2 Mn-1 Mn-1 MnX
+ +
RH2 RH2
三、负氢离子转移还原 第三族元素硼、铝等的氢化物,可以氢负离子的形式与不 饱和键加成,得一配合物离子,进而与质子结合而完成加氢还
13
原过程。
H H B H H
9
上述过程可能有不同的途径。 (1)氢的活化 氢的活化为催化氢化关键性的步骤。氢分子十分稳定,离 解能高达109Kcal/mol(1cal=4.1840J)。但当与中央金属配 合时,可显著降低断裂键能。氢分子的活化途径有两种:氢分 子作为电子给与体,将部分成键电子转移到中央金属的空轨道 上去以形成σ-配键;氢分子作为电子接受体,中央金属将部分 电子转移到氢分子的反键轨道,形成反馈键。这类过渡态的两 种极端形式(受电子或给电子)可用Mn-1…H2⊕和Mn+1…H2ө来表 示(M示中央金属。在H2ө和H2⊕中H-H键断裂能量分别为62k cal/mol和18.6kcal/mol。达到低于普通未活化氢分子的键断 裂能量。 形成Mn-1…H2⊕过渡态,配合物中金属原子必须具有低能量 的空轨道,第Ⅷ族过渡金属具有此种空轨道;形成Mn+1…H2ө 过渡态,电子必须由金属原子转移到氢分子的反键轨道,这就
第七章 还原反应

第七章 还原反应
7.1 催化氢化
7.2 碳—碳不饱和键的还原
7.3 芳环、杂环的还原 7.4 羰基化合物的还原 7.5 羧酸及其衍生物的还原 7.6 含氮化合物的还原
还原反应:为有机化合物中的不饱和键进行加
氢,以及对分子中与碳原子相连的原子和
基团用氢去置换的反应。
还原反应类型:催化氢化;化学还原;电解
碳-碳叁键属最容易氢化基团,反应条件较温和, 从工业制备价值看,炔烃氢化主要是选择性氢化,
使反应终止在烯烃阶段
RCHC CCH2R' B2H6 RCH2CH R'CH2C 3 B CH3COOH H H H2C C C H CH2 R'
若用钠在液氨中则得到反式烯烃。
RCHC CCH 2R' 2Na NH 3 RCH 2 Na C C Na CH2R' 2NH3 RCH 2 H C C H CH 2 R'
+ 2CH 3CH 2ONa
2CH 3CH2OH H
H
苯甲醚用金属钠在液氨中还原得到3,6-二氢苯甲醚,
在酸性溶液中水解,经酸催化异构化可得环己烯-3-酮。 典型还原反应可用于(±)硫辛酸的合成。
OCH3 (1)BuLi (2) CH2 CH2 O OCH3 CH2CH2OH Na , NH3 EtOH OCH3 CH2CH2OH
COOH Na , NH3 EtOH
OC2H5 Na-EtOH
β-乙氧基萘
COOH
OC2H 5 H 2O,H +
92%
O
四氢酮-2
OCH 3 (1)Na-EtOH H3CO (2)H O
OCH3
7.3.2 杂环催化氢化还原
CH3 H 2 ,Pa/C, CH 2COOH,CH3COONa 55-70 ℃,0.2MPa Cl CH3
7.1 催化氢化
7.2 碳—碳不饱和键的还原
7.3 芳环、杂环的还原 7.4 羰基化合物的还原 7.5 羧酸及其衍生物的还原 7.6 含氮化合物的还原
还原反应:为有机化合物中的不饱和键进行加
氢,以及对分子中与碳原子相连的原子和
基团用氢去置换的反应。
还原反应类型:催化氢化;化学还原;电解
碳-碳叁键属最容易氢化基团,反应条件较温和, 从工业制备价值看,炔烃氢化主要是选择性氢化,
使反应终止在烯烃阶段
RCHC CCH2R' B2H6 RCH2CH R'CH2C 3 B CH3COOH H H H2C C C H CH2 R'
若用钠在液氨中则得到反式烯烃。
RCHC CCH 2R' 2Na NH 3 RCH 2 Na C C Na CH2R' 2NH3 RCH 2 H C C H CH 2 R'
+ 2CH 3CH 2ONa
2CH 3CH2OH H
H
苯甲醚用金属钠在液氨中还原得到3,6-二氢苯甲醚,
在酸性溶液中水解,经酸催化异构化可得环己烯-3-酮。 典型还原反应可用于(±)硫辛酸的合成。
OCH3 (1)BuLi (2) CH2 CH2 O OCH3 CH2CH2OH Na , NH3 EtOH OCH3 CH2CH2OH
COOH Na , NH3 EtOH
OC2H5 Na-EtOH
β-乙氧基萘
COOH
OC2H 5 H 2O,H +
92%
O
四氢酮-2
OCH 3 (1)Na-EtOH H3CO (2)H O
OCH3
7.3.2 杂环催化氢化还原
CH3 H 2 ,Pa/C, CH 2COOH,CH3COONa 55-70 ℃,0.2MPa Cl CH3
第七章 还原反应

*通常,比旋度和立体异构体的组成成线性关系,如忽略测定 的实验误差,则%e e和%op两者数值应相等。
Chapter 7 Reduction Reaction
③立体选项百分率(不对称合成百分率): 当产物为一非对映异构体时用立体选项百分率表示。
立体选择(选向)性与立体专一性的区别: 前者选择性(或选向率)大于0,小于100%;后者选向 率或产品关学纯度为100%。一般生物反应具有立体专一性特 征。
Chapter 7 Reduction Reaction
一、手性醛、酮的不对称还原(Cram规则)
对于手性醛、酮,根据手性碳上连接基团性质的差异,其 立体控制途径可分为三类模型: 1.开链模型
O
Z
M
S
R'
LR
OZ
M
S
R
R'
L
Chapter 7 Reduction Reaction
开链模型要点说明:
② 还原试剂包括金属氢化物、醇铝(也包含格氏试剂同 类)将从所成环空间阻碍较小的一边(S所在一边)对羰基进 行加成,从而决定反应的立体选择性;
③ 环状模型中影响立体选择性的因素较之开链模型要复 杂一些,除了手性碳基团与前手性中心羰基之间的立体效应和 电子效应以外,还可能受反应试剂、溶剂、温度等因素的影响。
Chapter 7 Reduction Reaction
不对称反应(合成)效率的表示: 一种立体异构体在产品中占优势的程度。
根据不同的检测方法,可有不同几种表达形式: ①光学纯度百分率(percent optical purity):
②对映体过量百分率(percent enatiomeric excess):
Chapter 7 Reduction Reaction
Chapter 7 Reduction Reaction
③立体选项百分率(不对称合成百分率): 当产物为一非对映异构体时用立体选项百分率表示。
立体选择(选向)性与立体专一性的区别: 前者选择性(或选向率)大于0,小于100%;后者选向 率或产品关学纯度为100%。一般生物反应具有立体专一性特 征。
Chapter 7 Reduction Reaction
一、手性醛、酮的不对称还原(Cram规则)
对于手性醛、酮,根据手性碳上连接基团性质的差异,其 立体控制途径可分为三类模型: 1.开链模型
O
Z
M
S
R'
LR
OZ
M
S
R
R'
L
Chapter 7 Reduction Reaction
开链模型要点说明:
② 还原试剂包括金属氢化物、醇铝(也包含格氏试剂同 类)将从所成环空间阻碍较小的一边(S所在一边)对羰基进 行加成,从而决定反应的立体选择性;
③ 环状模型中影响立体选择性的因素较之开链模型要复 杂一些,除了手性碳基团与前手性中心羰基之间的立体效应和 电子效应以外,还可能受反应试剂、溶剂、温度等因素的影响。
Chapter 7 Reduction Reaction
不对称反应(合成)效率的表示: 一种立体异构体在产品中占优势的程度。
根据不同的检测方法,可有不同几种表达形式: ①光学纯度百分率(percent optical purity):
②对映体过量百分率(percent enatiomeric excess):
Chapter 7 Reduction Reaction
第七章 还原反应
H3CO H3CO CH3 CO(CH2)9OAc OCH3 H2, Pd/C H3CO H3CO OCH3 O ClCO(CH2)9OAc H3CO H3CO OCH3 CH3 H3CO H3CO O CH3 (CH2)10OH CH3 (CH2)10OAc -Ac [O]
还原成醇的反应p378 二、还原成醇的反应
O NH2NH2/KOH N H
O
O H2NNH2. H2O kOH O
△
N H
85%
盐酸胺碘酮中间体
分子中存在的双键不受影响
O 85%H2NNH2 H2O/KOH/TEG 180-200oC
(三)催化氢化还原
O FG R H2/Pd-C H+ FG R
芳香醛、 芳香醛、酮的还原 加压、酸性条件下, 加压、酸性条件下,有利于羰基还原成甲基或亚甲基 条件温和,无副产物 条件温和,
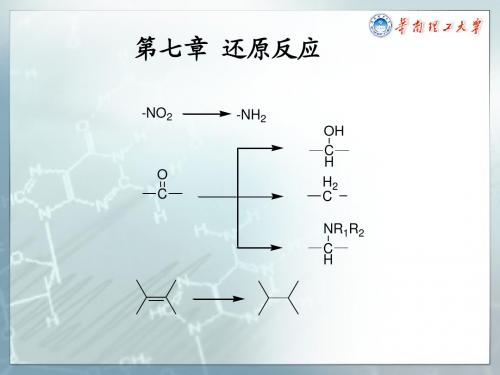
第七章 还原反应
-NO2 -NH2
O C
OH C H H2 C NR1R2 C H
羰基( 的还原反应p374 第三节 羰基(醛、酮)的还原反应
H2 C
(芳香环上引入碳链) 芳香环上引入碳链)
O C
OH C H NR1R2 C H
一、还原成烃的反应
O C
H2 C
(一) Clemmensen还原(酸性条件) 一 还原( 还原 酸性条件)
Leuckart胺烷基化反应 胺烷基化反应p383 胺烷基化反应
R C O + HCOONH4 R'
甲酸铵
R CH R'
NH2
R C O + HCOONR1R2 R'
N-烷基取代甲酰胺 烷基取代甲酰胺
R CH R'
还原成醇的反应p378 二、还原成醇的反应
O NH2NH2/KOH N H
O
O H2NNH2. H2O kOH O
△
N H
85%
盐酸胺碘酮中间体
分子中存在的双键不受影响
O 85%H2NNH2 H2O/KOH/TEG 180-200oC
(三)催化氢化还原
O FG R H2/Pd-C H+ FG R
芳香醛、 芳香醛、酮的还原 加压、酸性条件下, 加压、酸性条件下,有利于羰基还原成甲基或亚甲基 条件温和,无副产物 条件温和,
第七章 还原反应
-NO2 -NH2
O C
OH C H H2 C NR1R2 C H
羰基( 的还原反应p374 第三节 羰基(醛、酮)的还原反应
H2 C
(芳香环上引入碳链) 芳香环上引入碳链)
O C
OH C H NR1R2 C H
一、还原成烃的反应
O C
H2 C
(一) Clemmensen还原(酸性条件) 一 还原( 还原 酸性条件)
Leuckart胺烷基化反应 胺烷基化反应p383 胺烷基化反应
R C O + HCOONH4 R'
甲酸铵
R CH R'
NH2
R C O + HCOONR1R2 R'
N-烷基取代甲酰胺 烷基取代甲酰胺
R CH R'
第七章 还原反应

二、还原成醇的反应
氢化硼钾(钠)与上述锂盐不同,在常温 下,遇水、醇都较稳定,不溶于乙醚及四氢呋 喃,能溶于水、甲醇、乙醇而分解甚微,因而 常选用醇类作为溶剂。如反应须在较高的温度 下进行,则可选用异丙醇、二甲氧基乙醚等作 溶剂。在反应液中,加入少量的碱,有促进反 应的作用。氢化硼钠比其钾盐更具吸湿性,易 于潮解,故工业上常采用钾盐。采用氢化硼钾 (钠)还原剂反应结束后,可加稀酸分解还原 物并使剩余的氢化硼钾生成硼酸,便于分离。
-H2O
R R
C
NR
[H]
R R
/
CH NH R
2019/1/17
三、还原胺化反应
(二)Leuckart反应 • 在甲酸及其衍生物存在下,羰基化合物与氨、 胺的还原胺化反应称为Leuckart反应。与氢化 还原胺化比较,本反应具有较好的选择性。一 些易还原基团,如硝基、亚硝基、碳-碳双键不 受影响。许多不溶于水的脂肪酮、脂肪芳香酮 及杂环酮,用甲酸铵或甲酰胺还原,然后水解, 可得良好产率的伯胺;如用N-烷基取代或N, N-二烷基取代的甲酰胺代替甲酸铵,则可得到 仲胺或叔胺。
乌 尔 夫 -凯 惜 纳 -黄 鸣 龙
C
O
催化剂 A l C l 3/ L i A l H 4
2019/1/17
一、还原成烃基的反应
(一)Clemmensen反应 在酸性条件下,用锌汞齐或锌粉还原醛基、 酮基为甲基或亚甲基的反应称Clemmensen反应 。锌汞齐是将锌粉或锌粒用5%~10%的二氯化汞 水溶液处理后制得。将锌汞齐与羰基化合物在约 5%盐酸中回流,醛基还原成甲基,酮基则还原成 亚甲基。Clemmensen还原反应,能用于几乎所 有的芳香脂肪酮的还原,反应易于进行且收率较 高。但脂肪酮、醛或脂环酮的Clemmensen还原 容易产生树酯或双分子还原,生成频哪醇等副产 生,因而收率较低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• (3)烷氧基铝对羰基化何物的还原 即Meerwein-Ponndorf-Verley Reduction • (4)甲酸及其衍生物对羰基化合物的还原 胺化 经过Shiff碱后还原 • (5)水合肼对醛、酮的还原 即Wolff-Kishner Reduction
• 2. 亲电加成 硼烷
• THF optimally provides uncomplexed, monomeric BH3 available for reduction (or other reactions).In ether (B2H6), or in the presence of amines (BH3•NR3), less reactive borane-complexes are formed
一般决速步骤主要为吸附和解吸两步:
(1) 物理吸附和化学吸附: 物理吸附(范德华吸附):作用物分子在cat表面浓
集,为物理作用力,无选择性多分子吸附。
化学吸附:化学键引起,形成新的化学键,生成活 化吸附中间物,降低活化能,使氢化进行。
2. 活化中心
cat表面晶格上有很高活性的特定部位,如:原
子、离子、有若干原子有规则排列而成的一个
第七章
还原反应
Chapter 7
Reduction Reaction
• 有机物分子中碳原子总的氧化态(Oxidation Stete)降低的反应为还原反应,即加上H或 减少O。 • 三大类: • ① 催化氢化
• 多相催化氢化(Heterogeneous Hydrogenation) • 均相催化氢化(Homogeneous Hydrogenation)
• Amide-Amine
• Carbamate-Methylated Amine
• Epoxide-ol
• Nitrile-Amine
• Aliphatic Nitro-Amine
• Halolide-alkane
DIBAL
• 低温下将酯、内酯、腈还原为醛:
Pinacol Coupling
Blanc Reduction
• 溶解金属还原的一般过程:双电子化,双 质子化。
伯奇还原
金属钠溶解在液氨中可得到一种蓝色的溶液,它 在醇的存在下,可将芳香化合物还原成1,4-环己二烯 化合物,该还原反应称为伯奇还原。
Na
NH3(l)
C2H5OH
1 K、Li能代替Na,乙胺能代替氨;
小区域。作用物分子结构与活性中心结构间有 一定的几何对应关系,才能发生化学吸附,表 现出催化活性。
3. 多相催化氢化反应历程
(1) H2在cat表面活性中心发生化学吸附; (2) C=C+cat
σ -络合物;
半氢化状态中间物;
烷烃。
(3) 活化的H
(4) H2进行顺式加成
Polyani历程:
Bond历程:
• ② 化学还原 • ③ 生物还原
第一节 还原反应机理
一、电子反应机理 1. 亲核加成 (1)金属复氢化物对羰基化合物的还原 • LAH NaBH4 LiBH4 KBH4 NaBH3CN 各种 烷氧基硼氢化物
• (2)金属复氢化物对含氮化合物的还原
• 脂肪族硝基化合物可被LAH还原为胺; • 芳香族硝基化合物可被LAH还原为偶氮化 合物; • 硫代硼氢化钠可还原硝基化合物为胺; • 硼氢化钠可还原亚胺、烯胺。
2 卤素、硝基、醛基、酮羰基等对反应有干扰。
反应机理: Na + NH3 Na+ + (e-) NH3
溶剂化电子
金属钠溶解在液 氨中可得到一种 蓝色的溶液,这 是由钠与液氨作 用生成的溶剂化 电子引起的
(e )NH3
-
CH3OH
-CH3O-
自由基负离子 (e-) NH3 负离子
CH3OH
自由基
H H
• (4)硫化物或含氧硫化物对含氮化合物的 还原 前者为电子供体 • (5)活泼金属作用下的氢解反应 • 2. 自由基取代还原 R3SnH作用,使碳卤键断裂,氢原子取代 卤原子
三 非均相催化氢化反应
1 基本原理
非均相催化氢化的五个连续步骤 ①:作用物分子向催化剂界面扩散; ②:作用物分子向催化剂表面吸附(物理和化学); ③:作用物分子向催化剂表面发生化学反应; ④:产物分子在催化剂表面解吸; ⑤:产物分子由催化剂界面向介质扩展。
环上有给电子取代 基时,反应速率减慢。
环上有吸电子取代 基时,反应速率加快。
H
H
Mechanism
•金属+非质子溶剂 Acyloin Condensation
Benzene/Toluene
Mechanism
Example
3. 氢转移试剂还原
(1)LAH
• 羰基-醇
• 酯 -醇
• Lactone-diol
(H转移)
(歧化)
Bond历程较Polyani历程进步,可以解
释 H 交换, C=C 位置异构及顺反异构现 象。但不能解释活性中心的本质及不同 cat具有不同活性的结果。
重点内容讲解
• 1. 催化氢化
• H2/Raney Ni; H2/CuCr2O4; PtO2; (Ph3P)RhCl • Lindlar: Pd/CaCO3/Pb(OAc)2
• (1)硼烷对烯烃的还原 • 顺式加成,四中心过渡态,硼原子加到取 代较少的碳上。
• (2)硼烷对羰基化合物及含氮化合物的还 原
二 自由基反应机理 1. 电子转移还原 • 氢化还原机理
• 氢解还原机理
• (1)碱金属对芳香族化合物的还原 即Birch还原 • (2)活泼金属对羰基化何物的还原 Clemmensen还原、Blanc还原、偶姻缩 合、Pinacol偶联 • (3)活泼金属对含氮化合物的还原 硝基化合物、肟、偶氮化合物等
Hale Waihona Puke Wilkinson cat.
• (Ph3P)RhCl-通常只还原位阻最小的双键; • 加入Ph3P不但能够促进催化剂在有机溶剂 中的溶解度,而且使其更具空间效应。
• 2. 溶解金属还原 • 金属+酸: Clemmensen reduction
• 金属+ NH3 (l): 一般溶解金属还原;对炔烃 还原为反式烯 • 金属 + NH3 (l) + 质子溶剂:Birch还原 • 金属+醇:Blanc reduction、Pinacol Coupling
