[新版]2017版医疗器械分类目录讲解.ppt
2017版和2002版医疗器械分类目录对比

2017版和2002版医疗器械分类目录对比医疗器械分类目录对于医疗器械的监管、生产、经营以及使用都有着至关重要的指导作用。
随着医疗器械行业的迅速发展以及新技术、新产品的不断涌现,原有的 2002 版医疗器械分类目录已经难以满足实际需求。
2017 版医疗器械分类目录应运而生,与 2002 版相比,在多个方面都有了显著的变化。
首先,从目录的框架结构来看,2017 版分类目录更加清晰合理。
2002 版目录主要按照临床科室和医疗器械的功能进行分类,而 2017 版则采用了更加科学的分类原则,按照医疗器械的技术专业和临床使用特点进行划分。
这种分类方式更符合现代医疗器械的发展趋势,便于监管部门和相关从业者快速准确地找到所需的分类信息。
在分类的细致程度上,2017 版也有了明显的提升。
2002 版目录对于一些新兴的医疗器械或者交叉领域的产品分类不够明确,导致在实际应用中可能出现争议和困惑。
2017 版则对这些模糊地带进行了进一步的明确和细化,大大减少了分类的不确定性。
例如,在体外诊断试剂方面,2017 版分类目录单独列出了相关章节,对不同类型的体外诊断试剂进行了详细分类,为这类产品的管理提供了更具针对性的依据。
在分类规则方面,2017 版分类目录也进行了优化。
2002 版的分类规则相对较为简单,对于一些复杂的情况难以涵盖。
2017 版则增加了更多的分类判定原则和示例,使得分类过程更加透明、可操作。
同时,2017 版还引入了动态调整机制,能够根据医疗器械行业的发展及时对目录进行更新和完善,保持目录的科学性和适用性。
从信息化管理的角度来看,2017 版分类目录更便于电子信息化管理。
2002 版主要以纸质文档的形式存在,查询和使用相对不便。
2017 版则借助现代信息技术,建立了相应的数据库和查询系统,方便相关人员快速准确地获取分类信息,提高了工作效率。
对于企业而言,两版目录的变化也带来了不同的影响。
2002 版目录下,一些企业可能因为分类不明确而在注册申报、生产经营等环节遇到困难。
医疗器械产品分类目录

医疗器械产品分类目录一、绪论医疗器械是指用于预防、诊断、治疗、补充或改变人体结构和生理功能的医疗设备、试剂、材料和其他相关物品。
为了管理和规范医疗器械市场,各国家和地区都制定了相应的分类目录。
本文将介绍医疗器械产品分类目录,并对各个分类进行简要解析。
二、密码产品1. 医用数字成像设备和系统医用数字成像设备和系统包括X线摄影设备、CT扫描设备、核磁共振成像设备等。
这些设备能够采集、传输和处理医学图像,帮助医生进行诊断和治疗决策。
2. 医用电子仪器设备医用电子仪器设备包括心电图仪、血压计、血氧仪等。
这些设备通过测量和记录人体的生理信号,帮助医生监测病患的健康状态或进行诊断。
三、手术器械1. 外科手术器械外科手术器械主要用于进行外科手术操作,包括手术刀、刀片、剪刀、钳子等。
这些器械用于切割、吻合、夹取、拆线等手术步骤。
2. 骨科手术器械骨科手术器械用于进行骨科手术操作,包括钢板、螺钉、钢丝等。
这些器械用于骨折固定、关节置换等手术步骤。
四、医用材料1. 医用一次性耗材一次性耗材包括针头、导管、手套、口罩等。
这些材料在医疗过程中仅使用一次,能够避免交叉感染的风险。
2. 医用高分子材料医用高分子材料包括医用塑料、医用橡胶等。
这些材料广泛用于医疗器械的制造中,具有良好的生物相容性和物理性能。
五、辅助性产品1. 医用气体设备医用气体设备包括吸氧器、氧气瓶等。
这些设备用于提供纯净氧气给病患,帮助呼吸系统功能不全的患者正常呼吸。
2. 医用冷疗设备医用冷疗设备用于对病患进行低温冷疗,促进组织修复和炎症缓解。
常见的设备包括冷冻机、冰袋等。
六、体外诊断器械体外诊断器械用于对人体样本进行检测和分析,包括血液、尿液、唾液等。
常见的体外诊断器械有血液分析仪、尿液分析仪等。
七、医用软件医用软件用于医学影像分析、病例管理、临床决策支持等方面。
这些软件能够提高医生的诊断准确性和工作效率。
八、结论医疗器械产品分类目录是医疗器械市场管理的重要参考,对于保证医疗器械质量和安全至关重要。
医疗器械分类目录(2017年版第一类)

02-07手术器械-针
/
6
耳鼻喉科用牵开器
牵开器
内耳张开器
内耳张开器
02-11手术器械-牵开器
/
乳突牵开器、鼻腔撑开器、鼻窥器
乳突牵开器、鼻腔撑开器、鼻窥器
/
7
耳鼻喉科用其他器械
吸引、冲洗器械
五官科吸引管、鼻腔吸引管、扁桃体吸引管、鼻窦冲吸器
五官科吸引管、鼻腔吸引管、扁桃体吸引管、鼻窦冲吸器
03-10神经和心血管手术器械-牵开器
颈椎牵开器
04-04骨科用钩
颅骨牵引器
04-13外固定及牵引器械
3
神经外科脑内用其他器械
颅骨钻
手摇颅骨钻、颅骨钻
手摇颅骨钻、颅骨钻
03-11神经和心血管手术器械-穿刺导引器
/
颅骨线锯条
颅骨线锯条
颅骨线锯条
03-14神经和心血管手术器械-其他器械
/
线锯导引器
线锯导引器
对应关系
备注
序号
产品类别(一级)
产品类别(二级)
品名举例
品名举例
对应位置
1
神经外科脑内用钳
器械钳
动脉瘤夹钳、银夹钳、头皮夹钳、U型夹钳
动脉瘤夹钳、银夹钳、头皮夹钳、U型夹钳
03-03神经和心血管手术器械-钳
/
2
神经外科用牵开器
牵开器
颅骨牵引器、脑乳突牵开器、软轴牵开器、后颅凹牵开器、颈椎牵开器
脑乳突牵开器、软轴牵开器、后颅凹牵开器
鼻组织钳、鼻筛窦钳、鼻咬切钳、鼻咽活体取样钳、鼻粘膜钳、鼻(窦)息肉钳、鼻腔填塞钳、鼻骨复位钳、上颌窦咬骨钳、蝶窦咬骨钳、鼻中隔咬骨钳、上颌窦止血钳
【2017年整理】医疗器械分类目录(版)(1)

医疗器械分类目录(2002版)6809泌尿肛肠外科手术器械6810矫形外科(骨科)手术器械6812妇产科用手术器械6813计划生育手术器械6815注射穿刺器械6816烧伤(整形)科手术器械6820普通诊察器械6821 医用电子仪器设备6822 医用光学器具、仪器及内窥镜设备6823医用超声仪器及有关设备6824医用激光仪器设备6825医用高频仪器设备6826物理治疗及康复设备6827中医器械6828医用磁共振设备6830医用X射线设备6831医用X射线附属设备及部件6832医用高能射线设备6855口腔科设备及器具2013年事业单位招考银行金融基础知识(1)1、目前我国实行的是分业经营、分业监管的金融监管体制。
2、银行控股公司制是指某一个集团通过直接购买若干银行的多数股票来控制被收购银行的一种组织形式。
3、信用合作的本质特征是:由社员入股组成,实行民主管理,主要为社员提供信用服务。
4、与商业银行开办汽车消费信贷业务相比,汽车金融公司的专业化程度更高,更具有专业优势。
5、我国的金融资产管理公司以最大限度保全资产、减少损失为主要经营目标。
6、经济决定金融,不同的经济体制决定着不同的金融组织体系。
7、按照《中国人民银行法》规定,财政不得向中国人民银行透支,但中国人民银行可以直接认购政府债券。
8、1992年10月,国务院证券委员会和中国证监会成立。
9、我国商业银行实行的是总分行制,分行之间不应有相互存贷的市场交易行为。
10、“受人之托,代人理财”是信托的本质特征。
11、人身保险包括人寿保险、健康保险、意外伤害保险和保证保险等。
12、中国华融资产管理公司主要接收从中国农业银行剥离出来的不良资产。
13、中国人民银行成立于1949年12月1日。
14、中国人民银行是人民币发行的唯一的合法机构。
15、吸收活期存款,创造信用货币,是商业银行最明显的特征。
16、信用合作制实行“一股一票”制,社员依据入股的多少对信用社决策施加不同的影响力。
2017版医疗器械分类目录纯表格版本

3
骨科用钳
3
骨科用钳
03咬骨钳 04组织 用钳
05撑开钳 06压缩钳
07植入物塑形用钳
01拉钩
04骨科手术器械
4
骨科用钩
02牵开器
04骨科手术器械 04骨科手术器械
04骨科手术器械 04骨科手术器械 04骨科手术器械
04骨科手术器械
04骨科手术器械 04骨科手术器械 04骨科手术器械 04骨科手术器械 04骨科手术器械 04骨科手术器械 04骨科手术器械
02无源手术器械
02无源手术器械
02无源手术器械
02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械
02无源手术器械
02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械 02无源手术器械
01 有源手术器械
01 有源手术器械 01 有源手术器械 01 有源手术器械
01 有源手术器械 01 有源手术器械 01 有源手术器械 01 有源手术器械 01 有源手术器械 01 有源手术器械 01 有源手术器械 01 有源手术器械 01 有源手术器械
7 手术导航、控制系统
01手术导航系统
02手术定位系统 03手术控制系统
03神经和心血管手术器 械
03神经和心血管手术器 械
03神经和心血管手术器 械
03神经和心血管手术器 械
03神经和心血管手术器 械
03神经和心血管手术器 械 03神经和心血管手术器 械
03神经和心血管手术器 械
2017医疗器械分类目录

编号大类名称小类名称680101基础外科手术器械医用缝合针(不带线) 680102基础外科手术器械基础外科用刀680103基础外科手术器械基础外科用剪680104基础外科手术器械基础外科用钳680105基础外科手术器械基础外科用镊夹680106基础外科手术器械基础外科用针、钩680107基础外科手术器械基础外科其它器械680201显微外科手术器械显微外科用刀、凿680202显微外科手术器械显微外科用剪680203显微外科手术器械显微外科用钳680204显微外科手术器械显微外科用镊、夹680205显微外科手术器械显微外科用针、钩680206显微外科手术器械显微外科用其他器械680301神经外科手术器械神经外科脑内用刀680302神经外科手术器械神经外科脑内用钳680302神经外科手术器械神经外科脑内用钳680303神经外科手术器械神经外科脑内用镊680304神经外科手术器械神经外科脑内用钩、刮680305神经外科手术器械神经外科脑内用其他器械680305神经外科手术器械神经外科脑内用其他器械680402眼科手术器械眼科手术用剪680403眼科手术器械眼科手术用钳680404眼科手术器械眼科手术用镊、夹680405眼科手术器械眼科手术用钩、针680406眼科手术器械眼科手术用其他器械680406眼科手术器械眼科手术用其他器械680501耳鼻喉科手术器械耳鼻喉科用刀、凿680502耳鼻喉科手术器械耳鼻喉科用剪680503耳鼻喉科手术器械耳鼻喉科用钳680504耳鼻喉科手术器械耳鼻喉科用镊、夹680505耳鼻喉科手术器械耳鼻喉科用钩、针680506耳鼻喉科手术器械耳鼻喉科用其他器械680601口腔科手术器械口腔用刀、凿680602口腔科手术器械口腔用剪680603口腔科手术器械口腔用钳680604口腔科手术器械口腔用镊、夹680605口腔科手术器械口腔用钩、针680606口腔科手术器械口腔用其它器械680701胸腔心血管外科手术器械胸腔心血管外科用刀680702胸腔心血管外科手术器械胸腔心血管外科用剪680703胸腔心血管外科手术器械胸腔心血管外科用钳680703胸腔心血管外科手术器械胸腔心血管外科用钳680704胸腔心血管外科手术器械胸腔心血管外科用镊、夹680704胸腔心血管外科手术器械胸腔心血管外科用镊、夹680705胸腔心血管外科手术器械胸腔心血管外科用钩、针680706胸腔心血管外科手术器械胸腔心血管外科用其他器械680706胸腔心血管外科手术器械胸腔心血管外科用其他器械680707胸腔心血管外科手术器械胸腔心血管外科用吸引器680802腹部外科手术器械腹部外科用剪680803腹部外科手术器械腹部外科用钳680804腹部外科手术器械腹部外科用钩、针680806腹部外科手术器械腹部外科用其他器械680902泌尿肛肠外科手术器械泌尿肛肠科用剪680903泌尿肛肠外科手术器械泌尿肛肠科用钳680903泌尿肛肠外科手术器械泌尿肛肠科用钳680905泌尿肛肠外科手术器械泌尿肛肠科用钩、针680906泌尿肛肠外科手术器械泌尿肛肠科用其他器械681001矫形外科(骨科)手术器械矫形(骨科)外科用刀、锥681001矫形外科(骨科)手术器械矫形(骨科)外科用刀、681002矫形外科(骨科)手术器械矫形(骨科)外科用剪681003矫形外科(骨科)手术器械矫形(骨科)外科用钳681003矫形外科(骨科)手术器械矫形(骨科)外科用钳681004矫形外科(骨科)手术器械矫形(骨科)外科用锯、凿、锉681004矫形外科(骨科)手术器械矫形(骨科)外科用锯、凿、锉681005矫形外科(骨科)手术器械矫形(骨科)外科用钩、针681006矫形外科(骨科)手术器械矫形(骨科)外科用刮681007矫形外科(骨科)手术器械矫形(骨科)外科用有源器械681007矫形外科(骨科)手术器械矫形(骨科)外科用有源器械681008矫形外科(骨科)手术器械矫形(骨科)外科用其它器械681201妇产科用手术器械妇产科用刀681202妇产科用手术器械妇产科用剪681203妇产科用手术器械妇产科用钳681204妇产科用手术器械妇产科用镊、夹681205妇产科用手术器械妇产科用钩、针681206妇产科用手术器械妇产科用其他器械681303计划生育手术器械计划生育用钳681306计划生育手术器械计划生育用其他器械681500注射穿刺器械注射穿刺器械681500注射穿刺器械注射穿刺器械681601烧伤(整形)科手术器械烧伤(整形)用刀、凿681603烧伤(整形)科手术器械烧伤(整形)用钳681604烧伤(整形)科手术器械烧伤(整形)用镊、夹681606烧伤(整形)科手术器械烧伤(整形)用其他器械682001普通诊察器械体温计682002普通诊察器械血压计682004普通诊察器械听诊器(无电能)682005普通诊察器械叩诊锤(无电能)682006普通诊察器械反光器具682007普通诊察器械视力诊察器具682101医用电子仪器设备用于心脏的治疗、急救装置682102医用电子仪器设备有创式电生理仪器及创新电生理仪器682103医用电子仪器设备无创医用传感器682103医用电子仪器设备有创医用传感器682104医用电子仪器设备心电诊断仪器682105医用电子仪器设备脑电诊断仪器682106医用电子仪器设备肌电诊断仪器682107医用电子仪器设备其他生物电诊断仪器682108医用电子仪器设备电声诊断仪器682109医用电子仪器设备无创监护仪器682109医用电子仪器设备无创监护仪器682110医用电子仪器设备呼吸功能及气体分析测定装置682111医用电子仪器设备医用刺激器682111医用电子仪器设备医用刺激器682112医用电子仪器设备血流量、容量测定装置682113医用电子仪器设备电子压力测定装置682114医用电子仪器设备生理研究实验仪器682115医用电子仪器设备光谱诊断设备682116医用电子仪器设备体外反搏及其辅助循环装682117医用电子仪器设备睡眠呼吸治疗系统682118医用电子仪器设备心电电极682120医用电子仪器设备心电导联线682201医用光学器具、仪器及内窥镜设备植入体内或长期接触体内的眼科光学器具682202医用光学器具、仪器及内窥镜设备心及血管、有创、腔内手术用内窥镜682203医用光学器具、仪器及内窥镜设备电子内窥镜682204医用光学器具、仪器及内窥镜设备眼科光学仪器682205医用光学器具、仪器及内窥镜设备光学内窥镜及冷光源682206医用光学器具、仪器及内窥镜设备医用手术及诊断用显微设备682207医用光学器具、仪器及内窥镜设备医用放大镜682208医用光学器具、仪器及内窥镜设备医用光学仪器配件及附件682301医用超声仪器及有关设备超声手术及聚焦治疗设备682302医用超声仪器及有关设备彩色超声成像设备及超声介入/腔内诊断设备682303医用超声仪器及有关设备超声母婴监护设备682304医用超声仪器及有关设备超声换能器682305医用超声仪器及有关设备便携式超声诊断设备682306医用超声仪器及有关设备超声理疗设备682307医用超声仪器及有关设备超声辅助材料682401医用激光仪器设备激光手术和治疗设备682402医用激光仪器设备激光诊断仪器682402医用激光仪器设备激光诊断仪器682403医用激光仪器设备介入式激光诊治仪器682404医用激光仪器设备激光手术器械682405医用激光仪器设备弱激光体外治疗仪器682501医用高频仪器设备高频手术和电凝设备682501医用高频仪器设备高频手术和电凝设备682502医用高频仪器设备高频电熨设备682503医用高频仪器设备微波治疗设备682504医用高频仪器设备射频治疗设备682504医用高频仪器设备射频治疗设备682505医用高频仪器设备高频电极682601物理治疗及康复设备高压氧治疗设备682602物理治疗及康复设备电疗仪器682602物理治疗及康复设备电疗仪器682603物理治疗及康复设备光谱辐射治疗仪器682603物理治疗及康复设备光谱辐射治疗仪器682604物理治疗及康复设备高压电位治疗设备682605物理治疗及康复设备理疗康复仪器682605物理治疗及康复设备理疗康复仪器682606物理治疗及康复设备生物反馈仪682607物理治疗及康复设备磁疗仪器682608物理治疗及康复设备眼科康复治疗仪器682609物理治疗及康复设备理疗用电极682701中医器械诊断仪器682702中医器械治疗仪器682703中医器械中医器具682703中医器械中医器具682801医用磁共振设备医用磁共振成像设备(MRI) 683001医用X射线设备X射线治疗设备683002医用X射线设备X射线诊断设备及高压发生装置683002医用X射线设备X射线诊断设备及高压发生装置683003医用X射线设备X射线手术影像设备683004医用X射线设备X射线计算机断层摄影设备(CT)683101医用X射线附属设备及部件医用X射线管、管组件或源组件683102医用X射线附属设备及部件医用X线影像系统及成像器件683103医用X射线附属设备及部件X线机配套用患者或部件支撑装置(电动)683104医用X射线附属设备及部件X射线透视、摄影附加装置683105医用X射线附属设备及部件X射线机用限速器683106医用X射线附属设备及部件医用X线胶片处理装置683107医用X射线附属设备及部件医用X线机配套用非电动床、椅等用具683201医用高能射线设备医用高能射线治疗设备683202医用高能射线设备高能射线治疗定位设备683301医用核素设备放射性核素治疗设备683302医用核素设备放射性核素诊断设备683302医用核素设备放射性核素诊断设备683303医用核素设备核素标本测定装置683304医用核素设备核素设备用准直装置684001临床检验分析仪器血液分析系统684001临床检验分析仪器血液分析系统684002临床检验分析仪器生化分析系统684003临床检验分析仪器免疫分析系统684004临床检验分析仪器细菌分析系统684004临床检验分析仪器细菌分析系统684005临床检验分析仪器尿液分析系统684006临床检验分析仪器生物分离系统684007临床检验分析仪器血气分析系统684008临床检验分析仪器基因和生命科学仪器684008临床检验分析仪器基因和生命科学仪器684010临床检验分析仪器临床医学检验辅助设备684101医用化验和基础设备器具医用培养箱684102医用化验和基础设备器具医用离心机684103医用化验和基础设备器具病理分析前处理设备684104医用化验和基础设备器具血液化验设备和器具684104医用化验和基础设备器具血液化验设备和器具684501体外循环及血液处理设备人工心肺设备684502体外循环及血液处理设备氧合器684503体外循环及血液处理设备人工心肺设备辅助装置684503体外循环及血液处理设备人工心肺设备辅助装置684504体外循环及血液处理设备血液净化设备和血液净化器具684505体外循环及血液处理设备血液净化设备辅助装置684506体外循环及血液处理设备体液处理设备684506体外循环及血液处理设备体液处理设备684507体外循环及血液处理设备透析粉、透析液684601植入材料和人工器官植入器材684602植入材料和人工器官植入性人工器官684603植入材料和人工器官接触式人工器官684604植入材料和人工器官支架684605植入材料和人工器官器官辅助装置684605植入材料和人工器官器官辅助装置685401手术室、急救室、诊疗室设备及器手术及急救装置685401手术室、急救室、诊疗室设备及器具手术及急救装置685402手术室、急救室、诊疗室设备及器具呼吸设备685403手术室、急救室、诊疗室设备及器呼吸麻醉设备及附件685403手术室、急救室、诊疗室设备及器具呼吸麻醉设备及附件685404手术室、急救室、诊疗室设备及器具婴儿保育设备685405手术室、急救室、诊疗室设备及器输液辅助装置685405手术室、急救室、诊疗室设备及器具输液辅助装置685406手术室、急救室、诊疗室设备及器负压吸引装置685407手术室、急救室、诊疗室设备及器呼吸设备配件685407手术室、急救室、诊疗室设备及器呼吸设备配件685408手术室、急救室、诊疗室设备及器医用制气设备685409手术室、急救室、诊疗室设备及器具685410手术室、急救室、诊疗室设备及器具冲洗、通气、减压器具685411手术室、急救室、诊疗室设备及器诊察治疗设备685413手术室、急救室、诊疗室设备及器手术灯685413手术室、急救室、诊疗室设备及器具手术灯685414手术室、急救室、诊疗室设备及器具手动手术台床685501口腔科设备及器具口腔综合治疗设备685502口腔科设备及器具牙钻机及配件685503口腔科设备及器具牙科椅685503口腔科设备及器具牙科椅685504口腔科设备及器具牙科手机685505口腔科设备及器具洁牙、补牙设备685506口腔科设备及器具车针685507口腔科设备及器具口腔综合治疗设备配件685507口腔科设备及器具口腔综合治疗设备配件685508口腔科设备及器具口腔灯685601病房护理设备及器具供氧系统685602病房护理设备及器具病床685602病房护理设备及器具病床685604病房护理设备及器具医用供气、输气装置685701消毒和灭菌设备及器具辐射灭菌设备685702消毒和灭菌设备及器具压力蒸汽灭菌设备685703消毒和灭菌设备及器具气体灭菌设备685704消毒和灭菌设备及器具干热灭菌设备685705消毒和灭菌设备及器具高压电离灭菌设备685706消毒和灭菌设备及器具专用消毒设备685706消毒和灭菌设备及器具专用消毒设备685707消毒和灭菌设备及器具煮沸消毒设备685708消毒和灭菌设备及器具煮沸灭菌器具685801医用冷疗、低温、冷藏设备及器具低温治疗仪器685801医用冷疗、低温、冷藏设备及器具低温治疗仪器685802医用冷疗、低温、冷藏设备及器具医用低温设备685803医用冷疗、低温、冷藏设备及器具医用冷藏设备685805医用冷疗、低温、冷藏设备及器具冷敷器具686301口腔科材料高分子义齿材料686302口腔科材料齿科植入材料686303口腔科材料根管充填材料686303口腔科材料牙周塞治剂686304口腔科材料颌面部修复材料686305口腔科材料永久性充填材料及有关材686305口腔科材料永久性充填材料及有关材料686306口腔科材料暂封性充填材料及有关材686307口腔科材料金属、陶瓷类义齿材料686308口腔科材料齿科预防保健材料686309口腔科材料充填辅助材料686310口腔科材料正畸材料686311口腔科材料印模材料686312口腔科材料铸造包埋材料686313口腔科材料模型材料686314口腔科材料齿科辅助材料686315口腔科材料研磨材料686401医用卫生材料及敷料可吸收性止血、防粘连材料686402医用卫生材料及敷料敷料、护创材料686402医用卫生材料及敷料敷料、护创材料686404医用卫生材料及敷料手术用品686405医用卫生材料及敷料粘贴材料686501医用缝合材料及粘合剂医用可吸收缝合线(带针/不带针)686502医用缝合材料及粘合剂不可吸收缝合线(带针/不带针)686503医用缝合材料及粘合剂医用粘合剂686504医用缝合材料及粘合剂表面缝合材料686601医用高分子材料及制品输液、输血器具及管路686602医用高分子材料及制品妇科检查器械686603医用高分子材料及制品避孕器械686604医用高分子材料及制品导管、引流管686604医用高分子材料及制品导管、引流管686605医用高分子材料及制品呼吸麻醉或通气用气管插管686606医用高分子材料及制品肠道插管686607医用高分子材料及制品手术手套686608医用高分子材料及制品引流容器686609医用高分子材料及制品一般医疗用品687001软件功能程序化软件687002软件诊断图象处理软件687002软件诊断图象处理软件687003软件诊断数据处理软件687004软件影象档案传输、处理系统软件687005软件人体解剖学测量软件687701介入器材血管内导管687701介入器材血管内导管687702介入器材导丝和管鞘687703介入器材栓塞器材品名举例管理类别医用缝合针(不带线)II手术刀柄和刀片、皮片刀、疣体剥离刀、柳叶刀、铲刀、剃毛刀、皮屑刮刀、挑刀、锋刀、修脚刀、修甲刀、解剖刀I普通手术剪、组织剪、综合组织剪、拆线剪、石膏剪、解剖剪、纱布绷带剪、教育用手术剪I普通止血钳、小血管止血钳、蚊式止血钳、组织钳、硬质合金镶片持针钳、普通持针钳、创夹缝拆钳、皮肤轧钳、子弹钳、纱布剥离钳、海绵钳、帕巾钳、皮管I小血管镊、无损伤镊、组织镊、整形镊、持针镊、保健镊(简易镊)、拔毛镊、帕巾镊、敷料镊、解剖镊、止血夹I动脉瘤针、探针、推毛针、植毛针、挑针、教学用直尖针、静脉拉钩、创口钩、扁平拉钩、双头拉钩、皮肤拉钩、解剖钩I刀片夹持器、麻醉口罩、麻醉开口器、照明吸引器头、粉刺取出器、黑头粉刺压出器、皮肤刮匙、皮肤套刮器、皮肤刮划测检器、皮肤检查尺、皮肤组织钻孔器、开口器、卷棉子I显微喉刀I显微剪、显微枪形手术剪、显微组织剪I显微枪形麦粒钳、显微喉钳、显微持针钳I显微镊、显微持针镊、显微止血I显微耳针、显微喉针、显微耳钩、显微喉钩I显微合拢器I脑神经刀、可拆卸式脑膜刀、脑神经刀、脑膜刀II银夹钳、U型夹钳、动脉瘤夹钳I肿瘤摘除钳、脑组织咬除钳II脑膜镊、垂体瘤镊、肿瘤夹持镊II脑膜钩、脑膜拉钩、神经钩、神经根拉钩、交感神经钩、脑刮匙、脑垂体刮匙II脑吸引器、后颅凹牵开器、手摇颅骨钻、脑打针锤、脑压板I脑活检抽吸器、脑膜剥离器II角膜剪、眼用手术剪、眼用组织I晶体植入钳、环状组织钳I角膜镊、眼用镊、眼用结扎镊I眼用钩针I眼用板铲、眼用固定环、开睑器I玻璃体切割器III耳鼓膜刀、鼻粘膜刀、扁桃体刀、酒渣鼻切割刀、鼻骨凿、乳突平(园)骨凿、上颌窦对孔凿、耳用骨凿I 扁桃体剪、甲状腺剪、喉头剪、中耳剪、鼻剪I 扁桃体止血钳、枪式间接喉钳、筛窦钳、耳钳、双关节鼻中隔咬骨钳、甲状腺三爪钳、鼻咽活体I 喉用敷料镊、耳用膝状镊、鼻用枪状镊、扁桃体止血夹I 喉部微型手术钩、耳用探针、双头鼓式探针、扁桃体拉钩、鼻腔I 扁桃体吸引管、乳突吸引管、乳突牵开器、麻醉咽喉镜、支撑喉镜、耳单头(双头)刮匙、音叉I 牙龈刀、水门调刀、粘固粉调刀、银汞雕刻刀、牙骨凿、阻生牙骨凿、牙釉凿I 牙龈剪、全冠剪I 拔牙钳、切断牙钳、牙槽咬骨钳、舌钳、扩大钳I 残根镊、牙用镊、长镊、成形片I 牙探针、脓肿探针、牙周袋探针I 牙挺、丁字形牙挺、牙根尖挺、牙用锉、牙骨锤、牙刮匙、根管充填器、牙骨膜分离器、牙龈分离器、洁治器、刮治器、剔挖器、研光器、粘固粉充填器、银汞合金充填器、去冠器、口镜、拔髓针柄、水枪头、热气枪头、吹火管、咬合器、印模托盘、汞合金输送器、磨牙带环就位器、结扎杆、带环推子、弓丝成型器、I 胸骨刀I 心脏手术剪、胸骨剪、肋骨剪I 心房持针钳、胸腔止血钳、胸腔组织钳、三角肺叶钳、结扎钳、双关节肋骨咬骨钳I 心内膜心肌活组织钳、心房侧壁钳、主动脉侧壁钳、主动脉阻断钳、主动脉止血钳、主动脉游离钳、无损伤肺动脉止血钳、无损伤动脉止血钳、无损伤动脉导管钳、动脉侧壁钳、动脉阻断钳、静脉阻断钳、腔静脉钳、腔静脉游离钳、主肺动脉钳II 胸腔镊、胸腔组织镊、肺组织镊I 大隐静脉镊、心房止血器、心耳止血器、凹凸齿止血夹II 心房(心室)拉钩、二尖瓣膜拉钩、排气针I血管扩张器、血管牵开器、胸骨手钻、双头剥离匙、肋骨骨膜剥离子、内膜剥离器I 血管打洞钳(器)、心房打洞器、二尖瓣扩张器II 心内吸引器(头)、左房引流管、冠状动脉吸引器、冠状动脉灌注器、大隐静脉冲洗管、静脉撑开器、短柄吸引器(头)II 胃内手术剪、直角剪I 胆石钳、脾蒂钳、腹膜钳、胃组织取样钳I 胆道拉钩、双头腹壁拉钩、阑尾拉钩、气腹针I 荷包成型器、压肠板、单(双)胆石匙、胆道探条、腹壁固定牵I 肠剪、膀胱切除剪、前列腺剪I 肾蒂钳、肠钳、直肠活体取样钳、膀胱肿瘤匙钳、膀胱颈钳、痔I 血管阻断钳、骼血管阻断钳、骼静脉侧壁钳II 膀胱拉钩、前列腺拉钩、肛门探I 尿道扩张器、肛门镜、阴茎夹I 丝锥、髓腔铰刀、加压螺纹钉铰刀、截断刀、截骨刀、胫骨切刀、石膏刀、胫骨切割器、髋关节成型凹凸钻、钻头、铰孔钻、手枪式手摇骨钻I 椎管铲刀、椎管锉刀、手锥II 双关节棘突骨剪、双关节咬骨剪、骨剪、膝关节韧带手术剪、石膏剪、钢丝剪I 膝关节息肉钳、咬骨钳、持骨钳、腐骨钳、复位钳、持钉钳、持板钳、持棒钳、持钩钳、螺杆夹持钳、撑开钳、压缩钳、枪形取样钳、骨克丝钳、钢板弯曲钳、I 颈椎咬骨钳、颈椎双关节咬骨钳、脊柱侧弯矫正钳、髓核钳、椎板咬骨钳、弯头平口棘突骨钳、枪形咬骨钳II 弓锯、指锯、骨锯、小园刮凿、丁字凿、骨锉、弧形凿、髋关节成型凿、石膏锯、梯形铲、肘关节肱骨成型骨凿、髓腔锉、椎管锉、骨凿、座导凿I 环锯、腰椎用梯形骨凿、椎间盘手术用环锯、C0D椎板剥离器、颈椎测深凿、颈椎直角骨凿、椎板骨凿、椎体骨凿、椎体前方剥离II 单侧椎板拉钩、半月板钩、下肢截断拉钩、骨钩、颈椎拉钩、颈前路深部缝合针、骨牵引针、加压螺纹钉导引针I颈椎刮匙、可变神经剥离子器、刮匙、骨膜剥离器(子)I 电动石膏剪、电动石膏锯I 风动开颅器、电池式自停颅骨钻、电动胸骨锯、电动骨钻II 肢体延长架、多功能单侧外固定支架II 碎胎刀I 子宫剪、剖腹产剪、脐带剪、会阴剪I 产钳、剖腹产切口钳、妇科组织钳、子宫颈活体取样钳、子宫夹持钳、妇科分离钳、胎盘钳I 环形输卵管镊I 子宫拉钩、阴道拉钩、断头钩、子宫探针、腹水穿刺针I 碎颅器、输卵管通夜器、阴道牵开器、会阴牵开器、骨盆测量计I 输精管分离钳、输精管皮外固定钳、节育环放置钳I 子宫刮匙、输卵管提取板(钩)I 一次性使用无菌注射器及其胶塞、一次性使用无菌注射针、一次性静脉输液针、一次性使用光纤针、静脉留置针、一次性配药用注射针、穿刺针III 玻璃注射器II 辊轴取皮刀、鼻手术刀、鼻骨凿、指骨凿I 颌骨夹持钳、肌腱夹持钳、肌腱穿刺钳、软骨塑型钳I 整形镊、皮肤镊、眼睑镊、唇夹I 鼓式取皮机、烧伤植皮三用机、肌腱分离器、肌腱剥离器、筋膜套切器、皮肤疣圈断器、嘴形撑I 电子体温计、红外耳蜗体温计、口腔、肛门、腋下体温计、皮肤体温计、液晶体温计II 无创性电子血压计、台式、立式血压计、血压表、小儿血压表II 单用、二用、三用听诊器、额戴听诊器、胎音听诊器I 打诊锤、脑打诊锤、多用途叩诊I 额戴反光镜、电额灯、反光喉镜、聚光灯、反光灯、检眼灯、头I 卡片投影仪、视力表灯(箱)、视力检查仪、遮眼器、标准视力I 植入式心脏起搏器、体外心脏起搏器、心脏除颤器、心脏调搏器、主动脉内囊反搏器、心脏除颤III体外震波碎石机、病人有创监护系统、颅内压监护仪、有创心输出量计、有创多导生理记录仪、心内希氏束电图机、心内外膜标测图仪、有创性电子血压计III 无创医用传感器II 各种植入体内的医用传感器III 单导心电图机、多导心电图机、胎儿心电图机、心电向量图机、心电图综合测试仪、晚电位测试仪、无损伤心功能检测仪、心率变异性检测仪、心电分析仪、运动心电功量计、心电多相分析仪、心电遥测仪、心电电话传递系统、实时心律分析记录仪、长程心电记录仪、心电标测图仪、心II 脑电图机、脑电阻仪、脑电波分析仪、脑地形图仪、脑电实时分析记录仪II 肌电图机II 眼动图仪、眼震电图仪、视网膜电图仪、诱发电位检测系统(含视、听、体)II 听力计、小儿测听计、心音图仪、舌音图仪、胃电图仪、胃肠电流图仪II 病人监护仪(监护参数含心电、血氧饱和度、无创血压、脉搏、体温、呼吸、呼吸末二氧化碳)、麻醉气体监护仪、呼吸功能监护仪、睡眠评价系统、分娩监护II 心率失常分析仪及报警器、带S0T段的监护仪III 综合肺功能测定仪、呼吸功能测试仪、氧浓度测定仪、肺通气功能测试仪、CO2浓度测定仪、肺内气体分布功能测试仪、弥散功能测试仪、氮气计、微量气体分析器、压力型容积描绘仪、肺量仪II 声、光、电、磁刺激器II 心脏工作站电刺激器III 脑血流图仪、阻抗血流图仪、电磁血流量计、无创心输出量计、心脏血管功能综合测试仪II 电子血压脉搏仪、动态血压监护II 方波生理仪、生物电脉冲频率分析仪、生物电脉冲分析仪、微电极控制器、微操纵器、微电极监II 医用红外热象仪、红外线乳腺诊断仪II 气囊式体外反搏装置III 睡眠呼吸治疗系统II 心电电极II 心电导联线I。
(完整版)新医疗器械分类目录(旧分类对应新分类)

16眼科器械
6823-1超声诊断设备-眼科专用超声脉冲回波设;
6823-3超声治疗设备-超声手术设备
17口腔科器械
6823-3超声治疗设备中的超声洁牙设备(2012版)
18妇产科、辅助生殖和避孕器械
6823-2超声监护设备中的超声多普勒胎儿监护仪(2012版);
6821-8电声诊断仪器(2002版);
6821-3有创医用传感器(2002版);
6821-3无创医用传感器(2002版);
6821-18心电电极(2002版);
6821-19心电导联线(2002版)
08呼吸、麻醉和急救器械
6821-1用于心脏的治疗、急救装置中的心脏除颤器(2002版)
09物理治疗器械
6823-1超声诊断设备中的超声脉冲多普勒成像设备(2012版)
6824医用激光仪器设备
01有源手术器械
6824-1激光手术和治疗设备(除眼科激光光凝机、眼晶体激光乳化设备外)(2002版)(包含医用激光光纤)
06医用成像器械
6824-2激光诊断仪器(2002版);
6824-2激光诊断仪器(2002版)
6807-6胸腔心血管外科用其他器械中的双头剥离匙、内膜剥离器;
6807-6胸腔心血管外科用其他器械中的血管扩张器、血管牵开器;
6807-6胸腔心血管外科用其他器械中的血管打洞钳(器)、心房打洞器、胸骨手钻;
6807-7胸心血管外科用吸引器除静脉撑开器
6808腹部外科手术器械
02无源手术器械
6808-2腹部外科用剪;
6809-5泌尿肛肠科用针、钩;
6809-6泌尿肛肠科用其他器械中的尿道扩张器
2017版医疗器械分类目录讲解

注册人应当按照改变后的类别向相应食品药品 监督管理部门申请注册。在原医疗器械注册证 有效期内提出注册申请的,如在开展产品类别 产品管理类别由低类 转换工作期间注册证到期,注册人可向原审批 别调整为高类别 部门提出原医疗器械注册证延期申请,予以延 期的,原则上原医疗器械注册证有效期不得超 过2019年8月31日。
6
一、医疗器械目录概述
3、分类目录编写依据?谁负责编写?更新发布?
编写依据
• 分类目录依据《医疗器械分类规则》制定; • 国家药监总局负责编写; • 国家药监总局负责更新发布;
谁负责编写
更新发布
《医疗器械分类目录》&《医疗器械分类规则》关系 1> 分类规则用于指导分类目录的制定和确定新的产品注册类别;
20
四、新版实施过渡政于医疗器械生产经营许可证政策要求
时间节点 状态 其他条件 政策要求
2018.8.1起
新申请生产 许可证
依据医疗器械注册证按照新《分类目录》填 持按照新分类目 写《医疗器械生产许可证》的生产范围和医 录核发注册证 疗器械生产产品登记表,其中生产范围应填 写到一级产品类别。
(五)自2018年8月1日起,除第(二)项和第(四)项以及既往发布的分类界定文件中不作为医疗器械
管理的产品分类界定意见外,原《医疗器械分类目录》(国药监械〔2002〕302号,以下简称原《分类
目录》)及既往发布的医疗器械分类界定文件内容及目录废止。
14
四、新版实施过渡政策
二、医疗器械注册和备案管理有关政策
10
二、新旧分类目录区别
3、新分类目录影响 新《分类目录》的框架和内容均有较大调整,对医疗器械注册、生产、
经营、使用等各环节都将产生影响。为确保各方统一认识、平稳过渡、有
第10类 医疗器械2017

102017尼斯分类第十类医疗器械类外科、医疗、牙科和兽医用仪器及器械;假肢,假眼和假牙;矫形用物品;缝合用材料;残疾人专用治疗装置;按摩器械;婴儿护理用器械、器具及用品;性生活用器械、器具及用品。
【注释】第十类主要包括主要用于诊断、治疗及改善人和动物的功能或健康状态的外科、内科、牙科及兽医用仪器、器械及用品。
本类尤其包括:——医疗用支撑绷带和特种服装,例如:压力衣,静脉曲张用长袜,拘束衣,矫形鞋;——月经、避孕及分娩用仪器、器械及用品,例如:月经杯,子宫帽,避孕套,分娩褥垫,产钳;——由人造或合成材料制成的植入用假体及治疗用具,例如:人造外科移植物,人造乳房,脑起搏器,可生物降解的骨固定植入物;——医用特制家具,例如:医用或牙科用扶手椅,医用气褥垫,手术台。
本类尤其不包括:——医用辅料和吸收性卫生用品,例如:橡皮膏,包扎用纱布和绷带,防溢乳垫,婴儿尿布和失禁用尿布,卫生棉条(第五类);——活体外科移植物(第五类);——医用无烟草香烟(第五类)和电子香烟(第三十四类);——轮椅和电动代步车(第十二类);——按摩用床和医院用床(第二十类)。
【目录】•1001外科、医疗和兽医用仪器、器械、设备,不包括电子、核子、电疗、医疗用X光设备、器械及仪器•1002牙科设备及器具•1003医疗用电子、核子、电疗和X光设备•1004医疗用辅助器具、设备和用品•1005奶嘴,奶瓶•1006性用品•1007假肢,假发和家器官•1008矫形矫正用品•1009缝合用材料1001外科、医疗和兽医用仪器、器械、设备,不包括电子、核子、电疗、医疗用X光设备、器械及仪器外科用剪100007,医用针100008,缝合针100009,热气医疗装置100011,医用热气颤振器100012,医用导管100015,护理器械100016,牲畜助产器100027,外科手术刀100029,外科用小手术刀100030,外科手术探针100033,医用插管100042,冲洗体腔装置100044,阉割钳100049,外科仪器和器械100054,医生用器械箱100055,麻醉仪器100057,外科手术剪100058,压迫机(外科用)100060,医用滴管100061,割鸡眼刀100062,健美按摩设备100063,外科用刀100065,医用恒温箱100067,刮舌器100070,柳叶刀(外科用)100077,注射针管100080,医用引流管100081,医用探针100085,医用泵100086,验血仪器100087,医用滴瓶100089,医用钳100090,胃镜100093,血球计100095,皮下注射器100097,吸入器100099,医用注射针筒100100,泌尿科器械及器具100102,吹入器100103,医用灌肠器100104,医用灯100108,医用蒸发器100109,麻醉面罩100112,按摩器械100113,医疗器械和仪器100114,敷药用器具100115,医疗器械箱100116,外科医生用镜100118,助产器械100120,检眼计100122,检眼镜100123,兽医用喂丸器100127,血压计100129,医用石英灯100130,复苏器100135,人工呼吸器100138,人工呼吸设备100139,子宫注射器100142,阴道冲洗器100143,听诊器100144,耳聋治疗设备100147,手术台100150,医用穿刺套管针100151,尿道探针100153,尿道注射器100154,火罐100155,兽医用器械和工具100156,振动按摩器100158,医用气雾剂分配器100160,医用注射器100164,医用体育活动器械100176,早产婴儿保育箱100177,刷体腔用毛刷100178,医疗分析仪器100180,医用测试仪100180,医用薰蒸设备100182,肺活量计(医疗器械)100197,医用体温计100198,针灸针100199,医用诊断设备100201,心脏起搏器100203,医用电击去心脏纤颤器100211,透析器100212,医用导丝100213,医用牵引仪器100215,下体冲洗袋100218,显微皮肤磨削仪100220,医用身体康复仪100221,脉博计100222,医用支架100223,医用示温标签100225,治疗痤疮用装置100228,医用内窥镜摄像头100231,脑起搏器 100235,植入型皮下给药装置 100236,可生物降解的骨固定植入物 100237,医用压舌板100238,吸鼻器 100239,人工呼吸用呼吸面罩100242,医用细菌鉴定分析仪100244,医用DNA及RNA测试设备100245,医用干细胞再生设备100246,体脂监测仪100247,人体成分监测仪100248※止血缝合器械C100001,耳鼻喉科器械C100002,眼科器械C100003,已杀菌消毒的医疗器械C100004,输精器C100005,输血器C100006注:1.医疗器械和仪器与1002,1003商品类似;2.医用熏蒸设备与1109非医用熏蒸设备,蒸脸器具(蒸汽浴)类似;3.外科医生和医生用器械箱,医疗器械箱,外科医生和医生用箱与0501轻便药箱(已装药的),急救箱(备好药的)类似;4.兽医用器械和工具与0810兽医用刀类似;5.医用诊断设备与1003商品类似。
医疗器械分类目录讲解 ppt课件

CONTENTS
01
医疗器械 目录概述
02
新旧分类 目录区别
03
新版目录 结构介绍
04
新版实施 过渡政策
2
一、医疗器械目录概述
1、《医疗器械分类目录》到底是什么? 2、《医疗器械分类目录》有什么用?
3、《医疗器械分类目录》编写依据?谁负责编写?更新发布?
4、《医疗器械分类目录》修订原因?
3
一、医疗器械目录概述
1、分类目录是什么 /gyx02302/flml.htm(2002版分类目录地址)
4
一、医疗器械目录概述
1、分类目录是什么
补充说明:旧版和新版分类目录均不包含6840体外诊断试剂,体外诊断试剂分 类参照2013年发布的《体外诊断试剂分类子目录》。新版继续沿用6840代码。
11
三、新版目录结构介绍
《新版分类目录》由“22个分类目录”与“编制说明”共同组成,每一个分 类目录包含四大部分。
第一部分:范围 讲述本目录主要包含产品类别,并罗列类别名称。 第二部分:框架结构 a.一级、二级目录产品类别数量及品名案例数。 b.新目录与2002/2012版对应关系。 第三部分:其他说明 针对产品管理类别升降情况进行补充说明。 第四部分:目录内容 详细目录内容。
类界定文件中有关体外诊断试剂的分类界定意见进行判定,分类编码继续延用6840。
13
四、新版实施过渡政策
(三) 新《分类目录》不包括组合包类产品,组合包类产品的类别应当依据《医疗器械分类规则》(国 家食品药品监督管理总局令第15号)、5号令、30号令等相关规定进行判定。
(四)《关于发布第一类医疗器械产品目录的通告》(国家食品药品监督管理总局通告2014年第8号)、 《食品药品监管总局办公厅关于实施第一类医疗器械备案有关事项的通知》(食药监办械管〔2014〕 174号)和2014年5月30日以后发布的医疗器械分类界定文件中有关第一类医疗器械产品的分类界定意 见继续有效。自2018年8月1日起,上述文件规定的产品管理类别与新《分类目录》不一致的,以新《分
新医疗器械分类目录(旧分类对应新分类)

新医疗器械分类目录(旧分类对应新分类) 新分类码对应旧分类码的产品类别如下:6801-2:基础外科用刀;6801-3:基础外科用剪;6801-4:基础外科用钳;6801-5:基础外科用镊、夹;6801-1:医用缝合针(不带线);6801-6:基础外科用针、钩;6801-7:基础外科用其他器械中的皮肤刮匙、皮肤组织钻孔器、皮肤刮划测检器、皮肤检查尺、开口器;6802-1:显微外科用刀、凿;6802-2:显微外科用剪;6802-3:显微外科用钳;6802-4:显微外科用镊、夹;6802-5:显微外科用针、钩;6802-6:显微外科用其他器械中的显微合拢器;6803-1:神经外科脑内用刀;6803-2:神经外科脑内用钳;6803-3:神经外科脑内用镊;6803-4:神经外科脑内用钩、刮中的脑膜钩、脑膜拉钩、神经钩、神经和心血管经根拉钩、交感神经钩;6803-4:神经外科脑内用钩、刮中的脑刮匙、脑垂体刮匙;6803-5:神经外科脑内用其他器械中的脑膜剥离器、后颅凹牵开器、脑压板、手摇颅骨钻、脑吸引器;6804-1:眼科手术用刀;6804-2:眼科手术用剪;6804-3:眼科手术用钳;6804-4:眼科手术用镊、夹;6804-5:眼科手术用钩、针;6804-6:眼科手术用其他器械中的眼用板铲、开睑器、玻璃体切割器;6805-1:耳鼻喉科用刀、凿;6805-2:耳鼻喉科用剪;6805-3:耳鼻喉科用钳;6805-4:耳鼻喉科用镊、夹;6805-5:耳鼻喉科用针、钩;6805-6:耳鼻喉科用其他器械中的耳单头(双头)刮匙、乳突牵开器、扁桃体吸引管、乳突吸引管;6806-6:口腔用其他器械中的测量器、口镜(2002版)。
以上是新分类码对应旧分类码的产品类别。
下面是新分类码对应旧分类码的产品类别:基础外科用刀、剪、钳、镊和夹;医用缝合针(不带线);基础外科用针、钩;基础外科用其他器械中的皮肤刮匙、皮肤组织钻孔器、皮肤刮划测检器、皮肤检查尺和开口器;显微外科用刀、凿、剪、钳、镊和夹;显微外科用针和钩;显微外科用其他器械中的显微合拢器;神经外科脑内用刀、钳和镊;神经外科脑内用钩、刮中的脑膜钩、脑膜拉钩、神经钩、神经和心血管经根拉钩、交感神经钩、脑刮匙和脑垂体刮匙;神经外科脑内用其他器械中的脑膜剥离器、后颅凹牵开器、脑压板、手摇颅骨钻和脑吸引器;眼科手术用刀、剪、钳、镊、夹、钩和针;眼科手术用其他器械中的眼用板铲、开睑器和玻璃体切割器;耳鼻喉科用刀、凿、剪、钳、镊和夹;耳鼻喉科用针和钩;耳鼻喉科用其他器械中的耳单头(双头)刮匙、乳突牵开器、扁桃体吸引管和乳突吸引管;口腔用其他器械中的测量器和口镜(2002版)。
完整版)医疗器械分类目录(分类)

完整版)医疗器械分类目录(分类)医疗器械分类目录》是根据《医疗器械监督管理条例》及《医疗器械分类规则》(第15号局长令)制定的。
该目录与《医疗器械分类规则》相辅相成,用于指导新产品的注册类别。
我国采用的是分类规则指导下的目录分类制度,制定分类目录的原则是从严掌握,参照国际通行的分类,并基于使用风险。
执行分类目录是必要的。
2医疗器械分类目录的具体分类医疗器械分类目录包括了40个类别,涵盖了基础外科手术器械、眼科手术器械、口腔科手术器械、烧伤(整形)科手术器械、临床检验分析仪器、医用化验和基础设备器具、口腔科设备及器具、病房护理设备及器具、消毒和灭菌设备及器具、医用冷疗、低温、冷藏设备及器具等。
该目录的分类方法以风险为基础,考虑了医疗器械的使用环境、使用对象和使用目的等因素,为医疗器械的管理和监督提供了有力的依据。
3医疗器械分类目录的作用医疗器械分类目录是医疗器械监管部门对医疗器械进行分类管理和监督的基础。
它规定了医疗器械的分类方法和标准,为医疗器械的注册、备案、生产、销售、进口和使用提供了明确的依据。
同时,该目录还为医疗机构和医疗器械生产企业提供了参考,帮助他们更好地了解和掌握医疗器械的分类和管理要求,从而提高医疗器械的质量和安全水平,保障人民群众的健康和生命安全。
颅内钻、颅内锯、颅内凿、颅内吸引Ⅰ器、颅内电凝刀、颅内各种刀片、钻头、锯片等神经外科用剪神经剪、神经组织剪、神经剪刀、神经Ⅰ剪钳神经外科用钳神经钳、神经夹、神经钳针、神经钳镊、Ⅰ神经钳夹神经外科用镊、夹神经镊、神经镊钳、神经镊夹、神经组Ⅰ织夹神经外科用针、钩神经针、神经钩、神经镊针、神经夹针、Ⅰ神经针夹神经外科用其他器械神经钻、神经电凝刀、神经电切刀、神经Ⅰ吸引器、神经电极、神经电刺激器等肿瘤摘除钳、脑组织咬除钳和其他神经外科手术器械在医学领域中扮演着重要的角色。
这些器械包括银夹钳、U型夹钳、动脉瘤夹钳、神经外科脑内用镊、钩、刮、脑膜镊、垂体瘤镊、肿瘤夹持镊、脑膜钩、脑膜拉钩、神经钩、神经根拉钩、交感神经钩、脑刮匙和脑垂体刮匙等。
医疗器械分类目录2017年版与旧版对照表
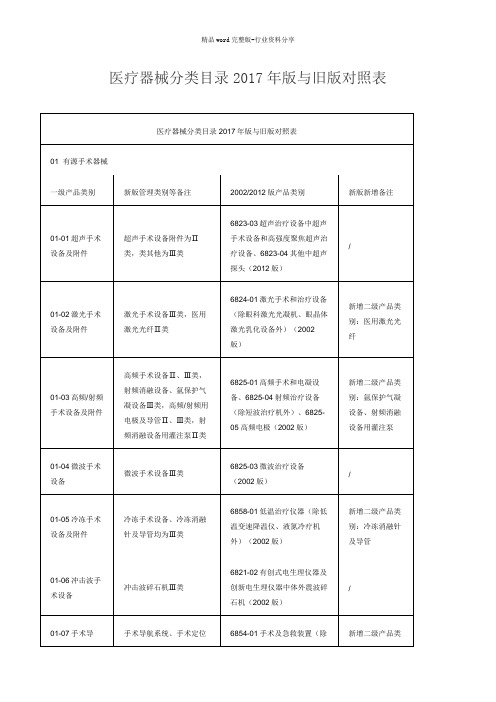
06-02 X射线计算机体层摄影设备(CT)
Ⅲ类
6830-3 X射线计算机体层摄影设备(2012版)
/
06-03 X射线发生、限束装置
Ⅱ类
6831-1医用X射线发生装置(2012版)
/
06-04 X射线影像接收处理装置
Ⅰ、Ⅱ类
6831-2医用X射线影像接收装置(2012版)
6820-1体温计、血压计(2002版),6821有创式电生理仪器及创新电生理仪器、心电诊断仪器、脑电诊断仪器、肌电诊断仪器、无创监护仪器、血流量、容量测定装置、电子压力测定装置-电子血压脉搏仪、生理研究实验仪器(2002版)
/
07-04监护设备
Ⅱ、Ⅲ类
6821-13电子压力测定装置-动态血压监护仪(2002版)
大部分产品为Ⅰ、Ⅱ类,其中心肌活检钳、心内膜心肌活检钳,银夹(术后不取出),一次性使用无菌心房打洞器、无菌主动脉打孔器、无菌血管打洞器、无菌血管打孔器为Ⅲ类。
6803神经外科手术器械、6807胸腔心血管外科手术器械
/
03-13神经和心血管手术器械-心血管介入器械
除球囊扩充压力泵、球囊扩张充压装置、球囊充压装置、球囊加压装置Ⅱ类,其余均为Ⅲ类介入类产品
/
08-05呼吸、麻醉、急救设备辅助装置
大部分产品为Ⅰ、Ⅱ类,其中麻醉蒸发器、蒸发器、麻醉气体输送装置为Ⅲ类。
6805-6耳鼻喉科用其他器械中的麻醉咽喉镜,6823-3超声治疗设备中的超声雾化器,6826-5理疗康复仪器中的防打鼾器(正压呼吸治疗机),6854-3呼吸麻醉设备及附件中的碱石灰,6854-7呼吸设备配件中的浮标式、墙式、手提式氧气吸入器,6866-5呼吸麻醉或通气用气管插管(2002版)
总局2017年医疗器械分类

附件医疗器械分类目录2017年8月目录01有源手术器械 (1)02无源手术器械 (6)03神经和心血管手术器械 (16)04骨科手术器械 (23)05放射治疗器械 (33)06医用成像器械 (37)07医用诊察和监护器械 (48)08呼吸、麻醉和急救器械 (56)09物理治疗器械 (62)10输血、透析和体外循环器械 (70)11医疗器械消毒灭菌器械 (76)12有源植入器械 (79)13无源植入器械 (82)14注输、护理和防护器械 (89)15患者承载器械 (103)16眼科器械 (106)17口腔科器械 (117)18妇产科、辅助生殖和避孕器械 (129)19医用康复器械 (137)20中医器械 (140)21医用软件 (144)22临床检验器械 (148)编制说明 (155)01 有源手术器械说明一、范围本子目录包括以手术治疗为目的与有源相关的医疗器械,包括超声、激光、高频/射频、微波、冷冻、冲击波、手术导航及控制系统、手术照明设备、内窥镜手术用有源设备等医疗器械。
二、框架结构本子目录按照产品预期用途和专业技术及功能特点进行层级排序,共划分为10个一级产品类别,在一级产品类别的基础上根据先设备后附件的形式设立二级产品类别共25个,列举120个品名举例。
本子目录包括2002版医疗器械分类目录中《6821医用电子仪器设备》《6822医用光学器具仪器及内窥镜设备》《6824医用激光仪器设备》《6825医用高频仪器设备》《6854手术室急救室诊疗室设备及器具》《6858医用冷疗低温冷藏设备及器具》和《〈6816烧伤(整形)科手术器械〉(部分)》,还包括了2012版医疗器械分类目录中《〈6823医用超声仪器及有关设备〉(部分)》。
该子目录中一级产品类别与2002/2012版分类目录产品类别的对应关系如下:三、其他说明(一)医用激光光纤与激光治疗仪配套应用,传输激光器产生的能量,用于激光手术治疗。
依据《关于一次性前列腺治疗套件等产品分类界定的通知》(国食药监械〔2008〕587号)和《国家食品药品监督管理局关于超声肿瘤治疗系统等17个产品分类界定的通知》(国食药监械〔2012〕36号)分类界定文件规定管理类别为二类,分类编码6824。
医疗器械PPT讲解(ppt文档)

《医疗器械产品注册管理办法》第二条规定:“进入 中国市场的任何一种医疗器械产品,须由产品生产者 或其委托代理人向中国政府医疗器械行政监督管理部 门提出产品注册申请。”第十三条规定:“未经注册 或未取得注册证件的医疗器械产品,不得进入市场, 不得进行广告宣传及展销活动。”
各国医疗器械法规—中国
FDA检查 FDA检查的主要项目:医疗器械注册审批、生产许可、生产监
医疗器械分类
医疗器械分类
产品分类决定了法规管理的范围,详见《联邦法典》 第21章(21CFR)862—892部份。
分类系统/风险分类
分类器械
风险
I类: 一般控制
低
II类: 一般控制和特殊控制
中
III类:一般控制和上市前批准
高
医疗器械分类
分类: I类是指:通过常规管理足以保证其安全性、有效
医疗器械法规
---监督管理
AML-AT-QS 2007/12/28
本课程目的
让各位了解
2017版《医疗器械分类目录》管理类别变化在这里!

2017版《医疗器械分类目录》管理类别变化在这里!国家局于2017年9月4日发布的《医疗器械分类目录》相比2002年发布的《医疗器械分类目录》进行了相当大的改动,下面就是根据2017版《医疗器械分类目录》而进行整理的目录内有发生产品类别变化的产品!降类产品清单一、三类降级成二类产品1、射频消融设备用灌注泵,由第三类降为第二类2、胃肠X射线检查用品中的胃肠道造影显像剂,由第三类降为第二类;3、胃肠超声显像粉,由第三类降为第二类;4、放射性核素扫描装置,由第三类降为第二类;5、内窥镜气囊控制器,由第三类降为第二类6、碘液保护帽,由第三类降为第二类;7、用于从人体组织获取标本进行活检,一次性使用的一次性使用活检针,其由第三类降为第二类8、接触胸腔、腹腔、脑室、腰椎、体内创面或体表真皮深层及其以下组织创面的引流导管:由第三类降为第二类9、髂骨穿刺针:由第三类降为第二类;10、用于非慢性创面、接触真皮深层及其以下组织且所含成分不可被人体吸收的的医用敷料:由第三类降为第二类;11、脱敏剂类产品,由第三类降为第二类;12、银汞合金,由第三类降为第二类13、种植体密封材料,由第三类降为第二类;14、牙周塞治剂,由第三类降为第二类;15、洁牙粉,由第三类降为第二类;16、根管扩大液、根管清洗剂,由第三类降为第二类;17、临时冠桥树脂,由第三类降为第二类18、2002版分类目录的“6870-2诊断图象处理软件”中的X射线影像处理系统、核医学成像、医用磁共振成像系统等,统一降为第二类;19、免疫分析设备中“全自动免疫分析仪”,包括“全自动酶联免疫分析仪”、“全自动化学发光免疫分析仪”、“全自动荧光免疫分析仪”由第三类降为第二类;20、微生物鉴定药敏分析仪器、微生物药敏培养监测仪器用于临床培养血液和体液等标本中需氧菌、厌氧菌、真菌和分枝杆菌等,同时用于细菌、真菌和分枝杆菌的药敏检测,由第三类降为第二类二、二类降级成一类产品1、发光二极管(LED)手术照明灯,由第二类降为第一类;2、接触椎间隙的非无菌提供的骨科重复使用手术器械,由第二类降为第一类;3、开口用锥(如手锥),由第二类降为第一类;4、对于在手术操作过程中可能接触中枢神经系统的非无菌提供的骨科用凿、骨科用锉、骨科用铲、脊柱外科定位/导向/测量器械、脊柱外科开孔扩孔器械、脊柱外科神经根探子、脊柱外科植骨块嵌入器、脊柱外科椎弓根钉尾部切断器、脊柱手术通道器械、脊柱外科椎体复位器、骨科剥离保护器、骨科组织保护器具,由第二类降为第一类;5、带有LED光源的医用光学放大器具,由第二类降为第一类;6、在医疗机构中使用,阻隔体液、血液飞溅或泼溅的足部隔离用品、隔离护罩,由第二类降为第一类;7、造口袋(含造口底盘)、造口护理用品、造口底盘、造口栓、防漏膏、造口护肤粉、造口皮肤保护剂等造口护理产品:由第二类降为第一类;8、原2002版分类目录中有明确分类的洁牙工作尖和仅用于打磨、抛光的车针,由第二类降为第一类;9、正畸弹簧,由第二类降为第一类;10、牙托梗,由第二类降为第一类;11、洗板机,由第二类降为第一类。
医疗器械分类目录
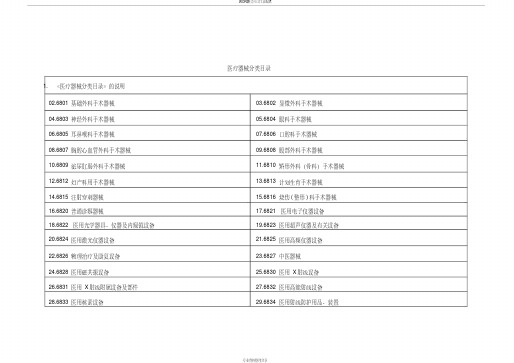
医疗器械分类目录1.《医疗器械分类目录》的说明02.6801基础外科手术器械03.6802 显微外科手术器械04.6803神经外科手术器械05.6804 眼科手术器械06.6805耳鼻喉科手术器械07.6806 口腔科手术器械08.6807胸腔心血管外科手术器械09.6808 腹部外科手术器械10.6809泌尿肛肠外科手术器械11.6810 矫形外科(骨科)手术器械12.6812妇产科用手术器械13.6813 计划生育手术器械14.6815注射穿刺器械15.6816 烧伤(整形)科手术器械16.6820普通诊察器械17.6821 医用电子仪器设备18.6822医用光学器具、仪器及内窥镜设备19.6823 医用超声仪器及有关设备20.6824医用激光仪器设备21.6825 医用高频仪器设备22.6826物理治疗及康复设备23.6827 中医器械24.6828医用磁共振设备25.6830 医用X射线设备26.6831医用X射线附属设备及部件27.6832 医用高能射线设备28.6833医用核素设备29.6834 医用射线防护用品、装置30.6840临床检验分析仪器31.6841 医用化验和基础设备器具32.6845体外循环及血液处理设备33.6846 植入材料和人工器官34.6854手术室、急救室、诊疗室设备及器具35.6855 口腔科设备及器具36.6856病房护理设备及器具37.6857 消毒和灭菌设备及器具38.6858医用冷疗、低温、冷藏设备及器具39.6863 口腔科材料40.6864医用卫生材料及敷料41.6865 医用缝合材料及粘合剂42.6866医用高分子材料及制品43.6870 软件44.6877介入器材关于指定《医疗器械分类目录》的说明一、《医疗器械分类目录》制定的依据《医疗器械监督管理条例》及《医疗器械分类规则》(第15号局长令)。
二、《医疗器械分类目录》与《医疗器械分类规则》的关系《医疗器械分类规则》用于指导《医疗器械分类目录》的制定和确定新的产品注册类别。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
