结晶
化工结晶过程原理及应用

化工结晶过程原理及应用化工结晶是指物质由溶液或熔融状态转变为晶体状态的过程。
结晶过程在化工生产中具有广泛的应用,可以用于分离纯化物质、提纯产品、制备晶体材料等。
本文将从结晶原理、结晶过程和结晶应用三个方面来介绍化工结晶的相关知识。
一、结晶原理。
结晶是物质由无序状态向有序状态转变的过程,其原理主要包括溶解度、过饱和度和结晶核形成三个方面。
1. 溶解度。
溶解度是指在一定温度下,单位溶剂中最多能溶解的溶质的量。
当溶质的实际溶解度小于其饱和溶解度时,溶液处于不稳定状态,有结晶的倾向。
因此,通过控制温度、压力和溶剂浓度等因素,可以促使溶质从溶液中结晶出来。
2. 过饱和度。
过饱和度是指溶液中溶质的实际浓度超过了饱和浓度的程度。
当溶液处于过饱和状态时,溶质会以晶体的形式析出。
过饱和度是结晶过程中重要的物理参数,对结晶速率和晶体形态有重要影响。
3. 结晶核形成。
结晶核是晶体生长的起始点,是溶质分子在溶液中聚集形成的微小团簇。
结晶核的形成是结晶过程中的关键步骤,其数量和大小对晶体的形态和纯度有重要影响。
二、结晶过程。
结晶过程主要包括溶解、过饱和、核形成和晶体生长四个阶段。
1. 溶解。
在结晶过程开始之前,溶质先要从固体状态或其他溶剂中溶解到溶剂中形成溶液。
溶解是结晶过程中的起始阶段,也是影响结晶质量的重要环节。
2. 过饱和。
当溶液中的溶质浓度超过了饱和浓度时,溶液处于过饱和状态。
过饱和度越大,结晶核的形成速率越快,晶体生长速度也越快。
3. 核形成。
过饱和状态下,溶质分子聚集形成结晶核,是结晶过程中的关键步骤。
结晶核的形成需要克服表面张力和核形成能的影响,对结晶质量和产率有重要影响。
4. 晶体生长。
结晶核形成后,晶体开始在溶液中生长。
晶体生长的速率和方向受溶液中溶质浓度、温度、搅拌速度等因素的影响。
三、结晶应用。
结晶在化工生产中有着广泛的应用,包括分离纯化、提纯产品、制备晶体材料等方面。
1. 分离纯化。
结晶可以用于将混合物中的不同成分分离,提高产品的纯度。
结晶原理的说明

结晶原理的说明结晶是一种物质从溶液或气体中形成具有有序排列的结晶体的过程。
在化学、地质、材料科学和生物学等领域,结晶都是一种重要的现象,常见于矿物、晶体管片、药物、化学品等物质的制备和研究中。
结晶的原理可概括为:过饱和和核晶生长。
过饱和是结晶过程的第一步。
当溶质从溶剂中溶解的过程中,溶液中的浓度会发生变化,当溶液中的浓度超过溶质在该温度下的饱和浓度时,即溶液处于过饱和状态。
此时,溶液中的溶质分子将不再保持均匀分布,并出现明显的聚集现象。
在过饱和状态下,溶液中的溶质分子会随机聚集形成微小颗粒,称之为晶核。
晶核的形成是结晶的起始点,其在溶液中的数量和大小决定了后续的结晶过程。
在浓度较高或条件适宜的情况下,晶核会进一步生长。
生长过程中,溶液中的溶质分子会逐渐加入到已有晶核表面,并排列成有序结构。
晶核周围的溶液分子会逐渐被消耗,使晶核逐渐增大,直到形成稳定的晶体。
结晶的过程是由于溶液中存在的过饱和度差引起的。
过饱和度差是指溶质分子在溶液中的浓度与溶质在溶液中的饱和浓度之间的差异。
当过饱和度差较大时,结晶过程会更容易发生,晶核的数量和生长速度也会增加。
结晶的过程受到多种因素的影响,包括溶液中的浓度、温度、压力、溶剂的选择、溶剂中杂质的存在、搅拌速度等。
这些因素会影响溶质在溶液中的溶解度和晶核生长的速度和形态,进而影响结晶的结果。
结晶是一种重要的分离和纯化技术,在化学工业中广泛应用。
通过控制结晶条件和结晶过程的参数,可以实现对溶质的选择性提纯。
此外,结晶还被用于制备材料,如生长半导体晶体管片和制备纯有机化合物等。
在药物领域,结晶技术也被用于制备药物晶体和改善药物的溶解性。
总之,结晶是一种物质从溶液或气体中形成具有有序排列的结晶体的过程,其基本原理是过饱和和晶核生长。
通过控制结晶条件和调节结晶过程的参数,可以实现对溶质的选择性提纯,并在各个领域得到广泛应用。
结晶的方法有哪些

结晶的方法有哪些
结晶是一种物质从溶液或气体中形成晶体的过程。
以下是一些常见的结晶方法:
1. 蒸发结晶:通过加热溶液使其蒸发,使得溶质浓度增加,从而导致结晶。
2. 冷却结晶:将溶液冷却至较低温度,使溶液中的溶质浓度增加而形成晶体。
3. 深冷结晶:将溶液或熔融物质迅速冷却至极低温度,使溶质分子或离子之间产生有序的排列形成晶体。
4. 沉淀结晶:通过加入反溶剂、改变pH值或温度等条件,使溶液中的溶质发生反应生成不溶的物质而形成沉淀晶体。
5. 冻结结晶:将液体物质迅速冷却并形成固态,从而形成结晶。
6. 溶剂结晶:将溶剂中的溶质蒸发至饱和,然后缓慢冷却或加入催化剂,促使晶体的生成。
7. 微波结晶:利用微波辐射加热溶液,使其蒸发形成结晶。
8. 蒸馏结晶:通过蒸馏提纯后的溶液进行结晶,去除杂质并形成纯净的结晶物。
这些是一些常见的结晶方法,不同的物质和实验条件可能适用不同的结晶方法。
结晶

• 结晶过程中,体系总的自由能变化分为两部 分,即:表面过剩吉布斯自由能(ΔGs)和 体积过剩吉布斯自由能( ΔGv) • 晶核的形成必须满足: ΔG= SΔGs+ VΔGv<0 通常ΔGs>0,阻碍晶核形成; ΔGv<0
ΔGv—形成单位体积晶体的吉布斯自由能变化
临界半径与成核功
• 假定晶核形状为球形,半径为r,则ΔGv= 4/3(πr3 ΔGv);若以σ 代表液固界面的表面 张力,则ΔGs= σ A=4 πr2 σ; • 因此,在恒温、恒压条件下,形成一个半径 为r 的晶核,其总吉布斯自由能的变化为: ΔG=4 πr2(σ+(r/3) ΔGv)
结
晶
结晶:结晶是指固体物质以晶体状态从溶液、 蒸汽或熔融物中析出的过程。熔融结晶和溶 液结晶。 结晶在化工过程中的应用: 1.大宗的无机盐:糖、盐、硝酸铵、尿素等。 糖+盐>100兆吨,化肥 > 1兆吨 2.冶金和材料工业中,结晶也是关键单元操 作。 3.医药等精细化学品。 在高新技术领域中的应用越来越广,如蛋白 质、纳米粒子和超纯材料的制造。
间接换热釜式结晶器 (a)、(b)为内循环式; (c)为外循环式
溶液结晶的类型
• 部分溶剂蒸发法(等温结晶法)
适用于溶解度随温度降低变化不大的体系, 或随温度升高溶解度降低的体系; 方法:
加压、减压或常压蒸馏 例如: 氯化钾、硫酸镁等溶液
溶液结晶的类型
• 真空蒸发冷却法
使溶剂在真空下迅速蒸发,并结合绝热冷 却,是结合冷却和部分溶剂蒸发两种方法的一 种结晶方法。
的几何规律排列,各质点间有力的作用,它是晶体
结构中的键。 • 由于键的存在,质点得以维持在固定的平衡位置上, 彼此保持一定距离,形成空间晶格。
结晶操作方法

结晶操作方法
结晶操作方法是一种常见的化学实验技术,主要用于从溶液中分离出固体晶体物质。
其基本原理是利用物质在不同温度下的溶解度差异,通过逐渐降低溶液中的溶质浓度,使溶质逐渐过饱和,从而使其结晶成固体。
以下是一些常见的结晶操作方法:
1. 循环结晶法:将溶液倒入结晶皿中,用热水浴使其逐渐升温并搅拌,直至完全溶解。
然后逐渐降温至室温,使溶液逐渐达到过饱和状态,结晶出固体晶体物质。
这种方法适用于溶解度难以预测或高温易分解的物质。
2. 慢降温结晶法:用热水浴将溶液加热至完全溶解,然后将它缓慢冷却至室温,使其逐渐过饱和。
这种方法适用于溶解度较低、易溶解和稳定的物质。
3. 蒸发结晶法:将溶液倒入浅平底皿中,在低温下慢慢蒸发,使其逐渐过饱和结晶。
这种方法适用于溶解度较低的物质。
4. 溶剂结晶法:在溶液中加入一定比例的另一种溶剂,使其逐渐过饱和结晶。
这种方法适用于有机物和无机物的结晶。
总之,选择合适的结晶操作方法可以提高结晶的产率和纯度,从而更好地满足实验需要。
- 1 -。
结晶的意思

结晶的意思词目:结晶拼音:jié jīng释义:1.物质从液态(溶液或熔融状态)或气态构成晶体。
2.晶体,即为原子、离子或分子按一定的空间次序排序而构成的液态。
也叫做结晶体。
3.比喻稀有的成果。
比如:劳动的结晶。
1) 优质是奉献的堆积,效益是优质的结晶。
2) 科学知识就是贵重宝石的结晶,文化就是宝石释出的光泽。
3) 劳动是一首永恒的赞歌。
你看万里长城葛洲坝高速公路立交桥一座座高楼通讯设备交通工具服务功能智能化运作等等,都是劳动人民的勤劳汗水与智慧结晶。
4) 法律就是社会习俗和思想的结晶。
5) 人来到世界上,本来就是赤条条。
于是我们不必担心什么,放弃是一种你我都有的权利。
懂得放弃是人生的大智慧,适时的放弃是自知与明智的美丽结晶。
有选择有放弃,这才是完美的人生。
6) 这条铁路的完工就是中西合璧的结晶。
7) 知识是从劳动中得来的,任何成就都是刻苦劳动的结晶。
宋庆龄8) 对付敌人必须充分发挥主观能动性,必须‘牵牛’‘宰牛’,不要‘顶牛’。
因为‘顶牛’就是消耗战,就是不精明的战术。
假若和敌人牛返角,最多也不过就是把敌人击退而已。
而战术的全部结晶就是为了歼灭敌人的有生力量。
9) 书是和人类一起成长起来的,一切震撼智慧的学说,一切打动心灵的热情都在书里结晶成形;在书本中记述了人类狂激生活的宏大规模的自白,记述了叫做世界史的宏伟的自传。
10) 科学知识从勤奋劳动中单单的,任何成就都就是勤奋劳动的结晶。
11) 什么是幸福?幸福是果园里果农望着压满枝头果实的满脸喜色,幸福是教室里莘莘学子憧憬未来的动人笑脸,幸福是实验室里科学家又有新发现时的舒展眉头,幸福是领奖台上运动员仰望国旗冉冉升起时的莹莹泪光。
幸福是奋斗的结晶,勤劳的丰碑。
12) 诚信就是一颗稀有的钻石,就是人与自然之美的结晶。
诚信不好过一支玫瑰,在花园之中,她就是最帅的,美得妍媚欲滴;美得冷人心潮;美得高尚;美得完美无瑕。
存有了诚信之后,人与自然的美不足以彰显了!13) 伟大的作品并非能力的表现,而是毅力的结晶。
结晶过程三个基本过程

结晶的种类和操作步骤介绍如下:
1.从定义上出发,结晶通常是指溶质从溶液中析出然后形成的晶体的一个过程。
2.结晶的种类有两种:冷却热饱和溶液法和蒸发溶剂法。
3.冷却热饱和溶液法的操作方法:
在较高温度时,使溶液达到饱和状态,这样在温度降低后,因为物质的溶解度下降,溶液中会析出这种物质的晶体。
4.蒸发溶剂法的操作方法:
蒸发往往是将溶剂加热到较高温度,此时,溶解度随温度变化不大的物质随着溶剂的减少,则可逐渐析出晶体。
扩展资料:
1.蒸发溶剂法适用于”溶解度随温度没有明显变化的”的物质。
2.冷却热饱和溶液法适用于“用来结晶溶质随温度的变化其溶解度变化较明显”的物质。
结晶名词解释

结晶名词解释
结晶[jiéjīng]
[释义] 1.物质从液态或气态形成晶体2.比喻珍贵的成果
结晶是汉语词汇,拼音是jié jīng,意思是热的饱和溶液冷却后溶质因溶解度降低导致溶液过饱和,从而溶质以晶体的形式析出的过程。
中文名结晶外文名crystallization拼音jié jīng繁体結晶注音ㄐㄧㄝˊ ㄐㄧㄥ
释义
1.物质从液态(溶液或熔融状态)或气态形成晶体。
2.晶体,即原子、离子或分子按一定的空间次序排列而形成的固体。
也叫结晶体。
一般由纯物质生成,具有固定的熔点,旋光度。
3.比喻珍贵的成果。
例如:劳动的结晶。
4.游戏道具
出处
艾青《给乌兰诺娃》诗:“不是天上的仙女,却是人间的女神,比梦更美,比幻想更动人--是劳动创造的结晶。
”
王朝闻《艺术创作有特殊规律》:“这是形象思维方法的卓越成就,是想像与思考的结晶。
”。
结晶
10) 如果其他条件相同,试比较下列铸造条件下铸件晶粒的大小: < (1) 金属型与砂型浇注 < (2) 变质处理与不变质处理 < < (3) 铸成薄件与厚件 (4) 浇注时振动与不振动
夹杂物:与基体要求成分和组织都不相同多余颗粒,外来夹杂物有浇铸中冲 入的其它固体物,如耐火材料、破碎铸模物等。
成分偏析:在多组元材料中,不同位置材料的成分不均匀叫做偏析。按其区 域分为宏观偏析(不同区域的成分不同)和微观偏析(各区域平均成分相同, 在微观位置如一个晶粒的内部或更小的范围看成分有差别)。
晶体
结晶时的过冷现象
各种纯金属如Fe、Cu等都有一定的结晶温度。Fe: 1539℃,Cu:1083℃等等,这是指理论结晶温度,也叫平衡 结晶温度,是指液体的结晶速度与晶体的熔化速度相等时的温 度。
实际上的结晶温度总是低于 这ห้องสมุดไป่ตู้平衡结晶温度,原因在
结晶的能量条件上。
金属的结晶过程用热分析方法测定,具体做法: 先将纯金属加热熔化为液体,然后缓慢冷却下来,同时每隔一定 时间测一次温度,并把记录的数据绘在温度-时间坐标中,得到温度 与时间的曲线,即:冷却曲线。
二、共价晶体 定义: 原子间以共价键相结合而形成的空间网状结构的晶体。 性质:熔沸点高,硬度大,难溶于一般溶剂。
常见的共价晶体:金刚石,硅、锗、锡的同素异构体或化合物
金刚石的结构
Si2O的结构
三、结晶型高分子聚合物
第四节 金属的结晶 结晶过程的宏观现象 凝固: 液体 --> 固体(晶体 或 非晶体) 结晶: 液体 --> 晶体 液体
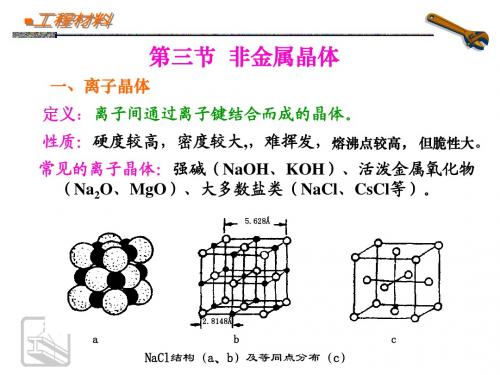
第三节 非金属晶体
一、离子晶体
定义: 离子间通过离子键结合而成的晶体。 性质:硬度较高,密度较大,,难挥发,熔沸点较高, 但脆性大。 常见的离子晶体:强碱(NaOH、KOH)、活泼金属氧化物 (Na2O、MgO)、大多数盐类(NaCl、CsCl等)。
结晶现象的原理与发生步骤

3、结晶的步骤
4盐析法 在溶液中,添加另一种物质使原溶质的溶解度降低,形成过饱和溶液 而析出结晶.加入的物质可以是能与原溶媒互溶的另一种溶媒或另一种 溶质. 5抗溶剂法 通过加入能降低溶解度的抗溶剂,如碳酸钠的抗溶剂结晶,在此结晶 体系中,乙二醇、一缩二乙二醇或者1,2-丙二醇等可加入其水溶液中,以 降低溶解度,产生过饱和度.
结晶现象的原理与方法
目录
1 结晶与晶体 2 结晶的基本原理 3 结晶的步骤 4 结晶过程影响因素分析
1、结晶与晶体
1、结晶与晶体
结晶是指固体物质以晶体状态从溶液、蒸汽或熔融物中析出的过程. 晶体是指内部结构中质点元素〔原子、离子、分子作三维有序规则排 列排列的固态物质. 晶体可分为三大晶族,七大晶系如下: 高级晶族:立方晶系<等轴晶系 中级晶族:三方晶系、四方晶系、六方晶系 低级晶族:正交晶系<斜方晶系、单斜晶系、三斜晶系.
2、结晶的基本原理
介稳区
不稳区 过渡区 亚稳区
稳定区
1—饱和曲线;2—第一过饱和曲线; 3—第二过饱和曲线
A稳定区:即不饱和区.其浓度≦ 平衡浓度,在这里不可能发生结晶.
B亚稳区:即第一过饱和区.在此 区域内不会自发成核,当加入晶种时,结 晶会生长,但不会产生新晶核.
C过渡区:即第二过饱和区.在此 区域内也不会自发成核,但加入晶种后, 在结晶生长的同时会有新晶核产生.
4、结晶过程影响因素分析
〔4冷却〔蒸发速度的影响 在实际生产中,通过真空绝热蒸发冷却是使溶液产生过饱和度的重要手 段之一.冷却速度快,过饱和度增大就快,容易超越介稳区极限,到达不稳 定区时将析出大量晶核,影响结晶粒度.因些,结晶操作过程的冷却速度 不宜太快. 〔5杂质的影响 物料中杂质的存在对晶体的生长有很大的影响,应该尽量去除杂质,以提 高产品质量.
化学生产中结晶的原理

化学生产中结晶的原理在化学生产中,结晶是一种常用的分离和纯化方法。
它通过使溶液中的溶质从溶液中析出,形成固体晶体的过程。
结晶的原理和过程涉及熔融度、溶解度、溶解过饱和度、晶种形成、晶体生长等多个因素。
首先,结晶的原理基于物质的熔融度。
在晶体中,分子、原子或离子按照一定的有序排列,形成规则的晶体结构。
当溶液中的温度降低到物质的熔融度以下时,溶质的分子运动速度减慢,可以逐渐排列成固体的晶体。
其次,结晶的原理还涉及溶解度和溶解过饱和度。
溶解度指的是在一定温度和压力下,溶剂中可以溶解的最大溶质量。
当溶液中的溶质浓度达到饱和状态时,再加入溶质就不能完全溶解,形成了过饱和溶液。
溶解过饱和度是实际浓度与饱和浓度之间的差异。
在溶液的过饱和状态下,当触发结晶的条件出现时,溶质会从溶液中析出,逐渐形成晶体。
另外,结晶过程中的晶种形成也是重要的原理。
晶种是指在过饱和溶液中首先形成的晶体,它可以作为新晶体形成的起始点。
晶种的形成可以通过多种方式实现,例如通过添加适量的杂质、加大过饱和度或通过物理方法如撞击晶体等。
在结晶过程中,晶体的生长也是至关重要的原理。
晶体的生长是在过饱和溶液中晶体表面上新晶体的增长。
它分为表面扩散和体积扩散两种方式。
表面扩散是指溶质从溶液中附着到晶体表面,并在晶体表面上扩散,然后沿晶体的生长方向逐渐积聚成新的晶体。
体积扩散是指溶质通过晶体内部空隙进入晶体内部,然后在晶体内部沿着晶体的生长方向逐渐形成新的晶体。
总结来说,结晶是利用物质的熔融度、溶解度和溶解过饱和度等原理,通过控制温度、浓度、晶种形成和晶体生长等因素,使溶质从溶液中析出,产生固体晶体的分离和纯化过程。
这给化学生产提供了一种重要的方法,可用于从溶液中分离纯化有机物、金属盐等物质,也可用于制备晶体纯度高、晶体形状良好的材料。
结晶的工艺流程

结晶的工艺流程
《结晶工艺流程》
结晶是一种将溶质从溶液中以晶体形式析出的工艺。
结晶工艺被广泛应用于化工、制药、食品等领域,以获得纯度高的晶体产品。
下面是一般的结晶工艺流程。
首先,原料的准备是结晶工艺的第一步。
通常需要将原料溶解在适当的溶剂中,以形成溶液。
溶剂的选择很重要,通常要避免使用过于挥发的溶剂,以免对结晶过程产生影响。
其次,溶液的净化是结晶工艺流程中的关键环节。
这一步主要是通过过滤或其他净化方法,去除溶液中的杂质,以确保结晶过程中可以形成纯净的晶体。
然后,控制结晶过程中的温度和其他操作条件也十分重要。
通过逐步冷却或添加合适的结晶剂,可以引导溶质从溶液中析出并形成晶体。
此外,搅拌也是影响结晶质量的重要因素。
最后,分离和干燥是结晶工艺的最后一步。
通过过滤或离心等分离方法,可以将形成的晶体从溶液中分离出来。
随后,经过适当的干燥处理,最终可以得到高纯度的晶体产品。
总的来说,结晶工艺是一种通过控制溶液中溶质的溶解度和温度等条件,将溶质以晶体形式析出的工艺。
经过适当的原料准备、净化、控制条件和分离干燥等步骤,最终可以获得高纯度的晶体产品。
化学结晶方法

化学结晶方法化学结晶是一种常见的化学方法,用于纯化和分离物质。
在许多领域,如药物生产、化学工业、天然产物的提取和纯化等方面,化学结晶都具有重要的应用价值。
以下是关于化学结晶的十条方法及其详细描述。
1. 溶剂结晶法溶剂结晶法是一种常用的结晶方法。
它利用溶液中的溶剂逐渐挥发,使物质分子之间的相互作用增强,最终形成晶体。
溶剂的选择是非常重要的,因为它会影响到晶体的质量和产率。
控制结晶条件也很关键,如温度、压力、搅拌速率等。
2. 熔融结晶法熔融结晶法是一种将纯化后的化合物熔化后,再进行晶体生长的方法。
此方法适用于高熔点固体,例如自然产物。
结晶的过程包括先融化化合物,然后逐渐降温,晶体开始生长。
在生长过程中,物质分子通过相互作用逐渐排列形成晶体。
3. 水合物结晶法水合物结晶法是利用水分子和化合物分子形成的结晶体。
水合物结晶常用于发掘新型分子结构或固体溶剂结晶。
水合物结晶法包括普通结晶法和溶剂结晶法等多种方法。
其关键在于充分利用水分子与化合物分子间的相互作用。
4. 水合度结晶法水合度结晶法利用化合物与水分子间的相互作用,控制晶体溶解度以产生纯度较高的晶体。
此方法可用于降低固体样品的含水量,从而提高纯度。
在苛刻的条件下,可获得不含任何水分子的极纯化合物。
5. 溶液沉淀法溶液沉淀法将化合物在溶液中加入适量的沉淀剂,利用溶液中的盐和水的反应生成化合物沉淀。
此法适用于需要分离纯化化合物的情况,如蛋白质和其他生物分子的分离纯化。
注意,沉淀剂的选择和配比对产物质量和产率有重要的影响。
6. 真空蒸馏结晶法真空蒸馏结晶法是将含有溶液的容器加热,使容器内部温度达到结晶温度。
通过蒸馏器将溶剂抽出,使化合物逐渐结晶。
该方法适用于高沸点的有机材料。
其关键是通过调节真空度和加热速率,控制晶体生长速度,以获得高质量的晶体。
7. 气氛控制结晶法气氛控制结晶法对晶体质量和产品产率有重要的影响。
将化合物溶解在溶液中,加入溶剂,然后通过控制反应气氛和盐度,使化合物结晶。
晶体结晶的基本过程

晶体结晶的基本过程
晶体结晶是物质从溶液、熔融状态或气体中由有序排列的原子、分子或离子形成的固体结构的过程。
以下是晶体结晶的基本过程:溶解或融化:结晶的起点通常是物质的溶液或熔融状态。
在溶液中,物质的分子或离子与溶剂分子相互作用,形成溶解态。
在熔融状态下,物质的分子或离子在高温下保持自由运动。
饱和:当溶液中溶质的浓度达到一定限度时,称为饱和状态。
在这个状态下,溶液无法再溶解更多的溶质,产生了一个饱和溶液。
过饱和或过冷:在某些情况下,可以通过提高溶液的浓度或降低温度来产生过饱和状态或过冷状态。
这种状态下,实际上存在比正常饱和溶液更多的溶质。
核心形成:在过饱和或过冷状态下,物质开始形成微小的结晶核心。
这些核心是由一小部分溶质聚集而成。
结晶生长:一旦形成核心,结晶就会继续在溶液中生长。
溶质从溶液中沉积到结晶核心上,逐渐形成完整的晶体结构。
晶体形态:结晶的形态取决于物质的种类、结晶条件和结晶速率等因素。
晶体可以呈现出各种各样的形状,包括立方体、六方柱、菱形等。
结晶结束:当溶液中的溶质耗尽或其他条件发生变化时,结晶过程结束。
此时,形成的晶体可以从溶液中或熔融物质中分离出来。
这是一个基本的晶体结晶过程的概述。
在具体情况下,结晶的过程可能受到多种因素的影响,包括温度、压力、溶剂选择等。
结晶的操作方法步骤

结晶的操作方法步骤
结晶是一种常见的分离纯化技术,下面是结晶的基本操作方法步骤:
1. 准备纯净的溶剂:选择适当的溶剂以使要结晶的物质在其中可以溶解。
确保溶剂没有杂质,可能会干扰结晶的形成。
2. 加热溶解物:将要结晶的物质加入到溶剂中,并用加热器加热,使其完全溶解。
加热可以提高溶解度,但需要注意不要加热过量,以免溶液过度饱和。
3. 降温:缓慢地降低溶液的温度,使溶液逐渐超过饱和度。
可以使用温度控制器或冷却设备来控制温度。
此过程可以通过让溶液自然冷却或用冷却器辅助进行。
4. 诱导结晶:在溶液中加入结晶的种子或用搅拌棒等物理方式来诱导结晶的形成。
种子作为晶核引导溶液中的分子进行有序排列,从而加速结晶过程。
5. 结晶:随着溶液的降温,溶质逐渐从过饱和度状态转变为结晶状态。
结晶在溶液中慢慢生长,形成晶体。
晶体的纯度可以通过适当的晶体生长条件进行优化。
6. 分离和收集晶体:使用过滤器、离心机或其它分离方法,将晶体与母液分离开来。
可以用纯溶剂将残留在晶体上的母液洗净,以进一步提高晶体的纯度。
7. 干燥晶体:将分离的晶体转移到干燥器或在室温下风化,除去残留的溶剂,
使晶体完全干燥。
值得注意的是,结晶操作的细节可能会因溶质的特性,溶剂的选择和实验条件的不同而有所调整。
确保操作温度、时间和容器的干净以及其它因素对结晶结果的影响应该在操作过程中仔细考虑和控制。
结晶的介绍

指数j、l和b是受操作条件影响的常数。结晶过程中,总成核速率 B0即单位时间单位容积溶液中新生核数目,可表达为 B0=B1+B2 在某些情况下上式可简化为
三、晶体生长
在过饱和溶液中有晶核形成后,以过饱和度为推动力,溶质 分子或离子继续一层层排列上去而形成晶粒,这种晶核长大的现 象称为晶体生长。常用较为简单的传质理论来描述晶体生长过程。
对应于一个结点的若干个质点 间组合,称为结构基元,这些 基元按空间点阵排列就构成了 晶体结构.
4.晶体结构的描述 ①密堆积方法:对于球体的堆积模型,要求球体间相互作 最紧密的堆积 • ②空间填充多面体方法:晶体结构也可看作是由各种形式 的配位多面体共用顶点、边和面相互联结而形成的一种三维 体系,或者说晶体结构可以用按一定规则填充的配位多面体 来描述.
结晶动力学
晶核形成模式大体分为两类:(1)初级成核,又分为均 相成核和非均相成核;(2)二次成核,又分为流体剪应力、 磨损和接触成核。在工业结晶过程中,一般控制二次成核为 晶核主要来源。只有在超徽粒制造中,才依靠初级成核过程 爆发成核。晶核的大小粗估为纳米至数十微米的数量级。 1. 初级成核 初级均相成核发生于无晶体或任何外来微粒存在的条 件下。在高度过饱和溶液中,大量溶质单元(原子、分子 聚和逐出溶剂分子都需要能量,也就是控制成核 动力学的能量势垒。 Kelvin方程描述了临界晶核粒度与溶液过饱和度之间的 关系:
主要内容
结晶机理和动力学
晶体构造理论 结晶过程与设备
结晶机理和动力学
• 为什么能形成结晶?
结晶过程
溶质从溶液中结晶的推动力是一种浓度差,称为溶液的过饱和度。结晶 过程经历两个步骤:首先要产生微观的晶粒(晶核)作为结晶的核心,产生晶 核的过程称为成核。然后是晶核长大,成为宏观的晶体,该过程称为晶体生 长。 熔融结晶是根据待分离物质之间的凝固点不同而实现物质结晶分离的过 程,推动力是过冷度。熔融结晶有不同的操作模式:一种是在冷却表面上沉 析出结晶层固体,另一种是在熔融体中析出处于悬浮状态的晶体粒子。熔融 结晶主要应用于有机物的分离提纯。 相平衡与溶解度(已学) 任何固体物质与其溶液相接触时,如溶液尚未饱和,则固体溶解,如溶液 过饱和,则逾量部分迟早将会析出,但如溶液恰好达到饱和,则溶解与析 出的速率相等,达到平衡,可用固体在溶液中的溶解度来表示,常用溶解 度对温度所标绘的曲线来表示。
结晶的方法

结晶的方法
1、蒸发结晶
加热蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出,叫蒸发结晶。
例如:当NaCl和 KNO3的混合物中NaCl多而KNO3少时,即可采用此法,先分离出NaCl,再分离出KNO3。
2、降温结晶
先加热溶液,蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出,叫降温结晶。
例如:当NaCl和KNO3的混合物中KNO3多而NaCl少时,即可采用此法,先分离出KNO3,再分离出NaCl。
3、重结晶
重结晶是将物质溶于溶剂或熔融后,又重新从溶液或熔融体中结晶的过程。
重结晶可以使不纯净的物质获得纯化,或使混合在一起的物质彼此分离。
利用重结晶可提纯固体物质。
某些金属或合金重结晶后可使晶粒细化,或改变晶体结晶,从而改变其性能。
结晶溶剂的选择
1、溶剂对欲结晶的成分热时溶解度大,冷时溶解度小,差别越大越好;
2、溶剂对杂质在冷、热时均溶或者不溶;
3、溶剂不与欲结晶成分发生化学反应;
4、溶剂的沸点不宜过高或过低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
习题
1.沉淀和结晶的异同点? 2.结晶的首要条件是什么?制备过饱和溶液的 方法? 3.影响结晶颗粒大小均匀的主要因素有哪些?
(二)晶体形状
同种物质用不同方法结晶时,得到的晶体形 状可以完全不一样。 外形变化是由于在一个方向生长受阻,或在 另一方向生长加速所致。 影响因素:
过饱和度、搅拌、温度、pH;
从不同溶剂中结晶得到不同的外形;
杂质:杂质可吸附在晶体表面,使其生长速 度受阻
(三)晶体纯度
晶体常会包含母液、尘埃和气泡等,所以结 晶器要清洁,结晶液应过滤以防止夹带灰尘、 铁锈等;
沉淀和结晶(晶体)的异同点 相同:在本质上同属一种过程(固相析出)
区别:
构成单位(原子、离子或 分子)的排列方式不同 晶体:有规则 无定形沉淀:无规则
条件缓慢变化时,溶质分子有足够时间排列, 有利于结晶形成; 条件变化剧烈,强迫快速析出,溶质分子来不 及排列就析出,形成无定形沉淀。
分 离 效 果
结晶法:高度的选择性(原因:只有同类分子
理论曲线 实际曲线 成 核 速 度
过饱和度
晶体生长速度和所需晶体大小
(2)温度
成核速度 温度 成 核 速 度
过饱和度
温度与过饱和度 相互消长速度
温度
(3)溶质种类 无机盐类: 阳离子或阴离子的化合价越低,越不容易成核 相同化合价下,含结晶水越多,越不容易成核 有机物质: 结构越复杂,相对分子质量越大,成核速度越慢
晶体表面有一定的物理吸附能力,因此有很 多母液和杂质——表面杂质可通过洗涤除去。 结晶速度过大时(过饱和度较高、冷却速度 很快),容易形成晶簇,包含母液等杂质。 重结晶
(四)重结晶 将晶体用合适的溶剂溶解,再次结晶,使纯 度提高。 原因:杂质和结晶物质在不同溶剂和不同温 度下的溶解度不同。 重结晶的关键:选择一种合适的溶剂
几种方法合并使用。
盐析和冷却并用;冷却和化学反应并用;结合 等电点
(二)晶核的形成 晶核:过饱和溶液中最先析出的微小颗粒, 是以后结晶的中心。 成核速度:单位时间内在单位体积溶液中生 成的新晶核数目。是决定晶体产品粒度分布的 首要因素。 1.成核速度的影响因素:
溶液的过饱和度、温度、溶质种类
(1)过饱和度
> 晶体生长速度
得到的晶体较细小
2.温度 快速冷却:达到较高的过饱和度,晶体细小 且常导致生成针状晶(容易散热); 缓慢冷却:粗大的晶体
温度温得到较细晶体
3.搅拌 搅拌能加快成核速度,提高晶体长大的速度。
搅拌达到一定程度后,再加快搅拌效果不显著; 晶体还会被打碎 搅拌越快,晶体越细 4.晶种 加入晶种能诱导结晶,而且能控制晶体的形 状、大小和均匀度
4.pH 等电点附近
5.温度 低温下结晶: ① 不容易变性失活 ② 使溶质溶解度降低,有利于溶质的饱和 ③ 避免细菌繁殖
温度:0-20 oC 富含有机溶剂的结晶体系:更低的温度 温度过低: 黏度增大结晶变慢—低温析出结晶后适当升温
6.时间 生物大分子(蛋白质): 相对分子质量大、立体结构复杂,结晶过程困 难,分子的有序排列消耗能量大,晶核生长和晶 体长大都比较缓慢,从不饱和到饱和的调节过程 需缓慢进行。 需要一定的结晶时间 生物大分子的结晶时间差别很大,少则以时计, 多则以月计。
结晶的过程 影响结晶析出的条件 结晶的一般方法
提高晶体质量的方法
一、结晶的过程
将溶质放入溶剂中 固体的溶解:溶质分子扩散进入液体内部 溶质的沉积:溶质分子从液体中扩散到固 体表面进行沉积 溶液未饱和:溶解速度 > 沉积速度 溶液饱和:溶解速度 = 沉积速度,平衡 达到饱和度:溶解速度 < 沉积速度, 可能析出晶体
2. 晶核的诱导 加晶种能诱导结晶 晶种可以是同种物质或相同晶形的物质,有时惰 性的无定形物质也可作为结晶的中心,如尘埃。 添加晶种诱导晶核形成的方法: (1)有现成晶体:取少量研碎,加溶剂,离心去 除大颗粒,稀释,悬浮液中有小晶核,倒入待结晶 溶液,搅拌,放置一段时间
(2)无现成晶体: ① 取1-2滴待结晶溶液置于表面玻璃皿上,缓 慢蒸发除去溶液,可得少量晶体 ② 取少量溶液置于试管中,旋转试管,使溶液 在管壁上形成薄膜,溶剂蒸发,冷却试管,管壁 上可形成一层结晶。 刮下结晶,蘸取少量接种到待结晶溶液,搅拌
抗溶剂的特点:极易溶解在原溶液的溶剂中
盐析结晶法:用固体氯化钠作为抗溶剂使溶液 中的溶质尽可能的结晶出来 有机溶剂结晶法:向水溶液中加入一定量的亲水 性的有机溶剂,降低溶质的溶解 度,使其结晶析出 水析结晶法:易溶于有机溶剂的物质,向其溶液 中加入适量水即可析出晶体
5.等电点法
利用某些生物物质具有两性化合物性质—当溶 液pH值调至等电点时溶解度最小,使生物物质从 水溶液中沉淀析出。 6.复合法
制备
1.蒸发法
借蒸发出去部分溶剂的结晶方法。使溶液在 加压、常压或减压下加热,蒸发除去一部分溶 剂,以达到或维持溶液过饱和度。
适于溶解度随温度变化不显著的物质或随温 度升高溶解度降低的物质(例子)。
2.冷却法 基本上不除去溶剂,而是使溶液冷却降温成为 过饱和溶液。 此法适于溶解度随温度降低而显著减小的物质
影响晶体生长的因素:
杂质、搅拌、温度和过饱和度
① 杂质:制止、促进、改变外形
② 搅拌:促进扩散,加速晶体生长、晶核形 成。以试验为基础,确定适宜的搅拌速度 ③ 温度:升高有利于扩散,使结晶速度增快
④ 过饱和度:
增高—使结晶速度增大
增高—引起黏度增加,结晶速度受阻
二、影响结晶析出的主要条件
溶液浓度 样品纯度 晶体形成
三、结晶的一般方法
工 业
除去一部分溶剂:如蒸发浓缩 不除去溶剂,直接加入沉淀剂及降低温度 盐析法
实 验 室
有机溶剂结晶法 等电点结晶法 其他
(一)盐析结晶法
主要用于大分子如蛋白质、酶、多肽等的结晶
原因:不耐热,对pH变化及有机溶剂十分敏感
用中性盐作为沉淀剂,安全、操作简单 加固体盐法
加饱和盐溶液
(三)晶体的生长
晶体生长:在过饱和溶液中已有晶核形成或 加入晶种后,以过饱和度为推动力,晶核或晶 种将长大,这种现象称为-。
晶体生长速度也会影响晶体产品粒度大小。
晶核形成后立即开始生长成晶体,同时新的 晶核还在继续形成
晶核形成速度 > 晶体生长速度:细小晶体,甚至无定形 晶核形成速度 < 晶体生长速度:粗大而均匀晶体
或离子才能排列成晶体)。
沉淀法:浓缩与分离,但所得的沉淀物聚集多
种物质,或含有盐类,或包裹着溶剂。
第五章 结 晶
结晶:液体呈晶态从溶液中析出的过程(有 时把析出的晶体也称为结晶) 晶态:外观形状一定、内部的分子(或原子、 离子)在三维空间进行有规则的排列而产生的 物质存在形态。 结晶有很好的选择性,原因:只有同类分子 或离子才能排列成晶体。
① 溶质在溶剂中的溶解度随温度升高而迅 速增大,冷却时能析出大量结晶; ② 溶质易溶于某一溶剂而难溶于另一溶剂, 且两溶剂互溶——用混合溶剂进行试验。
③ 对色素、降解产物、异构体等杂质有良 好的溶解性; ④ 无毒性或毒性极低、沸点较低便于回收
(五)晶体结块
主要原因:
母液没洗净,温度变化使母液中溶质析出, 使颗粒胶结在一起; 吸湿性强的晶体容易结块。 均匀整齐的颗粒晶体:结块倾向小,结块容 易弄碎; 粒度不均匀的晶体:结块倾向大,结块不容 易弄碎
3.化学反应结晶法 向溶液中加入反应剂,生成一个新的溶解度更 低的物质,当浓度超过它的溶解度时就有结晶析 出。 如:在抗生素的溶液中加入成盐剂(酸、碱或 盐类),使抗生素以盐的形式结晶析出。 NaOH, CH3COOK
4.解析法
向溶液中加入某些物质,使溶质的溶解度降低, 形成过饱和溶液而结晶析出。 抗溶剂或沉淀剂:固体、液体、气体
溶剂
pH
温度
时间
1.溶液浓度 超过饱和浓度 目的物的浓度是结晶的首要条件 浓度高:结晶收率高 浓度过高:分子在溶液中析出的速度太快,超 过形成晶核的速率,得不到晶体,只获得无定形 固体颗粒;杂质浓度增大,易生成纯度差的粉末 结晶。 浓度应根据工艺和具体情况确定
2.样品纯度
结晶是同种物质分子的有序排列,所以杂质是
透析扩散法
(二)有机溶剂结晶法
用于小分子物质的结晶
直接加有机溶剂结晶
利用挥发性溶剂蒸发结晶 (三)等电点结晶法 多用于一些两性物质 (四)其他 温度差法、加入金属离子法
四、提高结晶质量的方法
过饱和度 温度 搅拌速度 晶种
大小 晶体的质量 形状 纯度
(一)晶体大小
1.过饱和度 增加过饱和度一般使结晶速度增大 原因: 过饱和度 成核速度
最先析出的微小颗粒是以后结晶的中心,称 为晶核。 只有达到一定的过饱和度时晶核才存在。
晶核形成并不是结晶的完成,还需要继续扩 散成长为晶体。
过饱和溶液的形成 结晶 晶核的形成 晶体的生长
(一)过饱和溶液的形成
结晶的首要条件是溶液的过饱和。 蒸发法 冷却法 化学反应结晶法 盐析结晶法 等电点法 复合法
障碍。
多数生物大分子需要相当的纯度才能进行结晶 纯度越高,越容易结晶 母液中目的物的纯度接近或超过50%
3.溶剂 生化小分子:水、乙醇、甲醇、丙酮、氯仿 大分子(蛋白质、核酸、酶):(NH4)2SO4, NaCl,磷酸缓冲液、Tris缓冲液、丙酮、乙醇等 混合溶剂 选择溶剂需注意: ①溶剂不能和结晶物质发生化学反应 ②对结晶物质有较高的温度系数 ③杂质有较大的溶解度/结晶物质与杂质有溶 解度的差别 ④对于容易挥发的有机溶剂,操作方便、安全
