新颖的融合蛋白表达系统
二聚化结构域作为融合蛋白表达

二聚化结构域作为融合蛋白表达一、二聚化结构域作为融合蛋白表达的重要性1. 什么是二聚化结构域呢?简单来说,二聚化结构域就像是一把特殊的钥匙,它在蛋白质的世界里有着独特的作用。
蛋白质就像一个个小机器,有着各种各样的功能。
而二聚化结构域呢,能让两个或者多个蛋白质结合在一起,就像拼图的小块拼合起来一样。
这种结合可不是随便玩玩的,它对蛋白质的功能有着很大的影响。
比如说,它可能会改变蛋白质的活性,让原本不太活跃的蛋白质变得活跃起来,就像给一个沉睡的小机器人注入了能量一样。
从结构上来说,二聚化结构域有着自己独特的形状和化学组成。
这些特性决定了它能和哪些蛋白质结合,就像一把钥匙只能开特定的锁一样。
而且,不同的二聚化结构域在不同的生物体内或者不同的细胞环境里,可能会有不同的表现呢。
2. 融合蛋白表达又是什么概念?融合蛋白表达就像是把不同的小零件组合成一个新的大零件。
我们把二聚化结构域和其他的蛋白质部分组合在一起,形成一个新的融合蛋白。
这个过程就像是厨师把不同的食材混合在一起,做出一道新的菜肴。
在细胞这个小厨房里,各种分子就像食材一样,通过特定的机制被组合起来。
融合蛋白表达的好处可多啦。
比如说,我们可以利用二聚化结构域的特性,让融合蛋白更容易被细胞识别和处理。
这就好比给一个包裹贴上了特殊的标签,让快递员(细胞内的运输系统)能更快更准确地把它送到目的地。
3. 二聚化结构域在融合蛋白表达中的作用。
二聚化结构域可以起到稳定融合蛋白的作用。
想象一下,如果融合蛋白是一座小房子,二聚化结构域就像是房子的支柱。
没有支柱,房子可能就会摇摇欲坠。
有了它,融合蛋白在细胞内的环境中就能更稳定地存在,不会轻易被分解或者破坏。
它还能调节融合蛋白的功能。
就像我们前面说的,二聚化结构域可以改变蛋白质的活性。
在融合蛋白里,它同样可以发挥这样的作用。
比如说,它可能会影响融合蛋白与其他分子的相互作用,让融合蛋白能够更好地完成它的使命,不管是传递信号,还是参与细胞内的某种化学反应。
列举常用的蛋白质表达系统并阐述其基本表达策略

常用的蛋白质表达系统及其基本表达策略1. 介绍蛋白质表达系统是在生物技术领域中广泛应用的重要技术,它可以在大量生产目的蛋白质时提供帮助。
在选择蛋白质表达系统时,科研人员通常需要考虑表达效率、纯度、可溶性和最终产物活性等因素。
在本文中,我们将介绍一些常用的蛋白质表达系统,并阐述它们的基本表达策略。
2. 细菌表达系统细菌表达系统是最常用的蛋白质表达系统之一,其中大肠杆菌表达系统是应用最为广泛的。
基本表达策略包括将目的基因插入原核表达载体中,通过大肠杆菌的代谢系统表达目的蛋白质。
在表达前,需要考虑选择适当的启动子、选择合适的宿主菌株以及优化表达条件等因素。
3. 酵母表达系统酵母表达系统通常采用酿酒酵母或毕赤酵母。
基本表达策略包括将目的基因插入酵母表达载体中,通过酵母的翻译后修饰系统表达目的蛋白质。
在表达前,需要考虑选择合适的启动子、选择适当的宿主菌株以及与酵母细胞适应的表达条件等因素。
4. 昆虫细胞表达系统昆虫细胞表达系统常用于大规模生产蛋白质。
基本表达策略包括将目的基因插入昆虫表达载体中,通过昆虫细胞的翻译后修饰系统表达目的蛋白质。
在表达前,需要考虑选择合适的启动子、适当的宿主昆虫细胞系以及适合昆虫细胞生长的表达条件等因素。
5. 哺乳动物细胞表达系统哺乳动物细胞表达系统通常用于生产高度活性的蛋白质。
基本表达策略包括将目的基因插入哺乳动物表达载体中,通过哺乳动物细胞的翻译后修饰系统表达目的蛋白质。
在表达前,需要考虑选择适当的启动子、选择适合的宿主细胞系以及适合哺乳动物细胞生长的表达条件等因素。
6. 植物细胞表达系统植物细胞表达系统是一种新兴的蛋白质表达系统,常用于农业生物技术和药物开发领域。
基本表达策略包括将目的基因插入植物表达载体中,通过植物细胞的翻译后修饰系统表达目的蛋白质。
在表达前,需要考虑选择适当的启动子、适合的宿主植物组织以及适合植物细胞生长的表达条件等因素。
结论在选择蛋白质表达系统时,科研人员需要根据目的蛋白质的性质、表达需求以及实验条件等因素综合考虑,并选择最适合的表达系统和基本表达策略。
细菌的重组蛋白质表达系统

细菌的重组蛋白质表达系统蛋白质是构成生物体及细胞的重要组成部分,也是细胞功能的核心执行者。
为了研究和应用不同类型的蛋白质,科学家发展出了各种蛋白质表达系统。
其中,细菌的重组蛋白质表达系统是最常用的一种方法之一。
本文将详细介绍细菌重组蛋白质表达系统的原理、优势和应用。
一、原理细菌重组蛋白质表达系统利用细菌作为宿主来表达外源蛋白质。
这个系统主要包括以下几个重要组成部分:表达载体、宿主菌株、诱导系统和纯化方法。
1. 表达载体表达载体是指带有外源蛋白质编码序列的质粒。
这些质粒通常包括启动子、反义密码子和终止子等参与蛋白质表达的元件。
其中,启动子通过结合转录因子来启动蛋白质合成的过程。
反义密码子则能够增强蛋白质的长效稳定性,并促进其在细菌中的高效表达。
2. 宿主菌株宿主菌株在蛋白质表达系统中起到重要的作用,通常选择大肠杆菌作为宿主,主要因为大肠杆菌具有较高的生长速度、易于培养和常用的遗传工具。
此外,大肠杆菌本身产生的内切酶活性较低,有利于保护外源蛋白质的稳定性。
3. 诱导系统诱导系统是细菌重组蛋白质表达系统中的一个重要组成部分。
通常使用化学诱导或者温度诱导来启动表达载体中蛋白质编码序列的转录和翻译。
化学诱导通常通过添加一种诱导剂,如异丙基-β-D-硫代半乳糖苷(IPTG),来激活载体中的启动子。
温度诱导则是通过改变培养温度来调节蛋白质表达。
4. 纯化方法纯化是细菌重组蛋白质表达系统中最关键的环节之一。
常用的纯化方法包括亲和纯化、碳水化合物基负载层析和凝胶过滤等。
这些方法能够根据蛋白质的特性和亲和性实现高效纯化。
二、优势与其他蛋白质表达系统相比,细菌重组蛋白质表达系统具有以下优势:1. 高效性细菌重组蛋白质表达系统是目前各种表达系统中最高效的一种方法之一。
通过优化表达条件和使用高效的诱导系统,可以实现高产量的蛋白质表达。
此外,细菌本身的生长速度也有助于高效表达。
2. 便捷性相比其他表达系统,细菌重组蛋白质表达系统的操作更为简便。
融合蛋白表达系统

研究者们在分离到某一基因后,要对其编码蛋白质进行研究最理所当然的工作就是表达,即:有目的性地合成外源基因产物。
在重组 DNA技术的发展早期,人们认为在基因的前面有一个强启动子和一个起始密码子就足以在大肠杆菌中获得很好的表达。
随后,认识到获得有效的翻译所需的条件要复杂得多,除了要有强启动子和起始密码子外,良好的表达尚需编码目的蛋白的mRNA中含有核糖体结合位点,表达水平受密码子喜好程度的影响,也受编码序列中其他目前尚未明了的因素影响。
通过改变起始密码子前端的序列,或者在不改变蛋白质序列的条件下利用密码子的简并性改变5’末端编码序列往往有助于解决问题。
通常,两个基因之间的融合表达能更快地解决这些问题。
在这种方式中,目的基因被引入某个高表达蛋白序列(fusion tag)的3’末端,比如大肠杆菌的一段序列,或者任一可在大肠杆菌中高度表达的基因,它提供良好表达所必需的信号,而表达出的融合蛋白的N末端含有由fusion tag编码的片段。
fusion tag所编码的可能是整个功能蛋白或是其中的部分。
比如6x His Tag、β-半乳糖苷酶融合蛋白和trpE融合蛋白、谷胱甘肽S-转移酶(GST)融合蛋白以及硫氧还蛋白(Trx)融合蛋白等。
由于利用tag选择融合表达是为了简化重组一是fusion tag位于目的蛋白的N端,这时tag帮助提高目的蛋白的表达,缺点是纯化的表达产物中可能会有不完整的目的蛋白,原因是在翻译过程中意外中断的少量(C端)不完整的表达产物会一起被纯化。
另一是fusion tag位于目的蛋白的C端,这可以保证只有完整的表达产物才会被纯化。
当目的蛋白的功能区位于N端时,fusion tag位于C端可能减少对其功能的影响,反之亦然。
进行融合蛋白的表达经常会遇到三个问题,它们是:表达蛋白的溶解性、稳定性和fusion tag的存在。
前两个问题在融合蛋白表达系统和非融合蛋白表达系统都会遇到,而第三个问题是融合蛋白系统所独有的。
蛋白质表达系统介绍不同的蛋白质表达系统及其优缺点

蛋白质表达系统介绍不同的蛋白质表达系统及其优缺点蛋白质表达是生物学研究中一项重要的技术,它可以通过合成蛋白质来研究其结构和功能。
蛋白质表达系统是实现这一过程的关键工具,主要包括原核表达系统和真核表达系统两种。
本文将对这两种蛋白质表达系统进行介绍,并分析它们的优缺点。
一、原核表达系统原核表达系统是利用原核生物(如大肠杆菌)来表达外源蛋白质的系统。
该系统具有以下特点:1. 高表达水平:大肠杆菌是常用的原核表达宿主,具有高表达水平的优势。
通过利用原核细胞的强大蛋白质合成机器,可以获得高产量的外源蛋白质。
2. 易操作性:原核表达系统相对简单,操作步骤少,易于操作和控制。
不需要复杂的细胞培养条件,可以在常见培养基中进行表达。
3. 快速表达:从启动表达到获得蛋白质通常只需要数小时至数天,速度较快。
这使得原核表达系统在高通量表达和快速实验中具有优势。
然而,原核表达系统也存在一些缺点:1. 外源蛋白质折叠问题:由于原核细胞的机器无法正确折叠某些复杂蛋白质,这可能导致外源蛋白质的不正确折叠和失活。
2. 原核特异性翻译后修饰:原核细胞缺乏一些真核细胞所具有的翻译后修饰机制,这可能影响蛋白质的功能和稳定性。
3. 复杂蛋白质表达困难:对于复杂蛋白质(如膜蛋白),原核表达系统通常无法达到理想的表达水平和正确的折叠结构。
二、真核表达系统真核表达系统主要利用真核生物(如酵母、昆虫细胞和哺乳动物细胞)来表达外源蛋白质。
真核表达系统具有以下特点:1. 正确的折叠和修饰:真核细胞具有复杂的蛋白质折叠和修饰机制,能够产生正确折叠和修饰的蛋白质。
2. 适用于复杂蛋白质:真核表达系统适用于复杂蛋白质(如膜蛋白)的表达。
真核细胞提供了正确的环境和细胞器,能够较好地表达这类蛋白质。
3. 适用于大规模表达:真核细胞通常可以进行大规模培养和表达,适用于工业化生产。
然而,真核表达系统也存在一些缺点:1. 低表达水平:相对于原核表达系统,真核表达系统的表达水平较低,可能无法满足高产量蛋白质的需求。
融合型异源蛋白的表达

化学断裂法: 用于蛋白位点专一性化学断裂的最佳试剂为溴化氰(CNBr)
它与多肽链中的甲硫氨酸残基侧链的硫醚基反应,生成溴化亚氨内 酯,后者不稳定,在水的作用下肽键断裂,形成两个多肽降解片段 其中上游肽段的甲硫氨酸残基转化为高丝氨酸残基,而下游肽段N 端的第一位氨基酸残基保持不变。这一方法的优点是回收率高(可 达到85%以上),专一性强,而且所产生的目的蛋白的N端不含甲 硫氨酸,与真核生物细胞中的成熟表达产物较为接近。然而,如果 异源蛋白分子内部含有甲硫氨酸残基,则不能用此方法
大分子量的异源蛋白来说,上述三种氨基酸残基的出现频率是相当高的
融合型异源蛋白的表达
目的蛋白的回收
酶促裂解法:多残基位点 为了克服仅切单一氨基酸残基的蛋白酶所带来的应用局限性,
可在受体蛋白编码序列与不含起始密码子的外源基因之间加装一段 编码寡肽序列(Ile-Glu-Gly-Arg)的人工接头片段,该寡肽为具有 蛋白酶活性的凝血因子Xa的识别和作用序列,其断裂位点在Arg的 C末端。纯化后的融合蛋白用Xa处理,即可获得不含上述寡肽序列 的目的蛋白。由于Xa的识别作用序列由四个氨基酸残基组成,大 多数蛋白质中出现这种寡肽序列的概率极少,因此这种方法可广泛 用于从融合蛋白中回收各种不同大小的目的蛋白产物
融合型异源蛋白的表达
目的蛋白的回收
融合蛋白中受体蛋白部分的存在可能会影响目的蛋白的空 间构象和生物活性,如果将之注入人体还会导致免疫反应,因 此在制备和生产药用目的蛋白时,将融合蛋白中的受体蛋白部 分完整除去是必不可少的工序。融合蛋白的位点专一性断裂方 法有两种:
化学断裂法 酶促裂解法
融合型异源蛋白的表达
融合型异源蛋白的表达
融合型目的蛋白表达系统的构建
蛋白融合表达

蛋白融合表达全文共四篇示例,供读者参考第一篇示例:蛋白融合表达(Protein Fusion Expression)是生物技术领域中一种常用的蛋白表达技术,通过将不同蛋白基因序列进行融合,使其能够在目标宿主细胞中表达出含有多个功能区域的融合蛋白。
蛋白融合表达技术是从基因水平上控制蛋白质的结构和功能,为蛋白质的生物学功能研究、药物研发和生物制药等领域提供了有效的手段。
一、蛋白融合表达的原理蛋白融合表达技术是利用基因工程技术将两个或多个蛋白基因的编码序列连接在一起,形成一个新的融合蛋白基因,然后通过转染或转化等手段将其导入目标宿主细胞中,使其表达出融合蛋白。
蛋白融合表达的基本原理是将两个或多个不同功能的蛋白通过融合技术合并在一起,达到协同作用或增强某一功能的效果。
蛋白融合表达可通过多种途径实现,常见的方法包括直接连接两个蛋白的编码序列、利用核酶切割和PCR等技术进行DNA重组,以及通过载体和质粒等载体介导融合蛋白的表达。
不同的蛋白融合表达技术具有各自的特点和适用范围,选择合适的融合表达策略可提高蛋白表达效率和提取纯度。
1. 生物学功能研究:蛋白融合表达技术可用于研究蛋白质的结构和功能,通过融合不同功能区域的蛋白进行功能分析和蛋白相互作用研究,揭示蛋白质的生物学特性和作用机制。
2. 药物研发:蛋白融合表达技术在药物研发中具有广泛的应用,可用于合成重组蛋白、多肽和抗体等生物制剂,提高药物的活性和稳定性,开发新型药物和治疗方法。
3. 生物制药:蛋白融合表达技术是生物制药领域中最常用的生产方法之一,可用于大规模生产融合蛋白、重组蛋白和生物药物,提高生产效率和产品质量,满足临床需求。
4. 技术创新:蛋白融合表达技术在生物技术领域具有重要的技术意义,可以用于开发新型蛋白表达系统、优化蛋白表达和纯化工艺、改良蛋白结构和功能等方面,推动生物技术的发展和进步。
1. 提高蛋白表达效率:蛋白融合表达技术可以利用多个功能区域相互作用增强蛋白的稳定性和可溶性,提高蛋白的表达水平和纯度。
Cherry标签可视化蛋白表达系统
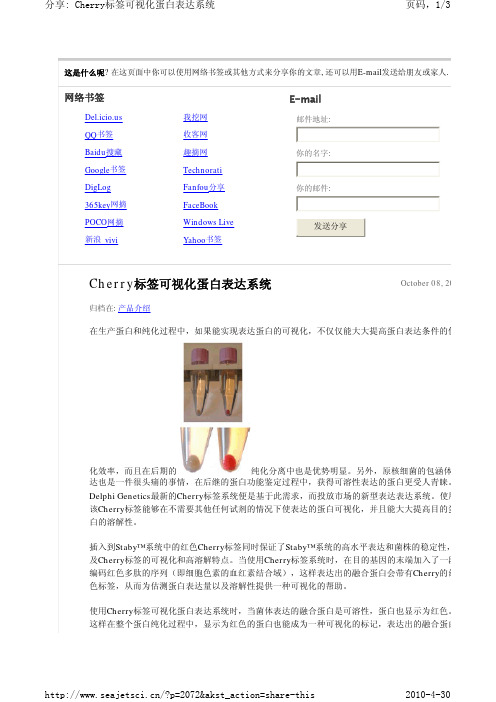
这是什么呢? 在这页面中你可以使用网络书签或其他方式来分享你的文章, 还可以用E-mail 发送给朋友或家人. Cherry 标签可视化蛋白表达系统归档在: 产品介绍 在生产蛋白和纯化过程中,如果能实现表达蛋白的可视化,不仅仅能大大提高蛋白表达条件的优化效率,而且在后期的纯化分离中也是优势明显。
另外,原核细菌的包涵体达也是一件很头痛的事情,在后继的蛋白功能鉴定过程中,获得可溶性表达的蛋白更受人青睐。
Delphi Genetics 最新的Cherry 标签系统便是基于此需求,而投放市场的新型表达表达系统。
使用该Cherry 标签能够在不需要其他任何试剂的情况下使表达的蛋白可视化,并且能大大提高目的蛋白的溶解性。
插入到Staby™系统中的红色Cherry 标签同时保证了Staby™系统的高水平表达和菌株的稳定性,及Cherry 标签的可视化和高溶解特点。
当使用Cherry 标签系统时,在目的基因的末端加入了一段编码红色多肽的序列(即细胞色素的血红素结合域),这样表达出的融合蛋白会带有Cherry 的红色标签,从而为估测蛋白表达量以及溶解性提供一种可视化的帮助。
使用Cherry 标签可视化蛋白表达系统时,当菌体表达的融合蛋白是可溶性,蛋白也显示为红色。
这样在整个蛋白纯化过程中,显示为红色的蛋白也能成为一种可视化的标记,表达出的融合蛋白网络书签我挖网QQ 书签收客网Baidu 搜藏趣摘网Google 书签Technorati DigLogFanfou 分享365key 网摘FaceBook POCO 网摘Windows Live 新浪 vivi Yahoo 书签E-mail 邮件地址: 你的名字: 你的邮件:发送分享October 08, 20的浓度可以通过光谱分析很容易被测定出。
另外,由于Cherry 标签的高溶解性也能提高目的蛋白的溶解性。
纯化后,标签可通过肠激酶被剪切掉。
除此之外,贴附在柱子上的蛋白很容易被观察到,并且也能够看出剩余目的蛋白何时停止流出。
哺乳动物细胞表达系统表达策略

一、概述在生物医学研究领域,哺乳动物细胞表达系统被广泛应用于蛋白质表达、疫苗研发、疾病治疗等多个方面。
然而,由于哺乳动物细胞表达系统的复杂性和不稳定性,研究人员不断探索新的表达策略,以获得更高效、更稳定的表达效果。
本文将就哺乳动物细胞表达系统的表达策略进行探讨,介绍目前常用的表达策略,并分析其优缺点。
二、哺乳动物细胞表达系统常用的表达策略1. 质粒转染法质粒转染法是最常见的哺乳动物细胞表达策略之一。
该方法通过将感兴趣的基因克隆入表达载体,然后转染至哺乳动物细胞中,利用哺乳动物细胞的表达机器来合成蛋白质。
质粒转染法操作简便,成本较低,适用于初步筛选基因表达情况。
2. 病毒载体介导的表达病毒载体介导的表达策略利用改良过的病毒载体携带外源基因,并将其导入哺乳动物细胞,以实现高效表达。
这种表达方式具有高效率和稳定性,适用于大规模基因表达和蛋白质生产。
3. 融合蛋白表达融合蛋白表达是一种常用的策略,通过将目标蛋白与融合标签结合,提高其稳定性和溶解性,使其更容易在哺乳动物细胞中表达和纯化。
4. 基因组集成技术基因组集成技术是近年来出现的一种新策略,通过将外源基因整合到哺乳动物细胞基因组中,实现长期高效的表达。
这种策略可以提高蛋白质表达的稳定性和可控性,适用于需要长期大量表达的研究领域。
5.化学修饰策略化学修饰策略是指通过对基因序列进行合成优化、蛋白质工程、修饰剂添加等手段,改善蛋白质表达效率和稳定性。
这种策略在提高蛋白质溶解性、减少蛋白结构的折叠和聚集等方面具有一定优势。
三、各种表达策略的优缺点分析1. 质粒转染法优缺点优点:操作简便、成本低、适用于常规表达实验缺点:表达水平和稳定性有限,不适用于大规模蛋白质表达和纯化2. 病毒载体介导的表达优缺点优点:高效率、稳定性好、适用于大规模蛋白质生产缺点:病毒安全性、成本较高、用于基础研究时操作复杂3. 融合蛋白表达优缺点优点:提高蛋白质稳定性和溶解性、易于纯化缺点:可能影响蛋白质的生物活性和功能4. 基因组集成技术优缺点优点:长期高效表达、提高表达稳定性和可控性缺点:操作复杂、潜在的遗传毒性5.化学修饰策略优缺点优点:改善蛋白质表达效率和稳定性缺点:操作繁琐、可能影响蛋白质的天然构象和活性四、结论与展望当前,哺乳动物细胞表达系统的表达策略多种多样,各自具有一定的优缺点。
蛋白质融合表达的原理和优点

蛋白质融合表达的原理和优点
蛋白质融合表达是一种利用重组DNA技术将两个或多个不同的基因序列融合在一起,从而产生一个新的蛋白质的表达方式。
这种技术可以用于生产大量的特定蛋白质,具有广泛的应用前景。
该技术的原理是将两个或多个不同基因序列通过PCR扩增、限制性酶切和连接等步骤连接在一起,形成一个新的基因序列。
该基因序列可以在细胞内进行转录和翻译,产生一个新的融合蛋白质。
这种方法可以将两个或多个不同功能的蛋白质结合在一起,形成一个新的具有多种功能的复合物。
该技术具有许多优点。
首先,它可以有效地增加目标蛋白质表达量。
由于许多目标蛋白质无法通过常规表达方式进行高效表达,因此使用融合表达技术可以显着提高目标蛋白质的产量。
其次,该技术可以使目标蛋白质更加稳定和易于纯化。
由于许多目标蛋白质会出现折叠异常或聚集现象,使得其难以纯化和稳定保存。
使用融合表达技术可以将目标蛋白质与其他稳定的蛋白质结合在一起,从而使其更加稳定且易于纯化。
此外,该技术还可以用于产生新的功能蛋白质。
通过将两个或多个不
同的蛋白质结合在一起,可以产生新的具有多种功能的复合物。
这种
方法不仅可以用于基础研究,还可以用于产生具有特定功能的药物或
工业酶。
总之,蛋白质融合表达技术是一种有效、高效且灵活的表达方式。
它
可以用于产生大量目标蛋白质、提高目标蛋白质稳定性和易于纯化性,并产生新的具有多种功能的复合物。
随着该技术在各个领域中的广泛
应用,相信它将为科学研究和工业应用带来更多机会和挑战。
融合蛋白的分离纯化原理

融合蛋白的分离纯化原理融合蛋白是指在外源表达系统中,将感兴趣的蛋白与另一个蛋白(通常具有较好的抗体或标签)融合在一起,以便在后续的蛋白分离和纯化过程中更容易识别和纯化。
以下是由融合蛋白的分离纯化原理所组成的详细解释。
1. 蛋白融合表达系统的构建和优势:融合蛋白的表达系统通常包括重组蛋白的DNA序列,它融合了目标蛋白和另一种中间蛋白(常被称为融合标签)。
通过将DNA序列导入到合适的宿主细胞中,在细胞中进行表达和产生融合蛋白。
融合蛋白具有以下优势:- 提高目标蛋白的产量和稳定性;- 改善目标蛋白的溶解和可溶性;- 方便蛋白纯化和检测。
2. 常见的融合标签:常见的融合标签包括:- 多希(histidine tag):这是最常用的标签,由6个连续的组氨酸残基组成。
利用多希标签可以简便地将融合蛋白通过亲和层析柱进行结合和纯化,例如金属螯合层析;- 谷氨酸蛋白酶切位点(glutathione S-transferase cleavage site, GST tag):GST标签可以用于纯化融合蛋白,它可以通过谷氨酸蛋白酶进行特异性切割,从而分离目标蛋白;- 绿色荧光蛋白(green fluorescent protein, GFP tag):GFP标签可以通过荧光显微镜直接检测融合蛋白,从而评估目标蛋白的表达和定位情况。
3. 整细胞和亲和层析柱的纯化方法:对于融合蛋白的纯化,可以采用整细胞和亲和层析柱的方法。
整细胞的纯化方法是将目标融合蛋白在细胞中产生,并通过裂解细胞膜和核膜释放蛋白。
然后,通过高速离心将裂解物中的纤维蛋白、DNA和RNA沉淀,获得上清液。
接下来,可以通过盐析沉淀、超滤或浓缩来富集目标蛋白。
亲和层析是利用融合蛋白与特定配体的结合来纯化蛋白。
例如,使用多希标签可以通过金属螯合层析柱选择性地结合多希蛋白,并通过改变洗脱缓冲液的组成来分离并收集目标蛋白。
4. 蛋白纯化的后续步骤:蛋白纯化的后续步骤通常包括:- 目标蛋白的浓缩和洗脱:通过离心、超滤或吸附到凝胶等方法去除污染物,从而富集目标蛋白;- 蛋白质的测定和定性:通过比色法、荧光法或质谱等方法确定目标蛋白的含量和纯度;- 蛋白质的保存和储存:通过冻干、冷冻或加入保护剂等方法保持蛋白的活性和稳定性。
融合荧光蛋白表达技术优缺点

融合荧光蛋白表达技术优缺点融合荧光蛋白表达技术是一种常用的生物学技术,它可以将荧光蛋白与其他蛋白质融合在一起,使得这些蛋白质能够发出荧光信号。
这项技术在生物学研究中具有重要的应用价值,但同时也存在一些优缺点。
优点:1. 可视化研究:融合荧光蛋白表达技术可以使研究人员直观地观察和分析细胞、组织或器官中特定蛋白的表达和定位情况,从而为生物学研究提供了重要的工具和手段。
2. 高度灵活性:通过融合荧光蛋白表达技术,研究人员可以将荧光蛋白与不同的蛋白质或细胞结构进行融合,从而实现对不同目标的研究,具有很高的灵活性。
3. 高度敏感性:荧光蛋白具有很高的荧光发射效率和荧光稳定性,可以提供高度敏感的荧光信号,使得研究人员能够观察到微弱的细胞信号或表达水平的变化。
4. 高度可重复性:融合荧光蛋白表达技术是一种可重复性较高的方法,通过标准化的实验操作和条件,可以获得稳定和可靠的结果。
缺点:1. 影响蛋白的功能和结构:融合荧光蛋白可能会改变融合蛋白的结构和功能,从而影响其正常的生物学功能。
因此,在使用该技术时需要谨慎选择融合位点和荧光蛋白的类型,以避免对研究结果产生误导。
2. 有限的颜色选择:目前常用的荧光蛋白主要包括绿色荧光蛋白和红色荧光蛋白,虽然已经有一些新型的荧光蛋白被发现,但颜色选择仍然有限,无法满足部分研究的需求。
3. 无法实时观察:融合荧光蛋白表达技术需要通过显微镜等设备来观察荧光信号,无法实时、连续地观察和记录目标蛋白的表达和定位情况。
4. 高成本和复杂性:融合荧光蛋白表达技术在实验操作和设备要求上都较为复杂,需要一定的实验经验和专业设备,同时也需要投入较高的经费成本。
总结起来,融合荧光蛋白表达技术在生物学研究中具有重要的应用价值,可以提供可视化的研究手段和工具。
然而,我们也要认识到该技术存在一些缺点,如对蛋白功能和结构的影响,有限的颜色选择以及高成本和复杂性等,需要在具体应用中综合考虑其优缺点并合理选择使用。
融合蛋白n端和c端表达

融合蛋白n端和c端表达
融合蛋白N端和C端表达是一种常见的蛋白质工程技术,用于产生具有特定功能或性质的蛋白质。
蛋白N端和C端表达融合可以通过多种方法实现,包括基因重组技术和蛋白质工程技术。
首先,融合蛋白N端和C端表达需要选择合适的宿主系统,常用的包括大肠杆菌、酵母菌和哺乳动物细胞等。
对于大肠杆菌表达系统,可以利用重组DNA技术将目标蛋白N端和C端与适当的表达载体连接,形成融合蛋白基因。
然后将该基因导入宿主菌中,利用菌体内的转录和翻译机制来表达融合蛋白。
其次,融合蛋白N端和C端表达还需要考虑蛋白质的折叠和功能。
在设计融合蛋白时,需要确保N端和C端的连接方式不会影响到蛋白质的结构和功能。
此外,还需要考虑到融合蛋白的纯化和鉴定方法,以确保获得高纯度和活性的融合蛋白。
另外,融合蛋白N端和C端表达的技术也可以应用于蛋白质工程和药物研发领域。
通过融合不同蛋白质的N端和C端,可以产生具有新功能或改良功能的蛋白质,为药物开发和生物技术研究提供了新的可能性。
总的来说,融合蛋白N端和C端表达是一项重要的蛋白质工程技术,通过合理设计和选择合适的表达系统,可以实现对蛋白质结构和功能的精准调控,为生物医药领域的研究和应用提供了有力支持。
融合蛋白连接原则

融合蛋白连接原则1. 引言融合蛋白连接是指将两个或多个不同的蛋白质序列连接在一起,形成一个新的融合蛋白。
融合蛋白连接在生物医学研究、药物开发和生物工程领域有着广泛的应用。
融合蛋白连接的设计和构建需要遵循一定的原则,以确保融合蛋白的稳定性、可溶性和功能。
本文将介绍融合蛋白连接的原则和方法,包括连接位点选择、连接序列设计、连接方式选择以及连接后的蛋白质表达和纯化方法等。
2. 连接位点选择连接位点的选择对于融合蛋白的稳定性和可溶性至关重要。
通常情况下,选择在两个蛋白质序列中间的松弛区域作为连接位点,以避免对两个蛋白质的结构和功能造成不利影响。
连接位点的选择应考虑以下几个因素:•松弛区域:连接位点应选择在两个蛋白质中间的松弛区域,避免对两个蛋白质的结构和功能造成不利影响。
•酶切位点:连接位点的选择还应考虑到酶切位点的位置,以方便后续的蛋白质表达和纯化。
•亲水性:连接位点的选择还应考虑到亲水性的变化,以确保连接后的融合蛋白在水溶液中的稳定性和可溶性。
3. 连接序列设计连接序列是指连接位点之间的氨基酸序列。
连接序列的设计应考虑到以下几个因素:•连接位点的氨基酸残基:连接序列的设计应根据连接位点的氨基酸残基来选择合适的连接序列。
连接序列的氨基酸残基应具有良好的溶解性和稳定性。
•连接序列的长度:连接序列的长度应适中,过短可能导致融合蛋白的稳定性和可溶性下降,过长可能影响蛋白质的折叠和功能。
•连接序列的氨基酸组成:连接序列的氨基酸组成应选择具有良好的溶解性和稳定性的氨基酸。
4. 连接方式选择连接方式是指连接位点之间的化学键的形成方式。
常见的连接方式包括:•肽键连接:通过形成肽键将两个蛋白质连接在一起。
肽键连接是最常用的连接方式,具有较好的稳定性和可溶性。
•二硫键连接:通过形成二硫键将两个蛋白质连接在一起。
二硫键连接具有较好的稳定性,适用于一些较大的蛋白质。
•化学交联:通过化学反应将两个蛋白质连接在一起。
化学交联可以实现更多样化的连接方式,但需要考虑到反应条件和副反应的影响。
融合蛋白

甲状旁腺激素 ( Parathyroid Hormone,PTH)是由甲状旁腺主细胞合成和分泌的一种单链多肽激素,成熟 PTH含84个氨基酸残基,分子量约为9500,是人体内调节钙磷代谢及骨转换的最为重要的激素之一。它主要通过 作用于靶细胞膜上腺苷酸环化酶系统,增加胞浆内cAMP及焦磷酸盐 (PPi)的水平来发挥作用。
融合蛋白的设计大致分为基于重复结构、基于生长因子以及基于细胞粘附分子3类。第1类融合蛋白中最典型 的是来源于弹性蛋白( Elastin-Like Polymers,ELPs)及丝素蛋白( Silk-Like Polymers,SLPs)的融合蛋白。 ELPs是一种由数个重复的氨基酸序列组成的细胞外基质蛋白,由两种短肽段交替排列构成,主要包括VPGZG、 VPGVG、APGVGV、VPGFGCGAG以及VPGG等5种。最著名的当属VPGZG融合蛋白( Z可换为除了脯氨酸外任意氨基酸)。 重复的VPGVG序列能够使融合蛋白具有温敏特性,将温敏性ELP与化学、酶、物理等多种交联方式的水凝胶结合起 来能够衍生出多种应用方式。ELPs主要由甘氨酸、丙氨酸和丝氨酸组成,极易形成反向平行的β -折叠片层结 构,具有多样侧链化学修饰位点,良好的热稳定性和机械性能,在生物医学上常用作手术缝合线,人工皮肤及软 骨修复材料。对于此类融合蛋白,只需通过调节其氨基酸序列和分子链长度,便能够精确控制其对温度、pH、离 子强度的响应敏感性,从而实现可逆的溶解转变。
3、细胞因子重组融合蛋白
细胞因子重组融合蛋白是一类利用基因工程的方法将编码细胞因子和其他有特定功能的蛋白分子基因序列连 接并表达相应蛋白质融合产物。其结构特点为将细胞因子功能活性域与其他分子的活性域融合,各组分可发挥协 同作用,使融合蛋白的生物学活性较各单体大大增强。
全能型酵母双杂交系统和蛋白表达系统

1.4 DUALhybrid 定制筛选服务
DUALsystems 公司除了提供 DUALhybrid 试剂盒外,还提供定制服务。此定制
服务分为两个独立的部分,研究者可以根据自己的需要,可选择其中的一部分或
选择完整的酵母双杂交服务。
Part I:
bai vector
提供用于酵母三杂交的载体。 优势:适用于酵母三杂交检测系统。
4)control plasmids
• pLexA-laminC, pLexA-p53 and pGAD-largeT
优势:降低假阳性,提高筛选的严谨性
5)Yeast
1.5 文献
综述: A novel genetic system to detect protein-protein interactions. Fields and Song Nature. 340, 245-6 (1989)
DUALmembrane系统是DUALsystems公司最独特的具有自主专利的产品系 列。它摆脱了传统酵母双杂交的最大局限性(即只能检测核蛋白之间的相互作 用),成为检测或筛选跨膜蛋白间相互作用强有力的检测技术。它利用分离的泛 素系统(split-ubiquitin)直接检测天然状态下膜蛋白间的相互作用,是目前市 面上唯一可提供检测膜蛋白间相互作用的新基因系统。
优势: -
研究者无需耗时建立酵母双杂交系统; 省略实验摸索的步骤,减少试剂的浪费,和大量的时间消耗; DUALsystems 公司已提供 超过10年的定制服务,经验丰富;
Free: 400 819 7199 Tel:010-52086640 reagent_bj@
酵母双杂交系统和蛋白表达系统
2)1 prey vector
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新颖的融合蛋白表达系统
研究者们在分离到某一基因后,要对其编码蛋白质进行研究最理所当然的工作就是表达——即:有目的性地合成外源基因产物。
在重组DNA技术的发展早期,人们认为在基因的前面有一个强启动子和一个起始密码子就足以在大肠杆菌中获得很好的表达。
随后,认识到获得有效的翻译所需的条件要复杂得多,除了要有强启动子和起始密码子外,良好的表达尚需编码目的蛋白的mRNA中含有核糖体结合位点,表达水平受密码子喜好程度的影响,也受编码序列中其他目前尚未明了的因素影响。
通过改变起始密码子前端的序列,或者在不改变蛋白质序列的条件下利用密码子的简并性改变5’末端编码序列往往有助于解决问题。
通常,两个基因之间的融合表达能更快地解决这些问题。
在这种方式中,目的基因被引入某个高表达蛋白序列(fusion tag)的3’末端,比如大肠杆菌的一段序列,或者任一可在大肠杆菌中高度表达的基因,它提供良好表达所必需的信号,而表达出的融合蛋白的N末端含有由fusion tag编码的片段。
fusion tag所编码的可能是整个功能蛋白或是其中的部分。
比如6x His Tag、β-半乳糖苷酶融合蛋白和trpE融合蛋白、谷胱甘肽S-转移酶(GST)融合蛋白以及硫氧还蛋白(Trx)融合蛋白等。
由于利用tag的特性通常可以对融合蛋白进行亲和层析等分离提纯,更多情况下选择融合表达是为了简化重组蛋白的纯化。
因此出现两种融合表达类型:一是fusion tag位于目的蛋白的N端,这时tag可以提供良好表达所必需的信号,帮助提高目的蛋白的表达,缺点是纯化的表达产物中可能会有不完整的目的蛋白,原因是在翻译过程中意外中断的少量(C端)不完整的表达产物会一起被纯化。
另一是fusion tag位于目的蛋白的C端,这可以保证只有完整的表达产物才会被纯化。
当目的蛋白的功能区位于N端时,fusion tag位于C端可能减少对其功能的影响,反之亦然。
进行融合蛋白的表达经常会遇到三个问题,它们是:表达蛋白的溶解性、稳定性和fusion tag的存在。
前两个问题在融合蛋白表达系统和非融合蛋白表达系统都会遇到,而第三个问题是融合蛋白系统所独有的。
裂解融合蛋白以除去fusion tag
为了对目的蛋白进行生化及功能分析,通常要从目的蛋白上去除fusion tag部分。
早期已建立了数种对融合蛋白进行位点特异性裂解的方法。
化学裂解如溴化氰(Met↓)、BNPS-3-甲
基吲哚(Trp↓)、羟胺(Asn↓Gly)等,不但便宜且有效,往往还可以在变性条件下进行反应。
但由于裂解位点的特异性低和可能对目的蛋白产生的不必要修饰,使该法渐渐被酶解法取代。
酶解的方法相对来说反应条件较温和,更重要的是,普遍用于此用途的蛋白酶都具有高度的特异性。
其中有用的酶有:Xa因子、凝血酶、肠激酶、凝乳酶、胶原酶。
所有这些酶都具有较长的底物识别序列(如在凝乳酶中为7个氨基酸),从而降低了蛋白质中其他无关部位生断裂的可能性。
而酶解法存在成本高(这些蛋白酶价格一般都相当昂贵),反应时间长等问题,更重要的是蛋白酶本身不可避免地会混入目的蛋白中,造成新的污染,提高纯化的复杂性。
IMPACT系统的推出是融合表达系统的一个重大突破。
该系统最大的优点是表达的融合蛋白无需蛋白酶裂解即可实现目的蛋白与fusion tag的精确切割。
IMPACT(Intein Mediated Purification with an Affinity Chitin-binding Tag)系统利用一个来源于枯草杆菌的5kDa大小的几丁质结合域(chitin binding domain,用于亲和纯化)和一个来源于酵母intein蛋白质组成一个双效的fusion tag,再与克隆到多克隆位点的目的基因融合表达。
Intein是一个蛋白质剪接元件,类似于基因组中的内含子intron在RNA的剪接中所起的重要作用,intein在较低的温度和还原条件下发生自身介导的N端裂解,可以释放出与之相连的目的蛋白。
也就是说融合表达产物在挂上亲和层析柱后只需要在低温(4度)条件下用含DTT,或者巯基乙醇,或者半胱氨酸的溶液洗脱,即可将目的蛋白洗脱,而将fusion tag留在纯化柱上。
而还原剂的小分子可以非常简单的去除。
该系统的出现是融合表达系统的重大突破,完全避免了蛋白酶的使用,不但可以有效降低成本,提高效率,也避免了蛋白酶与目的蛋白的分离纯化的麻烦。
随后推出的IMPACT-CN系统提供了两种选择,即fusion tag可以选择在目的蛋白的C端或者N端,使克隆或表达都能满足不同需要。
但是这一系统仍然有一个缺陷,那就是含有较多二硫键的蛋白不适用这一系统,因为还原剂的存在会破坏/影响蛋白的二级结构。
IMPACT—TWIN的推出为我们带来了更大的惊喜。
在多克隆位点的两端各有一段intein 和几丁质结合域的fusion tag,提供了三种选择:1、在克隆时切掉N端的fusion tag 1,插入目的基因,同原来的系统一样,可以在表达产物挂上亲和纯化柱后加入还原剂,将目的蛋白从fusion tag上解离并洗脱下来,得到的目的蛋白C端带有硫酯键,可以直接用于连接一个标记物、非编码氨基酸或者另一个蛋白;2、在克隆时切掉C端的fusion tag 2并插入目的基因,当表达产物挂上亲和纯化柱时只需要改pH值和温度(pH7, 25度)即可将目的蛋白从fusion tag上解离并洗脱下来。
这不但避免了蛋白酶的使用,更重要的是也避免了还原剂对
含丰富二硫键的蛋白二级结构的破坏。
由于调节缓冲液的pH值非常方便且无需另外去除洗脱产物中的还原剂,这大大地简化了目的蛋白的纯化过程,也扩大了该系统的应用范围。
3、可以将目的基因插入两个fusion tag之间,这样表达产物的两端都含有fusion tag,当产物挂上亲和纯化柱并经过两级洗脱后,由于目的蛋白两端分别有一个硫酯键和半胱氨酸,可以自身环化得到环形蛋白。
表达蛋白的可溶性
在大肠杆菌中许多外源蛋白的高水平表达最后都会导致形成包涵体,它是致密的不溶性蛋白和RNA的凝聚体,含有大部分的表达蛋白。
蛋白质沉淀形成包涵体有利的一面是可以利用包涵体的不溶性和致密性,通过超声波破碎、离心就能相对容易地对之进行初级纯化。
此外,以可溶性蛋白形式表达时往往易被降解的蛋白质,以包涵体形式表达时却可以很稳定。
纯化时,可用盐酸胍或尿素变性溶解包涵体中的蛋白质。
透析除去变性剂后,蛋白质可重新折叠复性。
然而这种方法亦有其弊端,经变性/复性后正确折叠的蛋白质的产量不稳定,有时会很低,更有些蛋白尤其是大蛋白基本上不能正确进行重折叠。
当包含体复性后的产量太低,而所需表达的是可溶性蛋白时,有多种解决方法可供尝试。
一个重要的变量就是温度,由于尚未明了的原因,高温(37℃和42℃)会促进包涵体形成,低温(30℃)的抑制其形成;另一个变量是表达水平,有时降低表达水平可增加可溶蛋白比例;第三个变量是携带表达载体的细胞株背景,不同的受体菌株表达出的特定蛋白的可溶性有显著的差异,但各株间究竟是何种遗传差异决定了溶解性的差异仍属未知;最后,值得注意的是,改变fusion tag往往可以影响所表达的融合蛋白的溶解性。
表达蛋白的稳定性
在大肠杆菌中表达外源蛋白,尤其是真核蛋白时,经常会遇到稳定性的问题。
包含体有助于稳定融合蛋白;采用缺失已知蛋白酶的大肠杆菌株作为宿主也是解决的方法之一。
比如,缺失数种胞质蛋白酶的lon htpR双突变株可减少不稳定蛋白质的降解。
与之相似的是,degP 突变株可稳定胞质中的融合蛋白、ompT突变株被证实在蛋白质的粗提过程中能避免一些非融合蛋白中暴露的碱性氨基酸残基之间的肽键发生断裂(如Arg-Arg)。
最后,对于某一特定融合蛋白来说,在不同的野生型实验株内其稳定性亦有差异,可能归因于不同株内蛋白酶的水平不同。
