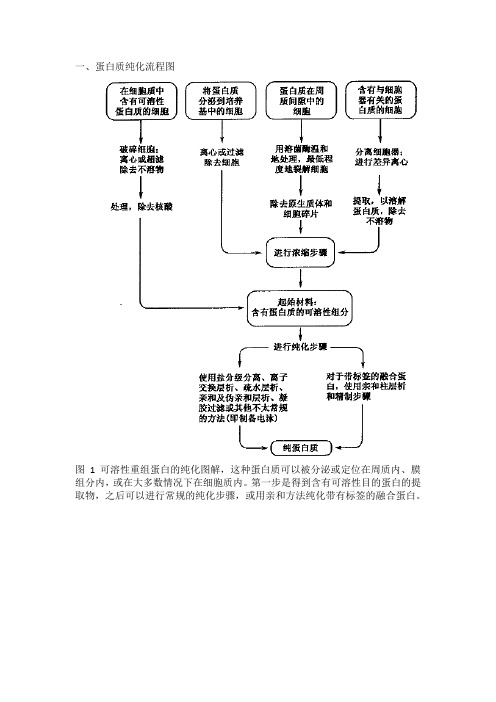
GST融合蛋白构建、表达与纯化
蛋白质表达:带GST标签蛋白的纯化

操作前的考虑
• BugBuster蛋白抽提试剂,以及Benzonase®核酸酶、rLysozyme™溶菌酶等能极大地方便可溶蛋白 及包涵体的制备,从而完全替代机械法操作,尽可能地保全蛋白。
• BugBuster,Benzonase核酸酶,rLysozyme溶菌酶及GST•Bind系统均可与蛋白酶抑制剂兼容。 • GST•Bind纯化系统可以与2-巯基乙醇,二硫苏糖醇以及EDTA等兼容。 • 本手册中的操作均可按实际表达水平和目的蛋白的量适当加以调整,特别是关于“柱层析”部分中的
默克生命科学服务热线:400 820 8872 bioteam@merc这样抽提得到的可溶蛋白溶液可以直接上 样于Novagen的纯化树脂(以及其它很多类似纯化系统)。蛋白溶液 在冰上可以短时存放(2-3小时),也可在-20℃长时间存放直至下步 分析。蛋白抽提液应该根据目的蛋白的活性要求的温度存放,有些蛋 白经冻融会失活。
储存
要求4℃存放的包括:10X GST Bind/Wash Buffer;10X Glutathione Reconstitution Buffer; Glutathione,Reduced,Free Acid;GST•Bind树脂(树脂千万不能冻) 要求-20℃存放的包括:Benzonase核酸酶 常温存放的包括:BugBuster,色谱柱
GST•Bind™ 缓冲液试剂盒
GST•Bind缓冲液试剂盒包括了从GST•Bind树脂和GST•Mag™磁性琼脂糖树脂纯化目的蛋白所需的结 合,冲洗和洗脱所需的缓冲液。试剂盒所含成分足够用于10个2.5ml柱的纯化。具体包括: • 2×100ml 10×GST Bind/Wash Buffer (43mM Na2HPO4,14.7mM KH2PO4,1.37M NaCl,27mM KCl,pH7.3) • 40ml 10×Glutathione Reconstitution Buffer (500mM Tris-HCl,pH8.0) • 1g Glutathione,Reduced,Free Acid
GST融合蛋白表达与纯化
70%(V/V)乙醇
适于水溶液的0.22μm膜
1、在1.5ml的微量离心管中放入1ml表达目的蛋白的大肠杆菌细胞培养物,4℃,最高转速离心2min,收集上清,将其过0.22μm的膜,收入1.5ml的微量离心管中,弃沉淀。
材料(带√的项见附录1)
用含有trp启动子和目的基因的质粒转化的大肠杆菌宿主菌株
√M9最低营养培养基加0.5%(m/V)酪蛋白水解物(Difco公司)
√1000x抗生素贮液
√400x吲哚-3-丙烯酸(IAA)
20ml无菌培养管
150ml摇瓶
37℃定轨摇床
1、从新鲜的琼脂平板上挑取含trp启动子和目的蛋白基因质粒转化的大肠杆菌宿主菌株的单一菌落,接种至含有2ml M9培养基(含0.5%的酪蛋白水解物和适量的抗生素)的20ml培养管,将培养管在定轨摇床上(200rpm)37℃培养过夜。
转化的大肠杆菌宿主菌株
√LB培养基
√1000x抗生素贮液
√20%(V/V)甘油,无菌的
√LB平板
20ml培养管
30℃或37℃定轨摇床
1、从新鲜琼脂平板上挑单菌落,接种2ml LB培养基(补加适当的抗生素;在20ml培养管中),在定轨摇床上培养过夜。对于基于pL的系统,温度为30℃,对于其他系统,温度为37℃。
辅助方案5 细胞外培养基样品的制备
通过分析培养基中的样品能够检查指导目的蛋白细胞外分泌的表达系统。如果培养物中蛋白质浓度很低(如低于100mg/L),可以加入牛血清白蛋白(BSA)作为沉淀的载体和核。
材料
表达目的蛋白的转化大肠杆菌细胞
2g/L BSA(可选;用0.22μm的膜除菌,4℃保存≤1个月)
gst蛋白纯化

GST蛋白纯化简介谷胱甘肽S-转移酶(glutathione S-transferase,GST)是一种常用的亲和标签,用于在分子生物学研究中用于蛋白质纯化和蛋白质亲和结合实验。
GST蛋白被广泛应用于蛋白质结构和功能研究、酶学研究、蛋白质互作研究等领域。
本文将介绍一种常见的方法来纯化GST蛋白,该方法主要包括以下步骤:细胞裂解、亲和层析、洗脱和纯化。
方法细胞裂解首先需要将GST蛋白表达在适当的宿主中,例如大肠杆菌。
在细胞达到适当的生长阶段后,使用合适的方法将细胞裂解,使得目标蛋白释放到溶液中。
一种常用的裂解方法是超声波裂解,通过超声波震荡将细胞破碎。
亲和层析经过细胞裂解后,将得到的细胞裂解液通过亲和层析柱。
亲和层析柱通常使用含有还原型谷胱甘肽(glutathione,GSH)结合物质的树脂,例如glutathione agarose beads。
这种树脂与GST标签结合,使得GST标签的融合蛋白能够特异性地结合于柱子上。
通过洗脱液去除非特异结合蛋白,将目标蛋白纯化。
洗脱洗脱过程是将结合于柱子上的目标蛋白从固定相洗净。
一般采用含有高浓度还原型谷胱甘肽的洗脱液,例如50 mM GSH。
洗脱液中的还原型谷胱甘肽与柱子上的结合物质竞争与GST标签结合,以此达到将GST蛋白洗脱下来。
纯化经过洗脱后,蛋白溶液中的GST蛋白含量较高。
为了进一步提高纯度,可以通过对溶液进行浓缩、去除低分子量杂质、调整溶液pH值等方法进行纯化。
常用的纯化方法包括丙酮沉淀法、离子交换柱层析法等。
注意事项•在实验过程中应严格操作,避免任何可能导致目标蛋白污染的情况发生。
•选择合适的表达宿主,不同的宿主可能会对GST蛋白的表达量和可溶性产生影响。
•在细胞裂解过程中,避免样品受到温度、剧烈振荡等因素的影响。
•注意亲和层析柱的操作方法,避免破损或污染。
•洗脱过程中注意还原型谷胱甘肽浓度和洗脱液的pH 值。
结论GST蛋白纯化是一种常见的蛋白质纯化方法,通过亲和层析技术可以实现对GST蛋白的高效纯化。
GST融合蛋白的纯化

GST融合蛋白的纯化诱导和收集菌体在一定的诱导条件下IPTG诱导蛋白的合成。
18~25℃的低温条件下培养可以使大部分蛋白融合蛋白可溶性表达,并保持较高的活性。
IPTG浓度一般为0.1~1.0mM。
5000rpm 5min离心收集菌体。
亲和层析柱的制备取存放谷胱甘肽琼脂糖的瓶子颠倒数次,使其混匀,取1.5ml混合液加入层析柱中,加10ml 20%乙醇,使琼脂糖在柱中自然沉降。
将20%乙醇流尽后,加10ml PBS清洗柱子,待管中PBS液面刚好没过凝胶时,套上滴口的套子,待用。
每100ml菌液的菌体用4ml PBS(加1%Triton-100、蛋白酶抑制剂)悬浮。
在冰水中超声波破碎细胞(1分钟/次×5次,每次间隔1分钟)。
将裂解液分装至小管,4℃10000rpm离心5分钟。
收集上清液,加DTT至终浓度为1mM。
0.45um过滤后加入亲和层析柱。
室温下使混合液自然通过层析柱,保留0.5ml过滤液做PAGE电泳检测用。
用10ml PBS洗柱子3遍,每次临近结束时收集洗涤液0.5ml测OD值。
配制10mM的还原型谷胱甘肽溶液,即洗脱液3ml(0.009g溶于3ml 50mM Tris-Cl溶液中)。
用洗脱液洗脱GST融合蛋白,每管0.5ml接收洗脱液。
测各管洗脱液蛋白浓度。
PAGE电泳检测纯度。
亲和层析柱的再生:用0.04M NaOH洗10ml×3次,用10ml PBS平衡后,加20%乙醇储存于4度。
或者按照beads使用说明书上的方法再生。
如果洗脱液中的还原型谷胱甘肽对实验有影响时,需用分子筛去除。
如果需要不带标签的蛋白,则蛋白被柱子吸附后,用蛋白酶进行切割;或者用分子筛过滤后,在筛子上进行酶切。
gst纯化蛋白步骤

gst纯化蛋白步骤GST纯化蛋白是一种常用的蛋白质纯化方法,它利用谷胱甘肽硫转移酶(Glutathione S-Transferase,GST)的亲和性,将GST标签蛋白与GST结合亲和树脂进行结合,然后通过洗脱,最终得到纯化的目标蛋白。
下面将为大家介绍GST纯化蛋白的详细步骤。
1.构建重组蛋白表达载体:首先需要在目标蛋白编码基因的N端或C端加上GST标签,通常选择GST-N和GST-C两种方式。
将GST标签与目标蛋白基因连接后,将其插入合适的表达载体中。
2.转化宿主细胞:将构建好的重组表达载体转化到适合的宿主细胞中,常用的宿主细胞有大肠杆菌和酿酒酵母等。
3.表达目标蛋白:宿主细胞在适宜的培养条件下进行培养,使其产生大量重组蛋白。
常见的培养条件包括温度、培养基的选择和添加诱导物等。
4.细胞破碎:培养得到丰富的重组蛋白的细胞后,通过机械或化学方法将细胞破碎。
常用的方法有超声波破碎、高压均质破碎、冻融法和溶菌酶法等。
5.蛋白纯化:将细胞破碎液进行离心分离,去除残余细胞碎片。
接下来,将蛋白样品加入含有GST结合亲和树脂的柱子中,通过亲和吸附,在树脂上富集GST标签蛋白。
6.洗脱纯化蛋白:使用合适的洗脱缓冲液,可以脱离与亲和树脂结合的非特异性结合蛋白,并洗脱纯化的目标蛋白。
一般使用还原性缓冲液,可将目标蛋白从GST结合亲和树脂上彻底洗脱。
7.蛋白质浓缩:通过合适的方法,如超滤、溶液浓缩装置等,使纯化的目标蛋白浓缩到较高浓度。
8.纯化蛋白的分析:对纯化的目标蛋白进行SDS-PAGE凝胶电泳分析,检测其纯度和分子量等指标。
通过上述步骤,可以得到较高纯度的GST标签蛋白。
需要注意的是,在步骤的选择和操作过程中,要根据目标蛋白的特性和所需纯度等要求进行调整,以获得更好的纯化效果。
希望本文对您进行GST纯化蛋白的实验有所帮助。
gst蛋白纯化原理

gst蛋白纯化原理GST蛋白纯化是一种常用的蛋白质纯化技术,其原理是利用谷胱甘肽-S-转移酶(Glutathione-S-transferase,GST)标签与谷胱甘肽的特异性结合来进行纯化。
GST标签可与谷胱甘肽通过二硫键共价亲和,然后通过GSH交换洗脱的原理进行蛋白纯化。
具体步骤如下:1.构建GST标签融合表达载体:将GST基因的编码序列与目标蛋白的编码序列融合,构建GST-目标蛋白融合表达载体。
这样,在细胞中表达该融合蛋白时,GST标签会紧密结合在目标蛋白的C端或N 端。
2.转染和蛋白表达:将构建好的GST-目标蛋白融合表达载体转染到合适的宿主细胞(如大肠杆菌),使其产生大量的融合蛋白。
3.细胞裂解和融合蛋白的亲和层析:收获融合蛋白的细胞,通过细胞裂解等方法破坏细胞膜,释放融合蛋白。
然后,将溶解的细胞提取物加载到含有谷胱甘肽固定在琼脂糖(或其他载体)上的亲和层析柱中。
GST标签可以特异性地与琼脂糖上的谷胱甘肽结合。
4.洗脱:通过洗脱缓冲液来去除非特异性结合的蛋白质,保留GST-目标蛋白复合物。
洗脱通常使用还原剂(如谷胱甘肽)、低pH 或其他方式进行。
5.目标蛋白的解离:将GST标签从目标蛋白上解离,得到纯化的目标蛋白。
这可以通过特定的酶切位点(如蛋白酶TEV切割位点)和相应的酶进行酶切,使GST和目标蛋白分别释放。
6.纯化分析:对纯化的目标蛋白进行分析,如SDS-PAGE凝胶电泳、Western blot等方法,确认目标蛋白的纯度和完整性。
在进行GST蛋白纯化时,对于融合表达载体的设计和构建、宿主细胞的选择、裂解条件和亲和层析条件的优化等方面都需要合理考虑,以获得高质量的纯化目标蛋白。
gst融合蛋白的分离和纯化的原理

gst融合蛋白的分离和纯化的原理
第一步,细胞裂解。
通常使用化学方法、物理方法或超声波等手段将目标蛋白所在的表达系统的细胞破碎,使蛋白从细胞溶液提取出来。
常用的细胞裂解方法有冻融法、超声波法和高压法等。
第二步,亲和层析。
利用GST融合蛋白在蛋白A/G琼脂糖或S-蛋白琼脂糖柱上与谷胱甘肽硫转移酶(GST)结合的特性,将目标蛋白与其他非特异性蛋白分离。
在这一步骤中,首先需要将裂解液与亲和层析树脂(例如:GST树脂)充分混合,使GST融合蛋白与亲和树脂结合;然后通过洗涤步骤,去除非特异性蛋白质的结合;最后,目标蛋白与亲和树脂的结合被破坏,并将其洗脱出来。
第三步,洗脱。
通过改变亲和层析树脂的pH值、离子浓度或添加特定试剂,破坏GST融合蛋白与亲和树脂的结合,实现目标蛋白从树脂上的洗脱。
常用的洗脱方法有酸洗脱、碱洗脱和还原洗脱。
第四步,纯化。
将洗脱的目标蛋白进行进一步的分离和纯化。
通常,还需要使用其他纯化方法,例如离心、电泳、层析等,进一步净化目标蛋白。
总的来说,GST融合蛋白的分离和纯化的原理是通过利用GST融合蛋白与亲和树脂之间的特异性结合,将目标蛋白与非特异性蛋白分离,然后通过改变条件破坏结合并将目标蛋白洗脱,最后进行进一步的纯化步骤,得到纯化后的目标蛋白。
这种方法具有简单、快速、高效的优点,在蛋白质分离和纯化的研究中得到广泛应用。
GST融合蛋白纯化方法

GST融合蛋白纯化方法1目的片段接入pGEX载体;2涂板,挑单克隆,摇菌至OD600≈1.0,加入IPTG(终浓度1 mM)诱导6-8 h;3收菌,每升菌液约以50 mL PBS重悬,加入1%Triton X-100(v/v),1%β-巯基乙醇(v/v),PMSF(终浓度1 mM);以下步骤均在冰上操作:4超声破碎菌体,15000 g,10min离心取上清,在上清中加入适量GST-beads,轻轻晃动令其吸附蛋白1 h;5 2000 g,3min离心弃上清;6加入至少10倍体积PBS,轻摇至beads悬浮于溶液中,2000 g,3 min离心弃上清;7重复步骤6 两次;8加入1 mL GST Elution Buffer,轻摇10 min;92000 g,3 min离心,收集上清;10重复步骤8-9至少两次;11 SDS-PAGE电泳检测蛋白纯度,Bradford法检测蛋白浓度;12将蛋白置于-20℃保存。
P.S. 大量提取前应取少量菌液,改变IPTG浓度,诱导温度,诱导时间等,以确定蛋白表达的最适条Thrombin cleavage(using thrombin produced by Amersham)1. Thrombin cleavage of eluted fusion protein bound to Sepharose* Mix 50 μl of thrombin (< 10 cleavage U/ml) solution and 950 μl of 1 x PBS for each ml of Glutathione Sepharose bed volumeAdd thrombin protease mixture to Glutathione Sepharose pelletGently shake or rotate the suspension at r.t. for 2-16 hCentrifuge the suspension at 500 x g for 5’ to pellet the beads and carefully transfer the eluted fraction to a clean tube.2. Thrombin cleavage of eluted fusion protein.Add 10 μl of thrombin solution (10 cleavage units) per mg fusion protein. If the amount of fusion protein in the eluate has not been determined, add 80 μl (80 U) of thrombin for each ml of Glutathione Sepharose bed volume from with the fusion protein was eluted.Mix gently and incubate at r.t. (22-25C) for 2-16 h.Once digestion is complete, GST can be removed by first removing glutathione by extensive dialysis (2,000 vol/ml) against 1 x PBS followed by batch purification.。
gst融合蛋白的分离和纯化的原理

gst融合蛋白的分离和纯化的原理
GST融合蛋白的分离和纯化,需要借助于Glutathione S-transferase (GST)的技术。
GST是一种宿主细胞的溶酶体蛋白,具有良好的应激和生存能力,可以将它引入宿主细胞中。
GST融合蛋白通常由一个来源编码的蛋白质PBX、一个响应者编码的GST、一个响应者编码的蛋白质或肽段(GST-fusion)、以及一些链接蛋白质(linker)组成。
GST-fusion是由GST和另一个蛋白质结合在一起,其中GST可以作为一种容易分离的标记,从而使细胞内的蛋白质被简单、有效地分离和纯化。
简单来说,GST-fusion蛋白以GST的作用,将某种原有的蛋白质与之融合。
这种融合的蛋白,可以分离出原有的蛋白,只需要在体外添加一些特定的抗体,将GST融合蛋白与GST特异的抗体结合起来即可。
GST-fusion的分离和纯化不需要拆裂复杂的蛋白,只需要添加特定的抗体即可,使其变得更加方便,效率更高。
实验八 亲和纯化GST融合蛋白

实验八单柱亲和纯化GST融合蛋白Single Column Purification of GST Fusion ProteinsN末端或C末端GST融合蛋白纯化方法运用谷胱甘肽琼脂糖凝胶(0.5-2 ml) 谷胱甘肽树脂预装柱(0.5-1 ml) 进行GST融合蛋白纯化的方法,适用于25-100 ml的诱导培养菌(纯化2.5-10 mg GST融合蛋白)1. 细菌培养:直接挑取表达质粒新转化的单菌落, 加入25-100 ml LB+Amp液体培养基中(含氨苄100 μg/ml),37℃振荡培养至OD600nm达0.5。
2. 诱导蛋白表达:加入终浓度为0.3 mM 的IPTG,30-37℃振荡培养3 h,诱导蛋白表达。
设立阴性对照。
取样10-20 μl进行SDS-PAGE电泳, 取样1-2 μl进行Western blot鉴定。
表达的时间和温度根据表达量, 可溶性和稳定性进行调整, 对于37℃不稳定或不溶的蛋白, 0.1 mM 的IPTG 20-25℃诱导培养6-20 h; 10-16℃振荡培养12-24 h.3.细胞收集:5000×g离心10分钟(4℃), 弃上清。
-20/-80℃贮存。
细胞冻融利于破碎。
4.破碎细胞:用5-10 ml的裂解缓冲液(10 mM Tris-HCl, pH8.0, 0.1 NaCl) 将菌体重悬,超声破碎细胞(冰浴),使融合蛋白释放。
15000-19000×g离心30分钟,上清即为可溶性蛋白的细胞粗提物。
上样5 μl进行SDS-PAGE电泳鉴定(Western:: 1∶10稀释, 上样5 μl)。
5.谷胱甘肽树脂预装柱的平衡: 20 ml的缓冲液4℃进行柱平衡。
每毫升谷胱甘肽树脂大约能够结合5-10 mg GST融合蛋白。
6.结合融合蛋白:用柱帽堵上,将澄清的细胞粗提物加入谷胱甘肽树脂预装柱(0.5 ml, # ;1 ml, # ),4℃放置15-30 min。
GST蛋白表达、纯化步骤

Protein Expression Protocol:1.Transform control construct and tag-fusion-constructs into E.coli BL21(DE3) competent cell, growovernight;2.Inoculate single colony to 2~3 ml LB medium, and grow at 37 degree for 7~10 hours or overnight;3.1:100 inoculate to 3 ml LB, bacteria grow for 2-3 hours at 37 degree, then follow 1:2000 add 1 MIPTG to induce protein expression overnight at 22 degree;4.Spin down bacteria at 12000 rpm for 1 min, wash with 1 ml ddH2O, add 100 ul 1x PBS toresuspend the deposition, then sonicate 3~5 min on ice;5. Spin down at 12000 rpm for 10min, separate the supernatants and deposition;6. Boiling with loading buffer at 100 degree for 5min, Spin down at 12000 rpm for 5min, 12%SDS-PAGE;7. After confirmed protein expressed in supernatants, increase the volume of bacteria medium. 1:100inoculate to 100 ml LB, grow bacteria for 2-3 hours at 37 degree;then follow 1:2000 add 1 M IPTG to induce protein expression overnight at 22 degree;8. Spin down bacteria at 8000 rpm 4 degree for 5 min, wash with 10 ml ddH2O, add 5 ml 1x PBS toresuspend the deposition, then sonicate 60 min on ice;9. Spin down at 12000 rpm 4 degree for 10min, separate the supernatants and deposition;10.Prepare the supernatants for purification.蛋白表达注意事项:1. E.coli BL21比DH5α生长要快,固体培养基上10~12小时即可长斑,液体培养基中8小时后即可生长成较大密度;切勿培养时间过长,防止菌体老化;2.为了后续实验的便利,应尽量减少包涵体的形成。
GST蛋白表达、纯化步骤(word文档良心出品)

Protein Expression Protocol:1.Transform control construct and tag-fusion-constructs into E.coli BL21(DE3) competent cell, growovernight;2.Inoculate single colony to 2~3 ml LB medium, and grow at 37 degree for 7~10 hours or overnight;3.1:100 inoculate to 3 ml LB, bacteria grow for 2-3 hours at 37 degree, then follow 1:2000 add 1 MIPTG to induce protein expression overnight at 22 degree;4.Spin down bacteria at 12000 rpm for 1 min, wash with 1 ml ddH2O, add 100 ul 1x PBS toresuspend the deposition, then sonicate 3~5 min on ice;5. Spin down at 12000 rpm for 10min, separate the supernatants and deposition;6. Boiling with loading buffer at 100 degree for 5min, Spin down at 12000 rpm for 5min, 12%SDS-PAGE;7. After confirmed protein expressed in supernatants, increase the volume of bacteria medium. 1:100inoculate to 100 ml LB, grow bacteria for 2-3 hours at 37 degree;then follow 1:2000 add 1 M IPTG to induce protein expression overnight at 22 degree;8. Spin down bacteria at 8000 rpm 4 degree for 5 min, wash with 10 ml ddH2O, add 5 ml 1x PBS toresuspend the deposition, then sonicate 60 min on ice;9. Spin down at 12000 rpm 4 degree for 10min, separate the supernatants and deposition;10.Prepare the supernatants for purification.蛋白表达注意事项:1. E.coli BL21比DH5α生长要快,固体培养基上10~12小时即可长斑,液体培养基中8小时后即可生长成较大密度;切勿培养时间过长,防止菌体老化;2.为了后续实验的便利,应尽量减少包涵体的形成。
gst融合蛋白的分离纯化过程

gst融合蛋白的分离纯化过程好吧,今天我们来聊聊GST融合蛋白的分离纯化过程。
这可不是一个无聊的实验室话题,反而是个充满趣味的科学旅程。
想象一下,我们的主角是GST,这可不是个简单的角色,它可是一种小蛋白质,但它在生物技术界可是响当当的明星。
GST,通俗点说,就是谷胱甘肽转移酶,它帮忙处理很多化学反应,像个优秀的“化学保姆”。
好,故事开始了。
我们得搞定一些基础材料。
这就像做菜,得先准备好所有的食材。
我们通常会从大肠杆菌中获得GST融合蛋白,简单点说,就是把我们想要的蛋白质和GST这位小帮手连在一起。
这样一来,GST就像是个“护身符”,帮助我们的目标蛋白质稳定下来,咱们就可以更轻松地把它从细胞中提取出来。
一旦我们培养好了这些大肠杆菌,接下来就是收割的时刻。
我们把这些细菌们放进离心机里,哐哐哐,转个不停,最后得到的就是细胞沉淀。
就像洗菜一样,沉淀物就是我们需要的“干货”。
然后,别急着庆祝,接下来还有一系列的步骤等着我们呢。
我们得把这些细胞打碎,释放出我们的小蛋白质。
这个过程听起来有点儿暴力,但其实是必须的。
我们可以用超声波破碎法或者化学裂解法,反正就是把细胞的“外壳”打破,搞得四分五裂,蛋白质才会“出场”。
打碎之后,别忘了再一次离心,把不需要的东西过滤掉。
好,到了关键时刻,我们要开始纯化了。
GST的神奇之处在于,它能与谷胱甘肽结合。
咱们在实验室里准备一堆“谷胱甘肽树脂”,这可是“吸铁石”,能把GST融合蛋白牢牢吸住。
把打碎的细胞液倒进树脂里,哇,真是神奇!GST融合蛋白就像一只迷路的小猫,找到它的家了。
静待一会儿,让GST与树脂“亲密接触”。
然后,洗掉那些“无关人员”,就像把多余的油腻食材滤掉,留下清爽的“主菜”。
这时,你可能会觉得,哎呀,怎么就这么简单?可是,真正的考验还在后头。
为了把GST融合蛋白从树脂上“请出来”,咱们得用个叫“洗脱液”的东西。
这东西可不简单,通常是含有游离谷胱甘肽的溶液,它就像是开门的钥匙,帮我们的蛋白质从树脂上解放出来。
GST融合蛋白的纯化步骤

GST融合蛋白的纯化步骤一、制取细胞的裂解物:1.每100ml培养物的细胞沉淀悬于4ml PBS缓冲液;2.加入溶菌酶至最终浓度1mg/ml,冰上或冷藏放置30min;3.用针筒将10ml0.2%TritonX-100强行注入细胞裂解物中,剧烈震动数次混匀;4.加入DNase和RNase至终浓度5ug/ml,4℃震动并温育10min;5.4℃3000g(5000r/min)离心30min;6.上清转移到一只新试管,加入DTT至终浓度为1mmol/L;二、纯化GST融合蛋白:1.细胞裂解物与50%谷胱甘肽-琼脂糖树脂匀浆混合,每100ml细胞培养物加2ml树脂,于室温下轻摇30min;2.混合物于4℃以500g(2100r/min)离心5min,小心去掉上清并留样少许进行SDS-PAGE;3.沉淀中加入10倍标准体积的PBS,颠倒离心管数次混匀,洗去未与树脂结合的蛋白;4.4℃以500g(2100r/min)离心5min,小心去掉上清并留样少许进行SDS-PAGE;5.重复步骤3和4两次;6.结合的GST融合蛋白可用谷胱甘肽洗脱缓冲液洗脱,也可用凝血酶,肠激酶或Xa因子切割,释放靶蛋白;三、用谷胱甘肽洗脱洗脱融合蛋白:1.沉淀中加入1倍柱床体积的谷胱甘肽洗脱缓冲液,室温轻轻搅动10min,洗脱树脂上结合的蛋白;2.4℃以500g(2100r/min)离心5min,上清移至新管中;3.重复步骤1和2两次,合并3次的上清;四、蛋白酶解从结合的GST融合蛋白上回收靶细胞:1.在结合了融合蛋白的树脂中加入凝血酶,肠激酶或Xa因子。
每毫升树脂加入50单位1mlPBS 的蛋白酶,颠倒离心管数次混匀,室温下震荡2~16h,用小规模实验确定精确时间;2.4℃以500g(2100r/min)离心5min,上清小心移至新管中;3.10%SDS-PAGE分析每一步(细胞抽提,洗涤和洗脱)样品的蛋白质组成。
五、谷胱甘肽琼脂糖树脂的处理:1.轻轻颠倒盛有谷胱甘肽-琼脂糖树脂的容器,将树脂混成匀浆;2.取部分匀浆放入15ml聚丙烯管(每100ml细菌培养物需要2ml匀浆);3.4℃以500g(2100r/min)离心5min,小心去掉上清;4.在树脂中加入10倍柱床体积的冷的PBS,颠倒数次,混合匀浆,4℃以500g(2100r/min)离心5min,小心去掉上清;5.每毫升树脂加入1ml冷的PBS,制成50%匀浆,颠倒数次,悬浮冰上放置待用。
利用GST融合蛋白表达系统表达与纯化人N-Ras蛋白

v V O I … . Z O N。 O . ・ 4 斗 J u U 1 l . _ . ・ U 2 0 1 5 LETTERS I N BI OTECH NOL0GY
物
技
术
通
讯
4 9 7
d o i : 1 0 . 3 9 6 9  ̄ . i s s n . 1 0 0 9 — 0 0 0 2 . 2 0 1 5 . 0 4 . 0 1 1
【 Ab s t r a c t ] Ob j e c t i v e :T o c o n s t r u c t t h e p r o k a yo r t i c e x p r e s s i o n v e c t o r o f h u ma n N — R a s g e n e ,o b t a i n t h e p u r i i f e d
3 .总 参 警 卫 局 卫 生保 健 处 , 北京 1 0 0 0 1 7 [ 摘 要] 目的 : 克 隆 人 N— ms 蛋 白全 长 编 码 区基 因 , 获得其原核表达 产物 , 并 对 融 合 蛋 白进 行 纯 化 。方 法 : 采用 P C R 技 术 从 人 乳 腺 文 库 中扩 增 出人 N — r a s 蛋 白全 长 编 码 区基 因 , 将其 克隆到p G E X — K G载 体 中 , 在大肠杆菌 R o s s a t e中表 达 后, 利 用G S T — S e p h a r o 8 e 4 B亲 和 珠 对 原 核 表 达 产 物 进 行 纯 化 , S D S — P A G E鉴 定 表 达 与纯 化产 物 。结 果 : 从 人 乳 腺 文 库
C o — c o r r e s p o n d i n g a u t h o r s , YE Q i — No n g ,E — ma i l :y e q n 6 6 @y a h o o . c o m; Z HA NG R o n g ,E — m a i l :z h a n g r o n g y i s h e n g @s i n a . c o n
GST融合蛋白的表达与纯化原理

GST融合蛋白的表达与纯化原理GST 纯化系统是利用GST (glutathione-S-transferase )融合蛋白与固定的谷胱甘肽(GSH)通过硫键共价亲和,通过GSH交换洗脱的原理来进行纯化。
1ml树脂大约可结合5-8 mg融合蛋白,并可反复使用数次。
试剂u IPTG(异丙基硫代-β-D-半乳糖苷) 2g IPTG 溶解入10ml 水,过滤除菌,分装,-20℃保存。
u Lysis buffer (50ml)1)2.5ml 1 M Tris,pH8.0 2)0.1ml 0.5ml EDTA 3)0.292g NaCl4)0.5ml Triton X-100 5)0.25ml 1M DTT u Elution buffer 1)0.615g glutathione 2)10 ml 1M Tris,pH8.0 3)90ml distilled water .GST 融合蛋白的表达与纯化操作步骤1、挑一个克隆至2ml LB液中(Amp+ )2、37℃振摇至OD600值约为0.63、将2ml菌液加入100 ml LB中4、37℃振摇至OD600值约为0.65、加入IPTG至终浓度为1mM6、)继续摇3~4h7、离心(5000 rpm,5min,4℃)8、用10×柱体积的lysis buffer悬浮细菌9、超声破碎细胞10、离心(12,000rpm,15min,4℃),取上清11、用滤纸过滤12、加0.5 ml 50%谷胱甘肽琼脂糖beads于层析柱13、5×柱体积的lysis buffer洗层析柱14、样品过柱15、5×柱体积的lysis buffer洗层析柱16、3×柱体积的elution buffer洗脱蛋白17、收集蛋白:0.5ml/管 18)取20ml样品SDS-PAGE鉴定可以在buffer里增加点蛋白酶抑制剂,防止蛋白的降解。
生物化学中的蛋白质表达和纯化

生物化学中的蛋白质表达和纯化蛋白质是细胞中最基本的生物大分子之一,具有重要的结构和功能作用。
在生化实验研究中,常常需要大量的蛋白质作为实验材料。
蛋白质表达和纯化技术是生物化学研究中的关键技术之一。
本文将简要介绍蛋白质表达和纯化的原理和方法。
一、蛋白质表达技术蛋白质表达是将目的基因转录成RNA后再翻译成蛋白质的过程。
蛋白质表达主要有原核细胞和真核细胞两种方法。
原核细胞表达系统主要利用大肠杆菌,真核细胞表达系统则使用哺乳动物细胞,其主要的表达技术有以下几种:(一)重组蛋白质大规模表达重组蛋白质是指人为构建的同源或异源蛋白序列,利用基因工程技术将其导入到表达宿主中进行高效表达的蛋白质。
大肠杆菌是目前最常用的宿主。
一般来说,要将目的基因插入到选择性表达载体中,选用合适的启动子和终止子,将目的蛋白质与标签结合。
表达宿主随后被转化,蛋白质在生长过程中表达出来,随后进行纯化和鉴定。
(二)GST融合蛋白表达GST融合蛋白是利用GST (glutathione S-transferase)标签的蛋白质,将GST和目的蛋白质融合在一起表达,然后通过Glutathione 亲和层析纯化方法纯化目的蛋白质。
GST融合蛋白可以提高目的蛋白质的稳定性和可溶性,使得其在细胞内表达更加稳定。
(三)His标签蛋白表达His标签是一种聚组氨酸标签,可以与Ni2+螯合,因此可采用Ni2+亲和层析的方法纯化。
His标签融合蛋白表达时选择了较少的氨基酸标签,对目标蛋白的生物学性质和功能影响较小。
二、蛋白质纯化技术蛋白质表达和纯化是蛋白质生物化学研究的关键。
通常情况下,表达宿主细胞中的蛋白质必须经过纯化才能得到纯净的蛋白质,获得足够高纯度的蛋白质可用于测定其结构和功能。
(一)离子交换层析法离子交换层析法是利用蛋白质负荷(或正荷)的离子性质与相应的离子交换质团之间进行选择性结合的纯化方法。
离子交换层析法分为阴离子交换层析和阳离子交换层析两种。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
GST表达融合蛋白载体pGEX-KG大小:5006bp,氨苄青霉素抗性(Amp r),IPTG诱导表达酶切位点:BamHI 930、SmaI 937、EcoRI 962、XbaI 966、NcoI 974、SalI 980、XhoI 985、SacI 992、HindIII 994GST分子量:构建pGEX-KG-YFG重组质粒1、分析所感兴趣的基因(your favorite gene, YFG)Primer Premier 5.0软件,分析YFG含有哪些酶切位点,注意是否与pGEX-KG载体的多克隆位点有重合2、确定合适的双酶切位点NEB网站()Double Digest Finder软件,查找最佳双酶切组合(下表)NEB双酶切图谱BamHI EcoRI NEBuffer EcoRI + BSA at 37°C. BamHI may exhibit star activity in this buffer.XbaI NEBuffer 3 + BSA at 37°C.At least one enzyme has < 100% activity in thisbuffer, so additional units of enzyme and/or longerincubation time may be necessary.NcoI NEBuffer 3 + BSA at 37°C.SalI NEBuffer 3 + BSA at 37°CXhoI NEBuffer 3 + BSA at 37°C.SmaI XbaINEBuffer 4 + BSA at 25°C withSmaI, then add XbaI and raisetemperature to 37°C.At least one enzyme has < 100% activity in thisbuffer, so additional units of enzyme and/or longerincubation time may be necessary.NcoINEBuffer 4 at 25°C with SmaI, thenadd NcoI and raise temperature to37°C.XhoINEBuffer 4 + BSA at 25°C withSmaI, then add XhoI and raisetemperature to 37°C.SacINEBuffer 4 + BSA at 25°C withSmaI, then add SacI and raisetemperature to 37°C.HindIIINEBuffer 4 at 25°C with SmaI, thenadd HindIII and raise temperature to37°C.At least one enzyme has < 100% activity in thisbuffer, so additional units of enzyme and/or longerincubation time may be necessary.EcoRI NcoI NEBuffer EcoRI at 37°C.3、设计PCR上、下游引物Primer Premier 5.0软件,设计PCR上、下游引物酶切位点外最多含6个碱基3’端不是A,最好是G或C,但是不推荐使用GC或CG结尾3’端至少保证有10个碱基完全配对得分(Rating)大于70[注意]上游引物:是否添加适当碱基,确保不打乱开放阅读框下游引物:添加终止密码子(UAA、UAG、UGA)4、引物合成及保存合成:上海生工生物工程技术服务有限公司(Email:******************,Tel:81767586);纯化方法:柱层析or聚丙烯酰胺凝胶电泳?;价格1.30/碱基保存:贮存浓度:100pmol/μl(100μM),工作浓度:10pmol/μl(10μM),-20°C保存5、PCR扩增YFG模板:质粒10ng/μl稀释少量-20°C保存引物:10pmol/μl(10μM)-20°C保存Taq酶:NEB Quick-Load Taq 2×Master Mix 扩增片段小于2.0kb反应条件(1)预变性94°C 5 min(2)变性94°C 30 s(3)退火待定30 s(4)延伸72°C 待定(5)重复2-5 25-30个循环(6)补平缺口72°C 10 min(7)暂存10°C[注意]退火温度:参考4(G+C)+2(A+T)-4(互补碱基),参考Ta Opt(Primer Premier 5.0)延伸时间:Taq酶:1kb/min循环数小于30,减少错配琼脂糖电泳检测PCR产物0.8%有效分离范围:10~0.8kb;1.0%有效分离浓度7~0.5kb50ml TAE加入5μl EB母液(5mg/ml)100V,30-45min拍照或者紫外灯下切胶回收6、构建pGEX-KG-YFG酶切:双酶切PCR产物、pGEX-KG回收:PCR产物直接回收、pGEX-KG电泳之后切胶回收连接:pGEX-KG 50ng、插入片段150ng转化铺平板:Amp r挑单克隆:Amp r(四个菌落足够了)鉴定:小提质粒酶切or菌体PCR7、转化BL21(DE3)pLysS菌株检测GST融合蛋白的表达(1)冰上融化BL21(DE3)pLysS感受态细胞(天根)(2)2 ml离心管中,加入25μl BL21+ 3μl质粒(300-500ng),混匀(质粒≤感受态1/10)(3)冰上放置30min(4)42°C,90s(5)冰上放置2-3min(6)加入300μl LB(无抗生素)(相当于菌体10倍体积的LB),37°C,250rpm,1 h (7)4000rpm,2min,弃上清,其余混匀以后涂平板(Amp r),37°C,过夜(16 h)(8)挑单克隆菌落,5ml LB(Amp r),37°C,250rpm,过夜(16 h)()稀释10倍、20倍、50倍测定OD600()选择合适的稀释倍数,5ml菌液,37°C,250 rpm,1 h,测定OD600(7)取100μl菌液加入5ml LB(Amp r)(50倍稀释),37°C,250rpm,过夜(16 h)(8)取500μl菌液加入5ml LB(Amp r)(10倍稀释)(其余菌液4°C保存),测OD600 (9)37°C,250 rpm,2 h(OD600:0.6-0.8),测OD600(10)室温放置20 min(摇床降温,30°C)(11)取100μl作为诱导前对照,冰上放置(12)菌液中加入IPTG,终浓度0.5-1 mM(13)30°C,250 rpm,2 -4h(可做时间梯度),测OD600(14)取100μl作为诱导后对照,连同诱导前菌液,12000rpm,离心2min,加入50μl 1×SDS 上样缓冲液(15)取4ml菌液,12000rpm,离心2min,收集到2ml离心管中(16)加入1ml GST裂解缓冲液重悬菌体(17)超声破碎细胞:超声20s,间隔10s,共3-5次,超声强度200-300W(冰浴)(18)超声后菌液换入一个新1.5ml离心管,4°C,12000rpm,离心5min(19)超声后上清:取25μl上清,加入25μl 2×SDS上样缓冲液(其余上清-80°C保存)(20)超声后沉淀:沉淀加入1ml GST裂解缓冲液重悬,取25μl,加入25μl 2×SDS上样缓冲液(其余沉淀-80°C保存)(21)将四个样品煮沸3min,12000rpm,离心5min(22)8-10%SDS-PAGE,30μl上样,顺序:诱导前菌体、诱导后菌体、超声后上清、超声后沉淀(23)考马斯亮蓝染色[注意](1)菌液OD值小于1即可(2)诱导时间最好做一个梯度,2-6h(3)诱导温度适当摸索,24°C、30°C(4)IPTG浓度可做梯度,1mM(5)超声条件可视实际情况改变,只要使细菌裂解充分即可,即菌液清亮不粘稠8、测序确认上海生工生物工程技术服务有限公司(Tel:81767529)测序引物:pGEX-3通用引物测序样品:过夜菌1ml;质粒(浓度大于50ng/μl,10μl)9、中提质粒(Promega)10、表达纯化GST融合蛋白(1)已经转化的菌液,或者重新转化BL21(DE3)pLysS(2)活化:取20μl菌液加入11ml LB(Amp r)(500倍稀释),37°C,250rpm,过夜(16 h)(3)取10ml菌液加入100ml LB(Amp r)(10倍稀释)(剩余菌液4°C保存)(4)37°C,250 rpm,1 h 10 min-1 h 20 min,OD600 0.6-0.8(OD600小于1.0即可)(5)取1ml菌液作为诱导前对照,冰上放置(6)加入IPTG,终浓度1 mM(7)30°C,250rpm,诱导适当时间(预实验确定)(8)取1ml菌液作为诱导后对照,连同诱导前菌液,12000rpm,离心2min,收集菌体,加入100μl 1×SDS上样缓冲液(9)其余菌液,分为两份,倒入50ml离心管,5000rpm,离心20 min,收集细胞(10)每管加入8-10ml GST裂解缓冲液重悬菌体,转移小烧杯中(无气泡)(11)超声破碎细胞:超声3s,间隔10s,40次左右,超声强度200-300W(冰浴)(12)将超声后菌液转移到50ml离心管中,4°C,13000rpm,离心20-30min(13)将上清转移到1个50ml离心管中,取出50μl,加入50μl 2×SDS上样缓冲液(其余上清-80°C保存)(14)将沉淀加入16-20ml GST裂解缓冲液(或PBS)重悬,取出50μl,加入50μl 2×SDS 上样缓冲液(其余沉淀-80°C保存)(15)将四个样品煮沸3min,12000rpm,离心5min(16)8-10%SDS-PAGE检测诱导、超声是否合适,30μl上样,顺序:诱导前菌体、诱导后菌体、超声后上清、超声后沉淀(17)考马斯亮蓝染色(18)混匀glutathione sepharose beads(4B)(mixed slurry),取200μl加入15ml离心管中(2份)(19)加入10ml PBS,混匀,3000rpm,离心3min,弃上清(20)加入超声后上清液,4°C轻柔摇荡60分钟(或过夜)(横放)(21)4°C,3000rpm,离心3min(22)10ml GST裂解缓冲液洗涤2次(冰上)(23)10ml TBS(含5mM MgCl2、1mM DTT)洗涤2次(冰上)(24)弃上清,加入1倍柱床体积的TBS(含5mM MgCl2、1mM DTT、50%甘油),混匀(25)取悬液测定蛋白浓度或SDS-PAGE(26)-20°C保存beads11、GST-Pull-down(1)10cm培养皿中,未处理的细胞或者转染的细胞(3-5μg质粒转染10cm培养皿,Cos-7、293T或者其他细胞,转染24h)(2)加入1ml 细胞裂解缓冲液,细胞铲刮下细胞(冰上)(3)将裂解液收集到1.5ml离心管中,振荡30s,冰上放置5min,重复2-3次,充分裂解细胞(4)4°C,12000rpm,离心15min,收集上清(5)测定蛋白浓度,取1mg总蛋白做GST-Pull-down?(6)留30μl作为input对照(input与Pull-down蛋白量约为1/10)(7)其余溶液,加入20μl glutathione sepharose beads(PBS洗涤过),4°C,轻柔振荡20min(8)12000rpm,离心3min(9)收集上清,分为两份,一份加入1-15μg GST结合的beads,另一份加入等量GST-融合蛋白结合的beads,4°C,轻柔振荡60min(10)3000rpm,离心3min,回收上清(11)1ml 细胞裂解缓冲液洗涤3次(12)弃尽上清,加入25μl 2×SDS上样缓冲液(13)煮沸3min,12000rpm,离心3min(14)SDS-PAGE,上样顺序:细胞裂解液input、x、GST、x、GST-融合蛋白(x:LSB)(15)考马斯亮蓝染色或免疫印迹[附录]GST裂解缓冲液(前四个组分配好之后4°C保存,DTT和蛋白酶抑制剂现用现加)常用IP细胞裂解液cleared lysates were incubated for 1.5 h with 3 μg immobilized GST or GST-32。
