氨基酸的一般代谢
氨基酸的一般代谢

第二节氨基酸的一般代谢一、体内蛋白质的降解1.成人每天有1~2%的蛋白质被降解,主要是肌蛋白。
2.真核生物中蛋白质降解的两条途径①溶酶体内降解过程*不依赖ATP*利用组织蛋白酶降解外源性蛋白、膜蛋白和长寿命的细胞内蛋白②依赖泛素的降解过程*依赖ATP,在胞液中进行*降解异常蛋白和短寿命蛋白述:体内蛋白质的降解参与多种生理、病理调节作用。
如基因表达、细胞增值、炎症反应、诱发癌瘤(促进抑癌蛋白P53降解)。
二、氨基酸代谢库1.定义:食物蛋白质经消化吸收的氨基酸(外源性)与体内组织蛋白质降解产生及合成的非必需氨基酸(内源性)混合在一起,分布在细胞内外液中所有氨基酸的总称。
2.来源:食物蛋白质3.主要去路:合成组织蛋白质4.分解代谢的主要途径:脱氨基作用5.氨基酸代谢概况:课本P84图7-2三、氨基酸的脱氨基作用1.定义:氨基酸脱去氨基生成酮酸的过程。
2.主要方式:转氨基、氧化脱氨基、联合脱氨基等述:氨基酸的脱氨基作用在体内大多数组织中均可进行,是氨基酸分解代谢的主要反应。
由转氨基和谷氨酸氧化脱氨基组成的联合脱氨基作用是肝肾组织中氨基酸脱氨基的主要方式。
联合脱氨基作用的全过程是可逆的,因此这一过程也是体内合成非必需氨基酸的主要途径。
(一)转氨基作用1.定义:课本P84,由转氨酶催化某一氨基酸的α-氨基转移到另一种α-酮酸的酮基上,生成相应的氨基酸,原来的氨基酸则变成α-酮酸。
述:体内大多数氨基酸可以参与转氨基作用,但赖氨酸、脯氨酸及羟脯氨酸例外。
2.氨基转移酶(转氨酶)述:人体内存在着各种转氨酶,催化专一的反应。
与临床密切相关的转氨酶主要有谷丙转氨酶(GPT或ALT)和谷草转氨酶(GOT或AST),它们在各组织中的含量不同。
⑴丙氨酸氨基转移酶(ALT)――谷丙转氨酶(GPT)ALT催化反应如下:ALT丙氨酸+谷氨酸丙氨酸+α-酮戊二酸→←⑵天冬氨酸氨基转移酶(AST)――谷草转移酶(GOT)AST催化反应如下:AST天冬氨酸+α-酮戊二酸→草酰乙酸+谷氨酸←3.转氨基作用的机理述:转氨酶的辅酶是维生素B6的磷酸酯,即磷酸吡哆醛或磷酸吡哆胺,在转氨基反应中起传递氨基的作用。
氨基酸的一般代谢

总反应式:
2NH3+CO2+3ATP+3H2O
尿素 鸟氨酸 精氨酸酶 H2O 精氨酸
尿素+2ATP+AMP+2Pi+PPi
NH3 + CO2
H2O 瓜氨酸
H2O
NH 3
NH2 + CO2 + H2O 线粒体 2ATP 2ADP+Pi 氨基甲酰磷酸 Pi 瓜氨酸 N-乙酰谷氨酸
胞液
鸟氨酸
瓜氨酸 鸟氨酸循环 鸟氨酸 尿素 H2O 精氨酸 ATP AMP+PPi 精氨酸代琥珀酸
天冬氨酸
α- 酮戊二酸
氨基酸
草酰乙酸
谷氨酸
α- 酮酸
苹果酸 延胡索酸
⑷ 鸟氨酸循环的特点: ① 尿素分子中的2个氮原子,一个来自氨, 另一个来自天冬氨酸,而天冬氨酸又可 由其它氨基酸通过转氨基作用而生成。 ② 尿素合成是一个耗能的过程,合成1分子
尿素需要消耗4个高能磷酸键。
⑸ 氨的其它去路
① 在肾小管细胞中,谷氨酰胺在谷氨酰胺 酶的作用下脱氨基,氨基与尿液中的H+ 结合,然后以胺盐的形式由尿排除。 ② 参与合成非必需氨基酸。 ③ 参与核酸中碱基的合成。
4.高血氨症和氨中毒
正常生理情况下,血氯的来源与去路保持动 态平衡,血氨浓度处于较低的水平。氨在肝脏中 合成尿素是维持这种平衡的关键。 当肝功能严重损伤时,尿素合成发生障碍, 血氨浓度升高,称为高血氨症。 一般认为,氨进入脑组织.可与脑中的α酮戊二酸结合生成谷氨酸,氨也可与脑中的谷氨 酸进一步结合生成谷氨酰胺。因此,脑中氨的增 加可以使脑细胞中的α一酮戊二酸减少,导致三 羧酸循环减弱,从而使脑组织中ATP生成减少, 引起大脑功能障碍,严重时可发生昏迷,这就是 肝昏迷氨中毒学说的基础。
氨基酸的一般代谢

氨基酸的一般代谢食物蛋白经过消化吸收后,以氨基酸的形式通过血液循环运到全身的各组织。
这种来源的氨基酸称为外源性基酸。
机体各组织的蛋白质在组织酶的作用下,也不断地分解成为氨基酸;机体还能合成部分氨基酸(非必需氨基酸);这两种来源的氨基酸称为内源性氨基酸。
外源性氨基酸和内源性氨基酸彼此之间没有区别,共同构成了机体的氨基酸代谢库(metabolic pool)。
氨基酸代谢库通常以游离氨基酸总量计算,机体没有专一的组织器官储存氨基酸,氨基酸代谢库实际上包括细胞内液、细胞间液和血液中的氨基酸。
氨基酸的主要功能是合成蛋白质,也合成多肽及其他含氮的生理活性物质。
除了维生素之外(维生素PP是个例外)体内的各种含氮物质几种都可由氨基酸转变而成,包括蛋白质、肽类激素、氨基酸衍生物、黑色素、嘌呤碱、嘧啶碱、肌酸、胺类、辅酶或辅基等。
从氨基酸的结构上看,除了侧链R基团不同外,均有α-氨基和α 羧基。
氨基酸在体内的分解代谢实际上就是氨基、羧基和R 基团的代谢。
氨基酸分解代谢的主要途径是脱氨基生成氨ammonia)和相应的α 酮酸;氨基酸的另一条分解途径是脱羧基生成CO2和胺。
胺在体内可经胺氧化酶作用,进一步分解生成氨和相应的醛和酸。
氨对人体来说是有毒的物质,氨在体内主要合成尿素排出体外,还可以合成其它含氮物质(包括非必需氨基酸、谷氨酰胺等),少量的氨可直接经尿排出。
R 基团部分生成的酮酸可进一步氧化分解生成CO2和水,并提供能量,也可经一定的代谢反应转变生成糖或脂在体内贮存。
由于不同的氨基酸结构不同,因此它们的代谢也有各自的特点。
各组织器官在氨基酸代谢上的作用有所不同,其中以肝脏最为重要。
肝脏蛋白质的更新速度比较快,氨基酸代谢活跃,大部分氨基酸在肝脏进行分解代谢,同时氨的解毒过程主要也在肝脏进行。
分枝氨基酸的分解代谢则主要在肌肉组织中进行。
食物中蛋白质的含量也影响氨基酸的代谢速率。
高蛋白饮食可诱导合成与氨基酸代谢有关的酶系,从而使代谢加快(图7-1)。
氨基酸的体内代谢-一般代谢

• α-酮酸的代谢
• 合成非必需氨基酸 • 转变为糖及脂类 • 氧化产生能量
• 若饲某种氨基酸后尿中排出葡萄糖增多,称此 氨基酸为称生糖氨基酸(glucogenic amino acid);若尿中酮体含量增多,则称为生酮氨基 酸(ketogenic amino acid)。尿中二者都增多 者称为生糖兼生酮氨基酸(glucogenic and ketogenic amino acid)。
• 一次循环,消耗2分子氨,3分子ATP,生成1分子尿素
2NH3+CO2+3ATP
CO(NH2)2+2ADP+AMP+4Pi
• 意义:机体解除氨毒的主要方式,是肝细胞的重要生物学功 能。
• 高血氨症——肝功能损伤时,尿素合成受 阻,血氨浓度升高,导致氨中毒。
• 一般认为,氨进入脑组织,可与α-酮戊二 酸结合生成谷氨酸,氨也可与谷氨酸进一 步结合生成谷氨酰胺。因此脑中氨的增多, 可使脑细胞中的α-酮戊二酸减少,导致三 羧酸循环减弱,从而使脑组织中ATP生成 减少,引起脑功能障碍,严重时可发生昏 迷,这就是肝昏迷氨中毒学说的基础。
• 氨基酸的体内代谢 ——氨基酸的一般代谢
• 氨基酸代谢库
食物蛋白质经消化吸 收,以氨基酸形式进 入血液循环及全身各 组织,组织蛋白质又 可降解为氨基酸,这 两种来源的氨基酸 (外源性和内源性) 混合在一起,存在于 组织细胞,血液和其 他体液中,总称为氨 基酸代谢库。
脱羧基作用
R
个别氨基酸 的代谢
• L-氨基酸氧化酶:以FEN或FAD为受氢体,在肝 肾存在,活性低
• D-氨基酸氧化酶:以FAD为受氢体,广泛存在, 活性较强
• 谷氨酸脱氢酶催化 进入氧
化磷酸 化
生物化学中的氨基酸代谢是什么

生物化学中的氨基酸代谢是什么在生物化学的广袤领域中,氨基酸代谢是一个至关重要的环节。
它就像是一座精巧复杂的工厂,各种化学反应有条不紊地进行着,将氨基酸这一基本的“原材料”转化为生命活动所需的能量、物质和信息。
那么,究竟什么是氨基酸代谢呢?让我们一起揭开它神秘的面纱。
首先,我们要明白氨基酸在生命中的重要地位。
氨基酸是构成蛋白质的基本单位,而蛋白质是生命活动的执行者。
从肌肉的收缩到酶的催化作用,从抗体的免疫防御到激素的信号传递,几乎所有的生命过程都离不开蛋白质的参与。
因此,氨基酸的代谢对于维持生命的正常运转具有不可替代的作用。
氨基酸代谢主要包括两个方面:氨基酸的合成与分解。
氨基酸的合成是一个复杂而精妙的过程。
在生物体内,有一些氨基酸可以通过从头合成途径产生。
比如说,人体可以利用简单的前体物质,如二氧化碳、氨、丙酮酸等,经过一系列的酶促反应,合成非必需氨基酸。
这些非必需氨基酸是指人体自身能够合成,不一定需要从食物中摄取的氨基酸。
然而,还有一些氨基酸,被称为必需氨基酸,人体无法自行合成,必须从食物中获取。
这些必需氨基酸包括赖氨酸、色氨酸、苯丙氨酸、甲硫氨酸、苏氨酸、异亮氨酸、亮氨酸和缬氨酸。
与合成相对应的是氨基酸的分解。
当蛋白质被分解或者细胞需要能量时,氨基酸就会被分解代谢。
这个过程通常始于脱氨基作用。
简单来说,就是将氨基酸分子中的氨基脱去,生成相应的α酮酸和氨。
脱氨基的方式有多种,其中转氨基作用是比较常见的一种。
在转氨基作用中,一个氨基酸的氨基转移到一个α酮酸上,生成新的氨基酸和新的α酮酸。
另一种重要的脱氨基方式是联合脱氨基作用,它是转氨基作用和氧化脱氨基作用的联合,能够更有效地脱去氨基。
脱氨基产生的氨是一种有毒物质,需要及时处理。
在肝脏中,氨可以通过鸟氨酸循环转化为尿素,然后通过尿液排出体外。
这个过程对于维持体内氨的平衡和防止氨中毒至关重要。
氨基酸分解产生的α酮酸则有多种去向。
一方面,它们可以通过三羧酸循环彻底氧化分解,产生能量。
氨基酸的代谢知识点

氨基酸的代谢知识点氨基酸代谢学习重点考纲提示:1.氨基酸,蛋白质生化2.个别重要氨基酸的代谢一、蛋白质的生理功能及营养作用1.营养必需氨基酸的概念和种类(1)定义:必须由食物供应的氨基酸称为营养必需氨基酸(2)地位:必需氨基酸的种数比(种类,数量,比例)决定蛋白质的生理价值(3)种类:八类——口诀记忆:甲携来一本亮色书(甲硫氨酸,缬氨酸,赖氨酸、异亮氨酸,苯丙氨酸和亮氨酸、色氨酸、苏氨酸)2.氮平衡(1)氮平衡概念:是指氮的摄入量与排出量之间的平衡状态(2)氮平衡分类1)总氮平衡:摄入氮=排出氮,如正常成年人2)正氮平衡:摄入氮排出氮,如生长期的儿童少年,孕妇和恢复期的伤病员3)负氮平衡:苏氨酸缺乏,引起负氮平衡,摄入氮排出氮,如慢性消耗性疾病,组织创伤和饥饿3.氨基酸和蛋白质的生理功能氨基酸是组成蛋白质的基本组成单位,氨基酸的重要生理作用是合成蛋白质,也是核酸、尼克酰胺、儿茶酚胺类激素、甲状腺素及一些神经介质的重要原料。
多余的氨基酸在体内也可以转变成糖类或脂肪,或作为能源物质氧化分解释放能量。
蛋白质是生命的物质基础,维持细胞、组织的生长、更新、修补;参与体内多种重要的生理活动,如催化物质反应、代谢调节、运输物质、机体免疫、肌肉收缩和血液凝固等;作为能源物质氧化供能。
二、蛋白质在肠道的消化、吸收及腐败作用1.蛋白酶在消化中的作用(1)蛋白消化作用:主要靠酶完成(2)胰液中的蛋白酶:外肽酶和内肽酶1)外肽酶:羧基肽酶和氨基肽酶。
想象氨基酸的氨基,羧基在其两端,在外侧,为外肽酶2)内肽酶:胰蛋白酶(能激活其他蛋白酶原的蛋白酶,蛋白质的消化主要靠它完成)、糜蛋白酶、弹性蛋白酶。
2.氨基酸吸收(1)小肠直接被吸收(2)耗能靠钠需载体的主动转运而吸收:载体主要是中性氨基酸载体(3)-谷氨酰基循环:是氨基酸吸收另一机制3.蛋白质的腐败作用(1)定义:大肠进行,细菌参与,通过氨基酸脱氨基,脱羧基作用完成。
(2)产物1)大多数有害产物:氨类2)少数经肝解毒为无害产物三、氨基酸的一般代谢1.联合脱氨作用(1)定义:脱氨作用和转氨作用联合为联合脱氨作用,是体内脱氨基主要方式,也是体内氨****的主要方式,是合成非必需氨基酸重要途径(2)参与联合脱氨作用的维生素:B6,PP(3)反应特点1)可逆2)互变:氨基酸完成互变,原有的氨基酸脱氨,转变成相应的-酮酸,而作为受氨的-酮酸则因接受氨基而转变成另一种氨基酸。
7第七章 氨基酸代谢

转变为蛋白质。这就是为什么食物中蛋白质不能为糖、脂肪替代,
而蛋白质却能替代糖和脂肪供能的重要原因。
三、脂类与氨基酸代谢的联系 20种氨基酸分解后均能生成乙酰CoA,经还原缩合反应可合成脂肪 酸进而合成脂肪,即蛋白质可转变为脂肪。乙酰CoA还能合成胆固 醇以满足机体的需要。氨基酸也可作为合成磷脂的原料。脂类不
三、含硫氨基酸的代谢 体内含硫氨基酸包括三种:蛋氨酸、半胱氨酸和胱氨酸。
(一)蛋氨酸(甲硫氨酸)代谢
1.蛋氨酸是体内重要的甲基供体
三、含硫氨基酸的代谢 体内含硫氨基酸包括三种:蛋氨酸、半胱氨酸和胱氨酸。
(一)蛋氨酸(甲硫氨酸)代谢
2.蛋氨酸是必需氨基酸
3.蛋氨酸循环
三、含硫氨基酸的代谢
体内含硫氨基酸包括三种:蛋氨酸、半胱氨酸和胱氨酸。
一、氨基酸的脱氨基作用 (一)氧化脱氨基作用
一、氨基酸的脱氨基作用 (二) 转氨基作用
知识卡片
ALT是反应肝细胞损伤非常灵敏的指标
这是由于ALT主要存在于细胞质中,AST主要存在于线粒体中。病变较 轻的肝病如急性肝炎时,释放入血的转氨酶主要是ALT,血中ALT升高 程度高于 AST 。但在慢性肝炎或中毒性肝炎,特别是肝硬化时,病变
累及线粒体,此时AST升高程度就会超过ALT。故在国外,对怀疑是肝
炎患者,常同时测 AST 和 ALT ,并计算 AST/ALT 的比值,以此判断肝炎
的变化与转归。
一、氨基酸的脱氨基作用
(三)联合脱氨基作用
联合脱氨基作用有以下特点: 1.联合脱氨基作用的顺序一般先转氨 基,再氧化脱氨基。 2.转氨基作用的氨基受体是α-酮戊
氨基酸三条代谢途径

氨基酸三条代谢途径
1. 氨基酸可以通过蛋白质合成途径进行代谢。
在这条途径中,氨基酸被用来合成新的蛋白质,从而维持身体组织的生长和修复。
2. 氨基酸还可以通过氨基酸降解途径进行代谢。
在这条途径中,氨基酸被分解成氨和酮酸,然后氨通过尿液排出体外,而酮酸可以被进一步代谢产生能量或合成其他化合物。
3. 氨基酸还可以通过氨基酸转化途径进行代谢。
在这条途径中,氨基酸可以通过一系列酶的作用转化成其他氨基酸,从而在身体中保持氨基酸的平衡和稳定。
氨基酸的代谢

3
提高蛋白质营养价值的方法
①食物蛋白质的互补作用 将几种营养价值低的蛋白质混合食用,则必需氨基酸互 相补充而提高营养价值,为蛋白质的互补作用。
例如:谷类蛋白质(赖氨酸少 色氨酸多)豆类蛋白质(赖氨酸多 色氨酸少)
①提高蛋白质的消化率和利用率
加工或者烹调
.
5
第二节 氨基酸的一般代谢
一、氨基酸代谢概况 二、氨基酸的脱氨基作用
(一)氨的来源与去路
1、氨的来源 2、氨的去路
(二)高血氨与氨中毒
.
14
(一)氨的来源与去路
氨的来源
氨的去路
(1)内源性氨:组织
中氨基酸脱氨基作用是体 内氨的主要来源。
(2)外源性氨:由肠
道吸收的氨。 包括:自由食物蛋白质在 肠道腐败产生的氨;血中 尿素渗透至肠腔在细菌作 用下分解产生的氨。
(1)尿素的合成 (2)谷氨酰胺的合成 (3)氨的其他代谢途径
一、氨基酸的脱羧基作用 二、一碳单位的代谢
三、含硫氨基酸的代谢 四、芳香族氨基酸的代谢
.
34
一个车夫,赶着一辆马车, 车上坐着7个人,每个人背 着7个袋,每个袋里装7只 大猫,每只大猫带着7只小 猫,每个小猫带着7只老鼠 作为干粮,问:一共多少条 腿?求腿数!!!
.
35
一、氨基酸的脱羧基作用
几种重要的胺类物质
多胺
某些氨基酸在体内经脱羧作用可产生多胺。包括:腐胺、 亚精胺、精氨。
.
36
二、一碳单位的代谢
1、一碳单位的概念
某些氨基酸代谢过程中产生的只含有一个碳原子的 基团,称为一碳单位。
2、一碳单位的来源
主要由丝氨酸、组氨酸、甘氨酸、色氨酸代谢产生。
3、一碳单位的载体
氨基酸的代谢
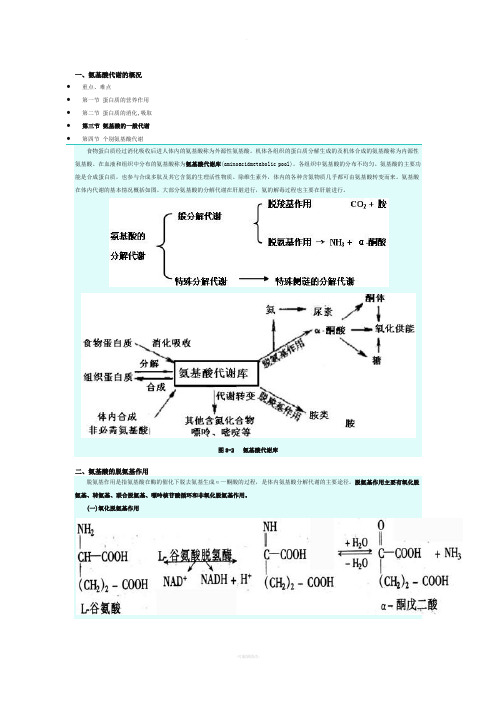
一、氨基酸代谢的概况∙重点、难点∙第一节蛋白质的营养作用∙第二节蛋白质的消化,吸取∙第三节氨基酸的一般代谢∙第四节个别氨基酸代谢食物蛋白质经过消化吸收后进人体内的氨基酸称为外源性氨基酸。
机体各组织的蛋白质分解生成的及机体合成的氨基酸称为内源性氨基酸。
在血液和组织中分布的氨基酸称为氨基酸代谢库(aminoacidmetabolic pool)。
各组织中氨基酸的分布不均匀。
氨基酸的主要功能是合成蛋白质,也参与合成多肽及其它含氮的生理活性物质。
除维生素外,体内的各种含氮物质几乎都可由氨基酸转变而来。
氨基酸在体内代谢的基本情况概括如图。
大部分氨基酸的分解代谢在肝脏进行,氨的解毒过程也主要在肝脏进行。
图8-2 氨基酸代谢库二、氨基酸的脱氨基作用脱氨基作用是指氨基酸在酶的催化下脱去氨基生成α—酮酸的过程,是体内氨基酸分解代谢的主要途径。
脱氨基作用主要有氧化脱氨基、转氨基、联合脱氨基、嘌呤核苷酸循环和非氧化脱氨基作用。
(一)氧化脱氨基作用氧化脱氨基作用是指在酶的催化下氨基酸在氧化的同时脱去氨基的过程。
组织中有几种催化氨基酸氧化脱氨的酶,其中以L-谷氨酸脱氢酶最重要。
L-氨基酸氧化酶与D-氨基酸氧化酶虽能催化氨基酸氧化脱氨,但对人体内氨基酸脱氨的意义不大。
1.L-谷氨酸氧化脱氨基作用由 L谷氨酸脱氢酶(L-glutamatedehydrogenase)催化谷氨酸氧化脱氨。
谷氨酸脱氢使辅酶NAD+还原为NADH+H+并生成α-酮戊二酸和氨。
谷氨酸脱氢酶的辅酶为NAD+。
谷氨酸脱氢酶广泛分布于肝、肾、脑等多种细胞中。
此酶活性高、特异性强,是一种不需氧的脱氢酶。
谷氨酸脱氢酶催化的反应是可逆的。
其逆反应为α-酮戊二酸的还原氨基化,在体内营养非必需氨基酸合成过程中起着十分重要的作用。
(二)转氨基作用转氨基作用:在转氨酶(transaminase ansaminase)的催化下,某一氨基酸的a-氨基转移到另一种a-酮酸的酮基上,生成相应的氨基酸;原来的氨基酸则转变成a-酮酸。
生物化学-氨基酸代谢

CHNH 2 COOH
Gln
NH4+
入血 Glu
随尿排出
二、氨的转运
• 氨是有毒物质,血中的NH3主要是以 无毒的Ala及Gln两种形式运输的。
(一)丙氨酸-葡萄糖循环
(二)谷氨酰胺的运氨作用
(一)丙氨酸-葡萄糖循环
肌肉
血液
肝
氨基酸 α-酮酸
α-酮戊 Ala 二酸
Ala Ala
谷 氨 酸 丙酮酸
COOH
CH2 CH2 CO COOH α -酮戊二酸 COOH
H2C CH2
H2N CH COOH
L-谷 氨 酸
NADH + H+ + NH3
LL--谷谷氨氨酸酸脱脱氢氢酶酶
NAD+ + H2O
Ala + -酮戊二酸 Glu + NAD+ + H2O
丙酮酸 + Glu -酮戊二酸+ NADH + NH4+
肝中活性最高
α-酮戊二酸
AST
Glu 心肌中活性最高
(三)联合脱氨基作用
• 在转氨酶和谷氨酸脱氢酶的联合作用下, 使各种氨基酸脱下氨基的过程。它是体 内各种氨基酸脱氨基的主要形式。其逆 反应也是体内生成非必需氨基酸的途径。
R
H2N CH COOH
α-氨基 酸 转转氨酶
R
CO COOH α -酮酸
一、体内氨的来源
1. 氨基酸脱氨基作用:是主要来源。还有 少量胺的氧化。
2. 肠道吸收的氨:4g/日 ①蛋白质的腐败作用 ②肠道尿素的水解
尿素 肠菌尿素酶 H2O
2NH3 + CO2
3. 肾小管上皮细胞分泌氨
生物化学第三节 氨基酸的一般代谢

小节练习第三节氨基酸的一般代谢2015-07-07 71802 0一、体内蛋白质分解生成氨基酸体内的蛋白质处于不断合成与降解的动态平衡。
成人体内的蛋白质每天约有1%~2%被降解,其中主要是骨骼肌中的蛋白质。
蛋白质降解所产生的氨基酸,大约70%~80%又被重新利用合成新的蛋白质。
(一)蛋白质以不同的速率进行降解不同的蛋白质降解速率不同。
蛋白质的降解速率随生理需要而变化,若以高的平均速率降解,标志此组织正在进行主要结构的重建,例如妊娠中的子宫组织或严重饥饿造成的骨骼肌蛋白质的降解。
蛋白质降解的速率用半寿期(half-life,t1/2)表示,半寿期是指将其浓度减少到开始值的50%所需要的时间。
肝中蛋白质的t1/2短的低于30分钟,长的超过150小时,但肝中大部分蛋白质的t1/2为1~8天。
人血浆蛋白质的t1/2约为10天,结缔组织中一些蛋白质的t1/2可达180 天以上,眼晶体蛋白质的t1/2更长。
体内许多关键酶的t1/2都很短,例如胆固醇合成的关键酶HMG-CoA还原酶的t1/2为0.5~2小时。
为了满足生理需要,关键酶的降解既可加速亦可滞后,从而改变酶的含量,进一步改变代谢产物的流量和浓度。
(二)真核细胞内蛋白质的降解有两条重要途径细胞内蛋白质的降解也是通过一系列蛋白酶和肽酶完成的。
蛋白质被蛋白酶水解成肽,然后肽被肽酶降解成游离氨基酸。
1.蛋白质在溶酶体通过ATP非依赖途径被降解溶酶体的主要功能是消化作用,是细胞内的消化器官。
溶酶体含有多种蛋白酶,称为组织蛋白酶(cathepsin)。
这些蛋白酶对所降解的蛋白质选择性较差,主要降解细胞外来的蛋白质、膜蛋白和胞内长寿蛋白质。
蛋白质通过此途径降解,不需要消耗ATP。
2.蛋白质在蛋白酶体通过ATP依赖途径被降解蛋白质通过此途径降解需泛素的参与。
泛素是一种由76个氨基酸组成的小分子蛋白质,因其广泛存在于真核细胞而得名。
泛素介导的蛋白质降解过程是一个复杂的过程。
氨基酸的分解代谢

氨基酸的分解代谢氨基酸是构成蛋白质的基本单位,它们不仅是生命活动的基础,也在人体的新陈代谢过程中发挥着重要的作用。
本文将从氨基酸的分解代谢入手,探讨其在人体中的意义及相应的生化途径。
让我们了解氨基酸的基本结构。
氨基酸包含一个氨基基团(NH2)、一个羧酸基团(COOH)以及一个特定的侧链(R基团)。
根据不同的侧链结构,氨基酸可以分为20种不同的类型。
这些氨基酸在人体中具有多种功能,如构建蛋白质、合成酶和激素等。
氨基酸的分解代谢主要发生在肝脏中。
当机体需要能量时,肌肉组织中的蛋白质会被分解为氨基酸,然后进入血液循环。
这些氨基酸通过肝脏的代谢途径被分解为能量和废物。
其中,最主要的途径是氨基基团转氨作用和尿素循环。
氨基基团转氨作用是指氨基酸的氨基基团与另一种有机酸结合,形成一种新的氨基酸和酮酸。
这一过程需要酶的催化作用,而且每种氨基酸对应的转氨酶是特异性的。
通过氨基基团转氨作用,氨基酸的氨基基团可以转移到其他代谢途径,进一步产生能量或合成其他物质。
另一种重要的代谢途径是尿素循环。
尿素循环是一种将氨基酸中的氨基基团转化为尿素的过程。
在此过程中,氨基基团与二氧化碳结合,形成尿素,然后通过肾脏排出体外。
尿素循环不仅可以排除体内过量的氨基酸和氨基基团,还可以维持体内氮平衡。
氨基酸的分解代谢除了产生能量外,还与体内其他代谢途径密切相关。
例如,一些氨基酸可以被转化为葡萄糖,以满足能量需求。
而其他一些氨基酸则可以通过一系列的代谢反应转化为脂肪酸,用于合成脂肪。
氨基酸的分解代谢还与体内的氨基酸供需平衡密切相关。
当体内摄入的氨基酸过多时,肝脏会通过抑制氨基酸的合成来调节供需平衡。
而当体内氨基酸不足时,肝脏则会通过分解肌肉蛋白质来提供氨基酸。
总结起来,氨基酸的分解代谢在人体中起着重要的作用。
它不仅能够提供能量,还参与到其他代谢途径中,维持体内的氮平衡和供需平衡。
了解氨基酸的分解代谢有助于我们深入理解人体的新陈代谢过程,并为相关疾病的治疗提供新的思路。
氨基酸的代谢

1、氨基酸的吸收部位:小肠
2、脱羧基作用 CO2 + 胺脱氨基作用 NH3 + α-酮酸
3、谷氨酸氧化脱氨产生α-酮戊二酸。
L-谷氨酸脱氢酶以NAD+或NADP+为辅酶
4、重要的转氨酶:谷丙转氨酶(GPT),谷草转氨酶(GOT)
(1)谷氨酸 + 丙酮酸 GPT α-酮戊二酸 + 丙氨酸(2)谷氨酸 + 草酰乙酸 GOT α-酮戊二酸 +天冬氨酸(3)转氨基作用特点:①只有氨基的转移,没有氨的生成
②催化的反应可逆
③其辅酶都是磷酸吡哆醛
④丙酮酸 α-酮戊二酸草酰乙酸
5、联合脱氨:转氨作用和氧化脱氨作用联合,从而使氨基酸脱去氨基并形成α-酮酸的过程。
(1)转氨酶与L-谷氨酸脱氢酶作用相偶联。
(2)嘌呤核苷酸联合脱氨基
(3)在骨骼肌、心肌、肝脏和脑组织由于主要以嘌呤核苷酸脱氨基为主。
大脑中50%经此途径脱氨。
6、脱羧酶的辅酶:磷酸吡哆醛
7、谷氨酰胺容易透过细胞膜,是氨的主要转运形式。
8、尿素生成的主要器官:肝脏。
鸟氨酸循环
(1)尿素循环将两个氨基(一个来自氨基酸脱氨基作用,一个来自
天冬氨酸)以及一个CO2转化为相对无毒的尿素,同时消耗4个高能磷酸键。
(2)氨基甲酰磷酸的合成:在线粒体中进行。
由氨基甲酰磷酸合成酶Ⅰ(PS-Ⅰ)催化。
(3)氨基甲酰磷酸+鸟氨酸瓜氨酸+天冬氨酸,瓜氨酸+天冬氨酸精氨酸代琥珀酸精氨酸鸟氨酸+尿素
(4)关键酶:精氨酸代琥珀酸合成酶。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H2O2 FMN
O2 FMNH2
R
+或分解
(一)α-酮酸可彻底氧化分解并提供能量 (二)α-酮酸经氨基化生成营养非必需氨基酸 (三)α -酮酸可转变成糖和脂类化合物
类别 生酮氨基酸 生糖兼生酮氨基酸
生糖氨基酸
氨基酸生糖及生酮性质的分类
氨基酸 赖氨酸、亮氨酸 异亮氨酸、苯丙氨酸、酪氨酸、色氨酸、苏氨酸 甘氨酸、丝氨酸、缬氨酸、组氨酸、精氨酸、半胱氨酸、脯氨酸、 丙氨酸、谷氨酸、谷氨酰胺、天冬氨酸、天冬酰胺、甲硫氨酸
(二)真核细胞内蛋白质的降解有两条重要途径
1. 溶酶体:ATP非依赖途径 • 组织蛋白酶负责降解 • 降解外源性蛋白、膜蛋白和长寿命的细胞内蛋白
2. 蛋白酶体:ATP依赖的泛素途径 • 依赖泛素 • 蛋白酶体负责降解 • 降解异常蛋白和短寿命蛋白
依赖泛素的蛋白酶体降解过程
(1)泛素(ubiquitin)
内源性氨基酸与外源性氨基酸共同分布于体内各处,参与代谢,称为氨基酸代谢库
(二)氨基酸代谢概况
食物蛋白质
尿素
氨
酮体
α -酮酸
氧化供能
组织蛋白质
体内合成氨基酸 (非必需氨基酸)
分解 合成
氨基酸 代谢库
脱羧基作用
糖
胺类
其它含氮化合物 (嘌呤、嘧啶等)
三、氨基酸分解代谢首先脱氨基
(一)氨基酸通过转氨基作用脱去氨基
• 76个氨基酸残基组成的小分子蛋白 • 普遍存在于真核生物
( 2 ) 蛋 白 酶 体 ( proteasome )
• 26S蛋白质复合物 • 由核心颗粒和调节颗粒组成
(3)泛素化 • 泛素与被降解蛋白质形成共价连接 • 依赖ATP和三种酶
泛素释放 识别
去折叠 打开 水解
蛋白酶体示意图
降解产物释放
O
1. 转氨基作用由转氨酶催化完成
• 转氨基作用:在转氨酶(transaminase)的作用下,某一氨基
酸去掉α-氨基生成相应的α-酮酸,而另一种α-酮酸得到此氨基生 成相应的氨基酸的过程。 • 转氨基作用不仅是体内多数氨基酸脱氨基的重要方式,也是机体 合成非必需氨基酸的重要途径。
转氨酶
• 丙氨酸氨基转移酶( ALT) 又称为谷丙转氨酶(GPT) 在肝中活性较高 肝疾病时,血清ALT活性明显升高
(CH2)2 CHNH2 +
COOH CH2 C=O
COOH
COOH
谷氨酸
草酰乙酸
AST
COOH COOH
(CH2)2 C=O
+
CH2 CHNH2
COOH
COOH
α -酮戊二酸 天冬氨酸
2. 各种转氨酶都具有相同的辅基和作用机制
• 转氨酶的辅基:维生素B6的磷酸酯,即磷酸吡哆醛 • 作用机制
(二)L-谷氨酸脱氢酶催化L-谷氨酸氧化脱氨基
1. L-谷氨酸脱氢酶:
存在于肝、脑、肾等组织中 辅酶为 NAD+ 或NADP+
NH2
NAD(P)H+H+ NH
H2O
CH COOH
C COOH
(CH2)2 COOH NAD(P)+
L-谷氨酸
(CH2)2 COOH
2. 转氨脱氨作用(transdeamination)
O
C COOH + NH3
(CH2)2 COOH
第二节
氨基酸的一般代谢
(General Metabolism of Amino Acids)
一、体内蛋白质分解生成氨基酸
• 成人体内的蛋白质每天约有1%~2%被降解 • 蛋白质降解产生的氨基酸,大约70%~80%被重新利用合成新的蛋白质
(一)蛋白质以不同的速率进行降解
蛋白质的半寿期(half-life):蛋白质浓度减少到开始值50%所需要的时间
COOH (CH2)2 CHNH2 + COOH
谷氨酸
CH3 C=O COOH
丙酮酸
ALT
COOH
(CH2)2 C=O
CH3 + CHNH2
COOH COOH
α -酮戊二酸 丙氨酸
• 天冬氨酸氨基转移酶(AST) 又称为谷草转氨酶(GOT) 在心肌中活性较高 心肌疾患时,血清AST活性明显升高
COOH
ATP
泛素 C O- + HS-E1
E1:泛素激活酶
AMP+PPi
O HS-E2
泛素 C S E1
E2:泛素结合酶
HS-E1
O
Pr HS-E2
O
泛素 C S E2 E3 E3:泛素蛋白连接酶
泛素 C
NH Pr
二、外源性氨基酸与内源性氨基酸组成氨基酸代谢库
(一)氨基酸代谢库(aminoacid metabolic pool)
α -酮戊二酸
• 转氨基作用与L-谷氨酸的氧化脱氨基作用偶联进行
• 转氨酶与L-谷氨酸脱氢酶协同作用 • 又称为联合脱氨基作用 • 主要在肝、肾组织进行
氨基酸
α -酮戊二酸
转氨酶
α -酮酸
谷氨酸
NH3+NADH+H+ L-谷氨酸脱氢酶 H2O+NAD+
(三)氨基酸通过氨基酸氧化酶催化脱去氨基
• L-氨基酸氧化酶催化 • 辅基是FMN或FAD
